Пример интраперикардиальной перевязки сосудов. Трансперикардиальный доступ к сосудам при туберкулезе
Добавил пользователь Alex Обновлено: 28.01.2026
Волгоградский государственный медицинский университет
Кафедра акушерства и гинекологии лечебного факультета Волгоградского государственного медицинского университета
Интраоперационная остановка и профилактика акушерских кровотечений
Журнал: Российский вестник акушера-гинеколога. 2014;14(4): 100‑103
Жаркин Н.А., Булавская Ю.В., Жаркин Ф.Н. Интраоперационная остановка и профилактика акушерских кровотечений. Российский вестник акушера-гинеколога. 2014;14(4):100‑103.
Zharkin NA, Bulavskaia IuV, Zharkin FN. Intraoperative stoppage and prevention of obstetric bleeding. Russian Bulletin of Obstetrician-Gynecologist. 2014;14(4):100‑103. (In Russ.).
Разработан и внедрен протокол интраоперационной остановки и профилактики акушерских кровотечений, ассоциированных с кесаревым сечением. Выполнено 70 операций, в том числе 57 оперативных вмешательств во время кесарева сечения по поводу остановки акушерских кровотечений, из них перевязка a. uterine на 2 уровнях у 27 пациенток, наложение компрессионных швов - у 28, комбинация двухуровневой перевязки маточной артерии с компрессионными швами - у 2. Профилактическая двухуровневая перевязка маточных артерий у пациенток группы высокого риска развития гипотонического кровотечения во время операции кесарева сечения произведена в 13 наблюдениях. Установлено, что двухуровневая перевязка маточных артерий во время кесарева сечения при развитии маточного кровотечения и с профилактической целью является высокоэффективным методом остановки кровотечения с сохранением матки (91,2%) и, следовательно, репродуктивной функции.
Несмотря на попытки сдержать увеличение частоты кесаревых сечений (КС), их уровень постоянно растет во всем мире. Наиболее высокая частота оперативных родов отмечается в странах Латинской Америки, Китае (более 40%), Северной Америки, Австралии и некоторых странах Европы (более 30%). В России наблюдается аналогичная тенденция, приведшая к тому, что частота КС превысила 20% в популяции. Безусловно, подобное явление способствует существенному снижению перинатальных потерь, однако, как у всякой медали, у этой проблемы есть и обратная сторона, которая заключается в увеличении материнской и заболеваемости, и смертности.
Так, по данным ВОЗ, материнская смертность, ассоциируемая с КС, достигает 40 на 100 000 живорожденных. Это в 4 раза выше, чем для всех типов влагалищных родов (10 на 100 000 живорожденных), и в 8 раз выше, чем для нормальных влагалищных родов (5 на 100 000) [6].
Материнская заболеваемость и смертность в случае родоразрешения после предыдущего КС может быть обусловлена разрывом матки, кровотечением, тромбоэмболией и инфекцией. Сторонники вагинальных родов после предшествующего КС утверждают, что риск развития осложнений в случае запланированного КС у женщин с рубцом на матке существенно превышает этот риск в случае удачной попытки вагинальных родов после КС. Риск материнской смерти при попытке вагинальных родов после КС составляет 17/100 000 в сравнении с 44/100 000 в случае планового КС [7].
По мнению В.М. Орлова [1], частота массивных кровопотерь при КС в 5 раз выше, чем при вагинальных родах.
В соответствии с рекомендациями ВОЗ [6] на первой линии профилактики гипотонических кровотечений во время КС стоят лекарственные средства: окситоцин, окситоцин + метилэргометрин и мизопростол (уровень доказательности А). Однако признается, что эффективность медикаментозной профилактики и остановка маточного кровотечения во время операции составляет не более 70%. Эффект от утеротоников можно ожидать в случае, если матка еще не потеряла способности сокращаться. Отсутствие эффекта обусловлено, вероятнее всего, нарушениями в системе гемостаза, трофическими нарушениями в мышце матки и переполнением миометрия кровью.
Свидетельством ограниченных возможностей утеротоников, о котором, без сомнения, знают все оперирующие акушеры, может явиться цитата из стандартов Британского Королевского общества акушеров-гинекологов (2009): «Мизопростол не такой эффективный, как окситоцин, но когда окситоцин не действует, то можно применять мизопростол, в частности при ведении домашних родов…» [5].
Существуют консервативные и радикальные методы хирургической остановки маточных кровотечений. К консервативным методам относят перевязку маточных артерий, компрессионные швы на матку: продольные по В-Lynch, поперечные по Pereira или их комбинация, а также перевязка внутренних подвздошных артерий. К радикальным методам относят гистерэктомию суправагинальную или тотальную. Отдельной строкой следует упомянуть эмболизацию маточных или внутренних подвздошных артерий, а также баллонную окклюзию магистральных сосудов (аорта или подвздошные артерии). Последние требуют специальных условий (родовспомогательное учреждение IIIБ уровня в составе многопрофильной больницы), которые невозможно достичь в широкой акушерской практике.
В специальной литературе имеется немало описаний различных вариаций последовательности и техники консервативных методов остановки кровотечения. Так, в стандартах Британского общества акушеров-гинекологов (2009) описан алгоритм хирургической остановки кровотечения, который начинается с наложения компрессионных швов. В случае, если эффект недостаточный и кровотечение продолжается, следующим шагом предлагается перевязка маточных сосудов на двух уровнях или внутренних подвздошных артерий [5].
Если посмотреть с точки зрения механизма достижения желаемого результата - остановки кровотечения, то компрессионные швы и перевязка магистральных сосудов имеют существенные различия. Компрессия (сдавление) преследует цель уменьшения размеров матки извне и, соответственно, уменьшения диаметра кровоточащих сосудов плацентарной площадки. K. Gezginc [3] также указывает на то, что в случае массивной кровопотери в результате атонии матки при КС после наложения компрессионных швов по B-Lynch, дополнительная перевязка маточных и яичниковых артерий с двух сторон может стать наиболее действенным методом окончательной остановки кровотечения: из 8 пациенток перевязка а. iliaca int. потребовалась только одной.
Безусловно, такое внешнее воздействие способствует сокращению матки в случае ее гипотонического состояния, когда матка еще не потеряла способности к сокращению. В то же время эффект от компрессионных швов будет недостаточным или отсутствовать вовсе в случаях кровотечения, обусловленного нарушением гемостаза или феномена «шоковой матки» [2].
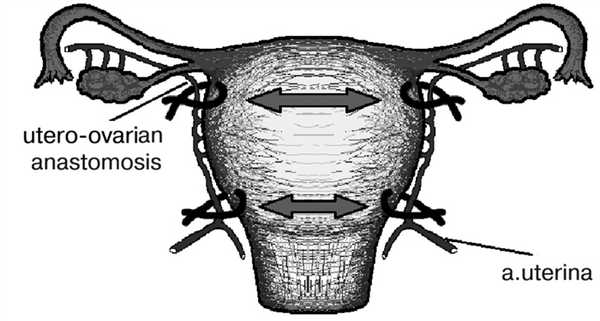
Перевязка магистральных сосудов, в частности, маточных артерий на 2 уровнях с двух сторон приводит в первую очередь к умеренной ишемии миометрия, т.е. к уменьшению притока крови к кровоточащим сосудам. Первый уровень - перевязка маточной артерии в начале восходящей ее ветви соответственно разрезу в нижнем маточном сегменте при КС. Второй уровень перевязки - на 1 см ниже маточно-трубного угла (рис. 1). Рисунок 1. Перевязка маточных сосудов на двух уровнях с двух сторон. Перевязка производится саморассасывающимся шовным материалом викрилом. Такая перевязка магистральных сосудов обеспечивает устранение переполнения миометрия кровью, результатом которого является восстановление его сократимости.
Действительно, на практике авторы статьи убедились в определенных преимуществах перевязки маточных артерий на двух уровнях по сравнению с наложением компрессионных швов. В первую очередь это касалось временно'го фактора и техники выполнения данного этапа операции. На наложение 4 лигатур на сосудистые пучки (2 уровня с двух сторон) требовалось в среднем 3,5 мин. Наложение шва по В-Lynch занимало в среднем 4 мин, а по Pereira (2 линии швов) - 6-7 мин. Кроме того, если хирургический этап остановки кровотечения проводился после вагинальных родов, то наложение шва по В-Lynch требовало рассечения передней стенки матки в нижнем сегменте с целью правильного выполнения техники наложения шва.
Второе, что обращало внимание авторов статьи во время операции перевязки маточных артерий, было видимое на глаз быстрое и устойчивое сокращение матки сразу после наложения 4-й лигатуры, что приводило к остановке кровотечения.
В первые сутки после операции имело место уменьшение количества лохий с постепенным его увеличением до нормального к третьим суткам. Отмечался адекватный маммарно-маточный рефлекс во время кормления грудью. Каких-либо дополнительных жалоб родильниц в послеоперационном периоде не было.
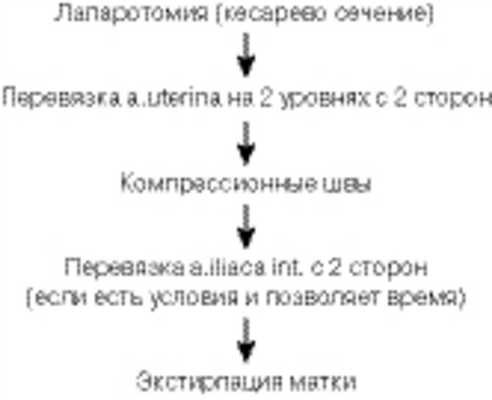
В связи с этим на кафедре акушерства и гинекологии Волгоградского государственного медицинского университета (ВолгГМУ) принят алгоритм хирургического этапа остановки акушерских кровотечений (рис. 2), который отвечает требованиям учета временно'го фактора (минимального времени на техническое выполнение данного этапа операции), непосредственного эффекта (сокращения матки и остановки кровотечения) и сохранения специфических функций женского организма. Рисунок 2. Алгоритм хирургического этапа остановки акушерских кровотечений.
На клинических базах кафедры акушерства и гинекологии ВолгГМУ за 6 лет выполнено 57 оперативных вмешательств по поводу остановки акушерских кровотечений. Из них перевязка a. uterina на двух уровнях - у 27 пациенток, наложение швов по B-Lynch - у 12, по Pereira - у 3, комбинация наложения швов по B-Lynch + Pereira - у 13, комбинация перевязки a. uterina на 2 уровнях с компрессионными швами - у 2. Желаемый результат в виде остановки кровотечения с сохранением матки был достигнут в 52 (91,2%) случаях. Дополнительных вмешательств этим пациенткам не потребовалось. Выписка произведена до 7-х суток послеоперационного периода. Перед выпиской проводилось допплерометрическое исследование маточных сосудов, выявившее восстановление кровотока у всех пациенток.
Гистерэктомия произведена в 5 (8,8%) случаях. Причинами органоуносящих операций явились реализация нескольких существенных факторов риска кровотечения, большая площадь преждевременной отслойки плаценты, несвоевременное проведение операции (позднее обращение за медпомощью), запоздалое решение о применении консервативных методов остановки кровотечения (ятрогенный фактор).
В результате проведенных операций кровопотеря составила до 1000 мл у 37 больных, 1001-1500 мл - у 13, 1501-2000 мл - у 5, более 2000 мл - у 2.
Показаниями к оперативному вмешательству являлись наиболее частые акушерские осложнения, такие как преждевременная отслойка плаценты, несостоятельный рубец на матке, беременность и миома матки, аномалии родовой деятельности и др. Неблагоприятными факторами, способствующими развитию кровотечения, были крупный плод, преждевременное излитие вод, многоводие, двойня, экстрагенитальные заболевания (сахарный диабет, тромбоцитопеническая пурпура, антифосфолипидный синдром и др.).
Известное высказывание о том, что пожар легче предупредить, чем потушить, привело авторов к мысли о целесообразности перевязки маточных сосудов на двух уровнях с двух сторон во время КС с профилактической целью, если имеется реальный риск кровотечения в послеоперационном периоде. Этому способствовал также опыт профилактической перевязки маточных сосудов в гинекологической практике, например, при консервативной миомэктомии больших узлов с целью уменьшения кровопотери [1].
Профилактическая перевязка произведена в 13 случаях. Первая операция была выполнена у пациентки во время 5-й операции КС. Другими показаниями к профилактической перевязке маточных сосудов явились тяжелая преэклампсия (2), перерастяжение матки вследствие многоплодной беременности (2) и гигантского плода (1), заболевания крови с критической тромбоцитопенией (3), консервативная миомэктомия после КС (2), преждевременная отслойка плаценты без массивной кровопотери (2). Во всех этих случаях кровопотеря во время операции в среднем составила 640±90 мл.
Течение послеоперационного периода у всех пациенток этой группы было обычным, выписка из стационара осуществлялась в стандартные сроки.
При обсуждении полученных результатов с коллегами перед авторами статьи были поставлены вопросы, касавшиеся вероятности некроза матки, снижения репродуктивной функции и целесообразности перевязки сосудов здоровой матки, если она хорошо сократилась.
В одной из недавних публикаций [4] приводятся данные об отдаленных результатах остановки маточных кровотечений различными хирургическими методами. Наиболее неблагоприятные последствия, которые проявлялись в ухудшении морфофункционального состояния яичников (снижение овариального резерва, ановуляция, недостаточность лютеиновой фазы), были выявлены после деваскуляризации матки (65 случаев). Компрессионные швы по B-Lynch (42 случая) способствовали развитию внутриматочных синехий, предлежанию плаценты и преждевременным родам при последующей беременности. Наименьшее повреждающее действие выявлено после перевязки внутренних подвздошных артерий (59 случаев), которое проявилось в бесплодии у одной пациентки в результате ановуляции. К сожалению, авторы не приводят отдаленные последствия перевязки маточных артерий на двух уровнях, которая была произведена ими в 2 случаях.
Еще в 1976 г. профессор М.С. Цирюльников провел успешные экспериментальные и клинические исследования по перевязке маточных артерий на 2 уровнях и круглых связок матки с целью остановки акушерских кровотечений. В.М. Орлов и соавт. [1] подтвердили эффективность профилактической перевязки восходящих ветвей маточных артерий и маточно-яичникового анастомоза при консервативной миомэктомии у молодых женщин.
Нами также проведен эксперимент на 6 половозрелых крысах линии Wistar, из которых 2 были интактными и 4 находились в первые сутки после родов. При выполнении эксперимента соблюдены все требования Приказа МЗ СССР №755 от 12.08.77 «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных».
Под общим обезболиванием выполнялись лапаротомия, перевязка сосудов рогов матки на двух уровнях - на 0,5 и 3 см от угла матки с обеих сторон. Передняя брюшная стенка восстанавливалась послойно наглухо. Через 4-5 дней проводилась повторная лапаротомия с визуальной оценкой внутренних половых органов животных. Результаты эксперимента (рис. 3 и 4) свидетельствовали об отсутствии некротических изменений рогов матки как у интактных животных, так и родивших. Рисунок 3. Интактная крыса на 4-е сутки после перевязки артерии рогов матки на двух уровнях с двух сторон (указано стрелками). Рисунок 4. Состояние рогов матки у родившей крысы на 7-е сутки после аналогичной перевязки артерий.
Проф. В.М. Орлов [1] свидетельствовал о наступлении и успешном завершении беременности тройней через 1 год после КС, сопровождавшегося перевязкой маточных артерий на двух уровнях. Из 13 пациенток, которым была произведена перевязка маточных артерий с профилактической целью, находившихся под наблюдением авторов статьи, беременность наступила у одной через 3 года после предшествующей операции - закончилась оперативными родами с благоприятным исходом.
Показаниями к профилактической перевязке маточных сосудов на двух уровнях могут быть факторы, способствующие гипотоническому состоянию матки после операции или нарушению гемостаза. К ним можно отнести следующие:
- перерастяжение матки (многоводие, многоплодие, гигантский плод);
- факторы, способствующие трофическим нарушениям миометрия (преждевременная отслойка нормально расположенной плаценты, высокий паритет родов, более 2 операций КС, эндометрит в анамнезе, состояние после консервативной миомэктомии до беременности или во время нее);
- нарушения в системе гемостаза;
- риск развития синдрома диссеминированного внутрисосудистого свертывания крови (ДВС) или развернутый ДВС-синдром (преэклампсия тяжелой степени);
- предлежание плаценты (перевязка сосудов после извлечения плода и перед ее удалением);
- осложнения родов, способствующие гипотоническому состоянию матки (дискоординация родовой деятельности, длительная стимуляция окситоцином, затяжные роды, хориоамнионит в родах и др.);
- консервативная миомэктомия после извлечения плода;
- варикозная болезнь вен матки.
Следует помнить о том, что хирургическая профилактическая перевязка маточных сосудов не исключает медикаментозной профилактики гипотонического состояния матки утеротоническими средствами.
Таким образом, современные хирургические органосохраняющие методы являются высокоэффективными и необходимыми в протоколе борьбы с акушерскими кровотечениями и могут быть использованы в качестве профилактической меры при высоком риске кровотечения во время КС.
Операции при хронической коронарной недостаточности
Хроническая коронарная недостаточность является очень распространенным заболеванием. В основе этого заболевания лежит атеросклеротический процесс, поражающий основные ветви коронарных артерий. Высокая смертность и малая эффективность консервативной терапии послужили стимулом для развития хирургии коронарной болезни сердца. Предложенные операции относятся к разряду паллиативных, так как направлены на улучшение коронарного кровообращения, а не на ликвидацию явлений атеросклероза. Мы разберем с Вами лишь основные методы оперативного вмешательства.
Органопексия. Принцип этих операций основан на подшивании различных органов или тканей к поверхности сердца с целью усиления коронарного кровообращения, за счет дополнительного врастания в миокард кровеносных сосудов. Название операции будет зависеть от характера подшиваемой ткани, например, если к поверхности сердца подшивается перикард - перикардиокардиопексия, диафрагма - диафрагмокардиопексия, большой сальник - оментокардиопексия, грудная мышца - кардиомиопексия, легкое - пневмокардиопексия.
Перикардиокардиопексия как метод реваскуляризации миокарда в клинике чаще всего применяется в модификации Томпсона. Дугообразным разрезом обнажают и резецируют хрящ пятого ребра слева. Внеплеврально подходят к передней поверхности перикарда, которая вскрывается. Имеющаяся в перикардиальной полости жидкость отсасывается, и на поверхности сердца распыляют 4-5 г стерильного талька. На перикард накладывают редкие узловые швы. После операции на поверхности сердца развивается асептический воспалительный процесс, при этом образуются тесные сращения между эпикардом и перикардом, что приводит к дополнительной васкуляризации миокарда за счет раскрытия интракоронарных и развития экстракоронарных анастомозов.
Оментокардиопексия - подшивание лоскута большого сальника к сердцу. Операция предложена О , Шонесси в 1939 году. После производства левосторонней торакотомии в V межреберье рассекается перикард и левый купол диафрагмы. Через разрез из брюшной полости извлекается большой сальник, он подводится к обнаженной передней поверхности сердца и фиксируется отдельными узловыми швами.
Диафрагмокардиопексия была разработана Б.В. Петровским. Техника операции состоит в следующем: производится левосторонняя торакотомия в V или VI межреберном промежутке. Обнажается передняя поверхность перикарда, он вскрывается между двумя швами-держалками. Из диафрагмы выкраивается лоскут шириной 6-7 см, длиной 11-12 см, основание которого направлено в сторону верхушки сердца. При выкраивании учитывается кровоснабжение лоскута, по его поверхности должен проходить крупный кровеносный сосуд - ветвь нижней диафрагмальной артерии. После этого подготовленный лоскут отдельными узловыми швами фиксируется к поверхности сердца.
Для производства кардиомиопексии было предложено использование лоскутов из большой грудной, межреберных мышц или прямой мышцы живота. Эту операцию нередко сочетали с перикардиокардиопексией.
Операция Вайнберга - имплантация внутренней грудной артерии в толщу миокарда левого желудочка, была предложена в 1945 году. Она выполняется из предне-бокового левостороннего доступа в V межреберном промежутке. В настоящее время нередко производят двустороннее оперативное вмешательство, в этих случаях используют трансстернальный доступ. Внутренняя грудная артерия мобилизуется на всем протяжении. На уровне VII межреберного промежутка внутренняя грудная артерия рассекается между двумя лигатурами. Ближе к подключичной артерии она пережимается турникетом. На передней поверхности левого желудочка в области верхушки сердца надсекается эпикард, вокруг накладывается кисетный шов. С помощью сосудистого зажима типа «москит» в толще миокарда формируется тоннель длиной не более 3 см. Затем снимают турникет, а кровоточащий сосуд имплантируют в тоннель с помощью зажима. Зажим из тоннеля извлекается, а на его место погружается артерия и фиксируется к миокарду желудочка путем прошивания нижнего ее отдела. Кисетный шов у нижнего края тоннеля затягивается.
Операция Фиески. Принцип операции заключается в двусторонней перевязке внутренних грудных артерий на уровне II межреберного промежутка ниже места отхождения перикардиально-диафрагмальных стволов. Оперативный доступ проводят во II межреберье, отступив от грудины на 5-6 см с обеих сторон. Производят мобилизацию сосудистого пучка. Сосуд перевязывают и пересекают между лигатурами. После производства этой операции увеличивается давление в перикардиально-диафрагмальных ветвях, а поскольку существует анатомическая связь между сосудами перикарда и коронарными артериями за счет анастомотической сети, то сброс крови в венечные артерии увеличивается, что и способствует улучшению коронарного кровообращения.
Прямые хирургические методы вмешательства на коронарных артериях. Для лечения хронической коронарной недостаточности В.П. Демиховым разработана методика операции прямого шунтирования внутренней грудной и коронарной артерии (коронаро-маммарный анастомоз). Доступом при данной операции может служить левосторонняя торакотомия в IV межреберье. Мобилизация грудной артерии выполняется таким же образом как и при операции Вайнберга, вдоль ее основного ствола перевязывают межреберные ветви. После выделения передней нисходящей ветви левой коронарной артерии, производят перевязку и рассечение ниже места окклюзии. С помощью сосудосшивающего аппарата накладывается анастомоз между центральным концом внутренней грудной артерии и дистальным отрезком нисходящей ветви левой коронарной артерии.
Аорто-коронарное шунтирование. Техника операции: в качестве оперативного доступа используют срединную стернотомию, которая позволяет подойти к нисходящим ветвям правой и левой коронарных артерий. Одна из бригад хирургов производит забор венозного аутотрансплантата из подкожной вены бедра. Несколько ниже места впадения поверхностной вены в бедренную, она перевязывается между лигатурами, рассекается и выделяется из окружающих тканей, после чего иссекается сегмент длиной 10-20 см, а центральный конец ее легируется. С помощью специального бужа разрушают клапаны в венозном трансплантате. Вторая бригада хирургов перед выполнением основного этапа операции канюлирует полые вены и бедренную артерию для подключения в нужный момент аппарата искусственного кровообращения. Операция может выполняться и без него, если имеется полная окклюзия просвета коронарного сосуда. Коронарную артерию выделяют из ложа, освобождают от жировой клетчатки и перевязывают выше места окклюзии, приподнимают на держалках и пересекают. После чего в просвет артерии водится буж с венозным трансплантатом, на котором выполняется артерио-венозный анастомоз по типу «конец в конец». После проверки герметичности дистального анастомоза во избежание воздушной эмболии венозный трансплантат и коронарная артерия заполняются физиологическим раствором. Следующий этап операции предусматривает наложение проксимального аорто-венозного анастомоза, для чего с помощью пристеночного сосудистого зажима отжимается участок восходящего отдела аорты, в котором формируется овальное отверстие размеров 1х0,3 см. Анастомоз выполняется атравматическими иглами, шов при этом может быть непрерывным. Зажим с аорты снимается и проверяется герметичность анастомоза. Дренируют переднее средостение и послойно ушивают рану грудной клетки.
Трансперикардиальная пневмонэктомия
О преимуществах интраперикардиальной перевязки магистральных сосудов легкого первым в1946году сообщил Allison.В Советском Союзе эта операция нашла свое распространение в связи с работойЛ. К. Богуша. Радикальная пневмонэктомия синтраперикардиальной обработкой корня легкого связана с именем Brock (1948).Принцип операции по Brockзаключается в радикальном удалении лимфатических медиастинальных узлов вместе с легким и частью перикарда, магистральные сосуды перевязываются интрапери-кардиально. Эту операцию Brockпредложил как одну из возможных при карциноме бронха. В настоящее время она применяется весьма редко, так как не имеет преимуществ перед обычной пневмонэктомией, а тяжесть и риск вмешательства значительно больший.
Однакоинтраперикардиальная перевязка магистральных сосудов,оставшаяся от метода радикальной пневмонэктомии, получила распространение в показанных для нее случаях. Эта методика обработки магистральных сосудов легкого показана и с успехом применяется, когда из-за обширнойвоспалительнойилирубцовой опухолевой инфильтрациикорня легкого остается возможной только их неизбежная интраперикардиальная перевязка. Кроме этого, интраперикардиальная перевязкалегочных артерии и вены возможна при интраоперационном повреждении этих сосудов вне перикарда. Нет необходимости обязательно перевязывать все магистральные сосуды интраперикардиально; если часть сосудов свободна, то интраперикардиально перевязываются только те из них, эксграперикардиальный доступ к которым может грозить повреждением их. Над таким труднодоступным сосудом небольшим разрезом рассекается перикард, из него выделяется и перевязывается намеченный сосуд.
Если возникла необходимость интраперикардиально перевязать все магистральные сосуды легкого и иссечь часть перикарда (например, при обширном прорастании опухолью), то необходим
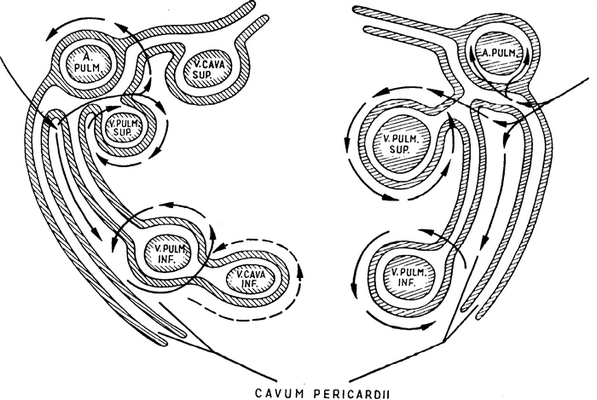
Рис. 3-73. Топография интраперикардиального расположения сосудов легких. Стрелками обозначено направление для выделения сосудов и их перевязки
и широкий доступ.Перикард широко вскрывается вдоль диафрагмального нерва.Порядок интраперикардиального выделения магистральных сосудов легкого, их расположение и связь с перикардом схематически представлены нарис. 3-73. На схеме видно, что интраперикардиально магистральные сосуды легкого окружены дуплика-турой серозной оболочки перикарда. Эта дуплика-тура местами натянута в виде перепонки между сосудами внутри общей перикардиальной оболочки.
Топографические внутриперикардиальные связи правой половины более сложные,чем левой. Справа магистральные сосуды легкого связаны единой оболочкой с верхней и нижней полыми венами (см. рис. 3-73).На схеме длинной стрелкой обозначено направление разреза перикарда. Дальше направление разреза показано небольшими стрелками. Рассекаются перемычки внутри перикарда, их обходят диссектором, выделяялегочную артерию.Интраперикардиальный отрезок правой части легочной артерии имеет длину 4-5см.Выделивверхнюю полую венуи взяв ее на «держалку», можно получить доступ к лежащей сзади нее части легочной артерии и, если возникнет в этом необходимость, произвести перевязку артерии у самого ее устья.Верхняя и нижняя легочные вены
легко выделяются, их обходят диссектором в направлениях, обозначенных на схеме стрелками.
В тех случаях, когда легочная артерия из-за близости ее к опухоли даже интраперикардиально труднодоступна, рекомендуется начинать выделение сосудов внутри перикарда снизу, обрабатывая, в первую очередь, нижнюю легочную вс ну, что облегчает затем доступ к легочной артерии. Для этой цели подходят книжней легочной инижней полой венам,расположенным одна над другой. Между ними натянут листок перикарда. Чтобы избежать повреждения этих сосудов, диссектором с тупыми концами сзади внутрипери-кардиально обходят нижнюю полую вену (на рис.3-73путь диссектора обозначен пунктиром). Кончиком диссектора приподнимают перикардиаль-ный листок, охватывающий нижнюю полую вену вне пределов ее стенки, и рассекают ножницами. После этого диссектор проводят через рассеченный ножницами листок перикарда под нижнюю легочную вену, обходят ее, проводят лигатуры и перевязывают. В этом случае перевязка сосудов имеетобратную последовательность —снизу вверх(рис. 3-74).
В левой половине грудиинтраперикардиальная перевязка магистральных сосудов производится легче. После вскрытия перикарда тупоносым со-
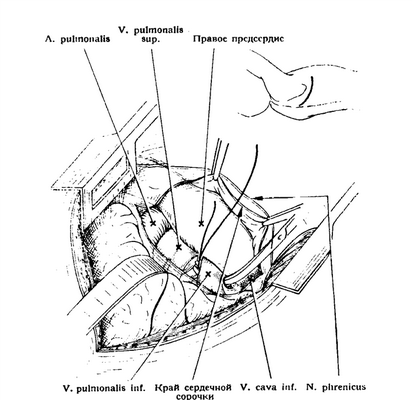
Рис. 3-74. Правосторонняя трансперикардиальная пневмонэктомия. Вскрывается перикард и между нижней полой веной и нижней легочной веной рассекается натянутая здесь серозная перемычка. Исходя отсюда и проникая кверху, последовательно перевязывают нижнюю легочную вену, верхнюю легочную вену и легочную .артерию
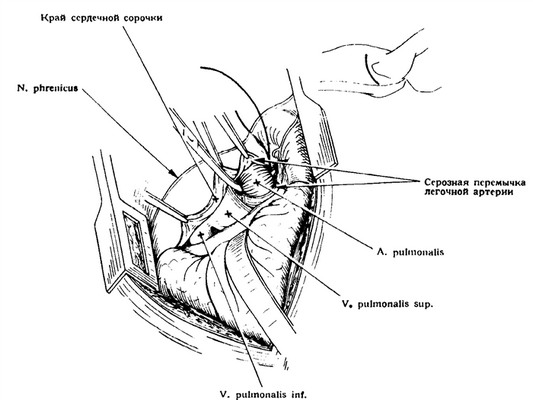
Рис. 3-75. Левосторонняя трансперикардиальная пневмонэктомия. Перикард вскрывают, серозную перемычку легочной артерии рассекают, артерию обходят и перевязывают. После этого, проникая в дистальном направлении, выделяют и перевязывают также и вены
ПЕРЕВЯЗКА КРОВЕНОСНЫХ СОСУДОВ
ПЕРЕВЯЗКА КРОВЕНОСНЫХ СОСУДОВ (vinctura vasorum; син.: лигирование сосудов, наложение лигатуры на сосуд) — оперативный прием, цель к-рого постоянное полное закрытие просвета кровеносного сосуда с помощью нити (лигатуры). Лигатура может быть заменена клипированием сосудов (см.) или прошиванием специальными сшивающими аппаратами типа УКЛ (см. Сшивающие аппараты).
Содержание
Показания
Перевязка магистральных артерий конечностей создает опасность ишемической гангрены и в срочных случаях должна применяться только при невозможности наложения сосудистого шва.
Подготовка
При подготовке к плановой перевязке сосуда (напр., по поводу травматической аневризмы) необходимо определить возможности коллатерального кровообращения. Для этого применяют пробы Короткова, Мошковича, Русанова, Генле (см. Коллатерали сосудистые), а также капилляроскопию (см.), ангиографию (см.). Если позволяет время, проводят предоперационную тренировку коллатералей (см.).
Для выполнения П. к. с. необходимы кровоостанавливающие зажимы (см. Зажимы хирургические), диссекторы, ножницы, пинцеты, вилка для низведения лигатур, хирургические иглы, в т. ч. атравматические (см. Иглы медицинские), лигатуры из кетгута, шелка, лавсана и др. (см. Шовный материал). Кетгут (см.) употребляют для перевязки мелких сосудов, чаще в подкожной клетчатке. Для перевязки более крупных сосудов используют шелк (см.), а также нити из синтетических материалов, к-рым отдают предпочтение, т. к. они вызывают меньшую реакцию со стороны окружающих тканей и не фрагментируются .
Техника перевязки
П. к. с. осуществляют в ране и на протяжении. В ране более крупные сосуды перевязывают каждый в отдельности, мелкие — путем наложения Z-образного или кисетного шва, захватывающего окружающие ткани, или останавливают кровотечение путем диатермокоагуляции. В частности, при лапаротомии, торакотомий и нек-рых других доступах П. к. с. сочетают с диатермокоагуляцией. П. к. с. на протяжении чаще всего является вынужденным приемом, когда не удается произвести П. к. с. в ране. Обычно это бывает при сильных кровотечениях в инфицированной ране, при аррозии сосуда. Для обнажения сосудов на протяжении используют типичные доступы, широко обнажают сосудистый пучок. Выделение сосудов производят с помощью ножниц и диссектора или зажимов иного типа. Из раны предварительно удаляют кровь тампонами и салфетками или лучше с помощью отсоса, после чего становится видным пересеченный кровеносный сосуд.
При типичном варианте П. к. с. конец сосуда захватывают зажимом, не выделяя его из окружающих тканей. Ассистент поднимает зажим кверху, а хирург подводит под него лигатуру (см.), обязательно обойдя лигатурой конец зажима (в глубокой ране иногда удобнее подводить нить под кровоостанавливающий зажим с помощью другого зажима или специального инструмента типа вилки), и завязывает первый узел. Затем ассистент снимает кровоостанавливающий зажим, а хирург, дополнительно подтянув первый узел, завязывает второй. При использовании синтетической нити необходимо завязать 3—5 узлов.
Второй вариант П. к. с. применяют, напр., при резекции желудка, когда необходимо пересечь малый сальник. На участок сальника накладывают два зажима, между к-рыми его пересекают; сосуды вместе с тканью сальника перевязывают (чаще с прошиванием сальника). Та-цой же вариант' П. к. с. возможен при резекции кишечника и др.
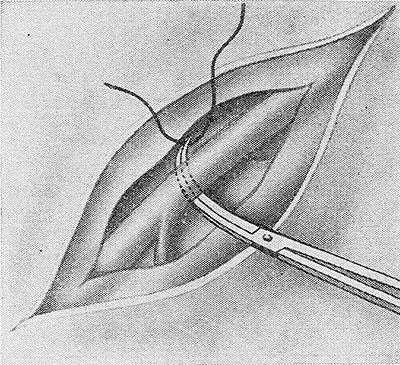
Рис. 1. Схематическое изображение перевязки сосуда на протяжении: под выделенный сосуд подводится двойная лигатура.
Третий вариант П. к. с. чаще всего используют при лигировании крупных сосудов. В этих случаях сосуд (вену или артерию) предварительно выделяют и под него с помощью диссектора подводят (рис. 1) и завязывают две лигатуры, между к-рыми сосуд пересекают. Точно так же сосуд можно пересечь между двумя зажимами и перевязать его концы. При лигировании крупных сосудов для надежности каждый конец лучше перевязать двумя нитями, причем вторую лигатуру наложить с прошиванием атравматической иглой. Возможны и другие варианты перевязки крупных сосудов. Так, перевязку тонкостенного сосуда можно произвести, наложив предварительно с помощью атравматической иглы П-образный или простой шов, захватывающий наружную оболочку сосуда. В случаях, когда стенка сосуда резко истончена и лигатура может легко прорезать ее, при прошивании сосуда применяют прокладки из тефлонового войлока.
При повреждении аорты или крупных магистральных сосудов применяются сосудистый шов (см.), наложенный с помощью атравматической иглы, и реконструкция сосудов. В случае выраженного кальциноза сосуда швы накладывают через наружную оболочку и по всей окружности сосуда, затем завязывают. Если невозможно сделать эти операции при первичной обработке раны, больного необходимо транспортировать в специализированное сосудистое отделение, применив временный сосудистый шунт (см. Шунтирование кровеносных сосудов).
Описанные варианты П. к. с. пригодны для перевязки как артерии, так и вены. Однако при перевязке магистральной вены чаще накладывают атравматический шов, а для полых и других крупных вен атравматический шов подкрепляют прокладкой. При отсутствии тефлоновой или другой синтетической прокладки с этой же целью могут быть использованы кусочки фасции или мышцы.
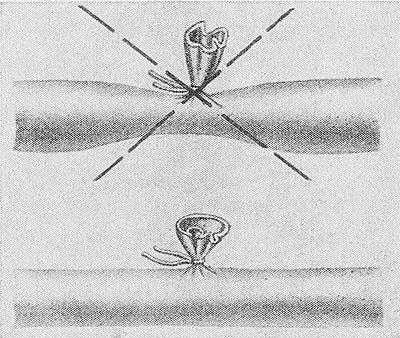
Рис. 2. Схематическое изображение боковой перевязки сосуда: внизу — правильная, вверху — неправильная.
Относительно редкую пристеночную П. к. с. (чаще на венах) производят гл. обр. при отрыве боковых ветвей сосуда. В таких случаях стенку сосуда в месте дефекта захватывают зажимом и накладывают тонкую лигатуру; при неправильном выполнении этой операции возможно сужение вены (рис. 2). При таком же дефекте артерии или крупной вены используют только сосудистый шов. При одновременном повреждении магистральной артерии и вены осуществляют реконструкцию как артерии, так и вены.
В военно-полевых условиях, когда перевязка магистральной артерии может оказаться единственно возможным средством остановки кровотечения, для предотвращения так наз. венного дренажа может быть применена хорошо зарекомендовавшая себя во время войны операция Оппеля, при к-рой наряду с артерией перевязывается и одноименная вена.
С целью профилактики ишемических расстройств в конечности во время операции в периферический конец артерии переливают кровь, производят десимпатизацию центрального конца и круговое рассечение наружной оболочки вблизи лигатуры по Русанову. Необходимо учитывать также, что перевязка нек-рых артерий (общей сонной, бедренной в зоне приводящего канала, подколенной), особенно чревата серьезными ишемическими расстройствами вплоть до гангрены, поэтому уровень ее должен определяться наличием коллатеральных ветвей. Так, перевязку бедренной артерии целесообразно производить дистальнее отхождения глубокой бедренной артерии; перевязку подколенной артерии — с сохранением латеральной и медиальной верхних коленных артерий; перевязку плечевой артерии — дистальнее коллатеральных (средней, лучевой и верхней локтевой) артерий.
Послеоперационный период
При больших операциях (торакотомий, торакофренолюм-ботомии и др.) для контроля за гемостазом и удаления скапливающейся геморрагической жидкости в полость вводят дренажи (см. Дренирование). Дренаж дает возможность проконтролировать тщательность П. к. с. в течение первых двух суток после операции.
После перевязки магистральных сосудов важно поддерживать нормальные гемодинамику (учитывая показатели АД, центрального венозного давления, объем циркулирующей крови и др.), кислотно-щелочное равновесие и другие показатели гомеостаза (см.). Для снятия спазма периферических сосудов целесообразно использовать спазмолитики (папаверин, но-шпу и др.), перидуральную анестезию (см. Анестезия местная). Для улучшения микроциркуляции и реологических свойств крови применяют инфузию реополиглюкина, персантина, курантила. Симптомы ишемии конечности, вызванные перевязкой магистрали, служат показанием к применению новокаиновой блокады поясничных (или шейных) симпатических ганглиев.
Осложнения
Кроме явлений ишемии (см.), возможны вторичные кровотечения в раннем и позднем послеоперационных периодах. Если кровотечение значительное, то показана срочная повторная операция. При незначительных кровотечениях могут быть использованы давящая повязка, наложение дополнительных швов и т. п.
Библиография:
Лыткин М. И. и Коломиец В. П. Острая травма магистральных кровеносных сосудов, Л., 1973; Петровский Б. В. и Милонов О. Б. Хирургия аневризм периферических сосудов, М., 1970; Покровский А. В. Клиническая ангиология, М., 1979; Шалимов А. А. и Дрюк Н. Ф. Хирургия аорты и магистральных артерий, Киев, 1979.
ПЕРЕВЯЗКА СОСУДОВ КОРНЯ ЛЕГКОГО В ПОЛОСТИ ПЕРИКАРДА ПРИ ПНЕВМЭКТОМИИ

Метод раздельной обработки элементов корня легкого при пневмэктомии является общепринятым. При этом выделяют и перевязывают сосуды легкого в корне и средостении, что удается относительно легко при отсутствии выраженных склеротических и воспалительных изменений в клетчатке и лимфатических узлах. Однако, патологический процесс (воспалительный и опухолевый) нередко поражает клетчатку корня легкого, в него вовлекается адвентиций сосудов. Выделение легочной артерии, легочных вен при этом чревато опасностью их повреждения и нередко — рокового кровотечения на операционном столе.
Ключевые слова
Полный текст
Б-ной Ю. М., 24 лет, поступил в хирургическое отделение Республиканского противотуберкулезного диспансера 7 декабря 1955 г. Диагноз: левосторонний неэффективный искусственный пневмоторакс, по поводу фиброзно-кавернозного туберкулеза легких, БК +.
В связи с неэффективностью антибактериальной терапии и лечебного пневмоторакса больному решено произвести операцию — верхнюю лобэктомию слева.
1/ІІ-56 г. операция под местной инфильтрационной анестезией ¼% раствором новокаина после вагосимпатической блокады на стороне операции. Выделение доли происходит с большими трудностями в связи с очень плотными сращениями в области средостения и по междолевой борозде. При препаровке в верхнем отделе междолевой щели повреждена ветвь легочной артерии. Для временной остановки кровотечения наложен зажим. Продолжено выделение ветвей легочной артерии в междолевой щели. Верхняя легочная вена и бронх обработаны типично. Доля удалена. Выделение основного ствола левой легочной артерии было рискованным из-за резких склеротических изменений клетчатки вокруг него. Попытка наложить лигатуру на поврежденную ветвь легочной артерии привела к соскальзыванию зажима и бурному кровотечению. Состояние больного резко ухудшилось, появились судороги, наступила остановка сердца, затем и дыхания. Кровотечение с большим трудом остановлено прижатием кровоточащего места пальцем, а затем грубо наложен зажим. Больному срочно в аорту перелито 20 мл крови, усилено внутривенное переливание крови. Вскоре состояние больного улучшилось, артериальное давление установилось в пределах 80-70. Для окончательной остановки кровотечения из легочной артерии, захваченной в зажиме, решено перевязать ее интраперикардиально. Перикард вскрыт продольным разрезом, длиной 6 см позади диафрагмального нерва над легочной артерией. После рассечения задней стенки перикарда у нижней полуокружности легочной артерии позади нее проведен зажим Федорова, конец которого выведен над верхним краем артерии в полости перикарда. Через проложенный таким образом туннель проведена шелковая лигатура, которая и была завязана. Зажим с артерии снят, небольшое кровотечение остановлено наложением лигатуры. Операция закончена без дренажа плевральной полости.
В послеоперационном периоде у больного была длительная лихорадка, увеличилось количество выделяемой мокроты. Комбинированное применение антибиотиков привело к постепенному улучшению общего состояния больного, нормализации температуры тела. Через 30 дней после операции больной был выписан для санаторного лечения с небольшой апикальной остаточной полостью.
Через три года после операции состояние больного вполне удовлетворительное, жалоб не предъявляет, кашель редкий, мокроты не выделяет, стойко абациллярен. Работает; одышки, сердцебиения нет. При рентгено-томографическом исследовании выраженные плевральные наложения в верхнем отделе плевральной полости слева, высокое стояние и ограничение подвижности левого купола диафрагмы.
В этом наблюдении при уже возникшем кровотечении из легочной артерии закрытие просвета ее в полости перикарда явилось единственным средством остановки смертельно опасного кровотечения. Вынужденное выключение главного ствола легочной артерии при лобэктомии не сказалось отрицательно на ближайших результатах операции. Отдаленные результаты вмешательства указывают на допустимость этого, вопреки литературным данным.
В другом случае перикард был вскрыт для перевязки легочных вен.
Б-ная 3. А., 24 лет, поступила в хирургическое отделение Республиканского диспансера 3/I-57 г. по поводу левостороннего фиброзно-кавернозного туберкулеза легких. Больной 11/III-57 г. был произведен верхний экстраплевральный пневмолиз слева. Операция оказалась неэффективной. Состояние больной продолжало ухудшаться, постоянно сохранялось бацилловыделение, количество мокроты — до 60 мл в сутки, иногда зловонная.
Добиться компенсации процесса при помощи длительной антибактериальной терапии и постельного режима не удалось. Температура тела периодически субфебрильная. Пульс — 86. Укорочение перкуторного звука над левым легким почти на всем протяжении, на фоне бронхиального дыхания большое количество разнокалиберных влажных хрипов, больше сзади, ниже угла лопатки. Жизненная емкость легких — 1400 мл. При рентгено-томографическом исследовании легких отмечается смещение сердца и средостения влево, почти тотальное затемнение левого легкого с множественными просветлениями в верхнем отделе. Небольших размеров верхушечный экстраплевральный пневмоторакс с утолщенными стенками. Диагноз: левосторонний хронический фиброзно-кавернозный туберкулез легких, ателектаз верхней доли, обсеменение нижней доли.
Левосторонняя пневмонэктомия (10/III-57 г.), выполненная под местной инфильтрационной анестезией раствором новокаина, была технически трудной из-за обширных рубцовых плевральных сращений на всем протяжении плевральной полости. Острым путем разрушены рубцовые ткани впереди корня легкого и по верхнему его полюсу. Выделены легочная артерия и легочные вены. Первая обработана типично, с прошиванием центрального отрезка. Экстраперикардиальная часть легочных вен оказалась короткой (1 см).
Выделение ветвей вен в корнях долей легкого было рискованным из-за склеротических и воспалительных изменений вокруг них. Чтобы надежно закрыть просвет легочных вен и избежать непоправимых осложнений, решено их перевязать трансперикардиально. Перикард вскрыт продольным разрезом позади диафрагмального нерва над корнем легкого. Затем перикард рассечен по нижнему краю верхней и нижней легочных вен. Лигатура при помощи зажима проведена через сделанные отверстия в задней стенке перикарда над верхним краем нижней и верхней легочных вен. Вторая лигатура наложена вне полости перикарда. Так как лигатуры на венах были фиксированы в задней стенке перикарда, необходимость в прошивной лигатуре отпала. Дефект в перикарде ушит двумя швами, так как из его полости отмечалось выпадение ушка левого предсердия.
Послеоперационный период протекал гладко. Через две недели после операции у больной наблюдался приступ сердечной слабости, ликвидированный внутривенным применением строфантина с глюкозой и эвакуацией экссудата из плевральной полости.
Через полгода после операции состояние больной вполне удовлетворительное, кашля и мокроты нет, температура нормальная. Жизненная емкость легкого - 1700 мл. После длительной ходьбы отмечает сердцебиение. Рентгенологически — фиброторакс слева.
Мы полагаем, что трансперикардиальный доступ к сосудам корня легкого имеет преимущества перед интраперикардиальным, так как при первом все манипуляции по выделению и обработке сосудов производятся под контролем зрения. При интраперикардиальном доступе проведение лигатуры позади сосудов производится вслепую, что нельзя считать безопасным. При этом доступе, однако, лигатура оказывается фиксированной в листке перикарда, и необходимость в прошивной лигатуре отпадает. Во втором нашем наблюдении мы фиксировали лигатуру в заднем листке перикарда по верхнему краю легочных вен, но выделение их произвели в основном трансперикардиально. Таким образом, использованы положительные стороны обоих доступов — интраперикардиального и трансперикардиального.
Представленные наблюдения подтверждают литературные данные о целесообразности интра- и трансперикардиальной перевязки сосудов корня легкого для предупреждения возможного кровотечения и воздушной эмболии при экстраперикардиальном их выделении и ликвидации уже возникшего кровотечения.
Читайте также:
