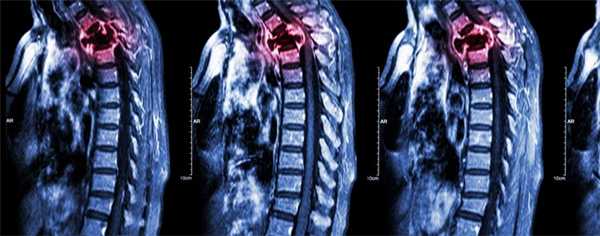
Примеры изменения прилегающих структур при метастазах в хориоидею
Добавил пользователь Morpheus Обновлено: 28.01.2026
Меланома хориоидеи — это пигментная опухоль злокачественного характера собственной сосудистой оболочки глаза (хориоидеи). Данная опухоль является одной из самых частых внутриглазных новообразований. Меланома хориоидеи является основной причиной смертности и инвалидизации онкобольных с поражением органа зрения. Заболевание может протекать практически бессимптомно, но при этом имеет высокую склонность к метастазированию, поэтому проблема ее выявления на начальных стадиях является крайне актуальной.
Этиологические факторы
Большинство случаев меланомы хориоидеи являются спорадическими, то есть обусловлены теми или иными мутациями клетки-предшественницы меланоцитарного звена, которая может дать начало патологическому опухолевому клону. Кроме того, есть предположение о наследственной причине данного заболевания. Воздействие такого типичного провоцирующего фактора для меланомы кожи, как повышенная инсоляция, для этой опухоли также не исключается.
В группе риска находятся пожилые люди (средний возраст манифестации опухоли — 60 лет). Немного чаще болеют мужчины. Склонны к появлению меланомы хориоидеи обладатели светлой кожи и волос, невусов и веснушек.
Клиническая картина
Жалобы пациентов зависят от размера и локализации меланомы хориоидеи, а также от наличия сопутствующих осложнений, к которым относятся: отслойка сетчатки вторичного характера, появление дегенеративных процессов в сетчатке, помутнение хрусталика.
На первичном приеме у офтальмолога обычно определяется снижение остроты зрения, появление перед глазом слепых участков (скотом), гемианопсий (выпадения половин поля зрения). В случае позднего обращения, больные жалуются на боль в глазу (вторичная глаукома), расширение сети сосудов. Также на склере может определяться пигментное пятно (экстраокулярный рост новообразования).
Стадии развития меланомы хориоидеи
Согласно международной классификации различают 4 стадии развития данной опухоли. Критерии распространенности опухолевого процесса:
- Т1 — размер меланомы 10 мм и менее, толщина — 2,5 мм и менее.
- Т2 — размер новообразования 10-16 мм, наибольшая толщина составляет 2,5-10 мм.
- Т3 — размером 16 мм и/или толщина более 10 мм без распространения за пределы глазного яблока.
- Т4 — наибольший размер опухоли 16 мм и/или толщина более 10 мм с распространением за пределы глазного яблока.
Также выделены 4 клинические стадии меланомы хориоидеи. Для каждой из них характерны определенные симптомы заболевания:
- Для первой, так называемой стадии «спокойного глаза», свойственно отсутствие ярких клинических проявлений и жалоб. Возможно наличие помутнения сетчатки, также могут определяться дефекты поля зрения.
- Вторая стадия характеризуется появлением боли в глазах, воспаления, покраснения глазного яблока, отека век.
- На третьей стадии меланома хориоидеи выходит за границы глазного яблока, формируется экзофтальм, склера теряет целостность.
- Четвертая стадия сопровождается генерализацией процесса. Общее состояние пациента ухудшается. Больные жалуются на сильную боль, снижается масса тела, нарастает интоксикация. Появляются метастазы меланомы внутренних органов: печени, легких, костей. Поражение того или иного органа провоцирует появление соответствующих симптомов. Может выявляться дальнейшее снижение остроты зрения, чувство пелены или тумана перед глазами. Данные проявления вызываются кровотечениями в стекловидное тело, помутнением хрусталика.
Симптомы второй и третьей стадии меланомы хориоидеи ярко выражены при расположении опухоли в центральной или парацентральной части глазного дна. Для периферической локализации новообразования характерно длительное отсутствие субъективных ощущений. В этом случае меланома выявляется либо случайно, либо на стадии распада опухоли и ее вторичных проявлений.
Виды меланомы глаза
Разработана классификация меланомы хориоидеи по морфологическому признаку. В зависимости от клеточной структуры, выделяют следующие типы данной опухоли:
- Веретеноклеточный.
- Эпителиоидный.
- Смешанный (микстмеланома).
- Фасцикулярный.
- Некротический.
Данная классификация имеет определенные недостатки, так как некротическая меланома хориоидеи определяется клинически, а вот определить ее клеточную принадлежность из-за обширного некроза невозможно. Веретенообразный и фасцикулярный тип имеют сходный прогноз. В связи с этим, в настоящее время морфологически принято выделять только 2 типа: веретеноклеточный и эпителиоидный. Смешанная форма занимает промежуточное положение. Ее прогноз зависит от преобладания тех или иных клеток. Наименее благоприятной прогностически считается эпителиоидноклеточная меланома хориоидеи.
Диагностика
Учитывая клинические особенности меланомы хориоидеи, ее диагностика, особенно на начальных этапах, представляет определенные трудности. Помимо анализа жалоб больного и клинико-анамнестических данных, учитываются результаты следующих инструментальных исследований:
- Биомикроскопии.
- Офтальмоскопии.
- Ультразвукового исследования глаза.
- Диафаноскопии и др.
Меланома хориоидеи является новообразованием с высоким риском появления метастазов. Поэтому при обследовании пациента необходимо использовать также методы диагностики метастатических очагов: УЗИ органов брюшной полости и лимфатических узлов, рентгенографию легких, КТ, МРТ.

Способы лечения меланомы хориоидеи
Выделяют органосохраняющие методы лечения данной опухоли и хирургический метод без сохранения глаза. В случаях, когда не удается сохранить глаз, производят энуклеацию — изолированное удаление глазного яблока или экзентерацию — иссечение вместе с глазным яблоком всего содержимого орбитальной полости.
Показания к энуклеации:
- Опухоль значительного размера.
- Распространение меланомы на диск зрительного нерва.
- Полное отсутствие зрительной функции.
- Экстрабульбарный рост опухоли.
- Вторичная глаукома.
После удаления глазного яблока, проводится имплантация внутреннего протеза и последующее наружное протезирование. Эти меры позволяют не только достичь хорошего косметического результата, но и препятствуют деформации лица.
К органосохраняющим методам лечения меланомы хориоидеи относятся:
Лучевая терапия. В зависимости от способа подведения излучения, лучевую терапию при данном заболевании проводят контактным или дистанционным способом. Контактное облучение, или брахитерапия, представляет собой имплантацию радиоактивных элементов вблизи очага меланомы.
Показания к проведению брахитерапии:
- Отсутствие признаков распада.
- Диаметр новообразования до 15 мм.
- Отстояние от диска зрительного нерва не менее 2 диаметров самого диска.
Брахитерапия является самым эффективным методом органосохраняющего лечения при меланоме хориоидеи. Его применение способно снизить вероятность образования метастазов опухоли.

В составе системного лечения, актуально проведение иммунной терапии. Также при оказании помощи больным с меланомой хориоидеи в поздних стадиях учитываются особенности ее метастазирования. Для данной опухоли характерно изолированное поражение печени метастазами. В таких случаях с успехом применяется химиоэмболизация данного органа.
Такой распространенный метод лечения меланомы кожи, как таргетная терапия, при меланоме хориоидеи не применяется, так как при данном виде опухоли отсутствуют специфичные BRAF-мутации.
Профилактика и диспансерное наблюдение
Рекомендовано пожизненное наблюдение за больными, которые получали лечение меланомы хориоидеи. После проведения лучевой терапии и удаления новообразования, офтальмолог должен осматривать пациентов каждые полгода в течение 2 лет, а далее — 1 раз в год. С целью раннего выявления метастазов назначают УЗИ органов брюшной полости и рентгенографию легких 1-2 раза в год.
Прогноз для жизни при меланоме хориоидеи
Продолжительность жизни при данном виде рака зависит от локализации и размера опухоли, возраста пациента, морфологии новообразования, проведенного лечения и других особенностей. Пятилетняя выживаемость на начальных стадиях меланомы хориодиеи после применения органосохраняющих радикальных методов составляет 93%, десятилетняя — 89%. На поздних стадиях, при выявлении метастазов печени медиана выживаемости составляет лишь 4-6 месяцев. Для пациентов с метастатическим поражением других органов годичная выживаемость составляет 76%.
Примеры изменения прилегающих структур при метастазах в хориоидею
ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва
ФГБУ "НИИ глазных болезней" РАМН, Москва
ГБУЗ "Офтальмологическая клиническая больница ДЗМ"
ГОУ ДПО РМАПО Минздрава России, ул. Баррикадная, 2/1, Москва, Российская Федерация, 125993
Меланома хориоидеи и изменения сетчатки
Журнал: Вестник офтальмологии. 2019;135(6): 4‑10
В литературе высказано предположение о существовании нового фенотипа — ретиноинвазивной меланомы хориоидеи (МХ). Однако нельзя исключить факт ее распространения по внутренней поверхности сетчатки. Цель исследования — изучить возможности исследования оптической когерентной томографии (ОКТ) для определения путей распространения МХ в сетчатку по результатам патоморфологического исследования глаз, энуклеированных по поводу МХ. Материал и методы. Изучены ОКТ-томограммы 64 глаз с МХ (средняя элевация опухоли — 2,89±0,19 мм, диаметр — 9,58±0,43 мм). Патоморфологическому исследованию подвергнуто 18 глаз с элевацией МХ до 7 мм, без предшествующего лечения. Результаты. ОКТ-исследования выявили признаки прорастания меланомы в сетчатку в 49 глазах. К ним отнесены: наличие зон конгломерата сетчатка/МХ (21 глаз), наличие разрыва мембраны Бруха (МБ) и ретинального пигментного эпителия (РПЭ), нарушение дифференцировки наружных слоев сетчатки (15 глаз). В 11 глазах выявлено сочетание двух типов прорастания. Патоморфологическими исследованиями установлены низкая митотическая активность МХ, присутствие небольшого количества мелкоочаговых некрозов и кровоизлияний. Распространение МХ в сетчатку выявлено в 13 глазах. Прорастание сетчатки начиналось с локального разрушения МБ и чаще ограничивалось уровнем фоторецепторов, нарушая архитектонику сетчатки, ядерных слоев. Над большими МХ грубая деструкция МБ, клетки опухоли — в отечной с кистовидной дистрофией сетчатке, во внутренних ее слоях, проникали в стекловидное тело. Инфильтрация сетчатки до внутреннего ядерного слоя сопровождалась ее транссудативной отслойкой и кистовидной дистрофией. Заключение. Инвазия МХ в сетчатку с поражением всех ее слоев, начиная с малой толщины опухоли, диктует обязательность ОКТ-исследования целости сетчатки. Опухолевую инфильтрацию сетчатки и при локализации вблизи диска зрительного нерва следует расценивать как противопоказание для локального разрушения опухоли эндовитреальным подходом. При брахитерапии рассчитывать апикальную дозу облучения следует с учетом опухоли и толщины сетчатки.
В 2000-е годы в практику офтальмологов вошел метод оптической когерентной томографии (ОКТ) сетчатки. При меланомах хориоидеи (МХ) его первоначально применяли в основном для выявления вторичных опухолеассоциированных изменений в сетчатке [1—4]. Позднее, с появлением режимов, позволяющих проводить исследование и более глубоких структур (EDI — enhanced depth imaging (Heidelber Engeneering) или DRI — deep range imaging (Topcon)), начали исследовать состояние хориоидеи в зоне опухоли [5—12]. Однако в литературе все еще отсутствуют сведения о возможности получения информации с помощью ОКТ о прижизненном выявлении интервенции клетками опухоли сетчатки. В то же время в 1997 г., когда T. Kivelä и P. Summanen описали случаи прорастания сетчатки дистантно расположенной меланомой радужки, распространившейся через «трансвитреальное пространство», появился термин «ретиноинвазивная меланома хориоидеи». Авторы подчеркивали редкое поражение хориоидеи при ретиноинвазивной меланоме. Более того, эту опухоль расценили как самостоятельный фенотип меланомы [13, 14]. Спустя 15 лет Т. Milman с соавторами исследовали состояние сетчатки в 4 глазах с ретиноинвазивной меланомой и в 4 глазах с неретиноинвазивной меланомой хориоидеи. Итог: в глазах с ретиноинвазивной меланомой отмечено диффузное прорастание сетчатки за пределами опухолевого узла. Но и в контрольных глазах была обнаружена очаговая инвазия сетчатки клетками меланомы над опухолью [15]. В 60-х годах ХХ века морфологическими исследованиями глаз, энуклеированных по поводу МХ, была доказана прямая инвазия меланомой надлежащей сетчатки [16, 17]. Анализ литературы свидетельствует, что вопрос — ретиноинвазивная меланома радужки и/или цилиарного тела является самостоятельным фенотипом увеальной меланомы или это продолженный рост меланомы радужки и/или цилиарного тела в прилежащие ткани — остается открытым.
Цель исследования — выявить возможности ОКТ-исследования для прижизненного определения распространения МХ в сетчатку, изучить пути распространения МХ в сетчатку по результатам патоморфологического исследования энуклеированных глаз по поводу МХ.
Материал и методы

Для оценки состояния сетчатки, лежащей над опухолью, изучены ОК-томограммы 64 глаз с МХ (средняя проминенция опухоли — 2,89±0,19 мм; средний ее диаметр — 9,58±0,43 мм). Преимущественно (41 глаз) меланомы локализовались в центральной зоне глазного дна. Исследование ОКТ выполняли в стандартном режиме и в режиме EDI — enhanced depth imaging (OCT Spectralis, Heidelberg Engineering, Германия). При расположении опухоли в периферических отделах глазного дна использовали широкопольный объектив. При этом за хориоидальный комплекс принимали расстояние между наружной границей ретинального пигментного эпителия (РПЭ) и гиперрефлективной линией кнаружи от слоя крупных сосудов хориоидеи, что предположительно является границей между хориоидеей и склерой [18]. Анализ томограмм проводили в режиме оттенков серого цвета, который является более информативным для оценки тонких изменений [19]. Метрическая характеристика глаз, обследованных ОКТ-методом, представлена в табл. 1. Таблица 1. Количество обследованных ОКТ глаз с МХ, ее размеры Примечание. Статистическая обработка полученных результатов выполнена с использованием программы IBM SPSS Statistics 23.0.
При анализе томографической картины учитывали, что в норме на сканах ОКТ высокого разрешения линия комплекса пигментный эпителий — хориокапилляры состоит из трех параллельных полос: двух относительно широких гиперрефлективных, разделенных тонкой гипорефлективной полосой. Принято считать, что внутренняя гиперрефлективная полоса — это линия контакта ворсинок пигментного эпителия и наружных сегментов фоторецепторов, а другая — наружная полоса — представляет собой тела клеток пигментного эпителия с их ядрами, мембрану Бруха (МБ) и хориокапилляры. Основные хориоидальные сосуды на томограмме гипорефлективны и могут быть различимы в виде двух слоев: слоя средних сосудов Саттлера и слоя крупных сосудов Галлера. Обычно М.Б. на ОКТ не дифференцируется (так как в норме РПЭ, МБ и хориокапилляры тесно связаны между собой), но при наличии друз и небольшой отслойки пигментного эпителия она определяется как тонкая горизонтальная интенсивно гиперрефлективная линия [19].
Патоморфологическому исследованию с целью уточнения характера изменений сетчатки над МХ было подвергнуто 18 глаз. Отбор глаз проводили по следующим критериям: отсутствие предшествовавшего лечения, локализация опухоли в хориоидее, максимальная проминенция опухоли — 7,0 мм. Исследовали серию срезов с парафиновых блоков. Окраска гематоксилином и эозином. Критерий отбора глаз и выявленные изменения в сетчатке представлены в табл. 2. Таблица 2. Метрическая характеристика МХ в глазах, отобранных для морфологического исследования, и частота роста в сетчатку Примечание. * — остальные случаи — веретеноклеточная МХ.
Результаты и обсуждение
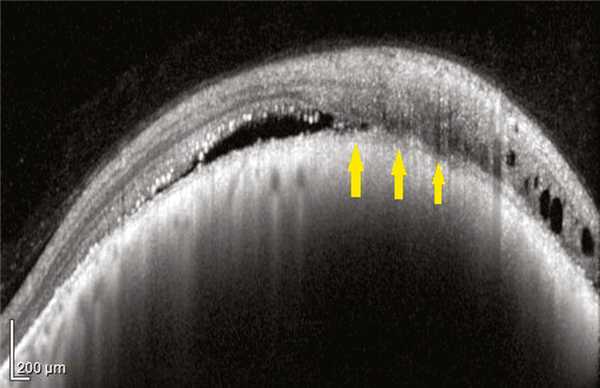
По результатам ОКТ-исследования в 49 глазах из 64 выявлены признаки нарушения дифференцировки комплекса хориоидея/МБ/РПЭ. Статистически достоверных различий размеров МХ при отсутствии или наличии прорастания ее в сетчатку выявлено не было (р=0,83 и р=0,23 соответственно для проминенции и диаметра). Разрушение сетчатки опухолью всегда начиналось с разрушения МБ и РПЭ, что мы наблюдали в 73% случаев при толщине опухоли от 1 мм. Единый конгломерат сетчатка/опухоль на большом протяжении отмечен в 21 (31,34%) глазу при средней толщине МХ — 3,0±0,29 мм, среднем диаметре — 10,29±0,72 мм. Изменения на ОКТ-сканах были представлены протяженной гиперрефлективной полосой с интенсивно гиперрефлективным подлежащим комплексом опухоли и нарушением дифференцировки надлежащей сетчатки, в первую очередь ее наружных слоев (рис. 1). Рис. 1. Горизонтальный ОКТ-скан через МХ (проминенция 3,0 мм). Стрелками указана зона протяженного дефекта МБ.
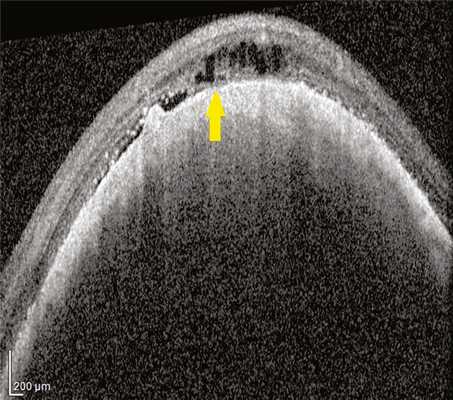
В 15 (22,4%) глазах визуализированы зоны разрыва МБ и РПЭ, нарушение дифференцировки структуры хориоидеи и сетчатки при средней проминенции МХ — 2,76±0,23 мм, среднем диаметре — 9,1±0,52. В этих глазах на ОКТ-сканограммах в зоне опухоли МБ была представлена в виде тонкой интенсивно гиперрефлективной линии на границе опухолевого комплекса и сетчатки. На протяжении этой линии имелись локальные дефекты с изменениями, аналогичными описанным выше (рис. 2). Рис. 2. Горизонтальный ОКТ-скан через МХ (проминенция 2,9 мм). Стрелкой указан локальный дефект МБ.
В 11 (11,4%) глазах наблюдали сочетание обоих, описанных выше, типов прорастания МХ в сетчатку. Средняя проминенция МХ в этих глазах составила 2,59±0,53 мм (1—6,0 мм); средний диаметр — 9,83±1,34 (6,06—19,59 мм). Статистически достоверной разницы в размерах меланом при разных типах прорастания не выявлено (p=0,69 и р=0,56 соответственно для проминенции и диаметра).
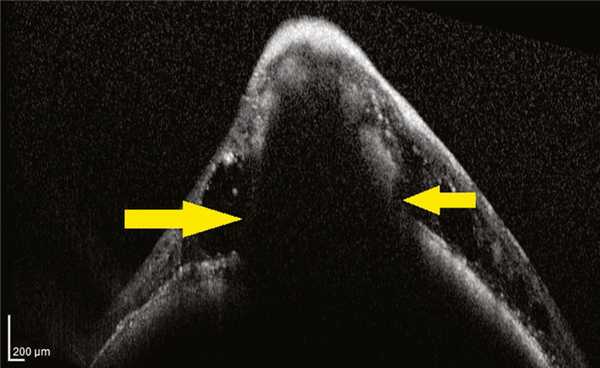
При грибовидной форме меланомы (2 глаза) четко прослеживался протяженный дефект МБ в зоне шейки гриба, что подтверждает возможный механизм развития этой формы МХ [17] (рис. 3). Рис. 3. Горизонтальный ОКТ-скан грибовидной МХ (проминенция 4,7 мм). Стрелками указан протяженный дефект МБ.
На основании полученных данных можно утверждать, что рост МХ в сетчатку начинается с локальных участков прорастания МБ и РПЭ при толщине опухоли от 1 мм. Следствием этого являются возникающие зоны нарушения дифференцировки слоев сетчатки. Иными словами, локальное прорастание МХ в сетчатку начинается с инвазии опухолевых клеток в МБ [20]. По мере увеличения количества таких зон происходит их слияние с формированием единого конгломерата сетчатки и опухоли на большом протяжении.
Анализ томограмм пациентов с МХ позволил сформулировать ОКТ-признаки прорастания меланомы в сетчатку. К ним относятся: наличие участков конгломерата сетчатка/МХ, появление зон разрыва МБ и РПЭ с нарушением дифференцировки первоначально наружных слоев сетчатки.
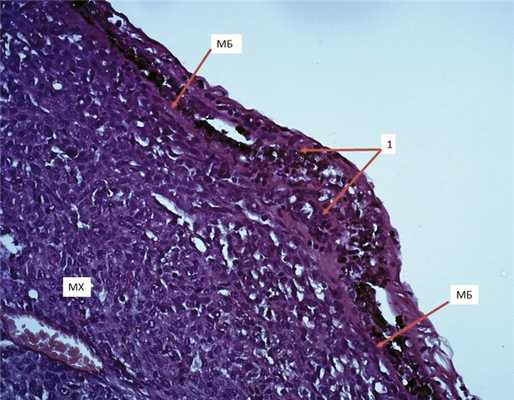
В трех случаях оказалось возможным сопоставить ОКТ-изменения сетчатки над МХ с морфологическими изменениями зоны опухоль/сетчатка в энуклеированных глазах. Всего морфологически исследовали 18 глаз. В исследованных глазах для МХ были характерными низкая митотическая активность, присутствие небольшого количества мелкоочаговых некрозов и кровоизлияний. Веретеноклеточная М.Х., независимо от толщины опухоли, преобладала во всех 14 глазах, смешанно-клеточная меланома с проминенцией 4, 5, 6 мм диагностирована в 4 глазах, что подтверждает высказанное ранее мнение о преобладании в Московском регионе МХ веретеноклеточного строения [21]. Выход опухоли за пределы склеры при морфологическом исследовании выявлен в 3 глазах (толщина опухоли соответственно 4, 5 и 7 мм). В сетчатку распространение меланомы визуализировано в 13 из 18 глаз. Прорастание сетчатки начиналось с признаков разрушения МБ, оно прослеживалось не на всем протяжении: наряду с локальными участками нарушения целости МБ имелись зоны ее утолщения. Это подтверждает высказанное в 1965 г. В.М. Шепкаловой мнение о прямом распространении меланомы хориоидеи в сетчатку через МБ, после чего клетки опухоли последовательно диссеминируют в субретинальное пространство и разрушают фоторецепторы. Действительно, в исследованных глазах клетки меланомы распространялись в субретинальное пространство, оседая на внутренней поверхности МБ, получали возможность инфильтрировать наружные слои сетчатки. Прорастание сетчатки в исследованных глазах было выражено в разной степени. Чаще оно ограничивалось только уровнем фоторецепторов, нарушая архитектонику сетчатки, смещая ядерные слои. Причем минимальная инфильтрация сетчатки клетками опухоли сопровождалась выраженной ее атрофией (рис. 4). Рис. 4. Микропрепарат М.Х.. Минимальная инфильтрация опухолью атрофичной сетчатки с прорастанием МБ (1 — очаг прорастания опухоли в сетчатку; ув. 200). Здесь и на рис. 5—10 окраска гематоксилином и эозином.
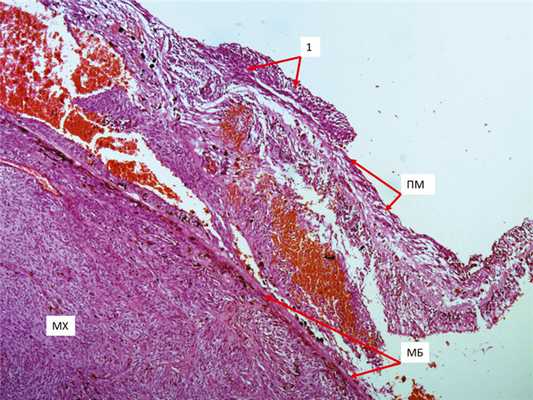
В одном случае при толщине меланомы 5,5 мм установлено прорастание опухолью всех слоев сетчатки с прорывом внутренней пограничной мембраны и распространением клеток опухоли по ее внутренней поверхности (рис. 5). Рис. 5. Микропрепарат М.Х.. Инфильтрация опухолевыми клетками всей толщины сетчатки с прорывом внутренней пограничной мембраны и распространением опухоли по ее поверхности (ПМ — внутренняя пограничная мембрана; 1 — распространение опухоли по поверхности ПМ; ув. 50). The body of retina is fully infiltrated by tumor cells, broken inner limiting membrane, the tumor spread over its surface (ПМ — inner limiting membrane (ILM); 1 — spreading of the tumor over ILM surface; magn. ×50).
Распространение клеток меланомы в субретинальном транссудате создает условия как для продолженного роста, так и для формирования имплантационных очагов в сетчатке вдали от места прорастания. Опухолевые клетки, прорастая в сетчатку, образуют периваскулярные фокусы, распространяясь в стекловидное тело [22]. Серийное исследование глаз в наших работах выявило мультифокальное прорастание сетчатки (рис. 6) Рис. 6. Микропрепарат М.Х.. 1 — очаги опухолевой инфильтрации в сетчатке; ув. 50. и формирование имплантационных метастазов, лежащих на наружной поверхности сетчатки дистантно от МХ (рис. 7). Рис. 7. Микропрепарат М.Х.. Имплантационный метастаз МХ на поверхности внутренней пограничной мембраны сетчатки. Сетчатка отечная с дистрофией и нарушенной архитектоникой (С — сетчатка; ИМ — имплантационный метастаз; ув. 50). Implantation metastasis of CM on the surface of retinal ILM. The retina is edematous, with dystrophy and disrupted architectonics (C — retina; ИМ — implantation metastasis; magn. ×50).
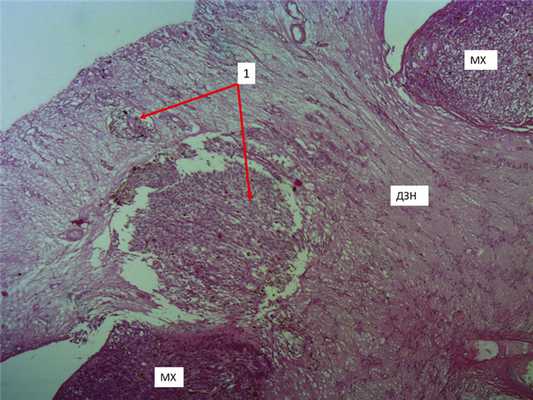
Над большими МХ (проминенцией более 5 мм) в МБ развивалась грубая деструкция с разрушением, клетки опухоли распространялись в сетчатку, которая к этому времени имела признаки отека, кистовидной дистрофии, а опухолевая инфильтрация достигала внутренних слоев сетчатки, и клетки МХ проникали в стекловидное тело. Прорыв сетчатки с распространением опухоли по ее внутренней поверхности позволяет обосновать механизм развития имплантационных метастазов на внутренней поверхности отслоенной сетчатки дистантно от опухолевого узла [16]. При перипапиллярном расположении опухоль при ее толщине от 2 мм инфильтрирует диск зрительного нерва (ДЗН) (рис. 8). Рис. 8. Микропрепарат М.Х.. Перипапиллярная М.Х. Инфильтрация опухолью ДЗН и сетчатки (1 — опухолевая инфильтрация ДЗН и сетчатки; ув. 50).
Инфильтрация сетчатки до внутреннего ядерного слоя сопровождается ее транссудативной отслойкой (рис. 9). Рис. 9. Микропрепарат М.Х.. Инфильтрация сетчатки опухолевыми клетками до уровня внутреннего ядерного слоя. Сетчатка над опухолью отслоена транссудатом (Т — транссудат, отслаивающий сетчатку; С — сетчатка; 1 — очаги опухолевой инфильтрации в сетчатке; ув. 100). Возникает отек сетчатки, развивается кистовидная дистрофия (рис. 10). Рис. 10. Микропрепарат М.Х.. Прорыв внутренней стекловидной пластинки (МБ) клетками меланомы (МХ), выход опухолевых клеток в субретинальное пространство (СП) с разрушением фоторецепторов (1). Субретинальное кровоизлияние (ув. 100).
Таким образом, из 18 обследованных глаз нарушение целости МБ выявлено в 15, распространение меланомы в сетчатку — в 13 глазах. Судить о частоте на столь небольшом выборочном материале не корректно. По данным W. Davies’а, инвазия сетчатки вокруг меланомы хориоидеи достигает 59% [16], A. Bhavsar полагает, что эти показатели колеблются в пределах 29—40% и возникают после того, как опухоль, проникая в МБ, мигрирует в вышележащую сетчатку [20]. Наряду с этим указывают на значительно бòльшую частоту инвазии сетчатки хориоидальной меланомой (86,87%), разрушение опухолью наружного ядерного слоя встречается у каждого пятого больного, инвазия клетками опухоли ганглиозного слоя выявляют практически в 1/3 исследованных глаз, а инвазию внутренней пограничной пластинки — в 24% случаев. Морфологический тип опухоли не имеет значения: в 74,51% случаев с веретеноклеточной меланомой хориоидеи, которая составила 72,7% среди обследованных глаз, инвазия сетчатки и склеры различной степени интенсивности составила 72% [23]. Т. Milman полагал, что ретиноинвазивная меланома характеризуется диффузной инфильтрацией сетчатки, в то время как для хориоидальной меланомы типична очаговая инфильтрация на вершине опухоли или предламинарная инвазия зрительного нерва [15]. Так ли это? Меланома радужки развивается в стромальном слое, содержащем тонкий слой меланоцитов, растет, как правило, поверхностно и, выходя за пределы угла передней камеры, распространяется по внутренней поверхности сетчатки, инфильтрируя ее. Сетчатка в цилиарном теле представлена двумя эпителиальными слоями и внутренней пограничной пластинкой, поэтому развивающаяся меланома быстро распространяется по поверхностным (внутренним) слоям сетчатки.
Заключение
Меланому хориоидеи, радужки и цилиарного тела, прорастающую в сетчатку, следует рассматривать как единую злокачественную опухоль III стадии роста. Это важный момент при планировании лечения, особенно когда речь идет об органосохранном лечении.
Возможность инвазии МХ в сетчатку с поражением всех ее слоев, начиная с малой толщины опухоли, диктует обязательное проведение ОКТ-исследования на предмет выявления целости сетчатки. Нарушение целости сетчатки, в том числе и при локализации вблизи ДЗН, следует расценивать как противопоказание для локального разрушения опухоли эндовитреальным подходом. При брахитерапии рассчитывать апикальную дозу облучения следует с учетом толщины сетчатки, а не только самой опухоли.
Участие авторов:
Концепция и дизайн исследования: А.Б.
Сбор и обработка материала: А.С., С.Н., И.М.
Статистическая обработка: А.С.
Написание текста: А.Б., А.С.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Динамика метастатического поражения хориоидеи на фоне полихимиотерапии (клинический случай)
В качестве иллюстрации приводим собственное клиническое наблюдение. Пациентка Ш., 34 года, в октябре 2020 года обратилась с жалобами на искажения предметов и снижение остроты зрения правого глаза в течение двух недель.
Анамнез: в октябре 2010 года у пациентки выявлен рак правой молочной железы, а в феврале 2011 года выполнена радикальная мастэктомия. В предоперационном периоде пациентка получила 4 цикла полихимиотерапии (ПХТ) по схеме FAC (фторурацил, адриамицин (доксорубицин), циклофосфамид) и радикальный курс дистанционной лучевой терапии на область правой молочной железы, парастернальную, надключичную и аксилярную области традиционным фракционированием с разовой очаговой дозой 2 Гр. Суммарная очаговая доза - 64 Гр. В послеоперационном периоде проведено 4 цикла ПХТ по схеме АТ (доксорубицин, таксотер). Далее в течение 5 лет пациентка получала гормональную терапию аналогами лютеинизирующего рилизинг-гормона, в течение 3 лет использовался тамоксифен и в течение 2 лет - анастрозол. В сентябре 2020 года были выявлены метастазы в правом легком и лимфоузлах средостения. Спустя месяц (октябрь 2020 г.) выявлен метастатический узел в желудке.
На момент обращения к офтальмологу: максимальная острота зрения (МОЗ) правого глаза - 0,7 н/к, левого - 0,8 с sph -0,5Д=0,9. ВГД OD=15,3 мм рт.ст., OS - 17,2 мм рт.ст. Передний отрезок обоих глаз - без патологии. При офтальмоскопии на глазном дне правого глаза выявлен отек в макулярной зоне, по ходу верхне-височной аркады - незначительно проминирующий округлый очаг желтоватого цвета размером 1-1,5 ДД. Перипапилярно с носовой стороны имелся плоский округлый очаг размером 1 ДД, на средней периферии в наружной половине диагностированы два плоских округлых очага желтоватого цветы с «пестрой» поверхностью размерами 1 ДД (рис. 1). На глазном дне левого глаза парамакулярно выявлены два плоских очага желтоватого цвета размерами 1 ДД. По ходу верхне-носовой аркады в 1,5 ДД от ДЗН визуализировали плоский очаг желтоватого цвета с пестрой поверхностью размером 1 ДД, на средней периферии снизу - 2 округлых очага желтоватого цвета с «пестрой» поверхностью размерами 2 и 1,5 ДД (рис. 2). В общей сложности было выявлено 9 очагов: 4 - в правом глазу и 5 - в левом.
По данным УЗИ обоих глаз зон проминенции выявлено не было. При проведении ОКТ в макулярной зоне правого глаза выявлена отслойка нейроэпителия (ОНЭ) высотой 309 мкм. Субфовеолярно с распространением в сторону верхне-височной аркады визуализировано расширение хориоидального комплекса с ровным профилем передней поверхности, асимметрией формы скатов хориоидального комплекса и неравномерной умерено рефлективной структурой. В зоне максимальной проминенции очага хориокапилляры не визуализировались. В надлежащей сетчатке - участки утолщения слоя ретинального пигментного эпителия, отек фоторецепторного и ядерных слоев. Аналогичные изменения имели и остальные очаги, в том числе на парном глазу. На поверхности и/или по скатам очагов выявлена ОНЭ. Толщина хориоидального комплекса в зоне максимальной проминенции очагов варьировала от 391 до 1062 мкм на правом глазу и 535-1254 мкм - на левом.
На основании данных анамнеза, билатерального многофокусного поражения с характерной ОКТ-картиной [6, 12-14] был поставлен диагноз метастатического поражения хориоидеи. Следует отметить, что описываемые в литературе неровности передней поверхности хориоидального комплекса («lumpy, bumpy») характерны для метастазов больших размеров [6, 13, 14], а на ранних стадиях процесса он может быть ровным или иметь незначительную неровность [15], что и имело место в данном случае.
Ранее симптоматическим лечением метастазов хориоидеи была признана лучевая терапия (дистанционная гамма-терапия или облучение узким медицинским протонным пучком), приводящая к регрессии опухолевого узла, резорбции субретинальной жидкости и повышению остроты зрения [2]. Считают, что лучевая терапия требует длительного периода лечения, что может быть неудобным и непрактичным у тяжелобольных пациентов [6]. Первые работы по успешному применению ПХТ в лечении пациентов с диссеминированным метастатическим процессом появились еще в 1970-80-х гг. [16], но, несмотря на это, долгое время эффективность ПХТ ставилась под сомнение [17]. В последние годы при многофокусном билатеральном поражении хориоидеи в сочетании с метастазами другой локализации предпочтение отдают системной химиотерапии, иммуно- или гормональной терапии [6].
С учетом наличия диссеминированного метастатического процесса пациентке была рекомендована консультация онколога. В октябре-ноябре пациентка получила 6 циклов ПХТ по схеме ТС (паклитаксел, карбоплатин).
На фоне проведенного лечения пациентка отметила уменьшение искажений перед правым глазом, при этом МОЗ повысилась до 0,8 н/к. При осмотре глазного дна правого глаза отмечено уменьшение размеров очага по ходу верхне-височной аркады и ОНЭ в макулярной зоне. Очаги в перипапиллярной зоне и на средней периферии с височной стороны не определены (рис. 4). При осмотре глазного дна левого глаза отмечено уменьшение размеров очагов по ходу верхне-носовой и нижне-височной аркад, а парамакулярно расположенные очаги уже не определялись (рис. 5).
По данным ОКТ на правом глазу субфовеолярная ОНЭ уменьшилась до 43 мкм. Толщина хориоидального комплекса в зонах, ранее соответствовавших зонам максимальной проминенции очагов, уменьшилась до 232-451 мкм на правом глазу и до 206-587 мкм - на левом (рис. 6, 7).
Уменьшение толщины хориоидального комплекса сопровождалось усилением рефлективности хориоидального комплекса с «уплотнением» его структуры, что скорее всего свидетельствует о формировании рубца на месте хориоидального метастаза. В фовеолярной зоне правого глаза появились участки деструкции РПЭ (штрихообразная гипертрансмиссия). В сетчатке над остальными очагами выявлено увеличение гиперрефлективных изменений на уровне РПЭ. На участках ранее существовавшей ОНЭ отмечено уменьшение рефлективности слоя фоторецепторов, она сохранялась только вокруг наиболее крупных очагов.
Приведенное наблюдение свидетельствует о большей информативности оптической когерентной томографии для выявления начальных, офтальмоскопически «скрытых» метастазов в хориоидею. Это позволяет рекомендовать обязательное билатеральное ОКТ-исследование не только макулярной зоны, но и средней периферии у больных с онкологическим анамнезом. Есть основания полагать, что его можно использовать и для оценки проводимого лечения (особенно это заметно на метастазах малых размеров), в частности, полихимиотерапии.
Метастазы в лимфоузлах
Метастазы — это вторичные опухолевые образования, которые возникают в результате рассеивания злокачественных клеток из первичных очагов. Они могут распространяться по всему организму, поражая практически любой орган. Однако в подавляющем большинстве случаев первые метастазы обнаруживаются в лимфоузлах.
Причины метастазирования в лимфоузлы
Пока не до конца ясны механизмы, посредством которых возникает метастаз в лимфоузел . Известно, что в данном процессе играет роль активация у злокачественных клеток способности к миграции и структурная перестройка кровеносных и лимфатических сосудов, питающих и окружающих опухоль — в них отсутствует базальная мембрана и перициты. Некоторые капилляры даже образованы непосредственно опухолевыми клетками. Таким образом, злокачественные клетки попадают в лимфатические сосуды и по ним достигают ближайших лимфатических узлов.
Способность рака к метастазированию определяется несколькими факторами:
- Степенью злокачественности рака. Чем менее дифференцированы клетки опухоли, тем она агрессивнее и тем раньше начинает метастазировать.
- Гистологическим типом опухоли. Чаще всего лимфогенным путем метастазируют карциномы — злокачественные новообразования, происходящие из эпителиальной ткани.
- Возрастом пациента. У молодых людей метастазы при одних и тех же опухолях в среднем появляются раньше, чем у людей пожилого возраста. Это связывают с особенностями кровообращения и активностью иммунной системы.
Ускорить процесс метастазирования могут тепловые процедуры и физиопроцедуры на область локализации новообразования, а также несоблюдение правил абластики при удалении опухоли. Последний момент очень важен при хирургическом лечении рака, поэтому онкологические операции должны выполняться в специализированных стационарах, в которых есть определенные условия для проведения подобных вмешательств и квалифицированный персонал.
Пути распространения
Сначала поражаются регионарные лимфоузлы, т. е. те, которые расположены ближе всего к первичному опухолевому очагу. На какое-то время они сдерживают дальнейшее распространение, но злокачественные клетки прорываются через этот барьер и распространяются на отдаленные группы лимфоузлов. Там они также на какое-то время блокируются, но затем идут дальше, распространяясь по другим группам лимфатических узлов, внутренним органам и даже костям и костному мозгу.
На какие виды рака указывает наличие метастазов в лимфоузлах
Как мы уже говорили, в лимфоузлы чаще всего метастазируют опухоли эпителиального происхождения, т. е. карцинома. Саркомы (злокачественные опухоли из соединительной ткани) чаще метастазируют гематогенным путем, т. е. с током крови. Однако и лимфогенный путь также имеет место быть.
Также лимфоузлы поражаются при лейкозах (раке крови) и лимфомах (рак лимфатической системы). В последнем случае количество групп пораженных лимфоузлов играет решающее значение для определения стадии заболевания.
По локализации пораженных лимфоузлов можно судить о том, где находится первичная опухоль, лишь ориентировочно. Например, для рака головы и шеи характерны метастазы в шейных лимфоузлах , при раке молочной железы - поражение лимфоузлов в подмышечной области и возле ключицы.
Для точного определения вида опухоли потребуется гистологическое исследование измененных узлов. Только после этого можно говорить об определенном диагнозе. Но бывают случаи, когда имеются метастазы, в том числе и множественные, но первичный очаг выявить не удается даже с использованием самых современных методов исследования. В этом случае диагноз так и звучит — метастатическое поражение из невыясненного первичного источника.
Как проявляются метастазы в лимфоузлах
Главным клиническим симптомом метастатического поражения лимфоузлов является их увеличение. Это неспецифическое проявление, которое может развиваться при воспалительных заболеваниях, некоторых инфекциях, лимфоаденопатиях, аутоиммунных патологиях и др. Если лимфоузлы располагаются поверхностно, их можно пропальпировать. При раке они, как правило, имеют мягкую консистенцию. Например, при метастазах в лимфоузлах шеи симптомы выглядят именно так, как описано выше: лимфоузел увеличен, его можно прощупать, а если он достаточно большой - увидеть при осмотре.
Болят ли лимфоузлы при раке ? Как правило, сами по себе они на ощупь безболезненные. Если происходит увеличение глубоко расположенных лимфоузлов, они могут сдавливать внутренние органы, нарушать их работу и вызывать боль. Симптоматика в этом случае будет зависеть от локализации пораженных лимфоузлов. Узлы ворот печени могут сдавливать воротную вену, приводя к развитию портальной гипертензии. Поражение лимфоузлов брыжейки может вызвать нарушение работы кишечника, внутригрудных — одышку и нарушение работы сердца. Таким образом, однозначно ответить на вопрос о том, болят ли лимфоузлы при онкологии , нельзя. Это не тот симптом, на который стоит ориентироваться. Наличие болевых ощущений зависит от ряда факторов.
Диагностика метастатического поражения лимфоузлов
При обнаружении злокачественных опухолей обязательно проводится исследование регионарных и отдаленных лимфатических узлов. С этой целью применяются инструментальные и лабораторные методы:
- Ультразвуковое исследование.
- Компьютерная томография.
- Магнитно-резонансная томография.
- Контрастная лимфоангиография.
- Эндоскопические методы исследования — с помощью специальной оптической техники производится осмотр внутренних полостей и органов.
Многие пациенты спрашивают: « susp mts - что это ?». Данный медицинский термин расшифровывается довольно просто. Оба слова в нем - это сокращения: susp от латинского suspitio - подозрение на что либо, mts - от metastases. Таким образом, это подозрение на метастазы, например, в лимфатических узлах. Таким образом, когда врач произносит термин susp mts , это означает, что ситуация неясная. А для того чтобы точно установить, имеются ли метастатические очаги, нужно провести обследование.
Одним из самых перспективных методов обнаружения метастазов является ПЭТ-КТ. В основе метода лежит внутривенное введение короткоживущих изотопов, которые сильнее всего накапливаются в зонах активного метаболизма, коими являются злокачественные новообразования. Таким способом можно диагностировать даже микрометастазы размером всего несколько миллиметров, которые невозможно детектировать другими методами исследования. ПЭТ позволяет обнаруживать опухолевые очаги даже в труднодоступных для других методах диагностики местах, например, метастазы в забрюшинные лимфоузлы , в лимфоузлы брюшной полости.
Показывает ли КТ метастазы в лимфоузлах ? Да, опухолевые очаги могут быть видны на снимках. Но их не всегда удается отличить от неизмененной нормальной ткани. Всё же для достоверного подтверждения метастатического процесса в лимфоузлах золотым стандартом является ПЭТ-КТ.
После обнаружения подозрительных лимфоузлов, их пунктируют или проводят биопсию. Полученный материал отправляют в лабораторию на гистологическое или цитологическое исследование. Только после лабораторного подтверждения можно достоверно говорить о наличии метастазов.
Как лечат метастазы в лимфоузлах
Тактика лечения метастазов выбирается индивидуально, с учетом следующих аспектов:
- Органная принадлежность новообразования и ее гистологический вариант.
- Молекулярно-генетические особенности рака.
- Чувствительность к тому или иному методу лечения.
- Количество метастазов, их локализация и размеры.
- Общее состояние больного.
В качестве лечения могут применяться как стандартные противоопухолевые методы, так и самые современные разработки:
- Химиотерапия.
- Радиотерапия.
- Хирургические лечение.
- Таргетная терапия.
- Иммунотерапия.
- Гормонотерапия.
Хирургическое удаление лимфатических узлов называется лимфаденэктомией. Такие операции могут проводиться превентивно, при первичном удалении опухоли с высоким риском распространения по лимфатической системе, например, при раке яичников. В других случаях лимфоузлы удаляются после подтверждения их метастатического поражения. Например, проводят биопсию сторожевого лимфоузла, и если результат положительный, проводят лимфаденэктомию.
Помогает ли химиотерапия при метастазах в лимфоузлах ? В целом да, это один из методов лечения злокачественных опухолей, распространившихся в лимфатические узлы. Химиопрепараты оказывают системное влияние на организм и повсеместно уничтожают раковые клетки, даже в случае микрометастазов, которые невозможно выявить имеющимися на сегодняшний день методами диагностики. Химиотерапия может быть назначена как самостоятельное лечение, так и в дополнение хирургическим операциям или лучевой терапии.
Следует отметить, что опухоль представляет собой гетерогенную группу клеток с мутациями различного типа. Химиопрепараты уничтожают их основную массу, но какая-то часть из них выживает и приобретает устойчивость к терапии первой линии. Из-за этого развивается рецидив или прогрессирование заболевания. В таком случае переходят к терапии второй и последующих линий, которые помимо цитостатиков могут содержать таргетные препараты (моноклональные антитела) и др. Они более прицельно действуют на молекулярные механизмы онкогенеза и если не приводят к выздоровлению, то на какое-то время сдерживают прогрессирование опухоли.

Некоторые злокачественные новообразования чувствительны к действию гормонов, которые в свою очередь стимулируют их рост и размножение. Если подавить этот механизм, опухоль не сможет активно развиваться, что на некоторое время сдержит ее рост. К таким новообразованиями относятся многие виды рака молочной железы. Проведение антигормональной терапии хоть и не излечивает больных, но продляет им жизнь на годы, а в некоторых случаях даже на десятки лет.
Лучевая терапия назначается для удаления метастазов радиочувствительных опухолей. В некоторых случаях она может заменять хирургические операции без ухудшения качества лечения и соответственно прогноза заболевания.
Профилактика
Для рака с высоким риском лимфогенного метастазирования обязательно проводятся профилактические мероприятия. В одних случаях требуется превентивное удаление лимфоузлов, даже если нет данных за их поражение. В других — проводят их облучение. Также в большом количестве случаев назначается химиотерапия, которая призвана в максимальном объеме уничтожить распространившиеся по организму раковые клетки.
Если говорить о профилактике возникновения метастазов в лимфоузлах, то стоит отметить, что практически любая злокачественная опухоль рано или поздно метастазирует. Обнаружив у себя новообразование, необходимо незамедлительно обратиться за специальной помощью, а не заниматься самолечением, которое может лишь усугубить ситуацию и ухудшить прогноз.
Метастазы в кости
Метастазы в костях могут развиться абсолютно при любом злокачественном процессе, для некоторых раков это практически обязательная локализация, при других заболеваниях — редкость. В метастатическом рейтинге первое место по частоте встречаемости достанется метастазам в лёгкие, второе — печеночным очагам и третье — скелетным метастазам.
Метастазы в костях трудно лечатся и обещают боли, тем не менее, скелетные очаги менее прочих локализаций опухоли сокращают жизнь, но способны испортить её переломом или сдавлением спинного мозга.
Какими могут быть метастазы в костях?
По клинико-рентгенологическим признакам все костные очаги подразделяют на три группы:
- остеобластические — с преобладанием уплотнения сверх физиологической меры, но дополнительно наросшая опухолевая ткань не придаёт кости прочности и может сдавливать проходящие по соседству нервы;
- остеолитические — превалирует разрушение структуры и вероятность перелома увеличивается по мере разрастания рака;
- смешанные — сочетание двух видов и это ситуация встречается чаще всего.
Практически не случает такого, чтобы у пациента были исключительно остеолитические или только остебластические очаги, как правило, диагностируется сочетание с превалированием либо разреженной литической, либо избыточной бластической структуры.
При каких раках развиваются?
Лидер среди всех злокачественных процессов, протекающих с метастатическим поражением скелета, миеломная болезнь — разрушение кости начинается в самом начале заболевания и в 100% клинических случаев отмечается множественная деструкция костной ткани.
При раке молочной и предстательной желёз у двух третей больных диагностируются скелетные метастазы, а патологоанатомические наблюдения выявляют вовлечение костей в злокачественный процесс практически у 90% пациентов. При раке молочной железы (РМЖ) превалируют смешанные и остеолитические варианты, при раке простаты — остеобластические.
Высокая частота метастазирования в кости отмечается при раке легкого, но при мелкоклеточном варианте — вдвое чаще и множественные костные дефекты, тогда как при немелкоклеточном — у 40% больных с тяготением к очагам единичным или солитарным, то есть единственному.
Каждый четвёртый, страдающий раком почки, имеет скелетные метастазы, при карциноме мочевого пузыря костные новообразования встречаются много реже.
При раке толстой кишки костное метастазирование выявляется у каждого восьмого больного, при раке желудка — не часто, поскольку раньше и обильнее рак поражает печень и брюшную полость. Рак кишечника тяготеет к мелкоочаговым и множественным вторичным образованиям.
Когда появляются скелетные метастазы?
При злокачественных процессах время появления метастазов в кости различается, тогда как скорость роста очага зависит исключительно от индивидуальных биологических характеристик опухолевой ткани, меняющихся под воздействием лечения и по мере раковой диссеминации.
При первичном обращении костные очаги при отсутствии других проявлений ракового процесса имеются едва ли у 20% пациентов, в подавляющем большинстве случаев опухолевое поражение костей признак диссеминации рака — распространения по системам или генерализации. При РМЖ, немелкоклеточной карциноме легких и раке толстой кишки именно так и происходит.
При раке предстательной железы нередко скелетная патология обнаруживается одновременно с опухолью простаты или в ближайшие сроки после диагностики неблагополучия в половой железе.
При карциноме почки часто сначала находят метастазы в костях и легочной ткани, а после обнаруживается первичная опухоль.
Какие отделы скелета поражаются чаще всего?
Локализация метастаза в кости определяется не нозологической принадлежностью первичной злокачественной опухоли, а функциональной нагрузкой и связанной с нею развитостью кровоснабжения. Множественные очаги в скелете более характерны для высоко агрессивного рака, единичные и тем более один метастаз свидетельствует в пользу благоприятного прогноза заболевания.
- Чаще всего вторичные отсевы рака возникают в обильно питаемых кровью губчатых костях — позвонках, причём преимущественно в испытывающих высокую нагрузку поясничных и грудных отделах позвоночника.
- Далее по частоте следуют метастазы в костях таза — почти половина всех случаев, типичные локализации — подвздошная и лонные кости.
- Вполовину реже отмечается метастазирование в костях черепа и нижней конечности, где превалирует поражение бедренной кости.
- Грудная клетка, преимущественно ребра и грудина, вовлекаются в злокачественный процесс практически в 30% случаев.
Клинические проявления костного метастазирования
Вопреки сложившимся мифам, скелетное метастазирование часто протекает без выраженной боли и даже вовсе без симптомов. Остеобластические очаги реже сопровождаются болевыми ощущениями, нежели остеолитические.
Опасные проявления метастатического костного поражения:
- гиперкальциемия — значительное повышение концентрации кальция из-за разрушения костного матрикса приводит к тяжелейшему состоянию, требующему коррекции метаболизма фактически реанимационными мерами;
- перелом — для возникновения достаточно разрушения половины поперечника кости или позвонка, каждому одиннадцатому пациенту с патологическим переломом необходима срочная хирургическая помощь;
- синдром сдавления или компрессии спинного мозга осколками сломанного грудного или поясничного позвонка осложняется тяжелыми неврологическими нарушениями ниже зоны повреждения;
- нарушение двигательной активности вплоть до паралича возможно при сдавлении спинного мозга в шейном отделе остеобластическим очагом или повреждении отломками при литическом разрушении.
Осложнения метастазирования в кости фатально отражаются на состоянии пациента и активно мешают проведению адекватного лечения, что может сократить срок жизни при безусловном отсутствии качества.
Почему возникает боль?
Боль обусловлена тремя причинами:
- разрушением раковым конгломератом обильно иннервированной надкостницы;
- раздражением в надкостнице болевых рецепторов биологически активными продуктами жизнедеятельности раковых клеток;
- вовлечением в метастатический узел нервных окончаний мышц.
Невыносимая боль далеко не всегда связана со скелетным метастазированием, как правило, это следствие высокой агрессивности опухолевых клеток в терминальной стадии процесса, когда в крови огромна концентрация биологически активных веществ — цитокинов, которые буквально «жгут» нервные окончания даже не поражённых опухолью тканей.
При высокой степени злокачественности первичной опухоли болевой синдром отмечается чаще и более интенсивный. Наиболее наглядный пример, распространенные и постоянные боли в абсолютно целых костях при аденокарциноме легкого, операция с удалением пораженного легкого полностью излечивает боль.
Как обнаруживают метастазы в кости?
Диагностика скелетных повреждений не сложная, но высокотехнологичная, начинают с изотопного обследования — остеосцинтиграфии, выявляющей минимальные раковые новообразования. Затем засвеченные изотопом «горячие очаги» подвергают рентгенографии или, что лучше, компьютерной томографии (КТ). ПЭТ — «королева» доказательств, к сожалению, дорогое исследование, поэтому для контроля эффективности терапии не очень подходит.
Для выявления очагов в скелете маркеры костной резорбции не подходят, в практической онкологии активного применения не нашли.
Анализы крови позволяют заподозрить опухолевое поражение костного мозга, что часто сопровождает метастазирование в грудину.
Лечение скелетных поражений
Можно ли вылечить метастазы в костях? Однозначно лечением можно продлить жизнь при хорошем самочувствии. С одной стороны, скелетные поражения — манифестация распространения рака по организму, с другой — признак относительно благоприятного прогноза заболевания при отсутствии опухоли в других тканях и висцеральных (внутренних) органах, что даёт годы жизни при стабилизации процесса.
На этапе костного метастазирования вопрос о радикальном лечении уже не стоит, но операция не исключается при благоприятной гистологической структуре и солитарном — единственном костном поражении. Так при раке легкого или почки с метастазом в плечевую кость или бедро можно выполнить одномоментное вмешательство с удалением больного органа и резекцией кости с протезированием, но после нескольких месяцев химиотерапии.
Химиотерапия — главный метод лечения костных поражений, лекарственная схема определяется первичной опухолью. При раке молочной и предстательной железы хорошие результаты демонстрирует гормональная терапия.
Дополнение химиотерапии локальным облучением позволяет повысить общий результат терапии, снять боль и уменьшить вероятность перелома. Так при поражении шейных позвонков лучевая терапия обязательна уже на первом этапе.
Операция необходима при угрозе сдавления (компрессии) спинного мозга поломанным позвонком, как правило, удаляется поражённая часть позвонка — ламинэктомия. При длительной — более полугода стабилизации в результате химиотерапии можно поставить вопрос об удалении поражённой кости конечности с заменой на протез, если больше нет других проявлений рака.
Зачем нужны бисфосфонаты?
Использование бисфосфонатов при метастатическом поражении скелета стало стандартом адекватной терапии.
Человеческие кости постоянно обновляются: остекласты разрушают, а остеобласты наращивают ткани, в норме процессы уравновешены, в присутствии злокачественной опухоли остеокласты приобретают избыточную активность. Бисфосфонаты по своему строению схожи с костным матриксом, поэтому после введения в организм направляются в кости, где губительно действуют на активизированные раковыми продуктами остеокласты, параллельно снимая боль и оберегая от переломов.
Бисфосфонатами можно лечиться около двух лет, при утрате чувствительности к ним аналогичную роль выполняет моноклональное тело деносумаб. Демосумаб и бисфосфонаты относят к остеомодифицирующим агентам (ОМА).
Для назначения ОМА недостаточно выявления «горячих» очагов при остеосцинтиграфии, их применяют при доказанном рентгенологическими методами опухолевом поражении.
Химиотерапия и ОМА — основные методы лечения скелетных поражений, но не единственные. Лечение костных метастазов должно быть комплексным, только комбинацией облучения и лекарств, с коррекцией метаболизма и присоединением паллиативной хирургии можно избавить от боли и вернуть пациенту активную жизнь.
Когда и что нужно и возможно в каждом конкретном клиническом случае онкологического заболевания знают специалисты нашей клиники. Узнайте больше, звоните:
Читайте также:
