Примеры медуллоэпителиомы цилиарного тела, симулирующей персистирующее гиперпластическое первичное стекловидное тело
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Несмотря на достаточно активное применение ИАГ-лазерной витреальной хирургии у взрослых пациентов, у детей она практически не используется. В тоже время у детей встречается патология стекловидного тела, потенциально перспективная для лазерной хирургии - изменения стекловидного тела могут быть проявлением врожденного синдрома первичного персистирующего гиперпластического стекловидного тела, ретинопатии недоношенных, исходов травм, операций и увеитов. Помутнения и швартообразование стекловидного тела снижают остроту зрения и часто носят тракционный характер, что может вести к отслойке сетчатки, цилиарного тела, развитию субатрофии глаза. В лекции представлены основные виды патологии стекловидного тела при синдромах, врожденных и системных заболеваниях у детей, возможности инструментальной и лазерной витреальной хирургии у детей. Поиск литературы для составления лекции/обзора проводился по базе данных Medline и РИНЦ.
Ключевые слова
Полный текст
Об авторах
Роман Владимирович Калиниченко
Н. Н Арестова
105062, Москва, РФ
Н. С Егиян
Список литературы
© ООО "Эко-Вектор", 2018
Примеры медуллоэпителиомы цилиарного тела, симулирующей персистирующее гиперпластическое первичное стекловидное тело
ФГБНУ «Научно-исследовательский институт глазных болезней»
Персистирующая артерия стекловидного тела у взрослого (клиническое наблюдение)
Журнал: Вестник офтальмологии. 2020;136(4): 214‑218
В статье представлен клинический случай функционирующей фетальной артерии стекловидного тела у пациентки 69 лет. Результаты оптической когерентной томографии с функцией ангиографии свидетельствуют о наличии кровотока в проекции персистирующей гиалоидной артерии (ПГА) на поперечных срезах изображения и на снимках en-face. При биомикроскопии переднего отрезка глаза визуализировано сосудистое русло ПГА, распространяющееся по задней поверхности хрусталика в виде отдельных веточек. Уникальность данного клинического случая обусловлена малой вероятностью подобных находок у лиц пожилого возраста. Наличие у пациентки прогрессирующей катаракты указывает на необходимость индивидуального подхода при определении тактики лечения. На наш взгляд, последовательное использование технологий лазерной коагуляции и лазерной фотодеструкции ПГА позволит минимизировать риск развития гемофтальма и тракционной отслойки сетчатки во время предстоящей операции по поводу катаракты.
Дата принятия в печать:
Диагностика синдрома ППГСТ и ПГА в раннем детском возрасте не вызывает больших затруднений. Данные научной литературы о диагностике ПГА и методах выявления в ней фетального кровотока свидетельствуют об использовании таких методов, как фотографирование глазного дна, флюоресцеиновая ангиография, оптическая когерентная томография (ОКТ) и ультразвуковая допплерография [6—10]. Впервые использование метода ОКТ с функцией ангиографии (ОКТА) в диагностике ПГА продемонстрировано в работе H. Jeon и соавторов в 2019 г., в которой описаны результаты обследования молодого пациента. Выявлено наличие кровотока только в проекции Бергмейстерова сосочка, в ПГА кровоток отсутствовал, что, по мнению авторов, связано с техническими ограничениями метода [11]. Действительно, ОКТА характеризуется низким аксиальным разрешением, что обусловливает трудность дифференцировки кровотока в центральных отделах стекловидного тела. Чаще всего кровоток удается зарегистрировать только на уровне Бергмейстерова сосочка, который состоит в основном из глиальной ткани и не имеет нормального кровотока, однако этот факт вовсе не исключает наличие проходимости в проксимальной части ПГА [8]. Целесообразность и сроки проведения вмешательства (хирургического, лазерного, комбинированного) при ППГСТ и ПГА зависят от риска формирования вторичных осложнений, таких как гемофтальм, обскурационная амблиопия, косоглазие, тракционная отслойка сетчатки [12]. Имеются работы, в которых приводятся случаи разрывов ПГА с гемофтальмом на фоне задней отслойки стекловидного тела (ЗОСТ) или ее угрозе в условиях тракции СТ в области диска зрительного нерва (ДЗН), особенно в глазах с осевой миопией или артифакией у детей, подростков и людей молодого возраста [6—8, 11]. Вопрос возможного присутствия ПГА в КК у взрослых старшего поколения до настоящего времени обсуждается. В доступных источниках встречаются единичные работы, демонстрирующие очень редкие случаи, связанные с ПГА во взрослом возрасте, в частности, у пациентки 52 лет с гемофтальмом [9].
В настоящей работе представлен клинический случай ранее не выявленной ПГА у пациентки А. 69 лет. Пациентка обратилась в ФГБНУ «НИИГБ» с жалобами на снижение зрения. Левый глаз (OS) видит хуже правого глаза (OD) с детства. Более ранние визиты пациентки к офтальмологам ограничивались только подбором очков. При рефрактометрии выявлено наличие в OD простого гиперметропического астигматизма ст. 1,0d., в OS — смешанного астигматизма ст. 2,5d с превалированием миопического компонента. Максимальная острота зрения с коррекцией правого глаза равнялась 0,7, левого — 0,2. Проведение биомикроскопии выявило признаки незрелой катаракты в виде умеренных помутнений в ядре и кортикальных слоях хрусталика обоих глаз. Изменения в хрусталике OS не ограничивались возрастной катарактой. Так, на ЗКХ в парацентральной зоне и несколько назальнее отчетливо определялась так называемая точка Миттенфорда — участок фиброзных изменений с кальцификатами, от которого в СТ отходит тонкий тяж — КК, идущий по направлению к заднему отрезку глаза (рис. 1). Обнаружены фиброзные помутнения на поверхности ЗКХ диаметром до 2—2,5 мм. Их интенсивность в центре значительная, по периферии — менее выраженная, в виде полупрозрачного ободка. Определялось, но неотчетливо, сосудистое русло фетальной артерии, распространяющееся по задней поверхности хрусталика в виде отдельных веточек с красноватым оттенком (рис. 2). Последнее с большой долей вероятности указывало на наличие остаточного кровотока в русле ПГА. Результаты офтальмоскопии подтвердили S-образную, несколько вытянутую форму (рис. 3) и классический тип прикрепления КК к ДЗН (с назальной стороны). Кроме этого, отмечено Y-образное расширение КК в зонах его контакта с ЗКХ и ДЗН.
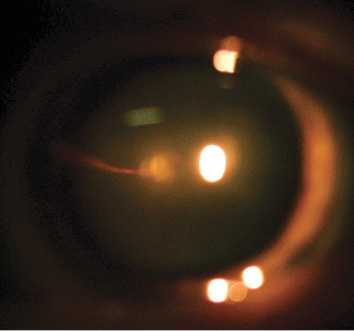
Рис. 1. Биомикроскопическая картина в области прикрепления Клокетова канала к задней капсуле хрусталика.
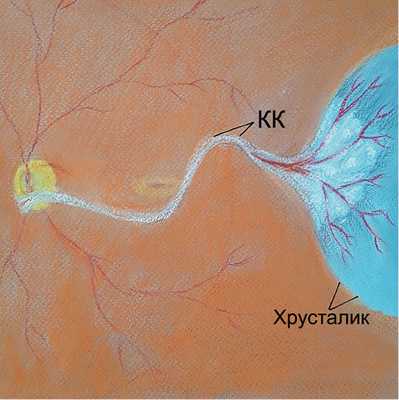
Рис. 2. Схематическое изображение фетальной сосудистой сети на поверхности задней капсулы хрусталика.
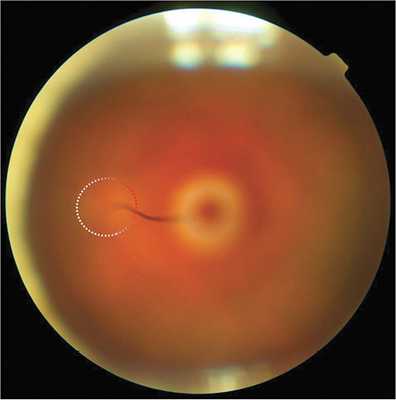
Рис. 3. Офтальмоскопическая картина: S-образный ход Клокетова канала и его Y-образное прикрепление к диску зрительного нерва.
При ультразвуковом сканировании (Voluson E8 GE, США) в B-режиме с исследованием полости стекловидного тела в различных пространственных плоскостях определялся достаточно тонкий гиперэхогенный тяж (КК) неравномерной толщины (до 1,5 мм). Отмечено, что тяж имеет плавный изгиб и берет начало от заднего полюса в проекции ДЗН, после чего, распространяясь кпереди, прикрепляется к ЗКХ с назальной стороны. В режиме цветного допплеровского картирования явных акустических признаков потоков крови в КК не было.
На поперечных срезах изображения перипапиллярной области, полученных методом ОКТА (SPECTRALIS HRA+OCT с модулем ОКТ-ангиографии, Heidelberg Engineering, Германия), отчетливо визуализировался кровоток от ретинальных и хориоидальных сосудов, а также отмечен сигнал средней рефлективности от тяжа (КК) соответственно локализации ПГА в заднем отделе стекловидного тела (рис. 4, а). Можно было бы предположить, что имеет место артефакт изображения, но присутствие кровотока подтверждалось наличием гиперрефлективного локуса в той же проекции на en-face снимках (рис. 4, б). В области сосочка Бергмейстера активный кровоток не определялся. Кроме того, проведение исследования позволило выявить наличие задней тракционной отслойки СТ и элевацию ретинального контура в зоне сосочка Бергмейстера.
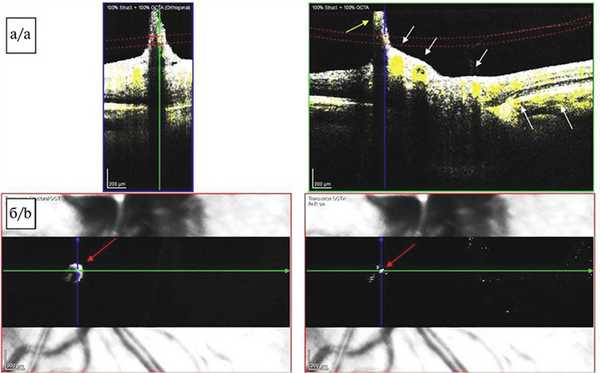
Рис. 4. Картина оптической когерентной томографии-ангиографии.
а — томограмма диска зрительного нерва, поперечный срез, сегментация на уровне заднего отдела стекловидного тела. Визуализируется сигнал кровотока от ретинальных и хориоидальных сосудов (белые стрелки), а также слабый сигнал кровотока от персистирующей гиалоидной артерии (желтая стрелка). В области сосочка Бергмейстера активный кровоток не выявлен; б — томограмма диска зрительного нерва, изображение en-face, проекция нижненазального сектора перипапиллярной области. Визуализируется гиперрефлективный участок, соответствующий сигналу кровотока в сосуде гиалоидного канала (красные стрелки).
Таким образом, указанные изменения, характеризующиеся признаками васкуляризации на поверхности ЗКХ с помутнениями и наличием кровотока в ПГА со стороны сетчатки, укладываются в клиническую картину смешанной формы синдрома ППГСТ, т.е. сочетающую в себе признаки передней и задней его форм. Если пользоваться рабочей классификацией синдрома ППГСТ у детей, предложенной Т.В. Судовской [13], рассматриваемые изменения по выраженности клинических проявлений могут соответствовать II степени из четырех возможных.
Заключение
Уникальность данного клинического случая обусловлена невысокой вероятностью подобных находок у лиц пожилого возраста, а также потенциальной информативностью оптической когерентной томографии-ангиографии в определении функционирования персистирующей гиалоидной артерии.
Наличие персистирующей гиалоидной артерии у пациентки 69 лет с прогрессирующей катарактой указывает на необходимость индивидуального подхода при определении тактики лечения. На наш взгляд, оправдано использование комбинированной лазерной хирургии, которая должна предшествовать операции по поводу катаракты. Последовательное применение технологий лазерной коагуляции и лазерной фотодеструкции фетального сосуда позволит минимизировать риск развития гемофтальма и тракционной отслойки сетчатки во время хирургии катаракты.
Участие авторов:
Концепция и дизайн исследования: Гамидов А.А., Макашова Н.В.
Сбор и обработка материала: Гамидов А.А., Дуржинская М.Х., Сакалова Е.Д., Велиева И.А.
Синдром первичного персистирующего гиперпластического стекловидного тела
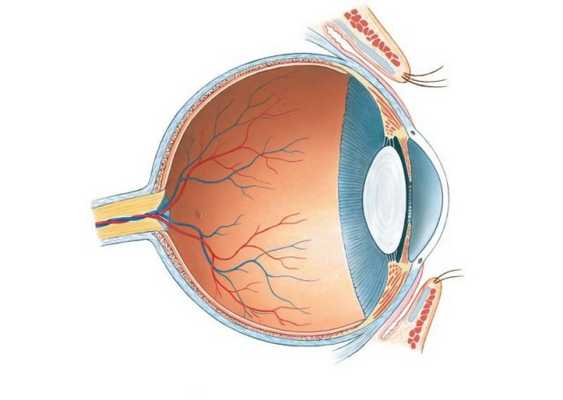
Аномалии сосудистой оболочки при односторонних врожденных катаракт (ОВК) включают: колобомы радужки, хориоидеи, поликорию, смещение зрачка. Этим аномалиям почти всегда сопутствует гипоплазия радужки, ригидность зрачка, дисгенез радужки и роговицы.
ОВК часто сочетаются с различными аномалиями стекловидного тела —помутнение, фиброз, остатки гиалоидной артерии, первичное персистирующее гиперпластическое стекловидное тело (ППГСТ).
Синдром ППГСТ относится к редко встречающимся врожденным аномалиям органа зрения. Его рассматривают как результат аномального развития стекловидного тела, связанный с гиперплазией мезодермальных элементов первичной гиалоидной артерии стекловидого тела. Этиопатогенетически — это патология эмбриогенеза, нередко вследствие внутриутробно перенесенной герпетической инфекции.
Персистирутощая гиалоидная система представляет собой папиллярные и препапиллярные мембраны, которые могут иметь вид массивной соединительнотканной пленки или тонких тяжей, идущих от диска зрительного нерва в стекловидное тело.
В основе синдрома лежит задержка обратного развития гиалоидной артерии и образованной ее ветвями, а также другими собственными сосудами стекловидного тела и передними цилиарными сосудами эмбриональной сосудистой оболочки хрусталика.
Впервые синдром ППГСТ описал Е.Т. Collins еще в 1908 году.
В 1949 году A. Reese представил клиническую картину синдрома ППГСТ после проведенного патогистологического исследования глаз, ошибочно энуклеированных по поводу ретинобластомы. Диагноз новообразования не был подтвержден, гистологическая картина препарата характеризовалась плотной фиброзной тканью в виде тяжа, идущего от задней поверхности хрусталика в стекловидное тело. Наряду с тяжом присутствовала персистирующая к диску зрительного нерва a. hyaloidea, цилиарные отростки были резко удлинены.
Более подробную клиническую картину классического синдрома ППГСТ представил ряд современных авторов.
Синдром ППГСТ характеризуется следующими признаками: односторонний микрофтальм, лейкокория, ретролентальная фиброваскулярная мембрана, удлинение цилиарных отростков, задняя полярная катаракта, пролиферация кровеносных сосудов в строме радужки, смещение кпереди иридо-хрусталиковой диафрагмы. Иногда она соприкасается или сращена с роговицей, вызывая ее выраженные помутнения и рубцы в центральной зоне.
Отмечается мелкая передняя камера, угол передней камеры в большинстве случаев узкий, что часто осложняется вторичной глаукомой.
Фиброзная шварта, находящаяся за хрусталиком, может быть различной распространенности. Наибольшее ее утолщение и выраженная васкуляризация наблюдается у заднего полюса хрусталика. Со швартой сохраняется а. hyaloidea, которая клинически не всегда видна, чаще в виде отдельной ветви подходит к хрусталику и вплетается в его капсулу более мелкими разветвлениями.
Выраженность клинических проявлений синдрома ПГПСТ разнообразна, может затрагивать передние и задние отделы глазного яблока — роговицу, переднюю камеру, хрусталик, стекловидное тело, зрительный нерв, сетчатку. Синдром часто сопровождается осложнениями (вторичная глаукома, витреоретинальная тракция, отслойка сетчатки, кровоизлияния в сетчатку и стекловидное тело), другими врожденными дефектами развития.
Описаны случаи сочетания синдрома с мегалокорнеа, врожденной глаукомой, колобомой хрусталика и зрительного нерва, с синдромом «утреннего сияния», с ретинопатией недоношенных, с врожденной миопией высокой степени, ретинитом Коатса, синдромом Ригера. Часто наблюдается и сопутствующая патология — косоглазие, нистагм. У большинства пациентов отмечали низкую остроту зрения, микрокорнеа, центральные помутнения роговицы, при гониоскопии — узкий угол передней камеры, задний эмбриотоксон, склерокорнеа, иногда — остатки сосудистой сумки хрусталика, подвывих хрусталика, в некоторых случаях хрусталик был прозрачным.
По мнению А.В. Хватовой (1982), хрусталик первоначально при рождении ребенка чаще прозрачный, впоследствии развивается катаракта, которую считают не врожденной, а расценивают как раннее осложнения синдрома ППГСТ. Хрусталик в микрофтальмичных глазах обычно уменьшен в размерах. Передняя капсула хрусталика интактна, задняя капсула чаще фиброзно изменена.
Эта патология обычно односторонняя, встречается у детей нормального гестационного возраста, не получавших оксигенотерапию после рождения.
Синдром ППГСТ относится к псевдобластомам или лейкокориям, его также обозначают термином «tunica vasculosa lentis». При мидриазе обнаруживается важный клинический признак — цилиарные отростки, вытянутые по направлению к шварте. В дальнейшем вследствие сморщивания шварты отростки вытягиваются еще больше, хрусталик мутнеет и набухает до такой степени, что достигает роговицы, которая также активно мутнеет. Передняя камера уплощается, развивается вторичная глаукома, что ведет к буфтальму, либо к атрофии глазного яблока. Однако своевременная экстракция катаракты и рассечение находящейся за пей шварты сохраняет глаз.
М.Д. Агатова (1989) также отмечала различные аномалии при этой врожденной патологии — гониодисгенез, неполное расщепление угла передней камеры (иридо-корнеальные и корнео-лентикулярные сращения), персистирующие эмбриональные структуры на поверхности радужки и в области зрачка.
Синдрому ПГПСТ нередко сопутствуют и системные аномалии: арахноидальные кисты, синдактилия, микроцефалия, аномалии сердца, патология легких и селезенки, гемипарезы, атаксии, гипотонии, спастические тетраплегии.
В литературе описан редкий случай сочетания синдрома ПГПСТ с туберозным склерозом, когда наряду с фиброваскулярной тканью стекловидного тела в сетчатке имеются опухолеподобные образования — гамартомы сетчатки.
Согласно проведенным генетическим исследованиям, в 2001 году была установлена локализация синдрома в локусе хромосомы 10q 11 — q 21, что свидетельствует в пользу врожденной аномалии развития и патологии эмбриогенеза.
Синдром ПГПСТ имеет определенное дифференциально-диагностическое значение, так как ошибочно установленный диагноз ретинобластомы может привести к неоправданной энуклеации глаза. Кроме ретинобластомы синдром ППГСТ необходимо также дифференцировать с псевдоглиомой и ретинопатией недоношенных. От ретинопатии недоношенных синдром ПГПСТ отличает нормальный вес ребенка и нормальные сроки гестации. Правильной постановке диагноза помогает метод эхографии.
Удаление катаракты при синдроме ППГСТ характеризуется нередкими осложнениями, как во время операции, так и в послеоперационном периоде (гифема, гемофтальм, заращение зрачка, вторичная глаукома, отслойка сетчатки). Осложнения обусловлены большим объемом оперативного вмешательства — удаление хрусталика, ретрохрусталиковой мембраны, персистирующего тяжа, коагуляция сосудов, разделение сращений между цилиарными отростками и капсулой хрусталика, передних и задних синехий.
В этом разделе мы публикуем статьи и материалы по медицинской тематике, присланные нашими читателями.
Если у вас есть что-то интересное, чем бы вы хотели поделиться с другими людьми, мы будем рады разместить вашу статью на нашем сайте.
Внимание!
В случае, если присланный вами материал не соответствует тематике сайта, он не будет опубликован без объяснения причины отказа в публикации. Если в вашей статье имеются ссылки, или статьи будут носить рекламный характер, то Вам сюда.
Защита авторских прав!
Присланный вами материал не должен нарушать авторских прав. Если это ваш материал, укажите ваше имя, и оно будет опубликовано в статье. В случае, если вы являетесь правообладателем и заметили, что размещенный на сайте материал нарушает ваши авторские права, напишите нам, этот материал будет немедленно удален с сайта. В письме приложите доказательства того, что вы являетесь автором материала или правообладателем.
По вопросам размещения пишите письма на email — [email protected]
ФГБУ «Московский НИИ глазных болезней им. Гельмгольца» Минздрава России, Москва
ФГБУ "Московский НИИ глазных болезней им. Гельмгольца" Минздрава России
ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России, Москва, Россия
ФГБУ «Московский НИИ глазных болезней им. Гельмгольца» Минздрава России, ул. Садовая-Черногрязская, 14/19, Москва, 105062, Российская Федерация
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН, 115478 Москва, Каширское шоссе, д. 23
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России, Каширское ш., 23, Москва, 115478, Российская Федерация
. Злокачественная медуллоэпителиома, симулирующая ретинобластому — клинико-гистологический анализ случая и опыт получения клеточной культуры
Журнал: Вестник офтальмологии. 2016;132(6): 64‑69
В работе представлен клинико-морфологический анализ случая первичной внутриглазной злокачественной медуллоэпителиомы редкой локализации — центрального отдела сетчатки с вовлечением диска зрительного нерва, — симулирующей ретинобластому, у ребенка 2 лет. Подробно приведены гистологические особенности опухоли (трубчатые и сетчатые структуры опухоли, розетки, ленточные образования, клетки с гиперхромными ядрами, клеточный полиморфизм). Описан единственный на сегодняшний день в Российской Федерации опыт создания первичной культуры внутриглазной злокачественной медуллоэпителиомы с последующей оценкой чувствительности (МТТ-тест) к четырем препаратам (оксалиплатин, иринотекан, ифосфамид, аскорбиновая кислота) в различных концентрациях. Из четырех исследованных препаратов IC50 (3,3 мг/мл) получена только для раствора аскорбиновой кислоты. Несмотря на относительную редкость первичной внутриглазной злокачественной медуллоэпителиомы, необходимо проводить дифференциальный диагноз с другими внутриглазными образованиями, прежде всего ретинобластомой. Полученные данные об эффективности раствора аскорбиновой кислоты в отношении клеток внутриглазной злокачественной медуллоэпителиомы могут быть использованы для дополнения существующих химиотерапевтических протоколов в детской нейро- и офтальмоонкологии.
Внутриглазная медуллоэпителиома (диктиома) — редкая врожденная эмбриональная опухоль, растущая из эпителия цилиарного тела, ресничной части сетчатки и зрительного нерва, которая встречается как у взрослых, так и у детей [1, 2]. Опухоль состоит из тубулярных структур, выстланных псевдомногослойным нейроэпителием. Данная опухоль чаще всего выявляется в первой декаде жизни. Диагностика медуллоэпителиомы не всегда очевидна. Эхографическая локализация зачастую затруднена в связи с плоскостным характером роста, что объясняет позднюю (послеоперационную) диагностику [3].
В литературе за последние 30 лет доступны лишь 10 работ, посвященных первичной внутриглазной медуллоэпителиоме диска зрительного нерва (ДЗН) [2, 4, 5]. В работе Pastora-Salvador и соавторов описан случай медуллоэпителиомы зрительного нерва у мальчика 12 лет. Пациенту провели локальную резекцию опухоли, при этом безрецидивный период наблюдения составил 25 лет [5].
Медуллоэпителиомы классифицируются на тератогенные и нетератогенные варианты, подразделяемые в свою очередь на доброкачественные и злокачественные типы. Основной признак нетератогенного типа опухолей — множественность слоев и полос низкодифференцированных нейроэпителиальных клеток, внешне схожих с эмбриональной сетчаткой или цилиарным эпителием [6].
Дифференциальный диагноз следует проводить с ретинобластомой и другими редкими внутриглазными опухолями, включая беспигментную меланому, шванному и аденокарциному ретинального пигментного эпителия, а также неопухолевыми процессами, такими как воспалительная гранулема [7, 8]. Несмотря на то что медуллоэпителиомы могут выглядеть в виде крупных нейробластных псевдорозеток, для них характерны трубчатые конгломераты клеток, а не рост в виде «перчаток» или «рукоятки», что типично для ретинобластом. Дифференциальными признаками могут служить также тесная взаимосвязь с подлежащими тканями и отсутствие псевдофоторецепторов, в отличие от розеток Флекснера—Винтерштайнера [6]. Иммуногистохимические исследования медуллоэпителиом с псевдорозетками Флекснера—Винтерштайнера выявляют положительный результат на нейронспецифичную енолазу и синаптофизин во всех случаях [6].
В некоторых случаях исход заболевания неблагоприятен. Такое развитие новообразования чаще всего связано с распространением за пределы глаза, но также описаны отдаленные метастазы в лимфатические узлы, околоушные железы, легкие и средостение [9]. Медуллобластома как примитивная нейроэктодермальная опухоль центральной нервной системы у детей поражает преимущественно мозжечок и встречается значительно чаще первичной опухоли внутри глаза [10]. На сегодняшний день доступны несколько химиотерапевтических протоколов для лечения данного заболевания [11]. Первичная внутриглазная медуллоэпителиома, несмотря на низкую частоту встречаемости, представляет интерес для офтальмологов в связи со сложностью ее дифференциальной диагностики с другими внутриглазными новообразованиями, а также единичными данными о возможном химиотерапевтическом лечении.
Цель настоящей работы — клинико-гистологический анализ случая злокачественной медуллоэпителиомы у ребенка, а также описание опыта получения клеточной культуры опухоли и проведения МТТ-теста.
Клинические данные. Мальчик в возрасте 2 лет и 3 мес поступил на обследование и лечение в стационар. Из анамнеза известно, что в возрасте 2 лет родители заметили изменение «окраски» зрачка левого глаза на фотографии, а через 2 мес обратились к врачу по месту жительства, диагноз — подозрение на ретинобластому группы D. До появления первых симптомов ребенка осматривали в 1 год и 7 мес, но без мидриаза. При поступлении острота зрения на левом глазу соответствовала правильной проекции света, передний отрезок глаза без изменений. На глазном дне, по данным осмотра на RetCam, — ДЗН и макула не определяются, прикрыты серо-белой опухолевой тканью с неровными границами и бугристой поверхностью (рис. 1). На правом глазу изменений не выявлено.
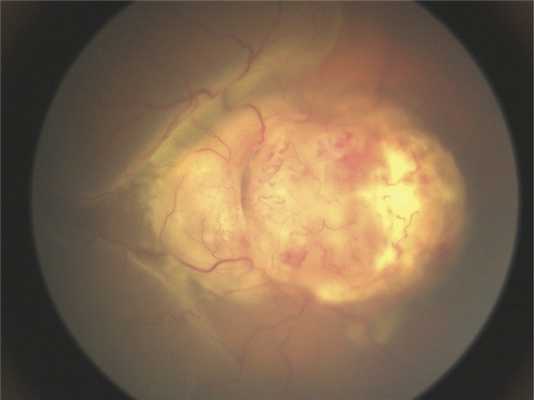
Рис. 1. Клиническая картина опухоли при осмотре на RetCam.
Согласно данным ультразвукового исследования, у заднего полюса выявлены плюс-ткань гетерогенной эхоструктуры с единичными кальцинатами, размером 6,4×13,3 мм, вторичная отслойка сетчатки (рис. 2). Учитывая локализацию опухоли (солитарный опухолевый узел, полностью перекрывающий ДЗН), отсутствие шансов на зрение, размеры образования и высокий риск экстрабульбарного распространения опухоли, выполнена энуклеация левого глаза с пластикой культи. После получения патогистологического заключения (злокачественная медуллоэпителиома) ребенок направлен на консультацию к детскому онкологу с целью возможного выявления новообразования в головном мозге. По данным магнитно-резонансной томографии, опухолевых очагов в ЦНС не выявлено, однако в связи с прорастанием опухоли за laminacribrosa пациенту назначен курс лучевой и химиотерапии (циклофосфан, вепезид, карбоплатин).
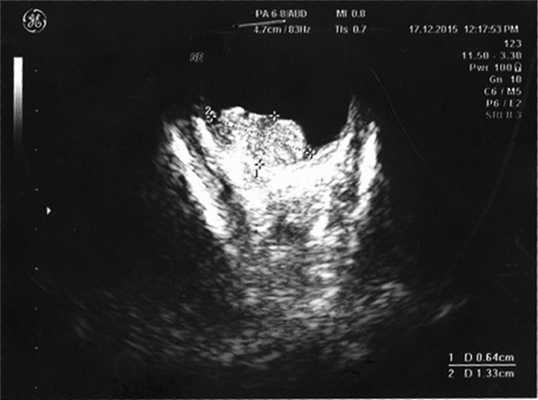
Рис. 2. Результат эхографии левого глаза у ребенка с подозрением на монокулярную форму ретинобластомы.
Патоморфологическое исследование. При морфологическом исследовании кусочка новообразования из боковой колодки выявлена опухоль, состоящая из кубических эпителиальных клеток, которые формировали единичные розетковидные структуры и небольшие участки солидного роста. Поставлен предварительный диагноз — недифференцированная ретинобластома без опухолевых комплексов в дистальном отрезке зрительного нерва. Далее при изучении срезов всего глазного яблока выявлен большой опухолевый узел в центральных отделах глазного дна, тесно связанный со зрительным нервом. Узел состоял преимущественно из трубчатых и сетчатых структур, розеток, ленточных образований, что придавало опухоли местами вид «кружева» (рис. 3).
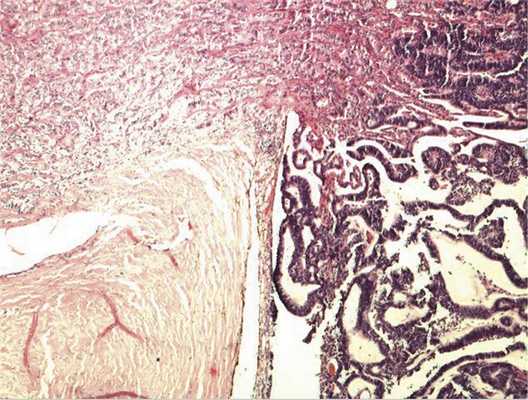
Рис. 3. Часть узла опухоли снаружи от ДЗН, имеющая вид «кружева». Окраска гематоксилином и эозином. Ув. 100.
Отмечалось наличие ленточных структур из низкодифференцированных эпителиальных клеток (рис. 4). Параллельно встречались участки солидного строения из клеток с гиперхромными ядрами с признаками клеточного и ядерного полиморфизма. В них почти исчезает строма, появляются митозы, встречаются участки дистрофии и некроза (рис. 5). Опухоль врастает в ткань ДЗН с переходом за laminacribrosa, но не достигает линии отсечения (рис. 6). В таком виде опухоль обладает местнодеструирующим характером роста и может давать метастазы, глубоко инфильтрируя прилежащую к ДЗН ткань хориоидеи. Окончательный гистологический диагноз: злокачественная медуллоэпителиома центрального отдела сетчатки с вовлечением ДЗН и инвазией перипапиллярной хориоидеи, с глубоким прорастанием по зрительному нерву, не достигая линии отсечения.
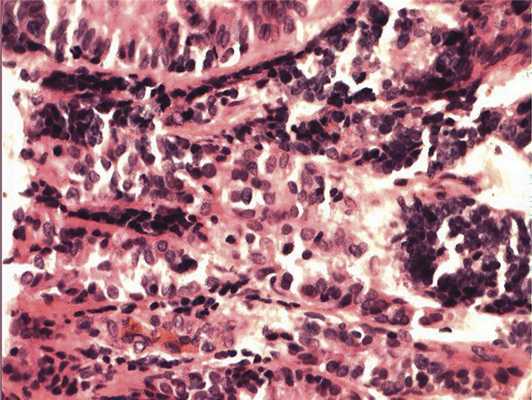
Рис. 4. Формирование полос из низкодифференцированных нейроэпителиальных клеток. Окраска гематоксилином и эозином. Ув. 400.
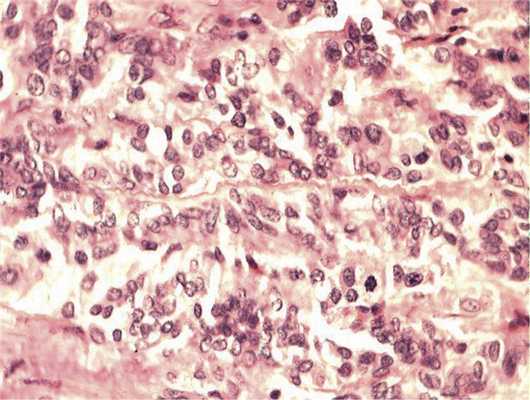
Рис. 5. Зоны солидного роста опухоли. Клеточный полиморфизм с фигурами митозов. Окраска гематоксилином и эозином. Ув. 400.
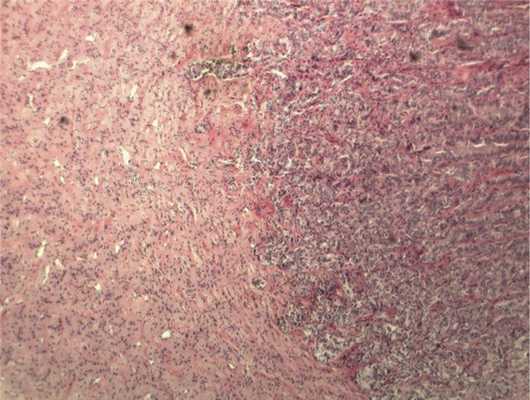
Рис. 6. Врастание опухоли в ткань ДЗН с ростом по ходу пучков нервных волокон. Окраска гематоксилином и эозином. Ув. 100.
Получение первичной культуры опухоли. После вскрытия глазного яблока взят образец опухолевой ткани для получения клеточной культуры с последующим исследованием лекарственной устойчивости (МТТ-тест). Опухолевый образец транспортировали в лабораторию генетики опухолевых клеток РОНЦ им. Н.Н. Блохина в течение 2—3 ч в бессывороточной среде RPMI («ПанЭко», Россия) с добавлением 100 мкг/мл гентамицина («Микроген», Россия). Далее полученную ткань обрабатывали механически (измельчали стерильными ножницами) и ферментативно (0,25% трипсин—0,04% ЭДТА; «ПанЭко», Россия) до получения клеточной суспензии, которую переносили в культуральные флаконы («Corning—Costar», США) со средой RPMI c добавлением 10% эмбриональной сыворотки коров («PAALaboratories», Австрия) и гентамицина 50 мкг/мл. Центрифугировали транспортировочную среду, полученный осадок клеток высевали на флаконы, которые помещали в термостат («Memmert», Германия) при температуре 37 °C и содержанием 5% СО2. Далее в течение 1 мес культивировали полученные клетки, по мере необходимости закисленную среду с погибшими клетками заменяли на новую питательную среду, при достижении клетками 60—80% уровня конфлюэнтности производили рассев клеток на новые культуральные флаконы. В течение культивирования клетки прошли 2—4 пассажа.
МТТ-тест. Метод основан на способности митохондриальных дегидрогеназ живых клеток метаболизировать желтый тетразол-реагент МТТ-3-(4,5-диметилтиазол-2)-2,5-дифенилтетразол-бромид в синий формазан. По интенсивности окраски конечного раствора судят о количестве живых клеток в лунке.
Клетки первичной культуры медуллоэпителиомы MB1 рассевали на 96-луночное плато по 1,5∙10 3 клеток в лунку в объеме 90 мкл культуральной среды RPMI. Препараты (иринотекан, ифосфамид, оксалиплатин и аскорбиновую кислоту) в объеме 10 мкл добавляли в различных концентрациях на следующий день. В контрольные лунки добавляли 10 мкл бессывороточной среды. Клетки культивировали в присутствии химиопрепаратов в течение 3 сут. Затем в лунки добавляли реагент МТТ в концентрации 5 мг/мл в объеме 20 мкл на лунку (рис. 7). Через 1,5—2 ч среду с реагентом удаляли и осадок растворяли в 60 мкл ДМСО. Уровень оптической плотности растворов в каждой лунке определяли с помощью спектрофотометра (планшетного ридера) Multiskan FC («ThermoScientific», EС) при длине волны 594 нм.

Рис. 7. 96-луночное плато с клетками первичной культуры злокачественной медуллоэпителиомы и исследуемыми препаратами.
Далее в «Программе для расчета IC50 химиотерапевтических веществ», написанной в лаборатории генетики опухолевых клеток, строили график зависимости уровня оптической плотности (проценты от контроля) от концентрации вещества и рассчитывали искомую концентрацию IC50 (полумаксимальное ингибирование). Использованы следующие химиопрепараты:
а) Иринотекан («Actavis», Исландия) в концентрациях 0,25; 0,5; 1,0 и 2,0 мг/мл;
б) Ифосфамид («Верофарм», Россия) в концентрациях 0,25; 0,5; 1,0 и 5,0 мг/мл;
в) Оксалиплатин («Medac», Германия) в концентрациях 0,1; 0,2; 0,38; 0,75 и 1,5 мг/мл;
г) Аскорбиновая кислота («Alvils», Россия—Китай) в концентрациях 0,6; 1,25; 2,5 и 5 мг/мл.
Результаты МТТ-теста представлены на рис. 8, а—г. Для аскорбиновой кислоты получена IC50 3,3 мг/мл. Результаты данного теста показывают, что с повышением концентрации препарата выживаемость клеток увеличивается.
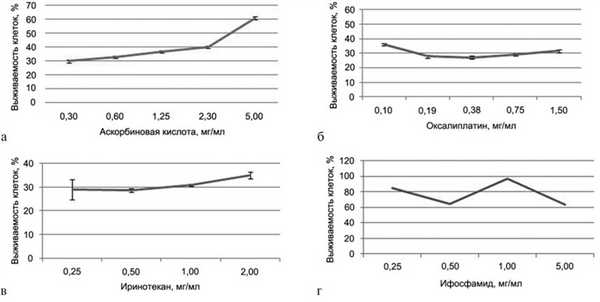
Рис. 8. IC50 (полумаксимальное ингибирование). а — для аскорбиновой кислоты; б — для оксалиплатина; в — для иринотекана; г — для ифосфамида.
IC50 для оксалиплатина, иринотекана и ифосфамида не получена. Для оксалиплатина при минимальной используемой концентрации 0,1 мг/мл выживаемость клеток составила 36%, для иринотекана при минимальной используемой концентрации 0,25 мг/мл — 29%, а для ифосфамида при максимальной используемой концентрации 5 мг/мл — 64%. Таким образом, из четырех исследованных препаратов IC50 (3,3 мг/мл) получена только для раствора аскорбиновой кислоты.
К настоящему времени патогномоничные симптомы, свидетельствующие о первичной внутриглазной злокачественной медуллоэпителиоме, не описаны, а диагноз ставится на основании патогистологического заключения. Вместе с тем ряд симптомов, включая наличие кальцификатов и нехарактерные рентгенографические признаки, затрудняют дифференциальную диагностику с другими внутриглазными опухолями детского возраста, прежде всего ретинобластомой. К характерным патоморфологическим особенностям ретинобластомы, отличающим ее от медуллоэпителиомы, относят наличие «истинных» розеток, состоящих из цилиндрической формы нейроэпителиальных клеток эмбрионального типа [12]. Для медуллоэпителиомы, напротив, характерно наличие псевдорозеток, располагающихся диффузно или вокруг сосудов [2]. Несмотря на относительную редкость опухоли, необходимо проводить дифференциальный диагноз с другими внутриглазными образованиями, особенно при наличии сопутствующих длительно существующих глазных симптомов. Полученные данные об эффективности раствора аскорбиновой кислоты в отношении клеток внутриглазной злокачественной медуллоэпителиомы могут быть использованы для дополнения существующих химиотерапевтических протоколов в детской нейро- и офтальмоонкологии. Клеточная культура медуллоэпителиомы и возможная животная модель опухоли являются потенциальными объектами для изучения как экспрессии генов, так и специфических мутаций в ткани опухоли, что в свою очередь представляет интерес в перспективе для селективной химиотерапии опухоли и сохранения глаза.
Врожденные аномалии развития стекловидного тела
Резюме: Патологические изменения, происходящие в стекловидном теле, можно разделить на приобретенные и врожденные. Первые встречаются значительно чаще, имеют большое клиническое значение и доминируют над врожденными по частоте заболеваемости. Врожденные аномалии встречаются в клинической практике офтальмолога многократно реже, вероятно поэтому данный вопрос мало освещён в общедоступной литературе.
Первичное персистирующее гиперпластическое стекловидное тело.
Во внутриутробном периоде через стекловидное тело проходят сосуды (гиалиноидная артерия и ее ветви), которые к моменту рождения ребенка подвергаются обратному развитию. В некоторых случаях по каким-либо причинам в стекловидном теле остаются мембраны, которые могут иметь вид тонких тяжей или массивной пленки. Обычно эти тяжи направлены от диска зрительного нерва вглубь стекловидного тела. Выделяют 4 степени заболевания в зависимости от степени выраженности персистирующих сосудов и пролиферации.
При патологоанатомическом исследовании: на продольном срезе глазного яблока виден сосудистый стебель, идущий от диска зрительного нерва через стекловидное тело к задней поверхности хрусталика и покрывающий ее. Характерными являются мелкая передняя камера и увеличенный хрусталик.
В зависимости от локализации фиброваскулярной ткани различают переднюю и заднюю формы заболевания.
В литературе отмечается необходимость раннего хирургического лечения первичного персистирующего гиперпластического стекловидного тела для предотвращения развития обскурационной амблиопии. Однако хирургическое вмешательство сопряжено с геморрагическими осложнениями. Для предотвращения геморрагических осложнений некоторые авторы предлагают ограничиться удалением врожденной катаракты и YAG-лазерным отсечением персистирующей гиалоидной артерии от задней капсулы хрусталика. Наличие плотной фиброваскулярной ретролентальной мембраны характеризует IV степень процесса и признаётся неоперабельной.
Персистенция гиалоидная артерия - врожденная патология глаза, связанная с нарушением регресса гиалоидной артерии стекловидного тела. Персистенция гиалоидной артерии наблюдается более чем у 3% здоровых доношенных младенцев. Она практически всегда обнаруживается на 30-й неделе внутриутробного развития и у недоношенных детей при скрининге с целью выявления ретинопатии недоношенных. В стекловидном теле виден бессосудистый тяж, который тянется к задней поверхности хрусталика. Это проявление персистирующего гиперпластического первичного стекловидного тела.
Кисты стекловидного тела могут быть как врожденными, так и приобретенными. Происхождение кист неизвестно, но так как внутри кисты иногда присутствуют кровеносные сосуды, предполагаются, что кисты могут брать начало от остатков гиалоидной артерии. Приобретенные кисты могут сочетаться с токсоплазмозом, токсокарозом, ювенильным ретиношизисом.
Синдром Патау. Причина возникновения заболевания - неправильное расхождение хромосом во время деления клеток у одного из родителей.
В результате этого в 13 паре хромосомного набора человека вместо двух хромосом образуются три, что и определяет весь спектр врожденных нарушений, также включающих глазные проявления.
Болезнь Норри — редко встречающаяся Х-сцепленная форма ретинальной дисплазии, характеризующаяся развитием двусторонней слепоты в раннем возрасте вследствие пролиферации недифференцированных сетчатки и стекловидного тела с формированием ретролентальных масс.
Заболевание впервые описано G. Nome (1927). В литературе описаны три случая значительного снижения зрения у женщин при болезни Норри. Определен отвечающий за болезнь Норри ген, кодирующий протеин с 133 аминокислотами. Характерна триада: потеря зрения, слуха и умственная отсталость.
Прогноз неблагоприятный. Эффективной терапии не существует. Возможно предупреждение рождения детей с болезнью Норри путем использования методов пренатальной диагностики при семейных случаях заболевания.
Возможно проведение энуклеации при наблюдающаяся в отдельных случаях боли в глазах.
Дифференциальный диагноз с ретинобластомой:
Болезнь Вагнера — редко встречающаяся витреоретинальная дистрофия с аутосомно-доминантным типом наследования, характеризующаяся прогрессирующими снижением остроты зрения и сужением поля зрения.
Наиболее постоянные симптомы заболевания: нитчатые помутнения и участки сгущения, располагающиеся за хрусталиком в кажущемся оптически пустым стекловидном теле. С течением времени зоны конденсации в стекловидном теле становятся тоньше и напоминают вуали. Мембранные структуры располагаются на периферии и вызывают тракции сетчатки. Нередко мембраны располагаются в области экватора в виде несколько искривленных полос, протяженность которых может достигать 360°.
При рождении ребенка глазное дно выглядит мозаичным с плохо отграниченными периферическими областями гипопигментации из-за атрофических изменений пигментного эпителия. На периферии эти дефекты имеют концентрическую ориентацию, а в заднем полюсе — радиальную, располагаясь, как правило, периваскулярно. Позднее некоторые участки гипопигментации, расположенные преимущественно вдоль крупных сосудов, сохраняются, другие трансформируются в зоны гиперпигментации. Пигментные нарушения сетчатки чаще локализуются в нижненаружном квадранте, их выявляют в 61—67 % глаз. Решетчатая дегенерация сетчатки встречается приблизительно у половины больных. Возникающая миопия может сочетаться с астигматизмом. Помутнения хрусталика выявляются уже в возрасте 10—20 лет и быстро прогрессируют. В качестве лечения целесообразно проводить трофическую терапию, при необходимости осуществляют коррекцию аметропии, экстракцию катаракты.
Список литературы:
1. Володин П.Л., Павленко В.В., Полянская Е.Г., Осокин И.Г. Микроинвазивная витрэктомия в лечении синдрома первичного персистирующего гиперпластического стекловидного тела у детей // Современные технологии в офтальмологии. - 2014. - № 1. - С.29-31.
2. Назаров П.В. Ишбердина Л.Ш. Хирургическое лечение при синдроме первичного гиперпластического персистирующего стекловидного тела // Российская педиатрическая офтальмология. - 2011.- №1.- С.51-53.
3. Терещенко А.В., Белый Ю.А., Трифаненкова И.Г., Демьянченко С.К. Дифференцированный подход к хирургическому лечению врожденной катаракты в сочетании с синдромом первичного персистирующего гиперпластического стекловидного тела. // Российская детская офтальмология. - 2013. - № 3. - С. 5.
4. Харлап С.И. Салихова А.Р. Аветисов К.С. Аветисов С.Э. Морфологические особенности клинических проявлений некоторых видов врожденных аномалий хрусталика и стекловидного тела. // Вестник офтальмологии, 2017.- № 2.- С.104-112.
5. Худяков А.Ю., Васильев А.В. Результаты хирургического лечения при синдроме первичного персистирующего гиперпластического стекловидного тела. Современные технологии в офтальмологии. - 2013. - № 1. - С. 201
6. Wang MX, Carlsen AJR, Liu JC. X-linked opthalmic disorders. In Tasman W Jaeger EA (eds) // Duane's Foundations of Clinical Ophthalmology. - 8006. - р. 380
Подписи к рисункам:
Рисунок 1. Виды патологических изменений стекловидного тела.
Рисунок 2. Эпидемиология ППГСТ.
Рисунок 3. Патологический препарат глаза с ППГСТ.
Рисунок 4. Глаз пациента П. с ППГСТ.
Рисунок 5. Пациент В. с IV степенью ППГСТ.
Рисунок 6. Патологоанатомический препарат глаза с ППГСТ.
Рисунок 7. Клиническая картина глаз пациентов с ППГСТ.
Рисунок 8. Клиническая картина глаз пациентов с ППГСТ.
Рисунок 9. Передняя форма ППГСТ.
Рисунок 10. Задняя форма ППГСТ.
Рисунок 11. Офтальмоскопическая картина глаза пациента с задней формой ППГСТ.
Рисунок 12. Остатки гиалоидной артерии глаза пациента Г. с ППГСТ.
Рисунок 13. Обоснование лечения ППГСТ.
Рисунок 14. Схема лечения пациента ППГСТ.
Рисунок 15. Глаз пациента Д. с персистирующей гиалоидной артерией.
Рисунок 16. Патология глазного яблока, сочетанная с персистирующей гиалоидной артерией.
Рисунок 17.Офтальмоскопическая картина глаза пациента с персистирующей гиалоидной артерией.
Рисунок 18. УЗ-картина персистирующей гиалоидной артерии.
Рисунок 19. Глаз пациента С. с кистой стекловидного тела.
Рисунок 20. Причина возникновения синдрома Патау.
Рисунок 21. Глазные симптомы при синдроме Патау. Лечение.
Рисунок 22. Причина возникновения синдрома Норри.
Рисунок 23. Патологоанатомический срез глаза пациента с синдромом Норри.
Рисунок 24. Вид глаза пациента с синдромом Норри.
Рисунок 25. Глазные проявления синдрома Норри.
Рисунок 26. УЗ- картина при синдроме Норри. Лечение.
Рисунок 27. Дифференциальный диагноз с ретинобластомой.
Рисунок 28. Синдром Вагнера.
Рисунок 29. Клинические признаки и лечение глазной патологии при синдроме Вагнера.
Читайте также:
