Примеры пигментной злокачественной медуллоэпителиомы цилиарного тела
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Медуллоэпителиома (МЭ) цилиарного тела встречается крайне редко. Затруднения в диагностике новообразования связаны преимущественно с плоскостным характером роста опухоли.
Цель. Изучить на примере клинического случая трудности диагностики МЭ цилиарного тела.
Материал и методы. Объектом исследования стала пациентка, проходившая обследование и лечение в ГАУЗ КО «Кемеровская областная клиническая офтальмологическая больница».
Результаты. Атипичные клинические проявления опухоли при отсутствии явной «плюс» ткани, расценивались как фиброз стекловидного тела в исходе процесса неясного генеза. Подвывих хрусталика, ретролентальная фиброзная пленка с новообразованными сосудами, отсутствие гипотонии при наличии субтотальной отслойки сетчатки являлись признаками внутриглазного новообразования.
Заключение. Диагностика внутриглазной МЭ является трудной задачей. Сочетание таких клинических признаков как плотная ретролентальная мембрана, подвывих хрусталика, вторичная гипертензия позволяют заподозрить внутриглазную опухоль. Выявление при УЗИ гетерогенной ткани, включающей анэхогенные зоны, подтверждает наличие МЭ.
Ключевые слова: медуллоэпителиома, цилиарное тело, внутриглазная опухоль.
Примеры пигментной злокачественной медуллоэпителиомы цилиарного тела
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН, Москва
ГУ ФНКЦ детской гематологии, онкологии и иммунологии Минздрава РФ им. Д. Рогачева, Москва
ФГБНУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко», Москва, Россия
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН
Медуллоэпителиома, эпендимобластома и эмбриональная опухоль с истинными розетками - единая нозологическая единица?
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2013;77(6): 51‑55
Рыжова М.В., Кушель Ю.В., Желудкова О.Г., Шишкина Л.В., Панина Т.Н., Меликян А.Г., Землянский М.Ю., Леменева Н.В. Медуллоэпителиома, эпендимобластома и эмбриональная опухоль с истинными розетками - единая нозологическая единица? Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2013;77(6):51‑55.
Ryzhova MV, Kushel' IuV, Zheludkova OG, Shishkina LV, Panina TN, Melikian AG, Zemlianskiĭ MIu, Lemeneva NV. Are the medulloepithelioma, ependymoblastoma and embryonal tumor with multilayered rosettes the same entity? Zhurnal Voprosy Neirokhirurgii Imeni N.N. Burdenko. 2013;77(6):51‑55. (In Russ., In Engl.).
Медуллоэпителиома - чрезвычайно редкая злокачественная преимущественно супратенториальная опухоль головного мозга. Гистологически медуллоэпителиома характеризуется эпителиальными структурами, подобными примитивному эпителию развивающегося мозга. Иммуногистохимическое исследование опухоли выявило положительную экспрессию LIN28A, а флуоресцентная гибридизация in situ - амплификацию микро-РНК на локусе 19q13. Имеющиеся в опухолевом геноме аберрации позволяют нам предполагать, что медуллоэпителиома, также как и эпендимобластома и эмбриональная опухоль с обилием нейропиля и истинными розетками, представляют собой единую нозологическую единицу.
Медуллоэпителиома — это редкая высокозлокачественная опухоль, возникающая у детей младшего возраста и поражающая преимущественно большие полушария головного мозга, относящаяся согласно классификации ВОЗ опухолей центральной нервной системы наряду с нейробластомой ЦНС, ганглионейробластомой ЦНС и эпендимобластомой к примитивным нейроэктодермальным опухолям WHO Grade IV [8].
Также медуллоэпителиома может поражать цилиарное тело, сетчатку и зрительный нерв, прогноз у медуллоэпителиомы глаза при энуклеации глазного яблока относительно благоприятный [3, 5, 11, 12].
Гистологически медуллоэпителиома характеризуется эпителиальными структурами (тубулярными, трабекулярными и папиллярными), подобными примитивному эпителию развивающегося мозга. Эпителий ограничен с внутренней стороны люминальной поверхностью, близко к которой обычно располагается большое количество митозов, и наружной лимитирующей мембранной. Медуллоэпителиомы могут демонстрировать различную дифференцировку, в том числе нейрональную и нейробластическую, астроцитарную, олигодендроглиальную, мезенхимальную, описаны медуллоэпителиомы с наличием пигмента меланина, также для этих опухолей характерно появление истинных многорядных розеток, сходных с эпендимобластическими розетками [3, 4, 9, 12].
Согласно текущей классификации опухолей [8] и данным экспертов в области нейропатоморфологии [3, 4, 9, 12], дифференциальный диагноз следует проводить с эпендимобластомой, карциномой сосудистого сплетения, незрелой тератомой и атипической тератоидно/рабдоидной опухолью.
Редкость возникновения медуллоэпителиом делает описание каждого наблюдения особенно важным, тем более, что представленные в мировой литературе данные характеризуют лишь морфологические особенности [2, 13], молекулярно-генетические аберрации медуллоэпителиом остаются не изученными до сих пор.
Мы надеемся, что наше наблюдение будет способствовать пониманию биологических особенностей этого новообразования.
Клинический случай
Мальчик в возрасте 1 года 10 мес поступил во II детское отделение ФГБУ «Научно-исследовательский институт нейрохирургии им. акад. Н.Н. Бурденко» с гигантской опухолью левого полушария головного мозга. Ребенок от первой беременности, протекавшей без патологии, первых самостоятельных родов на 37-й неделе. Масса тела при рождении 2750 г, рост 49 см. Мальчик развивался с отставанием в моторном развитии: начал переворачиваться в 6 мес, ползать и сидеть в 7 мес, ходить в 1 год 1 мес. Заболел в возрасте 1 года 7 мес, когда на фоне подъема температуры до 38 °С стал прихрамывать на правую ногу. Проведенная компьютерная томография (рис. 1)
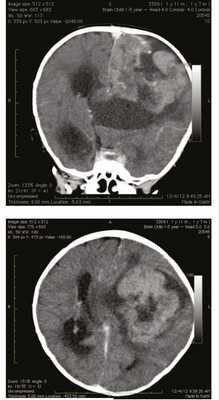
Рисунок 1. Компьютерная томография гигантской опухоли левого полушария головного мозга. выявила гигантскую опухоль левого полушария головного мозга. Также за прошедшие 3 мес отмечен активный прирост окружности головы. В клинической картине заболевания доминировали симптомы внутричерепной гипертензии в виде прогрессирующей макрокрании (окружность головы 60 см), на глазном дне были выявлены признаки внутричерепной гипертензии с развитием атрофии зрительных нервов и слепоты. Также обращала на себя внимание очаговая симптоматика преимущественного поражения левого полушария: ограничение взора влево, центральный парез VII нерва справа, тетрапарез до 4 баллов слева и до 3 баллов справа, рефлексы D>S, диссоциация по оси тела и координаторные расстройства с развитием выраженной атаксии, при этом движения в конечностях были сохранены в полном объеме. Мальчику было проведено тотальное удаление гигантской опухоли, имеющей достаточно хорошую псевдограницу с веществом мозга. После гистологической верификации опухоли ребенок и его родители были консультированы онкологом: было рекомендовано проведение высокодозной химиотерапии. Через 3 мес после постановки диагноза ребенок умер от прогрессии заболевания.
Материал и методы
Флуоресцентная гибридизация in situ (Fluorescence in situ hybridization, FISH) была проведена с коммерческой пробой Vysis Abbott Molecular Vysis LSI N-MYC (2p24) Spectrum Green/CEP 2 Spectrum Orange Probe и некоммерческой двухцветной пробой: FITC-меченной пробой 634C1 к локусу 19q13.42 и контрольной дигоксигенинмеченной пробой 2659N к локусу 19р13.
Патоморфологическое и молекулярно-генетическое исследования
За исключением небольших замороженных во время операции фрагментов опухоли был исследован весь присланный материал, составивший 12 парафиновых блоков. Гистологическое исследование показало достаточно однородную по морфологической картине злокачественную опухоль с обширными полями некрозов. Клетки опухоли формировали нейроэпителиальные структуры: каналы, полости и трабекулы, подобные нервной трубке эмбриона. Также в опухоли встречалось большое количество истинных многорядных розеток с фигурами митозов
Рисунок 2. Медуллоэпителиома. Гистологические препараты. а — общий вид опухоли, формирующей эпителиальные структуры (голубые стрелки) и истинные розетки (желтая стрелка). × 10; б — структуры, подобные нервной трубке (красные стрелки), и истинные розетки (голубая стрелка). × 30. Окраска гематоксилином и эозином. Участки нейропиля в опухоли отсутствовали. Иммуногистохимическое исследование выявило положительную экспрессию LIN28А (рис. 3), Рисунок 3. Медуллоэпителиома. Иммуногистохимическое исследование с антителом LIN28A. Тотальная положительная экспрессия в клетках опухоли. виментина, очаговую положительную экспрессию цитокератинов АЕ1/3 и СК18 (рис. 4); Рисунок 4. Медуллоэпителиома. Иммуногистохимическое исследование с эпителиальным маркером цитокератином СК18. Фокальная положительная экспрессия в клетках опухоли. тотальную ядерную экспрессию INI1, что свидетельствовало об отсутствии делеции гена INI1 и исключило атипическую тератоидно-рабдоидную опухоль. Экспрессии глиофибриллярного кислого белка GFAP, S-100, синаптофизина, нейронспецифической енолазы NSE, эпителиального мембранного антигена EMA и альфа-фетопротеина выявлено не было. Флуоресцентная гибридизация in situ демонстрировала кластерную амплификацию микро-РНК локуса 19q13 (рис. 5), Рисунок 5. Флуоресцентная гибридизация in situ с некоммерческой двухцветной пробой. FITC-меченной пробой 634C1 к локусу 19q13.42 и контрольной дигоксигенинмеченной пробой 2659N к локусу 19р13 выявлена кластерная амплификация микро-РНК локуса 19q13.42 (множественные сливные зеленые сигналы). Вверху в центре имеется канал (зеленые стрелки) структура, подобная примитивному эпителию развивающегося мозга; внизу слева (красная стрелка) — истинная многорядная розетка. количественных изменений на хромосоме 2 не наблюдалось (сбалансированный профиль хромосомы 2) (рис. 6). Рисунок 6. Флуоресцентная гибридизация in situ с пробой Vysis к онкогену N-MYC (локус 2p24)/центромера 2 не выявила добавки хромосомы 2. В центре — истинная многорядная розетка (показано стрелкой).
Медуллоэпителиома — чрезвычайно редкая злокачественная преимущественно супратенториальная опухоль головного мозга. За период с 2000 по 2013 г. в отделении патологической анатомии ФГБУ «Научно-исследовательский институт нейрохирургии им. акад. Н.Н. Бурденко» РАМН было диагностировано только 2 случая медуллоэпителиомы: текущий случай, а также клиническое наблюдение за 2006 г. В то же время диагноз примитивной нейроэктодермальной опухоли ЦНС за прошедшие почти 13 лет был поставлен в 100 случаях, среди которых было 19 первично диагностированных эмбриональных опухолей с обилием нейропиля и многорядными розетками ETMR (одна из самых больших серий в мире, собранных в одном лечебном учреждении).
По мнению некоторых авторов [2], в случае рецидива ETMR опухоль приобретает строение более сходное с медуллоэпителиомой. Нами [1] также описано подобное явление. Но в данном случае речь идет о первичной медуллоэпителиоме, демонстрирующей биологические особенности, идентичные выявляемым в ETMR: амплификацию микро-РНК на локусе 19q13 [6] и тотальную экспрессию опухолевыми клетками LIN28A [7]. Имеющиеся в опухолевом геноме аберрации позволяют нам вслед за S. Nobusawa и соавт. [10] предполагать, что медуллоэпителиома, как и эпендимобластома и эмбриональная опухоль с обилием нейропиля и истинными розетками, представляет собой единую нозологическую единицу.
Благодарности
Авторы сердечно благодарят проф. А.Г. Коршунова (Clinical Cooperation Unit Neuropathology, German Cancer Research Center (DKFZ), Heidelberg, Германия) за оказанную поддержку и добрые советы и Prof. Dr. S. Pfister (Division of Pediatric Neurooncology, German Cancer Research Center (DKFZ), Heidelberg, Германия) за любезно предоставленную пробу для FISH-исследования микро-РНК локуса 19q13.42/19р13 и поликлональное антитело LIN28A. Также мы благодарим И.В. Зубову и Т.М. Коршунову за высокопрофессиональное техническое исполнение иммуногистохимического исследования и флуоресцентной гибридизации in situ.
ФГБУ «Московский НИИ глазных болезней им. Гельмгольца» Минздрава России, Москва
ФГБУ "Московский НИИ глазных болезней им. Гельмгольца" Минздрава России
ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России, Москва, Россия
ФГБУ «Московский НИИ глазных болезней им. Гельмгольца» Минздрава России, ул. Садовая-Черногрязская, 14/19, Москва, 105062, Российская Федерация
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН, 115478 Москва, Каширское шоссе, д. 23
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России, Каширское ш., 23, Москва, 115478, Российская Федерация
. Злокачественная медуллоэпителиома, симулирующая ретинобластому — клинико-гистологический анализ случая и опыт получения клеточной культуры
Журнал: Вестник офтальмологии. 2016;132(6): 64‑69
В работе представлен клинико-морфологический анализ случая первичной внутриглазной злокачественной медуллоэпителиомы редкой локализации — центрального отдела сетчатки с вовлечением диска зрительного нерва, — симулирующей ретинобластому, у ребенка 2 лет. Подробно приведены гистологические особенности опухоли (трубчатые и сетчатые структуры опухоли, розетки, ленточные образования, клетки с гиперхромными ядрами, клеточный полиморфизм). Описан единственный на сегодняшний день в Российской Федерации опыт создания первичной культуры внутриглазной злокачественной медуллоэпителиомы с последующей оценкой чувствительности (МТТ-тест) к четырем препаратам (оксалиплатин, иринотекан, ифосфамид, аскорбиновая кислота) в различных концентрациях. Из четырех исследованных препаратов IC50 (3,3 мг/мл) получена только для раствора аскорбиновой кислоты. Несмотря на относительную редкость первичной внутриглазной злокачественной медуллоэпителиомы, необходимо проводить дифференциальный диагноз с другими внутриглазными образованиями, прежде всего ретинобластомой. Полученные данные об эффективности раствора аскорбиновой кислоты в отношении клеток внутриглазной злокачественной медуллоэпителиомы могут быть использованы для дополнения существующих химиотерапевтических протоколов в детской нейро- и офтальмоонкологии.
Внутриглазная медуллоэпителиома (диктиома) — редкая врожденная эмбриональная опухоль, растущая из эпителия цилиарного тела, ресничной части сетчатки и зрительного нерва, которая встречается как у взрослых, так и у детей [1, 2]. Опухоль состоит из тубулярных структур, выстланных псевдомногослойным нейроэпителием. Данная опухоль чаще всего выявляется в первой декаде жизни. Диагностика медуллоэпителиомы не всегда очевидна. Эхографическая локализация зачастую затруднена в связи с плоскостным характером роста, что объясняет позднюю (послеоперационную) диагностику [3].
В литературе за последние 30 лет доступны лишь 10 работ, посвященных первичной внутриглазной медуллоэпителиоме диска зрительного нерва (ДЗН) [2, 4, 5]. В работе Pastora-Salvador и соавторов описан случай медуллоэпителиомы зрительного нерва у мальчика 12 лет. Пациенту провели локальную резекцию опухоли, при этом безрецидивный период наблюдения составил 25 лет [5].
Медуллоэпителиомы классифицируются на тератогенные и нетератогенные варианты, подразделяемые в свою очередь на доброкачественные и злокачественные типы. Основной признак нетератогенного типа опухолей — множественность слоев и полос низкодифференцированных нейроэпителиальных клеток, внешне схожих с эмбриональной сетчаткой или цилиарным эпителием [6].
Дифференциальный диагноз следует проводить с ретинобластомой и другими редкими внутриглазными опухолями, включая беспигментную меланому, шванному и аденокарциному ретинального пигментного эпителия, а также неопухолевыми процессами, такими как воспалительная гранулема [7, 8]. Несмотря на то что медуллоэпителиомы могут выглядеть в виде крупных нейробластных псевдорозеток, для них характерны трубчатые конгломераты клеток, а не рост в виде «перчаток» или «рукоятки», что типично для ретинобластом. Дифференциальными признаками могут служить также тесная взаимосвязь с подлежащими тканями и отсутствие псевдофоторецепторов, в отличие от розеток Флекснера—Винтерштайнера [6]. Иммуногистохимические исследования медуллоэпителиом с псевдорозетками Флекснера—Винтерштайнера выявляют положительный результат на нейронспецифичную енолазу и синаптофизин во всех случаях [6].
В некоторых случаях исход заболевания неблагоприятен. Такое развитие новообразования чаще всего связано с распространением за пределы глаза, но также описаны отдаленные метастазы в лимфатические узлы, околоушные железы, легкие и средостение [9]. Медуллобластома как примитивная нейроэктодермальная опухоль центральной нервной системы у детей поражает преимущественно мозжечок и встречается значительно чаще первичной опухоли внутри глаза [10]. На сегодняшний день доступны несколько химиотерапевтических протоколов для лечения данного заболевания [11]. Первичная внутриглазная медуллоэпителиома, несмотря на низкую частоту встречаемости, представляет интерес для офтальмологов в связи со сложностью ее дифференциальной диагностики с другими внутриглазными новообразованиями, а также единичными данными о возможном химиотерапевтическом лечении.
Цель настоящей работы — клинико-гистологический анализ случая злокачественной медуллоэпителиомы у ребенка, а также описание опыта получения клеточной культуры опухоли и проведения МТТ-теста.
Клинические данные. Мальчик в возрасте 2 лет и 3 мес поступил на обследование и лечение в стационар. Из анамнеза известно, что в возрасте 2 лет родители заметили изменение «окраски» зрачка левого глаза на фотографии, а через 2 мес обратились к врачу по месту жительства, диагноз — подозрение на ретинобластому группы D. До появления первых симптомов ребенка осматривали в 1 год и 7 мес, но без мидриаза. При поступлении острота зрения на левом глазу соответствовала правильной проекции света, передний отрезок глаза без изменений. На глазном дне, по данным осмотра на RetCam, — ДЗН и макула не определяются, прикрыты серо-белой опухолевой тканью с неровными границами и бугристой поверхностью (рис. 1). На правом глазу изменений не выявлено.
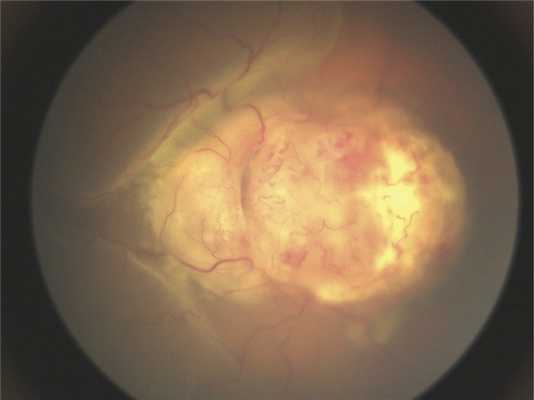
Рис. 1. Клиническая картина опухоли при осмотре на RetCam.
Согласно данным ультразвукового исследования, у заднего полюса выявлены плюс-ткань гетерогенной эхоструктуры с единичными кальцинатами, размером 6,4×13,3 мм, вторичная отслойка сетчатки (рис. 2). Учитывая локализацию опухоли (солитарный опухолевый узел, полностью перекрывающий ДЗН), отсутствие шансов на зрение, размеры образования и высокий риск экстрабульбарного распространения опухоли, выполнена энуклеация левого глаза с пластикой культи. После получения патогистологического заключения (злокачественная медуллоэпителиома) ребенок направлен на консультацию к детскому онкологу с целью возможного выявления новообразования в головном мозге. По данным магнитно-резонансной томографии, опухолевых очагов в ЦНС не выявлено, однако в связи с прорастанием опухоли за laminacribrosa пациенту назначен курс лучевой и химиотерапии (циклофосфан, вепезид, карбоплатин).
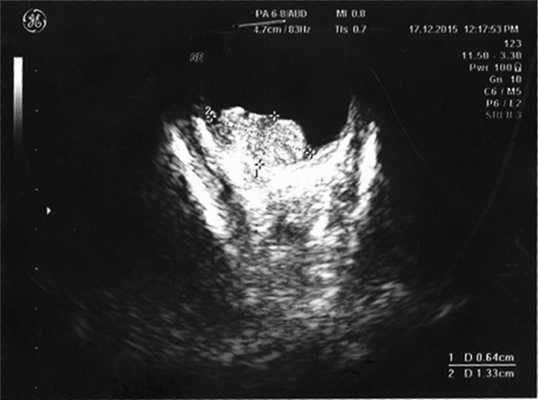
Рис. 2. Результат эхографии левого глаза у ребенка с подозрением на монокулярную форму ретинобластомы.
Патоморфологическое исследование. При морфологическом исследовании кусочка новообразования из боковой колодки выявлена опухоль, состоящая из кубических эпителиальных клеток, которые формировали единичные розетковидные структуры и небольшие участки солидного роста. Поставлен предварительный диагноз — недифференцированная ретинобластома без опухолевых комплексов в дистальном отрезке зрительного нерва. Далее при изучении срезов всего глазного яблока выявлен большой опухолевый узел в центральных отделах глазного дна, тесно связанный со зрительным нервом. Узел состоял преимущественно из трубчатых и сетчатых структур, розеток, ленточных образований, что придавало опухоли местами вид «кружева» (рис. 3).
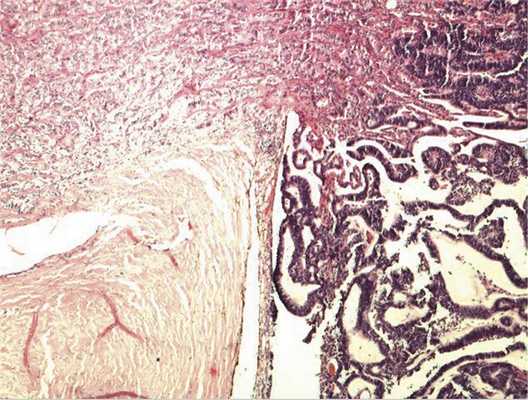
Рис. 3. Часть узла опухоли снаружи от ДЗН, имеющая вид «кружева». Окраска гематоксилином и эозином. Ув. 100.
Отмечалось наличие ленточных структур из низкодифференцированных эпителиальных клеток (рис. 4). Параллельно встречались участки солидного строения из клеток с гиперхромными ядрами с признаками клеточного и ядерного полиморфизма. В них почти исчезает строма, появляются митозы, встречаются участки дистрофии и некроза (рис. 5). Опухоль врастает в ткань ДЗН с переходом за laminacribrosa, но не достигает линии отсечения (рис. 6). В таком виде опухоль обладает местнодеструирующим характером роста и может давать метастазы, глубоко инфильтрируя прилежащую к ДЗН ткань хориоидеи. Окончательный гистологический диагноз: злокачественная медуллоэпителиома центрального отдела сетчатки с вовлечением ДЗН и инвазией перипапиллярной хориоидеи, с глубоким прорастанием по зрительному нерву, не достигая линии отсечения.
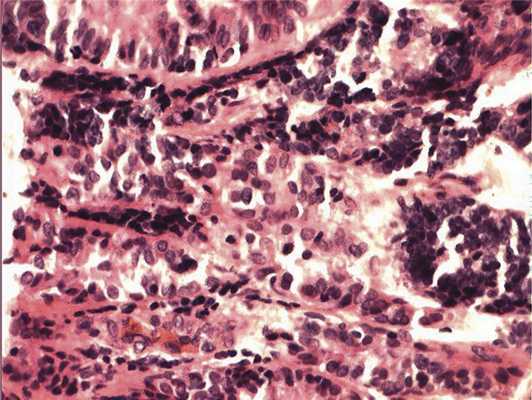
Рис. 4. Формирование полос из низкодифференцированных нейроэпителиальных клеток. Окраска гематоксилином и эозином. Ув. 400.
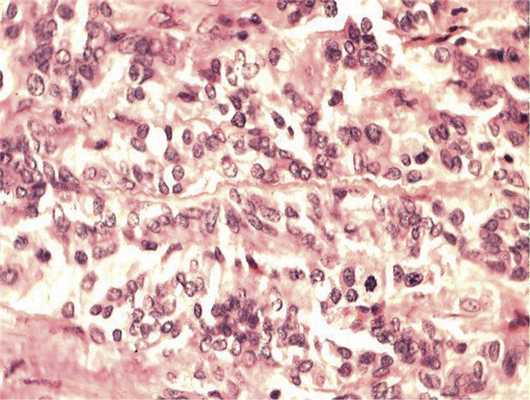
Рис. 5. Зоны солидного роста опухоли. Клеточный полиморфизм с фигурами митозов. Окраска гематоксилином и эозином. Ув. 400.
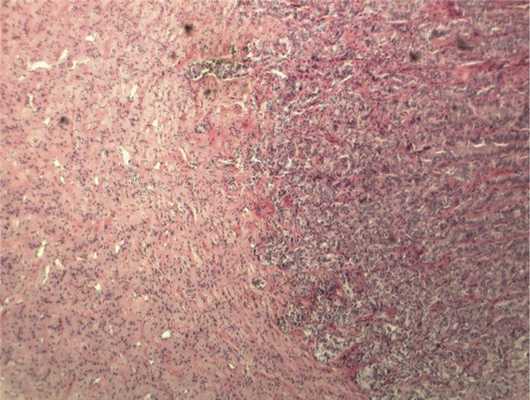
Рис. 6. Врастание опухоли в ткань ДЗН с ростом по ходу пучков нервных волокон. Окраска гематоксилином и эозином. Ув. 100.
Получение первичной культуры опухоли. После вскрытия глазного яблока взят образец опухолевой ткани для получения клеточной культуры с последующим исследованием лекарственной устойчивости (МТТ-тест). Опухолевый образец транспортировали в лабораторию генетики опухолевых клеток РОНЦ им. Н.Н. Блохина в течение 2—3 ч в бессывороточной среде RPMI («ПанЭко», Россия) с добавлением 100 мкг/мл гентамицина («Микроген», Россия). Далее полученную ткань обрабатывали механически (измельчали стерильными ножницами) и ферментативно (0,25% трипсин—0,04% ЭДТА; «ПанЭко», Россия) до получения клеточной суспензии, которую переносили в культуральные флаконы («Corning—Costar», США) со средой RPMI c добавлением 10% эмбриональной сыворотки коров («PAALaboratories», Австрия) и гентамицина 50 мкг/мл. Центрифугировали транспортировочную среду, полученный осадок клеток высевали на флаконы, которые помещали в термостат («Memmert», Германия) при температуре 37 °C и содержанием 5% СО2. Далее в течение 1 мес культивировали полученные клетки, по мере необходимости закисленную среду с погибшими клетками заменяли на новую питательную среду, при достижении клетками 60—80% уровня конфлюэнтности производили рассев клеток на новые культуральные флаконы. В течение культивирования клетки прошли 2—4 пассажа.
МТТ-тест. Метод основан на способности митохондриальных дегидрогеназ живых клеток метаболизировать желтый тетразол-реагент МТТ-3-(4,5-диметилтиазол-2)-2,5-дифенилтетразол-бромид в синий формазан. По интенсивности окраски конечного раствора судят о количестве живых клеток в лунке.
Клетки первичной культуры медуллоэпителиомы MB1 рассевали на 96-луночное плато по 1,5∙10 3 клеток в лунку в объеме 90 мкл культуральной среды RPMI. Препараты (иринотекан, ифосфамид, оксалиплатин и аскорбиновую кислоту) в объеме 10 мкл добавляли в различных концентрациях на следующий день. В контрольные лунки добавляли 10 мкл бессывороточной среды. Клетки культивировали в присутствии химиопрепаратов в течение 3 сут. Затем в лунки добавляли реагент МТТ в концентрации 5 мг/мл в объеме 20 мкл на лунку (рис. 7). Через 1,5—2 ч среду с реагентом удаляли и осадок растворяли в 60 мкл ДМСО. Уровень оптической плотности растворов в каждой лунке определяли с помощью спектрофотометра (планшетного ридера) Multiskan FC («ThermoScientific», EС) при длине волны 594 нм.

Рис. 7. 96-луночное плато с клетками первичной культуры злокачественной медуллоэпителиомы и исследуемыми препаратами.
Далее в «Программе для расчета IC50 химиотерапевтических веществ», написанной в лаборатории генетики опухолевых клеток, строили график зависимости уровня оптической плотности (проценты от контроля) от концентрации вещества и рассчитывали искомую концентрацию IC50 (полумаксимальное ингибирование). Использованы следующие химиопрепараты:
а) Иринотекан («Actavis», Исландия) в концентрациях 0,25; 0,5; 1,0 и 2,0 мг/мл;
б) Ифосфамид («Верофарм», Россия) в концентрациях 0,25; 0,5; 1,0 и 5,0 мг/мл;
в) Оксалиплатин («Medac», Германия) в концентрациях 0,1; 0,2; 0,38; 0,75 и 1,5 мг/мл;
г) Аскорбиновая кислота («Alvils», Россия—Китай) в концентрациях 0,6; 1,25; 2,5 и 5 мг/мл.
Результаты МТТ-теста представлены на рис. 8, а—г. Для аскорбиновой кислоты получена IC50 3,3 мг/мл. Результаты данного теста показывают, что с повышением концентрации препарата выживаемость клеток увеличивается.
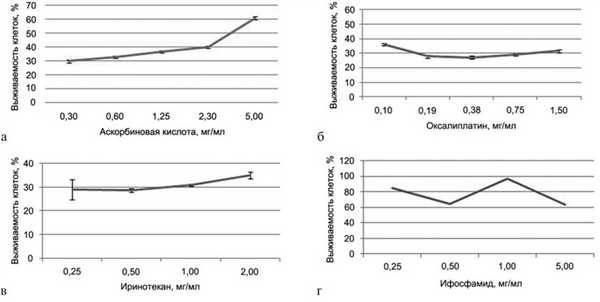
Рис. 8. IC50 (полумаксимальное ингибирование). а — для аскорбиновой кислоты; б — для оксалиплатина; в — для иринотекана; г — для ифосфамида.
IC50 для оксалиплатина, иринотекана и ифосфамида не получена. Для оксалиплатина при минимальной используемой концентрации 0,1 мг/мл выживаемость клеток составила 36%, для иринотекана при минимальной используемой концентрации 0,25 мг/мл — 29%, а для ифосфамида при максимальной используемой концентрации 5 мг/мл — 64%. Таким образом, из четырех исследованных препаратов IC50 (3,3 мг/мл) получена только для раствора аскорбиновой кислоты.
Заключение
К настоящему времени патогномоничные симптомы, свидетельствующие о первичной внутриглазной злокачественной медуллоэпителиоме, не описаны, а диагноз ставится на основании патогистологического заключения. Вместе с тем ряд симптомов, включая наличие кальцификатов и нехарактерные рентгенографические признаки, затрудняют дифференциальную диагностику с другими внутриглазными опухолями детского возраста, прежде всего ретинобластомой. К характерным патоморфологическим особенностям ретинобластомы, отличающим ее от медуллоэпителиомы, относят наличие «истинных» розеток, состоящих из цилиндрической формы нейроэпителиальных клеток эмбрионального типа [12]. Для медуллоэпителиомы, напротив, характерно наличие псевдорозеток, располагающихся диффузно или вокруг сосудов [2]. Несмотря на относительную редкость опухоли, необходимо проводить дифференциальный диагноз с другими внутриглазными образованиями, особенно при наличии сопутствующих длительно существующих глазных симптомов. Полученные данные об эффективности раствора аскорбиновой кислоты в отношении клеток внутриглазной злокачественной медуллоэпителиомы могут быть использованы для дополнения существующих химиотерапевтических протоколов в детской нейро- и офтальмоонкологии. Клеточная культура медуллоэпителиомы и возможная животная модель опухоли являются потенциальными объектами для изучения как экспрессии генов, так и специфических мутаций в ткани опухоли, что в свою очередь представляет интерес в перспективе для селективной химиотерапии опухоли и сохранения глаза.
Первый МГМУ им. И.М. Сеченова, Москва, 119991, Российская Федерация
Государственный институт усовершенствования врачей Министерства обороны РФ
Меланома кожи с явлениями регресса: описание клинического случая и обзор литературы
Журнал: Клиническая дерматология и венерология. 2017;16(5): 36‑41
Клиническая картина и течение меланомы крайне вариабельны. Одним из проявлений меланомы кожи является спонтанный регресс. Частичный регресс встречается в меланомах с частотой от 10 до 35% вне зависимости от толщины опухоли по Бреслоу, однако этот симптом нередко остается незамеченным патоморфологами. Прогностическая значимость регресса на сегодняшний день остается неоднозначной, однако большинство исследователей считают регресс неблагоприятным признаком. В статье приводится описание клинического случая меланомы кожи с явлениями регресса и обзор литературы по данной проблеме.
Клинические проявления меланомы достаточно разнообразны, что может объяснять несвоевременную диагностику данной метастазирующей опухоли. Для повышения точности диагностики меланомы предложен ряд неинвазивных методик [1], однако «золотым стандартом» диагностики считается гистологическое исследование. Существенным ограничением используемых методов является их зависимость от опыта исследователей, недостаточность которого приводит к диагностическим ошибкам. Так, точность дерматоскопического исследования зависит от прохождения специализированной подготовки [2], а расхождения при трактовке гистологических препаратов меланоцитарных новообразований встречаются среди экспертов в 1/3 случаев [3].
Признаки регресса опухоли считаются одним из гистологических критериев, свидетельствующих о меланоме [4]. Тем не менее эти признаки нередко остаются незамеченными патоморфологами, что влечет за собой отсрочку в постановке диагноза или неверное стадирование злокачественного опухолевого процесса. Приводим описание клинического случая ошибки в диагностике меланомы кожи с явлениями регресса (МсР) и обзор литературы по данной проблеме.
Пациентка Н., 49 лет, была направлена для осмотра внутридермального невуса в подмышечной области. При полном осмотре кожных покровов были выявлены явления хронического фотоповреждения в верхней трети спины, единичные клинически атипичные невусы (рис. 1). В нижней трети левого бедра было обнаружено асимметричное по форме и окрашиванию образование с неровными границами, размером 9×6 мм, в пределах которого имелся плотный экзофитный компонент (рис. 2). Проксимальнее образования определялся нормотрофический рубец 3×1 см после хирургического иссечения «родинки» в условиях онкологического диспансера. Пациентка затруднялась точно указать давность существования образования и наличие в нем какой-либо динамики, а также результаты предыдущего оперативного лечения. Семейный анамнез по злокачественным опухолям кожи не был отягощен. При дерматоскопическом осмотре (рис. 3) была выявлена асимметрия образования по структурам и цвету, участки атипичной пигментной сети по периферии образования, участки рубцово-подобной депигментации и структуры регресса в центральной части образования. В пределах папулезного компонента определялись преимущественно сосуды в виде шпилек. По результатам клинического и дерматоскопического осмотра был выставлен предварительный диагноз: меланома кожи бедра, поверхностно-распространяющаяся форма с явлениями регресса. По результатам гистологического исследования в онкологическом диспансере был поставлен диагноз: сложный меланоцитарный невус. Пересмотр гистологических препаратов подтвердил диагноз поверхностно-распространяющейся формы МсР. На момент хирургического лечения клинических и лабораторных данных, свидетельствующих о наличии метастазов, не получено. На дальнейшее динамическое наблюдение у дерматолога пациентка не возвращалась.
Рис.1. Клинически атипичный (диспластический) меланоцитарный невус кожи спины на фоне явлений фотоповреждения.
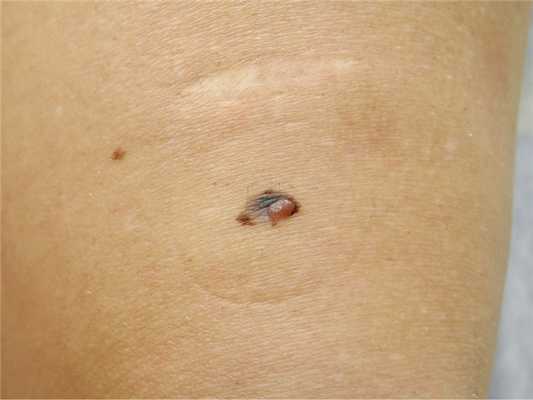
Рис.2. Асимметричное по форме и окраске образование кожи бедра.В центральной части — участок белесовато-синего цвета, соответствующий зоне регресса.
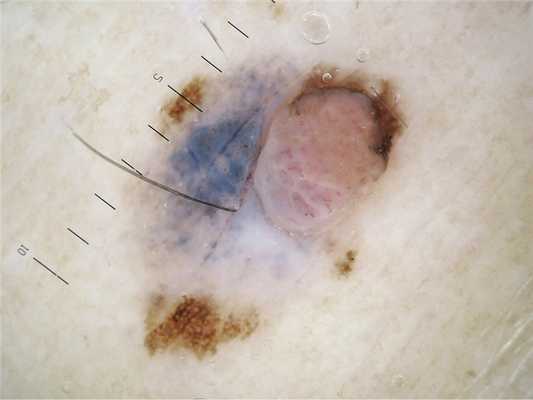
Рис.3. Дерматоскопическая картина образования на коже бедра: асимметрия строения и окраски опухоли, наличие меланом-специфичных признаков.
Под регрессом меланомы понимают спонтанное исчезновение клеток первичной опухоли. Явления частичного регресса встречаются в меланомах с частотой от 10 до 35% вне зависимости от толщины опухоли по Бреслоу, а в меланомах толщиной менее 1 мм признаки частичного регресса регистрируются достоверно чаще — до 61% [5]. Полный регресс встречается крайне редко (0,22—0,27%), но такие случаи значительно труднее документировать [6]. Регрессу чаще подвергаются опухоли, расположенные на коже туловища или нижних конечностей [7].
Клинически регресс меланомы чаще всего характеризуется появлением белых или серо-голубых пятнистых участков в пределах образования. Расположение очагов регресса по периферии может затруднить правильную интерпретацию границ образования. С течением времени папулезный компонент меланомы стадии вертикального роста может стать плоским, а опухоль полностью регрессировать. В некоторых случаях регрессу предшествует воспалительная реакция или зуд в области образования, кровотечение из образования после незначительной травмы [8].
Дерматоскопические проявления частичного регресса меланомы включают ряд признаков, наиболее известными из которых являются участки рубцово-подобной депигментации и структуры регресса. Определения употребляемых в статье дерматоскопических признаков приведены в табл. 1. Указанные признаки изредка могут встретиться и в ряде меланоцитарных невусов (рис. 4), что обусловливает сложности при проведении дифференциальной диагностики между МсР и меланоцитарными невусами с явлениями регресса (МНсР). Обязательным показанием для проведения эксцизионной биопсии является одновременное наличие структур регресса и участков рубцово-подобной депигментации в образовании или степень их выраженности более 50% (т.е. занимают более половины площади образования) [9].

Таблица 1. Определения дерматоскопических признаков
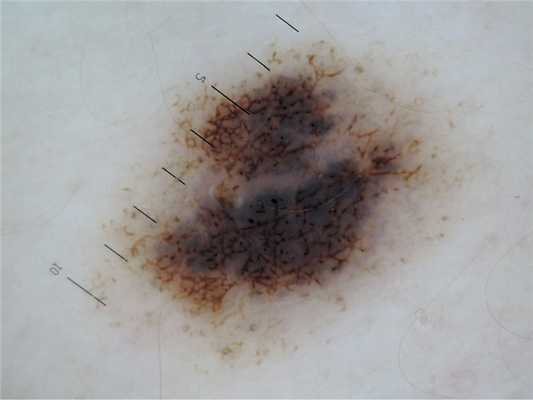
Рис.4. Меланоцитарный невус с явлениями регресса.Образование характеризуется более симметричной по сравнению с меланомой дерматоскопической картиной.
Для проведения дифференциальной диагностики между МсР и МНсР была предложена клинико-дерматоскопическая шкала, учитывающая шесть дерматоскопических структур, размер образования, пол и возраст пациента (табл. 2). Пороговое значение, при котором показано удаление образования, составляет 5 баллов и более. Образования, набравшие 4 балла и менее, требуют динамического наблюдения с повторным дерматоскопическим осмотром через 6 мес. По данным P. Rubegni и соавт. [10], чувствительность метода в диагностике меланомы составляет 98%, а специфичность — 76%.
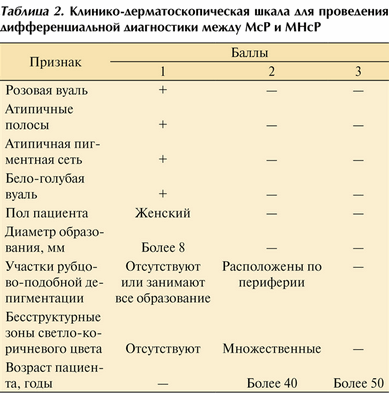
Таблица 2. Клинико-дерматоскопическая шкала для проведения дифференциальной диагностики между МсР и МНсР
Отдельной проблемой является полностью регрессировавшая меланома (пРМ). Таких случаев на сегодняшний день описано не более 50, причем большинство из них сопровождались развитием регионарных и/или отдаленных метастазов. Средний возраст пациентов на момент обращения составлял 48 лет, несколько чаще заболевание выявляли у мужчин. Погибали через 13 мес 1/3 пациентов после диагностирования метастатической меланомы [11]. Клинически пРМ может быть представлена беспигментными очагами, напоминающими рубец; частично или полностью пигментированными очагами с различной окраской, включая оттенки красного, серого и синего цвета. При дерматоскопическом исследовании возможно обнаружение участков рубцово-подобной депигментации, структур регресса, атипичных линейно-извитых сосудов, сосудов в виде точек или глыбок, розовой вуали, остаточной пигментации коричневого или черно-серого цвета и структур по типу хризалид [8].
Гистологически регресс напоминает формирование рубцовой ткани и проявляется атрофией эпидермиса, уплощением эпидермальных отростков, фиброзом, неоангиогенезом и наличием лимфоцитарного инфильтрата с примесью меланофагов (рис. 5) [12]. По гистологическим признакам регресс меланомы можно условно разделить на три стадии: начальную, промежуточную и позднюю. Ранняя стадия характеризуется выраженной инфильтрацией опухоли лимфоцитами. Затем происходит полное или частичное разрушение клеток меланомы на всем протяжении или сегментарно, формируется фиброз различной степени выраженности и прочие выше перечисленные признаки регресса [13]. Для выявления меланоцитарной природы образования может потребоваться иммуногистохимическое исследование (окрашивание на антиген S100, Melan-A, реакция на тирозиназу) [14]. Критерии постановки диагноза пРМ (табл. 3) были предложены J. Smith и J. Stehlin [11] в 1965 г. и позднее модифицированы разными авторами.
Таблица 3. Критерии постановки диагноза полностью регрессировавшей меланомы
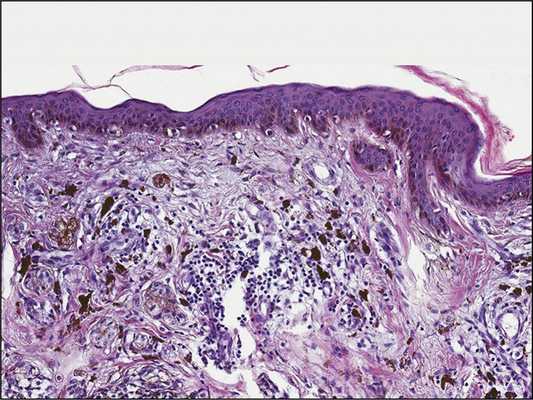
Рис.5. Гистологические проявления неполного регресса (промежуточная стадия).Эпидермис уплощен, в гиперпигментированном базальном слое — пролиферация атипичных меланоцитов. Непосредственно под эпидермисом — явления фиброплазии с горизонтальным расположением коллагеновых волокон и большим числом клеток фибробластического ряда. В подлежащих участках дермы — остаточные комплексы клеток меланомы, местами окруженные воспалительным лимфоцитарным инфильтратом с примесью меланофагов. Окраска гематоксилином и эозином. Ув. 200.
Как показывают результаты иммуногистохимических исследований, в основе феномена спонтанного регресса лежат иммуноопосредованные механизмы. В частности, происходит активация нативного противоопухолевого иммунитета с участием цитолитических Т-лимфоцитов [15]. Некоторые авторы [16] полагают, что травма или инфекция могут усилить противоопухолевый ответ организма и вызвать регресс опухоли. Согласно другой теории, регресс первичной меланомы запускается через иммунную систему только при наличии метастазов в регионарных лимфатических узлах. Существующие теории предполагают, что клеточные компоненты врожденного иммунитета способны распознавать определенные структуры на раковых клетках и запускать процесс регресса первичной опухоли. Развитие метастатического процесса может означать ускользание клеток опухоли от иммунной системы благодаря мутациям или подавлению активности системы HLA, снижению продукции супрессивных цитокинов и другим нарушениям в противоопухолевой защите организма [17, 18].
Прогностическое значение регресса меланомы неоднозначно. По мнению R. Scolyer и соавт. [13], большинство исследователей, изучавших прогностическое значение регресса, не указывали стадию процесса, использовали разные критерии диагностики и включения пациентов в исследование. Все это затрудняет интерпретацию гистологических признаков регресса в контексте других прогностических факторов.
Однако большинство исследователей все же считают регресс отрицательным прогностическим признаком. При диагностированном полном регрессе первичной опухоли отдаленные метастазы выявляются у 4—10% больных. При наличии метастазов и полном регрессе первичной опухоли у пациентов обычно наблюдается быстрое прогрессирование болезни с летальным исходом в кратчайшие сроки. «Тонкие» меланомы при наличии в них значительного регресса (50% и более) также сопровождаются повышенным риском метастазирования на момент диагностики. Высказываются мнения о двух возможных причинах такого феномена. Первое — ошибка диагностики, связанная с неправильным определением толщины меланомы по Бреслоу (заниженное значение), и, как следствие, — с неверным стадированием опухолевого процесса. Второе — изначально неблагоприятный биологический потенциал опухоли, который ассоциирован со спонтанным регрессом [6].
Проблема «тонких» меланом с признаками регресса состоит еще и в том, что при них наблюдается довольно высокий процент ложноотрицательных результатов биопсии «сторожевого» лимфатического узла: т. е. на момент исследования поражение «сторожевого» узла отсутствует, а в дальнейшем развивается метастатический процесс. J. Rubinstein и соавт. [18] изучали прогностическую значимость локальных метастазов в случаях «тонких» меланом (с толщиной менее 1 мм) в одном учреждении на протяжении 15 лет. За это время биопсия «сторожевых» лимфатических узлов была проведена 252 пациентам. В исследование включались как пациенты с выявленными метастазами, так и пациенты с ложно-отрицательными результатами. Предпринималась попытка сопоставить гистологические изменения с поражением лимфоузлов и клиническим течением болезни. В среднем наблюдение за пациентами продолжалось в течение 45,5 мес. Метастазы в регионарных лимфатических узлах наблюдались у 12 (4,8%) пациентов, причем у 6 (2,4%) больных отсроченные метастазы развились в среднем через 37,5 мес после постановки диагноза. Гистологические признаки регресса не коррелировали с наличием метастазов, однако были предикторами ложноотрицательных результатов биопсии «сторожевых» лимфатических узлов. У пациентов с отсроченными метастазами гистологические признаки регресса первичной опухоли отмечались в 60% случаев, в то время как у пациентов с наличием положительного «сторожевого» узла — только в 16%.
Таким образом, отсутствие метастазов в «сторожевом» узле на момент удаления первичной опухоли с признаками регресса, независимо от ее толщины, не исключает возможность дальнейшего прогрессирования болезни. Пациентам с гистологическими признаками регресса меланомы возможно требуется более активное динамическое наблюдение с целью раннего выявления поражения регионарных лимфатических узлов. Низкая приверженность пациентов к динамическому наблюдению за новообразованиями кожи может служить препятствием в выявлении ранних симптомов прогрессирования заболевания [19].
Медуллоэпителиома цилиарного тела: трудности диагностики
Медуллоэпителиома (МЭ) (диктиоцитома, neuroepithelioma ciliary, диктиома) - редкая врожденная ненаследственная эмбриональная опухоль беспигментного эпителия цилиарного тела 5. Данные литературы основываются в основном на отдельных тематических публикациях с малым количеством пациентов [1, 2, 7]. Выявляется чаще всего у детей первого десятилетия жизни, всегда односторонняя [1, 2, 5, 6]. Она классифицируется как доброкачественная, так и как злокачественная опухоль, в зависимости от степени дифференцировки клеток, митотической активности и наличия выхода опухоли за пределы глазного яблока [4, 8].
Изучить на примере клинического случая трудности диагностики медуллоэпителиомы цилиарного тела.
Материал и методы
Под наблюдением находилась пациентка Ж., 6 лет, которая впервые поступила в детское хирургическое отделение ГАУЗ КО «Кемеровская областная клиническая офтальмологическая больница» с жалобами на изменение цвета зрачка левого глаза (OS).
Из анамнеза: изменения заметили случайно. Осмотр офтальмолога в четыре года патологии не выявил. Со слов родителей, около года назад до обращения в стационар было падение с высоты, была осмотрена травматологом. Кроме того, месяц назад до госпитализации сестра ткнула пальцем в OS, лечились самостоятельно.
При первичном поступлении в июле 2015 г. острота зрения OD=1,0; OS=0. Непостоянное отклонение к виску OS до 10 градусов. При осмотре конъюнктива спокойная. Роговица прозрачная. Передняя камера средней глубины, равномерная. Зрачок круглый в центре. Хрусталик прозрачный, подвывих 1 степени (в условиях максимального мидриаза, в нижне-наружном квадранте). Ретрохрусталиковая фиброзная мембрана, имбибированная форменными элементами крови, конгломератами пигмента, содержит единичные новообразованные сосуды. Глазное дно не офтальмоскопируется. При трансиллюминации через фиброзную пленку получено равномерное розовое свечение. При диафаноскопии в нижне-наружном квадранте тень размерами 0,5 см х1,0 см.
По данным ультразвукового исследования OS: выраженный фиброз стекловидного тела с округлыми полостями, зернистым содержимым, субтотальная отслойка сетчатки. ПЗО OD/OS = 22,46/21,42 мм. ВГД OD/ OS=20/23 мм рт. ст. КЧСМ OS «0». Общая и ритмическая ЭРГ слева не регистрировались. Отмечено снижение амплитуды ЗВП OS.
Пациентка была направлена в ФГБУ «Московский НИИ глазных болезней им. Гельмгольца» МЗ РФ, где проводились обследования. Данных за онкопатологию не выявлено. Осенью 2015 г. диагностирована вторичная гипертензия левого глаза - ВГД=31 мм рт. ст., подобрано гипотензивное лечение, достигнута компенсация.
В дальнейшем пациентка наблюдалась в офтальмологических центрах. Состояние фиброза стекловидного тела расценивалось как исход процесса неясного генеза. Аутоиммунных реакций сенсибилизации к антигенам хрусталика и увеаретинальной ткани выявлено не было. Антител к ВПГ 1 и 2 типа, ЦМВ, ВЭБ, токсоплазмозу, токсокарозу, уреаплазме, хламидиям, микоплазме, туберкулезу не обнаружено.
В июне 2016 г. пациентка вновь обратилась на консультацию в клинику, где диагностирована осложненная набухающая катаракта слева. От предложенной энуклеации родители отказались. Проведена факоаспирация осложненной катаракты без имплантации ИОЛ. В ходе операции проведена ревизия УПК, выявлено полное заращение его за счет массивных гониосинехий, которые не удалось разделить. Проведена дополнительно лазерная иридэктомия OS.
Через месяц после хирургического лечения на плановом осмотре объективный статус без отрицательной динамики. На повторном осмотре через 3 месяца выявлено расширение эписклеральных сосудов. Мелкая, неравномерная передняя камера, иридокорнеальный контакт в нижне-наружных отделах. Субатрофия стромы радужки, сглаженность рисунка крипт. ВГД OS - 38 мм рт. ст. Проведена простая энуклеация OS с последующим гистологическим исследованием. На момент проведения энуклеации анамнез заболевания составил 1 год 2 месяца.
Патогистологическое заключение: в области цилиарного тела определялось опухолевидное образование диаметром 1,5 см. Гистологически опухоль представлена доброкачественной МЭ. Отсутствовало экстраокулярное распространение, не выявлено вовлечение в процесс зрительного нерва.
Результаты и обсуждение
В настоящее время, спустя 2,6 года после энуклеации, состояние ребенка удовлетворительное, признаков рецидива опухоли нет. Пациентка продолжает наблюдение у офтальмолога и онколога.
Представленный клинический случай МЭ цилиарного тела встречается крайне редко. Заболевание часто имитирует увеит, осложненную катаракту, вторичную глаукому [1, 2, 4, 10, 11]. Атипичные проявления опухоли, при отсутствии явной «плюс» ткани, являются диагностической проблемой. Тем не менее при первичном обращении пациентки, такие проявления, как подвывих хрусталика, ретролентальная фиброзная пленка с новообразованными сосудами, отсутствие гипотонии при наличии субтотальной отслойки сетчатки являлись признаками внутриглазного новообразования.
Трудности эхографической диагностики были обусловлены особенностями плоскостного роста и структуры ткани опухоли, которая содержала кисты разных размеров.
Рост опухолевой ткани привел к развитию вторичной гипертензии, осложненной катаракты, выраженных изменений рельефа радужки, глубины передний камеры, иридокорнеальному контакту. В большинстве случаев диагноз внутриглазной МЭ устанавливается несвоевременно, часто опухоль, как и в нашем случае, представляет собой патологоанатомическую находку [1, 2].
Диагностика внутриглазной медуллоэпителиомы является трудной задачей. Сочетание таких клинических признаков как плотная ретролентальная мембрана, подвывих хрусталика, вторичная гипертензия позволяют заподозрить внутриглазную опухоль. Выявление при ультразвуковом исследовании гетерогенной ткани, включающей анэхогенные зоны, подтверждает наличие медуллоэпителиомы.
Читайте также:
