Примитивная нейроэктодермальная опухоль глазницы: признаки, гистология, лечение, прогноз
Добавил пользователь Alex Обновлено: 28.01.2026
А примитивная нейроэктодермальная опухоль центральной нервной системы, часто сокращенно PNET, супратенториальный PNET, или CNS-PNET, [1] является одним из 3 типов эмбриональных опухолей центральной нервной системы, определяемых Всемирная организация здоровья (медуллобластома, атипичная тератоидная рабдоидная опухоль, и PNET). [2] Это считается эмбриональной опухолью, потому что она возникает из клеток, частично дифференцированных или еще недифференцированных с рождения. [1] Эти клетки обычно нейроэпителиальные клетки, [1] [2] [3] стволовые клетки суждено превратиться в глия или нейроны. [4] Это может произойти где угодно в пределах спинной мозг и головной мозг и может иметь несколько сайтов происхождения с высокой вероятностью метастаз через спинномозговая жидкость (CSF). [1] [2]
PNET имеет пять подтипов опухолей: нейробластома, ганглионевробластома, медуллоэпителиома, эпендимобластома, а не иначе как PNET. [1] Это похоже на медуллобластома в отношении гистологии, но разные в отношении генетических факторов и локализации опухоли. Это редкое заболевание, чаще всего встречается у детей, [1] [2] приходится от 1,9 до 7% опухолей головного мозга у детей. [2] Симптомы включают эмоциональные, зрительные, моторные и речевые дефекты. [2] Магнитно-резонансная томография (МРТ) и компьютерная томография (CT) используются для диагностики PNET. [2] Хотя универсальный план лечения еще не утвержден, общие стратегии включают: химиотерапия и лучевая терапия для лиц старше 3 лет. [1] [2] Их эффективность, однако, остается спорным. [2] Для удаления опухолевых клеток может быть использована операция. [2] Прогноз заболевания более благоприятен для взрослых, чем для детей, у которых вероятность возникновения последствий опухоли выше. [1] [2]
Важно отметить, что этот классификационный термин был удален из последней классификации ВОЗ опухолей ЦНС от 2016 года. Вместо этого PNET теперь включены в категорию «Эмбриональные опухоли с многослойными розетками» вместе с эпендимобластомой и эмбриональной опухолью с обильным нейропилем и настоящие розетки (ETANTR). [5]
Содержание
Классификация
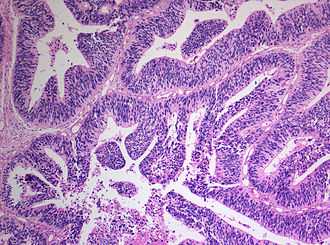
В Всемирная организация здоровья Примитивные нейроэктодермальные опухоли центральной нервной системы были разделены на пять подтипов: нейробластома, ганглионевробластома, медуллоэпителиома, эпендимобластома, а не иначе как PNET. [1] Последний охватывает сети PNET с различными характеристиками, которые еще не были четко определены. [1] Нейробластомы PNETS, которые включают процесс дифференциации клеток в нейроны, [1] [2] в то время как ганглионевробластомы PNET, которые включают ганглиозные клетки. [1]
Медуллоэпителиома, с другой стороны, это опухоли с постоянным делением клеток на эпителий ткань, в которой расположены пучки окончаний нейронов. [1] Такая ткань будет дифференцироваться в форму, аналогичную эмбриональной нервной трубке, также известной как стартовая структура нервной трубки. Центральная нервная система. [1] [2] [3] Медуллоэпителиомы также представляют собой узор, известный как розетки, характеризующийся расположением связки клеток в круглую форму и вокруг центра или нейропиля. [1] Эпендимобластома также имеет розетки, а также более высокую плотность клеток. [1] [3] Он включает в себя процесс дифференцировки в клетки эпендимы. [2] [3]
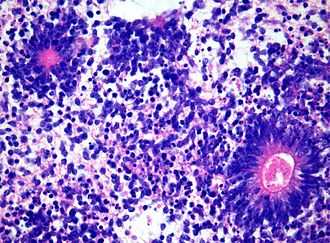
Появились и другие типы классификации, но они еще не утверждены Всемирная организация здоровья. [1] Термин «эмбриональная опухоль с обильным нейропилем и истинными розетками», или ETANTR, был предложен как шестой подтип PNET. [1] Однако все еще неофициальный термин «эмбриональная опухоль с многослойными розетками» (ETMR) используется чаще и включает в себя ETANTRs, медуллоэпителиомы, эпендимобластомы и варианты PNET с наличием розеток и без четко определенной классификации. [3]
PNET против медуллобластомы
Дифференциация примитивной нейроэктодермальной опухоли в центральной нервной системе и медуллобластома недавно. [1] [2] Согласно Всемирная организация здоровья, обе опухоли имеют одинаковую гистологию, но примитивные нейроэктодермальные опухоли возникают за пределами мозжечок. [2] Более того, документально подтверждено, что оба имеют разную генетическую экспрессию и мутации. [1] [2] Еще одно существенное различие между ними - расположение соответствующих кровеносных сосудов в головном мозге. [2] Также было высказано предположение, что PNET влияют главным образом глия клетки пока медуллобластомы влияние в основном нервный поведение, однако такая теория пока не подтверждена. [1] Медуллобластомы встречаются чаще, чем PNET, и составляют 10% всех случаев смерти детей от рака. [2] У них также лучший прогноз: дети, пораженные медуллобластома 5-летняя выживаемость достигается в 70-80% случаев, в то время как дети, пораженные PNET, достигают 5-летней выживаемости менее чем в 50% случаев. [1]
Факторы риска
Уровень PNET не коррелирует с полом, но показывает корреляцию с возрастом. [1] Большинство случаев возникает у детей в возрасте около 5 лет и очень редко у взрослых. [1] Что касается генетических мутаций, конкретный тип изменения гена, который напрямую приводит к этой опухоли, еще не определен. [1] Однако положительная корреляция между людьми с Синдром Ли-Фраумени с мутацией в ген p53 и PNET не поступало. [2] Значительное количество особей с мутациями на rb ген-супрессор опухоли также развили опухоль. [2] Такой ген кодирует белок Rb, ответственный за остановку клеточного цикла в Фаза G1. [6] Другой возможный фактор - мутации в CREB-связывающий белок, функция которого включает активацию транскрипции, [6] но это взаимодействие требует дальнейшего изучения. [2] Также предполагалось, что опухоль может возникнуть в результате облучения черепа. [2]
Диагностика
Большинство детей, у которых развиваются примитивные нейроэктодермальные опухоли, диагностируются в раннем возрасте, обычно в возрасте 3-6,8 лет. [2] Симптомы, присутствующие у пациентов на момент постановки диагноза, включают раздражительное настроение, проблемы со зрением, летаргия, и атаксия. [2] Окружность головы пациента также может увеличиваться в размерах, и они могут быть подвержены судорогам, особенно если они живут менее одного года. [2]
Для определения наличия заболевания можно использовать несколько анализов. Физические осмотры, показывающие отек диска зрительного нерва, дефекты поля зрения, черепные нервы паралич, дисфазия и очаговые неврологические нарушения являются свидетельством возможной опухоли. [2] PNET также можно обнаружить через компьютерная томография (CT) и магнитно-резонансная томография (МРТ). [2] В изображениях, созданных МРТ, нерегулярное увеличение твердой массы будет указывать на наличие опухоли. [3] Однако результаты МРТ обычно неоднозначны при определении наличия этой конкретной опухоли. [2] В Компьютерная томография, наличие PNET будет обозначаться повышенной плотностью и увеличением объема мозга. [2] В компьютерная томография может также показать кальцификация, [3] который присутствует в 41-44% случаев PNET. [2] Поскольку опухоль может воспроизводиться в других частях нервной системы через спинномозговая жидкость (CSF), также может быть проведен анализ CSF. [2] МРТ позвоночника - это четвертый тип анализа, который полезен при исследовании уровня распространения опухоли на спинной мозг. [2]
лечение
Не существует стандартизированной процедуры лечения примитивных нейроэктодермальных опухолей. [2] Общие стратегии включают адаптированные к риску лучевая терапия в сочетании с химиотерапия и спасение стволовых клеток. [1] Пациентам младше 2-3 лет лучевое лечение не применяется, поскольку они находятся в более уязвимой фазе и, следовательно, более подвержены риску развития. [1] Такие обследования, как анализ спинномозговой жидкости и МРТ позвоночника, используются для изучения эффективности лечения в предотвращении метастаз. [2]
Метод удаления опухолевой массы - это хирургическое вмешательство, при котором лучшим результатом будет полная резекция, то есть полное удаление опухоли. [2] Наряду с хирургическим вмешательством можно предпринять несколько мер, которые способствуют безопасности процедуры: исследование мочи, переливание крови и постоянный контроль артериального давления. [2] Возможные проблемы, возникающие в результате операции, включают: кровоизлияние, отек мозга, и гемипарез. [2] МРТ обычно проводятся через 1-2 дня после операции, чтобы проверить количество оставшейся опухоли. [2]
Прогноз
Вероятность рецидива и рецидива примитивных нейроэктодермальных опухолей. метастазировать через спинномозговая жидкость относительно высокий. [3] Результат PNET более положительный, когда человек является взрослым, независимо от возрастных подгрупп, или более старшим ребенком. [2] Менее 50% детей живут более 5 лет, [1] в то время как большинство взрослых живут до 7 лет. [2] Причина, по которой прогноз такой опухоли у детей наихудший, заключается в более высокой вероятности распространения опухоли на остальные части тела. нервная система сквозь спинномозговая жидкость и снова растет. [2] Более того, у детей есть вероятность развития дефицита познавательных процессов, проблем в эндокринная система, и психологические препятствия после болезни. [2] Взрослые же такой склонности не проявляют. [2] Как следствие, 37,7% детей, пораженных опухолью, доживают до 4 лет. [2]
Эффект от таких лечебных стратегий, как химиотерапия и радиационная терапия Прогноз болезни по-прежнему остается спорным, и исследования утверждают, что они либо полезны, либо неэффективны. [2] То же самое верно и для отношения между объемом опухоли, удаленной хирургическим путем, и выживаемостью. [2] Кроме того, такие факторы, как размер опухоли, место происхождения, раса и пол человека, не оказывают никакого влияния на исход болезни. [2] Однако взаимодействие некоторых факторов, таких как локализация опухоли, возраст и стратегия лечения, могут повлиять на прогноз. [2] Например, когда дети младше 3 лет страдают опухолями, возникшими не из шишковидная железа обращаются с химиотерапия, они дают лучшие результаты, чем те, которые страдают от шишковидная железа опухоли и лечить химиотерапия. [2]
НЕЙРОЭКТОДЕРМАЛЬНЫЕ ОПУХОЛИ

Примитивные или зрелые злокачественные нейроэктодермальные новообразования (neuroectodermal tumor) развиваются не из эпителия, как большинство раковых клеток, а из нейроэктодермы — клеточного материала головного или спинного мозга, вегетативной нервной системы и нейроэндокринных образований.
В зависимости от степени дифференциации и очага поражения нейроэктодермальные опухоли разделяются на две обширные группы: примитивные нейроэктодермальные опухоли кости (опухоли Аскина), являющиеся атипичным проявлением саркомы Юинга, и нейроэктодермальные опухоли — новообразования мягких тканей организма, чаще всего поражающие центральную нервную систему, а также головной мозг.
И в том, и в другом случае нейроэктодермальные опухоли относятся к опаснейшим онкологическим заболеваниям, которые чаще всего встречаются в возрасте от 3 до 20 лет, особенно у мальчиков.
Примитивная нейроэктодермальная опухоль фенотипически почти идентична саркоме Юинга. Это рыхлое мягкое злокачественное новообразование светло-серого цвета с обширными участками кровоизлияний и некрозов. Гистологические исследования характеризуют раковые клетки этой группы несколько меньшим содержанием гликогена, а также наличием в продуцированной ткани так называемых розеток Хомера-Райта, сформированных фибриллярным компонентом, протекающим между клетками. Также в опухолевом веществе часто встречаются кисты, возможно появление участков обызвествления и псевдоостеоидных образований — игл как при остеогенной саркоме хотя нейроэктодермальные иглы отличаются более упорядоченной структурой.
Опухоль состоит из незрелых мелких слабодифференциированных, быстро пролиферирующих раковых клеток, отличающихся высокой вирулентностью и способностью к инфильтрации. Наиболее типичные участки локализации опухоли Аскина — ребра, лопатки, грудная стенка, область малого таза, берцовые и бедренные кости. Разрушая кортикальный слой кости, опухоль быстро прорастает в окружающие ее мягкие ткани. Метастазы, в отличие от саркомы Юинга, способны распространяться не только в печени и других органах, но также проникать в сосуды и лимфатические узлы. Возможна инфильтрация в кости черепа, что в большинстве случаев приводит к летальному исходу. Если при саркоме Юинга пятилетняя выживаемость без возникновения рецидива болезни составляет порядка 70%, то при опухоли Аскина — не более 10%.
Среди нейроэктодермальных новообразований, поражающих мягкие ткани (ЦНС и оболочки мозга), выделяют внешне- и внутричерепные. Последние наиболее опасны, так как даже доброкачественные опухоли головного мозга обычно приводят к сдавливанию последнего стенками черепа или перекрытию ликворопроводящих путей, что способно вызвать тяжелейшую гипоксию и интоксикацию мозга. В нейроонкологии известны такие заболевания как астроцитома, глиобластома, эпендимома, медуллобластома, папиллома. Медуллобластома, особенно часто встречающаяся у детей (мальчиков 2-7 лет), — нейроэктодермальная опухоль мозга, образованная наиболее незрелыми клетками — медуллобластами. Продуцированные клетки медуллобластомы мелкие, слабодифференциированные, отличаются высочайшей вирулентностью и способностью к инфильтрации. В ткани опухоли встречаются розетки Хомера-Райта, кисты, а также детрит. Локализуются, как правило, в черве мозжечка, поражая ствол ЦНС, прорастая в мягкий кортикальный слой мозга и распространяясь метастазами по ликворопроводящим путям.
Симптомокомплекс при нейроэктодемальных опухолях характеризуется быстрым и болезненным при пальпации ростом новообразования. Если на начальном этапе развития саркомы боли носят местный и периодический характер, как правило, усиливаясь по ночам, то впоследствии усиливаются и становятся общими, существенно снижая качество жизни больного. Другими характерными симптомами являются лихорадка, тяжелая интоксикация, бессонница на фоне общей анемии, потеря аппетита, снижение массы тела, кашель, одышка. Поражение центральной или вегетативной нервной системы дополняет комплекс нейрологическими симптомами, среди которых повышенная возбудимость, раздражительность, страх.
Прогноз для любого типа нейроэктодермальных новообразований до сегодняшего дня остается крайне неблагоприятным, так как они очень плохо поддаются первичной диагностике. Большинство больных диагностируется чаще всего уже с обширными метастазами. При медуллобластоме мозга у детей прогноз относительно благоприятен, только если опухоль еще не успела диссеминировать. Отсутствие или незначительность метастазов гарантируют пятилетнюю выживаемость для 70% больных, хотя по статистике более чем у половины больных по истечении пятилетнего периода могут наблюдаться рецидивы. Для примитивной костной опухоли Аскина полное излечение на ранней стадии гарантировано в 10-20% случаев, пятилетняя выживаемость — в 62-70%.
Имеющиеся на сегодняшний день методы диагностики нейроэктодермальных опухолей включают рентгенографию, гистологические исследования, биопсию, внутривенное контрастирование, компьютерную и магнитно-резонансную томографию, радиоизотопное сканирование. Эти и другие методы позволяют максимально точно определить первичную локализацию опухоли, обнаружить метастазы в мягких костных тканях, а также в лимфатических сосудах и ликворопроводящих путях. Магнитно-резонансная томография дает возможность наиболее подробно изучить мягкие ткани, костный и головной мозг. С помощью МРТ нередко удается выявить самые мелкие очаги нейроэктодермальных новообразований, что особенно важно для благоприятного прогноза заболевания.
Лечение при нейроэктодермальных опухолях, как и при других онкологических заболеваниях, основано на наиболее рациональных схемах лучевой и полихимиотерапии. Хирургическое вмешательство показано в любом случае, хотя больше половины из них оказываются неоперабельными из-за обширной диссеминации. Считается, что примитивная нейроэктодермальная опухоль, будучи незрелой, плохо поддается воздействию лучевой терапии, однако облучение общей дозой не менее 20-60 Гр в сочетании с тщательно подобранной химиотерапией — единственно возможный способ лечения детей. При опухолях типа медуллобластомы производят интенсивное облучение мозжечкового червя, а также всего головного мозга и канала ЦНС. При костных новообразованиях воздействуют на пораженный участок. В химиотерапии применяют цитостатики, винкористин, актиномицин-Д, циклофосфамид, адриамицин.
Все применяющиеся на сегодняшний день методы лечения онкологических заболеваний даже если и способствуют выздоровлению, сопряжены с различными, в том числе тяжелыми, побочными эффектами, так как, убивая раковые клетки, лучевая и химиотерапия убивает и здоровые. Онкологи всего мира ищут способ, как сделать воздействие противораковой терапии точно направленным. До сего времени это им так и не удалось, однако недавно американскими учеными был найден вирус, который пролиферирует и паразитирует исключительно на измененных раковых клетках, не причиняя абсолютно никакого вреда клеткам здоровым. Неужели долгожданное, столь желанное для всего человечества, универсальное лекарство от рака наконец-то найдено?
Примитивная нейроэктодермальная опухоль глазницы: признаки, гистология, лечение, прогноз
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена Минздрава России
Лекарственная терапия примитивной нейроэктодермальной опухоли
Журнал: Онкология. Журнал им. П.А. Герцена. 2013;2(2): 54‑57
Болотина Л.В., Пайчадзе А.А. Лекарственная терапия примитивной нейроэктодермальной опухоли. Онкология. Журнал им. П.А. Герцена. 2013;2(2):54‑57.
Bolotina LV, Paĭchadze AA. Drug therapy for primitive neuroectodermal tumor. P.A. Herzen Journal of Oncology. 2013;2(2):54‑57. (In Russ.).
Представлен опыт успешного лечения пациента 38 лет по поводу распространенной примитивной нейроэктодермальной опухоли (PNET) мягких тканей шеи слева с метастазами в легких и плевре. В отечественной литературе имеется ограниченное число публикаций по данной тематике. Клиническое наблюдение поможет широкому кругу практикующих онкологов при подозрении на PNET выбрать оптимальную схему диагностических и лечебных мероприятий в каждом индивидуальном случае.
Впервые в самостоятельную нозологическую форму саркома Юинга была выделена в 1921 г. J. Ewing. На ее долю приходится около 10—15% всех первичных злокачественных опухолей скелета. [1]. Понимание морфологии и молекулярно-биологических особенностей течения позволяют рассматривать данную опухоль в качестве одного из представителей большой группы близкородственных злокачественных новообразований, характеризующихся высокоагрессивным потенциалом и одинаковой способностью поражать как кости, так и мягкие ткани [2]. Кроме саркомы Юинга, к данному семейству относятся так называемые периферические примитивные нейроэктодермальные опухоли (PNET). Они представляют собой недифференцированную высокозлокачественную саркому, развивающуюся скорее всего из мигрирующих эмбриональных клеток неврального гребешка (peripheral primitive neuroectodermal tumor — PNET). В литературе PNET описаны в различных органах и системах под разными названиями: периферическая нейробластома, периферическая нейроэпителиома, опухоль Аскина (злокачественная мелкоклеточная торакопульмональная опухоль), нейробластома взрослых).
PNET — болезнь преимущественно молодого возраста. Согласно статистическим данным, пик заболеваемости около 90% больных PNET приходится на вторую и третью декады жизни. Опухоли этой группы значительно чаще регистрируются у представителей европеоидной расы. Мужчины болеют практически в 2 раза чаще, чем женщины.
К настоящему времени не удалось выявить потенциальные этиологические факторы, влияющие на возникновение саркомы Юинга и PNET. В ряде научных работ изучена роль наследственного фактора в патогенезе этих заболеваний. В подавляющем большинстве клеток саркомы Юинга и PNET обнаружены изменения в виде транслокаций [t (11; 22) (q24;q12)] между EWS-геном на хромосоме 22 и FLI1-геном на хромосоме 11 [3].
Все PNET характеризуются наличием отчетливой нейроэктодермальной дифференцировки (экспрессия синаптофизина и нейронспецифической энолазы по данным иммуногистохимического исследования с помощью моно- и поликлональных антител) [4].
По системе TNM экстраскелетная саркома Юинга и примитивная нейроэктодермальная опухоль классифицируются как высокозлокачественные, могут локализоваться практически в любой кости, а также мягких тканях конечностей, головы и туловища. Более характерным для PNET является ретроперитонеальная или интраабдоминальная локализация (20-24% случаев). Реже поражаются висцеральные органы (18-20%). Вовлечение костей и мягких тканей грудной стенки встречается в 6,5% случаев. К неблагоприятным локализациям саркомы Юинга и PNET относятся кости таза, а также мягкие ткани забрюшинного пространства, брюшной полости и полости малого таза [5]. Для всех опухолей семейства PNET характерна ранняя непосредственная инвазия в окружающие мягкие ткани, а также выраженная способность к образованию гематогенных метастазов с преимущественной локализацией в легких. Кроме этого, отдаленные метастазы могут встречаться в костном мозге и других костях, как правило, литического характера, лимфатических узлах средостения и забрюшинного пространства, в центральной нервной системе.
Для лечения больных саркомой Юинга и PNET применяются хирургические, лучевые, лекарственные методы, а также их комбинации. При локализованных формах предпочтительным является проведение неоадъювантной цитостатической терапии с дальнейшим локальным (хирургическим и/или лучевым) воздействием на первичную опухоль и продолжением системной химиотерапии с адъювантной целью. До середины 70-х годов наиболее часто применяемой схемой была комбинация винкристина, циклофосфамида и дактиномицина. Включение в нее препарата доксорубицин привело к достоверному увеличению безрецидивной 5-летней выживаемости в среднем с 45—50% до 60% [6, 7].
В последующем было доказано, что применение этих цитостатиков в альтернирующем режиме с ифосфамидом и этопозидом в течение 12 мес позволяет увеличить показатели безрецидивной выживаемости до 73% [8, 9]. Полученные данные послужили основанием для стандартного назначения этих цитостатиков как в предоперационном, так и в послеоперационном периодах.
При распространенном процессе назначение самых эффективных на сегодняшний день лечебных режимов позволяет достичь 3-летней выживаемости не более 15—20% больным [10, 11]. Стандартным подходом является применение системной полихимиотерапии. С паллиативной целью возможно проведение лучевой терапии на первичный очаг, метастазы в костях, легких.
В отечественной литературе этой опухолью заинтересовались сравнительно недавно.
Больной К., 1969 года рождния, в октябре 2007 г. обратился в МНИОИ им. П.А. Герцена с жалобами на появление объемного образования в мягких тканях шеи слева, вынужденное положение головы, боль тянущего характера в коже волосистой части затылочной области, плохой сон. Из анамнеза известно, что около 3 мес назад, после перенесенного простудного заболевания отметил появление небольшого узлового образования (до 1 см) на задней поверхности шеи слева. Обратился в поликлинику по месту жительства. Проведена физиотерапия. На фоне проводимого лечения образование начало увеличиваться в размере, достигнув 5 см в диаметре. Направлен к онкологу. Через 1 мес самостоятельно обратился в РОНЦ РАМН, где после обследования (ультразвуковое исследование — УЗИ, и спиральная компьютерная томография — СКТ мягких тканей шеи, СКТ органов грудной клетки, сканирование скелета) диагностирована злокачественная опухоль заднебоковой поверхности шеи слева с множественными метастазами в легких и плевре слева. Для дообследования и выработки тактики дальнейшего лечения обратился в МНИОИ им. П.А. Герцена.
При поступлении на заднебоковой поверхности шеи слева у больного определялось умеренно болезненное, плохо смещаемое относительно окружающих тканей узловое образование плотной консистенции размером 10—15 см; кожа над ним гиперемирована. Выполнена трепанобиопсия. По результатам гистологического и иммуногистохимического исследования установлен морфологический диагноз — PNET (рис. 1, на цв. вклейке). Рисунок 1. Примитивная нейроэктодермальная опухоль. а — иммуногистохимическая реакция с антителами к CD 99. ×400. Рисунок 1. Примитивная нейроэктодермальная опухоль. б — окраска гематоксилином и эозином. ×400. Клинический диагноз: нейроэктодермальная опухоль (PNET) заднебоковой поверхности шеи слева T2NХM1 (метастазы в легких и плевре).
Тактика ведения пациента была обсуждена на межотделенческом консилиуме. Рекомендовано проведение полихимиотерапии (ПХТ) в виде чередования комбинации винкристина, доксорубицина, циклофосфамида (VAC) и комбинации ифосфамида с этопозидом (альтернирующий режим): винкристин 1,5 мг/м 2 внутривенно в 1-й день + доксорубицин 75 мг/м 2 внутривенно в 1-й день + циклофосфамид 1200 мг/м 2 внутривенно в 1-й день; через 3—4 нед — ифосфамид 1800 мг/м 2 внутривенно на фоне месны в 1—5-й день + этопозид 100 мг/м 2 внутривенно в 1—5-й день (рис. 2, 3). Рисунок 2. Компьютерные томограммы (а, б) органов грудной клетки до начала химиотерапии (стрелки указывают на метастазы в легких, плевре). Рисунок 3. Компьютерные томограммы мягких тканей шеи до начала химиотерапии: а — аксиальная проекция; б — корональная проекция (стрелки указывают на первичную опухоль в мягких тканях заднебоковой поверхности шеи слева).
Таким образом, приведенное нами клиническое наблюдение свидетельствует о том, что установление точного диагноза примитивной нейроэктодермальной опухоли до начала лечения и назначение адекватной системной терапии позволяет достичь полной регрессии новообразования с последующим длительным контролем над заболеванием. Полагаем, что наш опыт поможет широкому кругу практикующих онкологов при подозрении на PNET выбрать оптимальную схему диагностических и лечебных мероприятий в каждом конкретном случае.
ФГБУ «Ивановский НИИ материнства и детства им. В.Н. Городкова» Минздрава России
Врожденные незрелые тератомы. Описание двух наблюдений
Журнал: Архив патологии. 2021;83(2): 33‑37
Тератомы относятся к группе герминогенно-клеточных опухолей и состоят из тканей, являющихся производными 3 зародышевых листков. Локализация тератом крайне разнообразна. Основной задачей морфологического исследования является диагностика вида тератомы. Согласно классификации ВОЗ, выделяют зрелые и незрелые тератомы (коды ICD-O9080/0 и 9080/3 соответственно). Считается, что прогноз заболевания не зависит от состава зрелых тканевых компонентов. В данной статье приводится описание 2 секционных наблюдений врожденных незрелых тератом у недоношенных живорожденного и мертворожденного, одна из которых эпигнатус — крайне редкая по локализации опухоль. Подчеркнута необходимость тщательного морфологического исследования тератом, определяющего тактику лечения пациентов. Описанные наблюдения демонстрируют важность своевременной пренатальной диагностики и междисциплинарного подхода, а также необходимость четкой маршрутизации пациентов с диагностированными объемными образованиями у плода.
Дата принятия в печать:
Тератомы представляют собой опухоли, относящиеся к группе герминогенно-клеточных (ГКО). Они развиваются из популяции полипотентных клеток, являющихся источником развития тканей эмбриона и всех трех зародышевых листков — экто-, энто- и мезодермы.
Локализация тератом разнообразна и связана с маршрутом миграции первичных зародышевых клеток из желточного мешка в процессе эмбриогенеза [1, 2]. Клетки из энтодермы желточного мешка мигрируют вдоль будущего позвоночника к генитальному гребню в забрюшинном пространстве, где развиваются половые железы [3]. Подавляющее большинство герминогенных новообразований имеет внутригонадную локализацию (в половых железах). Возникновение экстрагонадных (внегонадных) ГКО связывают с нарушением процесса миграции из краниального конца в каудальный, при котором происходит задержка зародышевых клеток на пути следования, по ходу срединной линии. Экстрагонадные опухоли наблюдаются достаточно редко и могут располагаться в средостении, крестцово-копчиковом отделе, забрюшинном пространстве, головном мозге (шишковидном теле, гипофизе). Орофарингеальная тератома, или эпигнатус (epignathus), представляет собой крайне редкую врожденную опухоль, исходящую из ротовой полости, чаще всего из мягкого или твердого неба или из нижней челюсти. В некоторых случаях может наблюдаться интракраниальный рост опухоли с вовлечением мозговых структур. В структуре детской заболеваемости злокачественными новообразованиями на ГКО приходится около 3—4% случаев [3]. Заболеваемость эпигнатусом составляет от 1:35 000 до 1:200 000 живорождений с преобладанием девочек в соотношении 3:1 [4]. Согласно классификации ВОЗ 2014 г. [5], тератомы разделяют на зрелые и незрелые. По Международной классификации онкологических заболеваний (ICD-O) зрелые тератомы имеют код ICD-O 9080/0, незрелые — ICD-O 9080/3. Для определения степени незрелости тератомы используется классификация AFIP (Armed Forces Institute of Pathology), одобренная ВОЗ, согласно которой выделяют: 0 степень — отсутствие незрелого компонента, 1-я — примитивные нейроэпителиальные структуры составляют менее 1 поля зрения (при увеличении ×40) в любом срезе (low-grade), 2-я — незрелый компонент заполняет 1—3 поля зрения ( 40) (high-grade), 3-я — примитивные нейроэпителиальные структуры составляют более 3 полей зрения (×40) в любом срезе (high-grade).
Незрелые тератомы в отличие от других герминогенных опухолей чаще встречаются вне половых органов — в средостении, забрюшинном пространстве, крестцово-копчиковой области. Встречаются и редкие локализации тератом, такие как желудок, печень, мочевой пузырь, предстательная и щитовидная железы. Наиболее характерный компонент незрелых тератом — примитивные нейроэктодермальные структуры с медуллобластными клетками, нейробластами, формирующими псевдорозетки и трубочки, имитирующими развивающуюся нервную трубку, структуры сетчатки (или клетки меланоцитарного нейроэпителия) и сосудистых сплетений. Также компонентами опухоли могут быть незрелая жировая ткань из липобластов, железы кишечного типа, неполноценные печеночные балки, незрелые элементы почек и легких. Для незрелых тератом характерна гиперцеллюлярность и повышенная митотическая активность стромы, напоминающей эмбриональную мезенхиму.
Клинические проявления преимущественно зависят от локализации опухоли. Незрелые тератомы могут метастазировать в регионарные лимфатические узлы, печень, легкие, кости, надпочечники. Прогноз зависит от возраста пациента, гистологического типа и анатомического расположения опухоли. Хотя большинство неонатальных и врожденных экстрагонадных тератом доброкачественные, около 10% имеют злокачественный потенциал [6]. Обычно это незрелые тератомы. При этом наличие незрелого нейроэпителия обычно не является предиктором злокачественного поведения. Последнее в основном ассоциировано с микрофокусами опухоли желточного мешка, которые могут быть либо не замечены патоморфологом при исследовании гистологических препаратов, либо не войти в исследуемый материал. В связи с этим незрелые тератомы относят к потенциально злокачественным опухолям [7]. Прогноз при эпигнатусе чаще всего неблагоприятный и зависит от размеров опухолевого образования и вовлечения витальных структур. Антенатальная гибель плода отмечается почти в половине случаев. Смертность в раннем неонатальном периоде обусловлена нарушением проходимости верхних дыхательных путей.
Приводим 2 наблюдения врожденных незрелых тератом.
Первый случай. Недоношенная девочка, родившаяся у женщины С. 32 лет от вторых преждевременных оперативных родов в срок 28 нед 4 дня. Мать соматически здорова, в анамнезе 1 своевременные роды. Течение настоящей беременности осложнилось маловодием. В 21—22 нед. беременности при проведении скринингового УЗИ у плода обнаружено объемное кистозно-солидное образование в брюшной полости, заподозрена тератома. На пренатальном консилиуме беременность решено пролонгировать с учетом локализации образования, состояния плода и желания пациентки. На 29-й неделе беременности женщина поступила в Ивановский НИИ материнства и детства с жалобами на отсутствие шевелений плода. При выполнении допплерографии выявлены нарушения маточно-плацентарно-плодового кровотока III степени. Также диагностирован патологический тип кардиотокограммы (синусоидальный ритм). Принято решение о досрочном оперативном родоразрешении. Родилась живая недоношенная девочка массой тела 2750 г, длиной 38 см, оценка по шкале Апгар 1—3 балла. Состояние расценено как крайне тяжелое, обусловленное респираторными нарушениями и сердечной недостаточностью. Также у ребенка диагностирована неиммунная водянка плода. Ребенок интубирован, переведен в отделение реанимации. При УЗИ подтверждено наличие объемного образования в брюшной полости, а также отмечено наличие свободной жидкости в брюшной и плевральных полостях. После консультации детского хирурга выполнен лапароцентез, дренировано около 200 мл транссудата. Попытка катетеризации мочевого пузыря оказалась безуспешной. Несмотря на проводимую терапию, ребенок умер спустя 2 суток 18 ч вследствие развития рецидивирующего легочного кровотечения и правостороннего напряженного пневмоторакса.
На вскрытии в брюшной полости обнаружено опухолевидное кистозно-солидное образование, сдавливающее мочеточники и петли толстой и тонкой кишки. Опухоль размерами 85×60×40 мм имела неправильную форму и бугристую поверхность (рис. 1, а). На разрезе множество кист, заполненных слизистым, серозным и геморрагическим содержимым. Солидные участки белесовато-серого и желтоватого цвета, разной степени плотности, с очаговыми кровоизлияниями. Гистологически наиболее значимым компонентом опухоли была незрелая нейроэпителиальная ткань, представленная нервными трубочками и псевдорозетками из темных гиперхромных столбчатых клеток, формирующих многорядные структуры с многочисленными митозами (рис. 1, б), а также формирующиеся сосудистые сплетения (рис. 1, в) и элементы незрелой веретеноклеточной стромы. Энтодермальный компонент представлен многочисленными кистами, выстланными эпителием кишечного типа, встречающимися в 1—2 полях зрения каждого среза (рис. 1, г). Часть опухоли состояла из зрелой мезодермы (хрящевая, гладкомышечная, жировая ткань) и энтодермы (кисты и железистые структуры, выстланные переходным цилиндрическим и призматическим эпителием). Незрелые энтодермальные элементы представлены также тканью печени и почечной бластемой (рис. 1, д, е). Патогистологическое заключение: незрелая тератома забрюшинного пространства (2-я степень незрелости, high-grade).
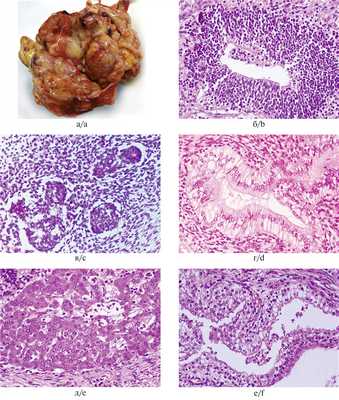
Рис. 1. Тератома забрюшинного пространства.
а — макроскопическая картина опухоли кистозно-солидного строения; б — незрелые элементы нейроэктодермального происхождения; в — формирующиеся сосудистые сплетения; г — кисты, выстланные эпителием кишечного типа; д — неполноценные печеночные балки; е — незрелая ткань почек. Окраска гематоксилином и эозином, ×400.
Второй случай. У женщины К. 28 лет во время второй беременности при скрининговом УЗИ у плода выявлены врожденная аномалия развития челюстно-лицевой области и опухоль ротовой полости кистозно-солидного строения размером 60×42 мм с участками кальцификации (подозрение на эпигнатус). Решение пренатального консилиума: в связи с неблагоприятным прогнозом для плода рекомендовано прервать беременность по медицинским показаниям. В Забайкальском перинатальном центре произведено оперативное родоразрешение при сроке 22 нед с извлечением мертвого плода мужского пола массой 525 г, длиной 21 см. Непосредственной причиной гибели плода послужила внутриутробная гипоксия, возникшая до начала родов. На аутопсии выявлено исходящее из ротовой полости и твердого неба опухолевидное образование размером 70×50×50, массой 53 г, с крупнобугристой поверхностью, кистозно-солидного строения, желтовато-красного цвета, преимущественно студневидной консистенции с участками костно-хрящевой плотности (рис. 2, а). Микроскопически основную часть опухоли составляли поля незрелой нервной ткани (более 3 полей зрения, ×40), представляющие множественные примитивные нейроэктодермальные структуры: нейрональные трубочки, чередующиеся с эпителиальными структурами, примитивными трубочками, фокусами глиальных клеток, нейробластами, ганглиозными клетками, сосудистыми сплетениями (рис. 2, б, в). Кроме того, в структуре опухоли выявлены производные эктодермы в виде элементов кожи с ее придатками. Мезодермальный компонент представлен соединительной, костной, хрящевой, жировой тканью, гладкомышечными волокнами и недифференцированной зародышевой мезенхимой. Энтодермальные компоненты — железистые структуры в виде трубочек и кист, выстланных цилиндрическим или реснитчатым эпителием (рис. 2, г). В паренхиме опухоли определялись крупноочаговые кровоизлияния на фоне выраженного полнокровия сосудов. Патогистологическое заключение: незрелая тератома (3-я степень незрелости, high-grade).
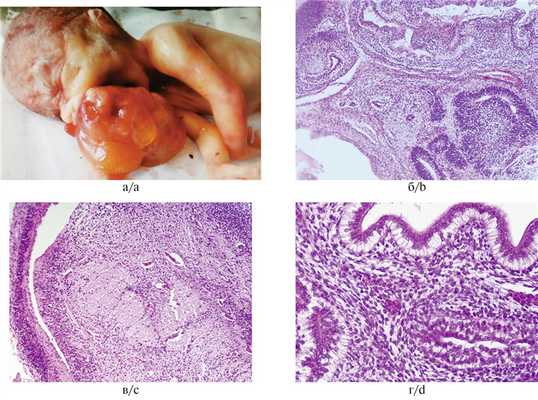
Рис. 2. Эпигнатус.
а — макроскопическая картина мультикистозной опухоли, выступающей изо рта; б — нейрональные структуры в виде трубочек и псевдорозеток; в — фокусы нервной ткани; г — энтодермальные структуры. Окраска гематоксилином и эозином, ×100.
В заключение, опираясь на собственный опыт и данные литературы, следует отметить, что визуализировать тератому практически любой локализации позволяет пренатальная ультразвуковая диагностика состояния плода и при необходимости магнитно-резонансная томография. Вопросы прерывания либо пролонгации беременности и выбора оптимального способа и срока родоразрешения решаются мультидисциплинарно, с учетом локализации, размеров, динамики роста опухоли и гестационного возраста плода. Однако определить степень незрелости опухоли можно лишь при ее тщательном гистологическом исследовании, которое по-прежнему остается золотым стандартом диагностики. Так, в первом наблюдении тератома внегонадной локализации (забрюшинное пространство) при гистологическом исследовании оказалась незрелой опухолью со злокачественным потенциалом, при которой может быть рекомендовано досрочное прерывание беременности. При выявлении эпигнатуса в пренатальном периоде необходимо исключить интракраниальный рост опухоли, который является показанием к прерыванию беременности. При выявлении у плода объемного образования необходима четкая маршрутизация с направлением пациенток в специализированные центры для решения вопроса о дальнейшей тактике и способе родоразрешения. Для лучшего междисциплинарного взаимодействия патоморфологов и клиницистов следует четко понимать терминологию и классификацию.
Сколько живут с опухолью головного мозга
У детей, молодых людей, зрелых и пожилых, независимо от их образа жизни, онкологи выявляют рак головного мозга. Сколько живут с этим заболеванием. Прогноз зависит от гистологического типа опухоли и стадии патологического процесса.

Причины
Прогноз при анапластической астроцитоме головного мозга давать сложно. Выживаемость пациентов не превышает четырёх лет и не увеличивается даже после проведения операции. При стандартном лечении наиболее частой формой опухоли мозга - глиобластомы -выживаемость составляет 4%. Терапия с применением генетически модифицированного полиовируса позволила увеличить трёхлетнюю выживаемость больных этой формой рака до 21%.
Опухоль головного мозга является одним из самых серьезных диагнозов в современной медицине. Данная форма рака одинаково может поразить важный орган, как мужчин, так и женщин, вне зависимости от возраста, поэтому при малейших подозрениях и симптомах, которые могут указывать на это заболевание, следует обращаться к специалистам. Эксперты рекомендую обращать внимание на частые головные боли, проблемы со зрением и координацией, неоднократные потери сознания, изменения в поведении.
Нейрохирурги утверждают, что опухоль головного мозга отражается на психике, душевном состоянии и индивидуальности человека. Доброкачественные новообразования длительное время протекают бессимптомно. Злокачественная опухоль может стремительно развиваться, проявляться агрессивно и быстро привести к летальному исходу.
Причин опухоли головного мозга много:
- Стремительное деление мозговых клеток;
- Отягощённая наследственность;
- Облучение высокими дозами радиации (опухоли могут образовываться спустя 15-20 лет с момента облучения).
Учёные доказали связь черепно-мозговых травм с возможностью отдалённого формирования оболочечно-сосудистых опухолей. Частота новообразований головного мозга находится в прямой зависимости от возраста пациента. До семи лет опухоли головного мозга встречаются значительно чаще, чем в период от 7 и до 14 летнего возраста. После 14 лет частота новообразований мозга снова возрастает. Максимум случаев заболевания приходится на пятидесятилетний возраст. Затем риск образования опухолей мозга уменьшается.
Учёные установили взаимосвязь гистологического типа новообразования и возраста пациента:
- У детей и юношей чаще возникает медуллобластома и астроцитома мозжечка, краниофарингиома и эпендимома, спонгиобластома ствола мозга;
- От 20 и вплоть до 50 лет преимущественно встречаются менингиомы, глиомы больших полушарий, аденомы гипофиза;
- Начиная с 45 лет чаще встречаются глиомы больших полушарий, менингиомы, невриномы слухового нерва, метастатические поражения головного мозга;
- При достижении в структуре опухолей головного мозга преобладают глиобластомы, метастатические опухоли, невриномы.
Внутримозговые новообразования, а также их злокачественные формы в 2-2,3 раза чаще диагностируются у мужчин. Доброкачественные опухоли более характерны для женщин.
Первые симптомы
Большинство новообразований головного мозга длительное время протекает бессимптомно или имеющиеся признаки не позволяют заподозрить наличие объёмного образования в черепной коробке. Онкологи Юсуповской больницы рекомендуют обращаться за специализированной медицинской помощью при наличии следующих симптомов:
- Частых и продолжительных головных болей, нередко появляющихся в местах развития опухоли, сопровождающихся тошнотой и рвотой;
- Потери координации, слабости, неспособности удерживать равновесие;
- Проблем со зрением и повышенной светочувствительности;
- Появлением внезапных приступов, напоминающих эпилептические.
Родственникам следует организовать консультацию нейрохирурга при наличии у пациента странных изменений в привычном поведении, необоснованной агрессии. С походом к специалисту в случае проявления подобных симптомов лучше не затягивать. Если опухоль головного мозга диагностирована на ранней стадии развития, когда симптомы невыраженные, пациенты живут намного дольше. Когда выявлен рак головного мозга 4 степени, прогноз для жизни неутешительный.
Локализация новообразований зачастую обусловливается их биологической природой. В больших полушариях мозга нейрохирурги чаще находят злокачественные глиомы, а в стволе мозга и мозжечке - доброкачественные новообразования.
Классифицируют опухоли головного мозга по степени зрелости их клеток и гистологическому признаку:
- К зрелым опухолям относятся астроцитомы, эпендимомы, олигодендроглиомы;
- Недозрелые новообразования представлены астробластомы, ганглиобластомы, олигодендроглиобластомы;
- В группу совершенно незрелых новообразований входят медуллобластомы, спонгиобластомы, мультиформные опухоли.
Опухоли головного подразделяют на различные группы по гистогенезу (развитию тканей):
- Новообразования нейроэктодермального или глиального ряда (астроцитомы, невриномы, медуллобластомы, пинеобластомы);
- Оболочечно-сосудистые опухоли - развиваются из арахноидэндотелия мозговых оболочек и стенок сосудов (ангиомы, менингиомы, хордомы, фибросаркомы, остеомы);
- Опухоли хиазмально-селлярной локализации - гипофиза, произрастающие из передней доли аденогипофиза, и краниофарингиомы;
- Бидермальные новообразования, которые состоят из элементов-производных двух зародышевых листков;
- Гетеротопические опухоли (хондромы, дермоиды, эпидермоиды, липомы, пиратемы).
В 1% случаев опухолей головного мозга определяются системные новообразования - множественный менингиоматоз, множественный нейрофиброматоз и множественный ангиоретикуломатоз. Метастазы в головной мозг (прогноз неблагоприятный) находят у 5% пациентов, а новообразования, которые врастают в полость черепа (саркомы, гломусные опухоли) - в 1,8% случаев. На данный момент по гистологическим и гистохимическим признакам выделяют порядка 90 различных опухолей нервной системы. По локализации опухоли головного мозга на супратенториальные новообразования, расположенные в передней и средней черепных ямках и субтенториальные, локализованные в задней черепной ямке.
Продолжительность жизни больного опухолью головного мозга определяет степень доброкачественности новообразования и стадии рака головного мозга. При доброкачественных опухолях очень часто онкологи Юсуповской больницы добиваются полного излечения. Продолжительность жизни или срок от окончания терапии до возобновления продолженного роста, которое потребует оперативного лечения, превышает 5 лет. Если характер опухоли полу доброкачественный, можно говорить о продолжительность жизни или временном интервале до продолженного роста новообразования от 3 и до 5 лет.
В случае относительно злокачественного характера опухоли пациенты живут 2-3 года. При злокачественной опухоли средний период жизни от 4 месяцев и до года, хотя известны и исключения. Глиобластома является не только самой агрессивной, но и одной из самых распространённых опухолей мозга. Онкологи выявляют до 52% первичных новообразований в этом органе. Для борьбы с заболеванием применяют химиотерапию, лучевую терапию и хирургическое лечение. При этом пациенты редко живут дольше 15-20 месяцев после установки диагноза.
Особенно опасны «возвращающиеся» опухоли, которые возникают вновь по завершении лечения. В этом случае продолжительность жизни редко превышает год. Терапия с применением генетически модифицированного полиовируса позволила увеличить трехлетнюю выживаемость пациентов с глиобластомой.
Продолжительность жизни зависит и от начала лечения, возможности провести весь возможный комплекс терапевтических процедур. Если лечение начато на ранних стадиях с применением инновационных методик оперативных вмешательств, лучевой и химиотерапии, пятилетняя выживаемость составляет около 80%. В остальных случаях прогноз не превышает 20-30%.
Сколько живут после операции опухоли головного мозга? Оперативные вмешательства существенно улучшают прогноз выживаемости пациентов. Операции наиболее эффективные на начальных стадиях заболевания. При появлении первых симптомов болезни обращайтесь в Юсуповскую больницу.
Когда обращаться к врачу
Выделяются 2 группы симптомов опухоли головного мозга - общемозговые и очаговые. Из общемозговых симптомов у 90% пациентов встречается головная боль. Причиной её возникновения является раздражение опухолью рецепторов мозговых оболочек. По мере роста происходит растяжение стенок желудочков, в дальнейшем - сдавление опухолью ствола мозга и мозговых сосудов. Боль глубинная, распирающая и разрывающая голову пациента. В самом начале заболевания боль приступообразная. По мере прогрессирования новообразования она становится все более длительной, интенсивность нарастает. Боль усиливается ночью и при физической нагрузке - при дефекации, кашле, повороте или кивании головой.
Кроме распространённых головных болей, которые заметны на 3-4 стадиях заболевания и возникают как результат повышения внутричерепного давления, врачи выделяют местные головные боли. Они возникают по причине раздражения мозговой оболочки, внутримозговых и оболочечных сосудов, стенок крупных сосудов головного мозга, появление различных изменений в костях черепа. Местные боли сверлящие, пульсирующие или дёргающие. Местные головные боли при опухоли мозга неврологи выделяют из общего болевого фона механически путём пальпации черепа, лица. Пациентам предлагают напрячься, покашлять или подпрыгнуть. При таких действиях головная боль усиливается.
У 50% пациентов, страдающих опухолью головного мозга, возникает рвота. Она появляется быстро, не связана с приёмом или характером пищи, отрыжкой, тошнотой, болями в области живота. Зачастую рвота сопутствует приступу головной боли, начинаясь на его пике. Иногда рвота возникает утром при повороте головы. Её причина - раздражения рвотного центра при внутричерепной гипертензии. При опухолях продолговатого мозга, IV желудочка, червя мозжечка, полушария мозжечка, рвота является очаговым и ранним симптомом.
В триаду ведущих симптомов опухоли головного мозга входят застойные соски зрительных нервов. Их офтальмологи определяют у 75-81% заболевших опухолью головного мозга. Застойные соски двусторонние, чаще развиваются при субтенториальных опухолях, реже - при супратенториальных.
Головокружение обнаруживается у 50% пациентов с опухолью головного мозга. Оно развивается как по причине застойных явлений в лабиринте, так вследствие поражения вестибулярных стволовых центров, височной или же лобной доли больших полушарий мозга. Головокружение зачастую сопровождается тошнотой. Пациент может потерять равновесие.
У 60-90% пациентов с опухолью головного мозга врачи определяют психические расстройства. Могут иметь место нарушения сознания:
- Оглушённость;
- Кома;
- Аспонтанность;
- Эмоциональные нарушения;
- Расстройства памяти.
К общемозговым симптомам опухоли мозга относят эпилептические припадки. Они возникают при локализации патологического процесса в задней черепной ямке. Местные симптомы зависят от типа опухоли головного мозга. При опухолях лобной доли неврологи определяют следующие местные признаки заболевания:
- Местные односторонние головные боли;
- Эпилептические припадки;
- Психические расстройства (пациент плохо ориентируется в окружающей обстановке, совершает абсолютно немотивированные поступки, неадекватно весел, шутлив).
Ранним проявлением болезни может быть центральный парез лицевого нерва, хватательный рефлекс на противоположной новообразованию стороне. К более поздним симптомам относится первичная атрофия зрительного нерва на стороне опухоли, застойные явления в другом глазу, экзофтальм на стороне, где обнаружена опухоль, менингеальные признаки, лобная атаксия. Если выявлена опухоль лобной доли головного мозга, прогноз зависит от её гистологического строения и стадии заболевания.
Проявлением опухоли теменной доли головного мозга является нарушение чувствительности (сложных форм и глубокого мышечного чувства), схемы тела, астереогноз. При левосторонней локализации опухоли развивается апраксия (нарушение целенаправленных движений и действий при сохранности составляющих их элементарных движений), нарушение способности письма, чтения, счёта, явления амнестической афазии (у пациентов возникают трудности называния предметов). Двигательные расстройства бывают при подкорковой локализации опухоли.
Для опухолей височной области мозга характерны следующие признаки:
- обонятельные и вкусовые расстройства;
- зрительные и слуховые галлюцинации;
- общие эпилептические припадки;
- гемианопсия (двухсторонняя слепота в половине поля зрения) при очагах в задних отделах доли;
- расстройства со стороны тройничного и глазодвигательного нервов.
При левосторонней локализации опухоли у правшей развивается сенсорная афазия (пациент всё слышит, но не может понять содержания слов). Для этой локализации типично раннее появление общемозговых симптомов.
Опухоли мозжечка проявляются головными болями, сопровождающимися рвотой. Важнейшими очаговыми проявлениями являются расстройство координации, мышечная гипотония, нистагм (непроизвольные колебательные движения глаз высокой частоты). При росте опухоли из червя наблюдается двусторонняя симптоматика:
- Преимущественное нарушение статической координации;
- Повышение внутричерепного давления;
- Приступы сильной головной боли и рвота при изменениях положения головы;
- Нарушение дыхания и сердечно-сосудистой деятельности.
Прогноз в этом случае неблагоприятный. Выделяют четыре стадии рака головного мозга. Если опухоль ограничена, говорят о первой стадии болезни. Дальнейшие стадии устанавливаются в зависимости от площади поражения. Четвёртая стадия означает расширенный рак с метастазами. Прогноз крайне неблагоприятный.
Пациенты часто спрашивают: «Что делать, врачи сказали, что у меня опухоль мозга?» При наличии первых симптомов опухоли головного мозга звоните по телефону Юсуповской больницы. Неврологи проведут обследование с помощью современных методов нейровизуализации, установят диагноз, организуют консультацию нейрохирурга. Комплексное лечение улучшает прогноз при раке головного мозга.
Читайте также:
