Принципы оценки результатов рандоминизированных исследований в онкологии
Добавил пользователь Владимир З. Обновлено: 22.01.2026
«Под скринингом подразумевается систематическое использование различных методов исследований с целью выявления лиц, имеющих повышенный риск определенного заболевания, но не обращавшихся пока к врачу и которым можно помочь дальнейшим обследованием или проведением непосредственных профилактических мер».
Европейские рекомендации по борьбе со злокачественными опухолями и их научное обоснование (третья версия).
В Российской Федерации скрининг, как правило, выявляет предопухолевые заболевания и злокачественные новообразования во II - IV стадиях, а эффективность профилактических осмотров оставляет желать лучшего. Пример тому - результаты проведенных профилактических осмотров в 2003 году в сельских районах юга Тюменской области различными методами, в том числе с применением анкетного скрининга (Приказ Департамента здравоохранения Тюменской области от 6 мая 2003 г. № 241 «О профилактических онкологических обследованиях населения Тюменской области с применением анкетного скрининга») и флюорографии (Информационный бюллетень «О состоянии онкологической помощи в Тюменской области за 2003 год» стр. 4). При помощи анкетного скрининга было обследовано 70013 человек, из них выявлено 96 пациентов со злокачественными новообразованиями (0,14% от числа всех обследованных). При помощи флюорографии обследовано 217255 жителей юга Тюменской области, выявлены злокачественные новообразования у 98 пациентов (0,05% от числа всех обследованных). С учетом других видов профосмотра всего было обследовано 492227 человек, из них у 394 выявлены злокачественные новообразования различной локализации, что составляет 0,08% от всего числа обследованных.
Учитывая рекомендации ведущих российских и международных онкологических обществ, а также мизерную эффективность проводимых скрининговых исследований, нельзя говорить о каком-то влиянии этих исследований на раннее выявление онкозаболеваний, а тем более об увеличении продолжительности жизни онкологических больных. Это сравнимо с разговорами об эффективности противопожарной сигнализации в уже сгоревшем доме. Если учитывать Европейские рекомендации по борьбе со злокачественными опухолями (а также рекомендации ВОЗ, Противоракового союза России, Международного противоракового союза (UICC)), то при выявлении рака легкого не только флюорография, но и рентгенография грудной клетки малоэффективны, что является научно обоснованным фактом. Исследования проведенные в Чехии (6364 человека), Англии, США и Японии доказали неэффективность использования рентгенографии легких в сочетании с цитологическим исследованием мокроты для скрининга рака легкого.
Также неэффективно самообследование молочной железы с целью выявления злокачественного новообразования. Рандомизированные исследования, проведенные в Китае с участием 267 тысяч женщин, не выявили разницы в смертности от рака молочной железы между опытной (скрининговой) и контрольной группами. Такие же результаты получили ученые в Англии, Москве и Санкт-Петербурге. Пока под сомнением и применение ПСА (простат-специфический антиген) для скрининга рака предстательной железы.
Тест на ПСА - простой, дешевый, приемлемый, легко доступный и весьма распространенный среди пациентов и врачей. В Милане (Италия), где отсутствует реклама или поощрение скрининга рака предстательной железы, было подсчитано, что 26,9% мужчин в возрасте 40 и более лет без наличия в анамнезе рака и 34% мужчин в возрасте 50 лет и старше обследуются с помощью теста на ПСА в течение двух лет. В России тест на ПСА также получил широкое распространение, а кое-где ПСА-скрининг носит региональный характер. Так в Приморском краевом онкологическом диспансере при обследовании 1060 мужчин с 2000 по 2004 годы с использованием ПСА, ТРУЗИ, биопсии предстательной железы, магнитно-резонансной и компьютерной томографии выявили 530 новых случаев рака предстательной железы. [2] С 2006 года в Тюмени начала работать программа ПСА-скрининга, осуществляемая Тюменским Областным Онкологическим Диспансером под руководством Департамента Здравоохранения администрации Тюменской области.
Многочисленные данные показывают увеличение частоты рака предстательной железы, снижение среднего возраста постановки диагноза, уменьшение распространенных стадий рака предстательной железы, рост умеренно дифференцированных новообразований после внедрения теста на ПСА. Снижение смертности от рака предстательной железы во многих странах начало отмечаться с 1991 года. Можно предположить, что скрининг с использованием теста на ПСА приносит пользу практическому здравоохранению. Однако нельзя заявлять об эффективности скрининга до получения результатов рандомизированных исследований.
В настоящее время научно подтвержденна эффективность следующих скрининговых методов:
- Маммография.Достоверное снижение смертности от рака молочной железы среди женщин старше 50 лет в среднем на 30% получены при исследованиях проведенных в США, Канаде, Швеции и Шотландии. [1]
- Цитология мазка с шейки матки. Достоверное снижение смертности от рака шейки матки в среднем на 80% получены при исследованиях проведенных в Финляндии, Исландии, Швеции, Дании, и Норвегии. [1]
- Тест на скрытую кровь в кале. Достоверное снижение смертности от рака толстой/прямой кишки в среднем на 15% получены при исследованиях, проведенных в штате Миннесота (США), Англии, Финляндии. [1]
Причем необходимо отметить, что в данных рекомендациях эффективные скрининговые методы больше направлены на выявление уже имеющейся опухоли, что на раннее выявление рака и увеличение продолжительности жизни.
Наиболее интересным скрининговым исследованием, проведенным под руководством Европейской ассоциации онкологов, является определение мутаций генов BRCA 1 и 2 у женщин с целью раннего выявления рака молочной железы. Данные белки, по результатам исследований, ответственны за 30 - 40% случаев наследственной предрасположенности к раку молочной железы. По рекомендациям седьмой конференции по адъювантной терапии рака молочной железы (Ст.-Галлен, Швейцария, февраль 2001 года) в данной группе женщин более приемлемы такие профилактические меры как двухсторонняя мастэктомия (снижение риска развития рака молочной железы более чем на 90%) и двухсторонняя овариоэктомия (снижение риска на 50 - 70%). [3] Однако, этическая сторона подобных профилактических мер остается нерешенной.
Большой интерес для современной онкологии представляет использование полимеразной цепной реакции (ПЦР) для определения изменений различных генов в плазме крови с целью раннего выявления злокачественных новообразований различной локализации, профилактики развития рака, а также формирования групп риска для динамического наблюдения.
ООО «Центром молекулярно-генетической диагностики Сабирова А.Х.» был проведен профилактический осмотр с использованием полимеразной цепной реакции 837 работников газодобывающей компании. Были выявлены изменения генов у 358 (42,8%) пациентов. У 18 (2,2%) пациентов при дальнейшем наблюдении диагностированы и морфологически подтверждены в онкологических центрах России различные формы рака на 0 (in situ) и I стадиях опухолевого процесса. Временные интервалы от момента выявления изменений некоторых генов до момента диагностики значимых форм рака были различными и составили от 4 до 15 месяцев. Данные пациенты пролечены в онкологических центрах России. Остальной группе пациентов проведена соответствующая терапия. У 34 удалось добиться ингибирования мутаций. Оставшиеся 295 пациентов внесены в группу риска.
Учитывая высокую эффективность ПЦР-скрининга, его необходимо ввести в повседневную клиническую практику как рутинное исследование, что уже сделано во многих развитых странах.Скрининг злокачественных опухолей и предраков имеет важное значение не только для увеличения продолжительности жизни онкологических больных, но и для уменьшения заболеваемости. В связи с чем разработка новых методов скрининга, в первую очередь молекулярно-генетических, имеет существенное социально-экономическое значение.
Авторы: А.Х.Сабиров, А.М.Нямцу, Е.Л.Нямцу, О.С.Велижанина (ООО «Центр молекулярно-генетической диагностики Сабирова А.Х.»)
Литература
Под редакцией М.И. Давыдова Энциклопедия клинической онкологии. - Москва - 2004.
Л.И. Гурина, С.В. Юдин, Г.А. Алексеева Оптимизация метода целевой диспансеризации мужского населения по профилактике, диагностике и лечению заболеваний предстательной железы. - Владивосток - 2004.
Рекомендации седьмой конференции по адъювантной терапии рака молочной железы (Ст.-Галлен, Швейцария, февраль 2001 года). С.А.Тюляндин, Российский онкологический научный центр Н.Н. Блохина РАМН. - Москва - 2001.
Мари Э. Вуд, Пол А. Банн Секреты гематологии и онкологии - Санкт-Петербург - 2001.
Оценка результатов лечения. RECIST
Эффективность лечения может оцениваться по нескольким критериям. Самыми важными критериями эффективности для пациента являются устранение симптомов болезни и улучшение качества жизни.
Но на основании только этих критериев невозможно объективно и достоверно оценивать распространенность и динамику развития опухолевого процесса. Также нельзя оценить главное: выраженность ответа опухоли на проводимое лечение. Поэтому во время лечения важно использовать лабораторные или инструментальные методы исследования.
К лабораторным методам можно отнести измерение онкомаркеров при некоторых типах опухолей. Нужно понимать, что для большинства опухолей не существует онкомаркеров. Но даже при наличии онкомаркеров, динамика изменений не всегда показывает, есть ли ответ на проводимое лечение.
Инструментальные (они же визуализационные) методы исследования являются первостепенными для объективной оценки эффективности лечения. В случае онкологических заболеваний наиболее применимы компьютерная, магнитно-резонансная и позитронно-эмиссионная томографии (КТ, МРТ, ПЭТ). Другие исследования назначаются реже.
С помощью инструментальных методов можно оценить количество, размеры и иногда даже активность опухолевых очагов в организме человека. Также инструментальные методы позволяют отследить динамику изменений на протяжении времени.
Для достоверной оценки динамики необходимо предоставить врачу-диагносту результаты предыдущих исследований (для этого лучше всегда иметь при себе диски и заключения). Обычно рекомендуется проводить повторные исследования того же типа, что и предыдущие (то есть КТ сравнивать с КТ, а МРТ с МРТ и так далее).
Почему важно оценивать эффективность лечения
В случае онкологии ранних стадий после проведенного радикального лечения оценка результатов проводится в рамках динамического наблюдения. Радикальное лечение подразумевает устранение всех опухолевых клеток из организма при помощи хирургии, лучевой или лекарственной терапии и их комбинаций.
Динамическое наблюдение необходимо для контроля размеров остаточного очага (если он не был удален) или обнаружения рецидивов.
В случае поздних стадий (при наличии отдаленных метастазов), когда основным методом лечения является лекарственная терапия, проведение контрольных обследований важно для определения эффективности подобранных препаратов. Без подобного контроля в большинстве случаев невозможно сказать, отвечает ли опухоль на лечение и получает ли пациент пользу от терапии.
На что влияют результаты оценки эффективности лечения
Результаты оценки эффективности лечения влияют на лечебную тактику. После радикального лечения онкологического заболевания на ранних стадиях важно оценить признаки рецидива. Если признаков рецидива на контрольных обследованиях не обнаруживается, то продолжается наблюдение. Контрольное обследование может выявить новые очаги - значит, речь идет о рецидиве. В таком случае необходимо снова начинать лечение.
При лекарственном лечении метастатического рака результаты контрольных обследований влияют на выбор схемы терапии. При неэффективном лечении схему терапии меняют. При подтверждении эффективности лечения в зависимости от типа опухоли может быть предложено несколько вариантов:
- Продолжение терапии теми же препаратами
- Начало поддерживающей терапии (исключение одного или нескольких препаратов из схемы для уменьшения токсичности лечения)
- Полное прекращение терапии с продолжением только наблюдения за пациентом.
Что такое RECIST?
RECIST - это набор критериев для оценки эффективности лечения при помощи инструментальных методов диагностики. Изначально данные критерии были созданы для оценки эффективности лечения пациентов в рамках клинических исследований, но позднее перешли в клиническую практику.
Набор критериев RECIST применим только для контроля эффективности лекарственной терапии метастатического рака. Оценка проводится на основании измерения размеров нескольких опухолевых очагов (называемых таргетными или целевыми). Последовательно оцениваются результаты инструментальных исследований одного типа.
Категории при оценке RECIST
Могут быть получены следующие результаты оценки эффективности лечения:
- Полный ответ (Complete Response - CR) - исчезновение всех опухолевых очагов.
- Частичный ответ (Partial Response - PR) - уменьшение суммы диаметров очагов не менее чем на 30%.
- Стабилизация заболевания (Stable Disease - SD) - увеличение очагов менее чем на 20% или уменьшение менее чем 30% без появления новых очагов.
- Прогрессирование заболевания (Progressive Disease - PD) - увеличение суммы диаметров основных очагов более чем на 20% или появление новых очагов.
Что такое клинические исследования?
Клинические исследования (КИ) в онкологии - испытания для оценки эффективности и безопасности определенных видов лечения.
КИ проводят по строго соблюдаемому протоколу в соответствии с международным стандартом GCP. Если исследование одобрено, значит, оно безопасно для участников, обеспечивает их защиту и достоверность результатов. Неукоснительное следование правилам необходимо в первую очередь для безопасности пациента. Методология исследований в онкологии учитывает интересы пациента как высший приоритет.
КИ нужны, чтобы расширить знания о заболеваниях, в том числе, онкологических, оценить эффективность и безопасность новых методов диагностики и лечения. Исследуют лекарства, вакцины, другие биологические продукты, хирургические и радиологические манипуляции, новые аппараты для проведения обследования.
На какие этапы и фазы делятся КИ лекарственных средств?
Все препараты до регистрирации проходят несколько фаз исследований.
Доклиническая фаза - препарат исследуется в лаборатории, определяются его потенциальная эффективность и безопасность in vitro (в стекле, то есть “в пробирке”, вне организма человека).
При положительном результате начинается клинический этап, длящийся годами, иногда десятилетиями.
1-я фаза - препарат впервые вводится в организм человека. Основной предмет оценки - его безопасность. Изучаются фармакокинетика и фармакодинамика - распределение препарата в организме. Набор участников на этом этапе обычно небольшой - 20-30 добровольцев. Исследованиями занимается ограниченное количество лечебных учреждений. При успешном прохождении испытаний начинается следующая фаза.
2-я фаза - число участников исследований увеличивают. Цель этапа - оценка побочных действий и эффективности препарата.
3-я фаза - самая сложная и длительная. Ее цель - доказать, что предлагаемый новый метод (препарат, комбинация препаратов) эффективнее, чем стандартная терапия, рекомендуемая в подобных ситуациях. В испытаниях 3-й фазы могут применять плацебо («пустышку») для сравнения действия исследуемого препарата с ситуацией в отсутствии лечения.
Если исследуемый метод лечения успешно проходит все этапы, его регистрируют.
Но и после выхода на рынок препарат продолжают проверять - проводят постмаркетинговый мониторинг для подтверждения, что препарат действительно эффективен, и польза от его применения превышает риски.
Какие бывают клинические исследования?
Открытые - участник и врач знают, какой препарат принимает пациент.
Простые слепые - участники не знают, какой препарат они принимают.
Двойные слепые - ни участник, ни врач не знают, какой препарат принимает пациент.
Рандомизированные - пациенты распределены в группы, сходные по многим параметрам: возрасту, полу, тяжести заболевания участников, и получающие разное лечение, например, стандартное и новое.
Плацебо-контролируемыми - одна группа пациентов получает исследуемый препарат, другая - плацебо, вещество без лечебных свойств.
Эталонный дизайн клинических исследований - рандомизированные контролируемые двойные слепые исследования, когда рандомизация (распределение в группы) осуществляется тайно, и контрольная группа получает плацебо, не отличимое внешне от исследуемого препарата.
В чем смысл участия в исследованиях для пациента?
Клинические исследования спроектированы так, чтобы принести пациенту максимальную пользу.
Участие в испытаниях абсолютно бесплатно - все препараты, процедуры и анализы оплачиваются фармакологической компанией, проводящей исследование.
Пациенты получают лечение и обследование в строго соблюдаемые сроки, что немаловажно, учитывая проблемы с доступностью онкологической помощи.
Участники клинических исследований вносят вклад в развитие онкологической науки, помогая другим пациентам с аналогичным диагнозом в будущем получить эффективное лечение.
Пациенты, попавшие в группу стандартной терапии или плацебо, а не исследуемого препарата, тоже получают бонусы от участия в клиническом исследовании: постоянное наблюдение врача, возможность бесплатно и в срок проходить контрольные обследования. В некоторых исследованиях выполняют кроссовер, когда через определенное время группы экспериментального лечения и контроля меняются ролями.
В чем риски участия в клинических исследованиях?
Дополнительное неудобство: участие в КИ может требовать более частых визитов к врачу и строгого соблюдения расписания обследований.
Как присоединиться к клиническому исследованию?
К сожалению, в России не разработан удобный и актуальный русскоязычный поисковик доступных клинических исследований.
На главной странице можно выбрать страну, город и интересующее заболевание.
В разделе “Contact and locations” можно увидеть города и центры, в которых проводятся исследования, а также контакты, по которым с ними можно связаться.
Пациент может обсудить перспективу участия в КИ с лечащим врачом и попросить помощи в подборе исследования.
КИ занимаются только лечебные учреждения, способные обеспечить соблюдение норм GCP. В России наибольшее количество исследований проводится в крупных федеральных центрах.
Молекулярно-генетические исследования
Термин “молекулярно-генетическое исследование” (МГИ) объединяет ряд медицинских тестов для выявления изменений в генах, хромосомах, белках.
Наш организм состоит из клеток. В большинстве клеток имеется ядро. В ядре - хромосомы. В них - молекулы дезоксирибонуклеиновой кислоты (ДНК). В двойных спиралях этих молекул последовательностью нуклеотидов “зашифрована” вся информация о нашем организме. Отдельные участки ДНК называются гены, они служат “шаблонами” для создания РНК. Каждая РНК несет информацию для синтеза какого-то определенного белка. Если в генетическом аппарате происходит “поломка” (мутация), то работа клетки может нарушится. Сбой в “инструкции” - ДНК - чреват риском развития болезни, например, появления опухоли. Такие нарушения и выявляют молекулярно-генетические исследования.
Выделяют следующие виды тестов:
- Определяющие конкретное изменение в определенном гене.
- Определяющие любые изменения, но только в одном гене.
- Выявляющие изменения в нескольких (ключевых) генах за один тест - мультигенные (панельные).
- Читающие целые хромосомы - хромосомные.
- Читающие основную последовательность ДНК человека, чтобы найти генетические изменения всего генома. (Секвенирование- от англ. sequence последовательность).
- Определяющие, какие гены включены или выключены в разных типах клеток - определение экспрессии генов.
- Изучающие количество или уровень активности белков, воспроизводимых генами - биохимические.
Виды исследований
- Иммуногистохимия (ИГХ): метод выявления белков на поверхности опухолевых клеток при помощи других “помеченных” белков, подходящих к ним «как ключ к замку». (Метод подходит для выявления ALK, PD-L1, NTRK).
- Полимеразная цепная реакция (ПЦР): метод, позволяющий определить наличие конкретной генетической поломки. (Так определяется мутация EGFR, HER2, METex14, BRAF, KRAS).
- Флуоресцентная гибридизация (FISH): метод определения активности гена в опухолевой ткани. (Применяется для определения ALK, ROS1, MET, RET, NTRK).
- Секвенирование нового поколения (NGS): метод «расшифровки» сразу нескольких участков генетического ма териала. Выполнение этого исследования может определить наличие или отсутствие большого количества поломок. (Методом NGS можно определить EGFR, HER2, METex14, BRAF, KRAS, ALK, ROS1, MET, RET, NTRK).
ИГХ, ПЦР, FISH применяются для поиска самых частых генетических нарушений.
NGS может выполняться для поиска более редких мутаций. Более подробно читайте здесь.
Для чего проводится МГИ?
Молекулярно-генетическое исследование выполняют при скрининге новорожденных для выявления генетических нарушений, для подтверждения генетического или хромосомного заболевания в любом возрасте, для определения риска пары иметь ребенка с генетическим заболеванием, для установления родства между людьми и многих других целей.
МГИ в онкологии необходимы для определения:
- Мутаций-мишеней для подбора таргетной терапии.
- Прогноза - определенные мутации связаны с более агрессивными опухолями. Эта информация позволяет врачу с самого начала учесть данный фактор и выбрать подходящее лечение.
- Наследственных мутаций, повышающих риск развития опухоли. При их выявлении врач может порекомендовать начать обследование раньше или проходить его чаще.
- Повышенного риска рака в семье. Родители могут передавать детям генетические мутации, связанные с опухолями. Если у пациента обнаружена мутация, есть шанс, что она присутствует у одного из его родителей, а также у братьев, сестер, детей.
Какие параметры оцениваются?
Рак молочной железы
Для выбора терапии при раке молочной железы обязательно определение:
- рецепторов к эстрогену и прогестерону
- рецептора эпидермального фактора роста 2 типа (human epidermal growth factor 2 receptor - HER2).
Опухоли с рецепторами к эстрогену или прогестерону называются гормонозависимыми. В их лечении используют гормональную терапию для подавления стимулирующего влияния гормонов на опухоль.
Если же опухоль HER2-положительна, то используется таргетная терапия препаратами, блокирующими HER2-рецепторы.
При раке молочной железы важно определить наличие мутаций, так как они встречаются примерно в 1 случае из 10. Наиболее часто мутации, ответственные за наследственные формы рака молочной железы, находятся в генах BRCA1/2 (BReast CAncer - ген рака молочной железы). Выявляется примерно у 3% пациентов с раком молочной железы, чаще у пациентов с тройным негативным раком молочной железы. Другими мутациями, способными повысить риск возникновения опухолей молочной железы являются: PALB2, STK11, CHEK2, CDH1, BRIP1, PTEN.
Рак предстательной железы
Риск возникновения рака простаты увеличивают мутации в генах:
- BRCA1 и BRCA2. Такие мутации у женщин повышают риск развития рака груди и яичников, а у мужчин - рака простаты (особенно изменения в BRCA2).
- MSH2, MSH6, MLH1 и PMS2. Унаследованные изменения любого из этих генов вызывают синдром Линча, сопровождающийся повышенным риском рака прямой кишки, простаты, матки и других видов рака.
- CHEK2, ATM, PALB2. Эти гены помогают исправлять случайные ошибки в ДНК. Мутации в них могут повысить риск рака простаты.
Более подробно читайте здесь.
Рак легкого
В зависимости от гистологического подтипа опухоли легкого используются разные методы исследования.
- В случае обнаружения аденокарциномы определяют: EGFR, ALK, ROS1. Также можно исследовать: BRAF, RET, MET, MEТ14ex, NTRK, HER2. У пациентов молодого возраста и некурящих мутации найти легче.
- При плоскоклеточном раке легкого или аденокарциноме без мутаций определяют наличие белка PD-L. Его определение необходимо для назначения иммунотерапии.
Более подробная информация здесь и здесь.
Меланома
При меланоме кожи для подбора таргетной терапии проводят МГИ на наличие мутации в гене BRAF. При отсутствии мутации проводят тест на мутацию в гене KIT, NRAS и более редко на ALK и ROS1.
Наследственная предрасположенность к меланоме встречается до 10% случаев и может быть связана с мутациями в гене CDKN2A, некоторыми вариантами гена MC1R и мутациями в гене BAP1. Также к наследственным факторам повышенного риска меланомы относится синдром семейных атипичных невусов и меланомы (FAMMM - familial atypical multiple mole and melanoma), связанный с мутацией в гене CDKN2A.
Где и кто проводят МГИ?
В Москве в рамках ОМС МГИ доступно в лабораториях:
В других городах МГИ доступно в лабораториях:
- НМИЦ онкологии имени Н.Н. Петрова (г. Санкт-Петербург)
- Другие лаборатории можно посмотреть на сайте.
Лучше всего выполнять МГИ на образцах опухолевой ткани, полученных в течение года до исследования. Позже исследование может дать ложно-отрицательные результаты.
Как понять, что МГИ необходимо, и к кому обращаться?
При наличии онкологического заболевания для определения показаний к генетическому тестированию, необходимо обратиться к онкологу. ИГХ, ПЦР, FISH доступны в России по ОМС. Исследование NGS в рамках ОМС проводится после получения отрицательного результата ПЦР-теста, во всех остальных случаях исследование проводится платно (цена более 100 тысяч рублей). Направление 057/у-04 на их выполнение дает врач-онколог.
Если нет установленного онкологического заболевания, но в семье были случаи рака молочной железы, кишечника, яичников, предстательной железы, поджелудочной железы или другие, то для оценки показаний к генетическому тестированию нужна консультация врача-генетика.
Как долго ждать результат?
Средний срок ожидания результата молекулярно-генетического исследования составляет около двух недель. Длительность выполнения NGS составляет около 1 месяца.
Результатом МГИ может быть отсутствие мутации (возможно, необходимо провести тестирование другим способом), наличие мутации или выявление мутации с неизвестной клинической значимостью.
Критерии оценки ответа на лечение в нейроонкологии (RANO): применение в клинических исследованиях и в рутинной практике
1) Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина, Москва, Россия;
2) Национальный медицинский исследовательский центр нейрохирургии им. акад. Н.Н. Бурденко, Москва, Россия;
3) МГУ им. М.В. Ломоносова, факультет Фундаментальной Медицины, Москва, Россия
Общие принципы оценки эффективности противоопухолевого лечения в онкологии. Критерии RECIST: На основании различных инструментальных методов оценки опухолевых очагов в общей онкологии для оценки динамики опухоли используют стандартные критерии оценки солидных опухолей RECIST в редакции 2009 г. (RECIST 1.1). Данные критерии используются при компьютерной и магнитно-резонансной томографии, в некоторых случаях - при традиционной рентгенографии. В нейроонкологии в клинических исследованиях и в повседневной клинической практике следует использовать «критерии ответа опухоли на лечение» RANO, а не RECIST и не критерии Macdonald в силу специфики анатомии и биологического поведения опухолей ЦНС, а также особенностей нейровизуалиазции на фоне противоопухолевой лекарственной терапии и современных методов лучевой терапии. Построенная на опыте применения критериев оценки ответа на лечение для солидные опухоли (RECIST) и критериев Макдональда, RANO-HGG включает в число параметров для оценки МРТ в режимах Т1 с контрастным усилением и T2/FLAIR, использование кортикостероидов, а также динамику клинического статуса; определяет понятия «псевдопрогрессирование» и «псевдоответ на лечение», которые стали актуальными в эпоху современных методов лучевой терапии, антиангиогенных и других препаратов, нарушающих проницаемость сосудов. Критерии RANO для глиом низкой степени злокачественности: МР-семиотика cходна с другими процессами, такими как демиелинизация или ишемия; кроме того, медленный характер роста, характерный для этих опухолей, часто затрудняет оценку реакции заболевания, поэтому было введено понятие «малый ответ на лечение» (уменьшение размеров измеряемых очагов на 25-50%). Критерии RANO для метастатического поражения ЦНС (метастазов в головной мозг, МГМ) и критерии RANO для лептоменингеального метастазирования: целью RANO-BM является определение активности потенциальных агентов в отношении МГМ и определение соответствующих конечных точек для клинических испытаний; важно, что эти критерии нужны для более точной оценки событий с интракраниальными очагами, чем в системе RECIST, согласно которой диаметры внутримозговых опухолевых очагов должны суммироваться с диаметрами как основной опухоли, так и отдаленных метастатических очагов. Критерии RANO для иммунотерапии - iRANO: их разработка была обусловлена специфиескими реакциями на иммунотерапию - нарастание зоны отека в головном мозге на фоне начавшейся иммунотерапии; данная система оценок позволяет последовательно и логично отдифференцировать ответ опухоли на лечение от прогрессирования опухоли; лептоменингеальное распространение - опасное и позднее осложнение диссеминированного онкологического процесса с поражением ЦНС, наиболее часто встречающееся при раке молочной железы и раке легких, а также при гематологических злокачественных новообразованиях. Оценка неврологического статуса в нейроонкологии: хотя критерии Macdonald и RANO включают клинический статус в определение прогрессирования, нет никакой количественной меры, чтобы определить это. Для устранения этого ограничения и количественной оценки клинических исходов была создана неврологическая оценка в нейроонкологии (NANO). RANO-кортикостероиды: кортикостероиды в различных дозах являются неотъемлемой частью клинического ведения пациентов с опухолями ЦНС на различных этапах лечения; однако было высказано предположение, согласно которому пациенты, нуждающиеся в стероидах в течение более длительных периодов времени или в более высоких дозах, имеют более короткую общую выживаемость. Кроме того, использование стероидов наряду с возрастом и состоянием работоспособности было связано с более плохим прогнозом. RANO/ПЭТ/КТ: последняя редакция этих рекомендаций RANO/ПЭТ-группы опубликована в 2019 г. В 2017 г. также были опубликованы рекомендации по использованию ПЭТ/КТ с трейсерами-аминокислотами у пациентов с менингиомой; целью работы которой стало обеспечение четких инструкций по техническим параметрам, показаниям к применению и интерпретации полученных результатов ПЖТ/КТ в нейроонкологии с ясным пониманием возможностей и ограничений и в конечном итоге - четких алгоритмов для данного метода обследования.
Введение
Настоящий аналитический обзор посвящен важным вопросам оценки эффективности лечения в нейроонкологии. Оценка эффективности противоопухолевого лечения нужна для выполнения клинических исследований, а также в повседневной практике для определения эффективности проводимого лечения [1]. Для такой оценки необходимо выработать критерии, которые, с одной стороны, были бы просты и удобны в использовании, с другой - как можно более полно учитывали бы особенности опухолей ЦНС в отношении как нейровизуализации, так и их клинического течения (динамика неврологического статуса, использование кортикостероидов, применение иммунотерапии и пр.).
Считается, что исторически первыми в онкологии для клинических исследований были предложены критерии RECIST - Response evaluation criteria in solid tumors (критерии оценки ответа солидных опухолей [на лечение]). Это набор определений и понятий, разработанных для оценки ответа опухоли на проводимое лечение: ответ («response»), стабилизация или прогрессирование («progression»).
Критерии RECIST впервые были опубликованы в феврале 2000 г. Международной кооперацией экспертов, включавшей следующие организации: Европейская Организация по Исследованию и Лечению Рака (European Organisation for Research and Treatment of Cancer, EORTC), Национальный Институт Рака США (National Cancer Institute of the United States, NCI), Группа Клинических Исследований Национального Института Рака Канады (National Cancer Institute of Canada Clinical Trials Group) [2]. На сегодня в подавляющем большинстве клинических исследований в онкологии используют критерии RECIST в редакции 2009 г. [3].
Однако на самом деле и в этой области, вероятно благодаря бурному развитию нейровизуализации в начале 1990-х гг., критерии оценки динамики опухолей ЦНС были предложены намного ранее - в 1990 г. (!). Такими критериями стали предложенные D.R. Macdonald et al. «Response criteria for phase II studies of supratentorial malignant glioma» (Критерии ответа [на лечение] для клинических исследований II фазы в лечении супратенториальной злокачественной глиомы).
При бурном развитии нейроонкологии с массой клинических исследований в начале текущего столетия с улучшением данных нейровизуализации, накоплением новых знаний и опыта в лечении опухолей ЦНС стало ясным, что необходимо выработать новые критерии для оценки эффективности противоопухолевого лечения в нейроонкологии. В 2008 г. была образована группа международных экспертов, включившая специалистов Radiation Therapy Oncology Group, RTOG (Группа Радиологов-Онкологов, США и Канада), а также European Association on Neurooncology (EANO). И в 2009-2010 гг. были опубликованы результаты этой экспертной работы в виде новых критериев RANO (Response Assessment Criteria for Neurooncology). В нашей стране критерии RANO впервые представлены в докторской диссертации Г.Л. Кобякова в 2012 г. [4] и официально рекомендованы в Клинических рекомендациях по лечению опухолей ЦНС Минздрава России в редакциях от 2018 и 2020 гг. [5, 6].
Наш обзор посвящен терминологии и принципам оценки эффективности противоопухолевого лечения в нейроонкологии, согласно критериям RANO.
Общие принципы оценки эффективности противоопухолевого лечения в онкологии. Критерии RECIST
На основании различных инструментальных методов оценки опухолевых очагов в общей онкологии для оценки динамики опухоли используют стандартные критерии оценки солидных опухолей RECIST в редакции 2014 г. (RECIST 1.1). Данные критерии используются при компьютерной и магнитно-резонансной томографии, в некоторых случаях - при традиционной рентгенографии [2, 3, 7].
Ключевые понятия RECIST 1.1 включают:
1. Целевые (таргетные) очаги (не более 5, не более 2 на орган и наиболее воспроизводимые).
2. Измеряемые очаги (размер не менее 10 мм для солидного очага, патологический лимфоузел более 15 мм по короткой оси, литический или смешанный очаг в кости с мягкотканым компонентом не менее 10 мм).
3. Неизмеряемые очаги (остеобластические очаги, поражение мозговых оболочек, плевральный и перикардиальный выпот, асцит и перитонеальные метастазы и лим- фогенный карциноматоз).
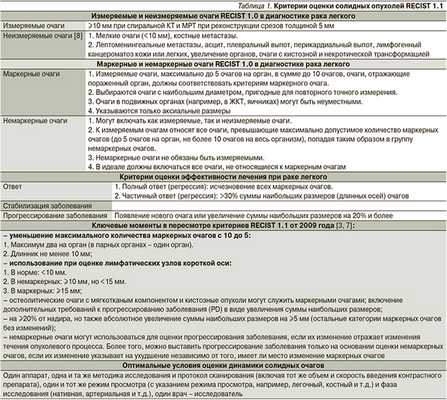
Ключевые правила измерения в RECIST 1.1 включают следующие понятия (табл. 1):
- в солидном очаге оценивается только наибольший диаметр.
- в лимфоузле оценивается только наиболее короткий диаметр.
- в костном очаге оценивается только солидный компонент.
Критерии оценки солидных опухолей RECIST представлены в табл. 1.
В системе RECIST при выполнении КТ-исследования обязательно использование внутривенного контрастирования с единой методикой постконтрастного сканирования. Для сливающихся/разделившихся очагов сравнивается наиболее длинный диаметр общего очага с суммой наиболее длинных размеров новых очагов. Сумма диаметров всех выбранных тарге.
Е.А. Кобякова , Д.Ю. Усачев , О.В. Абсалямова , Н.Г. Кобяков , К.С. Лодыгина , А.Ю. Беляев , Ю.Ю. Трунин , А.С. Беляшова , Г.Л. Кобяков
Читайте также:
