Псевдообструкция толстой кишки (синдром Огилви) - причины, признаки, лечение
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Паралитическая кишечная непроходимость (паралитический илеус) - состояние, обусловленное прогрессирующим снижением тонуса и перистальтики кишечной мускулатуры (парез) до полного паралича кишечника. Парез (паралич) захватывает или все отделы желудочно-кишечного тракта или локализуется в одном его участке (более редко - в нескольких) .
Паралитический илеус не является самостоятельным заболеванием, но может осложнять ряд тяжелых состояний различного генеза и локализации.
Примечание 1
В данную подрубрику включен паралич:
- кишечника;
- ободочной кишки;
- тонкой кишки.
Из данной подрубрики исключены:
- илеус без дополнительных уточнений (K56.7);
- обструктивный илеус без дополнительных уточнений (K56.6);
- непроходимость кишечника у новорожденного, классифицированная в рубрике P76;
- непроходимость двенадцатиперстной кишки (K31.5);
- послеоперационная непроходимость кишечника (K91.3);
- врожденное сужение или стеноз кишечника (Q41-Q42);
- ишемическое сужение кишечника (K55.1);
- мекониевый илеус (E84.1).
Примечание 2. В некоторых источниках данное заболевание описывается как синдром Огилви (острый нетоксический мегаколон, острая псевдообструкция толстой кишки) - внезапное расширение толстой кишки (более редко - всего кишечника) при отсутствии механической обструкции. К настоящему времени термин считается устаревшим.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Формы паралитической кишечной непроходимости:
1. Острая форма.
2. Хроническая форма. Характерные признаки:
- рецидивирующая кишечная непроходимость в течение последних 6 месяцев;
- вздутие живота и/или боль в предыдущие 3 месяца;
- наличие свидетельств непроходимости кишечника при выполнении рентгенографии;
- отсутствие доказательств анатомических /структурных аномалий кишечника.
Этиология и патогенез
Этиология
Заболевания и патологические состояния организма, с которыми может быть связано развитие паралитической кишечной непроходимости:
- перитонит;
- опухоли;
- гематома и воспалительный процесс в забрюшинном пространстве;
- мочекаменная болезнь;
- травма брюшной полости;
- инфаркт миокарда;
- плевропневмония;
- повреждение нервных образований, сопровождающееся недостаточным синтезом ацетилхолина в мионевральных пластинках;
- метаболические нарушения (дефицит калия, магния);
- отравление ядами;
- диабет (диабетический ацидоз).
Условно причины возникновения заболевания можно разделить на:
- инфекционно-токсические;
- метаболические;
- рефлекторные (в том числе "Послеоперационная кишечная непроходимость" - K91.3);
- нейрогенные;
- ишемические (см. "Сосудистые болезни кишечника" - K55).
Патогенез
Выделяют три основные фазы развития паралитической кишечной непроходимости:
1. Под действием этиологической причины происходит угнетение перистальтики и появляется парез кишечника.
2. Возникает кишечный стаз, характеризующийся нарушением эвакуации, скоплением жидкости и газа в просвете кишки, повышением внутрикишечного давления.
3. Появляются и быстро прогрессируют интоксикация, нарушение функционального состояния всех органов и систем организма.
Локализация
В силу анатомических особенностей поражается чаще всего слепая кишка. Такие причины как висцеральная миопатия, нейропатия, коллагеновые сосудистые болезни вызывают динамическую непроходимость как тонкого, так и толстого кишечника.
Эпидемиология
Признак распространенности: Распространено
Соотношение полов(м/ж): 1
В клиниках западных стран паралитическая кишечная непроходимость считается патологией, наиболее соответствующей пожилому возрасту. 39% взрослых пациентов было госпитализировано с клиникой паралитической непроходимости в возрасте старше 75 лет, 33% - в возрасте 60-75 лет, 28% - в возрасте 15-59 лет.
Существенных различий по полу и расе не выявлено.
У детей. Паралитическая непроходимость кишечника является одной из наиболее распространенных причин непроходимости у младенцев и детей. Ее частота превышает частоту инвагинации Инвагинация - впячивание пласта клеток при каком-либо формообразовательном процессе
кишечника, как причины острой непроходимости в этой возрастной группе.
Факторы и группы риска
- прием препаратов, подавляющих моторику кишечника;
- водно-электролитный дисбаланс и другие метаболические нарушения;
- тяжелые инфекционные заболевания;
- тяжелая интеркуррентная Интеркуррентный - привходящий, случайный, осложняющий течение другой болезни.
патология.
Клиническая картина
Клинические критерии диагностики
вздутие живота, запор, рвота, тошнота, субфебрильная лихорадка, уменьшение перистальтики кишечника, тахикардия, тахипноэ, пустая ампула прямой кишки, олигоурия
Cимптомы, течение
Симптоматика паралитической кишечной непроходимости включает:
3. Запор - 40% случаев. Более чем у 40% пациентов может иметь место небольшое отхождение газов или кала уже после развития клиники непроходимости.
Физикальное обследование:
1. Вследствие выраженного вздутия живота наблюдается грудной тип дыхания.
2. Тахикардия.
3. Снижение артериального давления.
4. Сухость во рту.
5. Олигоурия Олигурия - выделение очень малого по сравнению с нормой количества мочи.
.
Чувствительность выявляемых признаков:
1. Вздутие живота - 90-100%. Измерение окружности живота (талии) в динамике, как теста наблюдения и отклика на проводимую консервативную терапию, обсуждается.
2. Умеренная или слабая боль при пальпации - 64%. Боль отмечена как у пациентов с прободением и ишемией кишечника, так и у пациентов с нормальной стенкой кишки.
3. Уменьшение перистальтики, кишечные шумы высокой тональности или отсутствие кишечных шумов - 60%.
4. Нормальная перистальтика при аускультации кишечника или усиление кишечных шумов - 40%.
Диагностика
Диагностика основывается на:
- констатации клинического факта кишечной непроходимости;
- исключении механических причин кишечной непроходимости, а также ишемической непроходимости, послеоперационной непроходимости и непроходимости кишечника у новорожденных (все эти состояния классифицированы в других рубриках);
- установлении вероятной этиологической причины паралитического илеуса.
Методы визуализации подтверждают факт непроходимости кишечника и исключают механические причины.
Инструментальная диагностика
2. УЗИ (чувствительность - 86%) определяет растяжение кишечных петель с горизонтальным уровнем жидкости.
3. КТ с контрастированием (чувствительность и специфичность колеблются в районе 91-98%). Метод позволяет исключить в качестве причины механическую обструкцию и выявить иные заболевания брюшной полости.
КТ - более точный метод при измерении диаметра кишечника, позволяющим лучше оценить состояние слизистой для определения ее воспаления и жизнеспособности. На ишемию и некроз кишки могут указывать утолщение стенки, отек подслизистого слоя и, при прогрессировании некроза, наличие интрамурального газа.
4. Электрокардиография традиционно проводится для дифференциальной диагностики с учетом возраста пациентов.
6. Ирригоскопия (чувствительность - 96%, специфичность - 98%). Признаком паралитического илеуса считается достижение контрастом слепой кишки через 4 часа. Более длительное время или негативный результат считаются признаками механической непроходимости.
Лабораторная диагностика
Специфических лабораторных признаков паралитического илеуса не существует. Тесты направлены на:
- выявление сдвигов в водно-электролитном балансе;
- поиск вероятной этиологической причины (инфекционного агента, маркеров повреждения миокарда, поджелудочной железы и прочего);
- идентификацию лабораторных признаков значительного воспалительного процесса.
Общий анализ крови:
1. Умеренный лейкоцитоз со сдвигом влево (непостоянный признак). Значительный лейкоцитоз в сочетании с признаками раздражения брюшины или выраженной абдоминальной болью свидетельствует о серьезной абдоминальной патологии.
2. Возможна гемоконцентрация Гемоконцентрация - уменьшение содержания воды в крови относительно количества форменных элементов
(вследствие рвоты).
Серологическая и иная диагностика должны быть выполнены при подозрении на инфекционный характер заболевания.
Необходимыми тестами считаются также определение клостридиального токсина в кале, амёб в кале, исследование крови на трипаносомоз Трипаносомоз - заболевание, вызываемое паразитическими простейшими рода Trypanosoma. Двумя основными заболеваниями, которые переносят эти паразиты, являются болезнь Шагаса (южноамериканский трипаносомоз) и сонная болезнь (африканский трипаносомоз)
.
Примечание. Как правило, в лабораторной картине преобладают признаки основной патологии, вызвавшей паралитический илеус.
Дифференциальный диагноз
Осложнения
2. Кровотечение (редко) выявляется в основном при сопутствующей патологии желудочно-кишечного тракта (язвы и пр.) или в терминальной стадии ишемии.
Лечение
Используемые в настоящее время методы лечения динамической кишечной непроходимости включают:
- базовую терапию;
- фармакологическую стимуляцию;
- колоноскопическую декомпрессию;
- хирургическое лечение.
Базовая терапия
1. Декомпрессия путем введения назогастрального зонда и газоотводной трубки.
2. Пауза в питании и оральном приеме жидкости до разрешения клиники непроходимости. При длительности состояния более 2-3 дней может быть рассмотрен вопрос о парентеральном питании (частичном или полном).
Жевательная резинка может являться одной из форм мнимого кормления, которая стимулирует желудочно-кишечную перистальтику. Мета-анализ показал, что жевательная резинка может сократить время консервативной терапии и незначительно уменьшить продолжительность пребывания в стационаре.
3. Лечение основного заболевания.
5. Антибактериальная терапия назначается при установлении инфекционной природы основного заболевания.
6. Данные о влиянии самостоятельного передвижения пациента на скорость восстановления перистальтики противоречивы. Неизменной остается польза ходьбы, как средства профилактики тромбозов, ателектазов и пневмонии.
Возможно придание пациенту колено-локтевого положения для улучшения отхождения газов.
Фармакологическая терапия
1. Прозерин (неостигмин) вводится в/в в течение 3 минут в дозе 2,0-2,5 мг. Доза для детей должна быть скорректирована приблизительно 0,03 мг/кг. Целесообразен мониторинг пульса. В случае появления брадикардии показано введение атропина.
При неэффективности введение можно повторить через 3-4 часа или наладить постоянную инфузию с темпом введения 0,4-0,8 мг/час, длительностью не мене 24 часов.
Эффективность введения неостигмина составляет около 76%.
Противопоказания:
- механическая кишечная непроходимость;
- ишемия или перфорация кишечника;
- беременность;
- неконтролируемые нарушения ритма;
- тяжелый активный бронхоспазм ;
- почечная недостаточность.
2. Прочие препараты. Имеются единичные описания разрешения непроходимости при применении других препаратов:
- эритромицин;
- цизаприд;
- тегасерод;
- рензаприд;
- прукалоприд.
Имеется небольшой опыт в одновременном применении гуанетидина в сочетании с неостигмином.
Малый опыт применения и наличие потенциально опасных осложнений у некоторых препаратов обуславливает тот факт, что такое применение нельзя рекомендовать как рутинное.
3. Единое мнение по поводу применения клизм и осмотических слабительных (полиэтиленгликоль и электролиты) отсутствует.
С одной стороны применение клизм, особенно сифонных, повышает риск развития осложнений и зачастую не дает никакого эффекта.
С другой стороны, некоторые авторы рекомендуют осмотические слабительные и клизмы с фосфатом натрия для лечения ограниченных групп пациентов. По их мнению применение клизм с фосфатом натрия и/или осмотических слабительных, могут сделать последующую колоноскопию с декомпрессией более эффективной.
4. В некоторых случаях разрешение может быть достигнуто применением спинальной или эпидуральной анестезии, блокирующей симпатическую иннервацию, гиперактивность которой может быть одной из причин обструкции.
Колоноскопическая декомпрессия
Нехирургические подходы к механической декомпрессии:
- постановка декомпрессионных трубчатых зондов под рентгенологическим контролем;
- колоноскопия с установкой или без установки декомпрессионной трубки;
- чрескожная (пункционная) цекостомия под комбинированным эндоскопически-радиологическим контролем.
Предпочтительным подходом среди этих инвазивных нехирургических методов лечения является колоноскопическая декомпрессия.
Показания к декомпрессии толстой кишки (начальный метод выбора):
- выраженное расширение толстой кишки (более 10 см);
- значительная длительность (более 3-4 дней) при отсутствии улучшения после 24-48 часов терапии;
- при наличии противопоказаний или при неэффективности фармакологической терапии неостигмином.
Колоноскопию выполняют для предотвращения ишемии кишечника и перфорации. Она противопоказана при явном перитоните или признаках перфорации.
Пациентам с ишемией слизистой оболочки, обнаруженной при колоноскопии, может быть предпринята попытка консервативного ведения, если у них нет перитонеальных симптомов и колоноскопическую декомпрессию удалось успешно выполнить.
Общая клиническая успешность колоноскопической декомпрессии оценивается приблизительно в 88%. В случаях когда декомпрессионную трубку не устанавливали, успешность метода составила только 25%. Однако, следует заметить, что постановка трубки не полностью эффективна в предотвращении осложнений. Частота перфораций кишки при декомпрессионной колоноскопии составляет приблизительно 3%.
Хирургическое лечение
Хирургическое лечение показано пациентам с признаками ишемии толстой кишки или ее перфорации, а также тем, у кого попытки эндоскопического и фармакологического лечения не имели успеха.
Операция выбора - цекостомия, что обуславливается ее высокой эффективностью, небольшими осложнениями и возможностью выполнения под местной анестезией.
В послеоперационном периоде следует избегать препаратов, тормозящих перистальтику желудочно-кишечного тракта. Следует стремиться к замене опиоидов на НПВС с целью обезболивания.
Прогноз
Прогноз при паралитическом илеусе существенно варьируется для различных групп пациентов. Наиболее тяжелый прогноз у пациентов прободением кишечника. Летальность в этой группе колеблется от 18 до 30% (по некоторым данным, в группе с прободением кишечника смертность составляет 30-40%).
Возможны рецидивы паралитического илеуса (хроническая непроходимость), которые у пациентов старше 65 лет могут достигать 20%.
Хроническая интестинальная псевдообструкция
Хроническая интестинальная псевдообструкция - это функциональное заболевание кишечника, которое проявляется рецидивирующими приступами кишечной непроходимости. Патология связана с врожденными аномалиями нервно-мышечного аппарата ЖКТ либо с осложнениями различных аутоиммунных, эндокринных и других болезней. Основные симптомы: хронические боли в животе, расстройства стула, тошнота и рвота. Для диагностики используют рентгенографию ЖКТ, КТ или МРТ брюшной полости, глубокую биопсию стенки кишечника. Лечение включает специальную диету, медикаментозную терапию, хирургические операции.
МКБ-10



Общие сведения
Хроническая интестинальная псевдообструкция (ХИПО) была впервые описана в 1958 году после операционной находки дилатированных петель кишечника при отсутствии анатомических причин непроходимости. Заболевание встречается достаточно редко: около 1 случая на 100 тыс. населения, причем мужчины болеют на 20% чаще. Манифестация ХИПО возможна в любом возрасте - от периода младенчества до пожилого возраста. Основной проблемой патологии является ее тяжелое течение и инвалидизирующий характер, что требует от врачей поиска новых методов диагностики и лечения.

Причины
Первичная интестинальная псевдообструкция связана с врожденными и генетическими нарушениями нервно-мышечных структур. В последние десятилетия была установлена связь заболевания с Х-сцепленными мутациями и митохондриальными аномалиями. Наследственный характер подтверждается наблюдениями семей, представители разных поколений которых имели признаки ХИПО. Намного чаще встречается вторичная псевдообструкция, которая вызвана рядом причин:
- Аутоиммунные заболевания. Нарушения работы ЖКТ характерны для ревматоидного артрита, склеродермии, системной красной волчанки и дерматомиозита. Глютеновая непереносимость (целиакия) способна осложнятся функциональной кишечной непроходимостью.
- Эндокринные болезни. Чаще всего от хронической псевдообструкции страдают больные сахарным диабетом, у которых возникают множественные нейропатии. Распространенной причиной является гипотиреоз, поскольку гормоны щитовидной железы участвуют в регуляции работы внутренних органов.
- Неврологические заболевания. Функциональная непроходимость наблюдается при болезни Паркинсона, болезни Гиршпрунга, митохондриальной нейрогастроинтестинальной энцефалопатии. Причиной патологии могут выступать различные формы миопатии: мышечная дистрофия Дюшена, митохондриальная миопатия.
- Инфекции. Нарушение кишечной моторики наблюдаются у некоторых пациентов с хронической цитомегаловирусной инфекцией, заражением вирусом Эпштейна-Барр. Редким фактором риска ХИПО является американский трипаносомоз, известный как болезнь Шагаса.
- Прием лекарств. Тяжелые расстройства моторики и иннервации кишечных петель возможны при длительном лечении трициклическими антидепрессантами, антихолинергическими препаратами, наркотическими анальгетиками.
Патогенез
Хроническое интестинальная псевдообструкция возникает при мышечных или неврологических нарушениях. Зачастую присутствуют оба механизма. При миопатической патологии наблюдается отсутствие перистальтики на одном или нескольких участках кишечника, что затрудняет продвижение пищевых и каловых масс. Невропатический вариант проявляется некоординированными и неэффективными перистальтическими волнами, которые вызывают кишечную непроходимость.
Замедленная эвакуация кишечного содержимого становится причиной бактериального роста в тонкой кишке, дисбактериоза и расстройств пищеварения. Секреторная диарея вкупе с неполным всасыванием питательных веществ становится причиной белково-энергетической недостаточности, нехватки микроэлементов и витаминов. При длительной колонизации ЖКТ бактериями есть риск транслокации возбудителей с развитием сепсиса.

По механизму нарушения моторики кишечника выделяют миопатическую, невропатическую и смешанную формы. В отдельную категорию относят интестинальную псевдообструкцию, которая связана с поражением интерстициальных клеток Кахаля, отвечающих за ритмическую электрическую активность в ЖКТ. В практической гастроэнтерологии большое значение имеет классификация болезни по причинам развития на 2 группы:
1. Первичная. Возникает у пациентов, не имеющих сопутствующих гастроэнтерологических или других проблем. Связана с поражениями нервов и мышц пищеварительного тракта. Первичную псевдообструкцию подразделяют на 3 подкатегории:
- Врожденная. Выявляется у ребенка с рождения и зачастую обусловлена внутриутробными нарушениями развития пищеварительной трубки.
- Семейная. Связана с определенными генетическими аномалиями, которые передаются по наследству.
- Спорадическая. Причину патологии невозможно определить с помощью доступных медицине диагностических тестов.
2. Вторичная. Характерна для взрослых пациентов, обусловлена различными соматическими и неврологическими нарушениями.
Симптомы
Клинические проявления хронической интестинальной псевдообструкции зависят от формы заболевания, локализации и протяженности пораженных участков кишечника. При первичной ХИПО манифестация происходит в периоде новорожденности (тяжелая форма) либо спустя несколько месяцев жизни ребенка. Развитие вторичной псевдообструкции тесно связано с имеющимися у пациента хроническими заболеваниями, поэтому появление симптоматики возможно в разном возрасте.
Основным признаком болезни являются постоянные симптомы нарушения кишечной проходимости. Они представлены болями и спазмами в животе, вздутием и неприятным бурлением. Более 75% пациентов жалуются на периодическую тошноту и рвоту, особенно после употребления больших количеств пищи. У 40% людей возникают хронические запоры. До 20% больных страдают от периодических поносов с выделением зловонного кала, имеющего зеленоватый оттенок.
При интестинальной псевдообструкции симптоматика беспокоит пациентов длительное время и характеризуется периодическими обострениями. Во время приступа ХИПО больные жалуются на сильнейшие боли по всему животу, задержку стула, многократную рвоту. Такие проявления напоминают механическую кишечную непроходимость, что часто становится причиной диагностических ошибок на первом этапе обследования.
При хронической интестинальной псевдообструкции возможно развитие коморбидных состояний, которые имеют такой же патофизиологический механизм. К ним относят гастропарез, дисфункцию мочевого пузыря и мочевыводящих путей. Пациенты страдают от пузырно-мочеточникового рефлюкса, атонии мочевого пузыря, гидронефроза. У детей растяжение мочевых путей в сочетании с патологиями толстого и тонкого кишечника выделяется в отдельный синдром.
Около 19% взрослых пациентов страдают от комплексного митохондриального синдрома, который дополняется признаками псевдообструкции. У таких больных на фоне тяжелых нарушений перистальтики наблюдается стремительное похудение, авитаминозы, патологии репродуктивной функции. Характерны полиморфные неврологические симптомы, которые представлены периферической полинейропатией, нечеткой координации движений, снижением слуха и зрения.
Чаще всего пациенты с жалобами на сильные боли и задержку стула направляются на консультацию к врачу-хирургу. По показаниям к обследованию привлекают гастроэнтеролога, нутрициолога, уролога. Важное значение имеет определение хронического характера симптомов, исключение «острого живота» - показания к неотложной операции. Чтобы подтвердить интестинальную псевдообструкцию, назначаются следующие методы диагностики:
- Рентгенография ЖКТ. На обзорной рентгенограмме определяется большое количество воздуха во всех отделах кишечника. Исследование с пероральным контрастированием выявляет отсутствие перистальтики (при миопатической форме) или хаотичные перистальтические волны (при нейропатическом варианте), задержку бариевой взвеси в тонкой кишке более 24 часов.
- КТ органов брюшной полости. Компьютерную томографию назначают в сложных диагностических ситуациях, чтобы определить врожденные патологии пищеварительного тракта, выявить участки расширения, визуализировать сопутствующие урологические аномалии. По показаниям диагностика дополняется МРТ.
- Манометрия. Функциональная диагностика направлена на уточнение характера и вида хронической псевдообструкции. Для интестинальной миопатии характерно снижение амплитуды сокращений мышц. При нейропатической форме ХИПО определяются нескоординированные сокращения нормальной силы.
- Биопсия кишечника. Для информативной диагностики необходима глубокая интраоперационная биопсия кишечной стенки. При гистологическом исследовании биоптатов определяют увеличение числа нейронов, кальцификацию базальных ядер, эозинофильную инфильтрацию. Картина дополняется дегенерацией миофибрилл.
Дифференциальная диагностика
ХИПО необходимо отличать от механических причин обструкции ЖКТ, чтобы адекватно выбрать лечебную тактику. Дифференциальными признаками выступают хронический характер заболевания, отсутствие чаш Клойбера на рентгенограмме. Заболевание дифференцируют с тяжелой формой синдрома раздраженного кишечника (СРК), инертной кишкой, маскированной депрессией.

Лечение хронической интестинальной псевдообструкции
Консервативная терапия
Лечение начинается с диетотерапии. Для облегчения гастроинтестинальных симптомов пациентам назначают дробное частое питание, увеличение процента белковой пищи и сокращение потребления жиров. С целью коррекции нутритивных нарушений назначают витаминные и аминокислотные добавки. При невозможности самостоятельного потребления пищи применяют зондовое или парентеральное питание. Обязательно используют симптоматическую медикаментозную терапию:
- Прокинетики. Применяются лекарства из групп аналогов соматостатина, ингибиторов холинэстеразы, агонистов серотониновых рецепторов. Препараты улучшают моторику кишечника, способствуют продвижению пищевых масс, уменьшают интенсивность диспепсических расстройств.
- Антибиотики. Противомикробные медикаменты назначаются при синдроме избыточного бактериального роста (СИБР), чтобы купировать кишечные расстройства и предупредить генерализацию инфекции.
Хирургическое лечение
При декомпенсированной форме ХИПО требуется наложение стомы для беспрепятственного выведения кишечного содержимого, что позволяет уменьшить рвоту и облегчить самочувствие пациентов. При нарушении перистальтики ограниченного сегмента кишки применяют его оперативное удаление с наложением анастомоза. Рефрактерные формы заболевания требуют изолированной или мультивисцеральной трансплантации кишечника.
Прогноз и профилактика
Адекватные терапевтические программы способны уменьшить клинические проявления ХИПО, однако заболевание носит хронический и неизлечимый характер. Расстройства пищеварения составляют преграду для активной жизни пациентов, могут стать причиной инвалидности, поэтому прогноз сомнительный. Профилактика хронической псевдообструкции не разработана из-за разнообразия и неясности этиопатогенетических факторов.
1. Хроническая интестинальная псевдообструкция: трудности диагностики и лечения. Клиническое наблюдение/ И.Е. Хатьков, В.В. Цвиркун, А.И. Парфенов// Терапевтический архив. - 2021. - №8.
2. Хроническая интестинальная псевдообструкция/ А.И. Парфенов, Л.М. Крумс, С.В. Быкова, О.В. Ахмадулина// Терапевтический архив. - 2020. - №12.
3. Этиология и патофизиология хронического интестинального псевдообструктивного синдрома у детей II часть. Первичные и вторичные хронические псевдообструктивные синдромы у детей и взрослых/ Ю.В. Аверьянова, А.Ю. Разумовский, А.Э. Степанова// Российский вестник детской хирургии, анестезиологии и реаниматологии. - 2016. - №2.
Синдром раздражения кишечника (СРК) ( Синдром раздраженного кишечника , СРК )
Синдром раздражения кишечника - нарушение функций кишечника, обусловленное расстройствами нервной регуляции и психоэмоциональными расстройствами. Сопровождается дискомфортом и постоянной ноющей или резкой болью в животе, проходящей после дефекации, чувством неполного опорожнения кишечника. Характерны императивные позывы к дефекации, возможно выделение слизи с калом, изменение частоты стула, консистенции кала. Лабораторная и инструментальная диагностика направлена на исключение органической патологии пищеварительного тракта. Лечение синдрома включает диетотерапию, психотерапию, прием медикаментозных средств.


Синдром раздраженного кишечника - функциональное расстройство работы толстого кишечника, симптомокомплекс, характеризующийся продолжительным (до полугода) и регулярным (более трех дней ежемесячно) появлением боли в животе и нарушения стула (запоры или поносы). СРК - функциональное заболевание, связано с расстройством кишечной перистальтики и переваривания пищи. Это подтверждают нерегулярность жалоб, волнообразное течение без прогрессирования симптоматики. Рецидивы заболевания нередко провоцируются стрессовыми ситуациями. Потерь в весе не отмечается.
Среди населения развитых стран синдром раздраженного кишечника встречается у 5-11% граждан, женщины страдают им в два раза чаще мужчин. Наиболее характерен для возрастной группы 20-45 лет. При выявлении симптоматики СРК после 60 лет необходимо проводить тщательное обследование на предмет органических патологий (дивертикулез, полипоз, рак толстого кишечника). Синдром раздраженного кишечника в этой возрастной группе встречается более чем в полтора раза реже.

Причины СРК
В настоящее время причины возникновения и механизмы развития синдрома раздраженного кишечника изучены недостаточно. Выявлено несколько факторов, оказывающих влияние на функциональное состояние толстого кишечника и способствующие его раздражению. Наиболее явно прослеживается зависимость клинического течения синдрома раздраженного кишечника от психологических факторов, что позволяет предположить психо-нейрогенные механизмы развития заболевания. Отмечено, что в 32-44% случаев возникновению патологии предшествовало сильное психоэмоциональное потрясение, у многих больных СРК отмечаются депрессии, ипохондрия, бессонница, различные фобии и другие невротические расстройства.
Факторы риска
К факторам, способствующим возникновению заболевания, специалисты в области современной проктологии относят:
- физические травмы;
- инфекционные поражения кишечника (дизентерия, эшерихиозы, сальмонеллез и др.) в анамнезе;
- висцеральную гипералгезию (гиперчувствительность кишечника);
- гормональный статус (женщины склонны к возникновению приступов раздраженного кишечника в период менструации);
- генетическая предрасположенность (СРК чаще отмечается у обоих близнецов в однояйцевых парах, чем в двухяйцевых).
Клиническая классификация синдрома раздраженного кишечника основывается на преобладании тех или иных нарушений дефекации: СРК с преобладанием запора, поноса, смешанный и неклассифицируемый.
Симптомы СРК
Основные клинические проявления синдрома раздраженного кишечника: боль и нарушения стула (запоры, диарея, их чередование). Боль в животе при СРК обычно локализуется в нижней части живота, имеет тупой, ноющий характер, но может проявляться и острыми схваткообразными приступами. Болезненность усиливается после приема пищи, после дефекации ослабляются, у женщин приступы часто возникают непосредственно перед и во время менструации. Ночные боли, мешающие сну, нехарактерны.
Изменение характера дефекации может быть как в сторону запоров (стул реже одного раза в 3 дня), так и в виде диареи (частый и жидкий стул). Диарея обычно возникает утром и редко бывает чаще 2-5 раз в день, по ночам обычно не беспокоит. Зачастую имеет место чередование периодов запора с поносами. Кроме того, больные могут отмечать учащение позывов к дефекации, повышенное газообразование. При синдроме раздраженного кишечника общая масса выделяемого за сутки кала обычно не увеличивается.
Среди внекишечных проявлений СРК могут отмечаться тошнота, отрыжка, рвота, боль в правом подреберье, дизурия, головные боли, слабость, зябкость пальцев. Иногда отмечаются нарушения сна, затруднения дыхания, невозможность лежать на левом боку. У многих пациентов синдром раздраженного кишечника сопровождается психоневрологическими расстройствами, сексуальной дисфункцией.
Критерии, указывающие на органический характер проблемы, включают: пожилой возраст пациентов, онкологически осложненный семейный анамнез, лихорадку, изменения внутренних органов при физикальном обследовании (гепато- и спленомегалия), выявление патологических маркеров при лабораторных исследованиях, ничем не обоснованную потерю массы тела, клинические проявления по ночам. Если отмечаются данные признаки, то необходимо заподозрить какое-либо органическое заболевание толстого кишечника и провести всестороннее обследование для его исключения.

Обследование осуществляется специалистом-проктологом. Наряду с клинической симптоматикой и данными физикального обследования, в качестве диагностических мер при подозрении на синдром раздраженного кишечника применяются лабораторные и инструментальные исследования, направленные в первую очередь на исключение или выявления других хронических органических патологий пищеварительного тракта, которые могут проявляться сходной симптоматикой.
Лабораторные методы исследования представлены общим и биохимическим анализом крови, анализом кала на скрытую кровь, стеаторею, копрограммой, бакпосевом кала. Изменения нормальных показателей при лабораторной диагностике говорят об органическом характере патологического процесса, при СРК результаты анализов в норме.
К инструментальным методам диагностики, применимым при синдроме раздраженного кишечника, относятся УЗИ брюшной полости, КТ кишечника, рентгенографические обследования (ирригоскопия, рентгенография кишечника), эндоскопические исследования (колоноскопия, ректороманоскопия). Данные этих исследований также исключают органические поражение кишечника, подтверждая функциональный характер расстройства. Помимо обследования пищеварительного тракта, женщинам показана консультация гинеколога. Пациентам с СРК необходимо проконсультироваться с психотерапевтом.
Лечение СРК
Лечение пациентов с синдромом раздраженного кишечника затруднено в связи с недостаточно изученными механизмами его возникновения и развития. На сегодняшний день единой эффективной схемы лечения не выработано. Стоит отметить высокий процент эффективности плацебо при лечении этой патологии, что говорит о значительной зависимости ее течения от психологических установок. Значительная роль психо-эмоционального фактора подразумевает участие в лечении психотерапевта.
В комплекс терапевтических методик при лечении синдрома раздраженного кишечника входят диетическое питание, активный образ жизни, влияние на эмоциональное состояние пациента и при необходимости лекарственная терапия для облегчения клинической симптоматики. Рекомендации по диетическому питанию различаются в зависимости от преобладания в клинике запоров и поносов, но всем больным с СРК необходимо отказаться от продуктов, раздражающих слизистую оболочку кишечника, способствующих избыточному продуцированию желудочного сока и желчи, а также грубой пищи, способной механически повредить кишечную стенку. При диареях из рациона также удаляются продукты, содержащие растительную клетчатку, рекомендованы вяжущие средства, в то время как при преобладании запоров в рацион вводятся злаки, овощи, хлеб с отрубями и исключаются продукты, затрудняющие прохождение пищевого сока.
Больным с синдромом раздраженного кишечника рекомендована физическая активность, прогулки, аэробика. Нередко назначаются курсы лечебной физкультуры. Кроме того, желательно нормализовать режим дня, отказаться от деятельности, богатой стрессовыми ситуациями, стараться избегать эмоциональных нагрузок и переживания. Рекомендованы психотерапевтические методики.
Для восстановления и нормализации естественной кишечной флоры больным с синдромом раздраженного кишечника прописаны препараты кишечных бактерий. Помимо этого, лекарственные средства могут применяться для облегчения боли (спазмолитические препараты), купирования диареи (лоперамид) и разрешения запора (слабительные средства растительного происхождения - лактулоза). В случае выраженных неврологических симптомах могут назначаться успокоительные средства (валериана, пустырник и др.), легкие снотворные. Показана рефлексотерапия, нейроседативный массаж, электросон, релаксирующие ароматические ванны и фитованны с валерианой. Транквилизаторы, антидепрессанты, нейролептики назначаются только по показаниям после консультации с психиатром.
В качестве профилактических мер для синдрома раздраженного кишечника стоит отметить нормализацию питания и образа жизни (сбалансированная диета, регулярные приемы пищи, избегание гиподинамии, злоупотребления алкоголем, кофе, газированными напитками, острыми и жирными продуктами), поддержание положительной эмоциональной обстановки, прием лекарственных средств строго по показаниям.
Синдром раздраженного кишечника не относится к прогрессирующим заболеваниям, несмотря на продолжительное течение, он не склонен к осложнениям. В 30% случаев имеет место излечение. Иногда проходит самостоятельно в связи с изменением психологической обстановки и её нормализацией. Прогноз благоприятный, излечение во многом зависит от коррекции сопутствующих нервно-психических проявлений.
1. Клинические рекомендации Российской гастроэнтерологической ассоциации, Ассоциации колопроктологов России по диагностике и лечению больных с синдромом раздраженного кишечника / Ивашкин В.Т., Шелыгин Ю.А., Баранская Е.К. и др. - 2014
2. Синдром раздраженного кишечника: от патогенеза и диагностики к лечению / Соловьева Г.А. // Внутренняя медицина - 2007 - №2
3. Синдром раздраженного кишечника: Глобальная перспектива / Практические Рекомендации Всемирной Гастроэнтерологической Организации - 2015
Статьи: Острая толстокишечная псевдообструкция (cиндром Олигви)
Острое расширение толстой кишки может возникать в результате 3-х патологических состояний:
- Токсический мегаколон (осложнение воспалительных заболеваний кишечника или инфекции Clostridium difficile)
- Механическая обструкция
- Острая толстокишечная псевдообструкция
Острая толстокишечная псевдообструкция (синдром Олигви) это патологическое состояние характеризующееся значительной дилатацией слепой кишки и правой половины ободочной кишки (хотя иногда она может простираться и до прямой кишки), в отсутствии анатомических повреждений, препятствующих продвижению кишечного содержимого. Хроническая кишечная псевдообструкция является отдельным патологическим состоянием и здесь не обсуждается.
Этиология
Другой ретроспективный анализ выявил, что у 15 из 48 пациентов были вмешательства на или травмы позвоночника, или ретроперитонеума (52 %), в то время как 20 % перенесли операцию на сердце [3] . Однако острая песевдообструкция является редким осложнением операции на сердце, возникая в послеоперационном периоде, по данным одного исследования, только у 3 из 5,438 пациентов (0,06 %) [4] .
Метаболический дисбаланс (в особенности гипокалиемия, гипокальциемия или гипомагниемия) и введение наркотиков встречается у более 50 % пациентов с синдромом Олигви [3] ; однако эти факторы являются единственным фактором риска только в около 5 % случаев [1] .
Точный механизм развития дилатации толстой кишки у пациентов с острой толстокишечной псевдообструкцией неизвестен. Клиническая связь с ретроперитонеальными опухолями и спинномозговой анестезией указывает на роль автономной нервной системы. Прерывание парасимпатической иннервации на уровне S2-S4 приводит к атонии толстой кишки и функциональной проксимальной обструкции [1,2] . Однако объяснения механизма развития дилатации толстой кишки у пациентов без поражения парасимпатических нервов отсутствуют.
Клиническая картина и диагностика
Острая толстокишечная псевдообструкция чаще встречается у мужчин и у пациентов старше 60 лет [1] . Тошнота, рвота, боль в животе, запор и парадоксальная диарея являются основными, хотя и широко варьирующими, клиническими симптомами [1,3] . Вздутие живота присутствует всегда и может вызывать затруднение дыхания [1,3] . Патогомоничные для острой толстокишечной псевдообструкции физикальные и лабораторные данные отсутствуют. При физикальном обследовании выявляется тимпанит, хотя перистальтика выслушивается у почти 90 % пациентов [1] . Перитонеальные симптомы отсутствуют на ранних стадиях заболевания, их появление свидетельствует о скорой перфорации. Лабораторное обследование может выявить электролитные нарушения (гипокалиемия, гипокальциемия, гипомагниемия), как было упомянуто ранее. Если присутствует лейкоцитоз, то он обусловлен либо основным заболеванием пациента, либо скорой перфорацией, а не псевдообструкцией. Рентгенография брюшной полости выявляет дилатированную толстую кишку, от слепой кишки до селезеночного угла, а иногда и до прямой кишки. Гаустрация остается в норме. Колоноскопия или ирригография с водо-растворимым контрастом необходимы для подтверждения диагноза и исключения обструкции и токсического мегаколона.
Диагноз острой толстокишечной псевдообструкции может быть выставлен только после исключения токсического мегаколона и механической обструкции. Пациенты с механической обструкцией часто жалуются на схваткообразную боль в животе, однако отсутствие боли, в особенности у пожилых или постоперационных больных получающих наркотики не исключает этот диагноз. Так же как в случае с псевдообструкцией, механическая обструкция не имеет патогомоничных физикальных и лабораторных данных. Симптом "отрезания" (отсутствие газа в дистальной части ободочной кишки и прямой кишке) или уровни жидкости в тонкой кишке на рентгенограмме характерны для механической обструкции, но также могут наблюдаться у пациентов с синдромом Олигви. Пациент с токсическим мегаколоном в типичном случае находится в тяжелом состоянии с лихорадкой, тахикардией и напряжением живота. Они часто имеют анамнез кровавой диареи или других симптомов воспалительных заболеваний кишечника. Рентгенограммы могут демонстрировать симптом "отпечатка пальца" из-за наличия подслизистого отека или утолщения кишечной стенки. Острый колит визуализируется при сигмойдоскопии.
Существует небольшое количество контролированных исследований сравнивающих различные варианты лечения острой толстокишечной псевдообструкции. Следовательно, рекомендации базируются в основном на ретроспективных обзорах и собственном опыте. Лечение включает:
- Вспомогательную терапию и удаление возможных производящих факторов (опиаты, антихолинергетики)
- Фармакологические агенты и аккуратные клизмы которые могут стимулировать перистальтику толстой кишки
- Колоноскопическую декомпресию
- Хирургическое лечение
Ежедневное рентгенологическое исследование необходимо для измерения диаметра толстой кишки и выявление пациентов нуждающихся в декомпрессии через колоноскоп или операции [5] . Подавляющее большинство пациентов (85-90 %) выздоравливают при уменьшении диаметра кишки после лечения [1,3] .
Вспомогательная терапия и устранение вызывающих факторов
Вспомогательная терапия включая устранение возможных вызывающих факторов является частью лечения всех пациентов с синдромом Олигви. Оно может включать:
- Лечение обратимого лежащего в основе заболевания как инфекции или застойной сердечной недостаточности
- Внутривенное введение жидкости (прием через рот должен избегаться)
- Коррекция электролитных расстройств (в особенности гипомагниемии, гипокальциемии и гипокалиемии)
- Назогастральный зонд с периодической активной аспирацией
- Газоотводную трубку
- Отмену ненужных лекарственных средств, в особенности наркотиков, седативных препаратов и препаратов с антихоллинергическими побочными эффектами
Фармакотерапия
Мягкие клизмы могут быть назначены пациентам с синдромом Олигви, хотя их назначение было связанно с 5 % уровнем перфорации по данным одного из исследований [1] .
Данных касающихся использования прокинетиков в лечении острой толстокишечной псевдообструкции недостаточно.
Наиболее частым побочным эффектом была легкая/средней тяжести боль в животе, носящая транзиторный характер. Чрезмерная саливация и рвота так же наблюдались у нескольких пациентов. Симптоматическая брадикардия потребовавшая введение атропина наблюдалась у 2-х пациентов. Таким образом, пациенты должны быть проинструктированы о необходимости сохранения положения лежа на спине, по крайней мере, в течение 60 минут после введения препарата, нужен кардиомониторинг и атропин должен быть доступен для введения. Пациенты с брадиаритмиями или получающие бетта-адреноблокаторы являются группой повышенного риска. Клинический опыт указывает, что более низкие дозы препарата (1,5 мг) могут так же быть эффективны и возможно снижают частоту схваткообразных болей в животе, тошноту и рвоту. Из-за описанных выше побочных эффектов неостигмин должен использоваться с осторожностью.
Цизаприд. Описано успешно лечение одного пациента с помощью цизаприда, 10 мг внутривенно каждые 4 часа до 4-х доз, с последующим назначением 10 мг перорально 3 раза в день. [11] . Цизаприд для внутривенного введения не доступен в США, а является ли только пероральное введение препарата эффективным неизвестно. В любом случае использование цизаприда строго ограничено в США из-за его связи с развитием сердечных аритмий.
Декомпрессия
Декомпрессия у пациентов с синдромом Олигви может включать эндоскопическую декомпрессию и установку декомпрессионной трубки или чрезкожную цекостомию. Последняя процедура более инвазивна, требует комбинированного эндоскопического и радиологического подхода и обычно используется только у пациентов с безуспешной эндоскопической декомпрессией [12] .
Об успешной колоноскопической декомпрессии у пациентов с синдромом Олигви было впервые сообщено в 1977 году [13] . Тем не менее, ее роль в лечении таких пациентов остается дискутабельной. Уровень успешной эндоскопической декомпрессии в не контролированных исследованиях варьировала от 69 до 90 % [3,14,15] . Однако при ретроспективном исследовании 25 пациентов с раком, псевдообструкцией и диаметром слепой кишки от 9 до 18 см, у 23 было отмечено разрешение этого состояния без колоноскопии, обычно в течении 48 часов [15] . В дополнение к этому, уровень осложнений и смертности связанный с проведением колоноскопии для лечения синдрома Олигви составляет 3 % и 1 % соответственно [15] . Эти цифры значительно выше, чем у пациентов без псевдообструкции. Нет данных о диаметре толстой кишки, который служит абсолютным показанием для декомпрессии, степень дилатации возможно более важна чем абсолютный диаметр толстой кишки [5,15] . Тем не менее, попытка колоноскопической декомпрессии показана при неэффективности вспомогательной терапии и расширении диаметра кишки до 11-13 см или признаках клинического ухудшения. Обычный способ подготовки к колоноскопии — сбалансированным электролитным раствором, применяться не должен. Водные клизмы могут с осторожностью вводиться через ректальную трубку, но обычно после таких клизм выходит мало стула из-за дилатации и недостаточной пропульсивной активности толстой кишки. Рецидив дилатации, требующий повторной колоноскопической декомпрессии происходит у примерно 40 % пациентов с изначально успешной декомпрессией [14] . Хотя существует недостаточное количество контролированных исследований, установка декомпрессионной трубки с помощью проводника во время колоноскопии может уменьшить необходимость повторной колоноскопической декомпрессии [16] :
- Проводник проводится через канал колоноскопа после достижения дистальной части поперечно-ободочной кишки
- Газ должен быть аспирирован из кишки и проводник оставлен на месте при аккуратном выведении колоноскопа
- Декомпрессионная трубка (с несколькими боковыми отверстиями) может быть проведена по проводнику в дистальную часть поперечно-ободочной кишки
Для минимизирования инсуффляции воздуха все толстая кишка не должна осматриваться и проводник не должен устанавливаться в слепую кишку.
Хирургия
Хирургическое вмешательство редко необходимо. Оно применяется для пациентов с безуспешным консервативным и эндоскопическим лечением или пациентам с признаками перитонита или перфорации. Тип операции зависит от операционной находки. Хирургическая установка цекостомической трубки или правосторонняя гемиколэктомия с наложением первичного анастомоза могут быть выполнены у пациентов без перфорации. У редко встречающихся пациентов с перфорацией тотальная колэктомия, илеостомия или операция Гартмана могут выполняться с целью формирования в дальнейшем илеоректального анастомоза. Операция Гартмана включает резекцию пораженной части кишки, наложение концевой колостомы и создание культи прямой кишки, с восстановлением непрерывности толстой кишки 3 месяца спустя.
Мегаколон, не классифицированный в других рубриках (K59.3)
Мегаколон - состояние, характеризующееся увеличением (значительным расширением, а иногда и удлинением) толстой кишки без признаков механического препятствия.
Более академическое определение (Sheth SG, LaMont JT, 1998) рассматривает ТМ как "потенциально смертельное осложнение острого колита, определяемое как общее или сегментарное необструктивное расширение толстого кишечника не менее 6 см в диаметре в присутствии признаков системной интоксикации".
Примечание
В данную подрубрику включены следующие клинические понятия:
- дилатация толстой кишки;
- токсический мегаколон.
Из данной подрубрики исключены:
- "Мегаколон при болезни Шагаса" - K93.1* (B57.3+);
- "Болезнь Гиршпрунга" - Q43.1;
- "Паралитический илеус" - K56.0.
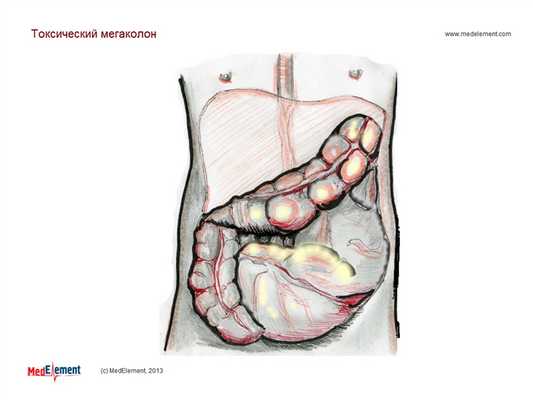
Токсический мегаколон (ТМ) является осложнением воспалительных и/или инфекционных заболеваний толстой кишки.
Воспалительные заболевания кишечника: язвенный колит, болезнь Крона.
Инфекционные агенты, связанные с развитием ТМ: Clostridium difficile, Salmonella, Shigella, Campylobacter, Yersinia, Entamoeba histolytica, Cryptosporidium.
Цитомегаловирус часто ассоциируется с ТМ у пациентов с ВИЧ или СПИДом. Однако пациенты с язвенным колитом (НЯК НЯК - неспецифический язвенный колит
) или болезнью Крона также восприимчивы к цитомегаловирусной инфекции с последующим развитием ТМ.
TM может являться следствием ишемического колита, обструктивного рака толстой кишки, дивертикулита и заворота кишок.
У больных с имеющимся "базовым колитом" TM может быть вызван следующими причинами:
- нарушения электролитного баланса, в том числе гипокалиемия и гипомагниемия;
- прекращение приёма 5-аминосалицилатов или кортикостероидов;
- применение наркотиков или использование антихолинергических средств, которые замедляют моторику толстой кишки.
Имеются описания редких случаев развития ТМ у пациентов с:
- ротавирусной инфекцией;
- инвазивным аспергиллезом;
- радиационным колитом;
- ишемическим колитом;
- неспецифическим колитом, развившимся на фоне химиотерапии;
- коллагеновым колитом;
- синдромом Бехчета (как крайне редкое осложнение).
Возраст: любой возраст
Признак распространенности: Редко
Распространенность. Общую распространенность токсического мегаколона (TM) определить достаточно сложно в связи с полиэтиологичностью заболевания.
В группе пациентов с неспецифическими колитами она составляет от 1% до 5%.
Распространенность колеблется от 0,4% до 3% у пациентов с клостридиальным или иным колитом (кроме неспецифических).
Традиционно TM считался осложнением в первую очередь неспецифического язвенного колита (НЯК), но не болезни Крона (БК). Однако в настоящее время признано, что частота его возникновения при БК сравнима с таковой при НЯК и составляет от 2% до 4%. Отдельные исследователи продолжают аргументированно настаивать на более высокой распространенности ТМ у пациентов с НЯК (10%) по сравнению с пациентами с БК (2,3%).
Заболеваемость TM, как осложнения НЯК и БК, постепенно уменьшается, в результате ранней диагностики тяжелых обострений и улучшения лечения, однако количество случаев ТМ, связанного с иными причинами (инфекции, применение антибактериальной терапии), возрастает.
Пациенты с неспецифическими колитами подвергаются наибольшему риску развития ТМ в начале заболеваний (первые 3-5 лет) или клиника ТМ манифестирует одномоментно с НЯК или БК.
Пол. Нет различий.
Раса. Нет различий.
- пациенты с неспецифическим колитом (БК, НЯК, коллагеновый колит, токсический колит, радиационный колит, неопределенный колит, ишемический колит);
- лекарственный анамнез, например, массивная антибактериальная терапия, химиотерапия, отказ или изменение лекарственной терапии неспецифических колитов;
- инфекционные заболевания;
- СПИД .
высокая лихорадка, значительная тахикардия, обезвоживание, изменение психического статуса, артериальная гипотензия, вздутие живота, боль в животе, спазмы в животе
Пациенты с токсическим мегаколоном (TM), как правило, имеют признаки и симптомы острого колита, которые не поддаются лечению.
Пациенты, возможно, уже имеют диагноз воспалительного заболевания кишечника или колита, вызванного иной причиной, хотя у некоторых пациентов, TM может быть первым признаком развития воспалительных заболеваний кишечника.
Тщательный сбор анамнеза может выявить также недавнее путешествие, применение антибиотиков, химиотерапии или иммуносупрессоров.
На фоне имеющегося неспецифического колита в анамнезе также можно выявить диарею (иногда с примесью крови) в течение недели. Уменьшение диареи, как правило, предшествует развитию ТМ.
Диагностические критерии ТМ (Jalan et al, 1969) включают в себя любые 3 из представленных ниже 4-х главных клинических и лабораторных признаков:
- лихорадка > 38,6 о C;
- тахикардия > 120 ударов в минуту;
- лейкоцитоз (WBC)> 10,5 × 10 9 / л (10500 / мкл);
- анемия.
Другие данные физикального исследования:
2. Боль в животе описывается чаще всего как диффузная или спастическая локальная и может уменьшаться после дефекации.
3. Живот может быть болезненным при пальпации (очагово либо диффузно). Боль может быть менее выраженной у пациентов, принимающих высокие дозы кортикостероидов. Локальная боль, сохраняющаяся или нарастающая, может свидетельствовать о надвигающейся перфорации Перфорация - возникновение сквозного дефекта в стенке полого органа.
кишечника. Симптомы раздражения брюшины и "доскообразный живот" свидетельствуют о перитоните Перитонит - воспаление брюшины.
.
Диагноз подтверждается визуализацией расширенной толстой кишки:
- расширение должно составлять более 6-6,5 см для ректосигмовидной области (общепринятый критерий ТМ - увеличение более 6 см);
- средний диаметр восходящего отдела толстой кишки у пациентов с ТМ должен быть увеличен от 8,8 см до 9,2 см (общепринятый критерий ТМ - увеличение более 8 см);
- возможно расширение слепой кишки до 12 см в диаметре.
Оценка диаметра сопровождается большими трудностями, поэтому для измерения должны быть использованы несколько проекций и участков замера толстого кишечника (особенно при сегментарном расширении).
3. УЗИ. Определены 5 признаков, которые могут быть ассоциированы с ТМ, однако не выяснена до конца их чувствительность и специфичность, что делает метод диагностики ТМ с помощью УЗИ скорее исследовательским, не умаляя его перспектив в будущем.
4. Компьютерная томография. Метод не является обязательным и показан пациентам с неясным диагнозом, с предполагаемым осложненным течением (перфорация, формирование абсцесса) или пациентам с перенесенными операциями на брюшной полости.
Лабораторные критерии диагностики:
- анемия (может маскироваться гемоконцентрацией, возникающей вследствие обезвоживания);
- лейкоцитоз более 10,5х10 9 , хотя пациенты со СПИД могут демонстрировать нейтропению.
Дополнительно должны быть исследованы:
- гемокультура (для диагностики сепсиса);
- кал (фекальные нейтрофилы, клостридиальный токсин, амёбы, ПЦР на цитомегаловирус, скрытая кровь);
- специфические биохимические маркеры НЯК и БК при неустановленном ранее диагнозе.
Необходимо дифференцировать внутри диагноза "токсический мегаколон" (ТМ) этиологически значимую патологию (см. раздел "Этиология и патогенез"). Этиотропная терапия является одним из ключевых факторов успеха.
3. Механическая непроходимость (включая копростаз). В анамнезе могут отмечаться как гиперперистальтика, так и запоры. Выраженная интоксикация на ранних стадиях отсутствует. При ректальном обследовании могут определяться каловые массы и выпадение прямой кишки. При рентгенологическом исследовании выявляется типичный знак в форме фасоли или птичьего клюва.
4. Болезнь Гиршпрунга. Младенческий или младший детский возраст. Вздутие живота, как правило, не сопровождается болью.
При ректальном исследовании отмечаются гипертонус сфинктера и каловые массы, извлечение которых может снять клиническую картину. Рентгенологическое исслдеование и биопсия подтверждают диагноз.
Примечание. Обезвоживание, анемия, электролитный дисбаланс являются не осложнениями, а клиническими критериями заболевания.
Цели лечения токсического мегаколона (ТМ):
1. Снижение компрессии кишечной стенки, чтобы предотвратить перфорацию.
2. Коррекция нарушений водно-электролитного баланса.
3. Лечение интоксикации и провоцирующих заболеваний.
Общие принципы
1. Все пациенты с установленным диагнозом ТМ должны быть подвергнуты немедленной интенсивной терапии.
3. Инфузионная терапия должна быть дополнена специфическим лечением при выявлении причины ТМ (системные ГКС - для НЯК и БК, ванкомицин - для клостридиального колита и т.д.).
4. Стандартно, вне зависимости от этиологии процесса, пациентам с ТМ проводится антибактериальная терапия препаратами широкого спектра действия.
5. Введение ранее назначенных любых средств, негативно влияющих на моторику кишечника (антидиарейные препараты, антихолиэстеразные препараты, опиоиды и пр.), должно быть прекращено.
6. Должна проводиться профилактика против возникновения острых (стрессовых) язв желудка и тромбоза глубоких вен.
Немедикаментозные методы
1. Декомпрессия желудочно-кишечного тракта (назогастральный зонд). В связи с тем, что при лежачем неподвижном положении пациента газы имеют тенденцию скапливаться в определенных отделах кишечника, следует изменять положение тела пациента (выполнение множественных поворотов на оба бока, выполняемых в течение 10 -15 минут каждые 2-3 часа). Возможно также придание пациенту колено-локтевого положения.
2. Питание:
- прием пищи запрещен;
- по показаниям может проводиться парентеральное питание.
Медикаментозная терапия
2. Гемотрансфузии проводятся по абсолютным показаниям (Hb менее 80 г/л). Возможно планируемую гемотрансфузию следует зарезервировать для оперативного вмешательства.
3. Антибактериальная терапия (АБТ). Пациентам с тяжелым ТМ АБТ назначается эмпирически препаратами широкого спектра действия.
Рекомендуемые препараты: метронидазол + гентамицин, ампициллин, пиперациллин-тазобактам (при аллергии на пенициллины возможно использование ципрофлоксацина).
При доказанной клостридиальной инфекции возможно дополнительное применение ванкомицина (через назогастральный зонд).
Длительность АБТ составляет 7-10 дней, для ванкомицина - 10-14 дней.
Предполагаемые дозы для взрослых:
- метронидазол: 15 мг/кг внутривенно в виде разовой дозы, а затем 7,5 мг/кг каждые 6 часов, максимальная разовая доза - 1 г;
- пиперациллин-тазобактам: 3,375 г внутривенно каждые 6 часов;
- ципрофлоксацин 400 мг внутривенно каждые 12 часов.
4. Системные ГКС должны быть использованы для пациентов с неспецифическими неинфекционными колитами. Если пациент уже получал системные ГКС, дозы должны быть увеличены.
Препаратами выбора являются гидрокортизон или метилпреднизолон, вводимые внутривенно:
- гидрокортизона сукцинат натрия - 100 мг внутривенно каждые 6-8 часов;
- метилпреднизолона натрия сукцинат - 12-15 мг внутривенно каждые 6 часов в начале.
Боле высокие дозы, которые могут потребоваться для некоторых пациентов, следует применять после консультаций со специалистами.
Хирургические методы
1. Показания для срочного оперативного вмешательства:
- перфорация кишечника;
- массивное кровотечение (гемотрансфузия более 6-8 доз эритроцитарной массы);
- нарастание интоксикации и прогрессирование дилатации толстой кишки;
- неэффективность терапии в течение 24-48 часов (по мнению некоторых авторов до 72 часов).
3. Другие методы оперативного вмешательства не получили столь широкого распространения и должны применяться при соответствующих показаниях.
Читайте также:
