Пути передачи болевых сигналов. Передача боли в спинном мозге
Добавил пользователь Alex Обновлено: 01.02.2026
Клиника комплексного лечения боли, Эпплтон, Висконсин, США
Стимуляция спинного мозга в лечении центрального болевого синдрома
Журнал: Вестник травматологии и ортопедии им Н.Н. Приорова. 2018;(4): 99‑103
Центральный болевой синдром (ЦБС) является неврологическим расстройством, вызванным повреждением или дисфункцией центральной нервной системы. В его лечении используются как консервативные, так и оперативные методы, однако их эффективность в подавляющем большинстве случаев оказывается довольно низкой. Представлено описание клинического наблюдения пациента 60 лет с повреждением спинного мозга на уровне позвонка Th10 вследствие автомобильной аварии, произошедшей за 44 года до лечения в нашей клинике, фантомными болями, возникшими после двусторонней ампутации выше колена вследствие облитерирующего атеросклероза сосудов нижних конечностей. Ввиду неэффективности консервативного лечения было принято решение о проведении стимуляции спинного мозга. Наличие выраженных послеоперационных изменений в области повреждения спинного мозга осложнило чрескожное введение тестовых электродов на уровне L1-L2 и Th12-L1. Удалось ввести электроды на уровне Th7-Th8, установить их на уровне Th5-Th7. На фоне постоянной нейростимуляции у пациента купировались боли в крестце, в области тазобедренных суставов — и фантомные боли, исчезла потребность в болеутоляющих препаратах. Стимуляция спинного мозга может служить альтернативой в лечении пациентов с некупируемым ЦБС.
Введение. Развитие хронической боли, в частности центрального болевого синдрома (ЦБС), связано с перенесенными травмами или хирургическими вмешательствами, в том числе ортопедическими. Согласно определению Международной ассоциации по изучению боли, ЦБС может быть вызван поражением или дисфункцией центральной нервной системы на уровне головного мозга, ствола головного мозга и спинного мозга. Появление ЦБС вследствие дисфункции спинного мозга чаще всего обусловлено его травматическим повреждением, например в результате дорожно-транспортного происшествия. При этом частота его развития варьирует в пределах от 25 до 85%. Боль при ЦБС может начаться в течение нескольких дней после воздействия этиологического фактора или же могут пройти годы, прежде чем появится болевой синдром, что наблюдают у пациентов, перенесших инсульт [1].
ЦБС является неврологическим состоянием, при котором запускается процесс сенсибилизации, что может быть следствием продолжающегося поступления сигналов с периферии или вызываться определенными процессами в головном мозге, а также быть генетически детерминированным. Это приводит к таким клиническим проявлениям, как гиперпатия, гипералгезия и аллодиния. Считается, что ЦБС появляется из-за нарушения проведения болевого сигнала в проводящей системе спинного мозга или вследствие нарушения обработки болевых сигналов в головном мозге [1]. Боль может локализоваться в какой-либо части тела или носить генерализованый характер, при этом она постоянная, трудно контролируемая, изнурительная, угнетающе воздействующая на пациента [1]. Боль при ЦБС чаще всего имеет характеристики обжигающе горячей, реже — стреляющей и колющей (иногда все вместе). Обжигающая боль усиливается в ответ на холод, при легком прикосновении, но не изменяется при сильном давлении [2].
ЦБС, связанный с повреждением спинного мозга, может приводить к дисфункции вегетативной нервной системы, недержанию мочи, пролежням, отекам нижних конечностей, легочным осложнениям, автономной дисрефлексии, спастичности, сексуальной дисфункции.
В развитии фантомного болевого синдрома участвуют как центральные, так и периферические механизмы [3]. При ампутации, сопровождающейся пересечением периферических нервов, нарушается нормальное проведение афферентных импульсов в спинной мозг. Известно, что до 80% пациентов после ампутаций жалуются на фантомные боли.
Лечение ЦБС включает консервативное, медикаментозное лечение, различные блокады на уровне спинного мозга и периферических нервов, хирургические методики и психотерапию. Для восстановления оптимального функционирования пациента с ЦБС очень важна реабилитация. При хронической боли у пациентов часто развивается депрессия, что делает необходимым вовлечение в лечебный процесс психолога и психиатра [1]. Фармакологическая терапия включает в себя трициклические антидепрессанты (амитриптилин, нортриптилин), противоэпилептические препараты (карбамазепин, габапентин), антиаритмические средства, применяемые для лечения нейропатических болевых синдромов (мексилетин). Опиоидные средства используются очень редко и никогда в качестве препаратов первого выбора.
При выраженной трудноконтролируемой боли могут использоваться хирургические методики: пересечение нервов и проводящих путей спинного мозга. К сожалению, эти методики дают кратковременный эффект, у 60-80% пациентов боль рецидивирует. Проведенные исследования показали отсутствие положительных результатов лечения ЦБС при применении указанных выше хирургических способов лечения [4].
Стимуляция моторной коры головного мозга используется в лечении многих хронических болевых синдромов, включая ЦБС, связанный с повреждением спинного мозга, фантомную боль, постгерпетическую невралгию и комплексный региональный болевой синдром [5]. Результатом стимуляции моторной коры головного мозга являются подавление возбудимости клеток таламуса, увеличение регионарного кровотока и улучшение моторной функции [6]. До начала применения этого метода использовался метод глубинной стимуляции головного мозга, который эффективно устранял болевой синдром, но сопровождался большим числом осложнений [7]. Стимуляция спинного мозга (spinal cord stimulation — SCS) используется в лечении фантомной боли с 1969 г., первые исследования были опубликованы в 1975 г. [8]. В настоящее время SCS является успешной интервенционной методикой лечения в том случае, если проведенное ранее консервативное лечение не обеспечило контроль болевого синдрома и улучшение функционального статуса пациента.
Представляем клиническое наблюдение
Пациент М., 60 лет, обратился в клинику с жалобами на выраженную постоянную тупую и ноющую боль в области поясничного и грудного отделов позвоночника, а также на колющую и жгучую боль в области живота и таза, иррадиирующую в ноги. Пациент находился под наблюдением терапевта и невролога, ему проводилась комплексная медикаментозная терапия, включающая морфин в суточной дозе 120 мг и габапентин 300 мг 3 раза в день (более высокие дозы вызывали когнитивные расстройства).
Из анамнеза известно, что в возрасте 16 лет пациент попал в автомобильную аварию и получил необратимое повреждение спинного мозга на уровне позвонка Th10 с развитием параплегии, в связи с чем ему были проведены две реконструктивные операции на позвоночнике с уровня Th8 до L3, которые не привели к улучшению неврологического статуса, и наложена илеостома.
В дальнейшем на фоне длительного курения (2 пачки в день) у пациента развились облитерирующий атеросклероз артерий нижних конечностей и окклюзия дистальной аорты. С целью реваскуляризации нижних конечностей и таза были наложены аортофеморальные анастомозы и анастомоз между левой подмышечной и левой общей подвздошной артерией, что не сопровождалось значимым клиническим эффектом. У пациента начались гангрена нижних конечностей и пролежни в области крестца, бедер и промежности. В возрасте 54 лет ему была проведена двусторонняя ампутация выше колен, после чего возникли мучительные, некурабельные фантомные боли и боли в области крестца, живота и таза, которые пациент описывал как обжигающие, стреляющие, с ощущением жара. Кроме того, у пациента были диагностированы гипертоническая болезнь, гиперлипидемия и депрессия.
Комплексное консервативное лечение, включавшее в себя акупунктуру, массаж, метод биологической обратной связи, физиотерапию, кинезиотерапию, эффекта не имело. Симпатические блокады давали кратковременное облегчение. В связи с неэффективностью предшествующего длительного комплексного лечения пациенту была предложена SCS. После успешного прохождения психологического тестирования была запланирована временная SCS с целью купирования фантомной боли в обеих нижних конечностях, боли в области крестца, живота и таза.
Методика. Временная SCS была проведена под местной анестезией с использованием С-дуги; две иглы Туохи были введены чрескожно в эпидуральное пространство на уровне позвонков L3—L4. К сожалению, из-за послеоперационных изменений в эпидуральном пространстве временные электроды для SCS не смогли пройти выше уровня Th12. При попытке ввести электроды на уровне L4—L5 результат был тот же. Комплексное интраоперационное программирование двух восьмиконтактных электродов было предпринято на уровне Th12, L1 и L2 с использованием различных параметров, но пациент не чувствовал парестезии. Было принято решение завершить неудавшуюся попытку временной нейростимуляции с удалением игл Туохи и электродов.
Пациент был осмотрен неврологом и нейрохирургом, и ему была предложена повторная SCS с установкой чрескожных электродов выше уровня перенесенных операций (Th8). Повторная операция через 1 мес была аналогична первой, но две иглы Туохи были введены чрескожно в эпидуральное пространство на уровне Th7—Th8 c установкой двух восьмиконтактных электродов на уровне Th5—Th7. Оба тестовых электрода были присоединены к временному нейростимулятору с последующим комплексным программированием. На фоне начавшейся спинальной стимуляции пациент отмечал ярко выраженные субьективные ощущения в виде «мурашек и теплоты» в области крестца и обеих нижних конечностях. Обе иглы Туохи были удалены, и электроды фиксированы к коже с использованием пластырных полосок Steri-Strips. В тот же день пациент был выписан домой для 3-дневной тестовой нейростимуляции. При повторном осмотре он отмечал снижение фантомной боли в обеих нижних конечностях, боли в области спины и таза на 80% (уровень боли до тестовой нейростимуляции соответствовал 10/10 по визуальной аналоговой шкале (ВАШ), во время тестирования — 2/10) и выразил свое согласие на имплантацию постоянного нейростимулятора. Временные электроды были удалены.
Через 1 нед в амбулаторном хирургическом центре под местной анестезией и внутривенной седацией пациенту была проведена имплантация постоянных электродов и нейростимулятора. Так же, как во время тестирования, две иглы Туохи были введены в эпидуральное пространство на уровне Th7—Th8 под контролем С-дуги. Затем два восьмиконтактных электрода («Medtronic Inc.», США) были проведены через иглы и установлены на уровне Th5, Th6 и Th7 (рис. 1). Рис. 1. Окончательная установка электродов на уровне позвонков Th5, Th6 и Th7. В ходе интраоперационного тестирования было выполнено программирование установленных электродов, и пациент вновь подтвердил эффективную стимуляцию в области поясницы, крестца и обеих нижних конечностях. После дополнительной внутривенной седации электроды были подведены через проводник в левую супраглютеальную область, где между фасцией и подкожной жировой клетчаткой было сформировано ложе для стимулятора (рис. 2). Рис. 2. Имплантированный подзаряжаемый нейростимулятор в левой супраглютеальной области. Электроды присоединены к подзаряжаемому нейростимулятору («Medtronic Inc.», США), раны послойно ушиты.
Послеоперационный период протекал без осложнений. Нейростимуляция была начата через 2 нед после операции. Пациент использовал следующие параметры стимуляции: частота 60 Гц, длительность импульса 450 мкс, амплитуда импульса 1,5—2,3 В. Повторные обследования пациента для оценки уровня боли в послеоперационном периоде были проведены через 2, 4, 8, 12 нед и 6 мес после имплантации нейростимулятора. При каждом послеоперационном визите к врачу пациент отмечал значительное снижение боли на фоне круглосуточного использования нейростимулятора. Он прекратил прием морфина и габапентина, улучшилось его функционирование и произошла социальная интеграция. Также была частично восстановлена способность пациента к бытовой и профессиональной деятельности, активному отдыху.
Стимуляция нейрональных структур спинного мозга обусловливает ингибирование передачи болевых импульсов в головной мозг. Феномен блокирования передачи ноцицептивных импульсов объясняется теорией воротного контроля боли («gate-control theory»), предложенной R. Melzack и P. Wall в 1965 г. [9]. Теория предполагает, что воздействие на афферентные нервные волокна крупного диаметра и активация неноцицептивных путей способны блокировать ноцицептивные импульсы и таким образом закрывать «ворота боли». Как показывают последние исследования, эффект, оказываемый нейростимуляцией, комплексный и включает в себя влияние на локальный кровоток, нейротрансмиссию, выброс эндорфинов, концентрацию биологически активных веществ, нейромедиаторов. Кроме того, нейростимуляция блокирует мембранную деполяризацию, стимулирует ангиогенез, подавляет симпатическую иннервацию и оказывает нейропротективный эффект [10]. Точный механизм нейромодуляции только предстоит раскрыть, что объяснит многовекторность воздействия этой методики.
С момента первой имплантации нейростимуляторов с эпидуральными электродами для SCS более 30 лет тому назад опубликовано много работ, подтверждающих высокую эффективность этой технологии в лечении хронических болевых синдромов различной этиологии 12. Методика SCS успешно используется в лечении пациентов с синдромом оперированного позвоночника, трудно контролируемой болью вследствие облитерирующего атеросклероза сосудов нижних конечностей [12, 13], ишемической болью [14], стенокардией [15], нейропатиями [16, 17], хронической висцеральной болью [18], хроническим панкреатитом, постоперационными невромами и посттравматической спленэктомией 21.
В представленном наблюдении первая попытка ввести электроды в эпидуральное пространство не увенчалась успехом из-за произошедших в нем послеоперационных изменений (временные электроды для SCS не смогли пройти выше уровня Th12). Последующее интраоперационное программирование электродов на уровне Th12, L1 и L2 не дало ожидаемого эффекта из-за повреждения спинного мозга. Однако программирование на уровне Th5—Th7 обеспечило эффективную стимуляцию в области крестца и обеих нижних конечностях. Путем тщательного программирования удалось не только обеспечить планируемую стимуляцию в областях ощущаемой пациентом боли, но и избежать появления ненужных парестезий в области грудной клетки. Для такого характера боли, как у нашего пациента, идеально было бы расположение электродов на уровне Th8—Th9—Th10 с входом в эпидуральное пространство на уровне Th12—L1 или L1—L2 с целью упрощения процесса введения электродов и снижения риска повреждения спинного мозга. Тем не менее успешно ввести электроды в эпидуральное пространство можно было только выше уровня позвонков, на котором были ранее перенесены операции. Однако этот осложняющий интраоперационный фактор не должен служить причиной отказа от попыток установить чрескожные электроды.
Заключение. Трудности в лечении пациентов с ЦБС испытывают специалисты разных профилей, в том числе травматологи-ортопеды. В представленном клиническом наблюдении пациента с ЦБС с безуспешным медикаментозным и интервенционным лечением в анамнезе показана актуальность использования методики SCS, которая обеспечила стойкий клинический эффект. Методика позволяет провести предварительное тестирование, дает возможность изменять параметры стимуляции как самому пациенту, так и клиницисту через программатор, является нетравматичной и может быть прекращена несложным удалением нейростимулятора в условиях амбулаторной операционной. Методика SCS может быть предложена пациентам с некупирующимся ЦБС как альтернативное лечение, которое имеет выраженный и стойкий болеутоляющий эффект. Она позволяет пациентам избежать побочных эффектов медикаментозной терапии, улучшить функциональный статус, повысить качество жизни и способствует социальной адаптации.
Механизмы ощущения боли
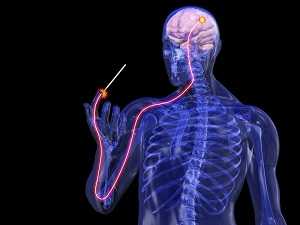
Все люди рано или поздно сталкиваются с болью, но мало кто знает где и как формируется болевое ощущение.
В данной статье нам хотелось бы приоткрыть завесу тайны механизмов передачи боли.
Как мы чувствуем боль? Давайте на минутку представим себе, что кто-то, конечно же, не Вы, порезал палец острым кухонным ножом. По какому же пути необходимо пройти болевому импульсу от поврежденного пальца, чтобы достигнуть головного мозга, где в конечном итоге и формируется ощущение боли?
Болевые рецепторы, находящиеся в коже в результате травмы активируются, благодаря выходу из поврежденных клеток различных химических веществ, таких как гистамин, субстанцию Р, серотонин (5HT), брадикинин и простагландины.
Болевые импульсы, генерируемые этими рецепторами, передаются затем по чувствительным спинномозговым (сенсорным) нервам, клеточные тела которых сгруппированы в небольшое образование, именуемое спинномозговым ганглием (узлом).
Поступившие в спинной мозг болевые импульсы обрабатываются в заднем роге, после чего ответно формируются импульсы, летящие через двигательные нервы к мышцам руки, приводя к её быстрому отдергиванию от повреждающего агента, в данном случае лезвия ножа. Такую основу имеет под собой безусловный (автоматический) рефлекс, не требующий участия головного мозга, или сознательной деятельности.
В зависимости от функционального состояния заднего рога спинного мозга (см. о воротной теории боли и феномене сенситизации заднего рога ниже), болевые сигналы вместе с тем направляются вверх по спино-таламическому пути спинного мозга к специфической структуре головного мозга, называемой таламус.
В дальнейшем, таламус, обработав посупившие к нему импульсы, отправляет специфические сигналы в центры, контролирующие кровяное давление, пульс, дыхание и эмоции. Вот почему в случае остро возникшей боли происходит учащение сердцебиения и дыхания, повышается кровяное давление, а также происходят знакомые всем нам эмоциональные и поведенческие изменения: появляется болезненная гримаса, человек дует на поврежденный палец или быстро трясет им в воздухе.
Между тем, болевые импульсы не останавливаются в таламусе, а передаются дальше в первичную сенсорную кору - специфическую область полушарий головного мозга, где происходит конечная обработка полученных сигналов.
Принято считать, что в таламусе все же происходит частичное восприятие поступающих болевых импульсов, однако их наиболее тонкая дискриминация (распознавание), происходит в первичной сенсорной коре полушарий головного мозга.
Важно отметить, что сперва, сразу после воздействия болевого раздражителя, формируется острое, с мгновенным началом, кратковременное болевое ощущение, передаваемое от области повреждения к задним рогам спинного мозга по толстым быстропроводящим сенсорным (чувствительным) волокнам - А-дельта волокнам.
За ним следует тупая, имеющая медленное начало, более длительная боль, передающаяся от травмированного участка в задний рог по волокнам меньшего диаметра с низкой скоростью проведения - C волокнам. Почему это важно? Предлагаем Вам ознакомиться с воротной теорией боли.
Воротная теория боли
Почему, получив то или иное повреждение мы незамедлительно потираем травмированный участок?
Потирание поврежденного участка приводит к возбуждению тактильных рецепторов (реагирующих на прикосновение) кожи, которые активируются и начинают посылать импульсы в задний рог спинного мозга через А-бета волокна. Эти сигналы, поступив в спинной мозг, блокируют проведение болевых импульсов, поступающих по С-волокнам, то есть закрывают ворота на боль.
На механизме блокирования ворот на боль основаны многие методы лечения, такие как иглоукалывание - стимулирут А-дельта волокна, а также ряд физиопроцедур (чрезкожная нейростимуляция, электромышечная стимуляция и т.д.). Ниже хотелось бы рассмотреть еще один, обратный воротному механизму феномен - сенситизацию заднего рога.
Феномен сенситизации заднего рога
В течение часа после травмы, происходят специфические изменения в заднем роге спинного мозга, получившие название феномена сенситизации, основной смысл которого заключается в том, что все поступающие в спинной мозг стимулы более легко проводятся по спинному мозгу в головной, а не блокируются на уровне заднего рога, препятствуя тем самым информационной перегрузке головного мозга.
Сенситизация обусловлена активацией Н-метил-Д-аспартам (NMDA) рецепторов. На блокаде этих рецепторов основан обезболивающий эффект ряда лекарственных препаратов.
Клинически сенситизация проявляется снижением порога восприятия как болевой, так и любой другой, будь то температурной, тактильной, вибрационной чувствительности в той области, за которую ответственен сенситизированный задний рог.
Порог болевой чувствительности изменяется по двум направлениям:
Стимулы, которые ранее расценивались как безболезненные, воспринимаются как боль;
Самые незначительные болевые импульсы воспринимаются как интенсивная боль.
Обычно, после травмы, явления сенситизации проходят одновременно с заживленинем поврежденных тканей. Напротив, у определенной части людей она сохраняется гораздо дольше, что в определенной степени можеть объяснять развитие хронических болевых синдромов. В ряде случаев, длительная сенситизация объясняется сохранением активного очага в поврежденной когда-то ткани, который посылает болевые импульсы в спинной мозг, поддерживая тем самым произошедшие в нем перестройки. В других - точная причина этого феномена неизвестна. Однако замечено, что существует тесная взаимосвязь между эмоциями и феноменом сенситизации заднего рога. Наличие у человека тревожных и депрессивных расстройств приводит к ослаблению нисходящих тормозных влияний на спинной мозг со стороны головного, что может приводить к поддержанию сенситизации.
Исходя из выше сказанного, методами лечения хронических болевых синдромов являются:
Болезни спинного мозга
Спинной мозг является частью центральной нервной системы. Он содержит в себе нервные пути, берущие своё начало от нервных ядер в головном мозге, и собственные нейроны, сообщающиеся с периферическими органами и головным мозгом. Спинной мозг и отходящие от него нервные корешки располагаются в просвете позвоночного канала. Он пролегает от начала шейного отдела и заканчивается в верхнем отделе поясничного отдела позвоночника у взрослых людей.
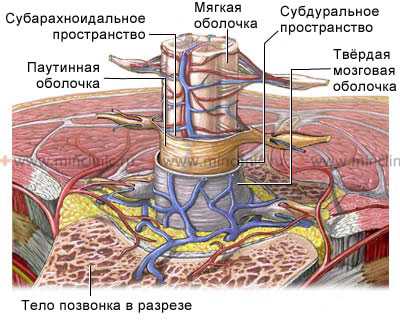
Спинной мозг расположен в позвоночном канале и окружён эпидуральной жировой клетчаткой.
Некоторые болезни спинного мозга могут приводить к необратимым неврологическим нарушениям у пациента и часто к их последующей инвалидизации. Повреждения спинного мозга при своих небольших габаритах могут приводить к параличу рук и ног (тетраплегии), или только ног (параплегии) с полным отсутствием или снижением чувствительности ниже места повреждения. Так как спинной мозг по сути похож в своём поперечном сечении на многожильный кабель, то достаточно бывает незначительных размеров его повреждений для появления непреходящих неврологических симптомов и инвалидизации больного.
При заболевании, вызывающем сдавление спинного мозга (извне или изнутри), возникший неврологический дефицит может быть обратимым. В таких случаях важно во время устранить возникшее сдавление спинного мозга, чтобы у пациента не успела развиться гибель его нервных структур.
Анатомия спинного мозга имеет сегментарное строение. Спинной мозг осуществляет иннервацию конечностей и туловища. От него отходят 31 пара спинномозговых нервов. Этот сегментарный тип строения и иннервации облегчает диагностику пациента. При неврологическом осмотре определить локализацию патологического процесса в спинном мозге позволяют граница расстройств чувствительности, паралич или слабость мышц рук или ног (параплегия, парапарез) и другие типичные синдромы.
Кроме неврологического осмотра пациента производят магниторезонансную (МРТ) или компьютерную (КТ) томографию спинного мозга. Ранее распространенный метод миелографии сейчас уже отошёл на второй план в клинической практике в связи появление более точных и безопасных методик исследования заболеваний спинного мозга и позвоночника (МРТ и КТ). Анализ спинномозговой жидкости (СМЖ, ликвора) способен дать уточняющие данные при постановке диагноза при некоторых заболеваниях спинного мозга.
Неврологические симптомы, связанные с анатомическим строением спинного мозга и позвоночника
Знание анатомического строения спинного мозга (сегментарный принцип) и отходящих от него спинномозговых нервов позволяет невропатологам и нейрохирургам на практике точно определять симптомы и синдромы повреждения. Во время неврологического осмотра пациента, спускаясь сверху вниз, находят верхнюю границу начала расстройства чувствительности и двигательной активности мышц. Следует помнить, что тела позвонков не соответствуют расположенными под ними сегментами спинного мозга. Неврологическая картина поражения спинного мозга зависит от повреждённого её сегмента.
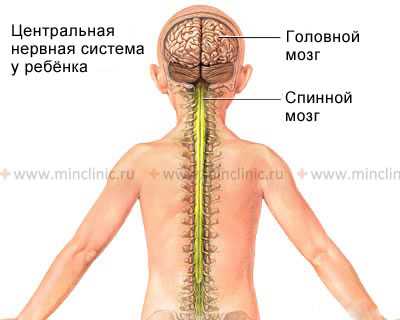
По мере роста человека длина спинного мозга отстаёт от длины окружающего его позвоночника.
Во своего формирования и развития спинной мозг растет медленнее чем позвоночник. У взрослых людей спинной мозг заканчивается на уровне тела первого поясничного L1 позвонка. Отходящие от него нервные корешки буду спускаться дальше вниз, для иннервации конечностей или органов малого таза.
Клиническое правило, используемое при определении уровня поражения спинного мозга и его нервных корешков:
- шейные корешки (кроме корешка C8) покидают позвоночный канал через отверстия над соответствующими им телами позвонков,
- грудные и поясничные корешки покидают позвоночный канал под одноименными позвонками,
- верхние шейные сегменты спинного мозга лежат позади тел позвонков с теми же номерами,
- нижние шейные сегменты спинного мозга лежат на один сегмент выше соответствующего им позвонка,
- верхние грудные сегменты спинного мозга лежат на два сегмента выше,
- нижние грудные сегменты спинного мозга лежат на три сегмента выше,
- поясничные и крестцовые сегменты спинного мозга (последние формируют мозговой конус (conus medullaris) локализуются позади позвонков Th9-L1.
Чтобы уточнить распространение различных патологических процессов вокруг спинного мозга, особенно при спондилёзе, важно тщательно измерить сагиттальные диаметры (просвет) позвоночного канала. Диаметры (просвет) позвоночного канала у взрослого человека норме составляет:
- на шейном уровне позвоночника — 16-22 мм,
- на грудном уровне позвоночника —16-22 мм,
- на уровне позвонков поясничных L1-L3 — около 15-23 мм,
- на уровне позвонков поясничных L3-L5 и ниже — 16-27 мм.
Неврологические синдромы заболеваний спинного мозга
При поражении спинного мозга на том или ином уровне будут выявляться следующие неврологические синдромы:
- утрата чувствительности ниже уровня его поражения спинного мозга (уровень расстройств чувствительности)
- слабость в конечностях, иннервируемых нисходящими нервными волокнами кортико-спинального пути от уровня поражения спинного мозга
Нарушения чувствительности (гипестезия, парестезия, анестезия) могут появиться в одной или обеих стопах. Расстройство чувствительности может распространяться вверх, имитируя периферическую полинейропатию. В случае полного или частичного перерыва кортико-спинальных и бульбоспинальных путей на одном и том же уровне спинного мозга, у пациента возникает паралич мышц верхних и/или нижних конечностей (параплегия или тетраплегия). При этом выявляются симптомы центрального паралича:
- мышечный тонус повышен
- глубокие сухожильные рефлексы повышены
- выявляется патологический симптомом Бабинского
В зависимости от уровня повреждения спинного мозга у пациента будут возникать двигательные и чувствительные нарушения.
Во время осмотра больного при повреждении спинного мозга обычно обнаруживают сегментарные нарушения:
- полосу изменений чувствительности вблизи верхнего уровня проводниковых сенсорных расстройств (гиперальгезия или гиперпатия)
- гипотонию и атрофию мышц
- изолированное выпадение глубоких сухожильных рефлексов
Уровень расстройств чувствительности по проводниковому типу и сегментарная неврологическая симптоматика примерно указывают на локализацию поперечного поражения спинного мозга у пациента. Точным локализующим признаком служит боль, ощущаемая по средней линии спины, особенно на грудном уровне. Боль в межлопаточной области может оказаться первым симптомом компрессии спинного мозга у больного. Корешковые боли указывают на первичную локализацию поражения спинного мозга в области наружных его масс. При поражении конуса спинного мозга боли часто отмечаются в нижней части спины.
На ранней стадии поперечного поражения спинного мозга в конечностях может отмечаться снижение тонуса мышц (гипотония), а не спастика по причине спинального шока у пациента. Спинальный шок может длиться несколько недель. Иногда его ошибочно принимают за обширное сегментарное поражение. Позднее сухожильные и периостальные рефлексы у пациента становятся повышенными. При поперечных поражениях, особенно обусловленных инфарктом, параличу часто предшествуют короткие клонические или миоклонические судороги в конечностях. Другим важным симптомом поперечного поражения спинного мозга служит нарушение функции тазовых органов, проявляющееся в виде задержки мочи и кала у пациента.
Характер возможных двигательных и чувствительных неврологических нарушений зависит от объёма повреждения спинного мозга.
Сдавление внутри (интрамедуллярное) или вокруг спинного мозга (экстрамедуллярное) клинически может проявляться схожим образом. Поэтому одного неврологического осмотра больного не достаточно, чтобы определить локализацию поражения спинного мозга. К неврологическим признакам, свидетельствующим в пользу локализации патологических процессов вокруг спинного мозга (экстрамедуллярно) относятся:
- корешковые боли,
- синдром половинного спинального поражения Броун-Секара,
- симптомы поражения периферических мотонейронов в пределах одного или двух сегментов, часто асимметричные,
- ранние признаки вовлечения кортико-спинальных путей,
- существенное снижение чувствительности в крестцовых сегментах,
- ранние и выраженные изменения спинномозговой жидкости (ликвора).
К неврологическим признакам, свидетельствующим в пользу локализации патологических процессов внутри спинного мозга (интрамедуллярно) относятся:
- с трудом локализуемые жгучие боли,
- диссоциированная утрата болевой чувствительности при сохранности мышечно-суставной чувствительности,
- сохранение чувствительности в области промежности и крестцовых сегментах,
- поздно возникающая и менее выраженная пирамидная симптоматика,
- нормальный или незначительно измененный состав спинномозговой жидкости (ликвора).
Поражение внутри спинного мозга (интрамедуллярное), сопровождающегося вовлечением наиболее внутренних волокон спиноталамических путей, но не затрагивающего самые внешние волокна, обеспечивающие чувствительность крестцовых дерматомов, проявится отсутствием признаков поражения. Будет сохранено восприятие болевых и температурных раздражений в крестцовых дерматомах (нервные корешки S3-S5).
Синдромом Броун-Секара обозначают комплекс симптомов половинного поражения поперечника спинного мозга. Синдромом Броун-Секара клинически проявляется:
- на стороне поражения спинного мозга — параличом мышц руки и/или ноги (моноплегия, гемиплегия) с утратой мышечно-суставной и вибрационной (глубокой) чувствительности,
- на противоположной стороне — выпадением болевой и температурной (поверхностной) чувствительности.
Верхнюю границу расстройств болевой и температурной чувствительности при синдроме Броун-Секара нередко определяют на 1-2 сегмента ниже участка повреждения спинного мозга, поскольку волокна спиноталамического пути после формирования синапса в заднем роге спинного мозга переходят в противоположный боковой канатик, поднимаясь вверх. Если имеются сегментарные нарушения в виде корешковых болей, мышечных атрофий, угасания сухожильных рефлексов, то они обычно бывают односторонними.
Спинной мозг кровоснабжают одна передняя спинномозговая и две задние спинномозговые артерии.
Если очаг поражения спинного мозга ограничен центральной частью или затрагивает ее, то он преимущественно будет повреждать нейроны серого вещества и сегментарные проводники, которые производят свой перекрест на данном уровне. Такое наблюдается при ушибе во время спинномозговой травмы, сирингомиелии, опухоли и сосудистых поражениях в бассейне передней спинномозговой артерии. При центральном поражении шейного отдела спинного мозга возникают:
- слабость руки, которая более выражена по сравнению со слабостью ноги,
- диссоциированное расстройство чувствительности (аналгезия, т. е. утрата болевой чувствительности с распределением в виде «накидки на плечах» и нижней части шеи, без анестезии, т.е. потери тактильных ощущений, и при сохранности вибрационной чувствительности).
Поражения конуса спинного мозга, локализующиеся в области тела позвонка L1 или ниже, сдавливают спинальные нервы, входящие в состав конского хвоста. Это вызывает периферический (вялый) асимметричный парапарез с арефлексией. Этому уровню поражения спинного мозга и его нервных корешков сопутствует нарушение функции тазовых органов (дисфункция мочевого пузыря и кишечника). Распределение чувствительных расстройств на коже пациента напоминает очертания седла, достигает уровня L2 и соответствует зонам иннервации корешков, входящих в конский хвост. Ахилловы и коленные рефлексы у таких больных снижены или отсутствуют. Часто пациенты отмечают боли, отдающие в промежность или бедра.
При патологических процессах в области конуса спинного мозга боли выражены слабее, чем при поражениях конского хвоста, а расстройства функций кишечника и мочевого пузыря возникают раньше. Ахилловы рефлексы при этом угасают. Компрессионные процессы могут одновременно захватывать как конский хвост, так и конус спинного мозга, что вызывает комбинированный синдром поражения периферических мотонейронов с повышением рефлексов и появлением патологического симптомом Бабинского.
При поражении спинного мозга на уровне большого затылочного отверстия у пациентов возникает слабость мускулатуры плечевого пояса и руки, вслед за которой появляется на стороне поражения слабость ноги и руки на противоположной стороне. Объемные процессы данной локализации иногда дают боль в шее и затылке, распространяющуюся на голову и плечи. Другим свидетельством высокого шейного уровня (до сегмента Тh1) поражения служит синдром Горнера.
Некоторые заболевания позвоночника могут вызвать внезапную миелопатию без предшествующих симптомов (по типу спинального инсульта). К их числу относятся эпидуральное кровоизлияние, гематомиелия, инфаркт спинного мозга, выпадение (пролапс, экструзия) пульпозного ядра межпозвонкового диска, подвывих позвонков.
Хронические миелопатии возникают при следующих заболеваниях позвоночника или спинного мозга:
Боль: от патогенеза к выбору лекарственного препарата
Боль является наиболее частой и сложной по субъективному восприятию жалобой пациентов. В 40% всех первичных обращений к врачу боль является ведущей жалобой. Большая распространенность болевых синдромов оборачивается значительными материальными, социальными и духовными потерями.
Как уже говорилось выше, комитет по классификации Международной ассоциации по изучению боли определяет боль как «неприятное сенсорное и эмоциональное переживание, связанное с существующим или возможным повреждением ткани или описываемое в терминах такого повреждения» [37]. В этом определении подчеркивается, что ощущение боли может возникать не только при повреждении ткани, но даже при отсутствии какого-либо повреждения, что указывает на важную роль психических факторов в формировании и поддержании боли.
Классификация боли
Боль - понятие клинически и патогенетически сложное и неоднородное. Она различается по интенсивности, локализации и по своим субъективным проявлениям. Боль может быть стреляющей, давящей, пульсирующей, режущей, а также постоянной или периодической. Все существующее многообразие характеристик боли во многом связано с самой причиной, вызвавшей ее, анатомической областью, в которой возникает ноцицептивный импульс, и очень важно для определения причины боли и последующего лечения [3].
Одним из наиболее существенных факторов в понимании этого феномена является разделение боли на острую и хроническую (рис. 8).
Рис. 8. Боль: острая и хроническая. Главным отличием хронической боли от острой является не временной фактор, а качественно иные нейрофизиологические, психофизиологические и клинические соотношения.
Острая боль всегда указывает на конкретную проблему или угрозу для человека. В этом ее биологический смысл и «польза». Хроническая боль является во всех случаях патологическим состоянием, приводящим к дезадаптации и снижению качества жизни пациента. А для общества хроническая боль оборачивается огромными экономическими потерями.
Острая боль - это сенсорная реакция с последующим включением эмоционально-мотивационных вегетативных и других факторов при нарушении целостности организма. Развитие острой боли связано, как правило, с вполне определенными болевыми раздражениями поверхностных или глубоких тканей и внутренних органов, нарушением функций гладкой мускулатуры. Острый болевой синдром развивается в 80% случаев, имеет защитное, предупредительное значение, так как свидетельствует о «повреждении» и вынуждает человека предпринять меры для выяснения причины боли и ее устранения. Длительность острой боли определяется временем восстановления поврежденных тканей и/или нарушенной функции гладких мышц и обычно не превышает 3 месяцев. Острая боль обычно хорошо купируется анальгетиками.
В 10-20% случаев острая боль переходит в хроническую, которая длится более 3-6 месяцев. Однако главным отличием хронической боли от острой является не временной фактор, а качественно иные нейрофизиологические, психофизиологические и клинические соотношения. Хроническая боль не носит защитного характера. Хроническая боль в последние годы стала рассматриваться не только как синдром, но и как отдельная нозология. Ее формирование и поддержание зависит в большей степени от комплекса психологических факторов, нежели от характера и интенсивности периферического ноцицептивного воздействия. Хроническая боль может сохраняться после завершения процессов заживления, т.е. существовать вне зависимости от повреждения (наличия ноцицептивного воздействия). Хроническая боль не купируется анальгетиками и часто приводит к психологической и социальной дезадаптации пациентов.
Одной из возможных причин, способствующих хронификации боли, является лечение, неадекватное причине и патогенезу болевого синдрома. Устранение причины острой боли и/или максимально эффективное ее лечение - залог профилактики трансформации острой боли в хроническую.
Важное значение для успешного лечения боли имеет определение ее патогенеза. Наиболее часто встречается ноцицептивная боль, возникающая при раздражении периферических болевых рецепторов - «ноцицепторов», локализованных практически во всех органах и системах (коронарный синдром, плеврит, панкреатит, язва желудка, почечная колика, суставной синдром, повреждения кожи, связок, мышц и т.д). Нейропатическая боль возникает вследствие повреждения различных отделов (периферической и центральной) соматосенсорной нервной системы [9].
Ноцицептивные болевые синдромы чаще всего являются острыми (ожог, порез, ушиб, ссадина, перелом, растяжение), но могут носить и хронический характер (остеоартроз). При этом виде боли фактор, вызвавший ее, как правило, очевиден, боль обычно четко локализована (обычно в зоне повреждения). Описывая ноцицептивную боль, пациенты чаще всего пользуются определениями «сжимающая», «ноющая», «пульсирующая», «режущая». В лечении ноцицептивной боли хороший терапевтический эффект можно получить при назначении простых анальгетиков и НПВП. При ликвидации причины (прекращении раздражения «ноцицепторов») ноцицептивная боль проходит [9].
Причинами нейропатической боли могут быть повреждения афферентной соматосенсорной системы на любом уровне, начиная от периферических чувствительных нервов и заканчивая корой больших полушарий, а также нарушения в нисходящих антиноцицептивных системах. При поражении периферической нервной системы боли называют периферическими, при поражении центральной нервной системы - центральными (рис. 9).
Нейропатическая боль, возникающая при повреждении различных участков нервной системы, характеризуется пациентами как жгучая, стреляющая, холодящая и сопровождается объективными симптомами раздражения нервов (гиперестезия, парестезия, гипералгезия) и/или нарушения их функции (гипестезия, анестезия). Характерным симптомом нейропатической боли является аллодиния - феномен, характеризующийся возникновением боли в ответ на действие безболевого стимула (поглаживание кисточкой, ватой, температурного фактора).
Рис. 9. Периферическая и центральная нейропатическая боль.
Нейропатическая боль характерна для хронических болевых синдромов разной этиологии. При этом их объединяют общие патофизиологические механизмы формирования и поддержания боли.
Нейропатическая боль плохо поддается лечению стандартными анальгетиками и НПВП и часто приводит к выраженной дезадаптации пациентов.
В практике невролога, травматолога, онколога встречаются болевые синдромы, в клинической картине которых наблюдаются симптомы как ноцицептивной, так и нейропатической боли - «смешанная боль» (рис. 10). Такая ситуация может возникать, например, при компрессии опухолью нервного ствола, раздражении межпозвонковой грыжей спинномозгового нерва (радикулопатии) или при компрессии нерва в костном или мышечном канале (туннельные синдромы). В лечении смешанных болевых синдромов необходимо воздействие на оба, ноцицептивный и нейропатический, компоненты боли.
Рис. 10. Представленность различных типов боли.
Ноцицептивная и антиноцицептивная системы
Сегодняшние представления о формировании боли основаны на представлениях о существовании двух систем: ноцицептивной (НС) и антиноцицептивной (АНС) (рис. 11).
Ноцицептивная система (является восходящей) обеспечивает проведение боли от периферических (ноцицептивных) рецепторов до коры головного мозга. Антиноцицептивная система (является нисходящей) предназначена для контроля над болью [17, 18].
На первом этапе формирования боли происходит активация болевых (ноцицептивных) рецепторов. К активации болевых рецепторов может привести, например, воспалительный процесс. Это вызывает проведение болевых импульсов к задним рогам спинного мозга.
На сегментарном спинальном уровне происходит модуляция ноцицептивной афферентации, которая осуществляется влиянием нисходящих антиноцицептивных систем на различные опиатные, адренергические, глютаматные, пуриновые и другие рецепторы, расположенные на нейронах заднего рога. Этот болевой импульс затем передается в вышележащие отделы центральной нервной системы (таламус, кора головного мозга), где происходит обработка и интерпретация информации о характере и локализации боли.
Рис. 11. Современные представления о боли: ноцицептивная (НС) и антиноцицептивная системы (АНС).
Однако итоговое восприятие боли в значительной степени зависит от активности АНС. АНС головного мозга играют ключевую роль в формировании боли и изменении реакции на боль. Очевидна их широкая представленность в головном мозге и включение в различные нейротрансмиттерные механизмы (норадреналин, серотонин, опиоиды, дофамин). АНС работают не изолированно, а, взаимодействуя между собой и с другими системами, они регулируют не только болевую чувствительность, но и сопряженные с болью вегетативные, моторные, нейроэндокринные, эмоциональные и поведенческие проявления боли. Это обстоятельство позволяет рассматривать их как важнейшую систему, определяющую не только характеристики болевого ощущения, но и его многообразные психофизиологические и поведенческие корреляты [3]. В зависимости от активности АНС боль может усиливаться или уменьшаться.
Препараты для лечения боли
Препараты для лечения боли назначают с учетом предполагаемых механизмов боли. Понимание механизмов формирования болевого синдрома позволяет проводить индивидуальный подбор лечения. При ноцицептивной боли с наилучшей стороны зарекомендовали себя нестероидные противовоспалительные препараты (НПВП) и опиоидные анальгетики. При нейропатической боли обоснованным является применение антидепрессантов, антиконвульсантов, местных анестетиков, а также блокаторов калиевых каналов.
Нестероидные противовоспалительные препараты
Если в патогенезе болевого синдрома ведущую роль играют механизмы воспаления, то наиболее целесообразно в этом случае применение НПВП. Их использование позволяет подавить синтез альгогенов в поврежденных тканях, что предотвращает развитие периферической и центральной сенситизации [26]. Помимо болеутоляющего эффекта препараты из группы НПВП оказывают противовоспалительное и жаропонижающее действие.
Современная классификация НПВП предполагает разделение этих средств на несколько групп, отличающихся селективностью в отношении ферментов циклооксигеназы 1 и 2 типа, которые участвуют в ряде физиологических и патологических процессов (рис. 12).
Рис. 12. Селективные и неселективные НПВП.
Считается, что противоболевой эффект препаратов из группы НПВП связан в основном с их влиянием на ЦОГ2, а желудочно-кишечные осложнения обусловлены их влиянием на ЦОГ1. Однако исследования последних лет обнаруживают и другие механизмы анальгетического действия некоторых препаратов из группы НПВП. Так, было показано, что диклофенак (Вольтарен) может оказывать противоболевое действие не только через ЦОГ-зависимые, но и другие периферические, а также центральные механизмы [15].
Местные анестетики
Ограничения поступления ноцицептивной информации в ЦНС можно достичь при применении различных местных анестетиков, которые могут не только предотвратить сенситизацию ноцицептивных нейронов, но и способствовать нормализации микроциркуляции в зоне повреждения, уменьшению воспаления и улучшению обмена веществ. Наряду с этим местные анестетики расслабляют поперечно-полосатую мускулатуру, устраняют патологическое напряжение мышц, которое является дополнительным источником боли [26].
К местным анестетикам относят вещества, вызывающие временную потерю чувствительности тканей в результате блокады проведения импульсов в нервных волокнах. Наибольшее распространение среди них получили лидокаин, новокаин, артикаин и бупивакаин. Механизм действия местных анестетиков связан с блокированием Na + -каналов на мембране нервных волокон и торможением генерации потенциалов действия.
Антиконвульсанты
Длительно существующее раздражение ноцицепторов или периферических нервов приводит к развитию периферической и центральной сенситизации (гипервозбудимости).
Существующие сегодня антиконвульсанты, применяемые для лечения боли, имеют различные точки приложения. Дифенин, карбамазепин, окскарбазепин, ламотриджин, вальпроаты, топиромат действуют главным образом, подавляя активность потенциал-зависимых натриевых каналов, предотвращая спонтанную генерацию эктопических разрядов в поврежденном нерве. Эффективность этих препаратов доказана у пациентов с тригеминальной невралгией, диабетической невропатией, фантомно-болевым синдромом.
Габапентин и прегабалин тормозят вход ионов кальция в пресинаптическую терминаль ноцицепторов, тем самым уменьшая выброс глутамата, что приводит к уменьшению возбудимости ноцицептивных нейронов спинного мозга (уменьшает центральную сенситизацию). Эти препараты также модулируют активность NMDA-рецепторов и снижают активность Na + -каналов.
Антидепрессанты
Антидепрессанты и препараты из группы опиоидов назначают с целью усиления антиноцицептивных влияний. При лечении болевых синдромов в основном используют препараты, механизм действия которых связан с блокадой обратного захвата моноаминов (серотонина и норадреналина) в ЦНС. Обезболивающий эффект антидепрессантов может быть частично обусловлен и непрямым анальгетическим действием, так как улучшение настроения благоприятно сказывается на оценке боли и уменьшает болевое восприятие. Кроме того, антидепрессанты потенцируют действие наркотических анальгетиков, повышая их сродство к опиоидным рецепторам [26].
Мышечные релаксанты
Мышечные релаксанты применяют в случаях, когда вклад в формирование боли вносит мышечный спазм. Следует отметить, что мышечные релаксанты оказывают воздействие на уровне спинного мозга, а не на уровне мышц.
В нашей стране для лечения болезненных мышечных спазмов используются тизанидин, баклофен, мидокалм, а также препараты из группы бензодиазепинов (диазепам). В последнее время с целью расслабления мышц в лечении миофасциальных болевых синдромов применяются инъекции ботулинотоксина типа А [22]. У представленных препаратов - разные точки приложения. Баклофен является агонистом ГАМК-рецепторов, ингибирует активность вставочных нейронов на спинальном уровне.
Толперизон блокирует Na + -и Ca 2+ -каналы интернейронов спинного мозга и уменьшает выброс болевых медиаторов в нейронах спинного мозга. Тизанидин относится к мышечным релаксантам центрального действия. Основная точка приложения его действия находится в спинном мозге. Стимулируя пресинаптические a2-рецепторы, он подавляет высвобождение возбуждающих аминокислот, которые стимулируют рецепторы к N-метил-D-аспартату (NMDA-рецепторы). Вследствие этого на уровне промежуточных нейронов спинного мозга происходит подавление полисинаптической передачи возбуждения. Поскольку именно этот механизм отвечает за избыточный мышечный тонус, то при его подавлении мышечный тонус снижается. В дополнение к миорелаксирующим свойствам, тизанидин оказывает также центральный умеренно выраженный анальгезирующий эффект.
Исходно тизанидин был разработан для лечения мышечного спазма при различных неврологических заболеваниях (при травматических повреждениях головного и спинного мозга, рассеянном склерозе, инсульте). Однако в скором времени после начала его применения были выявлены анальгетические свойства тизанидина. В настоящее время применение тизанидина в монотерапии и в комплексном лечении болевых синдромов получило широкое распространение [11].
Селективные активаторы нейрональных калиевых каналов (SNEPCO)
Принципиально новым классом препаратов для лечения болевых синдромов являются селективные активаторы нейрональных калиевых каналов - SNEPCO (Selective Neuronal Potassium Channel Opener), оказывающие воздействие на процессы сенситизации нейронов заднего рога за счет стабилизации мембранного потенциала покоя.
Первый представитель этого класса лекарственных средств - флупиртин (Катадолон), обладающий широким спектром ценных фармакологических свойств, выгодно отличающих его от других обезболивающих препаратов.
В последующих главах подробно изложены сведения о фармакологических свойствах и механизме действия Катадолона, представлены результаты исследований его эффективности и безопасности, рассказывается об опыте применения препарата в разных странах мира, даны рекомендации по применению Катадолона при различных болевых синдромах.
Читайте также:
