Рабочий ход миозина и плечо его рычага
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Мышцы, сокращаясь, приводят в движение кости и действуют при этом как рычаги.
Рычаг - это всякое твердое тело, закрепленное в одной точке, вокруг которой происходит движение.
Обязательными элементами рычага являются:
точка опоры;
точка приложения силы;
плечо рычага - это расстояние от точки опоры до точки приложения силы;
плечо силы - это кратчайшее расстояние от точки опоры до линии действия силы (рис. 2).
Рис.2. Схема рычага. Плечи рычага (ОА и ОБ), плечи сил (ОА1 и ОБ1).
Если сила тяжести действует под прямым углом, то плечо силы и плечо рычага совпадают по величине.
Если речь идет о двигательном аппарате человека, то таким твердым телом является кость. Точкой опоры, вокруг которой происходят движения, является сустав. Само движение происходит за счет силы тяги мышц.
Костные рычаги — х это звенья тела, подвижно соединенные в суставах под действием приложенных сил. Они служат для передачи движения и работы на расстояние.
Различают два вида рычагов: первого и второго рода. Если две силы (сила тяжести и сила тяги мышц) приложены по разные стороны от точки опоры рычага и действуют в одном направлении, то тело является рычагом первого рода. Этот рычаг двуплечий, т.к. плечо силы тяжести и силы тяги мышц расположены по обе стороны от точки опоры, образуя соответственно два равных плеча. Такой рычаг является рычагом равновесия.
Примером рычага первого рода является соединение позвоночника с черепом, т.е. атлантозатылочный сустав. Его еще называют суставом равновесия, так как сила тяжести черепа уравновешивается силой тяги мышц затылка (рис.3).
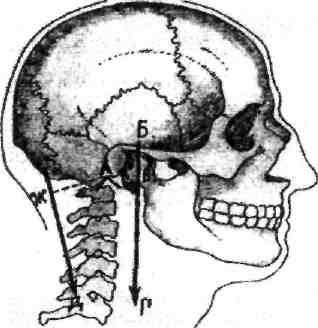
Рис. 3. Рычаг первого рода (рычаг равновесия).
А- поперечная ось атлантозатылочного сустава; БГ- направление силы тяжести; ЕД- направление мышечной тяги; АВ- плечо рычага силы тяжести; аж- плечо силы
Рычаг второго рода - одноплечий, т.к. плечо силы тяжести и плечо силы тяги мышц расположены по одну сторону от точки опоры и направлены в противоположные стороны. Различают две разновидности этого рычага. Первую разновидность обычно называют рычагом силы. Он характеризуется тем, что плечо силы мышечной тяги больше плеча силы тяжести. Примером такого рычага может служить стопа во время подъема на полупальцы (рис.4).
Рис. 4. Рычаг второго рода (рычаг силы).
А - точка опоры; БВ - направление силы тяжести; ДГ- направление равнодействующей силы мышечной тяги; АЕ - плечо рычага силы мышечной тяги; АЖ- плечо рычага
Местом опоры в данном случае являются главным образом головки плюсневых костей, через которые проходит ось вращения всей стопы. Сила мышечной тяги, если обозначить ее в виде прямой, идущей от пяточной кости в направлении тяги трехглавой мышцы голени, имеет большее плечо, чем сила тяжести. Сила тяжести передается на стопу через кости голени и давит непосредственно на таранную кость, способствуя опусканию стопы. Движения рычага этого вида довольно ограничены, здесь имеется выигрыш в силе за счет проигрыша в амплитуде и в скорости движения.
Вторую разновидность рычага второго рода принято называть рычагом скорости. Он характеризуется тем, что сила мышечной тяги приложена вблизи оси вращения и имеет значительно меньшее плечо, чем противодействующая ей сила тяжести. Примером рычага скорости является локтевой сустав и двуглавая мышца плеча, производящая сгибание предплечья (рис.5).
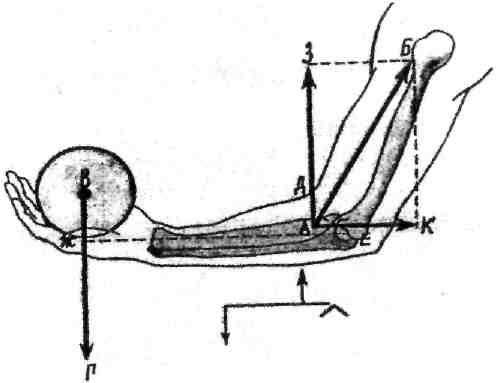
Рис.5. Рычаг второго рода (рычаг скорости).
АБ - направление равнодействующей мышц-сгибателей предплечья;
ВГ- направление силы тяжести или сопротивления; ЖЕ - плечо рычага
силы тяжести; ДЕ - плечо рычага силы мышечной тяги; A3 - «полезная»
составляющая силы мышечной тяги; АК- другая составляющая этой силы; Е - поперечная ось вращения локтевого сустава.
Этот рычаг имеет проигрыш в подъемной силе, но значительный выигрыш в амплитуде и скорости движения. Действительно, при сгибании в локтевом суставе можно кистью, а тем более концами пальцев, производить движения со значительно большей амплитудой и скоростью, чем движения пяткой стопы при подъеме на носки.
4.Адаптация мышечной системы к физическим нагрузкам
Физические нагрузки при систематических тренировках оказывают значительное влияние на мышцы, изменяя их строение и функцию. В процессе тренировок мышца изменяется на органном, клеточном, субклеточном и молекулярном (биохимическом) уровнях. Эти изменения
62 приводят к адаптации мышцы к физическим нагрузкам. Изменения
в строении мышц определяются методом биопсии.
Физические нагрузки вызывают неодинаковые
морфофункциональные перестройки в мышцах, что зависит от характера
двигательной деятельности. Нагрузки бывают преимущественно
динамического и статического характера.
Изменения в мышцах при статических и динамических
Статические нагрузки
Динамические нагрузки
1. Резкое увеличение объема и веса мышц.
1. Умеренное увеличение объема и веса мышц.
2. Укорачивается мышечная часть, удлиняется сухожильная (т.е. увеличивается поверхность прикрепления мышц на костях).
2. Укорачивается сухожильная часть, удлиняется мышечная часть.
3. Увеличивается количество плотной соединительной ткани между мышечными пучками, что создает дополнительную опору.
3. Умеренное увеличение количества плотной соединительной ткани. В большей мере разрастается рыхлая соединительная ткань, где много эластических волокон.
4. Миофибриллы располагаются рыхло.
4. Увеличивается количество миофибрилл, которые «упакованы» очень плотно.
5. хорошо развита капиллярная сеть в виде петель
5. Ход капилляров прямолинейный.
°. Количество нервных волокон в мышцах относительно небольшое.
6. Количество нервных волокон в 4-5 раз больше, чем в мышцах,
выполняющих преимущественно статическую работу.
7. Усиливается перистость мышцы, а значит и ее сила.
7. Отсутствие перехода в перистость.
8. Увеличение объема мышцы идет за счет миофибриллярной гипертрофии.
8. Увеличение объема мышцы идет за счет саркоплазматической гипертрофии и гиперплазии.
Все указанные выше изменения в мышцах происходят на фоне процессов рабочей гипертрофии и гиперплазии.
Гипертрофия - это утолщение мышечных волокон, т.е. увеличение объема и массы мышц (идет увеличение мышечного поперечника в результате мышечной тренировки).
Выделяют 2 типа рабочей гипертрофии:
1) саркоплазматический тип связан с утолщением мышечных волокон за счет преимущественного увеличения объема саркоплазмы (т.е. несократительной части мышечных волокон).
2) миофибриллярный тип связан с увеличением объема миофибрилл (т.е. собственно сократительного аппарата мышечных волокон) и ведет к значительному росту максимальной силы мышц, а также и к росту абсолютной силы.
Преимущественное развитие первого или второго типа рабочей гипертрофии определяется характером мышечной тренировки:
а) длительные динамические упражнения с относительно небольшой нагрузкой вызывают гипертрофию первого типа;
б) изометрические упражнения с большим мышечным напряжением при
водят к развитию второго типа гипертрофии.
Гиперплазия - это процесс увеличения количества мышечных волокон. Механизм гиперплазии описал П.З. Гудзь.
\V\ мышечные дочерние
^_ j ц_ ^L^yN^"*^.^ «цкпалочковндиые ядра
кровеносный СПСуд
На определенном уровне тренированности исходное гипертрофированное мышечное волокно расщепляется на два новых волокна (отводки) из мышечных почек. В обычном мышечном волокне идет кровеносный сосуд, который питает мышцу. Потом этот сосуд раздваивается, и каждое новое мышечное волокно имеет свой сосуд. Расщеплению мышечных волокон предшествует перестройка их моторной иннервации, в результате чего в новые мышечные волокна прорастают нервы с соответствующими синапсами.
К сожалению, у спортсменов возникают не только приспособительные изменения в мышцах, но и патологические, чаще всего травмы. Характер мышечной патологии, ее локализация, связь с видом спорта, возрастом спортсмена, его спортивным стажем и уровнем спортивной квалификации позволяют выявить основные причины поражения мышц: перенапряжение, микротравмы, нарушение координации движений, переутомление спортсменов, несоответствие между силовыми возможностями мышц и прочностью их сухожилий. Современный спорт предъявляет чрезвычайно высокие требования к организму спортсмена. Уже сегодня для повышения устойчивости опорно-двигательного аппарата к механическим воздействиям могут быть рекомендованы апробированные методы. Среди них - отбор будущих спортсменов с учетом их генетической предрасположенности к занятиям
65 определенным видом спорта. В отличие от костной системы,
которая в значительной степени генетически детерминирована, мышечная система лабильна и во многом зависит от характера физической нагрузки. Поэтому необходим подбор и характера таких режимов нагрузки, которые направляли бы адаптационные процессы в костях, сухожилиях, суставных хрящах, связках, мышцах по рациональному пути в полном соответствии с возможностями морфологических структур и предъявляемыми к ним требованиями.
Вопросы для самоконтроля
В чем внешне выражается двигательная функция мышц?
Что такое мышечный тонус? Факторы, влияющие на мышечный
Охарактеризуйте типы мышечного сокращения.
Перечислите факторы, определяющие "величину силы мышц.
Что такое мышцы-синергисты и мышцы-антагонисты? Приведите
6. Дайте характеристику динамической (преодолевающей и
уступающей) работе мышц.
Дайте характеристику статической (удерживающей) работе мышц.
Что такое костные рычаги? Их классификация.
9. Охарактеризуйте рычаг первого рода. Ю.Охарактеризуйте рычаг второго рода (рычаг силы и рычаг
Дайте сравнительную морфофункциональную характеристику изменениям в мышцах при динамической и статической работах.
В чем заключаются механизмы рабочей гипертрофии и рабочей гиперплазии?
Лекция № 5 ТЕМА: Введение в общую динамическую морфологию
1 Понятие о динамической морфологии и ее значение для специалистов
физической культуры и спорта.
2. Характеристика схемы анатомического анализа положений и движений
1. Понятие о динамической морфологии и ее значение для специалистов физической культуры и спорта Динамическая морфология (греч. dynamis - сила) - раздел морфологии, изучающий анатомическую основу различных положений и движений человеческого тела.
Развитие динамической морфологии тесно связано со становлением анатомии, возрастной и спортивной морфологии, биомеханики. В разработке научных основ динамической анатомии большая заслуга принадлежит П.Ф. Лесгафту и его ученикам. В 1874 г. П.Ф. Лесгафт опубликовал книгу «Теория телесных движений», а в 1888 г. - «Руководство по физическому воспитанию детей школьного возраста», где обосновал необходимость выбора физических упражнений, исходя из строения организма человека. В 1927 г. возник курс «Теория движений», а также «Биомеханика физических упражнений». Большой вклад в развитие и становление динамической морфологии внес М.Ф. Иваницкий, который в 1928 г. опубликовал «Записки по динамической анатомии», а в 1938 г. - «Движения человеческого тела». Именно он показал ведущую роль анатомического анализа положений и движений тела человека в решении теории и практики спорта.
Классификация динамической морфологии
Динамическую морфологию условно подразделяют на три отдела:
общая динамическая морфология - изучает деятельностное (т.е. в связи с выполняемыми движениями) строение тела человека на разных структурных уровнях организации (от ультрамикроскопического до организменного);
частная динамическая морфология - дает анатомический анализ отдельных положений и движений тела человека, изучает влияние возрастного и полового факторов на эти движения. Этот раздел входит практически в каждую спортивно-педагогическую дисциплину;
отдел, пограничный с биомеханикой - изучает положение центров тяжести (ЦТ) и общего центра тяжести (ОЦТ), виды и условия равновесия, устойчивость и ее показатели, действия сил при различных положениях и движениях тела.
Динамическая морфология развивает основные принципы функциональной анатомии в их приложении к изучению движений тела. Она тесно связана с другими науками:
1) с возрастной и конституциональной морфологией, так как изучает возрастные, половые и соматотипологические особенности положений и движений тела человека;
2) со спортивной морфологией, так как изучает морфофункциональные изменения (перестройки) организма в связи с адаптацией к регулярной мышечной деятельности;
3) с биомеханикой, так как все движения человеческого тела подчиняются основным законам механики.
Каково же значение этого раздела для тренеров и педагогов? Его можно рассматривать в двух аспектах:
68 j) педагогический состоит в том, что знания, приобретенные по
динамической морфологии, систематизируются применительно к задачам спортивной практики;
2) прикладной заключается в том, что на основе полученных знаний Нормируются навыки самостоятельного анализа положений и движений тела спортсмена, что помогает будущему специалисту оценить качество их выполнения, совершенствовать спортивную технику и предупреждать спортивные травмы.
2. Характеристика схемы анатомического анализа положений и движений тела спортсмена
Анатомический анализ положений и движений тела спортсмена целесообразно проводить в определенной последовательности. М.Ф. Иваницкий предложил для такого анализа использовать схему, включающую шесть разделов.
СХЕМА АНАЛИЗА ПОЛОЖЕНИЙ И ДВИЖЕНИЙ ТЕЛА СПОРТСМЕНА Л МОРФОЛОГИЯ ПОЛОЖЕНИЯ ИЛИ ДВИЖЕНИЯ.
Описание позы исполнителя: положение тела и его отдельных частей (туловища, головы, конечностей) в пространстве. При анализе движений дать общую характеристику, подразделение на фазы, описание отдельных фаз и т.д.
Мышечное сокращение
Среди механохимических преобразователей энергии, распространенных в живой природе, исключительно важную роль играют линейные молекулярные моторы - белковые машины, которые движутся вдоль полимерных нитей, используя в качестве «топлива» молекулы АТФ(аденозинтрифосфата). К таким моторам относятся белки актомиозинового комплекса, входящего в состав сократительного аппарата мышц. Движение микроворсинок (жгутиков и ресничек) определяется взаимодействием другой пары моторных белков - динеина и тубулина. Кинезин и другие родственные ему белки (некоторые формы миозина) работают в клетке как переносчики органелл (митохондрий, лизосом) и сравнительно крупных частиц. В данной статье мы рассмотрим работу линейных молекулярных моторов на примере двух механохимических белков - миозина и кинезина. Среди большого числа моторных белков миозин скелетных мышц и кинезин из клеток мозга являются наиболее изученными. Несмотря на то, что функции миозина и кинезина в клетке различаются, они удивительно похожи по своему строению и механизмам действия.
Модель скользящих нитей
Скелетные мышцы состоят из многоядерных клеток, связанных возбудимой плазматической мембраной, по которой приходит нервный импульс, инициирующий сокращение мышцы. Мышечные клетки состоят из множества сократительных волокон - миофибрилл, расположенных параллельно друг другу. Структурно-функциональными единицами миофибрилл являются саркомеры, которые располагаются вдоль мышечных волокон через каждые 2,3 мкм. На электронно-микроскопических снимках продольного среза мышечной ткани видно, что саркомер состоит из параллельных рядов толстых и тонких нитей (рис. 1, а). Вертикальные темные линии Z соответствуют специальным структурным белкам, разделяющим миофибриллы на саркомеры. Между ними видны горизонтальные нити сократительного аппарата. От Z-линий отходят тонкие нити, которым на электронно-микроскопических снимках соответствуют светлые полосы I. В центральной части саркомера расположены толстые нити, которым соответствуют темные полосы А. В середине каждой полосы А видна более светлая полоса Н. Наличие двух темных участков полосы А определяется тем, что в этих зонах толстые нити пересекаются тонкими нитями. Более светлая полоса (зона Н) соответствует участку саркомера, где толстые нити не пересекаются с тонкими нитями.
Рис. 1. Схематическое изображение строения саркомеров мышечного волокна: а - продольный разрез, б - поперечный разрез в области пересечения толстых и тонких нитей, в - изменение длины саркомера в результате движения толстых и тонких нитей
Толстые нити, имеющие диаметр 15 нм, состоят главным образом из молекул миозина. Тонкие нити имеют диаметр 9 нм. Они содержат белки трех типов: актин, тропомиозин и тропониновый комплекс. Если посмотреть на поперечный срез саркомера в области, где соседствуют толстые и тонкие нити (темный участок полосы А), то можно увидеть, что каждая тонкая нить окружена тремя толстыми нитями, а каждая толстая нить окружена шестью тонкими нитями (рис. 1, б). Толстые и тонкие нити взаимодействуют друг с другом с помощью поперечных мостиков длиной около 13 нм, которые через регулярные промежутки выходят из толстых нитей и заполняют щели между соседними толстыми и тонкими нитями. При сокращении мышцы ее длина укорачивается на одну треть. Как это происходит стало понятно в начале 1950-х гг., когда Эндрю и Хью Хаксли, Р.Нидергерк и Ж.Хэнсон, исследовавшие мышечные волокна методами рентгеноструктурного анализа, оптической и электронной микроскопии, независимо пришли к модели скользящих нитей. В основе этой модели лежат следующие факты:
- при сокращении мышцы длины толстых и тонких нитей саркомера не изменяются;
- саркомер укорачивается за счет перекрывания толстых и тонких нитей, которые скользят друг относительно друга во время сокращения мышцы; это проявляется в том, что при сокращении мышцы полосы Н и I укорачиваются (рис. 1, в);
- сила, развиваемая мышцей, создается в процессе движения соседних нитей.
Скольжение толстых и тонких нитей друг относительно друга совершается за счет энергии, выделяемой при гидролизе АТФ (ATP) до AДФ (ADP) (аденозиндифосфата) и неорганического фосфата (Фн). АТФазную активность миозина открыли в 1939 г. супруги В.А. Энгельгардт и М.Н. Любима, которые показали, что препараты миозина способны расщеплять АТФ на AДФ и Фн (АТФ + Н2О = AДФ+ Фн). Ими было также показано, что добавление АТР к белковому препарату, состоящему из нитей миозина, влияет на его механические свойства. Вскоре после этого А.Сцент-Дьорди (удостоенный впоследствии Нобелевской премии) установил, что в растворе актин и миозин образуют так называемый актомиозиновый комплекс. Примечательно, что сам по себе миозин плохо расщепляет АТФ, но в присутствии актина его активность возрастает приблизительно в 200 раз.
Строение толстых и тонких нитей мышечного волокна
Элементарной структурной единицей толстых нитей саркомера является молекула миозина. Миозин скелетных мышц (миозин класса II) является довольно крупным белком, состоящим из шести полипептидных цепей. Эта молекула представляет собой димер, образованный из двух сплетенных друг с другом одинаковых мономеров миозина (рис. 2, а). Каждый из этих мономеров состоит из одной тяжелой цепи (молекулярная масса 230 кДа) и двух легких цепей (молекулярная масса 20 кДа). Тяжелая цепь миозина неоднородна по своему строению. На одном конце ее полипептидная цепь свернута в виде глобулы, образующей своеобразную головку миозина (фрагмент S1). С помощью более тонкой шейки (фрагмент S2) головка миозина соединяется с длинным хвостом, который образован протяженной полипептидной цепью, уложенной в виде вытянутой (a-спирали. Хвосты двух мономерных единиц миозина сплетены друг с другом и образуют вытянутый стержень длиной 170 нм и толщиной 2 нм. Две подвижные головки, выступающие вбок из этого стержня (рис. 2, а), выполняют моторные функции - в ходе работы сократительного аппарата наклон головок миозина относительно его хвоста изменяется, обеспечивая перемещение миозина относительно актина.
Рис. 2. Строение молекулы миозина (а) и тонкой нити (б). В расслабленной мышце тропомиозин препятствует взаимодействию головки миозина с актином. Внизу (в) схематически показано различие геометрических характеристик моторных участков молекул миозина трех разных типов
Моторный фрагмент миозина (S1) непосредственно взаимодействует с тонкой актиновой нитью. Фрагмент S1 включает в себя каталитический центр, с которым связывается молекула АТФ и где происходит ее гидролиз до AДФ и Фн. При гидролизе АТФ выделяется энергия, за счет которой работает миозин. В 1993 г. Айвэн Рэймент и его коллеги методом рентгеноструктурного анализа установили пространственное строение головки миозина. Согласно их данным, фрагмент S1 представляет собой глобулу размером 16,5х6,5х4 нм. На картине трехмерного строения S1, полученной с разрешением 2,8, четко видны оба функционально важных участка: место посадки АТФ и выступающий наружу участок полипептидной цепи, который непосредственно взаимодействует с актином. Вращательная подвижность головки миозина обеспечивается за счет своеобразных шарниров - гибких участков полипептидной цепи. Один из них находится в месте соединения фрагментов S1 и S2, другой расположен между фрагментом S2 и хвостом миозина (рис. 2, а). Наличие молекулярных шарниров дает возможность фрагменту S1 присоединяться и отсоединяться от нити актина, а также изменять свою ориентацию в ходе сократительного цикла (рис. 3, 4). Функционально важным звеном молекулы миозина является ее регуляторный участок, расположенный в области шейки, соединяющей каталитическую головку с хвостом молекулы миозина. Шейка образована a-спиралью полипептидной цепи длиной 8-9 нм, которая окружена двумя легкими полипептидными цепями S2. Шейка, по сути дела, является рычагом, через который структурные изменения в каталитическом центре передаются хвостовой части молекулы миозина. Легкие цепи придают этому рычагу необходимую жесткость и выполняют важную роль в регуляции каталитической активности миозина. Молекулы миозина в мышцах работают не поодиночке, а образуют сравнительно толстые жгуты из сплетенных друг с другом димеров. В саркомерах поперечнополосатых мышц каждая толстая нить состоит приблизительно из 300 сплетенных димеров миозина. С обоих концов толстой нити выступают многочисленные подвижные мостики, которые могут связываться с окружающими их тонкими нитями актина (рис. 1, б).
Рис. 3. Схема, показывающая изменение положения головки миозина (S1) относительно тонкой нити в ходе структурных перестроек актомиозинового комплекса, которые приводят к возникновению силы, тянущей хвост миозина
Рис. 4. Цикл структурных превращений актомиозинового комплекса, приводящих к смещению молекулы миозина вдоль нити актина
Тонкие нити мышечных волокон состоят из нескольких белков (рис. 2, б). Основной составляющей тонких нитей является актин, присутствующий в них в форме вытянутых полимерных нитей. Эти нити образованы из мономеров глобулярного белка (G-актин), имеющего молекулярную массу 42 кДа. В растворе мономеры G-актина могут связываться друг с другом, образуя молекулы F-актина - вытянутые линейные полимеры G-актина, или микрофиламенты, имеющие диаметр 6-7 нм. Тонкие нити сократительного аппарата мышц, с которыми взаимодействуют миозиновые мостики, наряду с актином содержат также другие белки: тропомиозин и три белка тропонинового комплекса (рис. 2, б), которые играют очень важную роль в регуляции взаимодействия миозина с актином. По своей массе они составляют приблизительно треть от всей массы тонких нитей. Молекула тропомиозина состоит из двух a-спиралей длиной около 38 нм, вложенных в гораздо более протяженную нить F-актина. Тропониновый комплекс состоит из трех белков (TnC, TnI и ТnT). Белок TnI непосредственно связан с актином, а белок ТnT- с тропомиозином. Белок ТnC принадлежит к классу регуляторных белков, называемых кальмодулинами. Этот белок активируется при его взаимодействии с ионами Са 2+ . Тропониновые комплексы расположены вдоль тонкой нити через регулярные интервалы в 38,5 нм, соответствующие длине молекулы тропомиозина.
Рабочий цикл миозиновых (поперечных) мостиков
Вхождение актомиозинового комплекса в цикл миозиновых головок показан на рис. 709270916 А.
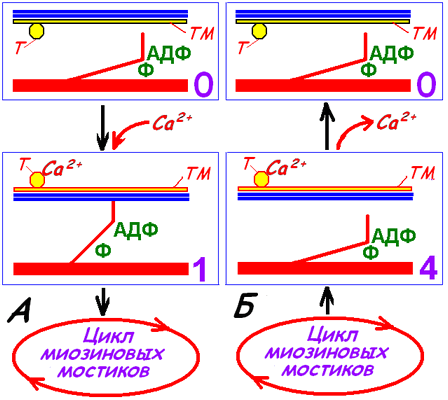
Рис. 709270916. Вхождение актомиозинового комплекса в цикл миозиновых головок (А) и выход из цикла (Б) поперечнополосатого миоцита.
Рабочий цикл миозиновых мостиков поперечнополосатого миоцита
Рабочий цикл миозиновых мостиков поперечнополосатого миоцита включает следующие процессы (рис. 709270802):
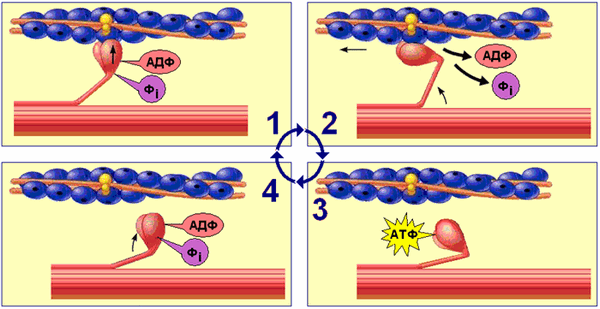
Рис. 709270802. Рабочий цикл миозиновых мостиков поперечнополосатого миоцита.
1. Головка миозина, несущая продукты гидролиза АТФ (АДФ + фосфат) соединяется с миозинсвязывающим участкам актиновой нити.
2. АДФ и фосфат покидают миозиновую головку. Головка миозина изменяет конформацию за счёт шарнирного участка в области шейки миозина. Происходит гребковое движение, продвигающее актиновую нить к центру саркомера (рабочий ход).
3. Головка миозина связывается с молекулой АТФ, что приводит к отделению миозина от актина.
4. Гидролиз АТФ восстанавливает конформацию молекулы миозина, и она оказывается готовой вступить в новый цикл.
Рис. 709270834 показывает цикл миозиновых мостиков без деталей и может быть использован студентом при ответе.
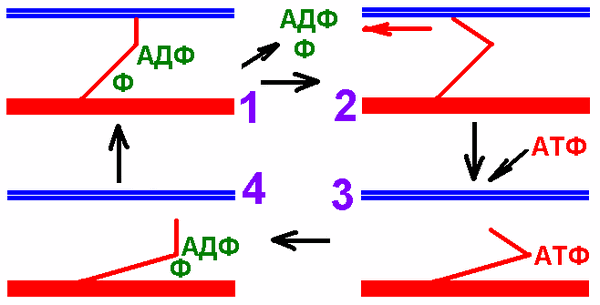
Рис. 709270834. Рабочий цикл миозиновых мостиков поперечнополосатого миоцита.
Головка миозина совершает около пяти циклов в секунду.
Когда одни головки миозина толстой нити производят тянущее усилие, другие в это время свободны и готовы вступить в очередной цикл.
Следующие друг за другом гребковые движениястягивают тонкие нити к центру саркомера. Скользящие тонкие нити тянут за собой Z-линии, вызывая сокращение саркомера. Поскольку в процесс сокращения практически одномоментно вовлечены все саркомеры мышечного волокна, происходит его укорочение.
До тех пор, пока в межфибриллярном пространстве имеется Ca 2+ , циклы будут повторяться. Это быстрое прикрепление, разрушение и новое прикрепление поперечных мостиков происходит повторно с большой скоростью и во многих участках миофиламентов во время мышечного сокращения и прекращается, когдаCa 2+ уходит из межфибриллярного пространства в цистерны или когда молекулы АТФ образуются не столь быстро, чтобы полностью обеспечивать «зарядку» энергией поперечные мостики.
Напряжение, развиваемое мышечным волокном, зависит от числа замкнутых поперечных мостиков, а скорость развития напряжения — от числа замкнутых поперечных мостиков, образуемых в единицу времени, т.е. от скорости их прикрепления к актину. По-видимому, даже при максимальном возбуждении только часть поперечных мостиков эффективно связана с актиновыми миофиламентами. При повышении скорости укорочения мышцы число прикрепленных поперечных мостиков в каждый момент времени уменьшается. Это и объясняет падение силы сокращения мышцы с увеличением скорости ее укорочения.
Если же мышца не укорачивается (при изометрическом сокращении), напряжение в мышечных волокнах создается за счет повторного прикрепления поперечных мостиков на одних и тех же фиксированных участках актиновых нитей. В этом случае никакой внешней работы не совершается, а энергия (АТФ) расходуется на поддержание напряжения мышцы. Тяга, развиваемая сократительными элементами в миофибриллах, передается сарколемме и через нее — на сухожилия мышц.
Период химико-механических изменений в сократительном миофибриллярном аппарате мышечного волокна, на протяжении которого в нем возникает и поддерживается активная механическая тяга, определяющая процесс сокращения, называется периодом активного состояния.
Миозин в мышечных волокнах
Дана характеристика молекулы миозина: длина, толщина и молекулярная масса. Описана также структура молекулы миозина: головок и хвоста. Подробно описано формирование толстого филамента путем самосборки и факторы, отрицательно влияющие на этот процесс.
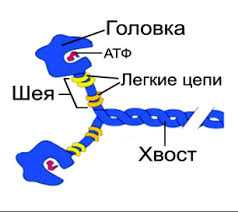
Основу толстого филамента саркомера (миофибриллы) составляет белок миозин. Впервые белок миозин был выделен из скелетных мышц в начале XX века.
Характеристика молекулы миозина
Молекула белка миозина (миозина II типа), который участвует в сокращении саркомера, имеет молекулярную массу 500 кДа. Длина молекулы равна 150 нм, а толщина - 2 нм. Молекула миозина образована четырьмя полипептидными цепями, две из которых (тяжелые) имеют молекулярную массу по 200 кДа, а две - легкие 20 и 17 кДа.
Рис. 1. Состав и структура молекулы миозина
Состав и структура молекулы миозина
Молекула миозина состоит из «хвоста» или «стержня» и двух «головок» (рис.1). Хвост миозина состоит из двух цепей, каждая из которых свернута в α-спираль. Две α-спирали дополнительно скручены в суперспираль. Эта суперспираль является стержнем (хвостом) миозиновой молекулы. Ее длина равна 135 нм.
На верхнем конце стержня две нити расходятся, сплетаются с дополнительными двумя легкими цепями и формируют две миозиновые головки. За счет головок длина миозиновой молекулы достигает 150 нм , а толщина - 2 нм. По этим характеристикам молекула миозина превосходит все молекулярные структуры, имеющиеся в природе.
Соединение между головкой и стержнем молекулы миозина подобно шарниру. Это позволяет головкам наклоняться и прикрепляться к молекулам актина.
АТФ-азная активность миозина
В 1939 году советскими учеными В.А. Энгельгардом и М.Н. Любимовой было установлено, что молекула миозина обладает АТФ-азной активностью, то есть участвует в реакции гидролиза АТФ - основной реакции энергообеспечения мышечной деятельности энергией. Позже было установлено, что на каждой миозиновой головке имеются центры. В одном из них находится фермент АТФ-аза. Другой центр предназначен для связывания головки миозина с тонким филаментом (рис.2).
Рис.2. Молекула миозина состоит из двух длинных полипептидов (тяжелых цепей), формирующих две глобулярные головки и стержнеобразный хвост, участвующий в образовании толстого филамента. Головки содержат актин-связывающие участки (А) и моторные области (М), где происходит связывание и расщепление АТФ. Вблизи головок с тяжелыми цепями ассоциированы две пары легких цепей, одна из которых содержит участок фосфорилирования (Ф).
В настоящее время на основе степени активности фермента АТФ-азы производится разделение мышечных волокон на типы.
Формирование толстого филамента
Несколько сотен миозиновых молекул способны самопроизвольно собираться в пучок. При таком объединении молекулы миозина располагаясь параллельно друг другу с некоторым сдвигом образуют своеобразный «ствол» (рис.2). Толщина «ствола» составляет 11-14 нм. В середине «ствола» переплетаются хвосты молекул миозина, а с двух концов «ствола» торчат головки. Это и есть толстый филамент (рис. 3 и рис.4).
Рис.3. Молекула миозина и толстый филамент Рис.4. Толстый филамент
Установлено, что агрегация (самосборка) толстого филамента очень чуствительна к рН саркоплазмы. Если рН саркоплазмы находится вне физиологических значений (рН = 7,2-7,5), самосборка толстых филаментов происходит нерегулярно и возникают очень длинные разветвляющиеся структуры (Дж. Бендолл, 1970). Из этого следует, что синтез белков, пока в мышечных волокнах много молочной кислоты (лактата) отставлен, так как могут синтезироваться «неправильные» толстые филаменты, саркомеры и миофибриллы.
Результирующее действие мышц в организме человека
В пятой лекции по дисциплине «Биомеханика мышц» анализируется результирующее действие мышц в организме человека. Дается понятие рычага, видов рычагов. Приводятся примеры рычагов различного рода. Формулируется правило рычага.
Лекция 5
5.1. Понятие рычага
В естественных условиях скелетные мышцы действуют через костные рычаги, а рычаги представляют собой механизмы, известные еще со времен классической древности.
Рычаг - твердое тело, способное вращаться вокруг неподвижной опоры (оси вращения), на которое действуют, по крайней мере, две силы с противоположными моментами вращения.
Одну из них обычно называют движущей (в нашем случае - сила мышц), а другую - силой сопротивления (сила тяжести, вес груза). Использование рычага позволяет получить выигрыш в силе. Для расчета выигрыша в силе существует правило, открытое Архимедом в III веке до н. э. Это правило называется правилом рычага.
Для того чтобы уравновесить меньшей силой большую силу, необходимо, чтобы ее плечо превышало плечо большей силы. Выигрыш в силе, получаемый с помощью рычага, определяется отношением плеч приложенных сил, рис.5.1.
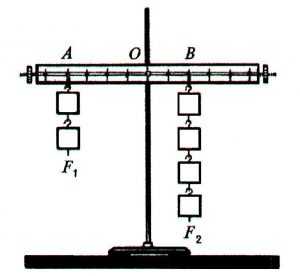
Рис. 5.1. Схема, иллюстрирующая правило рычага
В 1687 году французский физик П. Вариньон придал этому правилу общий вид, применив понятие момента силы.
Моментом силы называется физическая величина, по модулю равная произведению силы на ее плечо: M=Fh, где: M - модуль момента силы, F- сила, h - плечо силы.
Плечо силы - перпендикуляр, опущенный из центра вращения на линию действия силы.
Правило моментов, сформулированное П. Вариньоном:
Рычаг находится в равновесии, если момент силы, вращающей его по часовой стрелке, равен моменту силы, вращающей его против часовой стрелки.
Более подробно функционирование опорно-двигательного аппарата человека и биомеханика мышц описаны в книге:
В механике различают два вида рычагов.
В рычаге первого рода действующие силы расположены по разные стороны от точки опоры. В механике существует закон, открытый в начале новой эры Героном Александрийским. Этот закон называют «золотым правилом» механики.
Выигрывая с помощью механизма в силе, мы во столько же раз проигрываем в пути и наоборот.
Выигрыш в силе означает, что прикладывается меньшая сила. Техническим механизмом, построенным по принципу рычага первого рода, являются ножницы. Ножницы для резки металла имеют длинные рукоятки и короткие лезвия (выигрыш в силе). Ножницы для резки бумаги имеют короткие рукоятки и длинные лезвия (выигрыш в пути). Конструкция весла, используемого в академической гребле, также дает выигрыш в пути (проводка весла) и проигрыш в силе, прикладываемой гребцом к веслу.
В рычаге второго рода действующие силы приложены по одну сторону от точки опоры. Техническим механизмом, реализующим этот рычаг, является тележка с грузом.
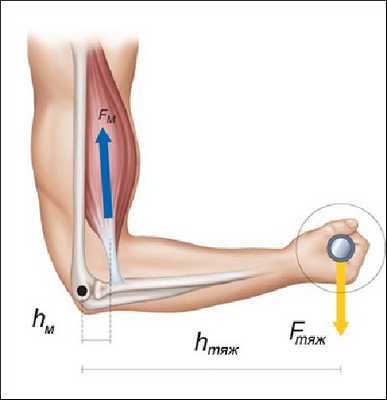
5.2. Звенья тела, как рычаги
Костные звенья, соединенные подвижно суставами, с позиции механики, представляют собой рычаги. Сустав при этом является точкой опоры рычага. Примерами рычагов первого рода у человека являются кости нижней конечности и антигравитационные мышцы, противодействующие силе тяжести. Так, сила тяжести Fтяж создает момент силы по одну сторону тазобедренного, коленного и голеностопного суставов, а сила тяги мышц Fм - по другую. Точками опоры рычагов являются тазобедренный, коленный и голеностопный суставы[1]. Человек сможет сохранять неподвижную позу, изображенную на рис 5.2, если момент силы тяжести, создаваемый вышерасположенными звеньями тела Fтяжhтяж будет уравновешен мышечным моментом, Fмhм т.е. будет иметь место равенство: Fтяжhтяж= Fмhм.
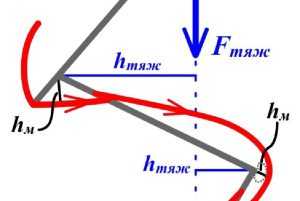
Рис.5.2. Пример рычагов первого рода
Чтобы противодействовать силе тяжести в антигравитационных мышцах человека, в течение длительного времени произошли следующие изменения: увеличился их физиологический поперечник, некоторые из них имеют перистую архитектуру. Кроме того, увеличились плечи силы тяги мышц за счет костных выступов (седалищный бугор и пяточный бугор), а также сесамовидных косточек (надколенник).
В рычаге второго рода действующие силы приложены по одну сторону от точки опоры. Примером рычага второго рода является предплечье с грузом (рис. 5.3.).
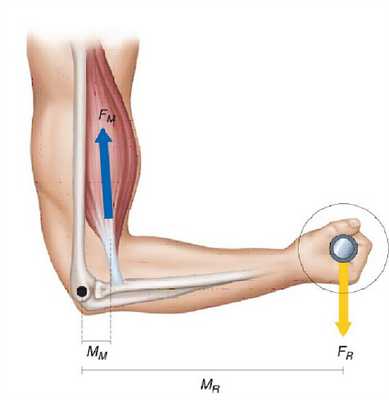
Рис.5.3. Пример рычага второго рода
Сила тяжести Fтяж и противодействующая ему сила мышечной тяги Fм приложены по одну сторону от точки опоры (локтевой сустав). Рычаг находится в равновесии, если выполняется то же условие, что и для рычага первого рода:. Fтяжhтяж= Fмhм.
Сила тяги мышцы, как правило, приложена на более коротком плече костного рычага. Поэтому, для уравновешивания рычага сила тяги мышцы должна быть во столько раз больше противодействующей силы, во сколько раз плечо ее силы тяги меньше плеча противодействующей силы. В связи с этим для костных рычагов почти всегда имеется проигрыш в силе, но выигрыш в пути и, как следствие - скорости перемещения внешнего груза («золотое правило» механики). Таким образом, биомеханизм характеризуется следующей особенностью: Имеется проигрыш в силе тяги мышц, но выигрыш в пути и в скорости перемещения груза или другого звена.
Рекомендуемая литература
1. Зациорский, В.М. Биомеханика двигательного аппарата человека / В.М. Зациорский, А.С. Аруин, В.Н. Селуянов.- М.: Физкультура и спорт, 1981.- 143 с.
2. Кичайкина, Н.Б. Биомеханика двигательных действий /Н.Б.Кичайкина, А.В.Самсонова : учебно-методическое пособие /Под ред Н.Б.Кичайкиной.- СПб: НГУ им. П.Ф.Лесгафта, 2014.- 183 с.
3. Попов, Г.И. Биомеханика двигательной деятельности: учеб. для студ. учреждений высш. проф. образования /Г.И.Попов, А.В. Самсонова.- М.: Издательский центр «Академия», 2011.- 320 с.
4. Самсонова, А.В. Биомеханика мышц: учебно-методическое пособие /А.В.Самсонова, Е.Н. Комиссарова / Под ред А.В.Самсоновой .- СПб., 2008.- 217 с.
[1] В отличие от технических механизмов, для костных механизмов приходится говорить не о точках опоры, а о «поверхности опоры».
Читайте также:
