Критерии подбора донора гемопоэтических стволовых клеток (ГСК)
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
ФБГУ "Гематологический научный центр" Минздрава России, Москва
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
Гематологический научный центр Минздрава России, Москва
Гематологический научный центр Минздрава РФ, Москва, Россия
Подбор неродственного донора для трансплантации гемопоэтических стволовых клеток. HLA-гаплотипы больных с заболеваниями системы крови
Журнал: Терапевтический архив. 2014;86(7): 31‑36
Хамаганова Е.Г., Паровичникова Е.Н., Кузьмина Л.А., Гемджян Э.Г., Чугреева Т.П., Юшкова А.А. Подбор неродственного донора для трансплантации гемопоэтических стволовых клеток. HLA-гаплотипы больных с заболеваниями системы крови. Терапевтический архив. 2014;86(7):31‑36.
Khamaganova EG, Parovichnikova EN, Kuz'mina LA, Gemdzhyan EG, Chugreeva TP, Iushkova AA. Selection of an unrelated donor for hematopoietic stem cell transplantation. HLA haplotypes in patients with blood system diseases. Terapevticheskii Arkhiv. 2014;86(7):31‑36. (In Russ.).
Резюме. Цель исследования. Изучение распределения HLA-А*-B*-C*-DRB1*-DQB1*-гаплотипов у больных с заболеваниями системы крови, установление наиболее часто встречающихся HLA-гаплотипов и сравнение полученных результатов с данными о частоте и распределении наиболее часто встречающихся HLA-гаплотипов у доноров ряда ведущих регистров. Материалы и методы. За период с 2008 по 2012 г. в Гематологическом научном центре (ГНЦ) Минздрава России обследованы 203 больных с заболеваниями системы крови, нуждавшихся в проведении трансплантации аллогенных гемопоэтических стволовых клеток (алло-ТГСК), а также 386 их кровных родственников. У всех при типировании установлен вид HLA-гаплотипа. Среди больных было 97 мужчин в возрасте от 17 до 64 лет (медиана 38 лет) и 106 женщин от 18 до 59 лет (медиана 40 лет). Результаты. У обследованных больных выявлено 265 различных HLA-гаплотипов. Установлен 21 встречающийся с высокой частотой HLA-гаплотип, из них 7 принадлежит к 10 наиболее распространенным у представителей европеоидной расы HLA-гаплотипам. Около 30% больных, нуждающихся в проведении алло-ТГСК и не имеющих HLA-идентичных сибсов, обладали HLA-гаплотипами из числа 10 наиболее распространенных у представителей европеоидной HLA-гаплотипов и, следовательно, могли рассчитывать найти совместимого неродственного донора в течение непродолжительного времени. У обследованных больных установлено большое разнообразие HLA-гаплотипов (265 видов у 203 человек). Это разнообразие, а также экстремальный полиморфизм HLA-аллелей указывают на необходимость иметь в стране крупные регистры HLA-типированных доноров костного мозга. Такие регистры повышают вероятность найти для больного с заболеванием системы крови, имеющего показание к трансплантации гемопоэтических стволовых клеток, HLA-совместимого неродственного донора в течение непродолжительного времени. Проведенное исследование подтвердило существование региональных особенностей в распределении HLA-гаплотипов внутри одного и того же этноса. Заключение. Для российских больных вероятность найти HLA-совместимого донора в крупном национальном регистре, аккумулирующем доноров из различных региональных популяций, существенно выше, чем в иностранных регистрах. Создание в стране крупных когорт HLA-типированных доноров костного мозга из разных регионов страны существенно повысит шансы больных с заболеваниями системы крови найти HLA-совместимого неродственного донора.
Подбор донора костного мозга (КМ) для пациента с заболеванием системы крови, имеющего показание к трансплантации гемопоэтических стволовых клеток (ТГСК), - сложная многоаспектная задача. Наиболее предпочтительными донорами гемопоэтических стволовых клеток (ГСК) служат HLA-идентичные сиблинги (англ. sibling - брат или сестра) пациента, которые вместе с ним наследуют от родителей идентичные гены HLA (Human Leukocyte Antigens), а также другие гены внутри HLA-гаплотипов [1]. (HLA-гаплотипом называют совокупность HLA-генов, лежащих на одной хромосоме. У человека имеется 2 HLA-гаплотипа: один наследуется от отца, другой - от матери; два HLA-гаплотипа образуют HLA-генотип.) С вероятностью примерно 25% (согласно законам наследования Менделя) HLA-гаплотип пациента и его сиблинга совпадают. Для тех пациентов, которым невозможно провести ТГСК от HLA-идентичного сиблинга, возникает необходимость найти неродственного HLA-совместимого донора [2, 3].
Вероятность найти неродственного донора и продолжительность его поиска зависят от распространенности HLA-гаплотипов [4, 6]. Для больных даже с одним HLA-гаплотипом, входящим в десятку наиболее часто встречающихся HLA-гаплотипов, вероятность найти совместимого неродственного донора в течение непродолжительного времени выше, чем для больных, не имеющих такой гаплотип [1, 4-8]. По сравнению с другими пациентами у них сравнительно ниже риск развития тяжелой реакции трансплантат против хозяина (РТПХ) и выше продолжительность жизни. Это объясняется тем, что в случае распространенных HLA-гаплотипов выше вероятность того, что пациент и донор будут не только HLA-идентичными, но и HLA-гаплотипоидентичными, т.е. идентичными не только по HLA-генам, но и по всем другим генам, входящим в HLA-гаплотип [4, 6].
HLA-гаплотипы устанавливаются в семейных (посредством выявления родительских гаплотипов) или в популяционных (на основании неравновесного сцепления между локусами HLA) исследованиях [9]. Отметим, что даже современные компьютерные программы, используемые при проведении популяционных исследований, пропуская низкочастотные HLA-гаплотипы, нередко генерируют артефактные HLA-гаплотипы [5, 9].
Распределение HLA-гаплотипов у больных и здоровых потенциальных доноров может различаться из-за возможной связи между HLA-генами и рядом заболеваний системы крови [10, 11], что снижает вероятность найти совместимого донора ГСК.
Отечественных работ, посвященных исследованию распределений HLA-А*-B*-С*-DRB1*-DQB1* [6] и HLA-А*-B*-DRB1*-гаплотипов, все еще немного [12, 13].
Задачей настоящего исследования являлось изучение распределения HLA-А*-B*-C*-DRB1*-DQB1*-гаплотипов у больных с заболеваниями системы крови (типированных с целью проведения аллогенной ТГСК - алло-ТГСК) Гематологического научного центра (ГНЦ) Минздрава России, установление наиболее часто встречающихся среди них HLA-гаплотипов и сравнение полученных результатов с данными о частоте и распределении наиболее часто встречающихся HLA-гаплотипов у потенциальных доноров в ряде регистров.
Материалы и методы
Определение HLA-гаплотипов больного проводили генотипированием его и его родителей (обоих или одного из них) с последующей при возможности процедурой сегрегации родительских гаплотипов. Предполагается, что больные и сиблинги, совпадающие по одному антигену в каждом из 5 типированных локусов HLA (А*-B*-C*-DRB1*-DQB1*), являются HLA-гаплоидентичными. В случае отсутствия в локусе второго антигена проводилось HLA-типирование с высоким разрешением для подтверждения или опровержения гомозиготности. Если у больного отсутствовал второй аллель в каждом из 5 локусов HLA, его включали в исследование только в том случае, если гомозиготность по HLA-гаплотипам подтверждена при типировании обоих родителей.
Геномную ДНК получали из периферической крови с использованием специальных наборов (корпорации «Invitrogen»). Типирование локусов HLA-А*-B*-C*-DRB1*-DQB1* выполняли методом полимеразной цепной реакции «низкого разрешения», которое при необходимости дополняли типированием с «высоким разрешением» с соответствующими праймерами.
При статистическом анализе построено частотное распределение HLA-гаплотипов у обследованных больных и определены наиболее часто встречающиеся у них гаплотипы. Относительную частоту HLA-гаплотипов вычисляли как отношение общего числа копий гаплотипов к числу обследованных пациентов. Пороговый уровень статистической значимости р принят равным 0,05. Вычисления проводили с использованием программного пакета SAS 9.1. Полученные статистические показатели, характеризуя когорту больных, которые проходят лечение в ГНЦ, имеют самостоятельную ценность, а также могут служить разведочными оценками соответствующих показателей для популяции больных среди населения страны в целом.
Результаты
Частотное распределение заболеваний системы крови обследованных больных оказалось следующим: острые миелоидные лейкозы (ОМЛ) у 63, острые лимфобластные лейкозы (ОЛЛ) у 54, миелодиспластические синдромы (МДС) у 20, хронический миелолейкоз (ХМЛ) у 22, апластическая анемия (АА) у 20, хронические Ph-негативные миелопролиферативные заболевания (хМПЗ) у 7, хронический лимфолейкоз (ХЛЛ) у 7, множественная миелома (ММ) у 3, Т-клеточная лимфома (ТКЛ) у 3, острый недифференцируемый лейкоз (ОНЛ) у 3, В-крупноклеточная лимфома (ВККЛ) у 1. Отметим, что диагнозы ОМЛ и ОЛЛ встречались статистически значимо (р<0,01) чаще других.
У 203 больных выявлено 265 различных HLA-A*-B*-C*-DRB1*-DQB1*-гаплотипов. HLA-гаплотипов, которые встретились 1 раз, было 198, 2 раза - 46, 3 раза и более - 21. HLA-гаплотипы, которые выявлены не менее 3 раз, рассматривались как встречающиеся с высокой частотой [14] (см. рисунок).
Рисунок 1. Частотное (абс. числа) распределение наиболее распространенных (встретившихся не менее 3 раз) HLA-гаплотипов больных ГНЦ, имеющих показания к алло-ТГСК. Такие HLA-гаплотипы установлены у 113 больных (3 из них наследовали одинаковые HLA-гаплотипы от обоих родителей, т.е. являлись гомозиготами по HLA-гаплотипам, что подтвердилось HLA-типированием их родителей).
В группу наиболее часто выявляемых HLA-гаплотипов больных ГНЦ вошли 7 из 10 наиболее часто встречающихся у представителей европеоидной расы HLA-гаплотипов; последние определены по данным самого большого регистра доноров КМ европейского происхождения - NMDP (National Marrow Donor Program) [16].
В табл. 1 представлена относительная частота (доля) HLA-гаплотипа среди больных, обследованных в ГНЦ, и доноров КМ ряда регистров (регистры доноров КМ создаются с целью обеспечения больных, нуждающихся в проведении алло-ТГСК), в частности, самого крупного в мире регистра NMDP по донорам-американцам восточно-европейского происхождения [14], крупнейшего в Европе регистра доноров-немцев КМ - ZKRD (Zentrales Knochenmarkspender Register Deutschland) [17, 18] и регистра доноров Кировской области, организованного на базе Российского научно-производственного центра «Росплазма» Федерального медико-биологического агентства (у этого российского регистра имеются опубликованные данные по пятилокусным HLA-гаплотипам).
Сравнение по распространенности HLA-гаплотипов показало, что среди встречающихся с высокой частотой HLA-гаплотипов обоих российских регистров отсутствовала у половины из 10 наиболее часто встречающихся у представителей европеоидной расы трехлокусных HLA-гаплотипов (см. табл. 2). Из этих 10 гаплотипов 2 (HLA-A*29-B44*-DRB1*07 и HLA-A*02-B*40(60)-DRB1*13) встречались крайне редко у больных ГНЦ. Интересно было провести специальное исследование, которое ответило бы на вопрос, объясняется ли это обстоятельство особенностями самой популяции или эти гаплотипы не характерны для рассмотренных заболеваний системы крови.
Гаплотип HLA-A*02-B*13-DRB1*07 оказался третьим по распространенности у больных ГНЦ (а также у американцев восточно-европейского происхождения) и был четвертым и пятым у доноров российских регистров и финнов. По-видимому, это связано с тем, что данный гаплотип более распространен в восточно-европейской и финской [20] популяциях и менее распространен среди среднеевропейцев и американцев европейского происхождения (у которых этот гаплотип не входит в десятку наиболее распространенных) [5, 16, 18].
Отметим, что примерно у каждого третьего (60 из 203) HLA-типированного в ГНЦ больного имелся, по крайней мере, 1 из 10 наиболее распространенных у европеоидов HLA-гаплотипов.
Проведенное исследование выявило у 203 больных 265 различных HLA-гаплотипов. Лишь около 30% больных, которым показано проведение алло-ТГСК (но у которых отсутствует HLA-идентичный сиблинг), имели хотя бы один (из двух возможных) HLA-гаплотипов, входящий в десятку наиболее распространенных у представителей европеоидной расы HLA-гаплотипов; иными словами, лишь примерно каждый третий больной мог рассчитывать найти совместимого неродственного донора в течение непродолжительного времени. Отметим еще раз, что HLA-гаплотипоидентичность с донором КМ существенно снижает у этих больных риск развития тяжелой формы РТПХ. В реальности таких больных даже несколько меньше, чем согласно приведенной оценке, поскольку по меньшей мере 2 из 10 наиболее распространенных у представителей европеоидной расы трехлокусных HLA-гаплотипа распадается на различающиеся варианты, которые могут не совпадать у больного и потенциального донора. Так, гаплотип HLA-A*02-B*15(В62)-DRB1*04 имеет 2 варианта, имеющие разные аллели локуса С и встречающиеся у представителей европеоидной расы одинаково часто: A*02-B*15(B62)-C*03:04(Cw10)-DRB1*04-DQB1*03(DQ8) и A*02-B*15(B62)-С*03:03(Cw9) -DRB1*04-DQB1*03 (DQ8), гаплотип HLA-A*02-B*40(B60)-C*03(Cw10)-DRB1*13-DQB1*06 также имеет 2 варианта генов: HLA класса 2: HLA-DRB1*13:01-DQB1*06:03 и (более распространенный) HLA-DRB1*13:02-DQB1*06:04 [1].
В целом профили распределения HLA-гаплотипов у обследованных больных ГНЦ и у доноров - представителей европеоидной расы схожи, однако есть и особенности, в частности, распространенность HLA-гаплотипа A*03-B*07-C*07-DRB1*15-DQB1*06 у обследованных больных статистически значимо превышала частоту других HLA-гаплотипов (что не наблюдается у доноров - представителей европеоидной расы). Можно предположить, что этот HLA-гаплотип ассоциирован (возможно, через антигены В7-DR15, имеющие низкую иммунную реактивность) с определенными заболеваниями системы крови [3, 7].
У 203 больных с заболеваниями системы крови, нуждающихся в проведении алло-ТГСК, установлено большое разнообразие HLA-гаплотипов (265 различных типов). Большое разнообразие HLA-гаплотипов, а также экстремальный полиморфизм HLA-аллелей являются прямым доказательством необходимости создания в стране крупных регистров HLA-типированных доноров КМ, имеющих в своем арсенале все наиболее распространенные HLA-гаплотипы.
Проведенное нами исследование подтверждает существование внутри одного и того же этноса региональных особенностей распределения HLA-гаплотипов, на что указывают, например, данные доноров КМ различных областей Восточно-Европейской равнины [12, 13, 21]. Отсюда следует, что для российских больных того или иного региона вероятность найти HLA-гаплотипоидентичного донора в крупном национальном регистре, аккумулирующем доноров из различных региональных популяций, существенно выше, чем в регистрах европейских популяций.
Заключение
Создание в России крупных национальных регистров (регистра) с широким спектром HLA-А-B-C-DRB1-DQB1-типированных доноров из разных регионов страны существенно повысит шансы больных с заболеваниями системы крови найти HLA-совместимого неродственного донора в течение непродолжительного времени.
Как устроено донорство костного мозга: мифы, страхи, побочные эффекты
Это кроветворная ткань, которая находится в крупных костях человека. В костном мозге есть гемопоэтические (кроветворные) стволовые клетки (ГСК), когда они делятся и созревают — образуются все виды клеток крови: эритроциты, лейкоциты, тромбоциты. ГСК — отправная точка для процесса кроветворения в организме. Процесс их деления практически ничем не ограничен: из небольшого числа ГСК может появиться множество «дочерних» клеток, они будут делиться дальше, созревать, а из них образовываться другие клетки крови.
Из-за такой способности ГСК к делению, они чувствительны к цитостатической химиотерапии и облучению. Поэтому процесс кроветворения может нарушиться во время лечения онкологических заболеваний (у людей, проходящих высокодозную химиотерапию, как правило, этот процесс останавливается). Если ввести такому пациенту подходящие ГСК, они смогут заселить костный мозг пациента своими «дочерними» клетками и восстановить кроветворение. Соответственно, цель врачей — собрать достаточное количество ГСК у здорового человека (донора) и пересадить их больному (реципиенту).
А как его достают? Большим шприцем из позвоночника?
Костный мозг — не спинной, поэтому никто не будет выкачивать у доноров стволовых клеток жидкость из позвоночника. Собрать клетки можно двумя способами. Первый и самый распространенный — взять их из крови. В таком случае донору предварительно на протяжении нескольких дней вводят подкожно препарат — стволовые факторы роста, что стимулирует выход ГСК из костного мозга в кровь.
Сам забор клеток из крови очень похож на обычное донорство компонентов крови, например, тромбоцитов. Человека сажают в кресло, из вены берут кровь, она фильтруется в аппарате. Дальше машина забирает себе стволовые клетки, а все остальное возвращает обратно донору. Процесс длится несколько часов.
Во втором случае берут не кровь, а сам костный мозг. Для этого донору делают общую анестезию, шприцем прокалывают тазовую кость и берут литр смеси костного мозга и крови (это не более 5 % всего костного мозга). После из взятой смеси выделяют стволовые клетки. Операция длится примерно полчаса, а донор в этом случае около двух дней проводит в стационаре. После процедуры могут быть болезненные ощущения, которые снимаются обезболивающими.
Второй вариант используется существенно реже, когда врачам не удается собрать периферические, то есть циркулирующие в крови, ГСК. Поскольку он сложнее, соглашаются на него в основном родственники нуждающегося в трансплантации. Впрочем, донор сам может выбрать способ забора клеток.
По данным американской компании Be The Match, которая курирует самый большой регистр (банк) доноров костного мозга в мире, хирургическое вмешательство для забора стволовых клеток требуется в 23 % случаев. По другим цифрам — американского Института юстиции — хирургическая процедура делается в 30 %, а в 70 % — стволовые клетки забирают через кровь.
Любой ли костный мозг подойдет больному или он чем-то отличается?
Нет, костный мозг у каждого свой. Найти себе донора с подходящими стволовыми клетками сложнее, чем с кровью. Иногда среди родственников пациента может оказаться потенциальный донор костного мозга, но так бывает только в 50 % случаев. Если среди родных нет никого подходящего, нужно искать человека с таким же HLA-генотипом (это цифровой показатель генов, он отвечает за тканевую совместимость).
Найти донора можно через регистры (банки) доноров костного мозга. В них содержатся данные людей, прошедших фенотипирование — исследование клеток и генотипа — и согласившихся стать донорами ГСК.
А как выглядят банки костного мозга?
Это не огромные больницы с генетическими материалами, а электронные базы, компьютерная сеть, в которой хранится информация о генотипе потенциальных доноров и больных. Система определяет, насколько совместимы донор и реципиент.
Совместимость у всех разная. У каждой клетки человека есть свой набор рецепторов — главный комплекс гистосовместимости. Рецепторы находятся на поверхности клетки, и по ним можно определить информацию о белках, которые находятся внутри. Так клетки собственной иммунной системы могут вовремя определять нарушения среды внутри клетки и устранять их или сигнализировать о них. До какого-то момента иммунная система способна таким образом распознавать наличие опухоли.
по теме

Лечение
Зафиксирован второй случай излечения от ВИЧ. На самом деле он третий
Для трансплантации необязательна совместимость групп и резус-факторов крови, важнее именно генетическая совместимость. Среди идеально подходящего неродственного донора и родственного донора, совпадающего не по всем пунктам, врачи выберут, скорее всего, последнего, потому что с ним ниже вероятность отказа от донации.
Порой больному подходят сразу 50-70 доноров, но бывает, что «генетический близнец» в регистре вовсе не находится. В последнем случае можно попробовать организовать донорские акции, чтобы больше людей прошли типирование, но в любом случае, если подходящего донора нет в банке, помочь пациенту не получится. Каждый год не менее трех тысяч людей умирают, потому что не смогли найти себе подходящего донора.
Пациент и донор с одним и тем же этническим происхождением вероятнее подойдут друг другу. Чем больше людей проходит типирование, тем больше в регистрах разных генетических данных, а значит, выше вероятность совместимости пациента и донора.
По данным американской компании Be The Match, больше всего проблем с поиском донора костного мозга у темнокожих людей, индейцев, уроженцев Аляски, азиатов, коренных гавайцев и других жителей островов Тихого океана, латиноамериканцев и метисов. Американский Институт юстиции сообщает, что афроамериканцы, у которых нет родственного донора, находят себе подходящего только в 25 % случаев, при этом, если донора нашли, в 80 % случаев это единственный вариант в реестре. Для азиатов этот показатель равен 40 %, для латиноамериканцев — 45 %, для европейцев — 75 %. Конкретный процент для метисов в статистике не приводится, но институт уточняет, что для них ситуация гораздо хуже.
Зачем нужны доноры костного мозга?
Еще один большой реестр доноров костного мозга в нашей стране находится в ведении «Русфонда» — Национальный регистр доноров костного мозга имени Васи Перевощикова. Он существует с 2013 года и объединяет 12 региональных российских регистров и один казахский. На 31 октября 2019 года в нем состояли 29 178 доноров костного мозга.
Семочкин приводит пример, что зачастую кавказцы не могут найти своего «генетического двойника» в европейской базе. Но у них больше детей в семье, поэтому выше вероятность найти родственного донора. Огромная проблема с поиском доноров и у малочисленных этносов, например, жителей Крайнего Севера. Как правило, найти донора им не удается.
Единственное решение проблемы — вступление в национальный регистр как можно большего количества людей разных национальностей. Как объясняет Семочкин, затраты на трансплантацию клеток и все остальные процедуры российского пациента с российским же донором не превышают 160 000 рублей. В то же время процедуры и трансплантация с донором из европейского банка требуют порядка 20 000 евро. Государство не может выделить такие деньги, у пациентов их тоже, как правило, нет — финансирование ложится на благотворительные фонды.
Как стать донором?
В России стать донором может любой здоровый гражданин РФ без хронических заболеваний в возрасте от 18 до 45 лет, в некоторых случаях — до 50 лет. Возраст имеет значение: чем моложе донор, тем выше концентрация клеток в трансплантате и их «качество».
Студентка магистратуры МГИМО Ирина стала донором костного мозга в конце октября этого года. До этого она с 18 лет регулярно сдавала кровь и тромбоциты в донорских организациях. Три года назад она прочитала колонку Валерия Панюшкина «Встреча» о том, как познакомились донор и реципиент, и окончательно решила сдать костный мозг.
Первый шаг — сдача крови на типирование. Это можно сделать в любой из крупных частных медицинских лабораторий или в лабораториях некоторых медицинских центров или регистров. Посмотреть полный список центров, позволяющих попасть в банк «Русфонда», можно здесь.
Ирина выбрала Национальный медицинский исследовательский центр гематологии. Там она сдала около 10 миллилитров крови на типирование и подписала соглашение о вступлении в регистр. Оно ни к чему не обязывает донора — можно отказаться в любой момент. Но это важно для реципиента — за 10 дней до пересадки стволовых клеток проводится высокодозная химиотерапия, которая полностью уничтожает кроветворную и иммунную системы. Поэтому отказ в последнюю минуту может быть губителен для того, кто ждет трансплантации.

«В поисках исцеления». Что нового было на конференции CROI-2019?
«Я тогда почувствовала большую ответственность. Стояла на перекрестке и думала: а вдруг меня сейчас собьет машина, и я не смогу сдать. Меня это не то чтобы особо напрягало, но я стала отвечать на все звонки с незнакомых номеров, мало ли», — вспоминает она.
Через два года Ирине в мессенджер с неизвестного номера написали, что она подошла пациенту (из России), позвали на расширенное типирование, а также сдать анализы на ВИЧ и гепатит. Результаты анализов она ждала еще пять дней, параллельно врачи обследовали остальных подходящих доноров. Ответ прислали также в мессенджере: совместимость Ирины с пациентом 9 из 10, а у другого донора 10 из 10, врачи выбрали его.
Спустя полгода ей снова позвонили, оказалось, что пересадка так и не состоялась, а донор все еще был нужен. Она приехала в центр гематологии, поговорила с врачом, сдала кровь на биохимию, ВИЧ, сифилис, сделала флюорографию и ЭКГ. Через несколько дней позвали на уколы. Количество уколов зависит от веса донора, в среднем, делают 1-2 укола в день на протяжении трех дней. Ирине назначили дважды в день. Родителям она не стала говорить про свое донорство — не поняли бы. Поэтому приходилось прятать шприцы с лекарством в упаковках от зубной пасты в холодильнике.
По словам девушки, побочные эффекты были незначительные: на второй день появилась небольшая ломота в костях, «будто провела ночь в неудобной кровати», на третий — ощущение «тяжелой головы». Все это время врачи были на связи. Медицинские организации одинаково заботятся и о доноре, и о реципиенте: с момента прохождения необходимых для сдачи процедур донор формально числится как пациент при госпитализации, даже если не лежит в больнице, а сидит дома, как Ирина.
Можно ли донору знакомиться с реципиентом?
Да, но через два года и только если обе стороны согласны. За два года станет понятно, смог ли костный мозг донора прижиться у реципиента. В некоторых европейских странах и США этот срок составляет один год. А в Испании донорам и реципиентам запрещено видеться на протяжении всей жизни. Анонимность обеспечивает безопасность. Если они познакомятся сразу после донации, а через месяц костный мозг не приживется, то родственники больного могут «отомстить» донору, обвинить его в чем-то, в чем он не виноват. Анонимность позволяет избежать этого. С другой стороны такая мера позволяет избегать шантажирования родственников реципиента и вымогательства у них денег.
Донорство костного мозга проводится безвозмездно, можно узнать лишь пол и возраст больного, а также передать что-то анонимное в знак поддержки. Ирина передала открытку, на которой изображены руки, держащие кофейную чашку, на фоне гор. «Я там написала: поправляйся, я в тебя верю. Никакую информацию о себе нельзя указывать, мне даже сказали писать в настоящем времени, чтобы не было окончаний прошедшего времени, по которым можно определить род», — рассказывает Ирина.
Потенциальную встречу с реципиентом девушка не представляет. По количеству взятых у нее стволовых клеток и предполагаемой массе тела, она считает, что ее реципиент — мужчина средних лет. «Я не хочу, чтобы он чувствовал себя обязанным, да и о чем мы будем разговаривать? Я бы хотела, чтобы эта встреча произошла на каком-то мероприятии, в медицинском центре, например. Так мне было бы легче».
Трудно ли восстановиться после донорства костного мозга?
Пообщаться с корреспондентом Ирина смогла уже через пару дней после донации: «Мне важно, чтобы мои друзья и другие люди видели, что я сдала костный мозг и со мной все нормально. Я не лежу после этого в реанимации».
Донор отдает малую часть своего костного мозга — 5 % стволовых клеток здорового человека достаточно для восстановления кроветворения у больного. Потеря части стволовых клеток никак не ощущается, а их объем полностью восстанавливается в течение семи-десяти дней. Оставшиеся в крови донора ГСК самостоятельно обратно всасываются в костный мозг. Повторное донорство возможно уже через три месяца после забора клеток, то есть сдать костный мозг можно несколько раз за жизнь.
На каком уровне находится трансплантация стволовых клеток в России?
По словам Сергея Семочкина, сама российская система пересадки костного мозга очень хорошая, но проблема в нехватке учреждений, делающих трансплантацию, в России их — единицы. Недостаточно учреждений, квалифицированных сотрудников, нет государственного финансирования. После трансплантации реципиент должен еще несколько лет — минимум два года — получать терапию на подавление иммунных реакций. Например, если пациент из региона, а костный мозг ему пересаживали в Санкт-Петербурге, то дальнейшее ведение пациента должно проходить в его регионе. Но это сложно, объясняет Семочкин, врачей в регионах к этому не готовят, они не понимают, что делать. В итоге люди вынуждены постоянно обращаться в федеральный центр, а это тормозит трансплантацию следующих пациентов.
Донорство костного мозга
Под пересадкой костного мозга понимается на самом деле трансплантация гемопоэтических стволовых клеток. Гемопоэтические (кроветворные) стволовые клетки образуются в костном мозге человека и являются родоначальниками всех клеток крови: лейкоцитов, эритроцитов и тромбоцитов.
Кто может стать донором гемопоэтических клеток?
Любой дееспособный гражданин РФ в возрасте от 18 до 45 лет не имеющий абсолютных противопоказаний. Для того чтобы быть зачисленным в регистр доноров костного мозга, потенциальный донор должен ознакомиться и добровольно подписать документы (согласие) о вступлении в регистр и сдать всего 5-10 мл крови.
В целом, противопоказания для вступления в регистр и становления донором костного мозга аналогичны противопоказаниям к донорству цельной крови и ее компонентов
Кто нуждается в пересадке костного мозга?
Для многих пациентов с онкологическими и гематологическими заболеваниями единственным шансом сохранить жизнь является пересадка гемопоэтических стволовых клеток. Это может спасти жизнь тысячам детей и взрослых больных раком, лейкозом, лимфомой или наследственными заболеваниями.
Как происходит типирование костного мозга?
Перед донорством гемопоэтических стволовых клеток нужно пройти типирование (определение HLA-генотипа) костного мозга. И если вы подойдете по типу какому-нибудь пациенту, то Вас пригласят на донорство гемопоэтических стволовых клеток.
Только 30% пациентов, имеющих заболевания, при которых показана трансплантация кроветворных стволовых клеток, могут найти подходящего (совпадающего по антигенам HLA) донора среди членов семьи. Остальным 70% пациентов требуется неродственная трансплантация стволовых клеток костного мозга.
Вероятность совпадения у двух человек HLA-генотипа не превышает 1 : 20 000, а в многонациональной России может составлять 1 : 50 000. Генетические «близнецы» - люди, не являющиеся родственниками, но имеющие идентичные генотипы, определяющие тканевую совместимость. Для поиска таких доноров и нужен регистр потенциальных доноров костного мозга. Поэтому чем больше будет база доноров, у которых определен HLA-генотип, тем выше шанс у больного.
Что происходит после внесения данных в регистр?
При появлении пациента, которому необходимо выполнить трансплантацию костного мозга, его данные HLA-генотипа сравнивают с данными потенциальных доноров, имеющихся в регистре. В результате может быть подобран один или несколько «совместимых» доноров. Потенциальному донору сообщают об этом, и он принимает решение, становиться или нет реальным донором. Для потенциального донора вероятность стать донором реальным составляет не более 1%.
Как происходит процедура донации стволовых клеток?
У донора берут костный мозг одним из двух способов:
- шприцом из тазовой кости (процедура безболезненна под наркозом),
- с помощью медицинского препарата «выгоняют» клетки костного мозга в кровь и собирают их оттуда через периферическую вену. Данная процедура напоминает аппаратный тромбоцитаферез (процедура донорства тромбоцитов), но более продолжительная по времени.
Донор отдает лишь малую часть своего костного мозга. Потеря части стволовых клеток донором не ощущается и их объем полностью восстанавливается в течение 7—10 дней.
5% стволовых клеток донора достаточно для восстановления кроветворения пациента. Пациенту переливают донорский костный мозг, он приживается и начинает производить кровь. Человек спасен!
Как происходит трансплантация стволовых клеток?
Когда донор найден и подтверждена его совместимость, пациент подвергается кондиционированию. Эта процедура направлена на уничтожение собственного костного мозга (пациента), который вырабатывает неправильные клетки крови, и подавление собственного иммунитета пациента с целью снижения риска. Пересадка (трансплантация) гемопоэтических стволовых клеток (ГСК) высокотехнологичный метод терапии очень похожа на процедуру переливания крови: полученные от донора стволовые клетки вливаются реципиенту через локтевую вену. Гемопоэтические (кроветворные) стволовые клетки, своевременно трансплантированные больному, способны восстановить его кроветворение и иммунитет.
Конфиденциальность информации
Информация о генотипе потенциального донора хранится в специальной общей базе, доступ к которой имеют конкретные специалисты трансплантационных центров, при этом контактные данные хранятся отдельно, в конкретном региональном регистре, куда вступал донор. Этим достигается безопасность, конфиденциальность и невозможность утечки данных.
Персональные данные донора до и после (в течение 2 лет) пересадки костного мозга не сообщаются реципиенту, и наоборот. Данная информация может быть передана сторонам только при обоюдном согласии. Таким образом обеспечивается анонимность донорства костного мозга.
Но после процедуры трансплантации донор может передать письмо для своего реципиента, где расскажет о своих мыслях и пожелает скорейшего выздоровления. А уже через два года после пересадки при обоюдном согласии донор может встретится со своим реципиентом и поговорить лицом к лицу.
Во многих странах мира донорство гемопоэтических стволовых клеток — почетное право каждого гражданина!
Если Вы хотите стать донором ГСК, обратитесь в регистратуру или любому сотруднику ОПК лично, по телефону 309-79-81 (добавочный номер 360 -донорский цитаферез; 362 - донорский отдел)
или по адресу: Санкт-Петербург, ул. 2-я Советская, д.16.
Мы ждем Вас с 8.00 до 12.00 с понедельника по пятницу. Для тех, кто не может посетить нас в рабочий день, проводятся акции в воскресенье. Информация о дне проведения акции размещается на сайте института или на нашей страничке в социальных сетях.
Контакты:
Вас проинструктируют о дальнейших действиях. Став донором, Вы можете спасти жизнь больному!
Врачи-специалисты по вопросам подбора совместимого донора гемопоэтических стволовых клеток могут обращаться по телефону
Донорство костного мозга: кто и как может стать донором

20 апреля в России отмечается Национальный день донора. Сегодня донорство ассоциируется в основном с переливанием крови, и действительно это направление наиболее востребовано. Однако врачи говорят и о других возможностях для тех, кто готов помочь в спасении жизни тяжелобольных пациентов. Крайне востребованы доноры костного мозга. Но такой вид донорства все еще вызывает массу вопросов и опасений. MedAboutMe разбирался в том, как проходит процедура и чего ожидать тому, кто решил стать донором.
Что такое костный мозг и зачем нужна его трансплантация
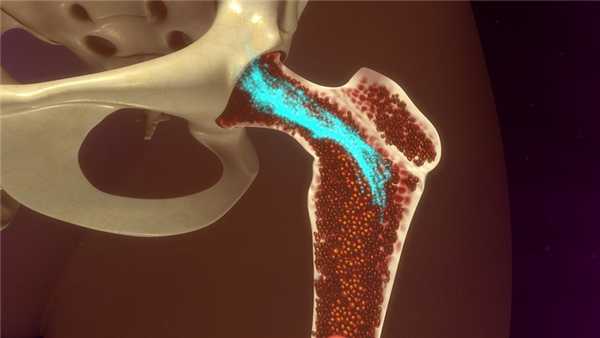
Деятельный костный мозг представляет собой рыхлую красную массу, которая находится внутри трубчатых и тазовых костей, ребер и даже костей черепа. Он не имеет отношения к головному или спинному мозгу, он не связан с нервной системой, а выполняет совершенно другую функцию — именно костный мозг отвечает за процесс кроветворения (гемопоэз). В нем находятся стволовые клетки, причем во взрослом организме это единственный орган, который их содержит. По своей сути это незрелые «заготовки», способные превращаться в специализированные клетки разных тканей. В частности, здесь находятся гемопоэтические стволовые клетки (ГСК, гемоцитобласты), которые вызревают в форменные элементы крови — эритроциты, лейкоциты и тромбоциты.
При ряде онкологических болезней (лейкозе, нейробластоме и других) костный мозг повреждается и начинает вырабатывать дефектные гемоцитобласты. Такие нарушения кроветворения сильно отражаются на здоровье человека и в результате приводят к смерти пациента. На сегодняшний день лучшего лечения, чем трансплантация костного мозга, в этом случае не существует. Пересаженные реципиенту клетки способны восстанавливать гемопоэз. Причем процедуру в норме не нужно будет повторять — ГСК способны делиться, поэтому донорские клетки просто заселяют костный мозг реципиента.
С помощью трансплантации гемопоэтических стволовых клеток можно лечить и другие заболевания. Например, такие генетические болезни, как апластическая анемия или другие дефекты крови. Также такая процедура рассматривается как перспективная в терапии аутоиммунных заболеваний.
Как выбирается донор и что такое регистры
Впервые трансплантация костного мозга была проведена еще в 50-х годах XX века, а уже с начала XXI века ежегодно проводится около 50 000 таких операций. Несмотря на это процедура сопряжена с рядом трудностей. Основная из них — это совместимость реципиента и донора. Неподходящий материал вызывает тяжелый ответ иммунной системы и смерть пациента. Поэтому костный мозг должен быть полностью идентичным на участках ДНК, отвечающих за отторжение, — цепочках генов тканевой совместимости (HLA). Это достаточно длинные и изменчивые участки, поэтому поиск подходящего материала — сложная задача. Как правило, на совместимость сначала проверяют единокровных сестер и братьев, если у пациента они есть. Совпадение встречается лишь в каждом четвертом случае, поэтому большинство нуждающихся в пересадке костного мозга вынуждены искать неродственного донора.
Для облегчения этой задачи в мире созданы базы данных — регистры доноров костного мозга. В них хранится не сам материал, а лишь необходимые данные о каждом доноре, типирование по HLA. Российские регистры увеличиваются с каждым годом, но сейчас там находится около 90 000 кандидатов, что слишком мало. Например, Национальный регистр США NMDP содержит сведения о 9 000 000, а немецкий DKMS — о 5 000 000. Всего в мире насчитывается около 25 000 000 потенциальных доноров.
Но если существуют большие международные базы, почему же для страны так важно наполнять свой регистр?
- Во-первых, вероятность совместимости между людьми одной этнической группы намного выше. И особенно тяжело искать доноров для представителей нацменьшинств.
- Во-вторых, запрос в зарубежные регистры и активизация донора — платная услуга, которая в разных странах может стоить от 20 000 до 50 000 долларов. При этом нужно понимать, что запрос — не гарантия успеха (по разным данным, 20-40% реципиентов так и не удается найти подходящего кандидата).
Требования к донору: кто может попасть в регистры
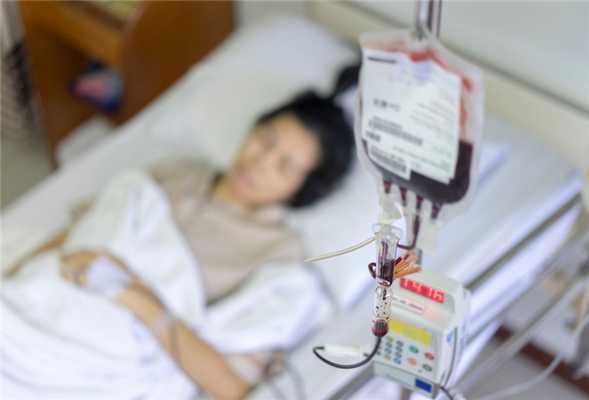
Потенциальным донором стволовых клеток может стать человек от 18 до 55 лет, без сопутствующих заболеваний. Так, не рассматриваются кандидатуры людей, у которых в анамнезе есть следующие диагнозы:
- Вирусные гепатиты В и С.
- ВИЧ.
- Туберкулез.
- Малярия.
- Онкологические заболевания.
- Психические расстройства.
Кроме этого, человек проверяется на вирусы Эпштейна—Барр, цитомегаловирус, вирус простого герпеса и другие. Связано это с тем, что на период трансплантации у реципиента для снижения риска отторжения специально угнетается иммунитет, и эти инфекции, которые в норме никак не влияют на здоровье, могут привести к тяжелому заболеванию.
Если донор отвечает начальным параметрам, у него производится забор крови на HLA-типирование. Для этих целей нужно сдать всего 9 мл крови. Далее данные передаются в регистр. Если впоследствии костный мозг подойдет какому-то больному, донора вызовут в клинику уже для сдачи материала. Далеко не все участники программы станут реальными донорами — по статистике, подойдет лишь один из 700-1000 человек. Иногда от занесения в регистр до вызова в клинику проходит несколько лет.
Как осуществляется донорство, если стволовые клетки подошли
Если данные донора подошли, с ним связываются сотрудники регистра и уточняют, по-прежнему ли он согласен участвовать в программе. После этого человек приглашается в клинику и повторно сдает анализы на инфекции. Забор гемопоэтических стволовых клеток не делается, если на момент трансплантации донор болен, поэтому ему проводится полное обследование. Также повторно делается типирование, чтобы исключить ошибку. Если все в порядке, человек направляется непосредственно на забор гемопоэтических стволовых клеток.
Само понятие «донорство костного мозга» появилось в 60-х годах ХХ века, когда забор осуществлялся непосредственно с кости. В современной медицине это понятие немного устарело, поскольку у донора берут гемопоэтические стволовые клетки, и не во всех случаях для этого требуется прокол кости.
Наиболее популярный современный метод донорства ГСК — это забор крови из вены. Сама процедура мало чем отличается от анализа крови, человек при этом не нуждается в анестезии. Но для того чтобы в крови было достаточное количество гемоцитобластов, перед самим забором донору дают специальный препарат, который заставляет их выходить в кровяное русло. Во время процедуры человек не теряет кровь — ее забирают через одну вену, после прогоняют через сепаратор, в котором оседают ГСК, и возвращают в организм через другую вену.
Забор клеток непосредственно из кости таза также практикуется в современной медицине. В этом случае применяется местная или общая анестезия, материал забирается иглой. Прием препаратов перед процедурой не требуется.
Оба способа безопасны для донора (он сам выбирает более подходящий для себя), они проводятся под контролем профильных специалистов и не приносят вреда здоровью. Некоторое время после процедуры человек может ощущать недомогания, похожие на ОРВИ, но такая симптоматика быстро проходит. Ущерба своему костному мозгу донорство не приносит. Как уже говорилось, гемопоэтические стволовые клетки легко делятся и быстро доходят до необходимой нормы. Ведь даже того незначительного количества, которое трансплантируется реципиенту, достаточно для восстановления функций костного мозга. Теоретически человек может быть донором несколько раз в жизни, полностью его костный мозг восстанавливается через 2 недели, а к следующей процедуре человек готов уже через несколько месяцев.
Критерии подбора донора гемопоэтических стволовых клеток (ГСК)
- 2022 (135)
- октябрь (8)
- Бизнесмен Олег Тиньков встретился со своим донором костного мозга
- Национальный РДКМ готов вступить в Федеральный регистр
- С начала года Национальный РДКМ пополнился почти на 12 тыс. доноров
- 39 полицейских из Нижнего Новгорода сдали образцы буккального эпителия для вступления в Национальный РДКМ
- У Национального РДКМ появился амбассадор в Петербурге
- Большой сентябрь: 970 человек вступили в регистр на акциях ко Всемирному дню донора костного мозга
- Братья по крови. Что происходит с донорством костного мозга в России
- В Барнауле хоккеисты, волейболисты и их болельщики пополнили Национальный РДКМ
- сентябрь (13)
- август (17)
- июль (13)
- июнь (18)
- май (18)
- апрель (18)
- март (8)
- февраль (13)
- январь (9)
- 2021 (202)
- 2020 (123)
- 2019 (151)
- 2018 (64)
- 2017 (47)
- 2016 (16)
- 2015 (11)
- 2014 (12)
- 2013 (5)
- О программе «Русфонд.Регистр»
- История создания регистра
- Счетчик регистра
- Партнеры и друзья регистра
- Как помочь Национальному регистру
- Как стать донором костного мозга
- Где сдать кровь на типирование
- Противопоказания к донорству
- Алгоритм поиска неродственного донора в Национальном РДКМ
- Мобильное приложение Русфонда
- Наши программы помощи
- Видеоархив
- Архив новостей регистра

Донорство костного мозга во всем мире
БЕЗВОЗМЕЗДНО,
ДОБРОВОЛЬНО,
АНОНИМНО
Скачайте буклет
Вам от 18 до 45 лет? Ваш вес больше 50 кг? Вы здоровы и готовы потратить время для спасения чьей-то жизни?
КАК СТАТЬ ПОТЕНЦИАЛЬНЫМ ДОНОРОМ КОСТНОГО МОЗГА - ШАГ ЗА ШАГОМ
1 Выбрать способ вступления в регистр:
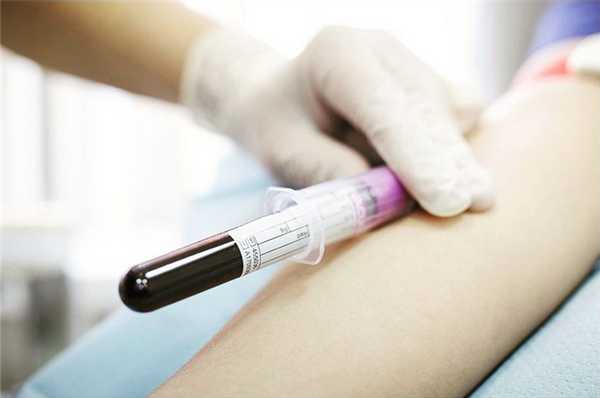
Сдать кровь на типирование (исследование набора генов, отвечающих за тканевую совместимость).
Сдать кровь на типирование можно в любом медицинском офисе «Инвитро», CMD или ДНКОМ, а также в любой лаборатории «МедЛабЭкспресс» в Пермском крае. Выберите ближайший к вам адрес медицинского офиса и уточните время работы на сайте партнеров.
2 Заполнить необходимые документы:
3 Сдать биоматериал для типирования.
В зависимости от выбранного способа вы сдаете 4 мл крови или самостоятельно берете мазок из полости рта.
4 Пройти типирование.
В специализированной лаборатории, куда поступит ваш биоматериал - образец крови или буккального эпителия, - определят ваш HLA-фенотип (цифровой код генов, отвечающих за тканевую совместимость). В течение шести месяцев по электронной почте вы получите уведомление о том, что исследование ваших образцов проведено, HLA-фенотип определен и данные внесены в Информационную систему Национального регистра доноров костного мозга имени Васи Перевощикова.
Поздравляем! С этого момента вы в регистре, вы - потенциальный донор костного мозга.
Что же потом?
ОТ ПОТЕНЦИАЛЬНОГО ДОНОРА К РЕАЛЬНОМУ - ШАГ ЗА ШАГОМ
6 Если клетки, совместимые с вашими, понадобятся конкретному больному и вы подтвердите свое согласие стать донором, вам будет предложено приехать в центр заготовки клеток в Санкт-Петербург, где специалисты подробно расскажут о донации (процедуре заготовки кроветворных стволовых клеток). Прежде чем стать реальным донором, вы пройдете полное медицинское обследование, цель которого - сделать забор клеток максимально безопасным. Вы в любой момент можете без объяснения причин отказаться от своего намерения стать донором. Но после совпадения от вашего решения может зависеть жизнь вашего генетического близнеца, поэтому так важно, чтобы вступление в регистр было осознанным.
7 Заготовка ваших кроветворных стволовых клеток может быть выполнена одним из выбранных вами способов:
- Непосредственно из костного мозга: при помощи стерильного шприца под наркозом у вас возьмут небольшую часть костного мозга из тазовой кости; операция продлится около 40 минут; вы проведете в стационаре один-два дня; после операции возможны болезненные ощущения, легко снимаемые таблетками от боли; ваш костный мозг полностью восстановится в срок от одной недели до одного месяца.
- Из периферической (венозной) крови: предварительно вам дадут препарат, «выгоняющий» кроветворные клетки из костного мозга в кровь; кровь возьмут из вены на одной руке, она пройдет через прибор, сепарирующий клетки, и вернется в вену на другой руке; вы проведете в кресле примерно четыре-пять часов, сможете при этом читать, смотреть телевизор; анестезия не требуется; ваши клетки полностью восстановятся в срок от одной недели до одного месяца.
Поздравляем! Вы стали донором костного мозга и подарили шанс на спасение своему генетическому близнецу.
По крайней мере два года ваш реципиент не будет знать, кто стал его донором. Но потом по обоюдному согласию вы сможете встретиться с человеком, которого помогли спасти. Мы с радостью организуем эту встречу!
Читайте также:
- Влияние пульпы на принципы препарирования зуба под коронку. Рекомендации
- Последствия лечения рака у детей
- Показания, доступ и ход операции выключения привратника, панкреатического дренажа при травме
- Челюстно-лицевая ортопедия и протезирование. История челюстно-лицевой ортопедии.
- Источники гемопоэтических стволовых клеток
