Радиационные поражения крупных сосудов. Стенки сосудов при лучевой болезни
Добавил пользователь Morpheus Обновлено: 22.01.2026
Хиросима, Нагасаки, Чернобыль - это черные страницы в истории человечества, связанные с атомными взрывами. Среди пострадавшего населения наблюдались негативные радиационные эффекты. Влияние ионизирующего излучения имеет острый характер, когда в течение короткого времени разрушается организм и наступает смерть, или хронический (облучение небольшими дозами). Третий вид влияния - долгосрочный. Он вызывает генетические последствия радиации.
Воздействие ионизирующих частиц бывает разное. В небольших дозах радиоактивное излучение применяют в медицине для борьбы с онкологией. Но почти всегда оно негативно влияет на здоровье. Малые дозы атомных частиц являются катализаторами (ускорителями) развития рака и поломки генетического материала. Большие дозы приводят к частичной или полной гибели клеток, тканей и всего организма. Сложность в контроле и отслеживании патологических изменений заключается в том, что при получении малых доз радиации симптомы отсутствуют. Последствия могут проявляться через годы и даже десятилетия.
Радиационные эффекты облучения людей имеют такие последствия:
- Мутации.
- Раковые заболевания щитовидной железы, лейкозы, молочной железы, легких, желудка, кишечника.
- Наследственные нарушения и генетического кода.
- Нарушение обмена веществ и гормонального равновесия.
- Поражение органов зрения (катаракта), нервов, кровеносных и лимфатических сосудов.
- Ускоренное старение организма.
- Стерильность яичников у женщин.
- Слабоумие.
- Нарушение психического и умственного развития.
Пути и степень облучения
Облучение человека происходит двумя путями - внешним и внутренним.
Внешняя радиация, которую получает организм, исходит от излучающих объектов:

- космос;
- радиоактивные отходы;
- испытания ядерного оружия;
- естественная радиация атмосферы и грунта;
- аварии и утечки на атомных реакторах.
Внутреннее облучение радиацией осуществляется изнутри организма. Радиационные частицы содержатся в пищевых продуктах, которые человек употребляет (до 97%), и в небольшом количестве в воде и воздухе. Для того чтобы понять, что происходит с человеком после облучения радиацией, нужно понимать механизм ее воздействия.
Мощное излучение вызывает в организме процесс ионизации. Это значит, что в клетках образуются свободные радикалы - атомы, у которых не хватает электрона. Чтобы восполнить недостающую частицу, свободные радикалы отбирают ее у соседних атомов. Так возникает цепная реакция. Этот процесс приводит к нарушению целостности молекул ДНК и клеток. Как результат - развитие атипичных клеток (раковых), массовая гибель клеток, генетические мутации.
Дозы облучения в Гр (грей) и их последствия:

- 0,0007-0,002 - норма получения организмом радиации за год;
- 0,05 - предельно допустимая доза для человека;
- 0,1 - доза, при которой риск развития генных мутаций удваивается;
- 0,25 - максимально допустимая однократная доза в чрезвычайных условиях;
- 1,0 - развитие острой лучевой болезни;
- 3-5 - ½ пострадавших от радиации погибает в течение первых двух месяцев из-за поражения костного мозга и, как следствие, нарушения процесса кроветворения;
- 10-50 - летальный исход наступает через 10-14 дней из-за поражения ЖКТ (желудочно-кишечный тракт);
- 100 - смерть наступает в первые часы, иногда через 2-3 дня из-за повреждения ЦНС (центральная нервная система).
Классификация поражений при радиационном облучении
Облучение радиаций приводит к повреждению внутриклеточного аппарата и функций клеток, что впоследствии вызывает их гибель. Наиболее чувствительны клетки, которые быстро делятся - лейкоциты, эпителий кишечника, кожа, волосы, ногти. Более устойчивы к радиации гепатоциты (печень), кардиоциты (сердце) и нефроны (почки).
Радиационные эффекты облучения
- острая и хроническая лучевая болезнь;
- поражение глаз (катаракта);
- лучевые ожоги;
- атрофия и уплотнение облученных участков кожи, сосудов, легких;
- фиброз (разрастание) и склероз (замена соединительной структурой) мягких тканей;
- уменьшения количественного состава клеток;
- дисфункция фибробластов (матрица клетки, основа при ее появлении и развитии).
- опухоли внутренних органов;
- злокачественные изменения крови;
- умственная отсталость;
- врожденные уродства и аномалии развития;
- рак у плода вследствие его облучения;
- сокращение продолжительности жизни.
- изменение наследственности;
- доминантные и рецессивные мутации генов;
- хромосомные перестройки (изменение числа и структуры хромосом).
Симптомы радиационного поражения
Симптомы облучения радиацией зависят в первую очередь от радиоактивной дозы, а также от площади поражения и продолжительности однократного воздействия. Дети более восприимчивы к радиации. Если у человека есть такие внутренние болезни, как сахарный диабет, аутоиммунные патологии (ревматоидный артрит, красная волчанка), это усугубит влияние радиоактивных частиц.
Однократная радиационная доза наносит большую травму, чем такая же доза, но полученная в течение нескольких дней, недель или месяцев.
При однократном воздействии большой дозы или при поражении обширной площади кожи развиваются патологические синдромы.
Цереброваскулярный синдром
Это признаки облучения радиацией, связанные с поражением сосудов головного мозга и нарушением мозгового кровообращения. Просвет сосудов сужается, поступление кислорода и глюкозы в мозг ограничивается.
- кровоизлияния в мозжечок - рвота, головная боль, нарушение координации, косоглазие в сторону поражения;
- кровоизлияние в мост - глаза не двигаются в стороны, расположены только посередине, зрачки не расширяются, реакция на свет слабая;
- кровоизлияние в таламус - полный паралич половины тела, зрачки не реагируют на свет, глаза опущены к носу, исход всегда летальный;
- кровоизлияние субарахноидальное - резкие интенсивные боли в голове, усиливающиеся при любых физических движениях, рвота, лихорадка, изменение ритмов сердца, скопление жидкости в мозге с последующим отеком, эпилептические припадки, повторные кровоизлияния;
- тромботический инсульт - нарушение чувствительности, отклонение глаз к очагу поражения, недержание мочи, нарушение координации и целенаправленности движений, психическая заторможенность, устойчивое повторение фраз или движений, амнезия.
Гастроинтестинальный синдром
- тошнота, снижение аппетита, рвота;
- вздутие живота, интенсивная диарея;
- нарушение водно-солевого баланса.
Впоследствии развивается некроз - омертвение слизистой кишечника, далее сепсис.
Синдром инфекционных осложнений
Это состояние развивается из-за нарушения формулы крови, как следствие, снижение естественного иммунитета. Возрастает риск экзогенной (внешней) инфекции.
Осложнения при лучевой болезни:
- ротовая полость - стоматит, гингивит;
- органы дыхания - тонзиллит, бронхит, пневмония;
- ЖКТ - энтерит;
- лучевой сепсис - усиливается гноеобразование, на коже и внутренних органах появляются гнойнички.
Орофарингеальный синдром
Это язвенное кровоточащее поражение мягких тканей ротовой и носовой полости. У пострадавшего отечная слизистая, щеки, язык. Десны становятся рыхлыми.
- сильная боль в ротовой полости, при глотании;
- продуцируется много вязкой слизи;
- нарушение дыхания;
- развитие пульмонита (поражение альвеол легких) - одышка, хрипы, вентиляционная недостаточность.
Геморрагический синдром
Определяет степень тяжести и исход лучевой болезни. Нарушается свертываемость крови, стенки сосудов становятся проницаемыми.
Симптомы - в легких случаях мелкие, точечные кровоизлияния во рту, в области заднего прохода, с внутренней стороны голеней. В тяжелых случаях радиационное облучение вызывает массивные кровотечения из десен, матки, желудка легких.
Радиационное поражение кожи
При небольших дозах развивается эритема - выраженное покраснение кожи из-за расширения кровеносных сосудов, позже наблюдаются некротические изменения. Спустя полгода после облучения появляется пигментация, разрастание соединительной ткани, появляются стойкие телеангиэктазии - расширение капилляров.
Кожа человека после радиации атрофируется, становится тонкой, легко повреждается при механическом воздействии. Лучевые ожоги кожи не поддаются лечению. Кожные покровы не заживают и очень болезненны.
Генетические мутации от воздействия радиации

Еще одни признаки радиационного облучения - это генные мутации, нарушение структуры ДНК, а именно одно его звена. Такое ничтожное, на первый взгляд, изменение приводит к серьезным последствиям. Генные мутации необратимо изменяют состояние организма и в большинстве случаев приводят к его гибели. Мутантный ген вызывает такие заболевания - дальтонизм, идиопатия, альбинизм. Проявляются в первом поколении.
Хромосомные мутации - изменение размеров, количества и организации хромосом. Происходит перестройка их участков. Они напрямую влияют на рост, развитие и функциональность внутренних органов. Носители хромосомных поломок погибают в детском возрасте.
Последствия облучения радиацией в глобальном масштабе:
- Падение рождаемости, ухудшение демографической ситуации.
- Стремительный рост онкологической патологии среди населения.
- Тенденция к ухудшению здоровья детей.
- Серьезные нарушения иммунного статуса среди детского населения, которое находится в зонах влияния радиации.
- Заметное сокращение показателей средней продолжительности жизни.
- Генетические сбои и мутации.
Значительная часть изменений, вызванная влиянием радиоактивных частиц, является необратимой.
Риск возникновения рака после облучения прямо пропорционален дозе облучения. Радиация даже в минимальных дозах негативно сказывается на самочувствии и работе внутренних органов. Люди часто списывают свое состояние на синдром хронической усталости. Поэтому после диагностических или лечебных мероприятий, связанных с облучением, необходимо принимать меры по ее выведению из организма и укреплять иммунитет.
Кардиопатии, обусловленные радиотерапией
Данная работа представляет собой систематический обзор литературы Национальной медицинской библиотеки США по теме «кардиопатии, обусловленные воздействием химиотерапии и лучевой терапии». В обзор включены все источники, найденные по ключевым словам: «cardiopathy-induced radiotherapy»
Введение
Совокупность изменений сердца под воздействием лучевой терапии получила название «радиационно-индуцированной болезни сердца», которая включает в себя целый комплекс изменений, возникающий в результате лучевого повреждения миокарда, перикарда, клапанного аппарата, коронарных артерий, проводящей системы сердца [21].
Таким образом, применение химиотерапии и лучевой терапии при лечении онкологических больных приводит к развитию хронической сердечной недостаточности (ХСН).
По результатам фармако — экономических анализов, на лечение ХСН в странах Европы и США ежегодно расходуется 1-2% всего бюджета здравоохранения, что в 5 раз превышает затраты, направленные на лечение всех форм злокачественных новообразований [Фомин И. В. и др. , 2006].
Кардиопатии, обусловленные радиотерапией
В последние десятилетия проблема поражений сердца вследствие радиотерапии приобрела новое значение, прежде всего в связи с существенным увеличением в современном мире числа лиц, подвергшихся радиационному воздействию, как локальному, так и общему. Это касается прежде всего пациентов с ходжскинской лимфой, для которых сердечно-сосудистые осложнения в последующие 30-40 лет после облучения являются основной причиной смерти, больных с раком лёгкого, молочной железы (чаще левостороннего), пациентов, перенёсших трансплантацию, сочетающиеся с тотальным облучением [1, 2, 21].
В настоящее время минимальный порог эффективной лучевой дозы безопасной для сердца не известен. В большинстве случаев стандартная суммарная доза облучения для пациентов с лимфомой Ходжкина составляет 30Гр, для пациентов с раком молочной железы 45-50Гр, и между величиной суммарного облучения и сердечной заболеваемостью последующие годы существует прямая пропорциональная зависимость. С дозой облучения напрямую связана продолжительность жизни больного, которая снижается в результате ускоренного прогрессирование коронароатеросклероза, фиброзных изменений клапанов (чаще левосторонних), перикарда с возникновение фибринозного, реже экссудативного плеврита, самого миокарда с развитием диастолической дисфункции и скорейшего развития терминальной ХСН. 4
В тоже время анализ заболеваемости ССЗ у людей, выживших после взрыва атомной бомбы и многолетнее наблюдения за ликвидаторами аварии на Чернобыльской АЭС показали, что даже малые дозы облучения 1 Гр и менее способны повлиять на состояние сердечной мышцы. Множество исследований показывают, что радиационное облучение области сердца в любой дозе представляет риск для возникновения сердечных событий [ 6].
Постлучевая кардиомиопатия — это гетерогенное заболевание, характеризующиеся дозозависимым прогрессирующим снижением сократительного резерва миокарда, снижением ФВ ЛЖ, повышением жёсткости сердца как за счёт миокарда, так и за счёт перикарда и преждевременной смертью [1].
Патогенез
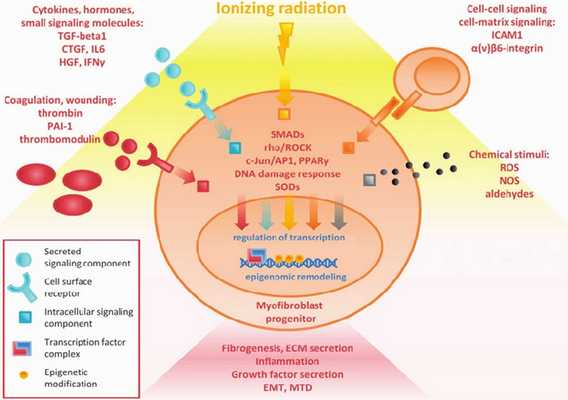
Механизм развития (Рисунок 3) постлучевых повреждений полностью не изучен, но известно, что ионизирующие облучение приводит к микроваскулярным нарушениям, повреждению эндотелия с повышением проницаемости сосудистой стенки, микротромбозу со снижением количества функционирующих капилляров — всё это является следствием запуска воспалительного ответа и причиной активации фиброзного замещения кардиомиоцитов. В миокарде увеличивается содержание коллагена I и III типов, которые вызывают снижение эластических свойств мышцы, повышая конечно-диастолическое давление [7].
Радиационные повреждения сердца включают в себя остро и хронически протекающие изменения. Сразу же после облучения повреждённые эндотелиоциты высвобождают факторы адгезии и пролиферации, активируются клетки воспаления с выделением провоспалительных цитокинов, таких как интерлейкины-1, 6, 8, фактор некроза опухоли-β, основной фактор роста фибробластов, инсулин-подобный фактор роста, соединительнотканный факторы роста, матриксные металлопротеазы разрушающие базальную мембраны сосудов, происходит активацию проонкогенов, c-myc и c-jun, которые поддерживают фиброз в тканях сердца [6, 21].
В позднем периоде происходят глубокие фибринозные изменения, протекающие десятилетия бессимптомно и приводящее в конечном счёте к развитию рестриктивной кардиопатией с умеренным снижением насосной функции ЛЖ или реже дилатационной с выраженными нарушениями показателей диастолической функции ЛЖ [8].
Важным моментом в развитии радио-индуцированной кардиопатии является её растянутое во времени развитие, что приближает её к антрациклинновой кардиопатии и предполагает наличие реорганизации многих белковых структур клетки, митохондриальных белков, повреждения митохондриальной ДНК и оксидативного стресса в её основе [9].
В патогенезе лучевой кардиопатии принимают участие уже известный гипоксия-индуцированный фактор1-α, интерлейкин-1, блокирование рецепторов которого как и в случае с воздействием Доксорубицина препятствует снижению ФВ, но при этом не оказывает влияние на процессы фиброза, ядерный фактор kappa B, представляющий собой белковый комплекс, регулирующий транскрипцию ДНК и участвующий в клеточном ответе на различные стрессовые воздействия, на оксидативный стресс в частности и выявленные недавно в качестве участников длительного асептического воспаления представители каликреин-кининновой системы, работающие посредством митоген-активируемых протеинкиназ [1].
Диагностика
При лучевом поражении сердца ЭКГ изменения обычно выражаются в неспецифических смещениях сегмента ST, низком вольтаже зубцов, появлении и прогрессировании нарушений ритма сердца, развитии внутрижелудочковых блокад, иногда атриовентрикулярных блокад, что, конечно, имеет лишь вспомогательное значения для диагностики кардиопатий.
Широко изучается выявление ЭХОКГ-признаков диастолической дисфункции, как наиболее ранних предвестников развития СН, однако в настоящее время отсутствуют практические руководства по раннему выявлению постлучевой кардиопатии с помощью показателей расслабления миокарда. Несмотря на это большинством экспертов поддерживает обязательное проведение ЭХОКГ спустя 10 лет после проведённой лучевой терапии в качестве мониторинга [2].
Натрий-уретические пептиды и тропонины могут быть использованы в качестве оценки степени лучевого повреждения миокарда, но опять-таки, определённых рекомендаций по их использованию в плане диагностики кардиопатий, обусловленных радиотерапией, не существует [117].
Главный приоритет в диагностике развивающегося интерстициального фиброза миокарда, основного морфологического проявления радиационного воздействия, принадлежит дорогостоящим методикам: МРТ с контрастным усилением, позволяющие выявить по эффекту задержки гадолиния признаки фиброза, происходящие после облучения средостения, перфузионная сцинтиграфия с 99mTс-МИБИ, однофотонная эмиссионная томография, способная визуализировать временные дефекты микроперфузии миокарда, попавшего под облучение, объём которых статистически коррелирует с лучевой нагрузкой 12.
В мировой литературе приводятся данные о применении радионуклиидной ангиографии, определение потребления миокардом кислорода в покое и при физической нагрузке в качестве скрининговых методов диагностики пациентов, прошедших радиотерапию, а также выявление радиационных повреждений сердца посредством обнаружения экстравазальных скоплений альбумина в миокарде [8, 13-17].
Радиопротекция и лечение
Современные методики лучевой терапии способствуют сокращению дозы облучения и уменьшению поля облучения, но неизвестно способствует ли это безопасности или просто оттягивает во времени проявление осложнений, так как, отсутствуют статистически достоверные данные, свидетельствующие об уменьшении долгосрочных событий.
К методикам, способствующим избежать повреждения сердца, относятся:
трёхмерное планирование облучения,
дыхательное стробирование с модуляцией интенсивности облучения,
использование свинцовых блоков для защиты сердца,
Техническое усовершенствование радиотерапевтической аппаратуры, развитие клинической дозиметрии, разработка предлучевой топометрии с использованием компьютерной техники служат основой повышения эффективности лучевой терапии при лечении опухолей. Наличие рентгеносимулятора, компьютерного томографа, возможность использования магнитно-резонансного и позитронного эмиссионного томографа позволяют весьма точно определить границы мишени, подлежащей облучению. Даже такая мелочь, как синхронизация лучевой терапии с дыханием, позволяет уменьшить дозу ионизирующего излучения в органах риска (сердце и лёгкие) и, тем самым, снизить вероятность развития лучевых осложнений.
Экспериментально на крысах были проведены попытки уменьшить лучевой воздействие на сердце путём синхронизации пучка облучения с сердечным циклом, тем самым оказывая воздействие в тот момент, когда миокард находится в состоянии относительной гипоксии [18].
На прогноз пациентов, подвергнутых радиотерапии, влияет возраст, так как известно, что риск поражения сердечно-сосудистой системы при радиационном облучении наиболее высок у лиц молодого возраста, перенесших радиотерапию до 40 лет облучение зоны средостения у детей и подростков, больных лимфогранулематозом, сопровождается ростом кардиальной смертности уже в течение первых пяти лет после облучения [10].
Сердечная смертность значительно увеличивается даже после облучения небольшой дозой в 5Гр в случае присоединения антракциклинов.
Несмотря на то, что радиационные поражения сердечно-сосудистой системы могут возникать в отсутствие факторов риска кардиологических заболеваний, необходимо помнить, что классические факторы риска (артериальная гипертензия, курение и гиперлипидемия) увеличивают риск прогрессирования радиационно обусловленных изменений сердца и требуют более агрессивной терапии [19].
Фармакологические методы предупреждения последствий лучевого воздействия в настоящее время не известны, но идут исследования в направлении препаратов, воздействующих на каликреин-кининовую систему. Так известно, что тучные клетки неожиданно оказывают протективную роль для сердца, посредством подавления активности эндотелина-1. Экспериментальные методы по использованию блокатора эндотелинновых рецепторов Бозентана в настоящее время не дали каких-либо положительных результатов. Также проводятся работы по изучению радиопротективных свойств Пентоксифиллина [4].
Описаны попытки экспериментального воздействия на процесс миокардиального фиброза и оксидативный стресс, индуцированные ионизирующей радиацией, с помощью статинов, гормона мелатонина, известного своими мощными кардиопротективными свойствами, витаминов С, Е, N-ацетилхолина. [20]
В эксперименте на мышах назначение Талидомида, известного седативного препарата, за которым были замечены возможности активировать созревание сосудистой стенки за счёт размножения перицитов, не приводило к защите сердца от радиационного повреждения [21].
В будущем должны быть проведены исследования по оценке эффективности профилактического приёма и-АПФ, ингибиторов минералкортикоидных рецепторов, аллопуринола.
Есть сведения о положительном лечебном эффекте пересадки мезенхимальных стволовых клеток пациенту с радиационной кардиопатией и перикардитом [22].
И наконец, пациенты с радио-индуцированной рестриктивной кардиопатией имеют наихудший прогноз после трансплантации сердца, им чаще требуется механическая поддержка в период ожидании трансплантанта с замещением функции правого желудочка и у них нередко почечная и дыхательная недостаточность вследствие лучевого повреждения соответствующих органов [23].
Однако, выживаемость таких пациентов, согласно данным клиники Мейо, после ортотопической трансплантации сердца в течение 1, 5, 10 лет составила 91, 7%, 75% и 46, 7% соответственно [24].
Таким образом, -радио-индуцированные кардиопатии, несмотря на низкую частоту развития, должны иметь должное внимание со стороны специалистов онкологии и кардиологии. В настоящее время существуют практические руководства, позволяющие уменьшить риск возникновения кардиопатии на фоне химиотерапии. В отношении профилактики радиационного повреждения миокарда ведутся дальнейшие работы.
Список литературы
Mawad R. , Gooley T. A. , Rajendran J. G. , Fisher D. R. et. al. Radiolabeled anti-CD45 antibody with reduced-intensity conditioning and allogeneic transplantation for younger patients with advanced acute myeloid leukemia or myelodysplastic syndrome. Biol Blood Marrow Transplant. 2014 Sep;20 (9): 1363-8. doi: 10. 1016/j. bbmt. 2014. 05. 014. Epub 2014 May 20.
Gyenes G. , Fornander T. , Carlens P. , Glas U. et. al. Myocardial damage in breast cancer patients treated with adjuvant radiotherapy: a prospective study. Int J Radiat Oncol Biol Phys. 1996 Nov 1;36 (4): 899-905.
Mezzaroma E. , Mikkelsen R. B. , Toldo S. , Mauro A. G. et. al. Role of interleukin-1 in radiation induced cardiomyopathy. Mol Med. 2015 Mar 26. doi: 10. 2119/molmed. 2014. 00243.
Lipshultz S. E. , et al; American Heart Association Congenital Heart Defects Committee of the Council on Cardiovascular Disease in the Young, Council on Basic Cardiovascular Sciences, Council on Cardiovascular and Stroke Nursing, Council on Cardiovascular Radiology. (2013) Long-term cardiovascular toxicity in children, adolescents, and young adultswho receive cancer therapy: pathophysiology, course, monitoring, management, prevention, and research directions: a scientific statement from the American Heart Association. Circulation. 128: 1927-95. doi: 10. 1161/CIR. 0b013e3182a88099
Jaworski C, Mariani JA, Wheeler G, Kaye DM. (2013) Cardiac complications of thoracic irradiation. J Am Coll Cardiol. 61: 2319-28. doi: 10. 1016/j. jacc. 2013. 01. 090.
Lipshultz SE, Adams MJ. (2010) Cardiotoxicity after childhood cancer: beginning with the end in mind. J Clin Oncol. 28: 1276-1281. doi: 10. 1200/JCO. 2009. 26. 5751
Taunk N. K. , Haffty B. G. , Kostis J. B. , Goyal S. Radiation-induced heart disease: pathologic abnormalities and putative mechanisms. Front Oncol. 2015 Feb 18;5: 39. doi: 10. 3389/fonc. 2015. 00039. ECollection 2015
Azimzadeh O. , Scherthan H. , Sarioglu H. , Barjaktarovic Z. et. al. Rapid proteomic remodeling of cardiac tissue caused by total body ionizing radiation. Proteomics. 2011 Aug;11 (16): 3299-311. doi: 10. 1002/pmic. 201100178.
Mezzaroma E. , Di X. , Graves P. , Toldo S. et. al. A mouse model of radiation-induced cardiomyopathy. Int J Cardiol. 2012 Apr 19;156 (2): 231-3. doi: 10. 1016/j. ijcard. 2012. 01. 038. Epub 2012 Feb 16.
Herrmann J. , Lerman A. , Sandhu N. P. , Villarraga H. R. et. al. Evaluation and management of patients with heart disease and cancer: cardio-oncology. Mayo Clin Proc. 2014 Sep;89 (9): 1287-306. doi: 10. 1016/j. mayocp. 2014. 05. 013.
Umezawa R. , Ota H. , Takanami K. , Ichinose A. et. al. MRI findings of radiation-induced myocardial damage in patients with oesophageal cancer. Clin Radiol. 2014 Dec;69 (12): 1273-9. Doi: 10. 1016/j. crad. 2014. 08. 010.
van Nimwegen F. A. , Schaapveld M. , Janus C. P. , Krol A. D. et. al. Cardiovascular Disease After Hodgkin Lymphoma Treatment: 40-Year Disease Risk. JAMA Intern Med. 2015 Apr 27. doi: 10. 1001/jamainternmed. 2015. 1180.
Dogan I. , Sezen O. , Sonmez B. , Zengin A. Y. et. al. Myocardial perfusion alterations observed months after radiotherapy are related to the cellular damage. Nuklearmedizin. 2010;49 (6): 209-15. doi: 10. 3413/nukmed-0315-10-05.
Burns R. J. , Bar-Shlomo B. Z. , Druck M. N. , Herman J. G. et. al. Detection of radiation cardiomyopathy by gated radionuclide angiography. Am J Med. 1983 Feb;74 (2): 297-302.
Lipshultz S. E, Adams M. J. Cardiotoxicity after childhood cancer: beginning with the end in mind. J Clin Oncol. 2010 Mar 10;28 (8): 1276-81. doi: 10. 1200/JCO. 2009. 26. 5751. Epub 2010 Feb 8.
Gladstone D. J. , Flanagan M. F. , Southworth J. B. , Hadley V. et. al. Radiation-induced cardiomyopathy as a function of radiation beam gating to the cardiac cycle. Phys Med Biol. 2004 Apr 21;49 (8): 1475-84.
Hong R. A. , Iimura T. , Sumida K. N. , Eager R. M. Cardio-oncology/onco-cardiology. Clin Cardiol. 2010 Dec;33 (12): 733-7. doi: 10. 1002/clc. 20823.
Wagdi P, Fluri M. , Aeschbacher B. , Fikrle A. , Meier B. Cardioprotection in patients undergoing chemo- and/or radiotherapy for neoplastic disease. A pilot study. Jpn Heart J. 1996 May;37 (3): 353-9.
Hoving S, Seemann I, Visser NL, te Poele JA, Stewart FA. Thalidomide is not able to inhibit radiation-induced heart disease. Int J Radiat Biol (2013) 89 (9): 685-91. doi: 10. 3109/09553002. 2013. 788797
Kursova L. V. , Konoplyannikov A. G. , Kal'sina S. Sh. , Baboyan S. B. Allogenic cardiomyoblasts raised from human mesenchymal stem cells in the therapy of radiation cardiomyopathy and pericarditis: case report. Bull Exp Biol Med. 2014 May;157 (1): 143-5. doi: 10. 1007/s10517-014-2510-4. Epub 2014 Jun 10.
Shah S. , Nohria A. Advanced heart failure due to cancer therapy. Curr Cardiol Rep. 2015 Apr;17 (4): 16. doi: 10. 1007/s11886-015-0570-3.
Saxena P. , Joyce L. D. , Daly R. C. et. al. Cardiac transplantation for radiation-induced cardiomyopathy: the Mayo Clinic experience. Ann Thorac Surg. 2014 Dec;98 (6): 2115-21. doi: 10. 1016/j. athoracsur. 2014. 06. 056
Радиационные поражения нервной системы
Радиационные поражения нервной системы - это группа патологий ЦНС, обусловленных воздействием различных форм ионизирующего излучения. Симптомы во многом зависят от поглощенной дозы и объема облученных тканей. В клинике могут превалировать астеновегетативный, менингеальный и интоксикационный синдромы, очаговая симптоматика, моторные и чувствительные расстройства, их комбинации. Диагностика основывается на анамнезе, результатах физикального, лабораторных, реже - аппаратных методов исследования. В ходе лечения применяются противорвотные, сосудистые, анальгетические, метаболические и гемостатические средства, плазмозаменители и препараты крови.
МКБ-10

Общие сведения
Радиационные поражения нервной системы - сравнительно редкая форма лучевой болезни (ЛБ). Низкий показатель заболеваемости обусловлен малой распространенностью потенциально опасных этиологических факторов и тем обстоятельством, что ярко выраженное поражение нервной системы возникает исключительно при сублетальных и летальных дозах облучения. На данный момент на территории бывшего СССР наиболее значимыми инцидентами, связанными с этими патологиями, являются аварии на ЧАЭС и атомных подводных лодках, непредвиденные обстоятельства при работе с радиоизотопными установками, во время которых, согласно статистическим данным, пострадало более 300 человек. Общемировой показатель находится в пределах от 20 до 200 случаев.

Причины
В основе этиологии радиационного поражения нервной системы лежит острое или хроническое воздействие ионизирующего излучения. Излучение может быть как внешним, так и внутренним - при попадании радиоактивных веществ внутрь с водой, продуктами питания или вдыхаемым воздухом, редко - путем всасывания через кожные покровы. К возможным причинам лучевого поражения ЦНС относятся:
- Непосредственная работа с радиоактивными веществами. В группу риска входят лица, трудящиеся на атомных электростанциях, в научно-исследовательских центрах и на производствах, использующих радиоактивные элементы, а также военные ученые, разрабатывающие ядерное оружие.
- Работа с медицинской аппаратурой. Включает медицинский персонал, работающий с компьютерными томографами и рентген-установками. Вероятность развития радиационного поражения ЦНС существует у врачей, проводящих лучевую терапию, и онкобольных пациентов, нуждающихся в подобном лечении.
- Пребывание в зараженной местности. В эту категорию включают людей, которые добровольно или при выполнении профессиональных обязанностей пребывают на территории с повышенным радиационным фоном - в зонах испытаний ядерного оружия, техногенных катастроф с участием радиоактивных элементов.
Механизм развития
Первичные изменения при радиационном поражении ЦНС в дозе до 50 Гр наблюдаются в синапсах, представлены «слипанием» медиаторных пузырьков, находящихся в терминальных отделах пресинаптической мембраны или в синаптической щели. Затем происходит набухание клеток нервной системы, пикноз мозжечковых зернистых клеток. В отдельных случаях эти изменения сочетаются с васкулитами, менингитами, воспалением сосудистого сплетения желудочков мозга и инфильтрацией гранулоцитами. Облучение головного мозга в дозе от 10 до 30 Гр ведет к ингибированию процессов окислительного фосфорилирования. Вероятно, это обусловлено острым недостатком АТФ, который при ЛБ расходуется на процессы репарации поврежденных ДНК.
Одномоментное облучение нервной системы в дозе, превышающей 50 Гр, оказывает прямое разрушающее воздействие на нейроны. Такая доза вызывает большое количество повреждений ядерного хроматина и избыточную активацию ферментов, отвечающих за репарацию ДНК. ДНК-лигазные реакции, протекающие в подобных условиях, характеризуются распадом АТФ до АДФ, который, в свою очередь, вместе с ферментом АДФ-трансферазой приводит к быстрому использованию всего внутриклеточного запаса НАД+. Последний в норме играет роль кофермента в процессе клеточного дыхания, распада глюкозы и обратного синтеза АТФ.
После радиационного поражения в структурах центральной нервной системы появляются признаки общего геморрагического синдрома. Морфологические характеристики процесса включают венозные застои и перерастяжения артериальных сосудов, провоцирующие выход плазмы за пределы кровеносного русла, лакунарные или обширные кровоизлияния в головной мозг. В паренхиматозных тканях ЦНС возникают воспалительные и дистрофически-некробиотические процессы. По мнению некоторых ученых, одну из ведущих ролей в развитии поражения нервной системы играет дисфункция гематоэнцефалического барьера вследствие отмирания эндотелиоцитов мозговых кровеносных сосудов.
Симптомы поражения НС
Признаки дисфункции нервной системы занимают существенную долю в симптоматике лучевой болезни только при условии одномоментного получения дозы ионизирующего излучения более 50 Гр или локального облучения области головы. В иных ситуациях они сочетаются с другими соматическими проявлениями, зависят от дозы и времени, прошедшего с момента воздействия. При ЛБ легкой и средней степени (доза - до 4 Гр) в клинической картине превалируют астенические и нервно-висцеральные симптомы. При тяжелой форме ЛБ (от 4-6 Гр и выше) в неврологическом статусе определяются общемозговые симптомы, менингеальный синдром, реже - очаговая симптоматика, нарушение координации.
Стадии
- На стадии первичной реакции у большинства больных отмечается общая слабость, повышенная утомляемость, апатия, головная боль, головокружение, бессонница, диарея, тошнота и рвота, реже - судороги. У некоторых пациентов выявляется болезненность при пальпации тригеминальных и сосудистых точек. Все вышеописанные проявления формируются в промежутке от 10 минут до 1 часа с момента поражения. Степень их выраженности и скорость возникновения напрямую определяются дозой излучения.
- Второй период - латентный или «мнимого благополучия». В нем наблюдается уменьшение интенсивности первичных симптомов без их полного исчезновения.
- Третья стадия - разгара. Она сопровождается резким усилением неврологического дефицита, формированием отека головного мозга, рассеянной симптоматикой нарушений ЦНС. Клинически сопровождается горизонтальным нистагмом, анизорефлексией, появлением патологических стопных и субкортикальных рефлексов, расстройствами функций черепно-мозговых нервов, дистонией скелетной мускулатуры, координаторными нарушениями. Зачастую этот симптомокомплекс сочетается с вегетативной дисфункцией: колебаниями артериального давления и температуры тела, гипергидрозом, гиперсаливацией.
- Последняя стадия - восстановления или стойких остаточных явлений - характеризуется крайне медленным улучшением общего состояния больного, исчезновением неврологической и интоксикационной симптоматики при сохранении вегетососудистых расстройств и астенического синдрома.
Радиационная астения
Может превалировать одна из типичных форм болезни. Радиационная астения имитирует симптомы невроза, проявляется слабостью, чрезмерной раздражительностью, утратой аппетита, тошнотой, реже - головокружением, эйфорией. В периоде разгара к ним может присоединяться гиперрефлексия, мышечная гипотония, тремор век, языка и верхних конечностей. Менингеальный синдром наблюдается у больных с тяжелыми формами лучевой болезни. При нем отмечаются нестабильные специфические симптомы Кернига и Брудзинского, гипотония скелетных мышц. Коматозная форма развивается при вовлечении в патологический процесс жизненно важных структур, отличается внезапным появлением чувства «горения» всего тела с последующей утратой сознания, сердечно-сосудистой и дыхательной недостаточностью.
Радиационная энцефалопатия
Радиационная энцефаломиелопатия может носить острый или хронический характер. В первом случае патология дебютирует атактическим синдромом, из-за чего возникает спутанность сознания, ярко выраженные менингеальные знаки. Характерная особенность - наличие очаговой симптоматики, определяющейся локализацией деструкции в ЦНС. Возможны внезапные потери сознания, многократная рвота, парезы и параличи, сочетающиеся с геморрагическим синдромом и гастроэнтероколитом. Хронический вариант этой энцефаломиелопатии может сопровождаться аналогичными симптомами, формирующимися на протяжении длительного времени.
Синдром радиационно-токсической энцефалопатии
Данная форма зачастую отмечается в период разгара и может иметь различные клинические формы. Ликвородинамическая отличается непостоянной общемозговой симптоматикой, очаговыми симптомами и когнитивными расстройствами. Гипертензионный вариант проявляется нарастающей цефалгией (в некоторых случаях - вплоть до рвоты), оболочечным синдромом, снижением рефлексов, психомоторным возбуждением. При эпилептической форме возникают приступы тонико-клонических или клонических судорог, опистотонус. Психотическая радиационная энцефалопатия характеризуется нарушением ориентации во времени и пространстве, зрительными и слуховыми галлюцинациями, кататоническим ступором.
Лучевая невралгия
Лучевая невралгия развивается при локальном поражении отдельных периферических нервов. Зачастую она комбинируется с эритематозным или буллезным дерматозом. Типичные проявления - парестезии по типу зуда, онемения, жжения и боли, носящие реактивный или спонтанный характер. Наблюдаются гипестезии, сухость кожи, локальный гипергидроз, алопеция, редко - отеки. Радиационная полиневропатия является результатом облучения нервных сплетений и сочетается с некрозом кожи, подкожной жировой клетчатки, мышц и фасций. Неврологически эта форма сопровождается трудно купируемым локальным болевым синдромом, гипестезией или анестезией, мышечными атрофиями, гипорефлексиями или арефлексиями, вегетативной дисфункцией в области иннервации пораженных нервов.
Осложнения
Через 1-2 месяца после фокального облучения головы может возникать ранняя радиационная энцефалопатия. Клинически она имитирует развитие новообразований головного мозга, после чего спонтанно регрессирует. Спустя 1-2 года после прохождения лучевой терапии может наблюдаться формирование позднего лучевого некроза. Его симптомы зачастую повторяют клинику заболевания, в связи с которым проводилась рентгенотерапия. Через 6 месяцев - 1 год вероятно появление симптомов церебральной атрофии, сопровождающейся когнитивными расстройствами, нарушением функций тазовых органов, ходьбы и другими проявлениями нормотензивной гидроцефалии.
При облучении области шеи выявляются миелопатии, проявляющиеся симптомом Лермитта, синдромом Броун-Секара. Поражение пояснично-крестцового отдела позвоночника характеризуется синдромом двигательного нейрона: фасцикуляциями, мышечными атрофиями, вялыми параличами иннервируемых областей. Отдаленными осложнениями, наблюдающимися спустя годы или десятилетия, являются дисфункции щитовидной и половых желез, гипоталамуса, новообразования ЦНС (глиомы, саркомы, шванномы, менингиомы), окклюзии артерий головного мозга. Последние становятся причинами транзиторных ишемических атак, инсультов.
Диагностика и обследование
Постановка диагноза поражения нервной системы при ЛБ проводится преимущественно на основе данных анамнеза и объективного обследования. К использованию рентгенологических методик прибегают только по жизненным показаниям, поскольку они способны усугубить течение радиационного поражения. Важнейшим аспектом является установление факта воздействия радиационного излучения на организм. Полная программа обследования включает в себя следующие пункты:
- Физикальное исследование. При общем осмотре оцениваются витальные функции, состояние кожных покровов, наличие трофических изменений и фасцикуляций, определяются мышечные атрофии, болезненность тех или иных участков тела. При изучении неврологического статуса врач акцентирует внимание на функции черепных нервов, мышечной силе и тонусе, объеме активных движений, тонусе сухожильных и периостальных рефлексов, наличии патологических рефлексов, участков гипестезии или анестезии.
- Лабораторные тесты. В общем анализе крови отмечается нейтрофильный лейкоцитоз с лимфопенией, которые сменяются лейкопенией, нейтропенией, тромбоцитопенией, анемическим синдромом, анизоцитозом и пойкилоцитозом, резким повышением СОЭ. Позднее в ОАК могут выявляться мегалоциты, мегалобласты, токсическая зернистость нейтрофилов, агранулоцитоз и панцитопения. Уровень лейкоцитов находится в прямой зависимости от тяжести лучевого поражения.
- Нейровизуализация. КТ или МРТ головного мозга, спинальных структур применяются с целью дифференциальной диагностики с другими потенциальными поражениями ЦНС при невозможности установить диагноз иным путем. Методики также информативны в случаях с атрофиями головного мозга, поскольку позволяют выявить расширение желудочков, лейкоареоз, спайки паутинной оболочки. При необходимости оценки уровня метаболизма глюкозы в ЦНС применяют ПЭТ-КТ.
Лечение радиационного поражения НС
Базовыми принципами лечения данной патологии являются раннее купирование неврологической симптоматики, профилактика вторичных осложнений, комплексность лечения с учетом стадии развития патологии. Рекомендуется использование различных терапевтических подходов в зависимости от места и времени, начиная с момента облучения. Таким образом, принято выделять следующие этапы оказания медицинской помощи:
- Доврачебная и первая медицинская помощь. Состоят из эвакуации больного из зоны радиационного загрязнения, первичной санитарной обработки пораженных участков тела, введения противорвотных и сердечно-сосудистых препаратов, анальгетиков, транквилизаторов, противосудорожных и других симптоматических средств, восстановления ОЦК.
- Медицинская стационарная помощь. Подразумевает коррекцию и дополнение лечения предыдущего этапа. На основании результатов лабораторных анализов могут назначаться антибиотики широкого спектра действия, мочегонные, гемостатики, плазмозаменители, растворы для коррекции электролитного спектра крови.
- Специализированная помощь. Проводится на протяжении всего периода лучевой болезни. С учетом состояния больного может выполняться переливание форменных элементов крови и плазмы, коррекция нарушений стволовых функций. При необходимости используются антибиотики, наркотические анальгетики, нейрометаболиты и витамины группы В.
- Период восстановления. Представлен физиотерапевтическими процедурами, направленными на устранение остаточных явлений, нормализацию кровоснабжения и метаболизма ЦНС. Включает различные виды массажа, лечебную физкультуру, магнитотерапию, санаторно-курортное лечение.
Прогноз и профилактика
Прогноз при ЛБ зависит от уровня полученной дозы, эффективности проведенного лечения и наличия у больного отягощающих факторов: артериальной гипертонии, сахарного диабета, других эндокринопатий. В тяжелых случаях при получении сверхвысоких доз развивается так называемая «смерть под лучом». Профилактика патологии основывается на полном исключении или нормализации условий облучения: соблюдении рекомендованной продолжительности рабочего дня и правил защиты (экранирование, индивидуальные дозиметры), ежегодное прохождение медицинской комиссии с оценкой пригодности к соответствующей профессиональной деятельности. В аварийных ситуациях применяется экстренная химиопрофилактика.
1. Военно-полевая и военно-морская терапия (часть 1: острая и хроническая лучевая болезнь). Учебно-методическое пособие / Эмануэль В.Л., Ловицкий С.В. - 2004.
3. Радиационные инциденты с неравномерным облучением человека / Соловьев В.Ю., Барабанова А.В., Бушманов А.Ю.// Саратовский научно-медицинский журнал - 2013 - Т.9, №4.
Лучевая болезнь
Лучевая болезнь - комплекс общих и местных реактивных изменений, обусловленных воздействием повышенных доз ионизирующего излучения на клетки, ткани и среды организма. Лучевая болезнь протекает с явлениями геморрагического диатеза, неврологической симптоматикой, гемодинамическими нарушениями, склонностью к инфекционным осложнениям, желудочно-кишечными и кожными поражениями. Диагностика основывается на результатах дозиметрического контроля, характерных изменениях в гемограмме, биохимических анализах крови, миелограмме. В острой стадии лучевой болезни проводится дезинтоксикация, гемотрансфузии, антибиотикотерапия, симптоматическая терапия.



Лучевая болезнь - общее заболевание, вызываемое влиянием на организм радиоактивного излучения в диапазоне, превышающем предельно допустимые дозы. Протекает с поражением кроветворной, нервной, пищеварительной, кожной, эндокринной и других систем. В течение жизни человек постоянно подвергается воздействию малых доз ионизирующего излучения, исходящего как от внешних (естественных и техногенных), так и внутренних источников, проникающих в организм при дыхании, потреблении воды и пищи и накапливающихся в тканях. Т. о., при нормальном радиационном фоне с учетом вышеназванных факторов суммарная доза ионизирующего излучения обычно не превышает 1-3 мЗв (мГр)/год и считается безопасной для населения. Согласно заключению Международной комиссии по радиологической защите, при превышении порога облучения более 1,5 Зв/год или однократном получении дозы 0,5 Зв может развиться лучевая болезнь.

Причины лучевой болезни
Лучевые поражения могут возникать вследствие однократного (либо кратковременного) облучения высокой интенсивности или длительного воздействия низких доз радиации. Высокоинтенсивное поражающее воздействие характерно для техногенных катастроф в атомной энергетике, испытаний или применения ядерного оружия, проведения тотального облучения в онкологии, гематологии, ревматологии и пр. Хроническая лучевая болезнь может развиваться у медицинского персонала отделений лучевой диагностики и терапии (рентгенологов, радиологов), больных, подвергающихся частым рентгенологическим и радионуклидным исследованиям.
Поражающими факторами могут выступать альфа- и бета-частицы, гамма-лучи, нейтроны, рентгеновские лучи; возможно одновременное воздействие различных видов лучевой энергии - так называемое смешанное облучение. При этом поток нейтронов, рентгеновское и гамма-излучение способны вызывать лучевую болезнь при внешнем воздействии, тогда как альфа- и бета-частицы вызывают поражение только при попадании внутрь организма через дыхательный или пищеварительный тракт, поврежденную кожу и слизистые оболочки.
Лучевая болезнь является результатом повреждающего воздействия, происходящего на молекулярном и клеточном уровне. В результате сложных биохимических процессов в крови появляются продукты патологического жирового, углеводного, азотистого, водно-солевого обмена, вызывающие лучевую токсемию. Поражающие эффекты, прежде всего, затрагивают активно делящиеся клетки костного мозга, лимфоидной ткани, желез внутренней секреции, эпителий кишечника и кожи, нейроны. Это обуславливает развитие костномозгового, кишечного, токсемического, геморрагического, церебрального и других синдромов, составляющих патогенез лучевой болезни.
Особенность лучевого поражения заключается в отсутствии в момент непосредственного воздействия тепловых, болевых и иных ощущений, наличии латентного периода, предшествующего развитию развернутой картины лучевой болезни.

Классификация
В основу классификации лучевой болезни положены критерии времени поражения и дозы поглощенной радиации. При однократном массивном воздействии ионизирующего излучения развивается острая лучевая болезнь, при длительном, повторяющемся в относительно малых дозах - хроническая лучевая болезнь. Степень тяжести и клиническая форма острого лучевого поражения определяются дозой облучения:
Лучевая травма возникает при одномоментном/кратковременном облучении дозой менее 1 Гр; патологические изменения носят обратимый характер.
Костномозговая форма (типичная) развивается при одномоментном/кратковременном облучении дозой 1-6 Гр. Летальность составляет 50%. Имеет четыре степени:
- 1 (легкая) - 1-2 Гр
- 2 (средняя) - 2-4 Гр
- 3 (тяжелая) - 4-6 Гр
- 4 (крайне тяжелая, переходная) - 6-10 Гр
Желудочно-кишечная форма является результатом одномоментного/кратковременного облучения дозой 10-20 Гр. Протекает с тяжелым энтеритом, кровотечениями из ЖКТ, лихорадкой, инфекционно-септическими осложнениями.
Сосудистая (токсемическая) форма манифестирует при одномоментном/кратковременном облучение дозой 20-80 Гр. Характеризуется тяжелой интоксикацией и гемодинамическими нарушениями.
Церебральная форма развивается при одномоментном/кратковременном облучении дозой свыше 80 Гр. Летальный исход наступает на 1-3 сутки после облучения от отека мозга.
Течение типичной (костномозговой) формы острой лучевой болезни проходит IV фазы:
- I - фаза первичной общей реактивности - развивается в первые минуты и часы после лучевого воздействия. Сопровождается недомоганием, тошнотой, рвотой, артериальной гипотонией и др.
- II - латентная фаза - первичная реакция сменяется мнимым клиническим благополучием с улучшением субъективного состояния. Начинается с 3-4 суток и продолжается до 1 месяца.
- III - фаза развернутых симптомов лучевой болезни; протекает с геморрагическим, анемическим, кишечным, инфекционным и др. синдромами.
- IV - фаза восстановления.
Хроническая лучевая болезнь в своем развитии проходит 3 периода: формирования, восстановления и последствий (исходов, осложнений). Период формирования патологических изменений длится 1-3 года. В эту фазу развивается характерный для лучевого поражения клинический синдром, тяжесть которого может варьировать от легкой до крайне тяжелой степени. Период восстановления обычно начинается спустя 1-3 года после значительного уменьшения интенсивности или полного прекращения лучевого воздействия. Исходом хронической лучевой болезни может являться выздоровление, неполное восстановление, стабилизация полученных изменений или их прогрессирование.
Симптомы лучевой болезни
Острая лучевая болезнь
В типичных случаях лучевая болезнь протекает в костномозговой форме. В первые минуты и часы после получения высокой дозы радиации, в I фазу лучевой болезни, у пострадавшего возникает слабость, сонливость, тошнота и рвота, сухость или горечь во рту, головная боль. При одномоментном облучении в дозе свыше 10 Гр возможно развитие лихорадки, поноса, артериальной гипотонии с потерей сознания. Из местных проявлений может отмечаться преходящая кожная эритема с синюшным оттенком. Со стороны периферической крови ранние изменения характеризуются реактивным лейкоцитозом, который на вторые сутки сменяется лейкопенией и лимфопенией. В миелограмме определяется отсутствие молодых клеточных форм.
В фазу кажущегося клинического благополучия признаки первичной реакции исчезают, и самочувствие пострадавшего улучшается. Однако при объективной диагностике определяется лабильность АД и пульса, снижение рефлексов, нарушение координации, появление медленных ритмов по данным ЭЭГ. Через 12-17 суток после лучевого поражения начинается и прогрессирует облысение. В крови нарастает лейкопения, тромбоцитопения, ретикулоцитопения. Вторая фаза острой лучевой болезни может продолжаться от 2-х до 4-х недель. При дозе облучения свыше 10 Гр первая фаза может сразу же перейти в третью.
В фазе выраженной клинической симптоматики острой лучевой болезни развиваются интоксикационный, геморрагический, анемический, инфекционный, кожный, кишечный, неврологический синдромы. С началом третьей фазы лучевой болезни наступает ухудшение состояния пострадавшего. При этом вновь усиливаются слабость, лихорадка, артериальная гипотензия. На фоне глубокой тромбоцитопении развиваются геморрагические проявления, включающие кровоточивость десен, носовые кровотечения, желудочно-кишечные кровотечения, кровоизлияния в ЦНС и пр. Следствием поражения слизистых оболочек служит возникновение язвенно-некротического гингивита, стоматита, фарингита, гастроэнтерита. Инфекционные осложнения при лучевой болезни чаще всего включают ангины, пневмонии, легочные абсцессы.
При высокодозном облучении развивается лучевой дерматит. В этом случае на коже шеи, локтевых сгибов, подмышечной и паховой области формируется первичная эритема, которая сменяется отеком кожи с образованием пузырей. В благоприятных случаях лучевой дерматит разрешается с образованием пигментации, рубцов и уплотнения подкожной клетчатки. При заинтересованности сосудов возникают лучевые язвы, некрозы кожи. Выпадение волос носит распространенный характер: отмечается эпиляция волос на голове, груди, лобке, потеря ресниц и бровей. При острой лучевой болезни происходит глубокое угнетение функции желез внутренней секреции, главным образом, щитовидной железы, гонад, надпочечников. В отдаленном периоде лучевой болезни отмечено учащение развития рака щитовидной железы.
Поражение ЖКТ может протекать в форме лучевого эзофагита, гастрита, энтерита, колита, гепатита. При этом наблюдается тошнота, рвота, боли в различных отделах живота, диарея, тенезмы, примесь крови в кале, желтуха. Неврологический синдром, сопутствующий течению лучевой болезни, проявляется нарастающей адинамией, менингеальной симптоматикой, спутанностью сознания, снижением мышечного тонуса, повышением сухожильных рефлексов.
В фазу восстановления постепенно улучшается самочувствие, и частично нормализуются нарушенные функции, однако длительное время у пациентов сохраняется анемия и астеновегетативный синдром. Осложнения и остаточные поражения острой лучевой болезни могут включать развитие катаракты, цирроза печени, бесплодия, неврозов, лейкемии, злокачественных опухолей различных локализаций.

Хроническая лучевая болезнь
При хронической форме лучевой болезни патологические эффекты разворачиваются медленнее. Ведущими являются неврологические, сердчно-сосудистые, эндокринные, желудочно-кишечные, обменные, гематологические нарушения.
Легкая степень хронической лучевой болезни характеризуется неспецифическими и функционально обратимыми изменениями. Больные ощущают слабость, снижение работоспособности, головные боли, нарушения сна, неустойчивость эмоционального фона. В числе постоянных признаков - снижение аппетита, диспепсический синдром, хронический гастрит с пониженной секрецией, дискинезии желчевыводящих путей. Эндокринная дисфункция при лучевой болезни выражается в снижение либидо, нарушениях менструального цикла у женщин, импотенции у мужчин. Гематологические изменения неустойчивы и не резко выражены. Течение легкой степени хронической лучевой болезни благоприятно, возможно выздоровление без последствий.
При средней степени лучевого поражения отмечаются более выраженные вегетативно-сосудистые расстройства и астенические проявления. Отмечаются головокружения, повышенная эмоциональная лабильность и возбудимость, ослабление памяти, возможны приступы потери сознания. Присоединяются трофические нарушения: алопеция, дерматиты, деформации ногтей. Сердечно-сосудистые нарушения представлены стойкой артериальной гипотензией, пароксизмальной тахикардией. Для II степени тяжести хронической лучевой болезни характерны геморрагические явления: множественные петехии и экхимозы, рецидивирующие носовые и десневые кровотечения. Типичными гематологическими изменениями выступают лейкопения, тромбоцитопения; в костном мозге - гипоплазия всех кроветворных ростков. Все изменения носят стойкий характер.
Тяжелая степень лучевой болезни характеризуется дистрофическими изменениями в тканях и органах, которые не компенсируются регенерационными возможностями организма. Клинические симптомы носят прогрессирующее развитие, дополнительно присоединяются интоксикационный синдром и инфекционные осложнения, в т. ч. сепсис. Имеют место резкая астенизация, упорные головные боли, бессонница, множественные кровоизлияния и повторные кровотечения, расшатывание и выпадение зубов, язвенно-некротические изменения слизистых, тотальное облысение. Изменения со стороны периферической крови, биохимических показателей, костного мозга носят глубоко выраженный характер. При IV, крайне тяжелой степени хронической лучевой болезни, прогрессирование патологических сдвигов происходит неуклонно и быстро, приводя к неминуемому смертельному исходу.
Диагностика лучевой болезни
Развитие лучевой болезни можно предположить на основании картины первичной реакции, хронологии развития клинических симптомов. Облегчает диагностику установление факта лучевого поражающего воздействия и данные дозиметрического контроля.
Степень тяжести и стадийность поражения можно определить по изменению картины периферической крови. При лучевой болезни отмечается нарастание лейкопении, анемии, тромбоцитопении, ретикулоцитопении, повышение СОЭ. При анализе биохимических показателей в крови обнаруживается гипопротеинемия, гипоальбуминемия, электролитные нарушения. В миелограмме выявляются признаки выраженного угнетения кроветворения. При благоприятном течении лучевой болезни в фазе восстановления начинается обратное развитие гематологических изменений.
Вспомогательное значение имеют другие лабораторно-диагностические данные (микроскопия соскобов язв кожи и слизистых, посев крови на стерильность), инструментальные исследования (ЭЭГ, электрокардиография, УЗИ органов брюшной полости, малого таза, щитовидной железы и др.), консультации узкопрофильных специалистов (гематолога, невролога, гастроэнтеролога, эндокринолога и др.).
Лечение лучевой болезни
При острой лучевой болезни больного госпитализируют в стерильный бокс, обеспечивая асептические условия и постельный режим. Первоочередные меры включают ПХО ран, деконтаминацию (промывание желудка, постановку клизмы, обработку кожи), введение противорвотных средств, устранение коллапса. При внутреннем облучении показано введение препаратов, нейтрализующих известные радиоактивные вещества. В первые сутки после появления признаков лучевой болезни проводится мощная дезинтоксикационная терапия (инфузии солевых, плазмозамещающих и солевых растворов), форсированный диурез. При явлениях некротической энтеропатии назначается голод, парентеральное питание, обработка слизистой полости рта антисептиками.
В целях борьбы с геморрагическим синдромом проводятся гемотрансфузии тромбоцитарной и эритроцитарной массы. При развитии ДВС-синдрома осуществляется переливание свежезамороженной плазмы, плазмаферез. В целях профилактики инфекционных осложнений назначается антибиотикотерапия. Тяжелая форма лучевой болезни, сопровождаемая аплазией костного мозга, является показанием к его трансплантации. При хронической лучевой болезни терапия носит, главным образом, симптоматический характер.
Прогноз лучевой болезни напрямую связан с массивностью полученной дозы радиации и временем поражающего воздействия. Больные, пережившие критический срок в 12 недель после облучения, имеют шансы на благоприятный прогноз. Однако даже при нелетальном лучевом поражении у пострадавших впоследствии могут возникать гемобластозы, злокачественные новообразования различной локализации, а у потомства выявляться различные генетические аномалии.
В целях предупреждения лучевой болезни лица, находящиеся в зоне радиоизлучения, должны использовать средств индивидуальной радиационной защиты и контроля, препараты-радиопротекторы, снижающие радиочувствительность организма. Лица, контактирующие с источниками ионизирующего излучения, должны проходить периодические медицинские осмотры с обязательным контролем гемограммы.
Читайте также:
