Развитие эндокринной системы плода.
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Дорогие женщины, уже ставшие мамочками, планирующие или сейчас носящие своего малыша. Беременность - это, бесспорно, сложный период в жизни женщины, сопровождающийся напряжением всех систем организма.
Одну из ведущих ролей в течение и благополучном разрешении беременности «играет» эндокринная система. К примеру, щитовидная железа - «ответственна» за развитие щитовидной железы плода, его внутриутробный рост, но особо велико ее влияние на формирование нервной системы ребенка. Нехватка гормонов щитовидной железы у матери, прежде всего, приведет к задержке развития малыша, в том числе и после рождения; поджелудочная железа - «отвечает» за обмен сахаров, динамику работы веса. Немаловажен и тот факт, что изменения углеводного и жирового обмена на фоне даже нормально протекающей беременности рассматривается, как сильные диабетогенные факторы. Поэтому нередко встречается такая патология, как диабет беременных, особенно у женщин с избытком веса.
Свой вклад в течение беременности вносят также яичники, надпочечники, гипофиз - центральная эндокринная железа и вновь образованный эндокринный орган - плацента, без которого вообще невозможно вынашивание ребенка. Поэтому, чтобы избежать неприятных сюрпризов со здоровьем при беременности, необходимо заранее начать подготовку к ней, даже если вы ваш будущий ребенок не будет первенцем в семье.
Если у вас была хроническая эндокринная патология еще до наступления беременности, необходимо с врачом добиваться компенсации заболевания (особенно, в случае сахарного диабета, гипотиреоза, дифорузно-токсического зоба и т.д.) необходимо оптимально подобрать дозы лечебных препаратов. В дальнейшем во время беременности необходимо постоянно находиться под наблюдением врача-эндокринолога, поскольку коррекция доз препаратов проводится каждый триместр беременности, а при некоторых заболеваниях - еще чаще.
Желательно уточнить у родственников, особенно по женской линии, наличие эндокринной патологии. Но если до беременности вы еще не наблюдались у эндокринолога, то план обследования эндокринной системы может выглядеть следующим образом: на 4-8 неделе уточняется функция щитовидной железы (берется кровь на гормоны - ТТГ, Т4 свободный, антитела к тиреопероксидазе, а при ярко выраженном токсикозе первой половины беременности, сопровождающегося похуданием - антитела к рецептору ТТГ.
На 10-12 неделе (повторно на 24-28 неделе) проводится тест чувствительности к углеводам, если уровень глюкозы при беременности до еды более 5,3 ммоль/л. И обязательно всем женщинам с избытком веса.
На 16-20 неделе (а также на любом сроке при УЗИ-признаках задержки развития плода) берется тест на ХГЧ (хорионический гонадотропин), альфа-фетопротеин. Проводится ежемесячный контроль за прибавкой веса. В среднем прибавка веса должны быть не более 1 кг. в месяц в 1-м триместре, не более 2-3 кг. во 2-м и 3-м триместре. В сумме он должен составлять не более 10-12 килограмм за всю беременность при нормальном весе изначально, не более 7 кг. при ожирении до беременности, не более 17 кг. при дефиците веса до беременности.
В более углубленном эндокринологическом обследовании нуждаются женщины с проблемами с зачатием, угрозами невынашивания беременности и другими признаками отклонений от нормального течения беременности.
Безусловно, из всего вышеперечисленного женщину более всего беспокоит набор веса. На этот показатель влияют многие факторы: состояние веса до беременности, характер питания во время беременности (особенно, если вы генетически склонны к избыточному весу). Поэтому нежелательно иметь в своем рационе жареное, острое, солености, ограничить цитрусовые, экзотические фрукты, морепродукты, орехи, выпечку. Стоит отдать предпочтение овощам и фруктам (яблокам, грушам и т.д.), сваренной (приготовленной на пару или запеченной в духовке) рыбе и мясу, кисло-молочным продуктам. Также на набор веса непосредственным образом влияют хронические заболевания внутренних органов. В особенности почек, сердечно-сосудистой системы, тех, которые могут привести к задержке жидкости, а это, в свою очередь, к набору веса. Риск прибавления веса особенно велик во втором триместре беременности. Поэтому если вы все-таки начали набирать вес, то будьте готовы к тому, что врач назначит вам специальную разгрузочную диету.
Не забывайте о движении, если конечно физическая нагрузка не противопоказана вам по состоянию здоровья. Нужно осознавать, что чрезмерный набор веса не является косметическим дефектом. Это признак неблагополучия в организме, влияющий на риск развития диабета беременных, артериальной гипертонии, слабости родовой деятельности и т.д.
В процессе кормления ребенка также следует следить за весом. А вот начать худеть стоит не ранее, чем через полгода после завершения кормления. Фитнес противопоказан кормящей женщине, поскольку повышенное количество гормонов стресса, вырабатываемое при занятиях спортом, может вызвать боли в животе малыша и постоянное беспокойство. Естественно, что в этот период противопоказан прием препаратов, снижающих вес.
Многим беременным в последние годы все чаще стали назначать препараты гормонов щитовидной железы (L-тироксин, эутирокс). Эти препараты назначают для того чтобы нехватка гормонов матери не отразилась на развитии ребенка. Поэтому не менее 3-х раз за период беременности вы должны будете контролировать свой гормональный фон и посещать врача эндокринолога.
Развитие эндокринной системы плода.
Неблагоприятные факторы не во всех случаях способны программировать развитие патологии в постнатальном периоде. Степень восприимчивости плода к этим факторам и последствия их воздействия на развивающийся организм объясняются высокой «пластичностью внутриутробного развития» плода и зависят от «критического периода», в течение которого может произойти программирование какой-либо патологии. Как правило, эти периоды совпадают с интервалами максимальной пролиферативной активности клеток различных органов и тканей. Поскольку периоды максимальной пролиферативной активности клеток разных органов и тканей существенно различаются, точно определить временны`е интервалы всех уязвимых периодов внутриутробного развития для определенных органов и тканей не представляется возможным.
«Критическими периодами» онтогенеза традиционно считаются: периоды формирования бластоцисты и дифференцировки клеток зародышевых листков, органогенез и тонкая дифференцировка клеток функциональных систем организма [28]. Полагают, что характер родоразрешения, а также развитие ребенка в первые несколько лет жизни существенным образом программируют реализацию предрасположенностей к развитию заболеваний, сформированных внутриутробно.
Механизмы фетального программирования и заболевания у взрослых
Экспериментальные исследования на животных ясно показали, что неблагоприятные условия пренатального периода вызывают стойкие изменения в развитии плода, которые в зрелые годы жизни обусловливают повышенный риск развития заболеваний. Цель современных исследований — идентификация специфических молекулярных механизмов, которые определяют взаимосвязь процессов, протекающих в пренатальном периоде развития организма (времени наибольших биологических изменений и вследствие этого — наибольшей уязвимости организма к неблагоприятным воздействиям), и рисков развития будущих взрослых заболеваний.
В настоящее время рассматриваются два важнейших механизма, объясняющих повреждающее действие неблагоприятных факторов на пренатальное развитие: собственно нарушение развития и нарушение адаптации [29, 30].
Нарушение развития — прямой тератогенный ответ на высокоинтенсивное или токсическое воздействие, проявляющийся в виде задержки или нарушения нормальных процессов развития. Следствием данного типа ответа является непосредственное развитие физических уродств или появление функциональных недостаточностей [31]. В отличие от первого механизма, нарушение адаптации — комплекс более тонких изменений, реорганизующий процесс нормального развития с целью перераспределения физиологических ресурсов плода для максимального увеличения шансов на выживание в неблагоприятных условиях окружающей среды [32]. Хотя изменения адаптации необходимы только в период внутриутробного развития, они продолжают действовать и после рождения, в дальнейшем обусловливая измененный ответ организма на различные неблагоприятные факторы во взрослом периоде жизни [29]. В свою очередь нарушение адаптации может быть обеспечено тремя различными механизмами: ремоделированием тканевого развития, изменениями эндокринной системы и стойкими повреждениями генной экспрессии [32].
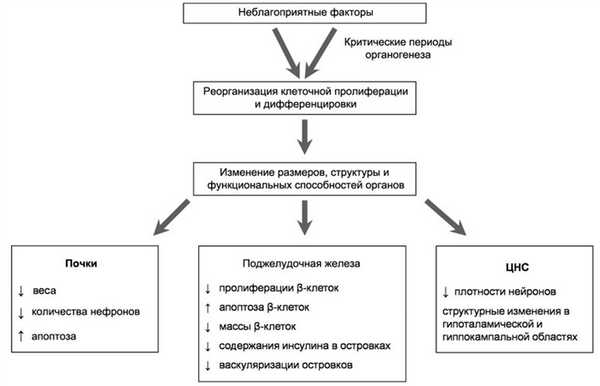
Тканевое ремоделирование. Тканевое ремоделирование — совокупность изменений (посредством количества и типа клеток) физиологических размеров и состава тканей и органов. Во время эмбрионального и фетального периодов развития большинство тканей крайне чувствительно к неблагоприятным внешним воздействиям. Участвуя в процессе органогенеза, эмбриональные клетки подвергаются координированной миграции, пролиферации и дифференцировке. Вследствие этого неблагоприятные воздействия в данные критические периоды развития организма способны вызывать необратимые структурные и функциональные повреждения тканей (рис. 1). Рисунок 1. Механизм тканевого регулирования. Данные повреждения могут быть ответом на тератогенное воздействие [31] или нарушением адаптации, сохраняющей и перераспределяющей ограниченные ресурсы в субоптимальных условиях выживания [32].
Изучение клеточного ремоделирования проводится на различных животных моделях, однако в связи с относительно коротким периодом гестации и быстрым постнатальным развитием чаще всего используются крысы. Одним из наиболее изученных примеров является ремоделирование почечной ткани.
Известно, что общее количество нефронов, характерное для взрослого человека, определяется задолго до рождения, в постнатальном периоде новые нефроны не образуются [33]. Отмечено, что у потомства крыс, родившегося от матерей, получавших во время беременности низкобелковую диету (НБД-потомство), масса почек [34] и количество нефронов уменьшены [34, 35], а процесс апоптоза ускорен [36]. Снижение питания потомства крыс во внутриутробном периоде за счет перевязки маточной артерии или снижения содержания кислорода во вдыхаемом матерью воздухе также приводило к стойкому уменьшению почечной массы и количества нефронов [33].
Другим хорошо изученным примером является клеточное ремоделирование в ткани поджелудочной железы плода, где к воздействию неблагоприятных факторов оказываются крайне чувствительными островковые клетки. У НБД-потомства крыс наблюдаются выраженные повреждения морфологической структуры поджелудочной железы, включая уменьшение количества, усиление апоптоза и снижение пролиферации β-клеток, уменьшение содержания инсулина и нарушение васкуляризации в островках Лангерганса [37]. Схожие дефекты развития поджелудочной железы вызывает у потомства и низкокалорийное питание матери во время беременности [38].
Показано, что у потомства животных, получавших низкобелковое питание, отмечалось изменение структуры и функции печени. Снижалось общее количество печеночных долек при одновременном их укрупнении. При этом наблюдались повышенная способность к глюконеогенезу [39], повышенное высвобождение жирных кислот из адипоцитов, повышенные концентрации ЛПНП и фибриногена в плазме [40, 41]. Данные особенности могут быть полезными в постнатальном периоде при дефиците питательных веществ, но способствуют развитию метаболических нарушений при благоприятных условиях [42].
Мышечная ткань — основная периферическая точка приложения действия инсулина. Считается, что если с 30-й недели плод испытывает дефицит нутриентов, то в ответ его мышцы становятся резистентными к инсулину и, возможно, частичная резистентность сохраняется на всю жизнь.
Развитие нейрональных клеток мозга также испытывает негативное влияние неблагоприятных факторов. У НБД-потомства [43] и у потомства от матерей с гестационным диабетом [44] отмечены выраженные повреждения плотности и архитектуры нейрональных гипоталамических клеток. Изменения морфологии и структуры гиппокампа наблюдаются у потомства, матери которых получали во время беременности глюкокортикоиды [45]. Показано, что длительное воздействие глюкокортикоидов вызывало не только отдаленные нарушения активности глюкокортикоидиндуцируемых ферментов, но и нарушения симпатоадреналовой функции [46]. Последнее было показано в экспериментах на крысах, когда применение глюкокортикоидов во время беременности приводило к нарушениям дифференцировки автономных нейронов и увеличению количества адренергических рецепторов, являясь примером клеточной трансформации. Таким образом, полагают, что структурная реорганизация тканевого развития является общим механизмом, посредством которого неблагоприятные факторы внутриутробного периода могут приводить к стойким повреждениям функции различных тканей во взрослой жизни. Значительные тканевые изменения таких ключевых органов, как почки и поджелудочная железа, причастны к развитию артериальной гипертензии, СД2 и сердечно-сосудистых заболеваний в будущем.
Изменения эндокринной системы. Эндокринная система играет важнейшую роль в регуляции большинства физиологических процессов. Фетальный рост и развитие являются одним из таких процессов, организованным комплексным взаимодействием между окружающей средой, материнской и фетальной сигналинговыми системами. Таким образом, повреждения материнско-фетальной эндокринной функции вследствие влияния неблагоприятных факторов — важнейший механизм, обусловливающий нарушение пренатального роста и развития. Повреждения эндокринной системы заключаются в изменении гормональной продукции, секреции и биологической активности, а также чувствительности тканей-мишеней. Следовательно, возможны повреждения на различных уровнях, следствием которых являются стойкие нарушения регуляции и активности материнской и фетальной эндокринных систем, а также их взаимодействия.
Нарушения чувствительности обнаружены в разных эндокринных системах, включая ренин-ангиотензиновую [47], гипоталамо-гипофизарно-адреналовую [48] и инсулиновую [49]. Показано, что у НБД-потомства ренин-ангиотензиновая активность снижена во время внутриутробного развития [50], но повышается после рождения, особенно во взрослые годы жизни [47]. Предполагается, что супрессия фетальной ренин-ангиотензиновой активности является следствием развивающейся в неблагоприятных условиях внутриутробного развития недостаточности нефрогенеза [50]. Повышение активности данной системы в постнатальном периоде обусловливает механизм развития гипертензии в зрелые годы [47].
Ограниченное поступление нутриентов к плоду может привести к стойкому нарушению нейроэндокринной регуляции, выражающемуся в повышении гипоталамо-гипофизарно-надпочечниковой (ГГН) и симпатоадреналовой гормональной активности и нарушениях ответа организма на стресс.
Чрезмерное воздействие глюкокортикостероидов на плод наблюдается при недостаточном питании матери, частом действии мощных стрессов и других неблагоприятных факторов, нарушающих течение беременности. В ответ на это развивается стресс-реакция с увеличением секреции глюкокортикостероидов в надпочечниках плода и в плаценте. Выраженность влияния избыточных концентраций глюкокортикостероидов на плод существенным образом зависит от характера активности 11β-гидроксистероиддегидрогеназы (11β-ГСД) [51], конвертирующей глюкокортикостероиды в неактивные 11-кето-производные. За счет этого предотвращается избыточное действие материнских глюкокортикостероидов на плод. В условиях недостаточного питания матери происходит снижение активности (до 30%) 11β-ГСД и таким образом усиливается воздействие материнских глюкокортикостероидов на плод [51]. Выяснено, что активность 11β-ГСД обратно пропорциональна размеру плаценты [52], что соответствует ранним эпидемиологическим изысканиям D. Barker, показавшего, что наибольшим риском развития сердечно-сосудистых заболеваний обладают те новорожденные с ЗВУР, у которых были большие плаценты.
Одними из важнейших следствий воздействия избытка глюкокортикостероидов на плод являются снижение пролиферативной активности клеток его внутренних органов и более ранняя дифференцировка клеток, программирование дисфункции эндотелия кровеносных сосудов.
Данные о программировании адренокортикальной активности у человека показали, что маловесные дети имеют не только повышенный уровень кортизола в пуповинной крови, но также тенденцию к более высоким значениям кортизола в более старшем возрасте. Этот эффект подтверждают исследования у мужчин 60-летнего возраста, продемонстрировавшие обратную зависимость между МТ при рождении и уровнем кортизола в плазме крови натощак [53]. Лица, имевшие низкую МТ при рождении, отличаются более высокой частотой пульса, что свидетельствует о повышенной активности симпатической нервной системы.
Инсулиноподобные факторы роста наряду с инсулином играют ключевую роль в регуляции темпов внутриутробного роста. Поэтому не случайно пристальное внимание уделяется изучению системы СТГ-ИФР-1. Показано, что у детей, родившихся с ЗВУР, на фоне нормальных базальных и стимулированных значений СТГ наблюдаются сниженные уровни ИФР-1, что, по-видимому, свидетельствует о сниженной функциональной активности рецептора СТГ. Более того, аномалии оси СТГ-ИФР могут также участвовать в программировании взрослых заболеваний [54, 55]. При изучении полиморфизма нуклеотидов гена гормона роста и плацентарного лактогена у когорты лиц от 59 до 72 лет выявлена их взаимосвязь с некоторыми фенотипическими особенностями у мужчин: низкой массой тела в возрасте 1 года, низким ростом, высоким АД, гиперинсулинемией и гипертриглицеридемией [56].
Инсулин играет центральную роль в регуляции роста плода во время пренатального развития и поддержании гомеостаза глюкозы у взрослых. Воздействия неблагоприятных факторов во время внутриутробного развития выражаются в повреждении функции поджелудочной железы и нарушении периферической инсулиновой чувствительности.
У плода инсулин играет ключевую роль в стимуляции клеточного деления посредством стимуляции секреции ИФР-1. Резистентность к инсулину в некоторых специфических тканях, таких как скелетная мускулатура, может играть роль защитного механизма, который позволяет экономнее использовать глюкозу при ее недостаточном поступлении за счет ограничения роста плода. Адаптация может выражаться и в уменьшении мышечной массы и ее гипотрофии, так как скелетная мускулатура — основная периферическая ткань, на которую действует инсулин.
Показано, что у НБД-потомства после рождения наблюдается улучшение толерантности к глюкозе и инсулиновой чувствительности. Однако в дальнейшем происходит быстрое возраст-зависимое снижение толерантности к глюкозе, что связано с истощением β-клеток в сочетании с повышением инсулиновой резистентности [14, 37]. Схожие изменения обнаружены у потомства крыс, внутриутробное развитие которых проходило в условиях перевязки маточной артерии [49].
Вместе с тем необходимо отметить, что в молодом возрасте и при нормальном индексе МТ признаков инсулинорезистентности не отмечено ни у людей, ни у крыс. Известно, что критическим периодом нарастания мышечной массы является время с 30-й недели беременности и весь первый год постнатального развития. Если в первые годы жизни ребенок быстро увеличивает МТ, это в большей степени происходит за счет увеличения жировой ткани, чем за счет нарастания мышечной массы, что также может способствовать развитию резистентности к инсулину [1].
Резистентность к инсулину может быть обусловлена и повышенной активностью ГГНС.
Кроме того, данные МР-спектроскопии показали, что взрослые люди с низкой МТ при рождении в анамнезе имеют сниженный уровень гликолиза и продукции АТФ в скелетной мускулатуре.
Таким образом, большинство примеров нарушения эндокринной системы обусловлены изменением активности эндокринных органов и тканей-мишеней. Поскольку эндокринная система участвует в регуляции тканевого роста и развития, ее повреждения могут играть определяющую роль в регуляции тканевого развития.
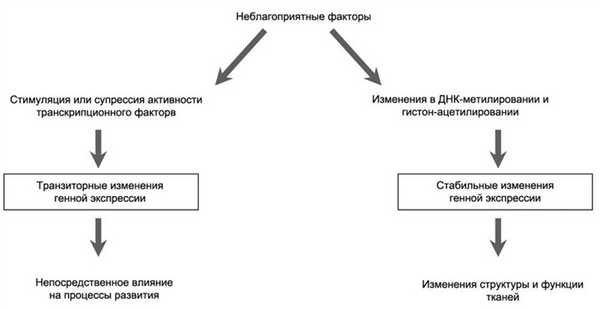
Изменения экспрессии генов. Индивидуальное генетическое наследование определяет прогноз будущего роста и развития организма. Вместе с тем неблагоприятные внутриутробные условия и уровень их интенсивности значительно снижают степень осуществления этих прогнозов. Изменение экспрессии генов является одним из фундаментальных механизмов прямого влияния неблагоприятных факторов на рост и развитие в пренатальном периоде. Эти факторы могут воздействовать на экспрессию генов по крайней мере двумя путями (рис. 2). Рисунок 2. Два возможных механизма генной экспрессии. Первый путь — генетическая экспрессия может быть транзиторно повреждена посредством нарушения активности транскрипционных факторов, промоторов и супрессоров генов.
Второй путь — повреждающие факторы могут индуцировать более устойчивые нарушения экспрессии генов в результате эпигенетической модификации ДНК. Предполагается, что эпигенетические изменения в экспрессии генов представляют центральный молекулярный механизм, посредством которого неблагоприятные факторы способны стойко повреждать будущие физиологические функции. Нарушения экспрессии генов могут быть как причиной, так и следствием ремоделирования тканей и изменений со стороны эндокринной системы.
Эпигенетическая регуляция активности генов подразумевает изменение характера их экспрессии без модификации последовательности ДНК и без изменения структуры самих генов [57].
Эпигенетические изменения экспрессии генов охватывают процессы ДНК-метилирования и гистон-ацетилирования. Метилирование ДНК включает ковалентное добавление метильных групп к гистонным остаткам ДНК. Характерным является то, что промотор гиперметилирования ассоциирован с молчащим геном, тогда как гипометилирование — с активной экспрессией гена [58]. В свою очередь ацетилирование гистона представляет собой добавление ацетил-группы к лизиновым остаткам гистона [59]. Изменения в ацетилировании гистона изменяют конформацию хроматина, которая в свою очередь нарушает экспрессию гена. Обычно ацетилирование гистона ассоциировано с транскрипционно активным генным локусом, характеризующимся обширной конформацией хроматина [59]. Эпигенетическое моделирование генной экспрессии во время гаметогенеза и раннего эмбриогенеза, являющихся критическими периодами развития, особенно чувствительно к повреждающему влиянию неблагоприятных факторов [60].
Изменения генной экспрессии как в фетальной, так и во взрослой тканях потомства, внутриутробное развитие которого проходило в неблагоприятных условиях, были обнаружены во многих исследованиях. Однако лишь недавно ученые начали исследовать эпигенетическую основу этих изменений. В исследованиях с использованием модели перевязки маточной артерии обнаружено, что фетоплацентарная недостаточность может стойко нарушать метилирование структуры ДНК [61], ацетилирование гистона и структуру хроматина [62] в тканях взрослого потомства. Фетоплацентарная недостаточность ассоциирована со специфическим гипометилированием гена р53 в почке плода, что впоследствии связано с увеличением экспрессии р53 мРНК и усилением ренального апоптоза [61]. В ЦНС плода фетоплацентарная недостаточность также ассоциирована с глобальным гипометилированием и снижением ацетилирования гистона [62].
Таким образом, в многочисленных эпидемиологических исследованиях описана сильная взаимосвязь между маркерами ЗВУР (сниженные МТ, окружность головы, окружность живота, диспропорции тела) и повышенным риском развития метаболических заболеваний в последующие взрослые годы. Предполагается, что эта взаимосвязь является следствием развивающейся адаптации плода в ответ на неблагоприятные факторы пренатального периода. Экспериментальные исследования на животных показали, что данные факторы могут индуцировать стойкие физиологические изменения, которые определяют серьезные риски развития метаболических и кардиоваскулярных аномалий во взрослой жизни. Размеры плода при рождении — не более чем косвенное отражение тех процессов, которые действительно управляют механизмами фетального программирования, а МТ при рождении является лишь неадекватным интегральным показателем внутриутробного роста.
Нейропсихиатрические расстройства при заболеваниях эндокринной системы
Нервная, иммунная и эндокринная системы тесно взаимосвязаны между собой и все они обеспечивают сохранение гомеостаза, поэтому психические расстройства всегда сопровождаются изменениями в этих системах организма, а коррекция этих изменений приводит к выздоровлению больного с симптомами нейропсихиатрических расстройств. С моей точки зрения, лечение психических расстройств не обязательно должно заключаться в назначении психотропных препаратов, а в первую очередь, в коррекции нарушений со стороны неврной, иммунной и эндокринной систем организма, теми препаратами, которые врачи этих специальностей лечат своих больных. Полагаю, что знание эндокринологии, неврологии и иммунологии обязательно для врачей психиатров, причем не только симптоматики заболеваний этих систем, чтения результатов лабораторных и инструментальных методов исследований, но и медикаментозных и немедикаментозных методов лечения той патологии, с которой встречаются врачи эндокринологи, иммунологи и неврологи. Создаваемая нами Российская Нейропсихиатрическая Ассоциация и ставит одной из своих целей сближение междисциплинарных исследований, на основе современных достижений билогии и психологии.
Однако, вернемся к теме данной заметки. Известно, что эндокринные нарушения могут приводить к различным неврологическим расстройствам, таким как головная боль, миопатия, хроническая и острая дисциркуляторная энцефалопатия, включая даже кому. Важно своевременно распознаватьть неврологические и психопатологические симптомы, вызванные эндокринными расстройствами, при лечении последних и наоборот, нарушения со стороны эндокринной системы при диагностике и лечении нейропсихиатрических расстройств. Ранняя диагностика и лечение гормонального дисбаланса может быстро ослабить выраженность неврологических и психопатологических симптомов.
Гипоталамо-гипофизарная система
Нейроэндокринная система, состоящая из нервной системы и эндокринной системы, как известно, хороший пример совместной работы этих систем организма. Кроме того, это ключ к пониманию механизмов их взаимодействия и первая подсказка для лечащего врача. Акцент в работе эндокринологов нередко ставится на роль гипофиза в регуляции активности различных эндокринных желез. Однако, внимание стоит уделить особенностям контроля гипоталамуса за секрецией гормонов гипофиза. Следует помнить, что здесь имеют место множественные взаимные взаимодействия между нервной системой и эндокринной системой для поддержания гомеостаза и правильной реакции на стимулы окружающей среды посредством регулируемой секреции гормонов, нейротрансмиттеров или нейромодуляторов. Нейроны выпускают свои нейротрансмиттеры и нейромодуляторы в синапсах, в то время, как нейросекреторные клетки выделяют вещества непосредственно в кровоток, которые выступают в качестве гормонов. Нейросекреторные клетки включают в себя нейрогипофизарные и гипофизиотропные клетки.
Гипоталамус
Таким образом следует признать, что гипоталамус является основной структурой мозга, участвующей в поддержании гомеостаза. В гипоталамусе имеется много определенных ядер, которые получают сенсорные входные данные от внешней и внутренней среды, такие как свет, ноцицепция, температура, кровяное давление, осмоляльность и уровень глюкозы в крови. Многие гормоны также демонстрируют, как отрицательную, так и положительную обратную связь непосредственно влияя на гипоталамус. Можно сказать, что гипоталамус обеспечивает скоординированные ответы, влияющие на гипофиз, кору головного мозга, ствол головного и спинного мозга, а также симпатические и парасимпатические преганглионарные нейроны для поддержания гомеостаза посредством скоординированных эндокринных, поведенческих и вегетативных реакций.
Неврологическая симптоматика эндокринных заболеваний
Различные неврологические признаки и симптомы, возникающие в результате эндокринных расстройств, включают головную боль, измененное состояние сознания, аномальную мышечную силу, мышечный тонус, ригидность мышц и судороги, двигательные расстройства и психомоторную заторможенность.
Головная боль может быть неспецифическим симптомом, но она может быть сравнительно часто вызвана патологическими состояниями, включая внутричерепную гипертензию и, в частности, ее идиопатическую форму. Идиопатическая внутричерепная гипертензия (синдром псевдоопухоли головного мозга, PTCS) — это наличие повышенного внутричерепного давления в условиях нормального состояния паренхимы головного мозга и спинномозговой жидкости. Головная боль, рвота, изменения зрения, паралич нерва и папилледема обычно представлены в клинической картине идиопатической внутричерепной гипертензии. У маленьких детей при этом могут быть обнаружены только раздражительность, сонливость или апатия. Если не лечить это заболевание, оно может прогрессировать до атрофии зрительного нерва, и зрение будет быстро потеряно. Точный механизм возникновения идиопатической внутричерепной гипертензии неизвестен, не ясен, но он может возникать в связи с различными состояниями, включая эндокринные нарушения, такие как недостаточность надпочечников, диабетический кетоацидоз, гиперадренализм, гипертиреоз и гипопаратиреоз. У детей идиопатическая внутричерепная гипертензия представляет собой нейроэндокринное расстройство, иллюстрирующее многие метаболические и гормональные нарушения в пределах гипоталамо-гипофизарно-надпочечниковой оси, и захватывает такие аспекты эндокринной системы, как ренин-ангиотензин-альдостерон, гормон роста (GH) и инсулиноподобный фактор роста-1 (IGF-1), гипоталамо-гипофизарно-щитовидная ось, гипоталамо-гипофизарно-гонадная ось, задний гипофиз и антидиуретический гормон.
Психопатологическая симптоматика при эндокринных заболеваниях
Измененный психический статус — обычное явление в отделении неотложной помощи, которое может быть вызвано эндокринными заболеваниями с быстрой декомпенсацией состояния эндокринной системы. Внимание, и уровень сознание могут поддерживаться взаимодействием между ретикулярным ядром ствола мозга, таламусом и корой головного мозга. Нарушение сознания означает значительное изменение в бодрствовании и осознании себя и окружающей среды. Причины комы у детей могут быть связаны с инфекционным или воспалительным факторами, структурными поражениями мозга, метаболическими и токсическими процессами, а также грубыми нарушениями питания. Метаболическая или эндокринная энцефалопатия должна рассматриваться с точки зрения дифференциального диагноза у тех пациентов, у которых отсутствуют очаговые неврологические признаки и симптомы раздражения менингеальных клеток (оболочки мозга).
Диабетическая кома является одним из значимых диагнозов, который следует исключить в отделении неотложной помощи при ведении пациентов с измененной психикой, в частности, помрачением сознания. Диабетический кетоацидоз и гипергликемический гиперосмолярный синдром являются наиболее опасными состояниями при гипергликемии. Напротив, гипогликемия, отек головного мозга после лечения диабетического кетоацидоза также может быть представлена измененной психикой, начиная от общей слабости, летаргии, раздражительности до комы.
Гипоплазия надпочечников
Гипонатриемический гиповолемический криз надпочечников у пациентов с врожденной гиперплазией надпочечников (CAH), дефицитом семейного глюкокортикоида или дефицитом адренокортикотропного гормона (ACTH) может привести к изменению психики больного.
Гипопаратиреоз
Гипокальциемическая тетания или судороги с гипопаратиреоидизмом или без него могут также привести к нарушению сознания. Следует помнить, что апатия, бред или психоз могут возникать при концентрациях кальция в сыворотке, превышающих 11 мг/дл. Проверка уровня глюкозы в крови, кальция и электролитов должна быть проведена на первом этапе оценки измененной психики у пациента с нейропсихиатрическими расстройствами.
Заболевания щитовидной железы
Тяжелый гипертиреоз и гипотиреоз могут быть редкой причиной изменения психики, щитовидной железы и комы гипотиреоза, соответственно. У пациентов с данной патологией могут возникнуть поведенческие и когнитивные изменения, миоклонус, судороги, психоз, непроизвольные движения и даже кома. При гипотиреоидной коме в анамнезе пациента могут быть перенесенные ранее заболевания щитовидной железы и прогрессирующая летаргия с гипотермией, брадикардией, запорами, одышкой, желтой и сухой кожей и редкими припадками. При повышенной активности щитовидной железе могут проявляться лихорадка, тахиаритмия, тахипноэ, одышка, застойная сердечная недостаточность, диарея, тошнота, рвота и гипергидроз. Кроме того, могут развиться тремор, беспокойство, спутанность сознания, бред и изменения психики до коматозного состояния. В качестве провоцирующих факторов могут рассматриваться серьезные хирургические вмешательства, травмы, системные инфекции, тяжелый эмоциональный стресс или диабетический кетоацидоз, поэтому функцию щитовидной железы следует оценивать при лечении диабетического кетоацидоза. Энцефалопатия Хашимото может развиться у пациентов с аутоиммунными заболеваниями щитовидной железы и характеризуется стероид-чувствительной энцефалопатией с присутствием антитиреоидных антител .
Изменения со стороны мышечной системы
Мышечная слабость, боль и ригидность мышц являются общими симптомами эндокринных расстройств. Системные характерные симптомы специфических эндокринных расстройств обычно предшествуют появлению слабости, но мышечная слабость может быть и начальным симптомом эндокринного заболевания. Эндокринная миопатия должна рассматриваться как одна из этиологии мышечной слабости, потому что специфическое лечение здесь вполне доступно для эффективного результата.
Электролитный дисбаланс, такой как гипер- или гипонатриемия, гипер- или гипокалиемия, гипофосфатемия, гипокальциемия и гипомагниемия, могут быть причиной миопатий, сопровождающихся эндокринными нарушениями. Глубокие сухожильные рефлексы могут быть нормальными или ослабленными, но обычно они отсутствуют. Сывороточная креатинкиназа обычно нормальная. Однако, она может быть и повышена, что не коррелирует с выраженностью мышечной слабости.
Спазмы, непроизвольные болезненные сокращения мышц или части мышц, могут возникать у нормальных детей, связанных с интенсивными физическими упражнениями, но они могут быть вызваны эндокринными нарушениями, включая надпочечниковую недостаточность, гипотиреоз или гипертиреоз. Скованность мышц и судороги возникают при миотонии, дистонии и других двигательных расстройствах, но могут присутствовать при гипотиреозе или тиреотоксикозе, когда активность двигательной единицы требует непрерывности.
Развитие эндокринной системы
Эндокринная система является одной из первых систем , которые развиваются в процессе внутриутробного развития.
Надпочечники
Кора надпочечника плода может быть выявлена в течение четырех недель после начала беременности . Кора надпочечников развивается от утолщения промежуточной мезодермы. Через пять-шесть недель беременности мезонефрос дифференцируется в ткань, известную как гребень гонады.
Гонадальный гребень производит стероидогенные клетки как для половых желез, так и для коры надпочечников. Мозговое вещество надпочечников происходит из эктодермальных клеток . Клетки, которые станут тканью надпочечников, перемещаются забрюшинно в верхнюю часть мезонефроса.
Через семь недель беременности к клеткам надпочечников присоединяются симпатические клетки, которые происходят из нервного гребня, чтобы сформировать мозговое вещество надпочечников . В конце восьмой недели надпочечники инкапсулируются и образовывают отдельный орган над развивающимися почками. При рождении надпочечники весят примерно от восьми до девяти граммов (вдвое больше, чем у взрослых надпочечников) и составляют 0,5% от общей массы тела. В 25 недель развивается зона коры надпочечников у взрослых, которая отвечает за первичный синтез стероидов в первые недели после рождения.
Щитовидная железа
Щитовидная железа развивается из двух различных кластеризаций эмбриональных клеток. Одна часть связана с утолщением дна глотки, которое служит предшественником фолликулярных клеток, продуцирующих тироксин (Т 4 ). Другая часть - от хвостовых отростков четвертых глоточно-паховых мешочков, что приводит к парафолликулярным кальцитонин-секретирующим клеткам. Эти две структуры становятся очевидными к 16-17 дням беременности.
Около 24-го дня беременности развивается нижняя кишка, тонкий, похожий на колбу дивертикул срединного зачатка . Примерно от 24 до 32 дней беременности срединный зачаток превращается в двухлопастную структуру. К 50 дню беременности медиальный и боковой зачаток сливаются воедино. На 12 неделе беременности щитовидная железа плода способна накапливать йод для производства ТРГ , ТТГ и свободного гормона щитовидной железы. В 20 недель плод может реализовать механизмы обратной связи для производства гормонов щитовидной железы. Во время развития плода Т 4 является основным гормоном щитовидной железы, вырабатываемым этим органом , тогда как трийодтиронин (Т 3 ) и его неактивное производное, обратный Т 3 , не обнаруживаются до третьего триместра.
Паращитовидные железы
Как только плод достигает четырех недель беременности, начинает развиваться околощитовидная железа . Человеческий эмбрион образует пять наборов глоточных оболочек, покрытых энтодермой. Третий и четвертый мешки ответственны за развитие нижней и верхней околощитовидных желез, соответственно. Третий глоточный мешок встречает развивающуюся щитовидную железу, и они мигрируют вниз к нижним полюсам долей щитовидной железы. Четвертый глоточный мешок позже сталкивается с развивающейся щитовидной железой и мигрирует к верхним полюсам долей щитовидной железы. Через 14 недель беременности околощитовидные железы начинают увеличиваться с 0,1 мм в диаметре до приблизительно 1 - 2 мм при рождении. Развивающиеся околощитовидные железы физиологически функциональны, начиная со второго триместра.
Исследования на мышах показали, что вмешательство в ген HOX15 может вызвать аплазию околощитовидной железы , что позволяет предположить, что этот ген играет важную роль в развитии околощитовидной железы. Также было показано, что гены TBX1 , CRKL , GATA3 , GCM2 и SOX3 играют решающую роль в формировании околощитовидной железы. Мутации в генах TBX1 и CRKL коррелируют с синдромом DiGeorge , в то время как мутации в GATA3 также приводят к DiGeorge-подобному синдрому. Пороки развития в гене GCM2 привели к гипопаратиреозу. Исследования мутаций гена SOX3 показали, что он играет роль в развитии околощитовидной железы. Эти мутации также приводят к различной степени гипопитуитаризма.
Поджелудочная железа
Фетальная поджелудочная железа человека начинает развиваться к четвертой неделе беременности. Пять недель спустя начинают появляться альфа- и бета-клетки поджелудочной железы . Через восемь-десять недель развития поджелудочная железа начинает вырабатывать инсулин , глюкагон , соматостатин и полипептид поджелудочной железы .
На ранних стадиях развития плода количество панкреатических альфа-клеток превышает количество панкреатических бета-клеток. Альфа-клетки достигают своего пика в средней стадии беременности. Начиная со средней стадии и до срока родов, количество бета-клеток продолжает увеличиваться, пока они не достигнут приблизительного соотношения 1: 1 с альфа-клетками. Концентрация инсулина в поджелудочной железе плода составляет 3,6 пмоль / г через семь-десять недель от начала беременности , а затем повышается до 30 пмоль / г через 16-25 недель беременности. В ближайшей перспективе концентрация инсулина увеличивается до 93 пмоль / г. Эндокринные клетки рассеиваются по всему организму в течение 10 недель. На 31 неделе развития островки Лангерганса дифференцируются.
В то время как поджелудочная железа плода имеет функциональные бета-клетки к 14-24 неделе беременности, количество инсулина, выделяющегося в кровоток, является относительно низким. В исследовании беременных женщин, имеющих плод в середине беременности и на ближайших стадиях развития, у плодов не было повышения уровня инсулина в плазме в ответ на инъекции высоких уровней глюкозы.
В отличие от инсулина, уровни глюкагона в плазме плода относительно высоки и продолжают увеличиваться в процессе развития. На средней стадии беременности концентрация глюкагона составляет 6 мкг / г по сравнению с 2 мкг / г у взрослых людей. Как и инсулин, уровни глюкагона в плазме плода не изменяются в ответ на инфузию глюкозы. Однако было показано, что исследование инфузии аланина беременным женщинам повышает концентрацию пуповинной крови и материнского глюкагона, демонстрируя реакцию плода на воздействие аминокислот.
В то время как альфа- и бета-клетки плода поджелудочной железы полностью развились и способны к синтезу гормонов во время оставшегося созревания плода, островковые клетки относительно незрелы в своей способности продуцировать глюкагон и инсулин. Считается, что это является результатом относительно стабильных уровней концентраций глюкозы в сыворотке плода, достигнутых благодаря материнскому переносу глюкозы через плаценту. С другой стороны, стабильные уровни глюкозы в крови плода могут быть связаны с отсутствием сигналов поджелудочной железы, инициируемых инкретинами во время кормления. Кроме того, клетки островков поджелудочной железы плода не способны в достаточной степени продуцировать цАМФ и быстро разлагать цАМФ под действием фосфодиэстеразы.необходимо секретировать глюкагон и инсулин.
Во время развития плода хранение гликогена контролируется фетальными глюкокортикоидами и плацентарным лактогеном . Инсулин плода ответственен за увеличение поглощения глюкозы и липогенеза на стадиях, приводящих к рождению. Фетальные клетки содержат большее количество рецепторов инсулина по сравнению со взрослыми клетками, а фетальные рецепторы инсулина не подавляются в случаях гиперинсулинемии . Для сравнения, гаптические рецепторы глюкагона плода снижены по сравнению со взрослыми клетками, а гликемический эффект глюкагона ослаблен. Это временное физиологическое изменение способствует увеличению скорости развития плода в последнем триместре. Плохо управляемый сахарный диабет уматери связан с макросомией плода , повышенным риском выкидыша и дефектами развития плода. Гипергликемия у матери также связана с повышенным уровнем инсулина и гиперплазией бета-клеток у доношенного ребенка. Дети матерей-диабетиков подвержены повышенному риску таких состояний, как: полицитемия , тромбоз почечной вены , гипокальциемия , респираторный дистресс-синдром , желтуха , кардиомиопатия , врожденные пороки сердца и неправильное развитие органов.
Гонады
Репродуктивная система начинает развиваться через четыре-пять недель беременности с миграцией половых клеток. Бипотенциальная гонада является результатом формирования медиовентральной области урогенитального гребня. Через пять недель развивающиеся половые железы отрываются от зачатка надпочечников. Гонадальная дифференциация начинается через 42 дня после зачатия.
У мужчин яички формируются в шесть недель плода, а клетки Сертоли начинают развиваться к восьми неделям беременности. SRY , определяющий пол локус, служит для дифференцировки клеток Сертоли . Клетки Сертоли являются источником происхождения антимюллеровского гормона . Синтезированный анти-мюллеровский гормон инициирует ипсилатеральную регрессию мюллерового тракта и тормозит развитие внутренних особенностей женщины. На 10 неделе беременности клетки Лейдига начинают вырабатывать гормоны андрогены. Гормон андрогена дигидротестостерон отвечает за развитие наружных половых органов у мужчин.
Яички опускаются во время пренатального развития в двухэтапном процессе, который начинается в восемь недель беременности и продолжается до середины третьего триместра. Во время трансабдоминальной стадии (от 8 до 15 недель беременности) губная связка сокращается и начинает утолщаться. Черепно-компенсационная связка начинает разрушаться. Эта стадия регулируется секрецией инсулиноподобного 3(INSL3) фактора ,( релаксиноподобный фактор, продуцируемый яичками) , и G-связанный рецептор INSL3, LGR8.
В течение трансигинальной фазы (от 25 до 35 недель беременности) яички опускаются в мошонку. Эта стадия регулируется андрогенами, генитально-бедренным нервом и пептидом, связанным с геном кальцитонина. Во втором и третьем триместре развитие яичка заканчивается уменьшением клеток Лейдига плода и удлинением и обвиванием семенных канатиков .
Исследования экспрессии генов показывают, что специфический комплемент генов, такой как фоллистатин и множественные ингибиторы циклинкиназы, участвует в развитии яичников. Ассортимент генов и белков, таких как WNT4, RSPO1, FOXL2, и различных рецепторов эстрогена, - предотвращают развитие яичек или линии мужского пола.
Гипофиз
Гипофиз формируется в ростральной нервной пластинке. Мешочек Ратке, полость эктодермальных клеток ротоглотки , образуется между четвертой и пятой неделями беременности и при полном развитии вызывает рост передней доли гипофиза. К семи неделям беременности начинает развиваться сосудистая система передней доли гипофиза. В течение первых 12 недель беременности передний гипофиз подвергается клеточной дифференцировке. На 20 неделе беременности гипофизарная портальная система уже сформирована.
Мешочек Ратке растет в направлении третьего желудочка и сливается с дивертикулом. Это устраняет просвет, и структура становится расщелиной Ратке. Задняя доля гипофиза формируется из дивертикула. Части ткани гипофиза могут оставаться в средней линии носоглотки. В редких случаях это приводит к функционированию эктопических гормон-секретирующих опухолей в носоглотке.
Функциональное развитие передней доли гипофиза включает пространственно-временную регуляцию транскрипционных факторов, экспрессируемых в стволовых клетках гипофиза, и динамические градиенты локальных растворимых факторов. Координация дорсального градиента морфогенеза гипофиза зависит от нейроэктодермальных сигналов от морфогенетического белка 4 инфундибулярной кости (BMP4). Этот белок отвечает за развитие первоначальной инвагинации мешка Ратке. Другими важными белками, необходимыми для пролиферации клеток гипофиза, являются фактор роста фибробластов 8 (FGF8)] Wnt4, и Wnt5. На паттерны развития вентрального отдела и экспрессию факторов транскрипции влияют градиенты BMP2 и другого белка (SHH). Эти факторы важны для координации ранних моделей клеточной пролиферации.
Через шесть недель после начала беременности кортикотрофные клетки могут быть идентифицированы. К семи неделям беременности передний гипофиз способен секретировать АКТГ. В течение восьми недель беременности соматотрофные клетки начинают развиваться с цитоплазматической экспрессией гормона роста человека. Как только плод достигает 12 недель развития, тиреотрофы начинают экспрессировать бета-субъединицы для ТТГ, в то время как гонадотрофы должны экспрессировать бета-субъединицы для ЛГ и ФСГ. Плоды мужского пола преимущественно продуцируют LH-экспрессирующие гонадотрофы, в то время как женские плоды продуцируют равную экспрессию LH и экспрессирующих FSH гонадотрофов. На 24 неделе беременности начинают появляться лактотрофы, экспрессирующие пролактин.
Эндокринная система у детей
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Эндокринная система у детей имеет очень сложную многоуровневую структуру и многоконтурное регулирование с возможностями как внешнего управления через механизмы адаптации к средовым факторам, так и внутреннего гомеостазирования через цепи отрицательной обратной связи. Последние чаще строятся на регуляции образования или выброса гормона в связи со снижением его содержания в крови или, напротив, роста продукции гормона при его усиленном потреблении и снижении концентраций. Однако существуют и механизмы, изменяющие пороги этой реакции через изменение чувствительности рецепторов к циркулирующим гормонам. Классическим примером является запуск событий полового созревания при снижении чувствительности рецепторов к половым стероидам.
Молекулы, изменяющие уровень функциональной активности или направленность активности каких-то групп клеток или ткани, в физиологии представлены очень широко. Часть таких молекул производят сами регулируемые клетки или ткани (аутокринная регуляция), некоторые из них продуцируются в близко расположенных и нередко родственных по структуре и функции клетках и тканях (паракринная регуляция). Вместе с тем в эволюции возникли и высокоспециализированные органы регуляции, формирующие сигнальные молекулы, распространяющиеся гуморально и влияющие на всю совокупность каких-то специализированных клеток или тканей, независимо от их близкой или отдаленной локализации к клеткам-продуцентам гормонов. Это и принято называть эндокринной регуляцией, а клетки, формирующие такие молекулы, и органы, объединяющие такие клетки, относят к эндокринным железам.
Эндокринные механизмы регуляции физиологических функций можно условно разделить на несколько уровней. Наивысшим представляется нейрогенный или гипоталамический уровень и, может быть, уровни еще более высокого порядка, такие как таламический, уровень ретикулярной формации или ринэнцефальные образования в целом, лимбико-ретикулярный комплекс и новая кора, обеспечивающие интегративные функции головного мозга. Стимулом для этих уровней и образований являются информационные сигналы или воздействия, исходящие из внешней или внутренней среды организма. Ответной реакцией этого уровня регуляции является включение или невключение тех или иных вегетативных структур и аппаратов, а также групп или отдельных желез внутренней секреции. Все это вместе принято относить к надсегментарным уровням регуляции, в которых еще не существует деления на симпатическую и парасимпатическую, вегетативную и эндокринную составляющие. Признано деление надсегментарных систем, структур и уровней регуляции на «эрготропные» и «трофотропные». Каждый из этих уровней или установок регуляции принципиально и комплексно, т. е. именно интегративно, изменяет всю ориентацию и структуру процессов жизнедеятельности. Именно здесь, на уровне ринэнцефальных структур, происходят «принятие решений» и «установка способа жизни», оптимальных для ребенка в настоящее время. Следуя терминологии А. М. Вейна, идет выбор между «эрготропной» и «трофотропной» формами поведения. Безмерно упрощая смысл сложнейших биологических регуляций, можно говорить о двух «способах жизни», составляющих альтернативу.
Эрготропные и трофотропные формы поведения (по А. М. Вейну, с изменениями)
Адаптация к изменяющейся среде, страх разлучения, неизвестности и ожидания, нарушения сна, готовность и мобилизация на бегство или нападение
Покой и комфорт, релаксация, принятие среды. Реализация процессов роста и развития, познавательной активности, обучаемости, памяти, поддержка сна
Ведущая вегетативная система
Реакции
лимбико-ретикулярного
комплекса
Психическая активация. Эндокринная активация: соматостатин, АКТГ, антидиуретический гормон, кортизол, катехоламины. Десинхронизация ЭЭГ, повышение мышечного тонуса
Психическая релаксация. Эндокринная активация: СТГ, ИПФР, окситоцин, ростовые пептиды, гастрин, холецистокинин
В случае относительно благоприятного средового окружения и психоэмоционального состояния, при отсутствии внешних и внутренних стрессирую- щих воздействий, центральные механизмы регуляции устанавливаются на «трофотропную» активность - на анаболизм, интенсивный рост и тканевую дифференцировку, на активацию памяти и механизмов обучаемости, на любознательность и исследовательское поведение. Этот комплекс запускается через включение нейроэндокринных цепей, ассоциированных с гормоном роста, другими ростовыми факторами, релаксационными пептидами и холецистокинином. Это и есть доминирующая совокупность свойств нормальной жизни и нормального развития ребенка любого возраста при ведущей роли парасимпатической активации.
Переключение установки должно быть осуществлено в кратчайшие сроки при изменении ситуации, при возникновении стрессорного стимула, острого дискомфорта или восприятии угрозы. Это будет уже включение комплексных аварийных систем выживания с доминированием компонентов «эрготропной» системы с ведущим участием симпатической активации, АКТГ, катехоламинов и кортикостероидов. Задачи развития здесь отступают на задний план или снимаются вообще, катаболизм доминирует над анаболическими процессами. Недостаточность реакций переключения, запаздывание с переключением в случае реальности угрозы для жизни ребенка может создавать или многократно увеличивать риск потери жизни, даже для детей практически здоровых и благополучных во всех отношениях. Опытные педиатры знают, что при некоторых острых инфекциях риск летального исхода, главным образом скоропостижной смерти, особенно велик у ранее самых здоровых, хорошо развитых детей раннего возраста. Инфекция, заставшая такого ребенка внезапно, может не встретиться здесь с мощной системой глюкокортикоидной защиты и быстро реализуется гемодинамическими расстройствами, шоком и отеком-набуханием головного мозга. Эту неспособность к быстрому включению защитных стрессорных механизмов у детей при инфекциях и ее связь с феноменом «mors thymica» описала выдающийся российский детский патоморфолог Т. Е. Ивановская. Все сказанное имеет непосредственное отношение как к врачебной тактике интенсивного лечения детей с катастрофическим течением острых инфекций, так и к практике формирования детского здоровья. В педиатрической практике существует и другая форма неадекватного проявления эрготропной реакции при острых инфекциях - это гиперсекреция антидиуретического гормона, или синдром неадекватного выделения вазопрессина. При этом отмечаются проявления болезни Пархона - прекращение мочеотделения, нарастающий отечный синдром при полном отсутствии жажды. Отеки могут распространяться и на дыхательные пути, пораженные вирусным воспалением. Отсюда своеобразный бронхообструктивный синдром.
Очевидно, что в системе воспитания здорового ребенка должна найти место и какая-то методика тренинга для ринэнцефалического переключателя способа Жизни. Необходимы как противострессорное, так и прострессорное воспитание и тренировка.
Большая часть гуморальных факторов, продуцируемых на уровне гипоталамуса, носят названия «освобождающих» или «выпускающих» факторов, их обозначают термином «либерины». Наиболее исследованы следующие гормоны гипоталамуса:
Читайте также:
- Варианты Toll-подобных рецепторов. NOD-белки
- Акклиматизация водолазов. Нарушения кровообращения у кессонных рабочих
- Характеристика риккетсий. Описание риккетсиозов
- Рекомендации по анализу рентгенограммы запястья в косой ЗП проекции (наружной ротации)
- Симптомы агранулоцитоза в полости рта и его лечение
