Развитие отечественной бронхоскопии. Литература для изучения бронхоскопии
Добавил пользователь Alex Обновлено: 09.01.2026
Несмотря на обилие современных антибактериальных препаратов, пневмония остается опасным для жизни заболеванием. По частоте случаев летального исхода пневмония стоит на первом месте среди всех инфекционных заболеваний [2, 16]. К наиболее тяжелым осложнениям пневмонии относят абсцедирование легочной ткани и эмпиему плевры [3, 6]. Гнойная деструкция легкого (ГДЛ) осложняет течение пневмонии у 4—6% пациентов, и этот показатель не имеет тенденции к снижению [6—8, 11].
Основными факторами, способствующими развитию ГДЛ, являются декомпенсация иммунитета, хронические обструктивные заболевания легких, бронхоэктатическая болезнь, курение, алкоголизм, несвоевременная и неадекватная врачебная помощь больным с острой пневмонией [2—4]. Летальность при осложненных формах ГДЛ колеблется от 13,5 до 54% [3, 5, 6, 10, 11].
ГДЛ начинается с мелкофокусной инфильтрации легочной ткани с последующим слиянием нескольких небольших очагов абсцедирования, не имеющих капсул, в единую полость, отграниченную от окружающей легочной ткани собственной пиогенной капсулой, толщина которой может превышать 1 см [1, 5, 6].
В диагностике ГДЛ ведущими являются лучевые методы: рентгенография и мультиспиральная компьютерная томография (МСКТ). В настоящее время обязательным считают выполнение бронхоскопии. В ряде случаев она позволяет установить причины абсцедирования: инородные тела, опухолевое поражение [1, 6, 11].
Лечение ГДЛ у большинства пациентов консервативное, но наряду с антибактериальными средствами широко применяют эндоскопические санации бронхов и местное введение лекарственных препаратов [5, 7, 12, 13]. Излечения некоторых пациентов невозможно добиться без хирургического вмешательства, чаще всего применяется трансторакальное дренирование абсцесса легкого (АЛ) [1, 7, 8].
В последние годы в качестве альтернативы хирургическому вмешательству при АЛ все шире применяют внутрипросветные эндоскопические технологии, такие как дренирование абсцесса через жесткий бронхоскоп [5, 8]. Возможность получения биоптатов из стенки абсцесса и ткани легкого из трансбронхиального доступа в процессе бронхоскопии имеет большое значение в верификации патологического процесса в легких [17].
Цель исследования — оценка эффективности диагностической и лечебной бронхоскопии у пациентов с ГДЛ.
За период с января 2015 г. по сентябрь 2016 г. в клинике на лечении находилось 19 пациентов с АЛ и 14 больных с мелкофокусной ГДЛ. Мужчин было 26, женщин — 7. Возраст больных колебался от 21 года до 79 лет. Чаще всего эти заболевания встречались у пациентов 41—60 лет — 63,6% наблюдений. В возрасте от 20 до 40 лет было 5 (15,2%) больных.
У всех пациентов ГДЛ развилась на фоне хронических неспецифических заболеваний (табл. 1).

Таблица 1. Хронические фоновые заболевания у пациентов с ГДЛ (n=33) Примечание. Процент рассчитан от общего числа наблюдений. Общее количество фоновых заболеваний превышает число наблюдений, так как у части пациентов выявлено более одного заболевания.
Следует подчеркнуть, что в анамнезе у 30 (90,9%) пациентов имело место длительное, от 11 до 40 лет, курение. Бронхиальной астмой в течение 12—15 лет страдали 3 (9,1%) пациента, заболеваниями органов желудочно-кишечного тракта — 8 (24,2%): у 6 (18,2%) был сахарный диабет среднетяжелого течения, у 2 (6,1%) — язвенная болезнь двенадцатиперстной кишки.
Состояние 28 (84,8%) пациентов оценивалось как среднетяжелое, 5 (15,2%) — как тяжелое. У 2 пациентов с мелкофокусной ГДЛ и у 2 пациентов с АЛ течение заболевания осложнилось плевритом (21,1%), у 1 (5,3%) с АЛ — эмпиемой плевры. У одного пациента на фоне АЛ и эмпиемы плевры развился сепсис. Дыхательная недостаточность II—III степени установлена в 23 (69,7%) наблюдениях.
В целом 33 пациентам было выполнено 70 рентгенографий и рентгеноскопий грудной клетки, всем 33 — МСКТ однократно, 1 больному — трижды.
Диагностическая фибробронхоскопия (ФБС) осуществлена во всех 33 наблюдениях. Методика диагностической ФБС не отличалась от общепринятой. В процессе ФБС была произведена щеточная биопсия у 12 больных со слизистой оболочки мелких бронхов в зоне деструкции легочной ткани, у 13 — из патологически измененной ткани легкого трансбронхиальным способом. У 25 пациентов была выполнена щипцовая трансбронхиальная биопсия ткани легкого с целью морфологической верификации патологического процесса.
Лечебный эндоскопический комплекс включал аспирацию патологического содержимого и промывание бронхов антисептическими растворами, перибронхиальное введение антибиотиков и дренирование полости абсцесса.
Санацию бронхов осуществляли у всех пациентов 20—100 мл 0,05% раствора диоксидина. Повторные санационные бронхоскопии выполняли через день, всего 54 такие процедуры.
Перибронхиальное введение антибиотиков в комплексном лечении мелкофокусной ГДЛ применили у 5 пациентов. Показанием к использованию этой методики являлось отсутствие ощутимой клинико-рентгенологической динамики в течение недели при стандартной парентеральной антибактериальной терапии. Следует отметить, что все 5 пациентов были молодого возраста (от 19 до 26 лет). Введение антибиотика через стенку бронха проводили с помощью эндоскопического инъектора с рабочей длиной иглы 1 см. Под контролем зрения осуществляли прокол медиальной стенки нижнедолевого бронха на 5—8 мм дистальнее отхождения VI сегментарного бронха и с помощью шприца через канал инъектора вводили раствор антибиотика из 1—2 точек. Во всех наблюдениях в качестве антимикробного препарата применяли амикацин. Однократно вводили суточную дозу амикацина 1000 мг в разведении 4 мл изотонического раствора натрия хлорида. Курс лечения колебался от 2 до 6 процедур. Всего было выполнено 19 перибронхиальных инъекций.
АЛ дренировали под рентгенологическим контролем в двух проекциях с помощью С-дуги. Пациент сидел в кресле или лежал на столе. Местную анестезию проводили 15 мл 2% раствора лидокаина. В зависимости от размера АЛ применяли два способа дренирования. При А.Л. диаметром не более 5 см (7 (36,7%) пациентов) предпочтение отдавали его внутреннему дренированию в просвет бронхов. Суть метода заключалась в многократной перфорации стенки абсцесса с помощью биопсийных щипцов. Стенку абсцесса перфорировали щипцами с закрытыми браншами, а извлекали их из полости с открытыми браншами. У 3 пациентов гнойный секрет в просвете дренирующего бронха появился сразу после пункции, а у 4 стал выделяться в бронх только на следующий день. Мы связываем это с развитием травматического отека в месте пункций, препятствующего быстрому опорожнению гнойника в дренирующий бронх.
Показанием к применению второго способа эндоскопического дренирования АЛ у 7 (36,7%) пациентов явился диаметр полости более 5 см. Суть метода заключалась в следующем. Под рентгенологическим контролем через биопсийный канал бронхоскопа в полость абсцесса проводили направительную струну. Затем по струне низводили дренажную трубку диаметром 2,5 мм. Проксимальный конец трубки выводили через носовой ход и фиксировали за ухом. Локализацию дренажа в полости абсцесса проверяли путем введения через его просвет водорастворимого рентгеноконтрастного вещества. В последующем полость абсцесса несколько раз в день промывали антисептическими растворами через дренаж.
Мазки, полученные путем щеточной биопсии из мелких бронхов, соответствующих пораженным сегментам легких, для выявления кислотоустойчивых микроогранизмов окрашивали по методу Циля—Нильсена. Мазки из ткани легкого при трансбронхиальной браш-биопсии высушивали, окрашивали сначала азуровыми красителями по Лейшману, затем докрашивали по методу Романовского—Гимзы с целью выявления эпителиоидных клеток и клеток Пирогова—Лангханса. Оценивали мазок методом световой микроскопии при увеличении 200—400.
Морфологическое исследование биоптатов ткани легкого включало их фиксацию в 10% растворе формалина, заливку в парафин, приготовление срезов толщиной 3—6 мкм, окраску их гемотоксилином и эозином и оценку морфологической картины под световым микроскопом при увеличении 200—400.
Результаты
По данным лучевых методов диагностики, у 24 (72,7%) пациентов очаги ГДЛ локализовались в правом легком (табл. 2).
Таблица 2. Локализация очагов ГДЛ по данным лучевых методов диагностики Примечание. Процерт рассчитан от общего числа наблюдений АЛ. У части пациентов очаги деструкции локализовались сразу в обоих легких либо в двух долях одного легкого.
Двустороннее поражение диагностировано у 3 больных с мелкофокусной ГДЛ: у одного были поражены обе верхние доли, у второго — слева верхняя и нижняя доли, а справа нижняя доля и у третьего полости распада локализовались в нижних долях обоих легких.
В верхней доле правого легкого очаги деструкции определялись в 2 раза чаще, чем в нижней, а в левом легком частота локализации ГДЛ в верхней и нижней долях была одинаковой.
Локализация АЛ в зависимости от его размера (по данным МСКТ) представлена в табл. 3.
Таблица 3. Локализация А.Л. в зависимости от его размера
Как видно из представленных данных, в правом легком АЛ среднего и большого размеров локализовались в 3 и 2,5 раза чаще, чем малые, а в левом на 5,2% чаще встречались АЛ малого размера. В то же время гигантский АЛ диаметром 11 см в единственном наблюдении был обнаружен в верхней доле левого легкого. Толщина капсулы абсцесса у 19 больных, по данным МСКТ, колебалась от 1 до 11 мм.
Наряду с ГДЛ при МСКТ у 14 (73,7%) из 19 пациентов с АЛ была выявлена полисегментарная пневмония. У 9 из 11 больных с абсцессом правого легкого воспалительная инфильтрация локализовалась на стороне абсцесса: у 7 она распространялась на одну долю, у 2 — на две доли. Еще у 2 пациентов с абсцессом правого легкого пневмония была двусторонней. Из 8 пациентов с абсцессом левого легкого пневмонию диагностировали только у 3, в том числе у 1 она была на стороне абсцесса и локализовалась в одной доле легкого, у 2 была двусторонней. У 1 больного с АЛ при МСКТ была диагностирована туберкулема, у 3 больных с мелкофокусной ГДЛ — бронхоэктазы и еще у 1 — инфильтративная форма туберкулеза легких.
Диагностическая ФБС позволила выявить бронхит различной степени выраженности у всех 33 пациентов. Атрофический бронхит был самой частой формой патологических изменений в анализируемой группе пациентов — у 27 (81,8%) из 33 больных. На этом фоне у 5 (15,2%) больных развилась рубцовая деформация долевых и сегментарных бронхов, сопровождающаяся сужением их просвета. Катаральный бронхит диагностирован у 6 (18,2%) пациентов. Гнойный секрет в правых и левых бронхах в небольшом количестве бы выявлен только у 6 из 33 (18,2%) больных, причем у 3 из них были бронхоэктазы. Ни в одном наблюдении на момент осмотра признаков дренирования очагов ГДЛ не обнаружено.
Воспалительные изменения, обнаруженные при эндобронхиальном цитологическом исследовании, проявлялись пролиферацией бронхиального эпителия, гиперплазией бокаловидных клеток, плоскоклеточной метаплазией. При трансбронхиальном цитологическом исследовании в мазке дополнительно выявляли макрофаги и гистиоциты, примесь нейтрофилов. Часто воспалительные изменения сочетались с дистрофией мерцательного эпителия (табл. 4).

Таблица 4. Характер изменений, выявленных при цитологическом исследовании мазков слизистой оболочки бронхов и ткани легкого у пациентов с ГДЛ (n=25) Примечание. Процент рассчитан от общего количества больных в группе. У большинства больных было сочетание 2—3 цитологических находок.
Как видно из представленных данных, при исследовании мазка слизистой бронха дистрофические изменения бронхиальных клеток диагностированы у всех 12 обследованных, а воспалительные изменения — только у 3 из 12 больных. При исследовании мазка ткани легкого, наоборот, клетки, характеризующие воспалительный процесс, обнаружены у всех 13 больных. Атипичные клетки, клетки Березовского—Штемберга и Ходжкина, а также микобактерии туберкулеза были выявлены только при трансбронхиальном заборе материала.
У большинства пациентов с АЛ было сочетание 2—3 гистологических находок. У 3 пациентов с АЛ из-за развившегося кровотечения трансбронхиально была произведена только щеточная биопсия для цитологического исследования.
При гистологическом исследовании биоптатов ткани легкого у 9 больных с мелкофокусной ГДЛ обнаружены различные проявления воспалительного процесса: лимфолейкоцитарная инфильтрация, дистелектазы, гиперплазия респираторного эпителия, скопления сидерофагов в просвете альвеол, пневмосклероз, у 2 — участки карнификации (табл. 5).

Таблица 5. Характер клеточных изменений, выявленных при гистологическом исследовании ткани легкого у пациентов с ГДЛ (n=25) Примечание. Процент рассчитан от общего количества наблюдений в группе.
У 16 пациентов с АЛ в биоптатах были обнаружены участки расплавления легочной ткани с грануляциями, фиброзная ткань, склероз межальвеолярных перегородок, лимфомакрофагальная либо лимфолейкоцитарная инфильтрация, участки карнификации. Злокачественные новообразования при трансбронхиальной биопсии выявлены у 1 (11,1%) из 9 пациентов с мелкофокусной ГДЛ и у 4 (25%) из 16 пациентов с АЛ, а туберкулез легких — у 1 (11,1%) больного с мелкофокусной ГДЛ и у 1 (6,3%) больного с АЛ.
Перибронхиальное введение амикацина позволило у всех 5 больных с мелкофокусной ГДЛ ускорить репарацию легочной ткани и добиться полного выздоровления. Исходом мелкофокусной ГДЛ у всех 14 пациентов явился очаговый фиброз легочной ткани.
Исходом АЛ у 7 больных, которым выполняли его внутреннее дренирование, явилось формирование очагового фиброза легкого (1) и ложных кист диаметром от 1 до 2 см (6).
Установленный эндоскопическим методом в полость абсцесса дренаж у 5 из 7 больных был удален через 7 дней, у 2 — через 4 дня. Промывание А.Л. антисептиками через дренаж обеспечило значительное уменьшение размера полости и исчезновение в ней уровня жидкости при динамическом рентгенологическом исследовании. Это являлось показанием к удалению дренажа. Сформированный за несколько дней канал между абсцессом и бронхом обеспечивал в дальнейшем адекватную санацию полости при бронхоскопии. Исходом заболевания у всех 7 больных явилось формирование на месте очага гнойной деструкции ложных кист диаметром от 1,5 до 3 см.
В основе развития ГДЛ лежит очаговое паренхиматозное воспаление, т. е. пневмония [1, 7]. Ведущими факторами, способствующими развитию ГДЛ, являются снижение иммунитета, хронические заболевания легких и курение [4, 9, 13, 15]. Наши данные полностью согласуются с такой точкой зрения. Так, в анализируемой группе длительно курящие лица составили 90,9%. Хронической обструктивной болезнью легких страдали 69,7% больных, буллезной эмфиземой и бронхиальной астмой — 18,2%. Хронический атрофический бронхит, вызывающий нарушение дренажной функции бронхов, при бронхоскопии был выявлен у 81,8% пациентов. Сахарный диабет, также повышающий риск развития ГДЛ, осложнял течение болезни в 18,2% наблюдений [14].
Согласно общепринятой точке зрения, одним из ведущих факторов в генезе АЛ не менее чем у 70% больных является аспирация содержимого глотки и ротовой полости, что подтверждается более частой его локализацией во II и VI сегментах правого легкого [1, 11, 15]. Этот патогенетический механизм, согласно данным МСКТ, мог иметь место только в 31,6% наших наблюдений.
Гнойную деструкцию чаще диагностируют в правом легком (56,7—60,42%), преимущественно в его нижней доле (28,9%), двустороннее поражение выявляют у 6,9—12,4% пациентов [4, 7]. Наши данные незначительно отличаются от указанных. Так, в правом легком ГДЛ локализовалась у 72,7% наблюдавшихся нами пациентов, двустороннее поражение встречалось только у 6,1% больных. В то же время верхняя доля правого легкого, по нашим данным, поражалась в 2 раза чаще, чем нижняя.
Несмотря на высокую диагностическую значимость МСКТ у пациентов с ГДЛ, верификация диагноза невозможна без морфологического исследования. Трансбронхиальная рентгеноэндоскопическая биопсия легкого позволяет получить больше материала для исследования, чем чрескожная пункционная биопсия под ультразвуковым или рентгенологическим контролем [17]. По результатам исследовании у 5 (15,2%) из 33 больных благодаря трансбронхиальной биопсии был установлен диагноз злокачественной опухоли, у 2 (6,1%) больных подтвержден диагноз туберкулеза легких.
Современная лечебная тактика при ГДЛ заключается в комплексной консервативной терапии с дренированием очагов нагноения [7]. Одним из основных компонентов этой терапии считают эндоскопические санации трахеобронхиального дерева с прицельным отмыванием прилежащих к очагу деструкции бронхов [7, 11]. Часто прицельные санации бронхов оказываются достаточными для полноценного очищения гнойной полости [8]. Так, у всех 14 больных с мелкофокусной ГДЛ эндоскопические санации бронхов, а у 5 больных дополнительно перибронхиальные инъекции антибиотика позволили добиться полного рубцевания очагов деструкции легочной ткани. При хронизации гнойного процесса, которая при морфологическом исследовании была установлена у 14 (73,7%) из 19 больных с АЛ, для успешного лечения необходимо дренирование полости абсцесса [8, 11]. По данным литературы, эндоскопическое или чрескожное дренирование приводит к успеху в 73% наблюдений, снижает количество осложнений на 39,5%, а количество операций — на 10,9% [5, 12]. Исходом А.Л. являются полное восстановление легочной паренхимы, остаточная воздушная полость и формирование рубца [6].
В нашем исследовании у всех 14 пациентов с хроническим АЛ, которым было предпринято наружное чрезбронхиальное дренирование, удалось достигнуть положительного клинического результата: у 13 образовалась остаточная воздушная полость и у 1 развился локальный фиброз легочной ткани. Операций и случаев летального исхода не было.
Таким образом, гнойная деструкция легкого развивается на фоне длительного курения, хронической обструктивной болезни легких, буллезной эмфиземы и бронхиальной астмы, эндоскопическим признаком которых служит атрофический бронхит (81,8%). Трансбронхиальная рентгеноэндоскопическая щеточная и щипцовая биопсия у пациентов с гнойной деструкцией легких позволяет выявить злокачественное (15,2%) и специфическое (6,1%) поражение легких. Комплексное консервативное лечение гнойной деструкции легких, включающее эндоскопические прицельные санации бронхов, перибронхиальные инъекции антибиотиков, трансбронхиальное дренирование, обеспечивает положительный клинический результат у всех пациентов.
Статьи: Гибкая диагностическая бронхоскопия
Современная программа исследования при заболеваниях органов дыхания и средостения в обязательном порядке включает диагностическую бронхоскопию. Своевременно и адекватно выполненное исследования позволяет эффективно установить диагноз при самых различных нозологиях.
К сожалению, в практической работе врача-эндоскописта нередки ситуации, когда неправильная тактика применения бронхологического исследования приводит либо к его неэффективности, либо к опасным и даже жизнеугрожающим осложнениям.
Эта памятка — своего рода подсказка для практических врачей, проводящих бронхологическое диагностическое исследование при различных заболеваниях трахеобронхиального дерева, легких и средостения.
Enter the password to open this PDF file:
Полный текст статьи:
1. Показания и противопоказания к гибкой диагностической бронхоскопии
• выявленные при рентгенографии, КТ или МРТ патологические изменения в легком и/или средостении;
• признаки стеноза бронхов и ателектаза легкого;
• кашель неясной этиологии;
• кровохарканье;
• подозрение на наличие инородного тела трахеи и бронхов;
• пред/послеоперационный осмотр в торакальной хирургии
• экссудативный плеврит неясной этиологии;
• затянувшаяся пневмония;
• подозрение на туберкулез бронхов, хроническое неспецифическое воспаление легких;
• наличие полости распада или киста легкого;
• интерстициальные и диссеминированные патологические изменения в легких;
• периферические новообразования в легком неясной этиологии;
• ателектаз легкого;
• подозрение на центральный рак легкого;
• лимфаденопатия средостения неясной этиологии;
• рак пищевода;
• подозрение на повреждение дыхательных путей.
Диагностическая бронхоскопия также показана при некорригируемых респираторных жалобах на протяжении более 1 мес и/или наличии изменений по данным методов лучевой диагностики.
Противопоказания
Абсолютные
• некорригируемая гипоксемия, декомпенсированная дыхательная недостаточность;
• нестабильная стенокардия;
• неконтролируемая аритмия сердечных сокращений.
Относительные
необъяснимая или тяжелая гиперкапния;
• обострение бронхиальной астмы, астматический статус;
• неконтролируемая коагулопатия;
• нестабильность шейного отдела позвоночника
• декомпенсированная недостаточность кровообращения и тяжелая дыхательная недостаточность;
• тромбоцитопения менее 50 000/мкл
Особые условия и ситуации при выполнении бронхоскопий
• диагностическая бронхоскопия не должна выполняться при обострении ХОБЛ;
• при наличии кардиальной патологии перед бронхоскопи- ей необходима консультация кардиолога;
• после инфаркта миокарда диагностическая бронхоскопия должна быть отложена минимум на 4 недели.
2. Условия для выполнения бронхоскопии
Оборудование комнаты для проведения бронхоскопии
• аппаратура для выполнения бронхоскопии в полной комплектации, наличие подводки кислорода с потоком не менее 3 л/мин, набора для реанимации.
Мониторинг
• до начала и после завершения исследования: постоянное измерение артериального давления, ЧСС, сатурации;
• во время бронхологического исследования: пульсоксиметрия; ЭКГ-мониторинг (в случае наличия кардиальной патологии).
Вопросы, на которые необходимо ответить перед выполнением бронхоскопии
• Показана ли данному пациенту бронхоскопия?
• Проверены ли анамнестические данные о наличии аллергических заболеваний;
• Есть ли в кабинете реанимационный набор.
3. Анестезия
Чем лучше и тщательнее выполнена анестезия перед гибкой бронхоскопией, тем более комфортно для врача выполнение диагностического исследования — сокращается время процедуры, легче корректировать возможные осложнения.
Все виды анестезии можно разделить на три вида: местная анестезия, седация и общий наркоз. За рубежом доминирует выполнение исследования в условиях седации (свыше 90 %). В России ситуация диаметрально противоположная — подавляющее большинство диагностических бронхоскопий выполняются под местной анестезией. Ниже в таблице представлены варианты применения каждого из методов обезболивания.
Местная анестезия
Препараты
Лидокаин и др.
Пути введения:
Спрей/Гель
Небулайзер
Препараты
Мидазолам
Пропофол
Фентанил
Тотальная
внутривенная
анестезия
+
миорелаксанты
Выбор анестетика
Наиболее часто для местной анестезии применяется лидокаин. Все местные анестетики, применяемые при бронхоскопии, можно разделить на две группы — амиды и эфиры (см ниже).
Перекрестная непереносимость анестетиков внутри одной группы вполне вероятна, а вот случаи тотальной непереносимости анестетиков из обеих групп крайне редки. Именно поэтому анестетиком резерва для гибкой бронхоскопии является новокаин, относящийся к отличной от лидокаина группе препаратов.
Лидокаин является анестетиком первого выбора, так как обладает наилучшими характеристиками, позволяя достичь обезболивания при минимальной вероятности побочных эффектов (в особенности метгемоглобинемии). Альтернативным препаратом для проведения местной анестезии является новокаин.
Перед выполнением анестезии следует тщательно собрать анамнез в отношении непереносимости лекарственных средств, прежде всего анестетиков.
Местная анестезия. Способы обезболивания и максимальная дозировка
Перед выполнением бронхологического исследования последовательно проводится анестезия гортаноглотки и носовых ходов (если предполагается трансназальная интубация), а в ходе самого исследования — дополнительная анестезия гортани, трахеи и бронхов через канал бронхоскопа.
Анестезия ротоглотки выполняется с помощью 10 % водного раствора лидокаина с помощью стандартного распылителя (на 1 нажатие распыляется доза препарата в 10 мг), как правило делается 5-6 распылений препарата. Рекомендуется первую дозу лидокаина нанести на слизистую щеки, в качестве теста на переносимость. Перед выполнением анестезии следует предупредить пациента об ожидаемых ощущениях анестезии — чувства «комка в горле», онемения и т. п.
Анестезия носовых ходов как правило выполняется 10 % раствором лидокаина — по 2-3 введения в каждый носовой ход. Следует предупредить пациента о том, что введение анестетика в носовой ход может сопровождаться раздражением слизистой носа — чувством жжения, рефлекторным чиханием, кашлем и слезотечением. Альтернативой лидокаин-спрею является использованием лидокаин-геля 2 % (Катеджель), который можно ввести в носовой ход с помощью гофрированного шприца, либо с помощью пропитанной гелем турунды.
Добавление анестетика во время исследования возможно как через канал эндоскопа, так и через специальный катетер-дозатор. Оба метода равноценны.
В ряде случаев, возможно выполнение дополнительного обезболивания с введением 2-3 мл 2 % лидокаина с помощью транскрикоидной инъекции через перстнещитовидную мембрану. Методика позволяет снизить выраженность кашлевого рефлекса и сократить общую дозу лидокаина, необходимую для выполнения исследования.
Альтернативой местной анестезии лидокаин-спреем служит введение анестетика через небулайзер. Для этого используется 4 % раствор лидокаина, объемом 3 мл, длительность введения составляет около 10-12 минут. Преимуществом такого метода анестезии является лучшая переносимость пациентом и возможность применения у лиц с измененным строением гортаноглотки. Недостаток такого метода — меньшая степень точности дозирования препарата, высокая абсорбция на слизистой ротоглотки.
Максимальная допустимая доза лидокаина при одном исследовании — 480 мг (24 мл 2 % раствора), рекомендуемая — 160 мг (8 мл 2 % раствора).
Применение атропина для местной анестезии
Согласно международным рекомендациям Британского и Американского Торака льных Обществ, Европейского Респираторного Общества, атропин в настоящее время не рекомендован для рутинной премедикации при выполнении бронхоскопии в связи с отсутствием клинических преимуществ при повышенном риске гемодинамических нарушений.
В нашей стране, тем не менее, большинство бронхологических исследований выполняется с применением атропина в качестве средства премедикации для коррекции возможных ваго-вагальных рефлексов, ларингоспазма и гиперсекреции слюнных и бронхиальных желез во время бронхоскопии. Окончательное решение относительно применения премедикации атропином остается на усмотрение врача, выполняющего бронхоскопию.
Седация
Частота применения седации при выполнении бронхоскопий за рубежом определяется тем, что сам врач, проводящий исследование, имеет полное право самостоятельно осуществлять седацию у исследуемых пациентов. В России такое право имеет лишь врачанестезиолог, соответственно выбор протокола седации лежит вне ответственности врача-эндоскописта.
В таблице ниже кратко перечислены основные препараты, применяемые для седации при бронхоскопии, и особенности их применения.
Бронхоскопия при онкологических заболеваниях
в Санкт-Петербурге
Бронхоскопия — эндоскопическое исследование трахеи и бронхов. В онкологии она применяется для диагностики злокачественных опухолей дыхательных путей. В клинике «Евроонко» эта процедура проводится с применением новейшего оборудования, которое обеспечивает максимально качественную визуализацию, высокую точность диагностики и позволяет выполнить биопсию, другие диагностические и лечебные манипуляции.

Показания к проведению бронхоскопии в онкологии
Эндоскопическое исследование дыхательных путей назначают пациентам, у которых имеются симптомы, свидетельствующие о поражении трахеи и бронхов, например, затрудненное дыхание, кашель с кровью. Эндоскопия трахеи и бронхов в онкологии помогает решать многие важные задачи. С помощью нее врач может:
Противопоказания
Предварительно врач должен опросить пациента, изучить его медицинскую документацию, выяснить, какими хроническими заболеваниями он страдает, какие принимает лекарства, есть ли у него аллергические реакции на лекарственные препараты.
Эндоскопическое исследование трахеи и бронхов противопоказано в следующих случаях:
- Обострение бронхиальной астмы и хронических обструктивных болезней легких (ХОБЛ). У таких пациентов введение бронхоскопа может спровоцировать спазм бронхов и сильно ухудшить их состояние.
- Инфаркт или инсульт, произошедший менее четырех недель назад. Во время бронхоскопии в легкие поступает меньше воздуха, происходит спазм сосудов, и это может спровоцировать повторное острое нарушение кровообращения.
- Сильное нарушение свертываемости крови, когда количество тромбоцитов в крови менее 20000 /мкл.
- Нарушения сердечного ритма, которые не удается контролировать с помощью медикаментозной терапии.
- Аневризма аорты.
- Эпилепсия. Стресс от процедуры может спровоцировать судороги.
Для большинства пациентов бронхоскопия безопасна. Тщательная оценка состояния пациента и коррекция сопутствующих патологий позволяют свести риски к минимуму.
Подготовка
В клинике «Евроонко» эндоскопическое исследование дыхательных путей проводится в состоянии легкого наркоза — медикаментозного сна (седации). Это комфортно для пациента: во время процедуры он не испытывает неприятных ощущений. Важно помнить, что общая анестезия всегда проводится натощак: за 8-10 часов нельзя ничего есть и пить. Если у пациента ранее случались аллергические реакции на лекарства, особенно на обезболивающие и препараты для наркоза, об этом нужно обязательно сообщить врачу.
Если пациент принимает антикоагулянты («кроверазжижающие» препараты), то перед проведением бронхоскопии врач на время может их отменить — это нужно, чтобы исключить риск кровотечения.
В день проведения исследования нельзя курить.

Как проводится процедура?
Чаще всего бронхоскопию проводят амбулаторно, без госпитализации в стационар. Обычно исследование длится около 30 минут, но может занять и больше времени, если помимо осмотра потребуется провести какие-либо процедуры.
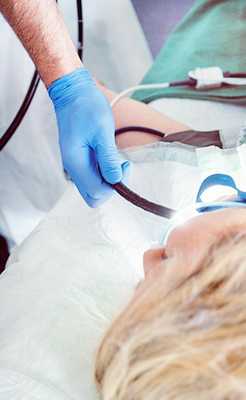
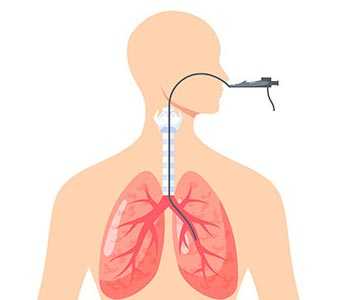
Во время исследования пациент лежит на спине. Анестезиолог вводит внутривенно препараты, погружающие в медикаментозный сон. Затем врач вводит в дыхательные пути пациента через рот бронхоскоп — инструмент в виде гибкой тонкой трубки с видеокамерой и источником освещения на конце. Доктор осматривает слизистую оболочку на предмет патологических образований и при необходимости выполняет биопсию или другие манипуляции.
Дополнительная диагностика во время бронхоскопии
Современное оборудование в клинике «Евроонко» позволяет выполнять во время бронхоскопии различные процедуры.
Биопсия бронхов
Во время бронхоскопии можно получить образец новообразования стенки бронха, чтобы провести гистологическое исследование. Обычно забор материала осуществляют с помощью специальных биопсийных щипцов или скарификатора (браш-биопсия). Для пациента эта процедура безболезненная. Исследование образца ткани под микроскопом позволяет отличить злокачественную опухоль от доброкачественной, установить ее тип, стадию.
Смыв со стенок бронхов
Эта процедура во время бронхоскопии позволяет получить материал для исследования на наличие злокачественных клеток при центральном раке легкого, патогенную флору при пневмониях и бронхитах, микобактерии туберкулеза. Чтобы сделать смыв, в бронхиальное дерево вводят небольшое количество физиологического раствора, а затем удаляют содержимое с помощью аспиратора. Жидкость собирают в одноразовый стерильный контейнер и отправляют в лабораторию.
ЭндоУЗИ и пункционная биопсия
Эндобронхиальное УЗИ (ЭндоУЗИ, эндосонография) — ультразвуковое исследование, которое проводят прямо через стенку бронха, с помощью датчика, находящегося на конце бронхоскопа. Это позволяет подвести датчик максимально близко к лимфатическим узлам и другим анатомическим структурам и получить максимально информативные изображения.
Под контролем эндоУЗИ можно провести пункционную биопсию — ввести иглу прямо через стенку дыхательных путей и получить образец ткани из нужного места для гистологического исследования.
Стентирование бронхов
Наши врачи обладают большим опытом стентирования полых органов при опухолевой обструкции. Стент — это небольшая трубка с сетчатой стенкой. Его устанавливают в участок трахеи или бронха, заблокированный злокачественной опухолью, чтобы обеспечить свободное движение воздуха. Стентирование во время бронхоскопии - малоинвазивное вмешательство, поэтому его зачастую хорошо переносят даже пациенты в ослабленном состоянии и с серьезными сопутствующими патологиями. При этом после процедуры сразу восстанавливается нормальный просвет бронха и обеспечивается свободное прохождение воздуха.
Удаление новообразований
Некоторые новообразования бронхов могут быть удалены эндоскопически. Если неоперабельная опухоль мешает прохождению воздуха, врач может освободить просвет с помощью аргонплазменной коагуляции, установить стент.

Восстановительный период
Обычно пациент может уехать домой в день процедуры, после того как заканчивается действие седации. В течение 2 часов не рекомендуется курить и принимать пищу. В течение пары дней лучше не заниматься работой и отдохнуть. Могут беспокоить небольшие боли в горле: они вызваны введением бронхоскопа и вскоре пройдут.
Возможные осложнения
Эндоскопическое исследование дыхательных путей — безопасная процедура, особенно если ее выполняет опытный врач на современном оборудовании. Риск осложнений невелик:
- Кровотечение. Проявляется в виде примеси крови в слюне, мокроте. Если возник этот симптом, нужно обратиться к врачу.
- Инфекции дыхательных путей. Проявляются в виде кашля, одышки, изменения цвета мокроты, повышения температуры тела.
- Некоторым пациентам после процедуры требуется оксигенотерапия (кислородная маска). Чаще всего такая необходимость возникает у людей с хроническими заболеваниями дыхательной, сердечно-сосудистой системы.
- Пневмоторакс и спадение легкого — встречается крайне редко.
Преимущества бронхоскопии
в клинике «Евроонко»
Врачи экспертного уровня с опытом работы в ведущих онкологических центрах России.
Новейшее эндоскопическое оборудование.
Специализированная клиника — максимальный уровень экспертности в сфере онкологии.
Наши врачи проводят эндоскопические исследования с применением современных безопасных препаратов для медикаментозного сна.
Во время исследования ведется видеозапись, которая выдается пациенту. В дальнейшем запись можно предоставить в любой клинике и избежать повторного исследования.
При подтверждении онкологического диагноза в клинике «Евроонко» можно сразу начать лечение в соответствии с современными международными протоколами.
Бронхоскопия легких
Бронхоскопия является методом исследования во фтизиатрии, пульмонологии и онкологии. Сейчас это единственный способ, позволяющий осмотреть внутреннюю поверхность трахеи и бронхов. Помимо диагностики бронхолегочных заболеваний бронхоскопию применяют в терапии различных болезней, например, туберкулеза и хронических бронхитов 1 .
Что такое бронхоскопия легких
Бронхоскопия легких - это процедура, которая проводится с помощью специального инструмента - бронхоскопа. Прибор представляет собой тоненькую трубку с лампой, смотровой трубкой, фото- и видеокамерой.
Современные бронхоскопы позволяют сделать запись осмотра изнутри для дальнейшего детального изучения. Для исследования применяют жесткие и гибкие (фиброоптические) бронхоскопы 2 .
Бронхоскопия является одним из точнейших методов диагностики - вся слизистая дыхательных путей прямо перед глазами врача. В случае обнаружения патологии специалист может сразу взять образец на биопсию.
Полезная информация о бронхоскопии легких
Противопоказания к бронхоскопии легких
Среди абсолютных противопоказаний к проведению бронхоскопии можно выделить:
- перенесенный менее 4 недель назад инфаркт или инсульт;
- аллергические реакции на анестезию;
- аневризма аорты;
- неконтролируемая аритмия; острый инсульт;
- стеноз гортани или трахеи;
- сердечно-сосудистая или легочно-сердечная недостаточность;
- нарушения психики (эпилепсия, шизофрения и другие);
- состояние после черепно-мозговой травмы 3 .
К относительным противопоказаниям, когда бронхоскопию следует отложить, относятся:
- высокое давление;
- вторая половина срока беременности;
- обострение бронхиальной астмы и хронической обструктивной болезни легких (ХОБЛ);
- повышенный уровень сахара в крови у пациентов с сахарным диабетом;
- острые респираторные заболевания верхних дыхательных путей.
Подготовка к бронхоскопии легких
Перед бронхоскопией легких должно быть выполнено рентгенологическое исследование или компьютерная томография органов грудной клетки. Процедура обычно назначается на утро и проводится натощак. В рамках подготовки к бронхоскопии легких за 3 часа до исследования нужно воздержаться от употребления воды и курения.
Пациентам с сахарным диабетом необходимо пропустить первый утренний укол. Остальные лекарства следует принимать по обычной схеме.
На время процедуры нужно снять зубные протезы и украшения на губах и во рту.
Где проводят бронхоскопию легких
Бронхоскопия легких проводится в условиях стационара - в специально оборудованном кабинете.
— Стандартная бронхоскопия проводится под местной анестезией, этого достаточно. Без необходимости подвергать пациента общему наркозу не нужно. Ригидная бронхоскопия всегда проводится под общим наркозом, - отмечает торакальный хирург Индира Зулуфова.
Как проходит бронхоскопия легких
Во время процедуры пациент находится в положении сидя или лежа. Выполняется местная анестезия носовой полости и ротоглотки, после чего пациенту через рот (реже через нос) аккуратно вводят бронхоскоп. Диаметр прибора существенно меньше просвета трахеи и бронхов, поэтому затруднений дыхания быть не должно. После осмотра врачом глотки, гортани, трахеи и бронхов бронхоскоп извлекается. Проходит бронскопия легких обычно за 15 минут.

Сколько стоит бронхоскопия легких
Стоимость процедуры варьируется от 3 до 15 тысяч рублей в зависимости от клиники и квалификации врача.
Отзывы врачей о бронхоскопии легких
Бронхоскопия проводится при заболеваниях трахеи и бронхов. Исследование может проводиться в двух вариантах:
- фибробронхоскопия - с использованием гибкого («мягкого») бронхоскопа,
- ригидная бронхоскопия - с использованием тубусов (железных трубок) различного диаметра.
— В диагностических целях проводится фибробронхоскопия. Процедура позволяет диагностировать широкий спектр заболеваний: онкологических, воспалительных, инфекционных и т.д. Во время бронхоскопии происходит осмотр и оценка состояния трахеи и бронхов. При необходимости и возможности проводят дополнительные исследования (например, взятие материала для проведения гистологического исследования) для уточнения заболевания. Для удаления инородных тел используется ригидная бронхоскопия, - отмечает торакальный хирург Индира Зулуфова.
По словам эксперта, на сегодняшний день диагностических альтернатив бронхоскопии не существует.
— По данным КТ органов грудной клетки или рентгенографии можно только заподозрить или предположить диагноз. Для постановки точного диагноза необходимы данные, полученные с использованием бронхоскопии, - добавляет Индира Зулуфова.
Популярные вопросы и ответы
На вопросы, касающиеся бронхоскопии легких, отвечает врач-терапевт Оксана Хамицева.
Сколько по времени делают бронхоскопию?
— Бронхоскопия проводится, в среднем, в течение 15 минут. Иногда, когда нужны дополнительные действия, например, взять биопсию, процедура может затянуться до 30 минут.
Будет ли больно во время бронхоскопии легких?
— В этот момент человек не испытывает боли. Полость носоглотки, через которою заводят зонд, обрабатывают местным анестетиком. Да, во время процедуры пациент будет испытывать неприятные ощущения. Но точно не боль, и он спокойно сможет дышать.
Сколько болит горло после бронхоскопии? Какие еще недомогания могут возникнуть?
— Горло после бронхоскопии может поболеть 15 минут, а может пару дней. Это не резкая боль, она, скорее, похожа на боль при завершающейся простуде. Также после процедуры может активно отходить мокрота, иногда с прожилками крови (если брали биопсию, например). В целом, если у пациента нет противопоказаний к проведению бронхоскопии, никаких выраженных последствий он не ощутит.
Чем опасна бронхоскопия легких?
— Если бронхоскопия назначена людям с противопоказаниями к ее проведению, можно получить ряд тяжелых осложнений в зависимости от самого заболевания:
• при гипертонии - криз;
• при аритмии - приступ аритмии;
• при расслоении аорты - разрыв;
• при стенозе гортани - травму;
• при беременности - выкидыш;
• при эпилепсии - приступ.
Можно ли делать бронхоскопию под общим наркозом?
— Если человек совсем не готов к процедуре, ее можно провести под общей анестезией. Тогда это займет около 60 минут, но человек точно ничего не почувствует и не поймет.
Какие есть альтернативы бронхоскопии?
— Альтернативой бронхоскопии может служить комплекс исследований: КТ, анализы крови, анализ мокроты, КТ с внутривенным контрастированием. Но сказать, что эти исследования могут полностью заменить бронхоскопию, нельзя.
Кому нельзя делать бронхоскопию?
Противопоказаниями к проведению бронхоскопии являются:
• заболевания легких в обострении (ХОБЛ, астма и др.);
• стеноз гортани;
• аритмия;
• расслоение аорты;
• высокое АД на момент исследования;
• инфаркт или инсульт давностью менее месяца;
• беременность;
• эпилепсия;
• психические расстройства.
Развитие отечественной бронхоскопии. Литература для изучения бронхоскопии
ГБУЗ Ярославской области «Клиническая онкологическая больница», Ярославль
ФГБУ «Московский научно-исследовательский онкологический институт им. Герцена» — филиал ФГБУ «НМИРЦ» МЗ РФ, Москва, Россия, 125284
Военная медицинская часть, Голицыно, Московская область, Россия, Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Москва, Россия
Московский научно-исследовательский онкологический институт им. П.А. Герцена, Москва
Диагностики эндобронхиальной предопухолевой патологии и ранних форм рака легкого
Журнал: Онкология. Журнал им. П.А. Герцена. 2016;5(5): 66‑71
В настоящее время в мире рак легкого на протяжении последних десятилетий лидирует в структуре заболеваемости и смертности у мужчин. Однако при использовании стандартных рентгеноэндоскопических методов диагностики более 70—80% впервые выявленных больных раком легкого имеют III—IV стадию заболевания, когда радикальное хирургическое лечение невозможно. Развитие центрального рака легкого имеет ступенчатый процесс: трансформация нормального эпителия в гиперпластический, формирование очагов метаплазии, дисплазии, рак in situ (CIS) и микроинвазивный рак. Диагностика рака легкого включает флюорографию, рентгенографию органов грудной клетки, рентгеновскую компьютерную томографию, цитологическое исследование мокроты. Однако ведущую роль в диагностике центрального рака легкого играет эндоскопический метод, который благодаря современным методикам (узкоспектральная эндоскопия, аутофлюоресцентная эндоскопия, увеличительная эндоскопия) позволяет быстро и эффективно выявлять изменения слизистой оболочки трахеобронхиального дерева на разных стадиях канцерогенеза.
Рак легкого в мире на протяжении последних десятилетий остается на первом месте в структуре заболеваемости и смертности у мужчин [1, 2].
Современная медицина располагает новой аппаратурой и высокотехнологичными методиками диагностики рака легкого. В то же время, при использовании стандартных рентгеноэндоскопических методов диагностики более 70—80% впервые выявленных больных раком легкого имеют III—IV стадию заболевания [2, 3]. По данным научно-исследовательских онкологических центов России, Великобритании и Америки смертность при злокачественных опухолях легкого крайне высокая и достигает 87% от числа заболевших [1—4].
Выделяют две основные клинико-морфологические формы рака легкого, отличающиеся степенью злокачественности, частотой и характером метастазирования: 1) немелкоклеточный рак легкого (НМРЛ) и 2) мелкоклеточный рак легкого (МРЛ). К НМРЛ относятся плоскоклеточный, крупноклеточный рак и аденокарцинома. Многие авторы и сейчас пользуются этой терминологией [2, 5, 6]. Но в последних публикациях, в том числе морфологической классификации Всемирной организации здравоохранения (ВОЗ) 2015 г., каждый гистологический тип рассматривается отдельно, понятие НМРЛ не используется, хотя остается легитимным [7, 8].
Считается, что при развитии очага центрального рака легкого эпителий трахеобронхиального дерева проходит следующие ступени канцерогенеза: трансформацию нормального эпителия в гиперпластический, формирование очагов метаплазии, дисплазии, рак in situ (CIS) и микроинвазивный рак [9].
Характеристика интраэпителиальных новообразований бронхиального дерева
Очаги тяжелой дисплазии и CIS слизистой оболочки бронхов, как правило, имеют весьма незначительные размеры: 1—10 мм по плоскости и 200—300 мкм по толщине и не имеют статистически достоверного риска метастазирования [10, 11].
Микроскопические различия интраэпителиальных предраковых новообразований легких представлены в табл. 1.
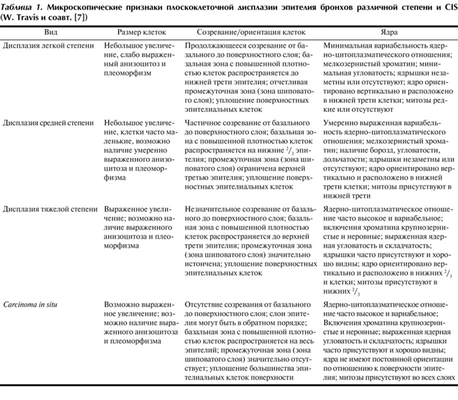
Таблица 1. Микроскопические признаки плоскоклеточной дисплазии эпителия бронхов различной степени и CIS (W. Travis и соавт. [7])
В случаях формирования очагов дисплазии виде папиллярных структур, с образованием протрузий, приподнятых эпителиальных образований используется понятие ангиогенная плоскоклеточная дисплазия, которая является более агрессивной в динамике своего развития по сравнению с плоскими очагами [12].
Анализ работ, посвященных естественному развитию преинвазивных неоплазий, показал, что уровень прогрессии CIS до инвазивной опухоли оценивали от 39 до 69%, в зависимости от исследуемой группы и длительности наблюдения [13, 14]. В исследовании R. Breuer и соавт. [15] опубликованы результаты, согласно которым 32% очагов тяжелой дисплазии и 9% случаев легкой/средней дисплазии прогрессировали до CIS или инвазивной карциномы за период наблюдения от 11 до 21 мес, но при этом наблюдалась регрессия в 54% преинвазивных неоплазий разных типов.
Начальные формы инвазивного рака легкого
Согласно данным ВОЗ (2015 г.) диагноз микроинвазивная карцинома устанавливается в случае [16], когда:
— размер опухоли ≤3 см ;
— инвазивный компонент ≤5 мм.
К понятию ранний центральный рак легкого относится: рентгеннегативная опухоль, определяемая при бронхоскопии, доступная для верификации с помощью щипцовой биопсии; рост опухоли ограничен внутренними слоями стенки бронха; отсутствуют отдаленные метастазы и не вовлечены медиастинальные лимфатические узлы [17, 18].
Лучевые методы диагностики
Среди основных лучевых методов исследования для выявления рака легкого используются флюорография, рентгенография органов грудной клетки, рентгеновская компьютерная томография (КТ). Главным недостатком флюорографии легких при диагностике рака легкого является низкий уровень чувствительности и точности, а доля ложноположительных и ложноотрицательных заключений достигает 30% [19].
Согласно последним рекомендациям AJCC, рентгенография органов грудной клетки из-за низкой эффективности не рекомендована для скрининга рака легкого [20]. Для скринингового исследования в группах риска развития рака легкого рекомендуется проведение низкодозированной спиральной компьютерной томографии (СКТ) органов грудной клетки [21].
Однако центральные, поверхностно-распространяющиеся опухоли, рост которых происходит без сужения и деформации просвета, даже с помощью КТ, чаще всего выявляют уже в стадии специфической лимфаденопатии.
Цитологическое исследование мокроты
Классическим недорогим и неинвазивным методом скрининга центрального рака легкого является цитологическое исследование мокроты. Образец мокроты считается адекватным при наличии в ней макрофагов или бронхиальных альвеолярных клеток [23]. Однако большим недостатком этого метода является низкая чувствительность, которая в среднем не превышает 65% [24], из-за ошибки забора материала, технических трудностей подготовки материала, а также значительной вариабельности согласованности между специалистами. Вероятность обнаружения атипичных клеток в мокроте увеличивается при центральной локализации рака легкого, большом размере опухоли, более прогрессивных стадиях рака, плоскоклеточном раке (в отличие от аденокарциномы) [25].
Эндоскопические методы диагностики
Еще в 460—370 гг. до нашей эры Гиппократ пытался интубировать дыхательные пути пациентам, нуждающимся в экстренной нормализации дыхания. В 1895 г. отоларинголог Г. Киллиан впервые доложил об удалении инородного тела из правого главного бронха пациента с помощью ригидного бронхоскопа Я. Микулича [26].
Современное бронхологическое исследование является основным методом выявления и диагностики скрытых, ранних, рентгеннегативных форм центрального рака легкого [27, 28].
Последние десятилетия стремительно развиваются эндоскопические методики, такие как бронхоскопия с высоким разрешением изображения, аутофлюоресцентная (autofluorescence bronchoscopy (AFB)) и узкоспектральная эндоскопия (narrow band imaging (NBI)). Параллельно в разных странах идет разработка стандартов трактовки эндоскопического изображения, получаемого с помощью этих методик [29].
Бронхоскопия в белом свете
Бронхоскопия в белом свете (white light bronchoscopy (WLB)) является стандартной современной эндоскопической методикой исследования дыхательных путей, которая имеет наибольшую доказательную базу. Согласно последним (2013) клиническим рекомендациям [31] Американского Колледжа Торакальных Врачей (American College of Chest Physicians), WLB рекомендована для обследования:
— при подозрении на центральный рак легкого по результатам лучевых методов диагностики;
— при выявлении атипических клеток в цитологическом анализе мокроты;
— для динамического наблюдения при преинвазивной неоплазии бронхиального дерева;
— для обследования пациентов с инвазивным центральным раком легкого с целью уточнения границ опухоли и выявления мультифокальных дополнительных очагов рака легкого.
Несмотря на очевидные преимущества WLB в диагностике раннего центрального рака легкого по сравнению с КТ, бронхоскопия в белом свете лимитирована в идентификации интраэпителиальных очагов рака малого размера [30, 31]. Многочисленные исследования подтверждают, что сочетание WLB и новых эндоскопических технологий, таких как AFB и NBI улучшают диагностику предопухолевой патологии и ранних, малоинвазивных форм рака легкого [32—34].
Аутофлюоресцентная бронхоскопия
Спектроскопические диагностические методики исследования принято делить на фотодинамическую диагностику, при которой используются экзогенные и эндогенные фотосенсибилизаторы, и аутофлюоресцентную диагностику, основанную на регистрации флюоресцентной активности эндогенных флюорофоров и изменения оптических свойств очагов неоплазии слизистой оболочки бронхов за счет изменения концентрации в ткани аминокислот, коллагена, эластина и дыхательных ферментов (НАДН и др.) [35, 36]. Изменения аутофлюоресценции ткани связаны со многими факторами: с изменением концентрации и глубины распределения эндогенных флюорофоров; с нарушением тканевой микроархитектоники с увеличением толщины слизистой оболочки и нарушением структуры ее слоев; с изменением степени васкуляризации (концентрации гемоглобина); с изменением уровня обмена веществ в патологически измененной ткани [37, 38].
В современных эндоскопических системах в режиме аутофлюоресценции при освещении слизистой оболочки используется свет длиной волны 395—475 нм для индукции феномена аутофлюоресценции и узкий зеленый спектр света (G-спектр, 500 нм) для фиксирования отраженного изображения. Естественная собственная флюоресценция тканей и отраженный зеленый свет фиксируются специальной сверхчувствительной ПЗС-матрицей, которая располагается на дистальном конце эндоскопа. При этом электронная система искусственно окрашивает аутофлюоресцентное изображение нормальной ткани в зеленый цвет, очаги неоплазии и рака — в пурпурный цвет, синий цвет или в виде темного пятна. Полученные изображения суммируются и отображаются на экране [39].
Большинство авторов считают, что применение AFB повышает частоту выявления скрытых очагов интраэпителиальной неоплазии [40—46].
Основным недостатком AFB является ее низкая специфичность. Выявление значительного количества ложнопозитивных очагов приводит к большому количеству бесполезных гистологических исследований [47].
Узкоспектральная бронхоскопия
NBI — это сравнительно новая эндоскопическая диагностическая методика, которая представлена как альтернативная технология для оценки бронхиального эпителия и выявления раннего рака легкого [48].
Обычно при эндоскопическом исследовании используется весь видимый световой спектр от 400 до 800 нм. Для NBI-режима применяется освещение с использованием двух световых волн длиной 415 и 540 нм в диагностике сосудистых структур слизистой оболочки, так как эти световые волны хорошо поглощаются гемоглобином. Это позволяет получить детальное изображение сосудистого рисунка тканей, его изменений, характерных для патологических участков воспалительного генеза, а также для предраковых заболеваний и ранних форм рака [49].
Основоположник классификации сосудистого рисунка патологических новообразований бронхиального эпителия — K. Shibuya. В 2010 г. К. Shibuya и соавт. [49] опубликовали классификацию, в которой выделили 4 типа патологического сосудистого рисунка: извитые сосуды, точечные сосуды, спиралевидные и штопорообразные сосуды. При этом были измерены диаметры сосудов в патологическом очаге. Авторы показали, что сочетание вышеуказанных типов сосудистого рисунка соответствует неоплазии различной степени злокачественности (табл. 2).
Таблица 2. Распределение типов сосудистого рисунка при разных центральных новообразованиях легких [49]
Была доказана высокая чувствительность и специфичность NBI-режима в сочетании с бронхоскопией высокого разрешения в белом свете для выявления патологии сосудистого рисунка и подтверждена связь степени злокачественности образования с увеличением диаметра сосудов слизистой оболочки.
Другие авторы [50—52] провели исследования по изучению возможностей NBI для анализа изменений сосудистого рисунка (архитектоники) слизистой оболочки бронхиального дерева при проведении дифференциальной диагностики воспалительных и неопластических изменений.
Существует только одно проспективное исследование F. Herth и соавт. [53] по сравнению эффективности WLI, NBI и AFB. Авторы считают, что NBI может существенно увеличить специфичность в диагностике и идентификации эндобронхиальных очагов. В будущем методики NBI и AFI должны дополнять друг друга при комплексном обследовании пациентов с онкологической патологией легких.
Не решенной на данный момент задачей остается отсутствие единой валидизированной NBI-классификации сосудистых рисунков новообразований трахеобронхиального дерева.
Увеличительная бронхоскопия
Увеличительная бронхоскопия — это новейшая эндоскопическая методика, которая позволяет получить изображение поверхности слизистой оболочки бронхов с 100—110-кратным увеличением, благодаря чему возможна детальная оценка микрососудистой сети [49]. Она не является скрининговой и не имеет широкого распространения. Однако в крупных научных центрах уже ведутся работы по изучению и внедрению методики увеличительной бронхоскопии.
Таким образом, в настоящее время существует большой арсенал диагностических методик для выявления предопухолевой патологии и рака легкого на ранних стадиях. Ведущую роль в диагностике центрального рака легкого играет эндоскопический метод, который, благодаря современным методикам, позволяет быстро и эффективно выявлять изменения слизистой оболочки трахеобронхиального дерева на разных стадиях опухолевого процесса. Одним из перспективных направлений в совершенствовании современных эндоскопических методик является разработка автоматизированных систем поддержки принятия клинического решения, которые помогают врачу в интерпретации многофакторного эндоскопического исследования при использовании сложных эндоскопических оптических технологий.
Читайте также:
