Редкие формы миастении. Синдром Ламберта-Итона - миастенический синдром.
Добавил пользователь Дмитрий К. Обновлено: 22.01.2026
ГБУЗ «Городская клиническая больница №51» Департамента здравоохранения Москвы, Московский миастенический центр, Москва, Россия;
ГБУЗ «Научно-практический психоневрологический центр им. З.П. Соловьева» Департамента здравоохранения Москвы, Москва, Россия
ГКБ №51, Московский миастенический центр
Декремент амплитуды М-ответа при низкочастотной стимуляции мышц больных миастенией и миастеническим синдромом Ламберта—Итона
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(2): 93‑96
Цель работы. Сопоставление изменения параметров М-ответа при низкочастотной стимуляции у пациентов с миастеническим синдромом Ламберта—Итона (МСЛИ) и миастенией, имевших аналогичную величину декремента, определяемую отношением четвертого (А4) М-ответа к первому (А1). Материал и методы. Обследованы 39 пациентов с МСЛИ в возрасте от 18 до 66 лет, а также 27 больных миастенией в возрасте от 19 до 70 лет. Всем больным проводили электромиографию и исследование паттерна декремента при низкочастотной стимуляции (3 имп/с). Для каждой серии стимулов рассчитывали в процентах декремент амплитуды А4 М-ответа к А1 (ранний декремент) и девятого (А9) к А1 (поздний декремент). Результаты и заключение. Анализ паттерна декремента показал, что при равной величине снижения фактора надежности нервно-мышечной передачи выявляется достоверное отличие в характере снижения амплитуды М-ответа. При МСЛИ в отличие от миастении отмечается другая последовательность изменений амплитуды М-ответа на второй стимул по отношению к первому и пятый — к четвертому. При МСЛИ выявляется прогрессирующий декремент (увеличение отношений позднего А9/А1 к раннему А4/А1), а при миастении — регрессирующий декремент (уменьшение отношений позднего декремента к раннему). Выявленные отличия отражают состояние механизмов мобилизации и освобождения ацетилхолина из терминали аксона.
Цель исследования — изучение механизмов нарушения нервно-мышечной передачи путем сопоставления изменения параметров М-ответа при низкочастотной стимуляции у пациентов с МСЛИ и миастенией, имевших аналогичную величину декремента, определяемую отношением четвертого (А4) М-ответа к А1.
Материал и методы
Обследованы 39 пациентов с МСЛИ, 21 женщина и 18 мужчин, в возрасте от 18 до 66 лет (средний — 45,2±14,9 года), а также 27 больных миастенией, 21 женщина и 6 мужчин, в возрасте от 19 до 70 лет (средний — 38,1±19,7 года). Диагноз миастении и МСЛИ был поставлен на основании клинических, электрофизио-, фармако- и иммунологических критериев.
Диагноз МСЛИ основывался на клинических признаках: слабости в мышцах тазового пояса; гипо- или арефлексии; феномене «врабатывания», проявляющемся увеличением мышечной силы и появлением сухожильных рефлексов в процессе максимального произвольного усилия, а также вегетативных нарушений; наличии выраженного феномена посттетанического облегчения при высокочастотной стимуляции и повышении концентрации антител к потенциалзависимым кальциевым каналам.
Диагноз миастении базировался на наличии глазодвигательных и бульбарных расстройств, слабости и утомляемости проксимальных отделов рук и в меньшей степени ног, положительной реакции на введение антихолинэстеразных препаратов и увеличении уровня антител к ацетилхолиновым рецепторам.
Далее производили расчет отношения А9/А1 к А4/А1 по формуле — (А9/А1)/(А4/А1)%.
Статистический анализ данных проводили с помощью пакета программ SPSS 17.0 («IBM Software», США). Анализ частот встречаемости признаков осуществляли с помощью критерия χ 2 . При сравнении независимых данных применяли непараметрический критерий Манна—Уитни. Во всех видах статистического анализа различия считали статистически значимыми при достигнутом уровне значимости р
Результаты
Основные клинические характеристики пациентов с МСЛИ и миастенией представлены в табл. 1. Как видно из приведенных данных, у 12 (30%) пациентов с МСЛИ и у 1 (3,7%) с миастенией имелись онкологические заболевания: у больных с МСЛИ — мелкоклеточная карцинома легких, у больного миастенией — тимома. У 26 (66,5%) пациентов с МСЛИ отмечались признаки вегетативной недостаточности и у 34 (87%) — угнетение коленных и ахилловых рефлексов; у больных миастенией признаков вегетативной дисфункции и нарушений рефлекторной сферы выявлено не было.
Таблица 1. Клинические характеристики пациентов с МСЛИ и миастенией Примечание. * — непараметрический критерий Манна—Уитни; ** — критерий χ2.
В соответствии с квантовой теорией высвобождения медиатора из терминали аксона изменение амплитуды потенциала концевой пластинки отражает динамику процессов расходования и мобилизации ацетилхолина. Ритмическая стимуляция нерва частотой 2—5 имп/с (межимпульсный интервал 400—200 мс) приводит к снижению эффективности опорожнения везикул, которое уменьшается с каждым последующим стимулом, пока не достигается уровень стабильности. В этой точке число везикул, опорожняющихся при каждом стимуле, считается равным их количеству вблизи от активной зоны, которые могут связываться с ними в интервале между стимулами [12—14]. При этом количество квантов освобождающегося медиатора уменьшается на 20% после второго стимула по отношению к первому и третьего — по отношению ко второму. К четвертому стимулу снижение количества квантов особождающегося медиатора прекращается вследствие активации другого процесса, связанного с мобилизацией фракции ацетилхолина, доступной к немедленному выделению [15, 16]. Каждый повторный импульс приводит к активации потенциалзависимых кальциевых каналов и вызывает поступление ионов кальция в цитоплазму терминали. Для освобождения от этого кальциевого заряда через мембранные кальциевые насосы, митохондрии и другие пути необходимо определенное время. Повторные импульсы способны вызвать поступление ионов кальция, которое превысит возможности пресинаптических механизмов его удаления. Концентрация кальция внутри терминали не может снизиться до уровня покоя после каждого стимула и потому при повторных импульсах его средняя концентрация в цитоплазме увеличивается [17, 18].
Физиологическое уменьшение числа квантов освобождающегося медиатора и величины кванта наряду с нарушением пространственных взаимоотношений пре- и постсинаптических структур, изменение плотности гидратированного геля синаптической щели и функционального состояния ацетилхолинэстеразы, уменьшение числа холинорецепторов на постсинаптической мембране являются причинами, которые могут привести к снижению фактора надежности нервно-мышечной передачи у больных миастенией [19]. Механизм снижения фактора надежности нервно-мышечной передачи при МСЛИ связан с уменьшением числа квантов медиатора, освобождающихся из терминали аксона в ответ на нервный импульс, из-за блокады вхождения кальция внутрь терминали через потенциалзависимые кальциевые каналы. Уменьшение вероятности взаимодействия ацетилхолина с его рецептором обусловлено значительным снижением числа освободившихся квантов медиатора при нормальной плотности холинорецепторов, что приводит к уменьшению амплитуды потенциала концевой пластинки в ответ на нервный импульс. Физиологический декремент освобождения медиатора приводит к еще более значительному снижению амплитуды потенциала концевой пластинки и соответственно уменьшает вероятность возникновения потенциала мышечного волокна [4, 7].
При миастении снижение уровня надежности обусловлено тем, что величина деполяризации, продуцируемая каждым квантом выделенного медиатора, зависит от числа рецепторов, находящихся в пределах его мишени на постсинаптической мембране. Уменьшение плотности холинорецепторов, типичное для миастении, уменьшит вероятность того, что молекула ацетилхолина найдет свободный рецептор для взаимодействия с ним прежде, чем гидролизуется под действием ацетилхолинэстеразы. Конечным результатом будет уменьшение амплитуды миниатюрного потенциала концевой пластинки, образуемого каждой везикулой, и уменьшение потенциала концевой пластинки в момент синхронного опорожнения популяции везикул в ответ на нервный импульс. Чем более значительно уменьшается плотность рецепторов, тем более вероятно возникновение потенциалов концевой пластинки, амплитуды которых окажется недостаточно для генерации потенциала мышечного волокна, несмотря на нормальное освобождение медиатора из терминали аксона. Синапс со сниженным уровнем надежности может то проводить, то не проводить импульс в ответ на физиологический декремент освобождения медиатора, свойственный нормальному нервно-мышечному соединению [19, 20].
Таким образом, степень снижения надежности нервно-мышечной передачи, независимо от вызывающих это снижение причин, может быть определена в каждом нервно-мышечном синапсе как разность между имеющейся амплитудой потенциала концевой пластинки и необходимой для генерации потенциала мышечного волокна. Снижение амплитуды потенциала концевой пластинки ниже этого уровня приводит к выключению мышечного волокна из активности. Чем в большем количестве нервно-мышечных соединений амплитуда потенциала концевой пластинки окажется ниже пороговой и не произойдет генерации потенциала мышечного волокна, тем большее количество мышечных волокон будет выключено из активности. При электромиографическом исследовании это будет проявляться феноменом декремента амплитуды М-ответа [20].
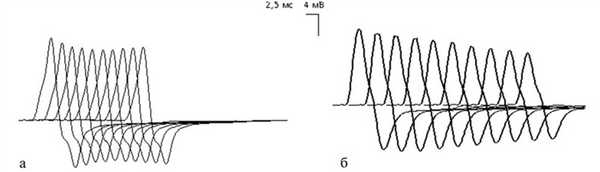
Ритмическая стимуляция с частотой 3 имп/с. а — при миастении; б — при МСЛИ.
Таким образом, результаты проведенного исследования показали, что при равных величинах снижения надежности нервно-мышечной передачи закономерность изменений амплитуды М-ответа на каждый последующий стимул в процессе низкочастотной стимуляции существенно отличается в группах пациентов с МСЛИ и миастенией.
Это обстоятельство имеет не только теоретическое значение, подтверждающее различия механизмов нарушения нервно-мышечной передачи при синаптических болезнях, но и практическое, которое позволяет в электромиографическом заключении обоснованно говорить о нарушении нервно-мышечной передачи «миастенического» типа.
Кризы при миастении
Кризы при миастении - это состояния острой декомпенсации патологии в виде пароксизмального нарушения витальных функций. Резкое усиление мышечной слабости сопровождается угнетением дыхания, бульбарными, сердечно-сосудистыми расстройствами. Чаще всего кризы сочетают в себе признаки миастенического и холинергического вариантов, что придает им более тяжелое течение. В диагностике используют клинические, лабораторные методы, электронейромиографию, КТ и МРТ органов грудной клетки. Неотложные состояния требуют ИВЛ, медикаментозной терапии, экстракорпоральной детоксикации, решения вопроса о хирургической коррекции.
МКБ-10
Общие сведения
Кризы при миастении достаточно редки - в общей популяции регистрируется 50-400 случаев на 1 млн. населения. На протяжении жизни их испытывают 10-45% пациентов с мышечной слабостью, особенно в первые два года болезни. Ежегодный риск возникновения кризов находится в пределах 2-3%. Декомпенсация миастении может наступить в любом возрасте, но значительно чаще встречается среди людей 18-40 лет. В гендерной структуре пароксизмальных состояний практически пятикратное преимущество принадлежит женщинам репродуктивного периода. В пожилом возрасте существенно возрастает показатель распространенности среди мужчин, выравнивая соотношение с женщинами.
Причины кризов
Осложненное течение характерно для приобретенной генерализованной миастении или локальных форм, за исключением глазной. Хотя некоторые авторы указывают на роль наследственной предрасположенности, но врожденные варианты болезни крайне редко сопровождаются кризами. Возникновение тяжелой декомпенсации связано с рядом внешних и внутренних факторов. Значимыми триггерами выступают следующие состояния:
- Респираторные инфекции. Вирусные и бактериальные инфекции дыхательных путей являются наиболее распространенной причиной клинического ухудшения при миастении - на их долю приходится 30-70% случаев. Значение имеют как бронхолегочные заболевания, так и ОРВИ с поражением верхних отделов респираторного тракта. Отдельное место занимают аспирационная пневмония, сепсис.
- Операции. Частой причиной становятся оперативные вмешательства, выполняемые под общей анестезией, особенно тимэктомия. Декомпенсацию наблюдают при миастенических кризах в анамнезе, длительности заболевания свыше 3 месяцев, наличии бульбарных симптомов перед операцией. В зоне повышенного риска находятся пациенты, у которых экстубация была отложена более чем на 24 часа.
- Прием лекарств. Прямым или опосредованным влиянием на нервно-мышечную передачу обладают многие лекарства. Дебют миастении либо развитие криза могут провоцировать бензодиазепины, миорелаксанты, антидепрессанты. Так действуют антибиотики (аминогликозиды, макролиды, тетрациклины), йодсодержащие вещества, препараты магния. Важное значение имеет нарушение схемы приема кортикостероидов и антихолинэстеразных средств.
- Эндокринно-обменные нарушения. Миастения подвержена декомпенсации на фоне дисфункции щитовидной железы, сахарного диабета, ожирения. Риск кризов увеличивается вдвое при патологии тимуса (тимомах). Имеют значение гормональные сдвиги у женщин - при менструациях, климаксе, в период беременности, после родов. Усугубить мышечную слабость могут электролитные расстройства (гипокалиемия, гипофосфатемия).
Вероятность тяжелого пароксизмального течения увеличивается у пожилых людей с сопутствующей соматической патологией (гипертонической, ишемической болезнью), при травмах. Провоцирующим фактором могут стать тяжелые стрессовые ситуации, интенсивные физические нагрузки, перегревание. В группу риска попадают лица в возрасте до 18 и старше 60 лет, с ранней генерализацией миастении, длительно принимавшие антихолинэстеразные препараты. Более половины кризов ассоциируют с неправильным ведением пациентов, но в трети случаев явную причину определить не удается.
Патогенез
Основой патогенеза кризов при миастении является массивная аутоиммунная агрессия против структур мионеврального синапса. Патологический процесс сопровождается образованием антител к ацетилхолиновым рецепторам, белкам постсинаптической мембраны (MuSK, LRP4), что приводит к комплемент-связанной деструкции и резкому уменьшению их количества. В результате не происходит генерации потенциала действия на постсинаптической мембране, что проявляется курареподобным блоком нервно-мышечной проводимости.
Особый механизм развития присущ холинергическому кризу. Генез моторных и вегетативных расстройств связан с гиперполяризацией постсинаптических мембран, вызванной чрезмерным количеством ацетилхолина. Как результат, снижается чувствительность незатронутых аутоиммунным процессом никотиновых и мускариновых рецепторов. Во всех случаях появление криза обусловлено передозировкой антихолинэстеразных препаратов. Кроме мышечной слабости, он характеризуется комплексом холинергических эффектов.
Дыхательные расстройства во время кризов обусловлены феноменом генерализации мышечного утомления, распространяющегося на области, испытывающие функциональную нагрузку. Респираторные расстройства при осложненном течении патологии связаны со слабостью скелетной мускулатуры: диафрагмы, межреберий, брюшного пресса. Не последнюю роль в этом процессе играют нарушение функции надгортанника, накопление слизи в дыхательных путях при недостаточности кашлевого толчка.
Классификация
Согласно классификации миастении по степени тяжести, кризы относят к V классу, когда дыхательные и бульбарные нарушения достигают такого уровня, что без искусственной вентиляции легких и зондового питания не обойтись. Разделение же самих пароксизмов достаточно условно, поскольку один быстро переходит в другой. В практической неврологии выделяют следующие кризы:
- Миастенический. Возникает при неэффективности ингибиторов холинэстеразы. Встречаются парциальные (дыхательный, кардиальный) или генерализованные варианты.
- Холинергический. Обусловлен нерациональным использованием антихолинэстеразных средств. По клиническим формам схож с миастеническим, но протекает с мускариновыми и никотиновыми эффектами.
- Смешанный. Встречается чаще других. Представляет собой наиболее тяжелый вариант криза, который имеет две фазы - миастеническую и холинергическую.
Существует три типа дыхательных расстройств при декомпенсированной миастении - скелетно-мышечный, бульбарный, смешанный. Первый характеризуется поражением мышц грудной клетки и диафрагмы. Бульбарный вариант предполагает парез надгортанника и западение языка с развитием асфиксии. У большинства пациентов оба типа развиваются одновременно.
Симптомы кризов при миастении
Декомпенсация болезни возникает внезапно (за 12-48 часов), сопровождается резким ухудшением жизненно важных функций из-за прогрессирующей мышечной слабости. Иногда наблюдается подострое развитие, когда симптомы нарастают в течение 3-14 дней. У пятой части пациентов кризы являются первым проявлением миастении, что обычно наблюдается при ее поздней манифестации. Склонность к повторному развитию пароксизмов свидетельствует о крайне тяжелом течении основного заболевания.
Миастенический и холинергический кризы имеют ряд общих признаков, к которым относят нарастающую слабость скелетной и бульбарной мускулатуры, глазодвигательные нарушения, гипомимию. Наиболее грозный симптом - дыхательные нарушения, представляющие прямую угрозу жизни пациента. Оба варианта характеризуются психомоторным возбуждением с беспокойством, страхом, спутанностью сознания, обусловленными нарастающей гипоксией головного мозга.
Миастенический криз
Помимо описанных симптомов, миастенический криз сопровождается вегетативной дисфункцией - гипергидрозом, гиперсаливацией, бледностью и цианозом кожных покровов. Он развивается постепенно, так как необходимо время на вовлечение вспомогательной мускулатуры. Пациент принимает вынужденную позу - полусидя, держась за спинку кровати для фиксации плечевого пояса. При генерализованном приступе усиливаются общая слабость, птоз, ограничивается подвижность глазных яблок. Бульбарные нарушения сочетаются с расстройствами дыхания и деятельности сердца.
Одним из вариантов проявления парциального кардиального миастенического криза становятся приступы, схожие со стенокардическими: пациент ощущает дискомфорт в области сердца, перебои в его работе. Объективно выявляют гипотонию, тахикардию. Пароксизм обычно возникает в ночное время, проходит после приема антихолинэстеразных препаратов. Парциальные дыхательные кризы развиваются по бульбарному или спинальному типу с нарастанием слабости в соответствующих группах мышц.
Холинергический криз
Характеризуется парадоксальным снижением мышечной силы в ответ на введение антихолинэстеразных средств. В клинической картине присутствуют отчетливо выраженные мускариновый и никотиновый эффекты. Первый проявляется усилением секреции слюны и бронхиальной слизи, повышенной потливостью, сужением зрачков. Возникают абдоминальные боли, диспепсические явления (тошнота, рвота, понос), брадикардия. Активация никотиновых рецепторов сопровождается мышечными фасцикуляциями, судорогами.
Смешанный криз
Учитывая быструю трансформацию кризов при миастении, их разграничение затруднено, поэтому чаще констатируют смешанный вариант. Он сопровождается несостоятельностью бульбарных и дыхательных мышц при незначительном снижении силы в конечностях. Сопутствующие нарушения туловищной локализации остаются чувствительны к анитихолинэстеразным препаратам. Но в сочетании с холинергическими симптомами такой криз представляет существенную опасность для пациента.
Осложнения
Кризы угрожают остановкой дыхания и сердечно-сосудистой недостаточностью, повышающими летальность при миастении вдвое. У трети пациентов пароксизмы имеют тенденцию к рецидивированию. При миастеническом кризе возрастает риск экстубационной дыхательной недостаточности, частота которой составляет 27%. Поражение бульбарных мышц ведет к развитию аспирационных состояний (пневмонии, синдрома Мендельсона).
Диагностика
Важной задачей для врача-невролога является ранняя диагностика дыхательных нарушений с выявлением риска кризового течения миастении. Тяжесть процесса устанавливается по международной классификации, шкале мышечной силы. Клиническими критериями являются прогрессирующая мышечная слабость, дисфагия, респираторный дистресс (одышка, тахипноэ, вовлечение вспомогательных мышц). Для выявления факторов декомпенсации применяются методы лабораторного и инструментального контроля:
- Биохимический анализ крови. Определение концентрации антител, направленных против ацетилхолиновых рецепторов и мышечно-специфической тирозинкиназы (MuSK), проводится иммуноферментным анализом, радиоиммунологическим методом. Исследование газов артериальной крови при дыхательных расстройствах показывает гиперкапнию, гипоксию, снижение сатурации.
- Фармакологические пробы. При введении антихолинэстеразных ЛС наблюдается регресс симптоматики миастенического криза. Холинергическая форма сопровождается отрицательной прозериновой пробой, при которой симптомы не исчезают, а нарастают. Если же пациент нуждается в ИВЛ, то проводить ее для разграничения двух вариантов нет необходимости.
- Электрофизиологическое исследование. Ритмическая стимуляционная электронейромиография является наиболее чувствительным тестом для обнаружения нарушений в мионевральном синапсе. Электрофизиологическим предиктором развития криза признается генерализованное снижение М-ответа на первый вызванный электрический стимул в пораженной мышце.
- Томография.КТ-сканирование грудной клетки выполняется для исключения патологии вилочковой железы - тимомы. Исследование имеет гораздо более высокую информативность по сравнению с традиционной рентгенографией. Высокой точностью при выявлении мягкотканных образований обладает МРТ, ее выполнение увеличивает диагностическую ценность рентгенологического метода.
Дифференцировать кризы при миастении необходимо с другими тяжелыми состояниями, сопровождающимися респираторными расстройствами. В списке вероятных заболеваний могут присутствовать синдром Ламберта-Итона, ботулизм, полиомиелит. Необходимо учитывать врожденные миастенические состояния, острые нарушения мозгового кровообращения, синдром Гийена-Барре и прочие нарушения со схожей симптоматикой.
Лечение кризов при миастении
Консервативное лечение
Резкая декомпенсация мышечной слабости - это жизнеугрожающее состояние, требующее оказания ургентной помощи. Все пациенты поступают в отделение реанимации и интенсивной терапии, где проводится восстановление дыхания и сердечной деятельности. В терапии кризов практикуется последовательный междисциплинарный подход, включающий общие и патогенетические (специфические) мероприятия консервативной коррекции.
Купирование дыхательной недостаточности проводится путем санации ротоглотки и трахеобронхиального дерева, интубации трахеи, перевода пациента на ИВЛ. Объем респираторной поддержки определяется тяжестью нарушений. Одновременно отменяют препараты антихолинэстеразного ряда и другие, усугубляющие проведение нервных импульсов. К мероприятиям общего характера относят выявление и устранение инфекционных осложнений, профилактику тромбозов. Специфическое лечение при кризах включает:
- Введение иммуноглобулинов. Может рекомендоваться как метод первой линии при лечении тяжелой генерализованной миастении и кризов. Внутривенные иммуноглобулины G способны угнетать аутоиммунную агрессию, оказывая быстрый кратковременный эффект. Метод дает сопоставимые с плазмаферезом результаты, но более доступен и прост в применении, лучше переносится пациентами.
- Плазмаферез.Экстракорпоральная детоксикация считается эффективным методом лечения кризовых состояний при миастении, назначается перед и после тимэктомии. Обменный плазмаферез позволяет вывести из плазмы крови антитела, обеспечивая большинству пациентов позитивный эффект, сохраняющийся 1-2 месяца. Альтернативой является селективная иммуносорбция.
- Кортикостероидную терапию. Патогенетически обосновано применение пульс-терапии кортикостероидами (метилпреднизолоном), которая способна купировать проявления криза. У некоторых пациентов сопровождается кратковременным ухудшением состояния или резистентностью. Риск негативных явлений уменьшается при одновременном применении плазмафереза, иммуноглобулинов.
В комплексной терапии используются различные средства симптоматической и вспомогательной коррекции, действие которых направлено на усиление выработки ацетилхолина, улучшение мышечной функции, подавление побочных эффектов патогенетического лечения. Используются метаболические средства (метионин, глутаминовая кислота, витамины), препараты кальция, адаптогены. Профилактику кортикостероид-ассоциированного остеопороза осуществляют ретаболилом, фторидом натрия.
Хирургическое лечение
Своевременное удаление тимуса (тимэктомия) оказывает превентивный эффект - уменьшает частоту и тяжесть кризов при миастении, особенно при ранней декомпенсации. В послеоперационном периоде у 6-22% пациентов отмечаются рецидивы тяжелых пароксизмов, но риск отрицательных последствий снижается при использовании малоинвазивных техник: цервикотомии, частичной стернотомии, торакоскопии под видеоконтролем. Пациенты с тяжелыми бульбарными расстройствами нуждаются в трахеостомии.
Экспериментальное лечение
Для лечения кризов при миастении предлагают использовать другие иммуносупрессивные препараты - азатиоприн, мофетила микофенолат, циклоспорин. Их рассматривают в качестве альтернативы кортикостероидам при наличии противопоказаний или неадекватного терапевтического ответа. Но в силу отсроченного действия эти препараты обладают ограниченным применением. При злокачественном течении болезни отмечена эффективность моноклональных антител (ритуксимаба).
Прогноз и профилактика
Своевременно оказанная медицинская помощь делает прогноз благоприятным, исход кризов может ухудшиться из-за сопутствующей патологии. Смертность от декомпенсации миастении составляет около 4%, но за счет активной респираторной поддержки и ранней интенсивной терапии ее удается избежать. Прогрессирование моторных нарушений оказывает инвалидизирующий эффект, снижая качество жизни. Для профилактики кризов проводят динамическое наблюдение за пациентами, рассматривают целесообразность тимэктомии, устраняют факторы риска, в том числе разъясняют важность правильного приема лекарств .
2. Особенности течения миастенического криза при позднем дебюте заболевания/ Лапшина О.В., Седышев Д.В., Беляков К.М., Антипенко Е.А., Густов А.В.// Современные проблемы науки и образования. - 2017. - № 4.
3. Миастения. Принципы диагностики и лечения, тактика ведения больных/ Малкова Н.А.// Медицина неотложных состояний. - 2008. - 1(14).
Миастения
Миастения - это аутоиммунное заболевание, вызывающее слабость мышц из-за нарушения в работе нервно-мышечной передачи. Чаще всего нарушается работа мышц глаз, лицевых и жевательных мышц, иногда - дыхательной мускулатуры. Это определяет характерные для миастении симптомы: опущение нижнего века, гнусавость голоса, нарушения глотания и жевания. Диагноз миастении устанавливается после прозериновой пробы и анализа крови на наличие антител к рецепторам постсинаптической мембраны. Специфическое лечение миастении заключается в назначении антихолинэстеразных препаратов, таких как амбенония хлорид или пиридостигмин. Эти средства восстанавливают нервно-мышечную передачу.
Миастенией (или ложным/астеническим бульбарным параличом, или болезнью Эрба-Гольдфлама) называют заболевание, основным проявлением которого является быстрая (болезненно быстрая) утомляемость мышц. Миастения - это абсолютно классическое аутоиммунное заболевание, при котором клетки иммунной системы, по той или иной причине уничтожают другие клетки собственного же организма. Такое явление можно считать обычной реакцией иммунитета, только направлена она не на чужеродные клетки, а на свои.
Патологическая утомляемость мышц была описана клиницистами в середине XVI века. С тех пор заболеваемость миастенией стремительно растет и выявляется у 6-7 человек на каждые 100 тыс. населения. Женщины болеют миастенией в три раза чаще мужчин. Самое большое количество случаев развития заболевания наблюдается у людей в возрасте от 20 до 40 лет, хотя болезнь может развиться в любом возрасте или быть врожденной.
Причины миастении
Врожденная миастения является следствием генной мутации, из-за которой нервно-мышечные синапсы не могут нормально функционировать (такие синапсы - это что-то вроде "переходников", которые позволяют нерву взаимодействовать с мышцей). Приобретенная миастения встречается чаще врожденной, но легче поддается лечению. Существует несколько факторов, которые при определенных условиях могут стать причиной развития миастении. Наиболее часто патологическая мышечная утомляемость формируется на фоне опухолей и доброкачественной гиперплазии (разрастания тканей) вилочковой железы - тимомегалии. Реже причиной возникновения болезни становятся другие аутоиммунные патологии, например - дерматомиозит или склеродермия.
Описано достаточно случаев выявления миастенической слабости мышц у больных с онкологическими заболеваниями, например, с опухолями половых органов (яичников, предстательной железы), реже - легких, печени и др.
Как уже упоминалось, миастения - это заболевание аутоиммунной природы. Механизм развития болезни основан на выработке организмом антител к белкам-рецепторам, которые находятся на постсинаптической мембране синапсов, осуществляющих нервно-мышечную передачу.
Схематически это можно описать так: отросток нейрона имеет проницаемую мембрану, через которую могут проникать специфические вещества - медиаторы. Они нужны для передачи импульса от нервной клетки к мышечной, на которой есть рецепторы. Последние на мышечных клетках теряют способность связывать медиатор ацетилхолин, нервно-мышечная передача значительно затрудняется. Именно это и происходит при миастении: антитела разрушают рецепторы на "второй стороне" контакта между нервом и мышцей.
Симптомы миастении
Миастению называют "ложным бульбарным параличом" из-за того, что симптомы этих двух патологий действительно похожи. Бульбарный паралич - это повреждение ядер трех черепно-мозговых нервов: языкоглоточного, блуждающего и подъязычного. Все эти ядра располагаются в продолговатом мозге и их поражение крайне опасно. Как при бульбарном параличе, так и при миастении, возникает слабость жевательных, глоточных и лицевых мышц. В итоге это приводит к самому грозному проявлению - дисфагии, то есть нарушению глотания. Патологический процесс при миастении, как правило, первыми затрагивает мышцы лица и глаз, затем - губ, глотки и языка. При длительном прогрессировании заболевания развивается слабость дыхательных мышц и мышц шеи. В зависимости от того, какие группы мышечных волокон поражены, симптомы могут комбинироваться в разных вариантах. Есть и универсальные признаки миастении: изменение выраженности симптомов в течение дня; ухудшение состояния после длительного напряжения мышц.
При глазной форме миастении болезнь затрагивает только глазодвигательные мышцы, круговую мышцу глаза, мышцу, поднимающую верхнее веко. Как следствие, основными проявлениями будут: двоение в глазах, косоглазие, сложность в фокусировке взгляда; невозможность долго смотреть на объекты, расположенные очень далеко или очень близко. Кроме этого, почти всегда присутствует характерный симптом - птоз или опущение верхнего века. Особенность этого симптома при миастении заключается в том, что он появляется или усиливается к вечеру. Утром же его может не быть вовсе.
Патологическая утомляемость лицевой, жевательной мускулатуры и мышц, ответственных за речь, приводит к изменению голоса, трудностям с приемом пищи и речью. Голос у больных миастенией становится глухим, "носовым" (такая речь звучит примерно так же, как если бы человек просто говорил, зажав нос). При этом говорить очень тяжело: короткий разговор может настолько утомить больного, что ему необходимо будет несколько часов на восстановление. То же самое касается и слабости жевательных мышц. Жевание твердой пищи может оказаться для человека с миастенией физически непосильной задачей. Больные всегда стараются четко планировать время еды, чтобы принимать пищу в момент максимального действия принимаемых лекарств. Даже в периоды относительного улучшения самочувствия, больные предпочитают есть в первой половине дня, поскольку к вечеру симптомы усиливаются.
Поражение мышц глотки - более опасное состояние. Здесь проблема, напротив, состоит в невозможности принимать жидкую пищу. При попытке выпить что-то больные часто поперхиваются, а это чревато попаданием жидкости в дыхательные пути с развитием аспирационной пневмонии.
Все описанные симптомы заметно усиливаются после нагрузки на ту или иную группу мышц. Например, длительный разговор может стать причиной еще большей слабости, а жевание твердой пищи часто приводит к дополнительному ухудшению работы жевательных мышц.
И, наконец, несколько слов о самой опасной форме миастении - о генерализованной. Именно она обеспечивает стабильный 1% смертности среди больных данной патологией (за последние 50 лет показатель смертности снизился с 35% до 1%). Генерализованная форма может проявляться слабостью дыхательных мышц. Расстройство дыхания, которое возникает по этой причине, приводит к возникновению острой гипоксии и смерти, если больному вовремя не была оказана помощь.
Миастения со временем неуклонно прогрессирует. Темп ухудшения может существенно различаться у разных больных, возможно даже временное прекращение прогрессирования болезни (впрочем, это встречается достаточно редко). Ремиссии возможны: как правило, они возникают спонтанно и заканчиваются так же - "сами по себе". Обострения миастении могут носить эпизодический или длительный характер. Первый вариант называется миастеническим кризом, а второй - миастеническим состоянием. При кризе симптомы проходят достаточно быстро и полностью, то есть во время ремиссии никаких остаточных явлений не наблюдается. Миастеническое состояние - это длительно существующее обострение с наличием всех симптомов, которые, тем не менее, не прогрессируют. Продолжаться такое состояние может в течение нескольких лет.
Диагностика миастении
Наиболее показательное при миастении исследование, которое может дать неврологу массу информации о заболевании - это прозериновая проба. Прозерин блокирует работу фермента, расщепляющего ацетилхолин (медиатор) в пространстве синапса. Таким образом, количество медиатора увеличивается. Прозерин обладает очень мощным, но кратковременным эффектом, поэтому для лечения этот препарат почти не используется, а вот в процессе диагностики миастении прозерин необходим. При помощи последнего проводится несколько исследований. Сначала больного осматривают, чтобы оценить состояние мышц до пробы. После этого подкожно вводится прозерин. Следующий этап исследования производится через 30-40 минут после приема препарата. Врач повторно осматривает больного, выясняя тем самым реакцию организма.
Кроме того, подобная же схема применяется для электромиографии - регистрации электрической активности мышц. ЭМГ проводится дважды: до введения прозерина и через час после него. Исследование позволяет определить, действительно ли проблема заключается в нарушении нервно-мышечной передачи или нарушена функция изолированно мышцы или нерва. Если даже после ЭМГ остаются сомнения в природе заболевания, может понадобиться проведение ряда исследований проводящей способности нервов (электронейрографии).
Важно исследование анализа крови на наличие в ней специфических антител. Их обнаружение - достаточный повод для постановки диагноза миастении. При необходимости делают биохимический анализ крови (по индивидуальным показаниям).
Ценную информацию может дать компьютерная томография органов средостения. В силу того, что большой процент случаев миастении можно связать с объемными процессами в вилочковой железе, КТ средостения таким больным проводят достаточно часто.
В процессе диагностирования миастении необходимо исключить все прочие варианты - заболевания, которые имеют сходную симптоматику. В первую очередь это, конечно, уже описанный выше бульбарный синдром. Помимо этого, проводится дифференциальная диагностика с любыми воспалительными заболеваниями (энцефалит, менингит) и опухолевыми образованиями в области ствола мозга (глиома, гемангиобластома и др.), другой нейро-мышечной патологией (БАС, синдром Гийена, миопатии). В ряде случаев похожие на миастению симптомы может давать нарушение мозгового кровообращения (ишемический инсульт) в бассейне позвоночной артерии.
Лечение миастении
Цель лечения при миастении - увеличить количество ацетилхолина в нервно-мышечных синапсах. Это делается не путем увеличения синтеза этого вещества (это достаточно сложно), а путем угнетения его разрушения. Для этого в практической неврологии используются препараты из той же группы, в которую входит неостигмин. Для длительного лечения выбираются препараты другого типа: оптимальным вариантом здесь считается средство с мягким и длительным действием. Наиболее часто сейчас используются производные пиридостигмина и амбенония.
В случае тяжелого течения и стремительного прогрессирования болезни назначаются препараты, угнетающие иммунный ответ. Как правило, используют глюкокортикоиды, реже - классические иммунодепрессанты. При подборе стероидов всегда стоит проявлять максимальную осторожность. Больным с миастенией противопоказаны препараты, содержащие фтор, поэтому спектр лекарств для выбора оказывается не очень большим. Всем больным миастенией старше 69 лет проводится удаление вилочковой железы. Также к этому методу прибегают при обнаружении в тимусе объемного процесса и в случае резистентной к лечению миастении.
Препараты для симптоматического лечения подбираются индивидуально, исходя из особенностей каждого больного. Человек с миастенией должен соблюдать некоторые правила в своем образе жизни, чтобы ускорить выздоровление или продлить ремиссию. Не рекомендуется проводить слишком много времени под солнечными лучами и переносить излишние физические нагрузки. Перед тем, как самостоятельно начать принимать какое-либо лекарство, консультация с врачом абсолютно необходима. При миастении противопоказаны некоторые средства. К примеру, прием определенных антибиотиков, мочегонных средств, успокаивающих препаратов и лекарств, содержащих магний - последние могут значительно ухудшить состояние больного.
Прогноз при миастении зависит от массы факторов: от формы, времени начала, типа течения, условий, пола, возраста, качества или наличия/отсутствия лечения и т. д. Легче всего протекает глазная форма миастении, тяжелее всего - генерализованная. На данный момент при строгом соблюдении рекомендаций врача почти все больные имеют благоприятный прогноз.
Так как миастения - это хроническое заболевание, то чаще всего больные вынуждены постоянно принимать лечение (курсами или непрерывно) для поддержания хорошего самочувствия, но качество их жизни от этого страдает не очень сильно. Очень важно своевременно диагностировать миастению и остановить ее прогрессирование до момента появления необратимых изменений.
Синдром Ламберта-Итона
Синдром Ламберта-Итона — аутоиммунное заболевание, обусловленное поражением пресинаптической мембраны двигательных нервных окончаний и ассоциированное со злокачественными неоплазиями и аутоиммунной патологией. Главным проявлением синдрома является чрезмерная утомляемость и понижение силы мышц, выраженное преимущественно в верхних отделах ног. Диагноз базируется на неврологическом обследовании и данных электронейромиографии. Лечение состоит в удалении опухоли (при ее обнаружении), проведении иммунносупрессивной терапии и сеансов плазмафереза, назначении фармпрепаратов, облегчающих прохождение нервных импульсов по нервно-мышечному синапсу.
Синдром Ламберта-Итона был детально изучен американскими исследователями Ламбертом и Итоном, в честь которых он получил эпонимическое название. Заболевание представляет собой миастенический синдром, ассоциированный с неопластическими и аутоиммунными процессами в организме. Возраст заболевших варьирует в пределах 20-70 лет, но наиболее часто поражаются лица старше 40-летнего возраста. Вначале синдром Ламберта-Итона диагностировался преимущественно у мужчин, и гендерное соотношение составляло 5 случаев заболевания у мужчин к 1 случаю у женщин. Однако современные наблюдения специалистов в области неврологии показали уменьшение этой разницы.
По различным данным, синдром Ламберта-Итона выступает как паранеопластический синдром у 50-75% заболевших; наиболее часто у мужчин (примерно в 70%) и достаточно редко у женщин (до 20%). 80% всех неоплазий, диагностируемых при данном синдроме, составляет мелкоклеточный рак легкого. Причем симптоматика миастенического синдрома может на несколько лет опережать выявление опухолевого процесса. В ряде случаев заболевание Ламберта-Итона сочетается с другими синдромами паранеопластического характера, например, с паранеопластической полиневропатией.
Причины синдрома Ламберта-Итона
Синдром развивается на фоне злокачественных неоплазий (рак бронха, рак желудка, рак яичников, ретикулосаркома, колоректальный рак, рак простаты и др.) и аутоиммунных процессов (ревматоидный артрит, болезнь Шегрена, СКВ, аутоиммунный тиреоидит и пр.). Патогенетическим субстратом заболевания являются аутоиммунные механизмы. У 90% пациентов были выявлены антитела к кальциевым каналам, входящим в структуру, как опухолевых клеток, так и окончаний двигательных нервных волокон. Предположительно мишенью аутоиммунной атаки является пресинаптическая мембрана нервно-мышечного синапса. Ее поражение приводит к уменьшению высвобождения ацетилхолина — медиатора нервно-мышечной передачи. Результатом является нарушение прохождения возбуждения от нервного волокна к мышечной ткани, что клинически проявляется утомляемостью и слабостью мышц.
Симптомы синдрома Ламберта-Итона
Основу клинической картины составляет повышенная утомляемость и слабость скелетных мышц, преобладающая в мышцах верхней части ног (мышцы бедра и тазового пояса). Пациенты предъявляют жалобы на слабость в ногах и шаткость, особенно заметные при подъеме по лестнице и продолжительной ходьбе. Могут отмечаться дискомфортные ощущения в области шеи и спины, миалгии, парестезии в дистальных отделах конечностей, вегетативные расстройства (сухость во рту, уменьшение слезопродукции, дистальный гипергидроз, ортостатическая артериальная гипотония). Типична паретичная "утиная походка". Наблюдается снижение сухожильных рефлексов.
Отличительной особенностью синдрома является некоторое нарастание мышечной силы в ходе двигательной активности, в отличие от миастении, при которой движения приводят к усугублению мышечной слабости. У отдельных пациентов может возникать опущение верхнего века. Характерные для миастении глазодвигательные расстройства, диплопия и нарушения глотания наблюдаются редко.
Диагностика синдрома Ламберта-Итона
Диагноз устанавливается неврологом на основании жалоб, неврологического обследования и результатов электронейромиографии. В неврологическом статусе выявляется тетрапарез с акцентом в проксимальных отделах ног, гипорефлексия, легкая дисметрия при выполнении координаторных проб, незначительное снижение глоточного и небного рефлексов.
Электронейромиография определяет снижение амплитуды потенциалов действия покоя и временное нарастание амплитуды М-ответа при произвольных мышечных сокращениях или на фоне ритмичной электростимуляции нерва частотой свыше 10 Гц (т. н. «феномен врабатывания»). При стимуляции частотой 2-3 Гц наблюдается снижение высоты М-ответа, типичное для миастении. Электрофизиологическое исследование позволяет дифференцировать синдром Ламберта-Итона от миастении, миопатии, БАС, полимиозита и другой нервно-мышечной патологии.
Поскольку высока вероятность, что заболевание развилось как паранеопластический синдром, рекомендовано широкое обследование пациента на предмет выявления неоплазии. Проводится анализ крови на онкомаркеры, КТ органов грудной клетки и средостения, МСКТ органов брюшной полости, МРТ головного мозга, КТ или МРТ позвоночника, УЗИ щитовидной железы и т. д. При отсутствии результатов (невыявлении неоплазии) показаны повторные обследования с интервалом в 6 мес. С целью подтверждения аутоиммунного характера патологии назначаются иммунологические исследования.
Лечение синдрома Ламберта-Итона
При паранеопластическом генезе синдрома лечение базируется на ликвидации опухолевого процесса. Если лечение опухоли проходит успешно, то обычно наблюдается регресс симптоматики. При аутоиммунном генезе заболевания проводится симптоматическая терапия фармпрепаратами, угнетающе воздействующими на иммунную систему. В основном используются глюкокортикостероиды. Хороший эффект оказывает плазмаферез, позволяющий отфильтровать из крови циркулирующие в ней аутоантитела.
С целью облегчения нервно-мышечного проведения в схему лечения включают ингибиторы ацетилхолинэстеразы — фармпрепараты, облегчающие нервно-мышечную передачу за счет накопления в синапсе ацетилхолина. К таким препаратам относятся пиридостигмин, ипидакрин. В ряде случаев отмечалось улучшение при применении гуанидина, облегчающего высвобождение ацетилхолина нервными окончаниями. Однако гуанидин не нашел широкого использования вследствие высокой токсичности с побочным воздействием на почки и костный мозг. Менее токсичным фармпрепаратом с аналогичным эффектом является 3,4-диаминопиридин. Его прием может сопровождаться возникновением парестезий, диареи, тахикардии, повышенной бронхиальной секреции. Хотя эффективность 3,4-диаминопиридина доказана клинически, в настоящее время он используется лишь в специализированных медицинских центрах.
Редкие формы миастении. Синдром Ламберта-Итона - миастенический синдром.
Серонегативный непаранеопластический миастенический синдром Ламберта—Итона
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(5): 77‑80
Обследовали 2 пациентов, у которых повторно проведенные исследования не выявили характерного для миастенического синдрома Ламберта—Итона наличия антител к потенциалзависимым кальциевым каналам класса P/Q. Однако данные клинического тестирования и электрофизиологического обследования выявляли типичный характер двигательных расстройств с отсутствием сухожильных рефлексов и явлениями дизавтономии, а также уменьшением амплитуды М-ответа и феноменов декремента при низкочастотной и инкремента при высокочастотной стимуляции. У пациентов не было выявлено признаков карциноматозного процесса. Аутоиммунный характер поражения подтверждался эффективностью терапии глюкокортикоидными препаратами.
Трудности диагностики миастенического синдрома Ламберта—Итона (МСЛИ) в первую очередь состоят в том, что у данного симптомокомплекса нет никаких признаков миастении, возможно, за исключением высокой чувствительности нервно-мышечного синапса к курареподобным миорелаксантам. В связи c этим возникает вопрос о том, правомочно ли называть его миастеническим? Важно, что, несмотря на жалобы пациентов на слабость, объективное тестирование мышечной силы не выявляет ее существенного снижения. Реакция на введение антихолинэстеразных препаратов более чем сомнительная. Нарушения нервно-мышечной передачи при электрофизиологическом исследовании также отличаются от таковых при миастении [1].
Примерно у ½ больных с МСЛИ выявляются признаки паранеопластического процесса. В результате длительного наблюдения за 63 больными с МСЛИ у 45% пациентов (из них 58% мужчин и 15% женщин) нами были выявлены признаки онкологического поражения, а в группе больных старше 40 лет это соотношение составило 75 и 22% соответственно [2]. Наиболее часто (около 85% случаев) выявляется мелкоклеточная карцинома легких, хотя имеются случаи сочетания с опухолью почек, острым лейкозом, ретикулосаркомой и даже злокачественной тимомой [3—5]. Вместе с тем МСЛИ — это не случайное сочетание миастении с онкологическим заболеванием [1].
В соответствии с современными представлениями, МСЛИ как с наличием, так и отсутствием бронхогенной карциномы относится к аутоиммунным заболеваниям, патогенез которого связан с наличием аутоантител к потенциалзависимым кальциевым каналам (ПКК) пресинаптической мембраны нервно-мышечного соединения [6, 7].
В сыворотке крови примерно 90% больных МСЛИ выявляются антитела к ПКК типа P/Q [2, 6, 8, 9]. Однако ряд исследователей [10, 11] обнаруживали и антитела к N- и L-типам каналов. У больных с МСЛИ как с признаками паранеопластического процесса, так и без такового, помимо специфических аутоантител, выявляются антитела, направленные как против различных антигенных мишеней нервно-мышечного соединения, так и других, например слизистой оболочки желудка, ткани щитовидной железы, клеткам Пуркинье и другим нейрональным структурам [12—18]. Большинство исследователей [6, 13, 14, 19] не выявляют у больных с МСЛИ типичных для миастении аутоантител к ацетилхолиновым рецепторам. Вместе с тем в литературе описана [1, 20] группа больных, имеющих комбинацию миастении и МСЛИ (англ.: «overlap myasthenic syndrome»), у которых в различные периоды течения болезни могут преобладать клинические признаки либо миастении, либо МСЛИ и соответственно выявляться антитела и к ацетилхолиновым рецепторам, и к ПКК.
Важно, что клинические проявления миастенического синдрома и электрофизиологические характеристики нарушений нервно-мышечной передачи у больных с МСЛИ с наличием и отсутствием паранеопластического процесса не отличаются. По мнению большинства исследователей [6, 7, 9], не отличаются они и по особенностям иммунного ответа, в частности по уровню антител к ПКК. В проведенных нами ранее исследованиях [8, 19] также не было выявлено существенных отличий в этих группах больных. Однако, несмотря на высокую диагностическую значимость исследования уровня антител к ПКК, у двух пациентов повторные исследования не выявили антител типа P/Q. Трудности диагностики серонегативного непаранеопластического миастенического синдрома представлены в следующих клинических наблюдениях.
Больной Р., 52 лет, впервые обратился в апреле 2004 г. с жалобами на слабость в ногах, больше в проксимальных отделах (трудно подниматься по лестнице), сухость во рту, а также слабость в руках. Болен с июля 2003 г., когда впервые заметил слабость в ногах и затруднение при ходьбе. Незадолго до этого стал отмечать выраженную сухость во рту и сухость кожи. По месту жительства (Тамбов) была диагностирована полинейропатия, по поводу которой лечился амбулаторно и стационарно — без эффекта. В декабре 2003 г. отметил ухудшение состояния — усилилась слабость в ногах и присоединилась слабость в руках (проксимальная и менее выраженная дистальная).
Объективно при осмотре в апреле 2004 г. в неврологическом статусе глазодвигательных и бульбарных нарушений нет. Сила мимической мускулатуры — нормальная. Сила в дистальных отделах рук 4 балла, в проксимальных отделах ног — 3 балла (со стула встает с опорой на руки, не может встать с корточек), в дистальных отделах ног — 4 балла. Плохо стоит на носках и пятках. Походка «утиная». Сухожильные рефлексы с рук и коленные снижены, ахилловы — не вызываются. Патологических стопных знаков, нарушений чувствительности, статики и координации нет. Положительный симптом «врабатывания» — увеличения силы при физической нагрузке.
При исследовании нервно-мышечной передачи методом непрямой ритмической стимуляции снижена амплитуда негативной фазы М-ответа. Выявлен декремент амплитуды М-ответа при стимуляции частотой 3 имп/с -32% (норма менее -10%). При стимуляции частотой 40 имп/с выявлен инкремент амплитуды М-ответа до 5,9 мв (247% по амплитуде, 151% по площади, -32% по длительности). В период посттетанического облегчения (ПТО) амплитуда М-ответа увеличилась до 4,76 мв (200%), декремент амплитуды М-ответа составлял -38%. В период посттетанического истощения (ПТИ) декремент амплитуды М-ответа составил -26%. Полученные данные характерны для пресинаптического типа нарушений.
Анализ параметров потенциалов двигательных единиц (ПДЕ) и спонтанной активности мышечных волокон с помощью концентрических игольчатых электродов выявил снижение средней длительности ПДЕ. Амплитуда ПДЕ была увеличена, отмечались повышенное количество полифазных потенциалов, а также спонтанная активность в виде единичных потенциалов фибрилляций (ПФ) и положительных острых волн (ПОВ).
После введения 40 мг нейромидина через 1 ч у пациента отмечалось нарастание мышечной силы на 1 балл. После введения нейромидина при исследовании состояния нервно-мышечной передачи увеличилась амплитуда М-ответа и уменьшился декремент при низкочастотной стимуляции, а при исследовании потенциалов двигательных единиц несколько увеличились параметры ПДЕ.
Таким образом, данные клинического и результаты электрофизиологического исследования не выявляли признаков полинейропатии, а указывали на наличие МСЛИ.
В связи с этим больному было проведено тщательное обследование по органам с целью исключения паранеопластического процесса, было начато лечение нейромидином в дозе 30 мг 3 раза в день и препаратами кальция, а также начата глюкокортикоидная терапия (перорально метилпреднизолон по 64 мг через день). На фоне проводимой терапии отмечена положительная динамика в виде уменьшения мышечной слабости, «сухого синдрома» и симптома «врабатывания», появления сухожильных рефлексов в руках. Обследование по органам не выявило паранеопластического процесса.
Антитела к ПКК типа P/Q (характерные для МСЛИ) выявлены не были. Концентрация антител к ацетилхолиновым рецепторам — 0,29 нмоль/л (норма не более 0,5 нмоль/л).
На фоне лечения глюкокортикоидными препаратами прибавил в весе около 10 кг, также появилась катаракта (впоследствии удалена). Было рекомендовано уменьшение дозы метипреда, однако при снижении дозы менее 24 мг увеличилась мышечная слабость в ногах и усилился «сухой» синдром», что вновь потребовало увеличения дозы глюкокортикоидных препаратов. В 2011 г. в течение 6 мес принимал 3,4 диаминопиридины (фирдапс) — без значительного эффекта.
В январе 2013 г. на фоне продолжающегося лечения (32 мг метипреда через день, а также ежедневно 4—5 таблеток нейромидина и препаратов кальция) отмечается «лунообразное» лицо. В неврологическом статусе сохраняется снижение мышечной силы в проксимальных и дистальных отделах ног до 4 баллов. Сухожильные рефлексы с рук средней живости, коленные и правый ахиллов рефлекс резко снижены. Левый ахиллов рефлекс не вызывается. Сохраняется минимальная сухость языка и сухость кожных покровов. Положительный синдром «врабатывания».
Больной Ц., 54 лет. Впервые обратился осенью 2011 г. с жалобами на слабость в ногах и руках, эпизоды двоения и сухость слизистых и кожи. Болен с октября 2006 г., когда после операции на коленном суставе стал отмечать слабость в ногах, затем постепенно слабость в руках, периодическое двоение. С этого же периода отмечает сухость слизистых, нарастающую при физической нагрузке. Учитывая слабость и утомляемость, а также повышение креатинфосфокиназы, был поставлен диагноз воспалительной миопатии, что подтверждалось результатами электромиографии, выявившими снижение средней длительности ПДЕ с минимальной спонтанной активностью. На основании обследования было высказано предположение о МСЛИ. В неврологическом статусе птоза и офтальмопареза нет. Диплопия при крайних отведениях глазных яблок. Нечеткие нарушения глотания. Мягкое небо подвижно. Голос нормальный. Слабость мимической мускулатуры, а также в проксимальных отделах рук, в большей степени — ног; в дельтовидных, дву-, трехглавых и пояснично-подвздошных мышцах — 3 балла. Сила мышц шеи — 4 балла. Синдром патологической мышечной утомляемости после физической нагрузки в виде увеличения слабости. Вместе с тем отмечается синдром «врабатывания». Кашлевой толчок и экскурсия грудной клетки достаточные. Сухожильные рефлексы на руках резко снижены, на ногах отсутствуют. Нарушений чувствительности, координации и статики нет.
После введения 2,0 мл 0,05% раствора прозерина отмечалось исчезновение диплопии и увеличение силы в конечностях на 2 балла. Проба расценена как позитивная.
При электромиографии амплитуда М-ответа мышцы, отводящей V палец кисти, снижена — 0,4 мв. Декремент при стимуляции с частотой 3 имп/с — 29%. Феномен инкремента при высокочастотной стимуляции с увеличением амплитуды М-ответа до 2,5 мв (400%); феномен ПТО — 147% и ПТИ — 49%.
В последующем принимал сочетание калимина с нейромидином с некоторым улучшением состояния. С ноября 2012 г. — глюкокортикоидные препараты (медрол) 64 мг через день. На фоне проводимого лечения отметил постепенное улучшение состояния с регрессом глазодвигательных и бульбарных расстройств, увеличением мышечной силы в проксимальных отделах конечностей. Уменьшилась сухость кожи и слизистых, появились сухожильные рефлексы. К февралю 2013 г. доза медрола была уменьшена до 36 мг через день.
При повторном обследовании отмечено значительное увеличение амплитуды М-ответа — 2,9 мВ. Декремент при стимуляции с частотой 3 имп/с — 37%. Феномен инкремента при высокочастотной стимуляции с увеличением амплитуды М-ответа до 6,2 мв (200%); феномен ПТО — 214% и ПТИ — 48% (см. рисунок).
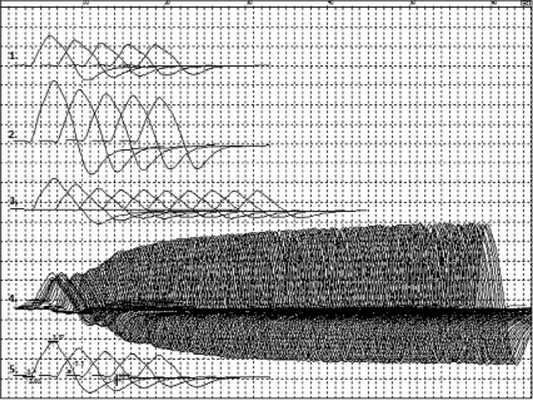
Изменения параметров М-ответа при стимуляции с частотой 3 имп/с в покое (1) в период ПТО (2), постактивационного (3) и ПТИ (5); при стимуляции серией из 200 импульсов с частотой 50 имп/с (4).
Антитела к ПКК типа P/Q (характерные для МСЛИ) не выявлены. Уровень антител к ацетилхолиновому рецептору 0,46 нмоль/л (норма — менее 0,5 нмоль/л).
МСЛИ, описанный в начале 60-х годов прошлого века как миастенический синдром, иногда сочетающийся с бронхогенной карциномой у злоупотребляющих курением табака пожилых мужчин, по мере накопления клинических наблюдений изменялся с появлением большего числа пациентов без признаков паранеопластического процесса, женщин, а также ранних и даже врожденных форм болезни [21]. Детальное изучение частоты отдельных клинических симптомов у большой группы больных с МСЛИ позволило выявить характерный паттерн болезни, позволяющий дифференцировать МСЛИ от миастении и других нервно-мышечных болезней [2]. У больных с МСЛИ крайне редко выявляется поражение глазодвигательной и бульбарной мускулатуры. Несмотря на жалобы на слабость, объективное снижение силы может быть очень незначительным, а при повторных движениях сила увеличивается в противоположность тому, что наблюдается у больных миастенией. Характерными симптомами МСЛИ являются угнетение сухожильных рефлексов, выраженные нарушения со стороны вегетативной нервной системы, а также так называемый синдром «врабатывания» — увеличение силы или появление рефлексов в процессе максимального произвольного усилия [2, 4, 5]. Так же как и другие исследователи, мы не выявили [2] достоверных клинических, электрофизиологических и иммунологических критериев, позволяющих дифференцировать пациентов с наличием и отсутствием паранеопластического процесса. Изучение концентрации аутоантител к ПКК типа P/Q также не выявило корреляции между уровнем антител и тяжестью клинических проявлений МСЛИ [8].
Приведенные два клинических случая серонегативного непаранеопластического МСЛИ представляют несомненный интерес, поскольку вызывали трудности диагностики. Клинический анализ представленных наблюдений показал, что даже пациенты с отсутствием типичных аутоантител могут существенно отличаться по выраженности и локализации двигательных расстройств. Так, в первом случае, более типичном для классических клинических проявлений МСЛИ, проведенное дважды исследование не выявило антител к ПКК типа P/Q. Во втором случае клинические проявления болезни сопровождались хоть и незначительными, но все же более типичными для миастении экстраокулярными и бульбарными нарушениями. Следует отметить, что выполненные в нашей клинике и одном из специализированных центров в Германии исследования антител к ПКК типа P/Q и ацетилхолиновому рецептору были негативными. Эти обстоятельства привели к неправильной диагностике в первом случае полинейропатии, во втором — миопатии. Важно, что оба наблюдения проявлялись несомненным, хотя и неверифицированным аутоиммунным характером поражения, на что указывает эффективность терапии глюкокортикоидными препаратами.
Читайте также:
