Реконструкция мягких тканей ноги при ранениях. Техника
Добавил пользователь Cypher Обновлено: 02.02.2026
К ранениям мягких тканей относятся ранения кожи, слизистой оболочки, глубоколежащих тканей (подкожной клетчатки, мышц и др.), а также сухожилий, сосудов и нервов. В результате нарушения целостности кожи происходит микробное загрязнение раневой поверхности, что может привести к развитию инфекции.
По повреждающему фактору раны делят на механические, термические (ожоговые) и химические; по орудию травмы — на раны от тупых, острых предметов, орудий и оружия, огнестрельных орудий и оружия; по характеру повреждений раны классифицируют на ушибленные, рваные, сочетанные, укушенные, колотые, резаные, колото-резаные, рубленые, пиленые, сочетанные пулевые, дробовые, осколочные.
По глубине повреждения различают поверхностные раны, располагающиеся в различных слоях кожи, и глубокие, проходящие в глубжележащих тканях. Раны внутренних органов и суставов, сообщающиеся с внешней средой раневым каналом, называют открытыми, а раны, раневые каналы которых проходят через полости или оканчивающиеся в них, - проникающими ранениями. Раны внутренних органов, не сообщающиеся с внешней средой, относятся к закрытым.
Причины
Резаные раны возникают в результате непосредственного воздействия острого оружия на поверхность кожи.
Рубленые раны образуются при опускании острого оружия на кожу под углом.
Колотые раны - результат глубокого проникновения острого тонкого инструмента. Возможно ранение полостей или суставов.
Ушибленные раны возникают в том случае, если какая-нибудь часть тела вступает в контакт с жестким препятствием и имеется твердая опора в виде костей черепа или другой кости.
Раздавленные, размозженные раны образуются вследствие воздействия тупого орудия с широкой поверхностью при противопоставлении твердой опоры.
Укушенные раны. Вследствие укуса животным или человеком в рану могут поступать высоковирулентные возбудители раневой инфекции.
Симптомы
Заподозрить закрытое повреждение можно, зная механизм травмы, (например, удар тупым предметом) и при наличии одного или нескольких признаков: синяк, отек, боль.
По некоторым признакам можно предположить характер травмы. К примеру, отек и деформация могут означать закрытый перелом. Синяк на голове, кровянистые выделения из носа, ушей и рта - возможна травма шейного отдела позвоночника или головного мозга. Синяки на грудной клетке, деформация, нарушение симметрии - возможна травма грудной клетки с повреждением ребер и грудины. Нарушение дыхания могут говорить о травме легкого. Синяки большого размера на животе - возможна травма внутреннего органа.
Признаки раны варьируют в зависимости от типа и глубины повреждения ткани. Как правило, любое повреждение сопровождает боль, возможно нарушение целостности кожного покрова, а также кровотечение.
Диагностика
При небольших поверхностных ранах, не сопровождающихся общими симптомами, диагноз выставляется на основании клинической картины. Детальное исследование осуществляется в процессе первичной обработки раны. При обширных и глубоких ранах с нарушением общего состояния необходимы дополнительные исследования, перечень которых определяется с учетом локализации повреждения. При повреждениях в области груди назначают рентгенографию грудной клетки, при повреждениях области живота - рентгенографию брюшной полости, УЗИ или лапароскопию и т. д. При подозрении на нарушение целостности сосудов и нервов требуется консультация нейрохирурга и сосудистого хирурга.
Лечение
Первая медицинская помощь заключается в первичной хирургической обработке раны, во время которой удаляются инородные тела из раны, останавливается кровотечение, рана промывается антисептиками, иссекаются нежизнеспособные ткани. Так же решается вопрос о профилактике столбняка и бешенства (если рана укушенная). Раны с выраженным воспалительным процессом не ушиваются, проводится их дренирование. Инфицированная рана заживает вторичным натяжением. Ежедневно проводятся перевязки и смена дренажей. Общее лечение заключается в противовоспалительной терапии, введении кровеостанавливающих средств, обезболивающих.
При обильной кровопотере решается вопрос о возмещении объема циркулирующей крови (ОЦК), вводятся кровезаменители, компоненты крови. В последующем при сильных рубцовых контрактурах и деформациях может повторно проводиться восстанавливающая операция.
Чаще всего поверхностные раны кровоточат не сильно. Поэтому помощь состоит в перевязке раны. Перед этой процедурой края смазывают антисептиком, следя за тем, чтобы он не попал в рану.
Рану закрывают стерильной салфеткой и бинтуют. Если края раны сильно разошлись, перед наложением повязок их надо сблизить (но не до смыкания) и в таком положении фиксировать 2-3 полосками лейкопластыря.
Рану нельзя промывать водой (опасность заражения), а также спиртом или йодной настойкой. Дезинфицирующий раствор, попадая в рану, обусловливает гибель поврежденных клеток, а также вызывает значительную боль. На рану нельзя накладывать никакую мазь, а также класть вату непосредственно в рану.
Не следует забывать о витаминотерапии. Дефицит витаминов резко замедляет репаративные (восстановительные) процессы.
Для ускорения заживления ран имеет значение правильное питание больных, особенно тех, кто перенес травматический шок, тяжелую инфекцию или большую операцию. Им необходима полноценная диета с повышенным количеством белка и витаминов. Лечебная физкультура показана в первую очередь при гнойных ранах верхних конечностей. Большую роль играют физиотерапевтические процедуры: УФО, УВЧ и др.
Реконструкция мягких тканей ноги при ранениях. Техника
предоставляем актуальную медицинскую информацию от ведущих специалистов, помогая врачам в ежедневной работе
Для цитирования: Посттравматическое воспаление мягких тканей и опорно-двигательного аппарата. РМЖ. 2013;15:819.
В клинической практике врачей любой специальности травма мягких тканей и опорно-двигательного аппарата занимает важное место. Наибольший уровень этого вида травм отмечается у мужчин в возрасте 20-50 лет, а у женщин - 30-59 лет, причем во всех возрастных группах данный показатель значительно выше у мужчин. По характеру повреждений около 50% травм - это вывихи, растяжения капсульно-связочного аппарата, травмы мышц и сухожилий, переломы костей верхних и нижних конечностей. Известно, что на любую травму организм отвечает неспецифической воспалительной реакцией - реактивным воспалением, которая является адаптационной и защитной реакцией и клинически проявляется болью, отеком и нарушением функции поврежденной области.
В лечении пациентов с повреждениями опорно-двигательной системы важной задачей является достижение быстрого и стойкого анальгетического эффекта, особенно в раннем посттравматическом или постоперационном периодах. Для решения этой задачи применяются нестероидные противовоспалительные препараты (НПВП), которые обладают как противовоспалительным, так и анальгетическим действием.
Как известно, действие НПВП основано, прежде всего, на ингибиции циклооксигеназ - ЦОГ-1 и ЦОГ-2. В современной фармакологии принято выделять селективные ингибиторы ЦОГ-1 и неселективные ингибиторы ЦОГ-1 и ЦОГ-2, преимущественно селективные ингибиторы ЦОГ-2 и высокоселективные ингибиторы ЦОГ-2 [1].
Позитивный лечебный эффект НПВП связан с подавлением активности ЦОГ-2 (циклооксигеназа 2-го типа). Этот фермент, участвующий в каскаде распада поврежденных при травме и других поражениях клеточных мембран, отвечает за выделение провоспалительных простагландинов и других медиаторов воспаления не только в суставах, но и в других органах и тканях, в первую очередь в стенках сосудов.
Выбор конкретного препарата определяется двумя основными параметрами: эффективностью и безопасностью [2, 3]. Длительное применение НПВП создает опасность целого ряда нежелательных реакций, основной из которых является их ульцерогенное действие. Чем более селективен препарат в отношении ЦОГ-2, тем менее выражен этот эффект, однако в то же время уменьшается анальгетическое действие препарата. У неселективных ингибиторов ЦОГ-1 и ЦОГ-2, наоборот, повышается риск нежелательных реакций со стороны желудочно-кишечного тракта (ЖКТ), но усиливается противовоспалительное и обезболивающее действие [1]. При необходимости проведения длительного курса лечения предпочтение обычно отдают селективным ингибиторам ЦОГ-2 [4].
Принципиальным моментом, который следует учитывать при выборе НПВП, считается скорость достижения клинического эффекта. Особое значение этот параметр имеет при купировании острых болевых синдромов, например травматического генеза. Известно, что НПВП с хорошей биодоступностью, максимально быстро создающие высокую пиковую концентрацию в крови, являются наиболее эффективными средствами для ургентного обезболивания. Быстрое развитие обезболивающего эффекта определяет необходимость их применения у пациентов с травмой и воспалением мягких тканей и опорно-двигательного аппарата. Однако большинство НПВП являются неселективными, что вызывает большое количество побочных эффектов и значительно снижает возможность использования лекарственных препаратов.
Преимущества селективных ингибиторов ЦОГ-2 в терапии болевых синдромов, в т.ч. при травме и в послеоперационном периоде, хорошо известны [5]:
1. Достоверное уменьшение частоты развития нежелательных явлений со стороны ЖКТ, почек, печени.
2. Отсутствие негативного влияния на синтез основных компонентов матрикса суставного хряща в отличие от неселективных НПВП.
3. Возможность длительного применения при заболеваниях и травмах суставов и пролонгация противовоспалительной терапии при необходимости (упорный синовит и др.).
Препаратом, обладающим указанными выше свойствами, является нимесулид. Ключевое значение имеет его высокая биодоступность - уже через 30 мин. после перорального приема достигается значимая концентрация препарата в крови, составляющая не менее 25% от максимальной. Полный обезболивающий и противовоспалительный эффект нимесулида отмечается через 1-3 ч после приема 7.
После перорального применения у здоровых добровольцев нимесулид (таблетка 100 мг) быстро всасывается и распределяется. Максимальная концентрация (Cmax) составляет от 2,86 до 6,50 мг/л, время до достижения максимальной концентрации (tmax) - 1,22-2,75 ч после применения. Средний период полувыведения - от 1,80 до 4,73 ч. Стабильный уровень концентрации достигается в течение 24-48 ч при ежедневном пероральном или ректальном приеме 2 р./сут. [9]. При клиническом использовании НПВП в течение длительного времени у пожилых пациентов, которые обладают повышенной чувствительностью к этим препаратам, довольно часто наблюдаются побочные эффекты [10]. Безопасной альтернативой в таких ситуациях является применение местных НПВП, что приводит к уменьшению системных побочных явлений.
Проведенное группой авторов исследование эффективности местного применения нимесулида показало, что данное лекарственное средство проникает трансдермально и достигает биофазы (синовиальной жидкости) в достаточной для производства его главной фармакологической активности (ингибирование ЦОГ) концентрации и, следовательно, оказывает положительное клиническое воздействие на болевой синдром, тугоподвижность суставов и адекватное функционирование пораженного органа [11]. Следует отметить, что степень проникновения препарата и скорость достижения биофазы зависят от его липофильности и увлажнения рогового слоя эпидермиса, а также от состояния барьерной функции кожи [12]. Клинический эффект данных средств определяется концентрацией действующего вещества, оптимальной терапевтической дозой, обеспечивающей анальгетический и противовоспалительный эффекты. Гели по сравнению с мазями являются более перспективной лекарственной формой, т.к. имеют рН, близкий к рН кожи, не закупоривают ее поры, быстро и равномерно распределяются. При их использовании создается высокая концентрация действующего вещества в периартикулярных тканях, а в кровоток препарат поступает в минимальной концентрации, не вызывающей каких-либо системных нежелательных реакций [13].
Клиническая эффективность топических средств при различных заболеваниях опорно-двигательного аппарата, включая травмы мягких тканей, суставов и связочного аппарата, была изучена в ряде исследований. Согласно полученным данным, в случае острой фазы артрита (первые 18 ч), как и в случае хронической фазы артрита (14 дней), гель нимесулид оказался эффективнее, чем гели диклофенак и пироксикам [14]. Применение нимесулида показало быстрое наступление лечебного эффекта. Авторами был сделан вывод, что хороший анальгетический эффект геля, содержащего нимесулид, позволяет применять препарат локально, что может быть более безопасным и эффективным методом лечения, чем назначение внутрь или ректально [15].
Основанием для проведения открытого сравнительного исследования геля диклофенак и геля нимесулид при РА послужил дискутируемый в литературе вопрос о выраженности анальгетического эффекта неселективных и селективных по отношению к ЦОГ-2 НПВП [16]. В результате оказалось, что анальгезирующий эффект обоих препаратов сопоставим. Выраженность боли в исследуемом коленном суставе достоверно уменьшалась как при ходьбе по ровной местности, так и при подъеме/спуске по лестнице в обеих группах. Скорость наступления эффекта была различной, в среднем составляла 30 мин., длительность аналгезии сохранялась от 4 до 6 ч, что свидетельствует о необходимости трехразового нанесения геля на пораженный сустав в течение суток. Эффект локальной терапии оценили как хороший 37,9% больных, применявших гель нимесулид, и 33,3% лечившихся гелем диклофенак, как удовлетворительный - 48,3 и 50% соответственно. Не отметили эффекта трое больных, получавших нимесулид, и пятеро - диклофенак. Переносимость гелевых форм была хорошей, побочных реакций (местных и системных) авторами не отмечено.
Согласно результатам метаанализа 86 рандомизированных клинических испытаний, в которых НПВП для местного применения сравнивались с плацебо, другими НПВП для местного использования или НПВП для перорального приема, локальные НПВП значимо превосходят плацебо по эффективности [13]. В этот обзор были включены исследования, в которых боль являлась клиническим исходом при острых (травма мягких тканей, растяжения и вывихи) или хронических заболеваниях (остеоартрит и ревматизм). Было показано, что при острых болях местное лечение эффективнее плацебо уже на 1-й нед., при хронических - через 2 нед. терапии. Нежелательные явления - как местные (3,6%), так и системные (0,5%) - встречались редко и были сопоставимы с плацебо. Согласно полученным данным, местное применение НПВП достоверно эффективнее плацебо, а число локальных (6%) и системных (3%) нежелательных явлений и количество больных, прервавших лечение из-за побочных реакций, было сопоставимым с числом больных, получавших наружно НПВП, и на фоне лечения плацебо [17].
В результате проведения оценки качества лечения больных остеоартрозом методом анкетирования исследователи выявили, что больные выполняют рекомендации врача главным образом в части проведения симптоматической терапии и широко используют местное лечение НПВП [18].
В некоторых ситуациях использование местных топических средств либо невозможно, либо не дает достаточного анальгезирующего эффекта, например при травме позвоночника и значительно выраженном болевом синдроме. В таких случаях необходимо и вполне оправданно использование пероральных анальгетиков, содержащих нимесулид. Так, исследование итальянских авторов показало высокую эффективность нимесулида у больных с переломом позвоночника на фоне остеопороза [19].
Применение пероральных форм нимесулида показало высокую клиническую эффективность и при острой патологии плечевого сустава [20]. Так, авторами в ходе двойного слепого плацебо-контролируемого исследования при сравнительной оценке эффективности обезболивания во время острого воспаления плечевого сустава установлено, что анальгезирующая способность нимесулида в дозе 100 мг значительно превосходит таковую диклофенака в дозе 75 мг при сравнимой безопасности применения. Аналогичные результаты были получены и в другом исследовании [21], в ходе которого проведена сравнительная оценка эффективности диклофенака и нимесулида при острой патологии плечевого пояса.
Хорошую эффективность и переносимость нимесулида у больных травматологического профиля зафиксировало исследование, проведенное группой итальянских исследователей среди детей с острой травмой в возрасте от 7 до 14 лет. В результате исследования обезболивающего потенциала нимесулида у этой категории больных установлено, что данный препарат обладает высокой анальгезирующей активностью, сравнимой с эффективностью наркотических анальгетиков, но при этом его использование не приводит к росту числа побочных эффектов от проводимой терапии [22].
Одной из самых частых причин обращения за медицинской помощью является спортивная травма, которая не сопровождается нарушением целостности костных структур, не требует оперативного лечения и длительной иммобилизации, но при этом ее наличие ухудшает качество жизни человека и требует обезболивания и эффективного купирования симптомов, таких как боль, отек и ограничение движений в конечности. При проведении мультицентрового исследования эффективности и безопасности лечения так называемых малых спортивных повреждений установлены эффективность и преимущества применения нимесулида у данных больных. Так, применение пероральной формы нимесулида в дозе 300 мг/сут. позволило полностью купировать симптомы повреждения и вернуться к привычной спортивной активности всем больным, получавшим лечение, при этом не зафиксировано побочных эффектов исследуемого препарата [23].
Заключение
Обзор современной литературы показал, что проведение лечебных мероприятий с включением в состав комплексной терапии НПВП, содержащих нимесулид, оказывается эффективным для различной патологии, в т.ч. и при травме мягких тканей и опорно-двигательного аппарата. В совокупности представленные данные свидетельствуют о хорошей переносимости и отсутствии системных нежелательных реакций, свойственных НПВП, при сравнительно высокой эффективности лечения.
Литература
1. Клиническая фармакология нестероидных противовоспалительных средств / под ред. Ю.Д. Игнатова, В.Г. Кукеса, В.И. Мазурова. М.: ГЭОТАР-Медиа, 2010. 576 с.
2. Насонов Е.Л. Нестероидные противовоспалительные препараты (Перспективы применения в медицине). М.: Анко, 2000.
3. Steinmeyer J. Pharmacological basis for the therapy of pain and inflammation with nonsteroidal anti-inflammatory drugs // Arthritis Res. 2000. Vol. 2 (5). Р. 379-385.
4. Moore R., Barden A., Barden J. Systematic review of dexketoprofen in acute and chronic pain BMC // Clin Pharmacol. 2008.
5. Боль (практическое руководство для врачей) / под ред. Н.Н. Яхно, М.Л. Кукушкина. М., 2012. 512 с.
6. Насонов Е.Л. Эффективность и переносимость нестероидного противовоспалительного препарата. Нимесулид: новые данные // РМЖ. 2001. № 15. С. 6-8.
7. Rainsford K. Current status of the therapeutic uses and actions of the preferential cyclo-oxygenase-2 NSAID, nimesulide // Inflammopharmacology. 2006. Vol. 14 (3-4). Р. 120-137.
8. Bennett A. Nimesulide a well established cyclooxygenase-2 inhibitor with many other pharmacological properties relevant to inflammatory diseases. In: Therapeutic Roles of Selective COX-2 Inhibitors. Editors Vein J.R., Botting R.M. William Harvey Press, 2001. Р. 524-540.
9. Bernareggi A. Clinical pharmacokinetics of nimesulide // Clin Pharamacokinetic. 1998. Vol. 35. Р. 247-274.
10. Ruoff G.E. Challenges of managing chronic pain in the elderly // Semin Arthritis Rheum. 2001. Vol. 32 (Suppl 1). Р. 43-50.
11. Erdogan F., Ergun H., Gokay N.S. et al. The diffusion of nimesulide gel into synovial fluid: a comparison between administration routes // International Journal of Clinical Pharmacology and Therapeutics. 2006. Vol. 44. № 6. Р. 270-275.
12. Хитров Н.А., Цурко В.В., Семочкина Е.Н. Локальная терапия остеоартроза // Лечащий врач. 2002. Vol. 3. Р. 48-55.
13. Moore R.A., Tramer M.R., Carall D. et al. Quantative systemic review of topically applied NSAID-s // Brit. Med. J. 1998. Vol. 316. Р. 333-338.
14. Gupta S.K., Prakash J., Awor L. et al. Anti-inflammatory activity of topical nimesulide gel in various experimental models // Inflamm Res. 1996. Vol. 45 (12). Р. 590-592.
15. Sengupta S., Velpandian T., Kabir S.R. et al. Analgesic efficacy and pharmacokinetics of topical nimesulide gel in healthy human volunteers: double-blind comparison with piroxicam, diclofenac and placebo // Eur J Clin Pharmacol. 1998. Vol. 54 (7). Р. 541-547.
16. Балабанова Р.М., Федина Т.П., Запрягаева М.Е. и соавт. Эффективность геля Найз (нимесулид) в качестве аддитивной терапии у больных ревматоидным артритом // РМЖ. 2008. № 16 (10). С. 684-687.
17. Mason L., Moore R.A., Derry S., Edwards J.E., McQuay H.J. Systematic review of topical for the treatment of chronic pain // BMJ. 2004. Vol. 328. Р. 991-994.
18. Замятина Е.А., Багирова Г.Г. Как лечатся больные остеоартрозом? Тезисы II Всероссийского конгресса ревматологов России. 2011. 27. № 98.
19. Rossini M., Bertoldo F., Lovato R., Bortolotti R., Gatti D., Adami S. Use of nonsteroidal anti-inflammatory drugs in patients with vertebral osteoporotic fractures // Reumatismo. 2002 Oct-Dec. Vol. 54 (4). Р. 340-343.
20. Wober W. Comparative efficacy and safety of nimesulide and diclofenac in patients with acute shoulder, and a meta-analysis of controlled studies with nimesulide // Rheumatology (Oxford). 1999 May. Vol. 38 (Suppl 1). Р. 33-38.
21. Wober W., Rahlfs V.W., Buchl N., Grassle A., Macciocchi A. Comparative efficacy and safety of the non-steroidal anti-inflammatory drugs nimesulide and diclofenac in patients with acute subdeltoid bursitis and bicipital tendinitis // Int J Clin Pract. 1998 Apr-May. Vol. 52 (3). Р. 169-175.
22. Facchini R., Selva G., Peretti G. Tolerability of nimesulide and ketoprofen in paediatric patients with traumatic or surgical fractures // Drugs. 1993. Vol. 46 (Suppl 1). Р. 238-241.
23. Calligaris A., Scaricabarozzi I., Vecchiet L. A multicentre double-blind investigation comparing nimesulide and naproxen in the treatment of minor sport injuries // Drugs. 1993. Vol. 46 (Suppl 1). Р. 187-190.
Введение: повреждения мягких тканей сопровождают жизнь человека и составляют основное число обращений в учреждения первичного звена здравоохранения. Ушибы возникают, как правило, при падении или ударах о твердые предметы и неотъемлемо связаны с болевым синдромом.
Цель исследования: определить эффективность анальгетической терапии при ушибах мягких тканей верхней и нижней конечностей.
Материал и методы: проведено пилотное проспективное сравнительное исследование с участием 54 человек в возрасте 25-50 лет, из них 27 — с ушибом мягкий тканей плеча, 27 — с ушибом бедра. Ушибы у всех пациентов характеризовались образованием подкожного или внутрикожного кровоизлияния, отеком мягких тканей без повреждения мышц. Для оценки эффективности применения таблетированной и инъекционной форм кетопрофена и диклофенака в зависимости от локализации повреждения было сформировано 8 групп. Оценивали скорость наступления обезболивающего эффекта в 1-е сутки после получения травмы и динамику выраженности боли по визуальной аналоговой шкале, выраженность отека. Лечение и наблюдение за пациентами прекращали при достижении стойкого анальгезирующего эффекта, восстановлении функции конечности.
Результаты исследования: средний возраст пациентов составил 44,7 года. Соотношение мужчин и женщин было 1:1. Особенностью оценки болевого синдрома при первичном обращении явилось то, что пациенты с ушибом плеча оценивали боли на 2-3 балла выше, чем пациенты с ушибом бедра. При ушибах верхней конечности кетопрофен в таблетках начинал проявлять свою активность уже на 10-й минуте, при ушибах нижней конечности — на 20-й минуте. Инъекционная форма препарата обеспечивала выраженный обезболивающий эффект уже на 5-й минуте. Как таблетированная, так и инъекционная форма кетопрофена продемонстрировали преимущество перед диклофенаком. К 3-4-м суткам во всех случаях удавалось добиться полного купирования боли.
Заключение: настоящее пилотное исследование подтвердило эффективность и быстрое начало анальгетического действия кетопрофена в лечении ушибов мягких тканей.
Ключевые слова: ушиб, мягкие ткани, боль, анальгетическая терапия, кетопрофен, диклофенак
D.V. Zhukov 1 , N.V. Ustikova 2 , V.M. Prokhorenko 1,2
1 Novosibirsk State Medical University, Novosibirsk, Russian Federation
2 Novosibirsk Research Institute of Traumatology and Orthopedics named after Ya.L. Tsivyan,
Novosibirsk, Russian Federation
Background: soft tissue injuries accompany the patient's life and make up the main number of visits to primary health care facilities. As a rule, contusions occur when falling or hitting hard objects and are inherently associated with pain.
Aim: to determine the analgesic therapy efficacy for soft tissue injuries of the upper and lower extremities.
Patients and Methods: a pilot prospective comparative study was conducted including 54 subjects aged 25-50 years (27 patients with shoulder contusion and 27 with hip contusion). Contusions in all patients were characterized by the formation of subcutaneous or intradermal hemorrhage and soft tissue edema without muscle damage. 8 groups were formed to assess the efficacy of the tablet and injection administration types of ketoprofen and diclofenac, depending on the location of the injury. The time of analgesic effect onset on the 1st day after the injury and the trend of pain severity were evaluated using a visual analog s cale, as well as edema severity. Treatment and follow-up of patients were discontinued when a persistent analgesic effect was achieved and the function of the limb was restored.
Results: the patients' median age was 44.7 years. The ratio of men and women was 1:1. A feature of the pain syndrome assessment during the initial treatment was that patients with a shoulder contusion rated pain 2-3 points higher than patients with a hip contusion. In the upper limb contusions, ketoprofen in tablets activated already at the 10th minute, in the lower limb contusions - at the 20th minute. The drug injectable form provided a pronounced analgesic effect already at the 5th minute. Both the tablet and injectable forms of ketoprofen demonstrated a benefit over diclofenac. By the 3rd-4th day, it was possible to achieve complete pain relief in all cases.
Conclusion: this pilot study confirmed the efficacy and rapid onset of the ketoprofen analgesic effect in the treatment of soft tissue injuries.
Keywords: contusion, soft tissue, pain, analgesic therapy, ketoprofen, diclofenac.
For citation: Zhukov D.V., Ustikova N.V., Prokhorenko V.M. Treatment of soft tissue injuries. Russian Medical Inquiry. 2021;5(3):145-149. DOI: 10.32364/2587-6821-2021-5-3-145-149.
Для цитирования: Лечение ушибов мягких тканей. РМЖ. Медицинское обозрение. 2021;5(3):145-149. DOI: 10.32364/2587-6821-2021-5-3-145-149.
Введение
Повреждения мягких тканей сопровождают жизнь человека. Ушиб — это закрытое механическое повреждение мягких тканей, обусловленное кратковременным воздействием повреждающего фактора, которое не сопровождается образованием ран. При ушибе всегда происходит разрыв мелких сосудов с последующим кровоизлиянием, степень выраженности которого может быть различной. Повреждения мягких тканей, вне зависимости от причины, их вызвавших, составляют основное число обращений в учреждения первичного звена здравоохранения. Ушибы возникают, как правило, при падении или ударах о твердые предметы. У детей первых лет жизни преобладают бытовые, игровые травмы, ушиб мягких тканей лица и шеи. В более старшем возрасте основными видами травм являются транспортные, спортивные, уличные травмы [1]. Повреждение поверхностных мягких тканей всегда сопровождается отеком места повреждения в результате пропитывания кожи лимфой, кровью и местным асептическим воспалением. Величина отека зависит от площади повреждения подкожной клетчатки в месте ушиба. Так, например, в области свода черепа ввиду тонкого слоя подкожно-жировой клетчатки отек незначительный, тогда как даже слабые ушибы лица сопровождаются развитием выраженного отека [2]. Продолжающееся в глубине тканей кровотечение нередко приводит к дополнительной травме соседних тканей в результате их сдавливания, что сопровождается постепенным усилением боли и нарушением функции. Ушиб иногда сопутствует другим повреждениям (перелому и др.), поэтому всегда следует исключать более сложные повреждения и оценивать последствия травм [2, 3].
Травмы мягких тканей сопровождаются болью различной интенсивности. Так, при ушибах крупных нервов и их окончаний боль всегда резкая, простреливающая. При ушибах туловища и конечностей (плечо, бедро) могут формироваться напряженные гематомы, с распирающими болями, иногда с поверхностным онемением.
Лечение ушибов мягких тканей традиционно направлено на устранение вышеперечисленных симптомов и исключение более тяжелой патологии [4]. В настоящее время существуют стандарты лечения — клинические рекомендации по оказанию скорой медицинской помощи при повреждениях мягких тканей, где особое место отводится вопросам иммобилизации, туалету раны и обезболиванию [5]. Введение опиоидных и неопиоидных анальгетиков рекомендовано проводить в сочетании с антигистаминными препаратами (метамизолом натрия, тримеперидином, дифенгидрамином). Необходимо как можно раньше выполнить иммобилизацию. Даже при легких повреждениях лучше наложить на ушибленное место тугую повязку или выполнить иммобилизацию ортезом. Это обеспечит покой ушибленного сегмента, нормализует микроциркуляцию, уменьшит двигательную активность. Некоторые ортезные изделия обладают эффектом микромассажа, что тоже благотворно влияет на репаративные процессы. Вместе с этим проводится анальгезирующая терапия. Эти мероприятия необходимо выполнять в течение первых 3 сут. Затем возможно применение согревающих процедур, физиотерапевтических мероприятий. Местную терапию мазями и гелями возможно применять с 1-х суток, если они не обладают согревающим эффектом и не увеличивают проницаемость сосудов.
Ушиб мягких тканей, а соответственно, и боль неотъемлемо связаны между собой. Боль — это своеобразное психофизиологическое состояние человека, возникающее в результате воздействия сверхсильных или разрушительных раздражителей и вызывающих функциональные или органические нарушения в организме. Причем боль носит субъективный характер, ее восприятие основано на личном опыте, связанном с повреждением в раннем периоде жизни. Ее перцепция определяется не только источником боли, но и такими, на первый взгляд, неочевидными факторами, как психофизическая и эмоциональная характеристика индивидуума, его культурный уровень, семейное обучение и многие другие. Наиболее часто она характеризуется как психофизическое состояние человека, являющееся характерной реакцией на различные органические и функциональные нарушения, вызванные действием разнообразных раздражителей. Боль одновременно является физическим ощущением и эмоциональной реакцией на него. Эксперт по вопросам боли Марго Мак Кеффри дает свое емкое определение — это «все, что, по словам пациента, ранит его».
Функционирование ноцицептивной системы опосредовано нейрохимическими механизмами, реализуемыми эндогенными пептидами и медиаторами, среди которых гистамин, субстанция Р, кинины, простагландины, лейкотриены, ионы калия и водорода 6. При боли активируются процессы гиперкоагуляции, пероксидного окисления липидов, увеличивается содержание протеолитических ферментов, что вызывает деструкцию тканей. Боль способствует развитию тканевой гипоксии, дистрофических процессов и нарушению микроциркуляции в тканях. Это, в свою очередь, усиливает альтерацию травмированных тканей [7].
Таким образом, боль является сложным психофизиологическим феноменом, который как с этической стороны, так и с позиции нормативно-правового регулирования требует лечения, направленного на облегчение боли [8]. Понимание сложности ее природы, механизмов развития и регулирования позволяет дифференцированно подходить к вопросу выбора анальгетической терапии.
К одним из наиболее эффективных средств защиты периферических ноцицепторов, не вызывающих депрессию витальных функций, относят нестероидные противовоспалительные препараты (НПВП). Современная концепция эффективного обезболивания ушибов и других видов травм предполагает мультимодальный подход — воздействие на различные звенья проведения болевой импульсации. В связи с этим целесообразно сочетать введение НПВП с опиатами или опиоидами при сильном болевом синдроме, например при шокогенных травматических повреждениях.
Нестероидные противовоспалительные препараты являются препаратами выбора при лечении легкой и умеренной боли. В основе их противовоспалительного действия лежит ингибирование циклооксигеназы (ЦОГ). Одним из представителей НПВП является кетопрофен, выпускаемый в различных формах (таблетированной, инъекционной, наружной). Тройной эффект — противовоспалительный, анальгезирующий и жаропонижающий — обусловлен блокированием ферментов ЦОГ-1 и ЦОГ-2 и, частично, липоксигеназы, что приводит к подавлению синтеза простагландинов (в т. ч. в ЦНС, вероятнее всего, в гипоталамусе) и тромбоксанов. Кетопрофен стабилизирует in vitro и in vivo липосомальные мембраны, при высоких концентрациях in vitro подавляет синтез брадикинина и лейкотриенов. Не оказывает отрицательного влияния на состояние суставного хряща [9].
С точки зрения соотношения противовоспалительной и анальгетической активности кетопрофен представляется оптимальной молекулой. Так, согласно данным экспериментального исследования с использованием модели зубной боли, кетопрофен обладает наиболее выраженным противовоспалительным эффектом по сравнению с многими НПВП, при этом показатель клинической эффективности (суммарное снижение боли через 4 ч) наибольший для кетопрофена [10]. Важно отметить, что эти экспериментальные данные были подтверждены данными метаанализа 13 РКИ: в отношении купирования умеренной и тяжелой боли кетопрофен существенно превосходит диклофенак и ибупрофен [11].
Несмотря на то, что кетопрофен является «традиционным» неселективным НПВП, он в меньшей степени способен вызывать НПВП-ассоциированные осложнения со стороны желудочно-кишечного тракта и сердечно-сосудистой системы — данные финского популяционного исследования по оценке причин развития 9191 события в верхних отделах ЖКТ (в т. ч. случаи крово-течения, язв и перфорации). Согласно полученным результатам вероятность развития серьезных осложнений со стороны ЖКТ при использовании кетопрофена была ниже в сравнении с другими НПВП, например диклофенаком. Кетопрофен демонстрировал аналогичный или даже меньший риск развития патологии ЖКТ, чем ряд селективных НПВП 10. Минимальное негативное влияние кетопрофена на состояние сердечно-сосудистой системы продемонстрировано в ряде масштабных эпидемиологических исследований.
В исследовании анальгетического эффекта кетопрофена в острый период травмы у пострадавших с различными скелетными повреждениями было отмечено начало обезболивающего эффекта уже через 12,2±2,6 мин после внутримышечного применения 100 мг кетопрофена. Применение 200 мг позволило сократить ожидание развития анальгезии до 8,2±2,2 мин. При этом у больных с тяжелой скелетно-мышечной травмой кетонал применялся в дозе 200 мг в комбинации с внутривенным введением трамадола (100 мг), при этом обезболивающий эффект реализовывался через 5,8±0,9 мин, что было быстрее по сравнению с монотерапией трамадолом в той же дозировке (6,0±1,2 мин) [12].
Цель исследования: определить эффективность анальгетической терапии при ушибах верхних и нижних конечностей.
Материал и методы
Проведено пилотное проспективное сравнительное исследование, в которое включено 54 пациента с ушибом мягких тканей плеча (n=27) и бедра (n=27). Ушибы у всех пациентов характеризовались образованием подкожного или внутрикожного кровоизлияния, отеком мягких тканей без повреждения мышц. Критерии включения: возраст 25-50 лет, компенсированная коморбидная патология. Критерии невключения: декомпенсированная или требующая постоянной медикаментозной поддержки сопутствующая патология; тяжелые повреждения мягких тканей; давность повреждения более 1 сут; самостоятельный прием анальгезирующих и других медикаментозных средств с целью обезболивания до первичного посещения. Все пациенты подписывали информированное согласие на участие в исследовании.
При первичном осмотре всем больным выполнено УЗИ места повреждения для исключения более тяжелой патологии. Оценку отека мягких тканей определяли на каждом посещении по объему окружности поврежденного сегмента конечности, измеряя в верхней, средней и нижней трети, и сравнивали с неповрежденной конечностью. Восстановление функции оценивали по возможности выполнения пациентом сгибания в локтевом и плечевом суставе и приседания не менее 10 раз, а также удержания груза 2,5 кг более 2 мин в вытянутой руке.
У всех пациентов помимо анальгезирующей терапии в 1-е сутки проводили иммобилизацию тугой повязкой места повреждения и применяли охлаждающие процедуры. При повторном визите (на 2-е сутки и далее ежедневно) оценивали интенсивность боли по ВАШ, выраженность отека. Лечение и наблюдение за пациентами прекращали при достижении стойкого анальгезирующего эффекта (по ВАШ), отсутствии нарастания отека мягких тканей, восстановлении функции конечности.
Результаты и обсуждение
Средний возраст пациентов составил 44,7 года. Соотношение мужчин и женщин было 1:1.
Как видно на рисунке 1, при ушибах верхней конечности кетопрофен в таблетках начинал проявлять свою активность уже на 10-й минуте, при ушибах нижней конечности — несколько позже, на 20-й минуте. Применение инъекционной формы (рис. 2) обеспечивало выраженный обезболивающий эффект уже на 5-й минуте. Как таблетированная, так и инъекционная форма кетопрофена продемонстрировали преимущество перед диклофенаком. К 3-4-м суткам во всех случаях удавалось добиться полного купирования боли. Продолжительность анальгезирующего действия препаратов не изучали ввиду большой психоэмоциональной составляющей и малой выборки пациентов. Особенностью оценки болевого синдрома при первичном обращении явилось то, что пациенты с ушибом плеча оценивали боли на 2-3 балла выше, чем пациенты с ушибом бедра (6-8 баллов).
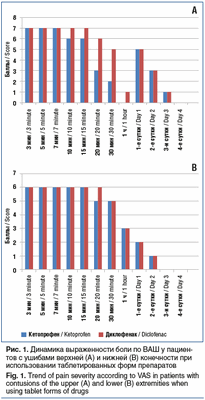
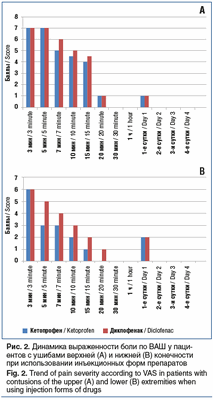
Хотелось бы отметить, что, несмотря на эффективность инъекционной формы препарата, формой выбора для пациентов с повреждением руки, согласно опросу, оставалась таблетированная форма. У пациентов с повреждениями ноги предпочтительной оказалась инъекционная форма. Здесь приходится констатировать парадокс: при более выраженном болевом синдроме при ушибе верхней конечности более эффективная инъекционная форма используется значительно реже, чем у пациентов с повреждением нижней конечности.
Заключение
Таким образом, данное пилотное исследование подтвердило эффективность и быстрое начало анальгетического эффекта кетопрофена в лечении ушибов мягких тканей. Использование препарата позволяет полностью купировать болевой синдром в течение 3 сут. Полученные в рамках небольшой выборки данные дают основания расширить группу наблюдения для увеличения мощности исследования, сформировав клинические группы в зависимости от вида, степени повреждения и локализации травмы.
Сведения об авторах:
Жуков Дмитрий Викторович — к.м.н., доцент кафедры травматологии и ортопедии ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0002-4334-217X.
Устикова Нина Васильевна — врач-ревматолог ФГБУ «ННИТО им. Я.Л. Цивьяна» Минздрава России; 630091, Россия, г. Новосибирcк, ул. Фрунзе, д. 17.
Прохоренко Валерий Михайлович — д.м.н., профессор, заведующий кафедрой травматологии и ортопедии ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ведущий научный сотрудник ФГБУ «ННИТО им. Я.Л. Цивьяна» Минздрава России; 630091, Россия, г. Новосибирcк, ул. Фрунзе, д. 17.
About the authors:
Dmitry V. Zhukov — Cand. of Sci. (Med.), Associate Professor of the Department of Traumatology and Orthopedics, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0002-4334-217X.
Nina V. Ustikova — rheumatologist, Novosibirsk Research Institute of Traumatology and Orthopedics named after Ya.L. Tsivyan; 17, Frunze str., Novosibirsk, 630091, Russian Federation.
Valery M. Prokhorenko — Dr. of Sci. (Med.), Professor, Head of the Department of Traumatology and Orthopedics, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; leading researcher of the Novosibirsk Research Institute of Traumatology and Orthopedics named after Ya.L. Tsivyan; 17, Frunze str., Novosibirsk, 630091, Russian Federation.
НИИ скорой помощи им. Н.В.Склифосовского, Москва
Д ерматомная кожная пластика является основным оперативным пособием при травматических дефектах кожи и мягких тканей (Б.А. Петров 1950; Б.М. Мессина 1970; В.А. Емельянов с соавт. 1976; Л.П. Логинов 1989, 1994 и др.). К настоящему времени техника дерматомной пересадки кожи в основном усилиями специалистов - комбустиологов доведена до совершенства. Возможно, поэтому пострадавшие с травматическими дефектами кожи и мягких тканей довольно часто лечатся в ожоговых стационарах. Имея 35-летний опыт оперативного лечения подобных больных в условиях отделения острых термических поражений НИИ скорой помощи им. Н.В. Склифосовского, мы смогли выявить ряд особенностей дерматомной пересадки кожи.
Свободная пересадка кожи на травматические дефекты была выполнена 136 больным (мужчин - 78, женщин - 58) в возрасте от 15 до 84 лет. Больные доставлялись в отделение из травматологических отделений института или других стационаров г. Москвы. Наиболее часто были поражены нижние (72 больных) и верхние (34 больных) конечности. Бытовая травма имела место у 100 пациентов, производственная - у 36. Площадь травматических дефектов составляла от 10 до 1200 см2. Травматические дефекты кожи и мягких тканей сочетались с открытыми или закрытыми переломами костей у 30 больных. Свободные пересадки кожи у 135 больных выполнялись на гранулирующие раны в сроки от 15 до 70 суток с момента травмы и у одной больной - через 12 часов после травмы.
Подготовка ран к пластическому закрытию осуществлялась частой сменой повязок с различными лекарственными препаратами в зависимости от состояния раневого ложа. Остатки нежизнеспособных тканей удалялись механически, ежедневной сменой повязок с различными ферментами (трипсин, коллагеназа, ируксол и др.). Хорошо зарекомендовали себя трикотажные углеродные повязки «Сорусал» и «Легиус» ООО НПЦ «Увиком», которые активно адсорбировали гнойное отделяемое, способствовали уменьшению интоксикации и тем самым улучшению общего состояния пациентов при обширных дефектах.
Для подавления патогенной микрофлоры выполнялась ежедневная смена повязок с антисептическими растворами (фурацилин, хлоргексидин, йодовидон, повидон-йод, лавасепт, мирамистин и др.). Для этих же целей использовались повязки с 5% диоксидиновой мазью на трикотажной сетчатой основе. Наряду с удобством применения, малой травматичностью при смене повязок у всех больных отмечалось уменьшение гнойного отделяемого с раневой поверхности уже после 2-3 перевязок, снижение уровня бактериальной обсемененности раны, улучшение характера грануляционной ткани. При малой эффективности указанных препаратов и сохраняющейся большой обсемененности гранулирующих ран использовались повязки с антибиотиками.
При избыточных грануляциях, появляющихся в поздние сроки после травмы, для их оздоровления успешно применяли фторокорт или другие препараты, содержащие гидрокортизон. Подобные препараты способствовали уплотнению и оседанию грануляций, сглаживанию грубой зернистости, исчезновению отека. К удалению грануляций прибегаем крайне редко, так как почти всегда удается добиться их хорошего состояния консервативными методами.
Степень готовности раневого ложа к восприятию кожного лоскута оценивалась визуально, противопоказанием для аутодермопластики считали наличие в ране b-гемолитического стрептококка и большую обсемененность ран микрофлорой. У подавляющего числа больных (90%) применяли сплошные кожные аутотрансплантаты; при тяжелом состоянии пациента, вызванном обширным дефектом кожи и сопутствующей патологией сердечно-сосудистой и дыхательной систем, использовали сетчатые трансплантаты.
Большое значение для получения хороших функциональных и косметических результатов лечения имеет правильный выбор толщины срезаемого кожного лоскута. Если для закрытия ран функционально пассивных областей вполне достаточен лоскут толщиной 0,3-0,4 мм, то для закрытия области суставов используем лоскуты толщиной 0,5-0,6 мм, а на опорных и постоянно подвергающихся механическому воздействию поверхностях (стопы, ладонная поверхность кистей, культи бедер и голеней) используем аутотрансплантаты толщиной 0,7-0,8 мм. Сроки заживления донорских ран после срезания лоскутов такой толщины увеличиваются до 3-3,5 недель вместо 1,5-2 недель при срезании более тонких трансплантатов. В связи с большей подверженностью толстого трансплантата инфекции для профилактики нагноения в послеоперационном периоде трансплантаты защищаем наложением повязок с антисептическими растворами или антибиотиками. В этом плане удобна и эффективна повязка с 5% диоксидиновой мазью на сетчатой основе, которая легко снимается на перевязке, не травмируя пересаженный трансплантат.
Косметический и функциональный результат зависит также от сроков проведения аутодермопластики: чем раньше выполнено пластическое закрытие раневого дефекта, тем лучше результат лечения. Проиллюстрировать вышесказанное можно следующими клиническими примерами.
Пример 1: Больная Ш-ва, 52 лет, доставлена НИИ СП им. Н.В. Склифосовского бригадой скорой медицинской помощи. Известно, что больная попала под электропоезд. Диагноз: обширная скальпированная рана правой голени и коленного сустава (9% поверхности тела). Травматический шок. При осмотре выявлено отсутствие кожи циркулярно на протяжении всей голени, на передней поверхности коленного сустава. Дном раны являлись подкожно-жировая клетчатка, мышцы, фасция, надкостница большеберцовой кости. Произведена хирургическая обработка раны и наложена повязка с раствором фурацилина. Проведены противошоковые мероприятия. Через 12 часов произведена дерматомная пересадка кожи. Раны полностью закрыты сплошными трансплантатами. Достигнуто полное приживление кожных лоскутов. Больная провела в институте 74 койко-дня, вернулась к своей прежней работе. Наблюдалась в течение 15 лет. Движения в коленном и голеностопном суставах - практически в полном объеме. Кожные покровы - в хорошем состоянии.
Пример 2: Больная У-ва, 54 лет. Доставлена в НИИ СП им. Н.В. Склифосовского бригадой скорой медицинской помощи с производства, где левой рукой попала в шлифовальный станок. Диагноз: открытый перелом костей левого предплечья. Рваные раны и отслойка кожи левого предплечья, плеча, локтевого сустава. При поступлении выполнена хирургическая обработка ран, остеосинтез костей предплечья. Лечилась в травматологической клинике института. На 40-е сутки с гранулирующими ранами переведена в отделение острых термических поражений. На 52-е сутки с момента травмы выполнена дерматомная пересадка 900 см2 кожи, приживление трансплантатов - 60%. Повторная пересадка кожи произведена на 104-е сутки с момента травмы с полным приживлением аутотрансплантатов. Больная была выписана домой на 165-е сутки с момента травмы с резким ограничением движений в локтевом и лучезапястном суставах, пальцах кисти. В дальнейшем в течение 4 месяцев прошла курс реабилитации в отделении восстановительного лечения института, в результате чего объем движений в конечности несколько увеличился. Тем не менее больная не смогла приступить к своей работе и была переведена на инвалидность.
Анализируя оба клинических примера, мы склоняемся к выводу, что поздние сроки оперативного восстановления утраченного кожного покрова у второй больной явились причиной плохого приживления кожных аутотрансплантатов и резкого нарушения функции верхней конечности. Поэтому считаем, что хирург должен приложить максимум усилий, чтобы подготовить рану к пересадке кожи в максимально короткие сроки.
Среди 146 пересадок кожи полное приживление аутотрансплантатов отмечено после 124 (84,9% ) операций, хорошее и удовлетворительное - после 14 (9,6 %) и полный лизис трансплантатов наблюдался после 8 (5,5%) операций. Наиболее частой причиной расплавления трансплантатов являлось наличие в ране b-гемолитического стрептококка. В отличие от этого полный лизис трансплантатов у обожженных иногда доходил до 10%, то есть почти в два раза превышал подобный показатель при лечении травматических дефектов. Это, на наш взгляд, обусловлено значительно меньшей площадью травматических дефектов в сравнении с ожоговыми ранами, а следовательно, менее выраженной интоксикацией, более сохранными показателями гомеостаза и, как следствие, лучшим состоянием воспринимающего ложа. По этой же причине при лечении травматических дефектов мы отказались от применения гомо- и ксенотрансплантатов, каких-либо искусственных раневых покрытий; в связи с отсутствием у больных с раневыми дефектами дефицита донорских ресурсов сетчатые трансплантаты применяем крайне редко. Кроме того, хорошее состояние грануляций у подавляющего числа больных позволяет получать 100%-ное приживление толстых кожных лоскутов (в 1/2-3/4 толщины кожи).
Таким образом, при травматических дефектах кожи и мягких тканей свободную пересадку кожи следует считать методом выбора, а строгое и последовательное соблюдение принципов оперативного лечения позволяет добиваться хороших функциональных и косметических результатов лечения у большинства пострадавших.
1. Петров Б.А. «Свободная пересадка кожи при больших дефектах».М., Медгиз, 1950.
2. Мессина Б.М. «Первичная кожная пластика при травме мягких тканей лица». М., Медицина, 1970.
3. Емельянов В.А. «Лечение больных с открытыми повреждениями кисти». В кн.: «Открытые тяжелые повреждения кисти». Л., 1976, с.16-17.
4. Логинов Л.П. «Свободная пересадка кожи при травматических дефектах».Труды V Национальной конференции по ожогам и пластической хирургии. София, 1988.
5. Логинов Л.П. «Особенности свободной пересадки кожи при травматических дефектах». Мат. конференции «Пластическая хирургия при ожогах и ранах». М., 1994, с.49-51.
Читайте также:
