Реконструкция пищеварительного тракта после панкреатодуоденальной резекции.
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Изобретение относится к медицине, хирургии. Может быть использовано при выполнении панкреатодуоденальной резекции. Формируют изолированную и основную петли петлями кишки. Накладывают гепатикоэнтероанастомоз. Накладывают гастроэнтероанастомоз. Дополнительно формируют вторую изолированную петлю тощей кишки. Панкреатоэнтероанастомоз и гепатикоэнтероанастомоз накладывают разобщенно с изолированными петлями. Мешкишечный анастомоз формируют клапанным изоперистальтическим между двумя изолированными и основными петлями. Способ позволит проводить профилактику панкреатита, холангита. 2 ил.
Формула изобретения
Способ реконструкции желудочно-кишечного тракта после выполнения панкреатодуоденальной резекции, включающий формирование изолированной и основной петель тощей кишки, наложение панкреатоэнтеро- и гепатикоэнтероанастомозов с изолированной и гастроэнтероанастомоза с основной кишечными петлями с последующим наложением межкишечного анастомоза, отличающийся тем, что дополнительно формируют вторую изолированную петлю тощей кишки, панкреатоэнтеро- и гепатикоэнтероанастомозы накладывают с изолированными петлями разобщено, а межкишечный анастомоз формируют клапанным изоперистальтическим между двумя изолированными и основной петлями.
Описание изобретения к патенту
Изобретение относится к медицине, а именно к хирургии и онкологии.
После выполнения панкреатодуоденальной резекции (ПДР) необходимо восстановить проходимость желудочно-кишечного тракта (ЖКТ) с включением в процесс пищеварения культи поджелудочной железы и гепатикуса. Известны способы реконструкции ЖКТ после ПДР путем наложения панкреато-, гепатико- и гастроэнтероанастомозов на одной или двух кишечных петлях [1].
Недостатком известных способов является развивающаяся в 15-30% случаев несостоятельность панкреатоэнтероанастомоза [2, 3], ведущая к очень тяжелым и зачастую смертельным осложнениям. Известные способы не разобщают панкреатоэнтероанастомоз от других, поэтому в случае его несостоятельности через дефект анастомозируемой кишки в брюшную полость начинают изливаться панкреатический сок и желчь - при наложении анастомозов на двух кишечных петлях, а также желудочный сок - при наложении панкреато-, гепатико- и гастроэнтероанастомоза на одной кишечной петле. Несостоятельность панкреатоэнтероанастомоза может приводить к развитию перитонита, кишечных свищей, аррозивных кровотечений.
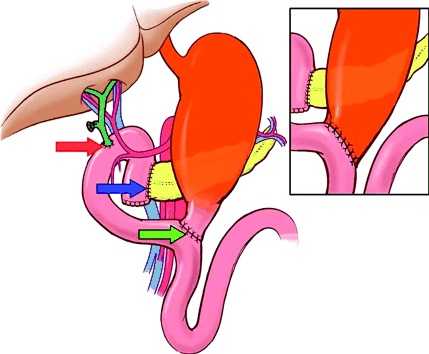
Известен способ реконструкции ЖКТ после выполнения ПДР по Шалимову [1960] (4). После удаления панкреатодуоденального комплекса, в который не включают желчный пузырь, формируют изолированную петлю тощей кишки (длиной не менее 1 м - с целью профилактики рефлюкса кишечного содержимого в желчный и панкреатический протоки), с которой последовательно анастомозируют культю поджелудочной железы и культю холедоха. С другой - основной - петлей тонкой кишки накладывают гастроэнтероанастомоз. Затем изолированную петлю кишки анастомозируют с основной (фиг. 1).
Недостатком известного, принятого за прототип способа является развитие тяжелых послеоперационных осложнений, вызванных несостоятельностью панкреато- и гепатикоэнтероанастомозов, которые могут привести к смерти больного. При несостоятельности указанных анастомозов в брюшную полость изливаются панкреатический, кишечный сок и желчь. В результате их перемешивания активируются ферменты поджелудочной железы (5). Активированные ферменты разрушают серозные оболочки предлежащих органов, что приводит к образованию кишечных свищей, возникновению аррозивного кровотечения. Потери пищеварительных соков могут быть довольно значительными. Консервативно и оперативно вылечить подобное осложнение очень трудно. Релапаротомия не может устранить опасные последствия указанного осложнения. Реконструкция ЖКТ в соответствии с известным способом не исключает рефлюкса кишечного содержимого в главный панкреатический и общий желчный протоки, что приводит к развитию панкреатита и холангита, повышает опасность несостоятельности анастомозов. Наложение панкреатоэнтеро- и холедохоэнтероанастомозов последовательно с изолированной кишечной петлей вызывает излишний расход - до 1 м длиной - и деформацию - перегибы - кишечной петли, т.к. почти вся она располагается в подпеченочном пространстве, что может нарушить пассаж кишечного отделяемого, способствовать развитию несостоятельности анастомозов.
С целью снижения летальности за счет уменьшения тяжести послеоперационных осложнений, вызванных несостоятельностью панкреато- и гепатикоэнтероанастомозов, предлагается способ реконструкции ЖКТ после ПДР, включающий формирование изолированной и основной петель тощей кишки, наложение панкреато- и гепатикоэнтероанастомозов с изолированной петлей, гастроэнтероанастомоза с основной петлей тощей кишки с последующим формированием межкишечного анастомоза, в котором, согласно изобретению, дополнительно формируют вторую изолированную петлю тощей кишки, панкреато- и гепатикоэнтероанастомозы накладывают разобщенно, каждый с одной изолированной кишечной петлей, а межкишечный анастомоз формируют клапанным между изолированными и основной петлями (один клапанный изоперистальтический анастомоз на трех кишечных петлях).
Сравнительный анализ показал, что признаками, отличающими заявляемый способ от способа-прототипа, являются:
- формирование двух изолированных петель тощей кишки (в способе-прототипе - одна петля);
- формирование разобщенных панкреато- и гепатикоэнтероанастомозов: каждого с одной изолированной кишечной петлей (в способе-прототипе эти анастомозы формируют последовательно с одной изолированной петлей);
- формирование межкишечного анастомоза клапанным изоперистальтическим между двумя изолированными и основной петлей, т.е. на трех петлях.
Т. о. в заявляемом способе все три анастомоза - панкреато-, гепатико- и гастроэнтероанастомоз разобщены между собой. В результате этого при несостоятельности панкреатоэнтероанастомоза или гепатикоэнтероанастомоза в брюшную полость изливается только панкреатический сок или только желчь с незначительным количеством кишечного сока. Переваривающая способность их мала, т. к. не происходит активации ферментов поджелудочной железы. Благодаря этому снижается тяжесть последствий возникшего осложнения. Потери пищеварительных соков из брюшной полости невелики. Осложнения удается вылечить консервативными мероприятиями.
Использование изолированных петель и межкишечного анастомоза на трех петлях - "тройник" - способствует тому, что панкреатический сок и желчь смешиваются только в момент поступления в кишечную трубку, заполненную пищей. При использовании прототипа эти секреты смешиваются в кишке, не содержащей пищу, что может привести к образованию острых язв кишки.
Формирование межкишечного анастомоза клапанным изоперистальтическим исключает рефлюкс кишечного содержимого в главный панкреатический проток и гепатикус, являясь профилактикой панкреатита и холангита, снижает опасность несостоятельности анастомозов (в способе-прототипе межкишечный анастомоз формируют по типу "конец в бок", зияющим, что не исключает рефлюкс).
Использование двух изолированных кишечных петель позволяет экономично расходовать тонкую кишку (2 петли длиной 25-30 см, в способе-прототипе - 1 петля кишки до 1 м длиной) и не создает грубой ее деформации как в способе-прототипе, поскольку исключает перегиб. Тем самым исключается нарушение пассажа кишечного содержимого, которое может привести к несостоятельности панкреато- и гепатикоэнтероанатомозов.
Т. о. каждый из отличительных признаков заявляемого способа необходим, а все в совокупности с другими существенными признаками достаточны для уменьшения тяжести послеоперационных осложнений и, следовательно, снижения летальности, т.е. являются существенными.
Анализ общедоступной научно-медицинской литературы и патентной документации показал, что способ неизвестен из уровня техники, т.е. отвечает требованиям новизны.
Автором впервые предложено формировать панкреато-, гепатико- и гастроэнтероанастомозы на трех разобщенных кишечных петлях с последующим наложением на них одного межкишечного анастомоза. При этом уменьшается тяжесть послеоперационных осложнений и, в конечном счете, снижается летальность. Изобретение, не следуя явным образом из уровня техники, обладает изобретательским уровнем.
Предлагаемый способ осуществляется следующим образом.
После удаления панкреатодуоденального комплекса, в который входит и желчный пузырь, формируют две изолированные петли начального отдела тощей кишки по 25-30 см длиной и основную петлю.
Изолированные петли тощей кишки проводят подободочно через окно мезоколон и анастомозируют одну петлю с культей поджелудочной железы (изолированно вшивают главный панкреатический проток в кишку), а вторую с гепатикусом узловыми двухрядными швами с использованием атравматического пролена и дренажей Фелкера. Кишечные петли, несущие панкреато- и гепатикоэнтероанастомозы, фиксируют в окне мезоколон. С основной петлей кишки формируют задний, нижний, подободочной клапанный гастроэнтероанастомоз Витебского. Культю желудка фиксируют в другом окне мезоколон.
Формируют клапанный межкишечный анастомоз. Две изолированные петли кишки после выхода их из окна мезоколон сшивают продольно вблизи дистальных культей по брыжеечному краю на 3-4 см серо-серозными швами. На образованную "двухстволку" сверху изоперистальтически укладывают отводящую петлю гастроэнтероанастомоза и поперечно подшивают рядом серо-серозных швов. Поперечно вскрывают все три анастомозируемые кишечные петли: на 1/2 поперечника верхнюю, отводящую петлю гастроэнтероанастомоза, на 1/4 поперечника - нижние изолированные петли кишки. Последние разрезы сшивают медиальными углами. Затем сквозными узловыми швами соединяют края всех трех отверстий в стенке кишечных петель. Второй ряд швов - узловые серо-серозные. Анастомозируемые петли кишки фиксируют серо-серозными швами выше и ниже анастомоза - шпоры (фиг. 2).
Больная А. , 68 лет. Диагноз: рак большого сосочка двенадцатиперстной кишки III ст. , механическая желтуха. Оперирована - панкреатодуоденальная резекция с реконструкцией желудочно-кишечного тракта по предлагаемому способу.
В послеоперационном периоде развилась несостоятельность панкреато- и гепатикоэнтероанастомозов. Отделяемого по дренажам из брюшной полости было немного. Остаточной полости не сформировалось. Больная выздоровела, выписана домой. Наблюдается 1 год, состояние - удовлетворительное. Успешный исход такого тяжелого осложнения как несостоятельность панкреато- и билиодигестивного анастомозов можно объяснить преимуществом предлагаемого способа реконструкции.
Операций по предлагаемому способу выполнено 13. Умерла одна больная, у которой была выполнена паллиативная ПДР (оставление части опухоли головки поджелудочной железы на крючковидном отростке) через 1,5 месяца после операции от кахексии. Остальные 12 человек выздоровели. Т.о. в результате проведения реконструкции ЖКТ после выполнения ПДР в соответствии с предлагаемым способом послеоперационная летальность составила 8,3 8,0%, в то время как после выполнения реконструкции по традиционному способу послеоперационная летальность составляет 20,1 2,7%. Т.о. предлагаемый способ обеспечивает уменьшение тяжести осложнений и снижение летальности.
Источники информации
1. Блохин Н.Н., Итин А.Б. Клименков А.А. Рак поджелудочной железы и внепеченочных желчных путей. - М.: Медицина, 1982. - 270 с. (прототип С. 146).
2. Никоненко А.С., Прокопенко И.Е., Клименко В.Н., Головко Н.Г. Хирургическое лечение рака поджелудочной железы // Актуальные вопросы хирургии поджелудочной железы: Тез. научн. конф. Киев, 1988. - С. 125.
3. Штофин С.Г., Веронский Г.В., Попов А.И. Вопросы хирургической тактики при панкреатодуоденальной резекции // Заболевания поджелудочной железы: Тез. науч. конф. Новосибирск, 1992. - С. 165-166.
4. Шалимов А.А., Радзиховский А.Н., Полупаев В.Н. Атлас операций на печени, желчных путях, поджелудочной железе и кишечнике. - М.: Медицина, 1979. - 368 с. (прототип С. 196),
5. Ковальчук В.И. Острый панкреатит и его осложнения: Лекции по частной хирургии. - Санкт-Петербург, 1992. - 63 с.
Сравнительный анализ способов реконструкции пищеварительной трубки после гастропанкреатодуоденальной резекции
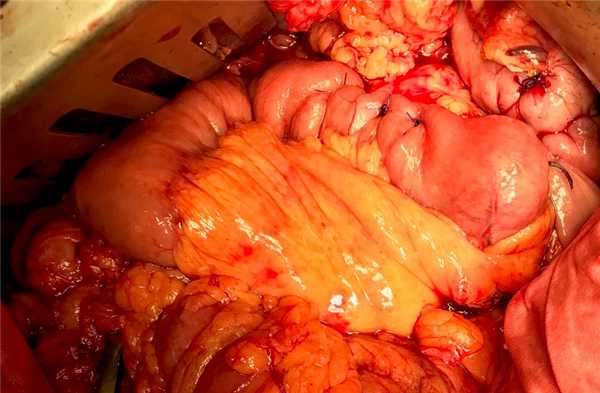
В настоящее время гастропанкреатодуоденальная резекция (ГПДР) остается основным хирургическим вмешательством, выполняемым при опухолях билиопанкреатодуоденальной зоны, а также вмешательством, остающимся в хирургическом арсенале для лечения пациентов с хроническим панкреатитом. При этом если отдаленные результаты ГПДР при злокачественных новообразованиях зависят преимущественно от локализации и первичной распространенности онкопроцесса, то непосредственные результаты операции определяются способом реконструкции пищеварительной трубки и техникой формирования анастомозов. На сегодняшний день при десятках известных способах реконструкции после ГПДР частота ранних послеоперационных осложнений и неудовлетворительных отдаленных функциональных результатов остается стабильно высокой, что свидетельствует об актуальности поиска оптимального варианта реконструкции.
В ближайшем послеоперационном периоде несостоятельность ПЭА имела место у 13 (17,8%) пациентов: у 4 (5,5%) пациентов с развитием перитонита, у 5 (6,8%) пациентов с развитием парапанкреатического абсцесса, у 4 (5,5%) пациентов с первичным формированием панкреатического свища. У 12 пациентов несостоятельность возникла после формирования двухрядного ПЭА, у 1 - инвагинационного ПЭА по J. Cameron. При этом несостоятельность ПЭА возникла у 7 пациентов после 1 варианта реконструкции (63,6% от всех операций по данной методике), у 4 пациентов после 2 варианта (23,5% от всех операций по данной методике), у 2 пациентов после 3 варианта (18,2% от всех операций по данной методике). Случаев несостоятельности ПГА и ПЭА по L. Blumgart установлено не было. У 3 (4,1%) пациентов после формирования ПЭА двухрядными швами развился некроз тела и хвоста поджелудочной железы. Несостоятельность ГТЭА имела место у 3 (4,1%) пациентов (1, 2 и 3 варианты реконструкции), имея во всех случаях отграниченный характер (желчеистечение по дренажу). Релапаротомии были подвергнуты 8 (10,9%) пациентов. Величина интраабдоминальных послеоперационных осложнений составила 26,0%, системных послеоперационных осложнений - 15,1%. Послеоперационная летальность составила 6,8%.
При оценке морфо-функционального состояния пищеварительного тракта в первые 6 месяцев послеоперационного периода наличие проявлений постгастрорезекционного синдрома (ПГРС) было отмечено у 16 (21,9%) пациентов: пептические язвы ГЭА у 5 (6,8%), клинически значимая диспепсия - у 11 (15,1%). ПГРС развился в 6 случаях после 1 варианта реконструкции (54,5%), в 3 случаях после 2 варианта (17,6%), в 2 случаях после 3 варианта (18,2%), в 4 случаях после 4 варианта (21,1%) и в 2 случаях после 5 варианта (18,8%). Клинически манифестированный хронический холангит имел место у 5 (45,5%) пациентов после 1 варианта реконструкции. Корреляции между способом формирования ГЭА и частотой развития ПГРС синдрома установлено не было, однако во всех случаях развития ПГРС после реконструкции по Ру имела место экономная резекция желудка (антрум-резекция, гемигастрэктомия) и длина отводящей от ГЭА петли менее 40 см (по данным рентгенологического исследования).
На основании проведенного анализа считаем возможным заключить следующее. Наименее приемлемыми непосредственными и отдаленными результатами после ГПДР сопровождается реконструкция с формированием ГЭА, ПЭА и ГТЭА на единой петле тонкой кишки. К факторам, не влияющим на непосредственные и отдаленные результаты операции следует отнести: способ формирования ГЭА и межкишечного анастомоза (ручной или аппаратный), формирование отдельных отключенных по Ру петель для ПЭА и ГТЭА. Критичными в плане развитие постгастрорезекционного синдрома и послеоперационной диспепсии являются экономные резекции желудка и длина отводящей от ГЭА петли менее 40 см. Наилучшими непосредственными результатами и отдаленными морфо-функциональными результатами после ГПДР сопровождаются реконструкция с формированием ПГА и ГТЭА на отключенной по Ру петле тонкой кишки либо с формированием ПЭА по L. Blumgart и ГТЭА на единой отключенной по Ру петле тонкой кишки.
Реконструкция пищеварительного тракта после панкреатодуоденальной резекции.
Изучить ближайшие результаты лечения больных после выполнения панкреатодуоденальной резекции (ПДР) в зависимости от варианта включения в пищеварительную систему культи поджелудочной железы (ПЖ).
МАТЕРИАЛ И МЕТОДЫ
В НИИ ККБ №1 им. проф. С.В. Очаповского с января 2013 по декабрь 2019 г. 242 пациентам выполнена ПДР. Комбинированными были 32 операции: 28 (11,6%) с резекцией воротной вены и 8 (3,3%) симультанных (правосторонняя гемиколэктомия — 4, правосторонняя адреналэктомия — 2, гастрэктомия со спленэктомией — 2). Включение культи ПЖ в тощую кишку выполнено 156 (64,5%) пациентам, в желудок — 86 (35,5%).
РЕЗУЛЬТАТЫ
Legi artis послеоперационный период протекал у 180 (74,4%) пациентов, всего зафиксировано 80 послеоперационных осложнений у 62 (25,6%) пациентов. Из стационара выписан 221 (91,3%) пациент, умер 21 (8,7%) пациент. Самой частой причиной возникновения проблем в послеоперационном периоде был панкреонекроз, который спровоцировал развитие 65 (82,5%) различных осложнений: 38 (72,1%) случаев в группе больных с панкреатикоеюноанастомозом (ПЕА) и 20 (71,5%) случаев при панкреатогастроанастомозе (ПГА). При отсутствии различий в частоте развития осложнений в этих группах в группе ПЕА тяжелые панкреатические свищи (ПС) типа C развились у 12 (23,1%) больных, свищи типа B — у 24 (46,1%), в группе пациентов с ПГА ПС типа C обнаружены у 4 (14,3%), типа B — у 8 (28,6%).
ЗАКЛЮЧЕНИЕ
ГБУЗ «Научно-исследовательский институт — Краевая клиническая больница №1 им. проф. С.В. Очаповского» Министерства здравоохранения Краснодарского края
ГБУЗ «Научно-исследовательский институт — Краевая клиническая больница №1 им. проф. С.В. Очаповского» Министерства здравоохранения Краснодарского края;
ФГБОУ ВО «Кубанский государственный медицинский университет» Минздрава России
ГБУЗ «Научно-исследовательский институт — Краевая клиническая больница №1 им. проф. С.В. Очаповского»
ГБУЗ «Научно-исследовательский институт — Краевая клиническая больница №1 им. проф. С.В. Очаповского» Минздрава Краснодарского края;
ФГБОУ ВО «Кубанский государственный медицинской университет» Минздрава России
ГБУЗ «Научно-исследовательский институт — Краевая клиническая больница № 1 им. проф. С.В. Очаповского» Министерства здравоохранения Краснодарского края
Дата принятия в печать:
Введение
Панкреатодуоденальная резекция (ПДР) — одно из наиболее серьезных вмешательств на органах брюшной полости: технически требовательное, длительное с довольно высоким риском послеоперационных осложнений (до 20—40%) и послеоперационной летальности (1—6%) [1—3]. По мнению большинства авторов, развитие неблагоприятного исхода в основном связано с несостоятельностью 1 (или более) из 3 анастомозов, выполняемых при реконструктивном этапе ПДР: поджелудочно-дигестивного, билиодигестивного и желудочно-дигестивного. Наиболее часто наблюдается несостоятельность поджелудочно-дигестивного анастомоза [4, 5]. Возможны и другие послеоперационные осложнения: кровотечение и формирование внутрибрюшного абсцесса [6—10].
При всем многообразии существующие варианты анастомозирования культи поджелудочной железы (ПЖ) можно разделить по способу включения в желудочно-кишечный тракт: панкреатикоеюноанастомоз (ПЕА) по типу duct to mucos и инвагинационный панкреатогастроанастомоз (ПГА). По данным российских и зарубежных авторов, предложено около 158 авторских методик включения ПЖ в систему пищеварения, все они имеют своих сторонников и противников. К преимуществам ПГА различные авторы относят хорошее кровоснабжение и близкое расположение стенки желудка к культе ПЖ, что уменьшает натяжение швов анастомоза и риск развития его несостоятельности [11, 12], а снижение активности панкреатического сока в кислой среде желудка уменьшает риск развития панкреонекроза и аутолиза тканей в зоне анастомоза [13]. Мультицентровое исследование [14] показало меньшую частоту развития панкреатических свищей (ПС) и других осложнений после формирования ПГА по сравнению с ПЕА. В то же время сторонники ПЕА приводят данные, свидетельствующие об отсутствии статистически значимых различий в частоте несостоятельности ПГА и ПЕА [15—17]. Инвагинационный ПГА используют при «мягкой» консистенции либо при «узком» протоке ПЖ.
В литературе продолжают обсуждать преимущества и недостатки различных типов анастомозирования после ПДР, а также поиски новых подходов и техник создания панкреатодигестивного соустья (ПДС).
Цель исследования — изучить ближайшие результаты лечения больных после ПДР в зависимости от варианта включения в пищеварительную систему культи ПЖ.
Материал и методы
В НИИ ККБ №1 им. проф. С.В. Очаповского с января 2013 по декабрь 2019 г. выполнены 242 ПДР по поводу опухолей периампулярной зоны (92,1%) и хронического панкреатита (7,9%).
Преимущественно пациенты поступали в стационар с явлениями механической желтухи (МЖ) (210/86,8%), в связи с этим согласно принятому в клинике дифференцированному подходу выполнено антеградное чрескожное чреспеченочное дренирование желчевыводящих путей (ЖВП). За время, в течение которого происходило снижение уровня гипербилирубинемии, больные были обследованы и подготовлены для проведения радикального хирургического вмешательства.
Критериями включения пациентов в исследование служили клинически либо гистологически установленный диагноз злокачественного новообразования (ЗНО) периампулярной зоны; у пациентов с псевдотуморозным панкреатитом — наличие дилатации главного протока ПЖ, общего желчного протока (ОЖП) и КТ-признаки компрессии воротной вены (ВВ) или ее притоков.
Критерями исключения из исследования являлись наличие по данным предоперационного обследования УЗИ- и/или КТ-признаков острого панкреатита, наличие положительного края по линии резекции ПЖ, в связи с чем проводили ее тотальное удаление, интраоперационное получение данных о наличии отдаленных метастазов опухоли.
Критериями невключения: общий соматический статус по шкале ASA III—V, гипербилирубинемия выше 150 мкмоль/л.
На дооперационном этапе рак верифицирован морфологически у 201 (82,71%) пациента.
При открытых и мини-инвазивных вариантах ПДР выполняла одна команда хирургов в технике no-touch с лимфодиссекцией [18]. В нашем исследовании выбор ПДС зависел от плотности паренхимы поджелудочной железы, а также диаметра главного протока ПЖ. Для выбора ПДС мы использовали критерий прорезывания ткани ПЖ лигатурой с двумя вариантами состояния ее ткани: вариант П (плотная) и вариант М (мягкая) [19]. В случае варианта М железы и «узкого» протока (диаметр менее 4 мм) предпочитали инвагинационный ПГА по Bassi (2006), который формировали непрерывным двухрядным швом с выполнением передней гастротомии [20]. При наличии дилатированного главного протока ПЖ и/или «плотной» железы накладывали двухрядный ПЕА duct to mucosa по методике Cattell в модификации S. Strasberg (2002) [21], ПГА выполняли инвагинационным способом, предложенным Bassi (2005), посредством передней гастротомии [20].
Периоперационное ведение пациентов осуществляли в рамках протоколов ERAS и FAST-TRACK, предполагающих единый подход к предоперационной подготовке, технике оперативного вмешательства, послеоперационного ведения больных и минимальное вмешательство в физиологические процессы [22].
При оценке результатов операций учитывали вариант включения культи ПЖ в желудочно-кишечный тракт, технику формирования соустья, длительность вмешательства, объем интраоперационной кровопотери, возникновение ПС по классификации международной группы экспертов ISGPF, необходимость и количество релапаротомий, длительность послеоперационного периода, госпитальную послеоперационную летальность [23].
Для оценки статистической значимости различий нескольких относительных показателей использовали χ 2 -критерий Пирсона (его полученное значение сравнивали со стандартным [df=2] при 5% уровне значимости). По таблице t-распределения Стьюдента определяли вероятность случайности различий (p). Различие расценивали как достоверное при p≤0,05, т. е. в случаях, когда вероятность различия превышала 95%.
Результаты и обсуждение
Из 242 ПДР 32 операции были комбинированными: в 28 (11,6%) случаях с резекцией воротной вены, в 8 (3,3%) случаях симультанно выполнены (правосторонняя гемиколэктомия — 4, правосторонняя адреналэктомия — 2, гастрэктомия со спленэктомией — 2).
В зависимости от показаний к оперативному лечению и локализации опухоли пациенты (n=262) распределены следующим образом: с ЗНО головки ПЖ — 177 (68,6%) больных, с ЗНО большого сосочка двенадцатиперстной кишки — 37 (14,1%), с ЗНО ОЖП — 29 (11,1%), у 19 (7,3%) пациентов ПДР выполнена по поводу хронического осложненного панкреатита. Распределение пациентов в зависимости от морфологического строения опухоли и ее размера, поражения лимфатических узлов (TNM-классификация) представлено в табл. 1.
Таблица 1. Распространенность и степень дифференцировки удаленных опухолей
Степень дифференцировки опухолевых клеток
Регионарные лимфатические узлы
ПЕА был наложен в 152 (62,8%) случаях, ПГА — в 90 (37,2%).
По данным табл. 2, в способах анастомозирования культи ПЖ статистически значимые различия получены лишь по длительности оперативного вмешательства (p<0,05).
Таблица 2. Особенности операции и течения послеоперационного периода
Длительность операции, мин
Интраоперационная кровопотеря, мл
Время пребывания в стационаре после операции, койко-дни*
Частота использования наркотических анальгетиков
Продолжительность применения наркотических анальгетиков, сут
Количество удаленных лимфатических узлов
Число больных с краем резекции R0
при окончательном исследовании
Количество проведенных повторных вмешательств
Примечание. * — при неосложненном течении послеоперационного периода; ПГА — панкреатогастроанастомоз, ПЕА — панкреатико-еюноанастомоз.
Всего зафиксировано 80 послеоперационных осложнений у 62(25,6%) пациентов, без осложнений послеоперационный период протекал у 180 (74,4%) пациентов; характер развившихся осложнений представлен в табл. 3. Наиболее частым осложнением явился панкреонекроз (очаговый, субтотальный, тотальный) — 58 (24,0%) больных, или 72,3% всех осложнений, и нагноение послеоперационной раны — 8 (3,3%) пациентов, или 10% всех осложнений.
Таблица 3. Распределение послеоперационных осложнений и летальность
Панкреатическая фистула, тип A
Панкреатическая фистула, тип B
Панкреатическая фистула, тип C
Осложнения, не связанные с анастомозом
Примечание. ПОН — полиорганная недостаточность. ОКН/ЧКН — острая/частичная кишечная непроходимость.
Общая летальность составила 8,7% (n=21).
«Уязвимым местом» ПДР является именно ПДС. В большинстве клиник ПЕА выполняют чаще, чем ПГА, приблизительное соотношение 3:1 [24]. Как для ПЕА, так и для ПГА несостоятельность швов анастомоза — наиболее частое послеоперационное осложнение после ПДР. Следует отметить, что и в классификациях, и в англоязычной периодической литературе термин «leakage» соответствует двум понятиям, традиционно принятыми в российской литературе: это и собственно несостоятельность швов анастомоза, и послеоперационный панкреатит (который может развиться, протекать и купироваться без развития несостоятельности швов, но проявляться другими осложнениями).
В большом кокрейновском обзоре, посвященном развитию послеоперационного ПС в зависимости от типа наложенного ПДС, авторы не смогли продемонстрировать преимуществ одной методики над другой [25]. ПЕА не отличается от ПГА в целом по частоте ПС, которые возникли соответственно в 24,3 и 21,4% случаев; увеличение продолжительности госпитализации или необходимость повторного хирургического вмешательства отмечены у 11,6 и 10,3% больных соответственно. Отмечено также, что результаты применения ПЕА мало отличаются от таковых при ПГА по показателям летальности: 3,9% против 4,8%. Риск послеоперационного кровотечения у пациентов в группе ПЕА был несколько ниже, чем у пациентов с ПГА: 9,3% против 13,8%, в то же время в группе с ПЕА чаще наблюдали абсцессы брюшной полости — 14,7%. При ПГА они встретились у 8% оперированных.
F. Chou и соавт.[26] провели сравнение стандартного и инвагинационного методов формирования ПЕА. Результаты их работы показали, что частота развития осложнений, в том числе ПС, а также послеоперационная летальность выше при использовании инвагинационной техники. При этом в большом количестве исследований, в том числе проспективных, не установлено существенных различий в результатах использования ПГА и ПЕА [23, 27—29].
Представленные в табл. 2 и 3 данные свидетельствуют об отсутствии статистически значимых различий между группами пациентов, которым был наложен ПГА и ПЕА по большинству анализируемых показателей для наличия/отсутствия всех осложнений после операции (χ 2 =0,24p>0,05), проблем, связанных с ПДС (χ 2 =0,42p>0,05), осложнений, не связанных с ПДС (χ 2 =0,05p>0,05), для летальности (χ 2 =1,76p>0,05). Сравнение ПГА и ПЕА по частоте возникновений панкреатических фистул разных типов также не показало статистически достоверных различий между ними: χ 2 =0,94p>0,05.
Отдельно мы проанализировали данные о 36 (14,9%) пациентах, которым выполнили комбинированные и симультанные вмешательства. Летальных исходов не было. Среди пациентов, перенесших ПДР с резекцией воротной вены, отмечено 3 послеоперационных осложнения при наложении ПГА: 2 нагноения послеоперационной раны и 1 кровотечение из анастомоза в просвет желудочно-кишечного тракта (ПС, тип B); еще у 1 пациента после ПЕА выявлен очаговый панкреонекроз с формированием внутрибрюшного абсцесса, что потребовало проведения малоинвазивных интервенционных методов лечения. Летальных исходов среди этих пациентов также не было.
Таким образом, радикальные операции при злокачественных опухолях панкреатодуоденальной зоны должны выполняться в профильных отделениях высокопотоковых хирургических центров специалистами с соответствующим опытом. При использовании ПГА на реконструктивном этапе при выполнении ПДР отмечена меньшая частота развития тяжелых ПС (тип C), несмотря на то что в данной группе при оценке культи ПЖ отмечаются неблагоприятные показатели плотности паренхимы и малый диаметр главного протока ПЖ. На наш взгляд, более широкое применение способа включения культи ПЖ в желудок, в том числе при использовании малоинвазивных способов выполнения ПДР, позволит снизить частоту развития осложнений и летальность, а также использовать все преимущества минимального доступа. Дифференцированный подход к выбору ПДС, определяемый состоянием паренхимы ПЖ и диаметром панкреатического протока, а также опытный хирург в условиях оснащенного высокопотокового хирургического центра — залог успешного результата хирургического лечения при ПДР.
Гастропанкреатодуоденальная резекция (Kausch-Wipple procedure)
Гастропанкреатодуоденальная резекция (ГПДР), синоним - операция Уиппла (Whipple’s procedure) включает одномоментное удаление головки поджелудочной железы, дистальной части желудка, двенадцатиперстной кишки, начального отдела тощей кишки, части желчных протоков, желчного пузыря и регионарных лимфатических узлов.
Показанием к проведению ГПДР являются: верифицированное опухолевое поражение головки поджелудочной железы, терминального отдела холедоха, большого дуоденального сосочка и двенадцатиперстной кишки, а также невозможность исключения злокачественного процесса указанной локализации. Кроме этого ГПДР в ряде случаев показана пациентам, страдающим хроническим панкреатитом.
Операция ГПДР, являясь единственным средством избавления пациента от опухоли панкреатодуоденальной зоны, является, тем не менее, весьма травматичным вмешательством. Необходимость формирования нескольких анастомозов обусловливает вероятность развития в послеоперационном периоде их несостоятельности с формированием свищей и развитием других достаточно тяжелых осложнений. Впервые ГПДР была проведена в Европе немецким хирургом Walter Kausch в 1909 году, в США - хирургом Allen Whipple в 1932 году. Результаты гастропанкреатодуоденальной резекции на протяжении десятилетий были весьма неутешительны: ГПДР сопровождалась большим количеством осложнений и достаточно высокой летальностью. Однако в настоящее время, благодоря отработанной технике этой операции, современной оснащенности операционной, профессиональной подготовке врачей анестезиологов-реаниматологов, ГПДР сопровождается минимальным количеством осложнений и послеоперационной летальности, хорошими отдаленными результатами выживаемости и качества жизни.

M.Evseev, A.Vladykin, I.Klyshin. Multivisceral resection for locally advanced colorectal cancer. Case report. Одним из направлений научных исследований.

В историческом обзоре приводятся в хронологической последовательности этапы рождения и эволюции панкреатодуоденальной резекции. Описаны первые опыты проведения.
Гастропанкреатодуоденальная резекция
Гастропанкреатодуоденальная резекция (ГПДР) представляет собой операцию, суть которой состоит в одновременном удалении целого органокомплекса: головки поджелудочной железы, нижнего отдела желудка, двенадцатиперстной кишки, входящего отдела тонкой кишки, желчного пузыря, частично — желчных протоков и расположенных в данном сегменте лимфатических узлов. Целью операции чаще всего является (лечение) злокачественного процесса данной локализации.
ГПДР — сложное хирургическое вмешательство, результаты которого долгие годы были малоутешительными. В настоящее время техника операции тщательно отработана, что, наряду с современным оснащением и высокой профессиональной подготовкой хирургов, позволяет значительно снизить возможные осложнения и получать хорошие результаты выживаемости и качества жизни пациента в отдаленной перспективе.
Преимущества операции ГПДР в Центре хирургии «СМ-Клиника»
Высококвалифицированные специалисты с большим опытом клинической практики в данной области хирургии, применение европейских методик.
Комфортные условия, возможности проведения полного комплекса послеоперационной восстановительной терапии.
Показания к операции
В большинстве случаев ГПДР назначается при раковых опухолях головки поджелудочной железы, двенадцатиперстной кишки, желчных протоков, если она дает возможность полностью исключить злокачественный процесс данной локализации. Показанием к гастропанкреатодуоденальной резекции может быть и хронический панкреатит. В каждом индивидуальном случае целесообразность данного хирургического вмешательства определяет опытный врач нашей клиники, исходя из клинической картины и других данных каждого пациента.
Подготовка к операции ГПДР
Операция выполняется в плановом порядке и требует тщательной подготовки и точной диагностики. Больной проходит полное стандартное обследование, включающее в себя комплекс лабораторных анализов, компьютерную томографию и УЗИ органов брюшной полости и грудной клетки, исследование на онкомаркеры, консультацию онколога, хирурга, кардиолога, стоматолога, терапевта и, в случае других хронических заболеваний, иных узких специалистов.
Мы предлагаем пройти все обследование в нашем центре, где оно займет 1-2 дня.
Больной госпитализируется в клинику накануне операции.
Техника проведения операции
Для обезболивания применяется общий эндотрахеальный наркоз под контролем опытного врача-анестезиолога нашей клиники.
Операция выполняется в два основных этапа:
- 1 этап: удаление затронутых патологией части поджелудочной железы и прилегающих органов.
- 2 этап: реконструкция соединений здоровых органов или их фрагментов для жизнеобеспечения организма.
Последовательность выполнения 1 этапа:
При мобилизации органокомплекса наши хирурги используют самые современные технологии лапароскопической (через проколы) или «без касания» (no-touch) мобилизации. Последняя технология позволяет значительно повысить радикальность операции.
Сформированный таким образом органокомплекс удаляется одновременно, после чего оперирующий хирург переходит ко второму этапу.
Последовательность выполнения 2 этапа:
Для восстановления жизнеспособности организма необходимо сформировать четыре соединения (анастомоза):
- Между культей поджелудочной железы и тонкой кишкой (в некоторых случаях — с задней стенкой желудка).
- Между тонкой кишкой и сохраненными желчевыводящими путями.
- Между тонкой кишкой и культей желудка.
- Восстановление проходимости (анастомоз) тонкой кишки.
После реконструкции ЖКТ врач ушивает операционную рану, ставит дренаж, и больной переводится в палату интенсивной терапии.
Средняя продолжительность операции — 4-6 часов.
Воспользуйтесь уникальной возможностью и получите бесплатную консультацию по поводу плановой операции. Подробнее.

Реабилитация после панкреатодуоденальной резекции
После операции ГПДР пациент проводит в стационаре нашей клиники 6-7 дней, на протяжении которых за его состоянием круглосуточно наблюдают врачи. Происходящая в организме реконструкция с перераспределением функций органов и необходимость формирования нескольких анастомозов усложняет послеоперационный период и требует восстановительной терапии. Медицинский персонал нашей клиники делает для этого все возможное и обеспечивает надлежащий уход и наблюдение, в любую минуту готов оказать качественную своевременную помощь. На всем послеоперационном этапе, включая отдаленный период, требуется диспансерное наблюдение, строгое соблюдение диеты, отказ от вредных привычек и исключение физических нагрузок.
Тяжесть операционной травмы и высокие риски появления послеоперационных осложнений значительно сокращаются наличием большого профессионального опыта врачей Центра хирургии «СМ-Клиника».
Получить ответы на интересующие вопросы можно, позвонив на наш номер или заказав обратный звонок.
Читайте также:
