Роль цитокинов, ультрафиолета в повреждении кожи и эпидермальной гиперплазии.
Добавил пользователь Алексей Ф. Обновлено: 01.02.2026
Фотодерматозы — разнообразная группа кожных болезней, отличающихся по клинической картине, тяжести течения и прогнозу, в патогенезе которых важная роль принадлежит солнечному излучению.
Солнечный свет состоит из волн разной длины: ультрафиолетовое (УФ) излучение, инфракрасное и видимое излучение (рис. 1).
Самое серьезное из них в плане повреждения кожи — это УФ-излучение. Его делят на УФА (320-380 нм), УФВ (280-320 нм) и УФС (200-280 нм). Наиболее опасно УФС, но оно в основном поглощается озоновым слоем стратосферы и не достигает земной поверхности (рис. 2).
Высокие дозы УФ-радиации вызывают различные биологические реакции в человеческом организме. Единица измерения УФ-облучения — биодоза (минимальная эритемная доза) — это минимальная продолжительность облучения, при которой возникает четко очерченное покраснение кожи. Биодозу выражают в минутах или в количестве энергии на единицу площади мДж/см 2 (для УФВ) или Дж/см 2 (для УФА). Воздействие УФА-лучей наиболее глубокое. Они проникают в дерму и соединительную ткань и при длительном воздействии вызывают дистрофические изменения соединительной ткани, ускоряют процесс старения кожи (фотостарение, геродермия), могут способствовать развитию меланомы, вызывать повреждения ДНК и мутации в клетках кожи.
УФВ-излучение поглощается преимущественно клетками верхних слоев эпидермиса, вызывает загар и солнечные ожоги. В малых дозах УФВ-лучи индуцируют синтез витамина Д; посредством секреции эндотелиального фактора роста (endothelial growth factor — EGF) УФВ-излучение способствует развитию опухолей кожи, в том числе и меланомы. Доказано также иммуносупрессивное действие УФВ-излучения, что приводит к снижению иммунитета в отношении инфекционных и паразитарных заболеваний, подавлению отторжения опухолевых клеток и возникновению рака кожи.
Чувствительность кожи к воздействию УФ-лучей зависит от индивидуальных особенностей человека и цвета его кожи, в связи с чем выделяют несколько фототипов (светочувствительность) кожи (табл. 1).
Ввиду многообразия эндогенных и экзогенных факторов, способствующих этой патологии, единой классификации до настоящего времени нет.
Существует классификация по клинической характеристике патологического процесса (Штейнберг М. А., 1958; Нерадов Л. А., 1959); по патогенезу: генетические, метаболические, дегенеративно-атрофические и прочие фотодерматозы (Parrish J. A. et al., 1979); по фоточувствительности кожи и характеру обычной реакции на облучение; часто используют классификацию поражений кожи по длине волны света, вызвавшего поражения:
а) изменения, вызванные чрезмерной по интенсивности или длительности инсоляцией:
- солнечные ожоги;
- острые актинические дерматиты; или повторяющимся облучением:
- фотостарение кожи;
- солнечный эластоз;
- предопухолевые и опухолевые поражения кожи;
б) фотодерматозы, вызванные дефицитом естественных кожных протекторов (пигментная ксеродерма, альбинизм);
в) дерматозы, усиливающиеся или проявляющиеся после инсоляции (красная волчанка, дерматомиозит, болезнь Дарье, хлоазма);
г) дерматозы, обусловленные присутствием в коже веществ, способных усилить солнечные эффекты, или заставляющие реагировать иммунную систему кожи после фотоактивации.
Солнечные лучи в организме человека могут вызывать различные типы патологических реакций: фототравматические, фототоксические, фотоаллергические и идиопатические (причины которых неизвестны).
Фототравматические реакции возникают при избыточном по интенсивности или по времени облучения кожи или при дефиците естественных факторов защиты. По времени возникновения такие реакции могут быть острые и хронические.
К острой фототравматической реакции относится солнечный ожог, протекающий по типу острого воспаления кожи. Он развивается в короткое время при гиперинсоляции у лиц с повышенной фоточувствительностью (I-II фототип) на участках кожи, подвергшихся облучению. Солнечный ожог проявляется эритемой, зудом, а в тяжелых случаях — отеком, везикулами, пузырями и болью; сопровождается повышением температуры тела, недомоганием, головной болью. При легкой степени ожога воспалительные явления разрешаются самопроизвольно и переходят в загар. При тяжелых реакциях — через несколько дней наступает интенсивное шелушение кожи, гипер- и гипопигментация. Рубцы обычно не образуются.
Патогенез. Под действием УФВ-лучей происходит нарушение структуры ДНК эпидермальных клеток в результате поглощения энергии УФ-лучей. Медиатором воспаления служат гистамин, серотонин, простагландины, лизосомальные ферменты, кинины.
Прогноз. Тяжелые солнечные ожоги, сопровождающиеся пузырями, могут быть фактором риска развития меланомы. Повторные солнечные ожоги приводят к преждевременному старению кожи (геродермии, актиническому старению).
Лечение и профилактика. Лечение зависит от степени выраженности дерматита. При легкой степени — примочки с 2% раствором борной кислоты, Свинцовой воды, влажные обертывания с настоем лекарственных трав — ромашки, календулы, зеленого чая и др., мази с кортикостероидами.
При тяжелых реакциях — Аскорутин, Аспирин, Индометацин по 1 таблетке 3 раза в день, кортикостероиды 15-20 мг/сут, Делагил, Плаквенил.
Местно — влажные обертывания, кортикостероидные мази. Может потребоваться соблюдение постельного режима и даже госпитализация.
Профилактика — фотозащитные (солнцезащитные) средства — лосьоны, гели, кремы с высоким солнцезащитным индексом (SPF), особенно лицам I и II фототипов.
Актиническое старение кожи (фотостарение, солнечная геродермия) — возникает при многолетнем регулярном воздействии УФ-излучения и обусловлено его кумулятивным эффектом. УФА-излучение, действующее на кожу, повреждает белки, липиды клеточных мембран, нуклеиновые кислоты. Постепенно накапливаясь, эти повреждения вызывают дегенеративные изменения в эпидермисе, коллагеновых и эластических волокнах и межклеточном веществе дермы, в результате чего кожа становится более сухой и грубой, постепенно теряет тонус, появляются морщины, пигментные пятна (солнечное лентиго), телеангиоэктазии, участки кератоза (актинический кератоз).
Гистологически это проявляется гиперкератозом, атрофией эпидермиса, эластозом, увеличением содержания меланина, появлением атипичных меланоцитов, расширением капилляров. Эти признаки проявляются преимущественно на открытых участках кожи.
Патогенез. При поглощении квантов света молекулы переходят в нестабильное состояние, что делает их более реакционно-способными. В результате могут образовываться как вполне устойчивые, так и свободные радикалы и активные формы кислорода. Таким образом, УФ-излучение вызывает прямое повреждение молекул белков и нуклеиновых кислот, а также опосредованное свободными радикалами (рис. 3, рис. 4).
Белки и нуклеиновые кислоты первыми испытывают на себе вредное воздействие УФ-излучения, т. к. имеют максимальное поглощение в УФ-области. Затем, в результате свободнорадикальных реакций, повреждаются липидные структуры (липидные пласты эпидермиса и клеточные мембраны). Реакция окисления липидов с участием свободных радикалов (перекисное окисление липидов) имеет цепной неуправляемый характер и приводит к образованию большого количества активных форм кислорода, липидных гидроперекисей и других реакционно-способных молекул.
Дегенеративные изменения кожи под действием УФ-излучения могут быть связаны с повышением активности металлопротеаз — ферментов, разрушающих межклеточное вещество дермы. Еще одной причиной повреждения тканей при воздействии УФ-излучения является воспаление. Оно возникает как вследствие перекисного окисления клеточных мембран, так и в результате выработки воспалительных цитокинов кератиноцитами в ответ на УФ-излучение.
Течение и прогноз. Без соответствующего лечения процесс актинического старения прогрессирует. Фотостарение, в отличие от хроностарения, в значительной степени обратимо. Кожа, как и любая живая ткань, может не только защищать себя от повреждений, но и восстанавливать разрушенные структуры. Поддерживая и стимулируя репаративные системы, можно существенно улучшить внешний вид кожи, поврежденной УФ-излучением, и добиться ее видимого омоложения.
Лечение и профилактика. Первое, что нужно сделать для предотвращения фотостарения, — уменьшить количество фотонов, достигающих кожи. Для этого следует, по возможности, избегать солнца и использовать солнцезащитные средства. В связи с тем, что повреждающим действием обладает не только УФ-излучение, идущее с прямыми лучами солнца, но и отраженное от земли и окружающих предметов, проходящее сквозь облака, воду и легкую одежду, необходимо ежедневно, независимо от времени года, использовать косметику, содержащую УФ-фильтры.
Все УФ-фильтры делятся на химические (или органические) фильтры и физические, или экраны, содержащие частички, рассеивающие, отражающие и поглощающие УФ-излучение.
К органическим фильтрам относятся: УФВ-фильтры — цинкоматы, бензофенол, парааминобензойная кислота (РАВА) и ее производные салицилаты камфоры и др., УФА-фильтры — дибензоилметан, бензофенон, производные камфоры.
Природные солнцезащитные средства — экстракты алоэ, ромашки, кофейная кислота, масло каритэ, 1-, 3-бета-глюканы и др. В качестве неорганических УФ-фильтров используют диоксид титана (TiO2), оксид цинка (ZnO), оксиды железа (Fe2O3, Fe3O4) и т. д.
Помимо использования УФ-фильтров существуют другие меры защиты кожи от фотостарения.
В коже в процессе эволюции сформировались защитные механизмы, позволяющие снизить повреждающее действие УФ-лучей. Часть из них работает также по принципу фильтров и позволяет снизить число фотонов, достигающих уязвимых структур кожи. В качестве химических фильтров выступают вещества, поглощающие УФ-излучения, — меланин, уроканиновая кислота; роль физического фильтра берет на себя роговой слой, который утолщается в ответ на интенсивное УФ-излучение.
Прямое повреждающее действие УФ-излучения на биоткани лишь отчасти ответственно за фотостарение. Более серьезный вклад в этот процесс вносят реакции с участием свободных радикалов, образующихся как в результате прямого действия УФ-излучения, так и сопровождающих вызванную им воспалительную реакцию. Поэтому большую роль в защите кожи от УФ-излучения играют антиоксиданты — вещества, обезвреживающие свободные радикалы и блокирующие реакции с их участием.
В коже существует надежная антиоксидантная система, состоящая из жирорастворимых антиоксидантов, поступающих на поверхность кожи с кожным салом — альфа-токоферол, бета-каротин, сквален, и защищающая кератин и липиды эпидермиса от свободнорадикального окисления.
Кроме того, в клетках эпидермиса присутствует целый набор антиоксидантов, ферментной и неферментной природы. К первым относятся супероксиддисмутаза (СОД), каталаза, глутатионпероскидаза. В мембранах кератиноцитов много альфа-токоферола, блокирующего реакции перекисного окисления липидов. В цитоплазме клеток содержится аскорбиновая кислота, которая является восстановителем для альфа-токоферола.
Кроме того, антиоксидантными свойствами обладают также женские половые гормоны, серосодержащие аминокислоты, растворимые предшественники меланина, мелатонин. Однако антиоксиданты белковой природы, как и другие белки, повреждаются УФ-излучением и снижают свою активность. Другие антиоксиданты в процессе борьбы со свободными радикалами окисляются и требуют восстановления.
Поддержать естественную антиоксидантную систему кожи на должном уровне можно с помощью косметических средств, содержащих антиоксиданты.
Антиоксиданты в косметике, как и в коже, делятся на жирорастворимые (липофильные) и водорастворимые (гидрофильные).
Из жирорастворимых антиоксидантов чаще всего используют альфа-токоферол, каротиноиды, сквален, убихинон. Из водорастворимых — витамин С, а также растительные полифенолы (флавоноиды).
Источником флавоноидов, оказывающих антиоксидантное, противовоспалительное и сосудосуживающее действие, чаще всего является экстракт зеленого чая, виноградных косточек, коры приморской сосны, гинкго, ромашки приморской, календулы лекарственной, василька синего и др. растений.
В связи с тем, что реакции с участием свободных радикалов, вызванные УФ-излучением, разворачиваются в коже достаточно быстро, важно обеспечить надежную защиту до начала действия повреждающего фактора. Поэтому антиоксиданты и УФ-фильтры стали обязательным компонентом дневных и солнцезащитных кремов, а также средств декоративной косметики.
Постоянно используя косметические средства, содержащие антиоксиданты, и избегая солнечных ванн, можно существенно замедлить скорость старения кожи.
При имеющихся уже признаках фотостарения (морщины, пигментные пятна, телеангиоэктазии и т. д.) целесообразно применять не только защитные, но и лечебные средства.
Основным средством против фотостарения являются ретиноиды.
Еще в 1986 г. А. М. Клигманом была впервые продемонстрирована способность транс-ретиноивой кислоты (третиноина) устранять многие признаки фотостарения и восстанавливать нормальную структуру кожи. Впоследствии эта способность ретиноидов была многократно подтверждена другими авторами.
Ежедневное применение кремов, содержащих ретиноиды, в частности, третиноина 0,1%, заметно сокращает признаки фотостарения. Активация регенеративных процессов в коже является эффективным методом в борьбе с фотостарением. В этом ключе целесообразно использовать различные отшелушивающие средства — пилинги, как химические (фенолом, трихлоруксусной кислотой (ТСА), альфа-гидроксильными кислотами (АНА)), так и аппаратные — дермобразия, лазерная шлифовка (эрбиниевые и СО2-лазеры). Наряду со стимуляцией регенерации кожи эти методы являются высокоэффективными в борьбе с гиперпигментацией, которая является одним из характерных признаков фотостарения кожи и не поддается консервативной терапии 2-4% гидрохиноном, койевой, аскорбиновой, фитиновой, лимонной, гликолевой кислотами.
Актинический (солнечный) кератоз
Заболевание, возникающее в результате многолетнего регулярного воздействия солнечного света у людей І-ІІІ фототипов. В основе патогенеза лежит повреждение кератиноцитов. Основным травмирующим агентом является УФВ-излучение (длина волны 280-320 нм). Болеют взрослые, как правило, мужчины, работающие на открытом воздухе (фермеры, пастухи, моряки, альпинисты, теннисисты и др.).
Клиническая картина характеризуется появлением жестких ороговевающих чешуек, спаянных с подлежащей кожей, округлой или овальной формы, при насильственном удалении которых отмечается болезненность. Цвет чешуек варьирует от нормальной кожи до желто-коричневых, часто с красноватым оттенком, при пальпации жесткие, шероховатые. Размер, как правило, менее 1 см. Элементы располагаются изолированно, преимущественно на лице, ушных раковинах, боковых поверхностях шеи, тыльной поверхности кистей, предплечьях и голенях. Течение хроническое, возможны спонтанные ремиссии. Частота злокачественного перерождения примерно 1 на 1000 ежегодно. По современной классификации ВОЗ это заболевание отнесено к предраковым. Злокачественная трансформация очагов происходит медленно, метастазы наблюдаются очень редко.
Лечение и профилактика. Большинству больных помогает фторурацил (5% крем) в течение нескольких недель в сочетании с криодеструкцией, лазерной деструкцией, 30% проспидиновой мазью. Перед длительным пребыванием на солнце — солнцезащитные средства с высоким фактором защиты.
Продолжение читайте в следующем номере.
Н. Ф. Яровая, кандидат медицинских наук, доцент
Иммунная система кожи
Кожа является крупнейшим специализированным органом человека, площадь которого составляет 2 м 2 , а масса — почти 3 кг. Она выполняет ряд важнейших функций. В частности, кожа — это барьерный орган и, что особенно важно отметить, подобно тимусу, она является местом, где созревают некоторые типы иммунных клеток и протекают иммунологические реакции. В принципе, в кожном барьере представлены все типы клеток, способные осуществлять широкий спектриммунных реакций. Это дает основание считать кожу органом иммунной системы.
В начале 80х гг. XX века была сформулирована концепция лимфоидной ткани кожи — skin-associated lymphoid tissue (SALT), которая продолжает развиваться и в наши дни. В соответствии с современными взглядами наряду с лимфоцитами к иммунной системе кожи следует отнести нейтрофилы, тучные клетки и эозинофилы, клетки Лангерганса и кератиноциты [3, 4, 20].
Лимфоциты
Для лимфоидных клеток характерна рециркуляция — постоянный обмен между кровью, лимфой и органами, содержащими лимфоидную ткань. Другой особенностью данной клеточной популяции является хоминг — заселение определенных участков лимфоидных органов и тканей. Поэтому внутридермальные лимфоциты отличаются от циркулирующих в периферической крови. Для изучения популяционного состава лимфоцитов кожи были использованы методы иммуногистохимии и «кожного окна» (определение процентного содержания клеток на отпечатке с небольшого участка кожи после удаления поверхностного слоя эпидермиса). Это позволило установить, что в норме лимфоидные клетки кожи являются преимущественно Т-лимфоцитами: CD5+ — 19%, CD3+ — 48%, CD25+ — 26%, CD4+ — 33%, CD22+ — 18% [7, 14]. Все они имеют достаточно специфичный общий маркер — кожный лимфоцитарный антиген (CLA), который считается рецептором, контролирующим сродство Т-клеток к коже. CLA — это адгезивная молекула на мембране, которая обеспечивает связывание Т-лимфоцита с эндотелием посткапиллярных венул кожи и переход его в дерму. CLA-позитивные T-клетки составляют 10—15% циркулирующих клеток крови. Популяция CLA-позитивных Т-клеток представлена несколькими субпопуляциями, различающимися по рецепторному статусу и функциональной активности [10, 11, 12]. Для всех CLA-позитивных Т-клеток характерна экспрессия кожного Т-клеточного хемоаттрактанта (CTACK), который «привлекает» в кожу Т-лимфоциты из циркуляции, прежде всего при различных воспалительных процессах. Совокупность накопленных сегодня клинико-экспериментальных данных показывает, что CTACK играет важную роль в иммунном ответе кожи. Наиболее значима его патогенетическая роль как провоспалительного фактора при таких заболеваниях, как атопический и контактный дерматиты [13].
Кроме того, большинство Т-лимфоцитов нормальной кожи здорового человека имеют рецепторы к другим хемокинам — биологически активным веществам, контролирующим миграцию клеток, в частности лимфоцитов. Это способствует их активному участию в различных иммунологических реакциях, как физиологических, так и патологических [1, 6, 21].
Т-клетки кожи способны дифференцироваться в цитотоксические клетки или клетки памяти (CD45RO). Клетки памяти экспрессируют также кожный лимфоцитарный антиген (CLA), образуются в лимфатических узлах, дренирующих кожу, и возвращаются в кожу при воспалении. В норме они участвуют в формировании иммунитета в коже, а при патологии принимают участие в патогенезе кожной Т-клеточной лимфомы, отторжения трансплантата, атопического дерматита и т. д. [2, 5, 10, 17]. Около трети лимфоцитов кожи являются Т-хелперами (СD4+). В последние годы показано, что данная субпопуляция клеток представлена двумя разновидностями —Th1 и Th2, которые различаются прежде всего по спектру продуцируемых цитокинов. В норме между этими клетками существует определенный баланс; при заболеваниях кожи соотношение Th1/Th2 меняется. Например,при воспалительных процессах повышается активность Th1-лимфоцитов [1, 8, 12, 15]. Таким образом, лимфоциты кожи представляют собой гетерогенную клеточную популяцию, в которой присутствуют клетки рециркулирующего пула и специфические кожные лимфоциты. Для последних характерен своеобразный набор клеточных рецепторов, обусловливающих их тропность к коже, а также определенный набор продуцируемых цитокинов, позволяющий им участвовать в различных клеточных реакциях, которые обеспечивают репарацию кожи.
Нейтрофилы
Нейтрофилы содержатся в нормальной коже в незначительном количестве, а при острых воспалительных процессах их число существенно возрастает. Кроме того, нейтрофильные гранулоциты участвуют в регуляции репаративных процессов путем взаимодействия с другими клетками (макрофагами, кератиноцитами). Одним из механизмов этого взаимодействия является продукция нейтрофилокинов, стимулирующих секрецию фибробластами и лимфоцитами факторов роста, которые в свою очередь индуцируют пролиферативную активность клеток регенерирующей ткани [3, 18].
Тучные клетки и эозинофилы
Тучные клетки (ТК) и эозинофилы кожи участвуют в различных патологических процессах, прежде всего — в аллергических. При внедрении аллергена в кожу он взаимодействует с эозинофилами и ТК, несущими на своей поверхности IgE-антитела. В результате этого взаимодействия происходит активация и дегрануляция клеток с последующим высвобождением различных медиаторов (субстанции Р, интерлейкинов 1 и 6, хемокинов). Они способствуют миграции в очаг патологического процесса других иммунокомпетентных клеток и поддерживают активность воспалительной реакции. Количество и функциональная активность этих клеток по-разному меняются при различных кожных заболеваниях. Кроме того, ТК и эозинофилы играют определенную роль в реализации патогенных эффектов стресса на кожу [2, 6, 9].
Клетки Лангерганса
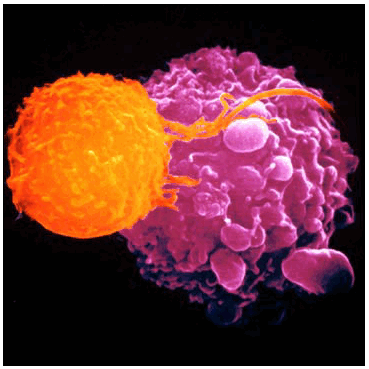
Клетки Лангерганса (КЛ) относятся к специализированным клеткам эпидермиса и составляют 2-3% от общего числа его клеток. Они представляют собой одну из форм дендритных клеток, имеющих моноцитарно-макрофагальное происхождение и выполняющих в организме важнейшие иммунные функции, прежде всего — как антигенпрезентирующие клетки. Дендритные клетки являются ключевым звеном, связывающим приобретенный и врожденный иммунитет [16].
При воспалении и других процессах, связанных с антигенной стимуляцией, КЛ приобретают двигательную активность, покидают эпидермис с током тканевой жидкости и, перемещаясь по лимфе, претерпевают определенные морфологические трансформации, в результате чего становятся так называемыми «вуалевыми» клетками. Достигая лимфатических узлов, они активно взаимо действуют с другими иммунокомпетентными клетками и осуществляют презентацию им антигенов. КЛ способны взаимодейство вать с различными типами Т-клеток, модулируя таким образом различные типы иммунных реакций (воспаление, аутоиммунитет). Кроме того, КЛ непосредственно участвуют в уничтожении бактерий в коже.
Кератиноциты
Кератиноциты также следует отнести к иммунной системе кожи. Они продуцируют широкий спектр регуляторных молекул (ростовых факторов, цитокинов), чем обусловлено их участие в иммунной защите кожи [2, 8, 16, 21]. Нарушение взаимодействия молекул адгезии на поверхности кератиноцитов с рецепторами лимфоцитов является важным механизмом патогенеза ряда заболеваний, например псориаза [5, 7, 17, 19].
Меланоциты
В последние годы эти пигмент-продуцирующие клетки кожи стали относить и к иммунокомпетентным, поскольку они, как и кератиноциты, способны продуцировать ряд цитокинов (интерлейкины 1, 3 и 6, фактор некроза опухолей, трансформирующий фактор роста и другие), которые выступают в роли медиаторов иммунного ответа в дерме [2].
Цитокины — биорегуляторы иммунных реакций
Последние десятилетия характеризовались бурным накоплением данных о новом классе иммунорегуляторных молекул — цитокинов. Они включают в себя огромное количество различных веществ, в том числе интерлейкинов, которые выполняют коммуникативную функцию между иммуноцитами и оказывают различные регуляторные влияния как в рамках иммунной системы, так и в других органах и тканях. В настоящее время в коже обнаружено большинство известных интерлейкинов: их функции связаны с кожей, а нарушение продукции лежит в основе патогенеза ряда кожных заболеваний, в частности псориаза и атопического дерматита [2, 6, 7].
Иммунная система кожи при инфекционном и неинфекционном поражении
Иммунная система кожи участвует в реализации и врожденного, и приобретенного иммунитета. Наиболее значимо ее роль проявляется при нарушении целостности барьера и проникновении в дерму микро организмов. При этом SALT реагирует как единая функциональная система. В анти-генпрезентирующих клетках происходят процессинг и презентация антигена, в ходе которых КЛ превращаются в дендритные клетки и перемещаются по дерме в лимфатические узлы. В результате они приобретают способность взаимодействовать с Т-хелперами, которые затем активируют В-клетки и частично дифференцируются в эффекторные лимфоциты и клетки памяти. Т-клетки памяти, несущие CLA, способны из кровотока мигрировать в эпидермис; именно они и преобладают в коже. В результате увеличения числа Т-клеток, контактирующих с наиболее «актуальными» антигенами, вносится поправка в антигенраспознающий репертуар Т- лимфоцитов. Этим определяется активность иммунного ответа.
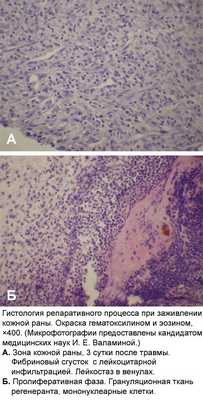
При неинфекционном поражении кожи, например при травме, иммунная система активно участвует в заживлении кожной раны. Заживление кожной раны — это динамичный интерактивный процесс с участием медиаторов, клеток крови, межклеточного матрикса и мезенхимальных клеток, который состоит из трех фаз: воспаление, образование грануляционной ткани и тканевое ремоделирование. Воспаление является реакцией организма в целом и кожи в частности на травму. Ведущая роль в его развитии принадлежит клеткам крови — нейтрофилам. Они не только участвуют в гемостазе, но и выделяют биологически активные вещества.
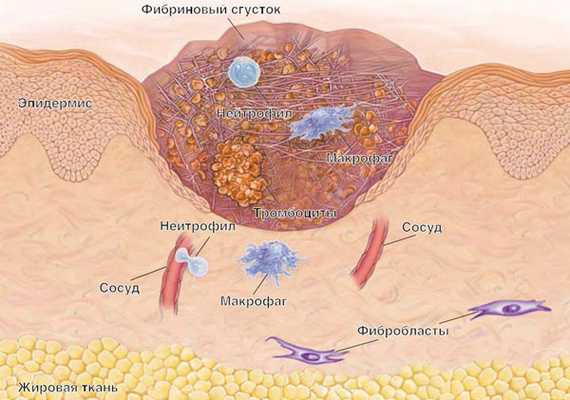
В результате происходит активация моноцитов-макрофагов, которые служат связующим звеном между воспалением и регенерацией. Активация этих клеток приводит к индукции пролиферации эпидермиса. Необходимо отметить, что реэпителизация начинается уже через несколько часов поле нанесения травмы. Первоначально она идет за счет сокращения внутриклеточных тонофиламентов, что повышает миграционную способность эпидермальных клеток. Примерно через четверо суток в ране определяется новообразованная строма (грануляционная ткань). Под влиянием различных цитокинов, продуцируемых иммунокомпетентными клетками, в ней происходят дифференцировка фибробластов, синтез коллагена, новообразование сосудов. Активное участие в этих процессах принимают цитокины, и в том числе — ростовые факторы (эпидермальный, трансформирующий, тромбоцитарный, эндотелиальный и другие). Метаболизм коллагена, появление в грануляционной ткани миофибробластов, пролиферация кератиноцитов и целый ряд других клеточных событий, завершающих «созревание» грануляционной ткани, приводят к формированию кожного рубца, что свидетельствует о восстановлении целостности ткани и завершении репаративного процесса [19, 21].
Таким образом, в коже представлены все типы иммунного ответа — врожденный и приобретенный (адоптивный), клеточный и гуморальный. Благодаря этому возможны и неспецифическая защитная функция (иммуноглобулины, лизоцим, лактоферрин, дефенсины, фагоцитоз), и первичное распознавание антигена с последующей его презентацией и пролиферацией антиген-специфических Т-клеток. В результате в дерме осуществляются как цитотоксические реакции, так и антителообразование. Необходимо подчеркнуть, что особенностью кожи как иммунного органа является относительное преобладание врожденного иммунитета над приобретенным, а в системе врожденного иммунитета кожи в свою очередь превалируют клеточные факторы. Анализ многочисленных научных данных позволяет полагать, что иммунные реакции имеют отношение к большинству физиологических и патологических процессов, происходящих в коже.
Нарушения функции SALT
На обширном экспериментальном и клиническом материале показано, что нарушения функций SALT — реактивности Т-клеток, продукции цитокинов, экспрессии хемокинов на клетках, межклеточных взаимодействий и других иммунологических реакций — приводят к развитию ряда заболеваний, любое из которых сопровождается изменением внешнего вида кожи. Это могут быть воспалительные заболевания кожи (фурункулы, акне), атопический дерматит, псориаз, Т-клеточная кожная лимфома [5, 16, 17]. Известно, что возрастные изменения кожи также связаны с изменением ее иммунологических функций. В стареющей коже наблюдаются мононуклеарная инфильтрация, снижение числа клеток Лангерганса и изменение продукции иммунокомпетентными клетками цитокинов, влияющих на пролиферацию и дифференцировку клеток кожи.
Разнообразие клеток, входящих в иммунную систему кожи, а также многообразие их функций объясняют тот факт, что на уровне кожи возможно проявление всех типов иммунопатологических синдромов (иммунодефицитный, аутоиммунный, аллергический, лимфопролиферативный). Иммунодефицитный синдром проявляется, например, фурункулезом и другими гнойно-воспалительными процессами. При дефектах фагоцитоза кожа становится чувствительной ко многим бактериальным и грибковым инфекциям, но иммунный ответ нарушается на любой антиген, поскольку страдает антигенная презентация.
Аллергический (гиперергический) синдром встречается достаточно часто и имеет место при контактном и атопическом дерматитах. Явления гиперергии характерны и для псориаза. Аутоиммунный синдром также имеет кожные проявления (склеродермия, системная красная волчанка). Примером лимфопролиферативного синдрома служит Т-клеточная лимфома кожи (грибовидный микоз).
Диагностика всех этих состояний основана на клинических признаках. Например, для иммунодефицитного заболевания это будут такие критерии, как рецидивирующее течение инфекционного поражения кожи, его затяжное течение несмотря на проведение адекватной фармакотерапии, тенденция к генерализации инфекционно-воспалительного процесса в коже, резистентность к антимикробной терапии, преобладание в очаге поражения некротических изменений над воспалительными, несоответствие локальных и системных проявлений кожной инфекции. Специфических тестов, характеризующих состояние иммунитета кожи, в практической медицине не существует. Дерматолог может ориентироваться на стандартные иммунологические показатели крови. В научных же исследованиях используют морфологическую (гистологическую) оценку иммунокомпетентных структур кожи, метод «кожного окна» и некоторые другие.
Как улучшить иммунитет кожи?
Патология иммунной системы приводит к развитию иммунозависимой патологии. Поэтому потребность в стимуляции иммунитета кожи при его угнетении патогенетически обоснована. Для этих целей могут быть рекомендованы такие препараты, как Полиоксидоний и Ликопид. Некоторые иммуномодуляторы (например, Рибоксин) могут использоваться как для системного, так и для местного применения, в том числе в мезотерапевтических методиках. При этом интрадермальные иньекции оказывают влияние преимущественно на иммунную систему кожи, а системное применение приводит к активации лимфопоэза в тимусе и лимфатических узлах. Другими словами, выбор способа введения препарата (местное или системное) должен базироваться на характере иммунных нарушений — как в коже, так и в организме в целом.
Умеренным иммунотропным действием обладают и неспецифические адаптогены (витаминно-микроэлементные комплексы, настойка аралии и т. п.). Мы обнаружили иммуноактивные свойства у органического кремния, который широко используется в мезотерапевтической практике. В лечении заболеваний, вызванных повышенной реактивностью иммунной системы (псориаз, лимфомы), используют иммунодепрессанты (циклоспорин). Последним достижением иммунофармакологии является использование в качестве ингибиторов иммунной системы моноклональных (высокоспецифичных) антител.
Улучшая иммунный статус кожи, следует помнить о том, что иммунная система кожи, морфологически представленная SALT, с одной стороны, является достаточно автономным отделом иммунной системы организма, с другой — имеет с ней тесные морфофункциональные и регуляторные взаимоотношения. Нарушения нормальных иммунных реакций в коже приводят к развитию многих дерматологических заболеваний и подавляющего большинства эстетических проблем, в том числе к преждевременному старению кожи. Неудивительно, что кожа является мишенью для иммунотерапевтических вмешательств, в частности иммуномезотерапии. Более подробно этот вопрос мы планируем рассмотреть в следующих публикациях.
Роль цитокинов, ультрафиолета в повреждении кожи и эпидермальной гиперплазии.

Нарушить барьерную функцию кожи можно разными путями. Например, как сейчас, — путем нарушения структуры гидролипидной мантии обработкой органическими растворителями (спирт) или ПАВ, посредством физического разрушения рогового слоя (пилинг, дермабразия, лазерная шлифовка). Есть еще один способ ослабить барьерные свойства кожи — изменить состав поверхностных липидов, что произойдет, например, в результате длительного ограничения приема пищевых жиров или продолжительного применения большого количества косметического масла (любого!).
Сразу же после физического повреждения рогового слоя скорость испарения воды с его поверхности резко возрастает. Затем в течение нескольких часов она постепенно снижается, что говорит о том, что барьерный слой снова восстанавливается. Если проследить всю динамику восстановления барьерной функции кожи, то можно видеть, что сначала восстановление идет довольно быстро. У человека барьерная функция восстанавливается на 60% через 12 ч, но полное восстановление занимает 72 ч. Считается, что быстрое восстановление происходит за счет массового выброса из гранулярных кератиноцитов уже готовых ламеллярных телец. В медленную фазу восстановления барьера происходит усиление синтеза жирных кислот, холестерина и церамидов, а также образование новых ламеллярных гранул.
В ответ на повреждение рогового слоя кератиноциты секретируют ряд сигнальных молекул — цитокинов, факторов роста. Установлено, что сразу после повреждения рогового слоя повышается концентрация ИЛ-1а (интерлейкин 1а), TNFα (фактор некроза опухолей альфа) и некоторых других цитокинов. Точная роль этих молекул в восстановлении эпидермального барьера пока не известна, но сам факт повышения их концентрации важен. Скорее всего, они стимулируют синтез липидов и образование ламеллярных гранул в эпидермисе, но они же могут вызывать появление гиперпигментации, воспаления и эпидермальной гиперплазии. Показано, что даже незначительное, но систематическое повреждение барьерного слоя (например, частое умывание горячей водой с мылом) приводит к возникновению гиперплазии эпидермиса, что говорит о том, что цитокины, вырабатываемые кожей при повреждении рогового слоя, могут инициировать патологические процессы.
Нанесение на кожу различных веществ может помочь или, напротив, затормозить восстановительные процессы.
Полная окклюзия
Если на кожу наложить полиэтиленовую или резиновую пленку, то секреции ламеллярных телец и увеличения синтеза липидов не происходит. Более того, сейчас актуальна проблема с тем, что сама окклюзия — ношение резиновых перчаток, может стать причиной повреждения барьерной функции кожи, ведь повышенная влажность приводит к повышению проницаемости кожи.
По всей видимости, увеличение скорости испарения воды через роговой слой является главным сигналом к восстановительным работам при разрушении барьерных структур. Непроницаемая пленка, которая не позволяет воде испаряться, блокирует ответ клеток эпидермиса на повреждение.
Частичная окклюзия
Если кожу с разрушенным роговым слоем покрыть слоем вазелина, то в первые часы после повреждения наблюдается замедление восстановления. На электронных микрофотографиях в гранулярном слое эпидермиса можно видеть деформированные (словно поеденные молью) ламеллярные тельца. Это говорит о том, что вазелин в какой-то мере проникает в гранулярный слой эпидермиса и нарушает формирование ламеллярных телец. Тем не менее тонкий слой вазелина не препятствует газообмену, как это делает полиэтиленовая пленка. И некоторое количество трансдермальной воды через нее испаряется, а кислород и углекислый газ нормально проходят.
Поэтому в итоге под слоем вазелина восстановление барьера завершается быстрее, чем без него. Временный барьер, который создает вазелин, защищает кожу от сильного обезвоживания и проникновения токсических веществ. Поэтому клетки могут успешнее работать над восстановлением барьера, не отвлекаясь на борьбу с внешним стрессом.
Физиологические липиды
Если вазелин при нанесении на кожу лишь в незначительной степени проникает внутрь, то физиологические липиды (церамиды, нейтральные жиры, жирные кислоты, холестерин) ведут себя совершенно иначе. Используя флуоресцентные метки, удалось показать, что эти молекулы с легкостью преодолевают роговой слой и проникают в живые клетки эпидермиса. Поскольку в клетках кожи есть все необходимые ферменты для переработки экзогенных липидов, липидные молекулы, проникшие извне, быстро разбираются на «запчасти», из которых строятся липиды эпидермиса.
Тем не менее, если обратиться к динамике восстановления кожи, то будет видно, что эффективное восстановление ее барьерной функции наблюдается лишь при использовании смеси трех ключевых липидов кожи — церамидов, холестерина, жирных кислот, взятых в определенном соотношении. В ходе многолетних экспериментов удалось подобрать соотношение физиологических липидов в смеси, оптимальное для скорейшего восстановления барьера — 3:1:1. Обращаем внимание на то, что это молярная пропорция, отражающая соотношение числа липидных молекул в смеси и означающая, что на три молекулы одного вида липидов приходится по одной молекуле двух других видов. Примечательно, что липидную смесь следует адаптировать под конкретное состояние кожи:
- если проблемы с кожей вызваны дефицитом незаменимых жирных кислот (несбалансированное питание, фотоповреждение), то оптимальной рецептурой для восстановления барьерной функции кожи будет:
1 (церамиды) : 1 (холестерин) : 3 (незаменимые жирные кислоты);
- для стареющей кожи необходимо увеличить долю холестерина по сравнению с остальными липидами, так как в стареющем эпидермисе часто наблюдается нарушение метаболизма холестерина, поэтому смесь будет выглядеть следующим образом:
1 (церамиды) : 3 (холестерин) : 1 (незаменимые жирные кислоты);
- при лечении атопического дерматита и некоторых других кожных заболеваний рекомендуется рецептура:
3 (церамиды) : 1 (холестерин) : 1 (жирные кислоты).
С практической точки зрения важно, что свободные жирные кислоты можно заменить триглицеридами или фосфолипидами и все еще получить быстрое восстановление барьера. Можно заменить церамиды сфингомиелином или холестерин эфирами холестерина без какого-либо ущерба для процесса восстановления. Это подтверждает наличие в коже очень активных ферментов, с помощью которых клетки эпидермиса могут использовать экзогенные липиды для синтеза собственных липидов.
Быстрое восстановление барьерной функции наблюдается лишь в том случае, если три ключевых липида (церамиды, холестерин, жирные кислоты) присутствуют в необходимом соотношении. При этом неважно, использована концентрированная или разбавленная липидная смесь, важно, чтобы пропорция ключевых липидов в ней сохранилась.
Натуральные масла
С тех пор как была установлена исключительная роль незаменимых жирных кислот в физиологии кожи, в косметологии большую популярность приобрели натуральные масла. Зачастую их наносят на кожу в чистом виде. С одной стороны, казалось бы, идея хорошая. Натуральные масла не содержат никаких посторонних химических веществ, и многие из них богаты дополнительными активными компонентами, такими как фитостерины, витамин Е, каротиноиды. Однако увлекаться чистыми маслами все-таки не стоит. Напомним, что целостность липидных пластов рогового слоя поддерживается точным соотношением всех липидных компонентов — церамидов, холестерина, свободных жирных кислот. Масла являются по своей природе нейтральными жирами, в основе которых триглицериды. Хотя они могут быть разобраны на составные части с высвобождением свободных жирных кислот, сначала они должны проникнуть через липидные пласты. Если масла слишком много, оно будет разбавлять липидные пласты, временно нарушая их структуру. Обычно структура пластов быстро восстанавливается. Однако слишком обильное и частое применение масел может привести к стойкому нарушению барьерной функции кожи. Все хорошо в меру.
В составе косметических средств натуральные масла обычно содержатся в небольших количествах, поэтому они не так заметно влияют на структуру барьера.
Информацию по составу и свойствам растительных масел, использующихся в косметике и для ухода за кожей, а также нюансы, касающиеся использования физиологических липидов и средств для создания окклюзии вы найдете в наших книгах «НОВАЯ КОСМЕТОЛОГИЯ. Косметические средства: ингредиенты, рецептуры, применение», «Косметическая химия для косметологов и дерматологов» и «НОВАЯ КОСМЕТОЛОГИЯ. Основы современной косметологии. 2-е издание, переработанное и дополненное». Они все доступны в электронном виде, и вы можете познакомиться с ними уже сегодня!
Нарушения дермального барьера как фактор хронизации дерматозов в детском возрасте, подходы к терапии: теоретические и практические инновации
В статье приводятся современные сведения о формировании барьерных свойств эпидермальных структур кожи. Раскрываются патогенетические особенности нарушений барьерных свойств кожи при воспалительных и десквамативных дерматозах в детском возрасте.
Disturbance of skin barrier properties as factor of chronization of dermatoses in children, treatment: theoretical and practical innovations
Current article describes up-to-date information about barrier properties forming in epidermal structures of the skin. Description of pathogenetic qualities of disturbance in skin barrier properties during inflammatory and desquamative dermatoses in children is given.
Кожа человека выполняет множество жизненно важных функций. Это основной орган, осуществляющий контакт с внешней средой, обеспечивающий барьер, что позволяет организму сохранять гомеостаз и предотвратить обезвоживание. Существенную роль в формировании барьерных свойств кожи играет эпидермальный барьер — это собирательное понятие, характеризующее роговой слой, его состояние и происходящие в нем процессы кератинизации, синтез высокоспециализированных межклеточных липидов, образование натурального увлажняющего фактора, десквамацию [1]. Осуществление барьерных функций кожи в целом обеспечивается посредством многочисленных кооперативных взаимодействий различных структур эпидермиса, дермы, клеток местного иммунологического надзора, экскреторной функцией сальных и потовых желез и т. д. [2].
Особое патогенетическое значение имеет понимание дермальных изменений, происходящих в эпидермисе пациентов, страдающих дерматозами, в основе которых лежат воспалительные и десквамативные процессы, происходящие в эпидермисе.
В еще большей степени это касается детей первых лет жизни, имеющих ряд анатомо-конституциональных особенностей строения кожи, обусловливающих незрелость эпидермальных и дермальных барьерных структур. Среди них: нежный и рыхлый эпидермис, тонкая базальная мембрана, нейтральная или слабощелочная рН, повышенная проницаемость эндотелия сосудов, высокая резорбционная способность жирорастворимых веществ и ряд других.
Как упоминалось выше, одно из ведущих мест среди защитных барьеров эпидермиса в настоящее время отводят роговому слою. Ранее считалось, что роговой слой это отмершие участки кожи с аморфной массой кератиновых нитей, исследования последних лет показали, что это живая, динамичная и очень активная ткань с выраженным метаболизмом липидов в межкератиноцитарном матриксе, таких как церамиды, гликосилкерамиды, свободные сфингоидные основания, холестерол и его сульфаты, жирные кислоты, фосфолипиды, некоторые другие, а также упорядоченной структурой и движением кератиноцитов 4. Известно, что процессы естественной кератинизации в эпителиальных клетках обеспечиваются белком филаггрином, осуществляющим агрегацию филаментов — компонентов цитоскелета. В результате этого процесса формируются постклеточные белковые структуры, в которых отсутствуют органеллы — корнеоциты. «Мертвыми» эти клетки считают потому, что они не синтезируют белки и не реагируют на влияния различных сигнальных молекул [2].
Двойные ковалентные связи жирных кислот прочно, подобно «цементу», скрепляют липидные пласты между собой и с роговыми «кирпичиками» корнеоцитов, образуя подобие кирпичной кладки, тем самым обеспечивается механическая прочность рогового слоя. Важно отметить также тот факт, что высокоспециализированные липиды рогового слоя образуют биполярную прослойку между кератиноцитами таким образом, что более полярная гидрофильная фаза располагается между двумя кристаллическими, наподобие «сэндвича» по A. Rawlings, 2003 [2].
Указанная структура позволяет препятствовать трансэпидермальной потере воды, проникновению через кожу водорастворимых веществ и обеспечивает целостность кожи.
В обеспечении надежности эпидермального барьера также важное значение имеет наличие на его поверхности водно-липидной мантии Маркионини, являющейся смесью кожного сала, секрета эккринных потовых желез и церамидов рогового слоя [3, 6]. Эмульгирование кожного сала происходит благодаря гидрофильным высокомолекулярным спиртам и холестеролу, входящему в его состав. При этом на поверхности кожного покрова создается слабокислый рН (4,5-5,5). Благодаря такому составу данная водно-липидная эмульсионная пленка выполняет ряд уникальных функций:
- поддержание нормальной эластичности кожи, препятствие ее пересушиванию;
- поддержание постоянной температуры тела (за счет изменений ее физического состава);
- нейтрализация щелочей органическими жирными кислотами, поддержание постоянного слабокислого pH;
- подавление размножения микроорганизмов благодаря свободным низшим жирным кислотам кожного сала;
- один из путей экскреции продуктов метаболизма, лекарственных и токсических веществ.
Таким образом, сложная динамическая система межклеточных взаимодействий и межкератиноцитарного обмена липидов создает стойкий, малопроницаемый эпидермальный барьер, надежно защищающий от воздействия факторов внешней среды, а также предотвращающий от трансэпидермальной потери влаги.
Одним из частых клинических проявлений многих кожных болезней, например, таких как ихтиоз, кератодермии, атопический дерматит, экзема, псориаз, хейлит, болезнь Дарье, болезнь Девержи и др., является сухость кожи следствие изменения соотношения и содержания липидов [4].
Сухая кожа — это истонченная кожа с шелушением и/или мелкими трещинами и субъективным ощущением стягивания. Причинами сухости, как правило, являются дегидратация рогового слоя и нарушения кератинизации, свидетельствующие о нарушении барьерной функции кожи. В некоторых случаях нарушение проницаемости является первичным патогенетическим звеном, влекущим за собой комплекс патологических изменений, в других случаях нарушение барьерной функции рогового слоя ухудшает течение уже существующих заболеваний [6]. В последнее время все большее число исследователей доказывают, что во многих случаях в развитии воспаления и гиперплазии эпидермиса существенную роль играют цитокины, вырабатываемые самими кератиноцитами при повреждении эпидермального барьера. Установлено, что сразу после повреждения рогового слоя повышается концентрация интерлейкина-1α (ИЛ-1α), фактора некроза опухоли α, которые действуют по сигнальному механизму: каждая сигнальная молекула способна стимулировать выработку других сигнальных молекул с различными функциями, которые в свою очередь побуждают клетки к секреции новых биологически активных веществ [6, 7].
При повреждении рогового слоя в эпидермисе разворачивается ответная реакция, направленная на восстановление его липидных структур. Если восстановление происходит недостаточно быстро, то клетки эпидермиса подвергаются массированной атаке со стороны микроорганизмов и токсинов, в процессе которой поврежденные кератиноциты начинают секретировать цитокины, запускающие воспалительную реакцию. Воспаление всегда сопровождается продукцией свободных радикалов, что приводит к дальнейшему повреждению клеток эпидермиса, которые уже не могут обеспечить полное восстановление липидного барьера, поэтому эпидермис постепенно обезвоживается. Кожа становится сухой, шелушащейся и воспаленной.
Наиболее распространенным заболеванием кожи в детской дерматологической практике является атопический дерматит [8]. Нарушения барьерных свойств кожи при этом дерматозе связаны со сложными и многогранными процессами, протекающими в эпидермисе. Так, в роговом слое отмечается снижение уровня свободных церамидов, в частности С1?линолеата, который играет важную роль в формировании билипидного слоя и которому принадлежит особо важная роль в защитном механизме при повторном раздражении. Именно с его недостатком связывают предрасположенность кожи к экзематозным реакциям под воздействием различных ирритантов. Отмечается повышение активности фермента сфингомиелиназы, свободных жирных кислот, сфингозина, фосфатидилхолина, на которые в значительной степени влияют рН и осмотическое давление [2, 6]. Все это в значительной степени изменяет нормальную регуляцию метаболизма липидов, гидролитическую деградацию корнеодесмосом при терминальном разъединении роговых клеток и высвобождение кератиноцитами ИЛ-1α, активирующего ответ эпидермиса на внешние раздражители. Кроме того, имеются данные о дефиците филаггрина у пациентов, страдающих атопическим дерматитом. В процессе деградации этого белка образуется натуральный увлажняющий фактор (natural moisturizing factor, NMF): высвобождающиеся аминокислоты, которые в норме создают высокое осмотическое давление в клетке, осуществляют приток воды в корнеоциты по градиенту концентраций, делая роговые чешуйки упругими. В свою очередь, обезвоживание эпидермиса стимулирует выброс провоспалительных цитокинов, способствуя формированию кожных патологических реакций [4, 7].
Указанные изменения приводят к формированию атопического ксероза, снижению барьерных функций кожи, проявляющемуся агрессией различных микробных агентов, играющих важную роль в хронизации воспаления, носящего атопический или неатопический характер. Сегодня общеизвестным является тот факт, что практически в 100% случаев кожный покров больных атопическим дерматитом колонизирован штаммами золотистого стафилококка, он высеивается как с пораженных, так и с непораженных участков кожи. При этом клинические признаки инфекционного процесса на коже нередко отсутствуют [8, 9].
Колонизация золотистого стафилококка возможна вследствие наличия на клеточной стенке бактерий — рецепторов-адгезинов к ламинину и фибронектину эпидермиса, формирования фолликулярных структур между клетками золотистого стафилококка и корнеоцитами, что приводит к формированию бактериальной биопленки, участвующей в адгезии стафилококка [10]. Также колонизация стафилококка возможна вследствие снижения экспрессии факторов врожденного иммунитета в коже, в частности антимикробных пептидов — дефензинов и кателицидина.
Кроме стафилококка, при атопическом дерматите высеваются и другие микроорганизмы, среди которых наиболее часто встречается стрептококк. Зачастую в очагах поражения обнаруживается микст-инфекция.
Нарушения барьерных свойств кожи также наблюдаются и у пациентов с псориазом. Эти изменения происходят вследствие снижения концентрации свободных и связанных церамидов: C3b, C5 и церамидов В соответственно. Вместе с тем отмечается снижение уровня экспрессии свободных церамидов — C2, C3a и C4; кислот — гидроксикислот, жирных кислот (олеатов и линолеатов, ковалентно связанных с корнеоцитами). Совокупность указанных трансформаций приводит к изменениям сцепления корнеоцитов и нарушениям десквамации.
Особенностями нарушений барьерных свойств кожи при ихтиозе являются снижения уровней свободных церамидов: C3b, C5 и уровня сфингозина, на фоне повышенной концентрации свободных церамидов — C2, C3a и C4. Результатом этих процессов является формирование ретенционного гиперкератоза [3].
Кроме того, нарушения эпидермального барьера у детей, страдающих воспалительными дерматозами, вызывают многочисленные внешние воздействия, приводящие к повреждению, в том числе этому способствуют расчесы, травмы, различные аллергены и ирританты, вторичная инфекция, а зачастую и неправильный уход за кожей [1, 4]. Нарушают, в известной степени, барьерные свойства кожи и беспорядочное использование больными наружных лечебных и косметических средств. В особенности это касается так часто применяемых глюкокортикостероидных лекарственных препаратов, которые вызывают изменения липидного барьера кожи.
Целью наружной терапии воспалительных и десквамативных дерматозов и состояний кожи в детском возрасте являются купирование воспаления и зуда путем назначения противовоспалительных средств, восстановление водно-липидного слоя и повышение барьерной функции кожи посредством использования смягчающих питательных средств. Важен также и последующий адекватный уход за кожей путем назначения очищающих и увлажняющих средств, позволяющих адекватно реабилитировать пациентов и пролонгировать ремиссию [11].
Для проведения рациональной наружной терапии необходимо оценивать характер и локализацию морфологических изменений кожи, выбрать лекарственное средство, учитывая механизмы его действия, подобрать адекватную лекарственную форму в зависимости от активности воспалительного процесса, выраженности клинической симптоматики нарушений барьерных свойств кожи.
В качестве современных средств увлажнения кожи используют различные лечебные косметические формы. Одни из них — средства непосредственного увлажнения — хумиктанты. В их основе натуральные увлажняющие факторы (пирролидонкарболовая кислота, мочевина, производные молочной кислоты), липосомы, полиолы, полисахариды, макромолекулы (хондроитинсульфаты, полисахариды, коллаген, эластин, др.). Средства, препятствующие потере воды, в состав которых входят вещества, образующие пленку, — воски, вазелин, парафин, пергидросквален, ланолин, многоатомные спирты, жирные кислоты, триглицериды, силиконы; либо препараты с кератолитическим действием [2].
Особое внимание в детской дерматологической практике отводится средствам на основе декспантенола, который в клетках кожи быстро превращается в пантотеновую кислоту, являющуюся составной частью коэнзима А и играет важную роль как в формировании, так и в заживлении поврежденного кожного покрова; стимулирует регенерацию кожи, нормализует клеточный метаболизм. Этим требованиям отвечает, например, крем Бепантен, являющийся важной составляющей комплексной наружной терапии ряда воспалительных и десквамативных заболеваний кожи с хроническим течением в детском возрасте. Вместе с тем фармакологические свойства препаратов для наружного лечения на основе декспантенола важны не только как лечебные, но и как профилактические средства, например, при пеленочном дерматите. Декспантенол в виде мази Бепантен формирует защитный барьер против внешних раздражителей (моча, фекалии), а мазевая основа Бепантена, представленная ланолином и мягким белым парафином, предотвращает трансэпидермальную потерю воды [12].
Особенностью современных тенденций создания средств лечебной косметики является комбинация биосовместимых увлажнителей и пленкообразующих веществ, многие из них в своем составе содержат микроэлементы. Тем самым достигается наибольшая эффективность увлажнения и дополнительная модификация действия посредством включения тех или иных микроэлементов [13].
Тем не менее, если обратиться к динамике восстановления кожи, будет видно, что эффективное восстановление барьерной функции кожи наблюдается лишь при использовании смеси трех ключевых липидов (церамидов, холестерина и жирных кислот), взятых в эквимолярном соотношении [6].
Среди аллергологов, педиатров и дерматологов остро дискутируется вопрос о частоте использования воды для очищения как пораженной, так и здоровой кожи [2, 4, 8, 11]. В исследованиях C. Chiang и L. E. Eichenfield (2009) было продемонстрировано уменьшение гидратации рогового слоя у пациентов, страдающих атопическим дерматитом [2, 14]. Мытье кожи водой без последующего нанесения увлажняющих средств резко снижало параметры ее увлажненности, вместе с тем увлажнение без предшествующего очищения с помощью воды существенно увеличивало содержание воды в роговом слое [2, 14, 15].
Также установлено, что скорость восстановления структур кожи, обеспечивающих барьерную функцию, значительно замедляется при наложении окклюзионной повязки на область повреждения. Дело в том, что репаративные процессы инициируются при увеличении трансэпидермальной потери воды. При снижении скорости трансэпидермальной потери воды выработка высокоспециализированных липидов рогового слоя тормозится [2, 15]. Этот факт следует учитывать, например, при выборе памперса при пеленочном дерматите или при выборе повязок в процессе лечения травматических поражений или после хирургических манипуляций.
Несмотря на все косметологические инновации последних лет, важно помнить, что не все кремы, состоящие из вышеуказанных ингредиентов современной фармакокосметологии, могут одинаково применяться и хорошо переноситься всеми пациентами. Так, соотношение одних и тех же ингредиентов для пациентов детского возраста, назначенных в прогрессирующую стадию псориаза, может привести к ухудшению течения кожного патологического процесса, а примененного в стационарную стадию — к улучшению и ускорить разрешение поражений кожи. Аналогично назначение врачом эмолентов должно учитывать состояние кожного покрова у детей в различные стадии и возрастные фазы течения атопического дерматита, важно также учитывать и анатомическую область поражений при назначении того или иного средства.
Адекватное использование местного лечения с применением современных дерматологических технологий имеет высокую безопасность, обеспечивает стойкую ремиссию заболеваний, предупреждает их рецидивирование и значительно улучшает качество жизни маленьких пациентов и членов их семей.
Литература
- Аравийская Е. Р., Е. В. Соколовский, Соколов Г. Н. и соавт. Эритема лица, особенности диагностики и ухода за кожей // Клиническая дерматология и венерология. 2003. № 3. С. 69-73.
- Аравийская Е. Р., Соколовский Е. В. Барьерные свойства кожи и базовый уход: инновации в теории и практике // Вестник дерматологии и венерологии. 2010; 6; 135-139.
- Скрипкин Ю. К. Кожные и венерические болезни. Рук-во для врачей в 4-х т. Т. 3. М.: Медицина. 1995. С. 239-292.
- Суворова К. Н., Тогоева Л. Т., Гришко Т. Н. и соавт. Корнеотерапия при воспалительных и десквамативных дерматозах у детей // Вопросы современной педиатрии. 2005. Т. 4. № 6. С. 39-44.
- Kligman A. M. The biology of the stratum corneum. In: Montagna W., Lobitz M. C. The Epidermis. Jerusalem-New York: Academic press 1964; 387-433.
- Эрнандес Е., Марголина А., Петрухина А. Липидный барьер кожи и косметические средства. М.: ИД «Косметика и медицина», 2005. С. 9-37.
- Nickoloff B. J., Naidu Y. Perturbation of epidermal barrier function correlates with initiation of cytokine cascade in human skin // J. Am. Acad. Dermatol. 1994; 30 (4): 535-546.
- Намазова Л. С., Вознесенская Н. И., Сурков А. Г. Атопический дерматит // Лечащий Врач. 2006. № 4. С. 72-78.
- Мазитова Л. П. Роль микробной гиперсенсибилизации в развитии аллергодерматозов у детей // Вестник дерматологии и венерологии. 2007. № 2. С. 36-38.
- Leyden J. E., Marples R. R., Kligmann A. M. Stafhylococcus aureus in the lesion of atopic dermatitis // Br. J. Dermatol. 1974. Vol. 90. P. 525-530.
- Смирнова Г. И. Современные технологии местного лечения атопического дерматита у детей // Иммунопатология, аллергология, инфектология. 2003. № 3. С. 75-82.
- Галлямова Ю. А. Пеленочный дерматит и травматизация кожи у детей // Лечащий Врач. 2013; 9; 24.
- Mao-Qiang M., Feingold C. R., Thornfeld C. R., Tlias P. M. Optimization of physiological lipid mixtures for barrier repair // J. Invest. Dermatol. 1996. Vol. 106. P.1096-1101.
- Chang C., Eichenfield L. E. Quantitative assessment of combination bathing and moisturizing regimens on skin hydration in atopic dermatitis // Pediatric Derm. 2009; 26: 3: 273-278.
- Grubauer G., Elias P. M., Feingold K. R. Transepidermal water loss: the signal for recovery of barrier structure and function // J. Lipid. Res. 1989; 30: 323-330.
Н. Н. Мурашкин, доктор медицинских наук, профессор
Читайте также:
