Сиалоцеле полости рта - лучевая диагностика
Добавил пользователь Morpheus Обновлено: 22.01.2026
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России, 125284 Москва, 2-й Боткинский пр-д, д. 3, Российская Федерация
Научно-клинический и образовательный центр пластической хирургии Университетской клинической больницы №1 Первого МГМУ им. И.М. Сеченова, Москва, Россия
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздравсоцразвития России
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава России
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Первый Московский государственный медицинский университет им. И.М. Сеченова, Национальный научно-исследовательский медицинский радиологический центр Минздрава России, Институт повышения квалификации Федерального медико-биологического агентства, Москва
Возможности ультразвуковой диагностики опухолей языка и дна полости рта
Журнал: Онкология. Журнал им. П.А. Герцена. 2015;4(4): 18‑21
Цель исследования — изучение возможности ультразвукового исследования (УЗИ) в первичной и уточняющей диагностике рака языка и дна полости рта. Материал и методы. Исследование проводилось на аппарате GE logiq 9. Использовались режимы: B-режим, виртуальное конвексное сканирование расширяющее поле обзора, импульсно-волновой допплер PW, цветовое допплеровское картирование (ЦДК). Обследованы 128 больных: 54 (42,2%) с опухолями слизистой дна полости рта и 74 (57,8%) с опухолями языка. Мужчин было 92 (71,2%), женщин — 36 (28,8%), средний возраст составил 55 лет. По данным УЗИ проводилась оценка распространения на анатомически важные прилежащие структуры. Полученные данные сопоставлены с данными магнитно-резонансной томографии. Результаты. Опухолевые образования языка и дна полости рта эхографически во всех (99,2%) случаях выглядели как инфильтративные изменения преимущественно гипоэхогенной, гетерогенной и/или незначительно гетерогенной структуры (61%), с неровными (93,8%) и нечеткими (95,3%) контурами. В остальных (4,7%) случаях изменения были представлены узловыми образованиями, в этих же случаях контур был четкий, местами неровный. При ЦДК кровоток в большинстве (72,3%) случаев был усилен. В 3,3% случаев кровоток в опухоли не отличался от интенсивности кровотока в здоровой ткани, в остальных (24,4%) случаях отсутствовал. Заключение. УЗИ позволяет хорошо визуализировать опухолевые изменения слизистых оболочек полости рта и оценивать распространенность на важные анатомические структуры.
В настоящее время проблема борьбы со злокачественными новообразованиями не только является одной из наиболее актуальных в медицине, но и затрагивает социальные аспекты жизни общества. Среди причин смерти населения промышленно развитых стран злокачественные новообразования (ЗНО) занимают 2-е место. В общей структуре онкологической заболеваемости в России ЗНО полости рта составляют 2,2%. В период за 2001—2011 гг. в Российской Федерации смертность увеличилась с 8748 до 9176 человек [1].
По макроскопической картине выделяют экзофитные, эндофитные и смешанные формы роста рака слизистой оболочки полости рта. Экзофитные формы рака встречаются в 30% случаев, эндофитные формы составляют до 40%, смешанный тип роста наблюдается у 30% пациентов. По морфологической структуре 95% опухолей слизистой полости рта являются плоскоклеточным раком, у 5% больных выявляют аденокарциному.
Основной путь метастазирования при опухолях полости рта — лимфогенный. Метастазами поражаются преимущественно регионарные лимфатические узлы: вначале заглоточные и поднижнечелюстные, далее подбородочные и верхние шейные. В зависимости от стадии возможно дальнейшее распространение по лимфатическим путям (в надключичные узлы и узлы верхнего средостения). Для рака языка и дна полости рта характерно агрессивное течение и раннее метастазирование, которое зачастую носит двусторонний и перекрестный характер [2].
Для адекватного лечения рака языка и дна полости рта необходима информация о местной распространенности процесса, о степени вовлечения прилежащих органов и структур. Необходимо также исключение или подтверждение регионарного метастазирования. Общепринятой оценкой определения распространенности ЗНО языка и дна полости рта являются визуальный осмотр, пальпация, компьютерная и магнитно-резонансная томография (КТ, МРТ), цитологическое и гистологическое исследования.
В зависимости от локализации и распространенности опухолевого процесса выполняют следующие варианты операций: резекция половины языка, комбинированная резекция языка и дна полости рта. В объем вышеперечисленных операций часто входит удаление групп регионарных лимфатических узлов (в зависимости от их распространенности и характера). Такие объемы оперативного вмешательства при данной локализации опухоли приводят к инвалидизации пациентов. Несмотря на то что ЗНО языка и дна полости рта относятся к опухолям визуальной локализации, диагноз нередко ставят уже на поздних стадиях, когда процесс имеет выраженное местное распространение, вовлечение прилежащих органов и структур с вторичным поражением регионарных лимфатических узлов. Около 34% пациентов погибают на первом году от момента установления диагноза [1, 3].
Основными методиками лучевой диагностики опухолевого поражения дна полости рта и языка являются КТ и МРТ. В мировой литературе имеется множество работ, посвященных роли КТ и МРТ в диагностике данной патологии. В этих работах представлены возможности лучевой диагностики первичного очага полости рта и его распространенности. Чувствительность и специфичность МРТ и КТ в выявлении первичного очага и дифференциальной диагностике его с неопухолевым поражением полости рта колеблется от 75 до 96% [4—10]. Детально изучены возможности методов лучевой диагностики в определении размера опухоли (по сравнению с данными гистологического исследования) и распространения плоскоклеточного рака на анатомически важные структуры в работах A. Imaizumi и соавт. [12] и P. Lam и соавт. [13]. Авторы показали высокую корреляцию (0,83), а также высокую чувствительность и специфичность — 96 и 54% для МРТ, 100 и 88% для КТ соответственно. Большинство работ демонстрирует высокую корреляцию между размером опухоли в гистологических препаратах и данными МРТ и К.Т. Однако имеются единичные работы, в которых показана низкая корреляция между размером опухоли в гистологических препаратах и данными МРТ-исследования [8].
Исследований, посвященных изучению возможности ультразвуковой диагностики рака языка и дна полости рта, в доступной литературе немного, а результаты неоднозначны, так как в них не проводится оценка чувствительности и специфичности метода. Наиболее интересна работа M. Keberle и соавт. [10], в которой проведено сравнение возможности ультразвукового исследования (УЗИ) с КТ и МРТ в диагностике рака языка и дна слизистой полости рта. Авторами показано, что результативность КТ и УЗИ практически одинакова (коэффициент корреляции 0,98), при этом УЗИ не сопровождается лучевой нагрузкой. С учетом появления современных ультразвуковых аппаратов экспертного класса, позволяющих получить большое количество информации об изменениях в интересующей области, мы решили изучить возможности УЗИ в первичной и уточняющей диагностике рака языка и дна полости рта.
Были обследованы 128 больных: 54 (42,2%) — с опухолями слизистой дна полости рта и 74 (57,8%) — с опухолями языка; из них 92 (71,2%) мужчины и 36 (28,8%) женщин (медиана возраста — 55 лет). Все больные были разделены в зависимости от стадии заболевания: I стадия — 11 (9%), II — 42 (34,4%), III — 35 (28,7%) и IV — 34 (27,9%) больных. Размер опухоли составлял не менее 1,5 см в наибольшем измерении.
У 124 (96,9%) пациентов был диагностирован плоскоклеточный рак слизистой полости рта. Из них у 71 (57,25%) имелся плоскоклеточный рак слизистой языка, у 53 (42,75%) — плоскоклеточный рак слизистой дна полости рта (с разной степенью дифференцировки и склонностью к ороговению). У 4 (3,1%) пациентов диагностированы злокачественные опухоли полости рта другой морфологической структуры: у 1 (0,775%) выявлена лейомиосаркома дна полости рта, у 1 (0,775%) — аденокистозный рак языка, у 1 (0,775%) — аденокарцинома языка, у 1 (0,775%) — мукоэпидермоидный рак языка.
Для уточнения морфологической структуры опухолей языка и дна полости рта и оценки изменений регионарных лимфатических узлов, проводили тонкоигольную аспирационную пункцию и трепанобиопсию под контролем УЗИ. Все результаты УЗИ сопоставляли с морфологическим заключением.
Опухолевые образования языка и дна полости рта эхографически во всех случаях (99,2%) выглядели как инфильтративные изменения преимущественно гипоэхогенной, гетерогенной и/или незначительно гетерогенной структуры (61%), с неровными (93,8%) и нечеткими (95,3%) контурами. В остальных случаях изменения были представлены узловыми образованиями (4,7%), в которых контур был четкий, местами неровный. При цветовом допплеровском картировании кровоток в большинстве случаев (72,3%) был усилен. В 3,3% случаев кровоток в опухоли не отличался по интенсивности от кровотока в здоровой ткани, в остальных (24,4%) случаях отсутствовал. При сопоставлении стадии, возраста и степени выраженности кровотока имелась прямая корреляционная зависимость, т. е. с увеличением стадии и возраста пациента кровоток будет усилен больше, а с увеличением размера опухоли ее структура стремится от гомогенной к гетерогенной.
Возможности аппаратуры позволяют в 100% случаев в процессе УЗИ оценить распространенность опухоли языка на следующие анатомически важные структуры: 1) язычную артерию; 2) подъязычную артерию; 3) распространение за срединную линию языка и дна полости рта при одностороннем поражении.
Нами разработана методика исследования нормальной анатомии полости рта и описан ход язычной артерии. Язычная артерия в норме визуализируется во всех случаях. Вовлечение артериального сосуда в опухолевый процесс характеризует следующая эхографическая картина: стенка сосуда расположена вблизи опухоли; нет неизмененной ткани между опухолью и стенкой сосуда; при компрессии датчиком сосуд и опухоль не смещаются друг относительно друга (рис. 1).
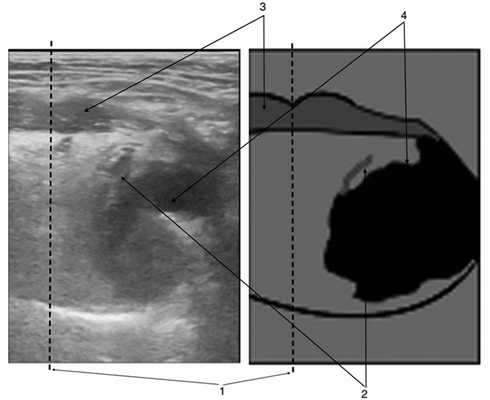
Рис. 1. Опухоль языка, вовлекающая язычную артерию и распространяющаяся на дно полости рта.
Если опухоль была расположена в средних отделах языка, то во всех случаях нам удалось выявить ее распространение на мышцы дна полости рта. В проекции корня языка опухоли визуализировались гораздо хуже. Опухоли не были выявлены у 2 (14%) пациентов с установленным диагнозом рак слизистой корня языка. Опухолевые образования в проекции корня языка, определенные при УЗИ, составили около 15 мм в наибольшем измерении и имели толщину 9±2 мм. Ограничения в диагностике опухоли в области корня языка связаны с использованием полостного датчика определенной конфигурации и невозможности создать полноценный контакт между сканирующей поверхностью датчика и поверхностью языка в области корня. Вследствие этого при опухоли, расположенной в области корня языка, исследование проводится через подчелюстные и подбородочную области либо через передние отделы языка в продольном сечении. При данных методиках исследуемая область расположена максимально далеко от датчика, что ведет к снижению качества получаемой эхограммы.
При исследовании опухолей переднего отдела дна полости рта также у всех 100% пациентов удалось определить распространение процесса за срединную линию, на мышцы основания языка. Размер опухоли дна полости рта составлял не менее 10×7 мм. Опухоли небольшого размера преимущественно локализовались в задних отделах дна полости рта, а большого размера могли располагаться в любой части дна полости рта. Благодаря этому все опухоли удалось визуализировать. Можно предположить, что небольшие опухоли слизистой дна полости рта (минимальные в нашей выборке) могут не визуализироваться в передних отделах данной области (вблизи слизистой альвеолярного отростка нижней челюсти), в результате невозможности полноценного контакта сканирующей поверхности датчика и опухоли (см. таблицу).

Распределение больных раком языка и дна полости рта в зависимости от распространенности процесса Примечание. Процентное соотношение рассчитывали относительно общего количества пациентов в представленной выборке; у одного пациента могло быть распространение процесса на несколько областей.
При сопоставлении размера опухоли, по данным УЗИ и МРТ, прослеживается корреляционная зависимость.
При анализе полученных данных с использованием программного пакета Statistica 10 (рис. 2, 3), размеры опухолевых образований дна полости рта и языка, по данным УЗИ и МРТ, имели достаточно высокую корреляцию (0,68). Размеры, полученные при измерении опухоли разными способами, статистически недостоверны, p>0,05.
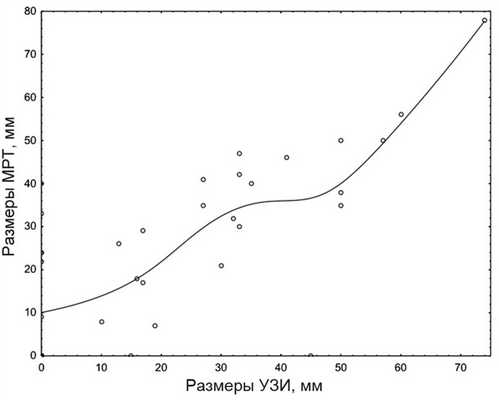
Рис. 2. Зависимость размеров опухолей дна полости рта и языка по данным МРТ и УЗИ.
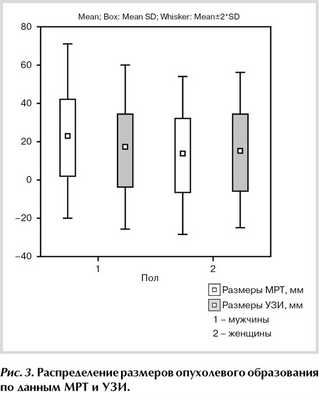
Рис. 3. Распределение размеров опухолевого образования по данным МРТ и УЗИ.
Заключение
Ультразвуковой метод позволяет визуализировать опухоли языка, локализованные преимущественно в его передних отделах, оценить распространение опухоли на анатомически важные структуры. Опухоли в проекции корня языка выявить более затруднительно в связи с невозможностью полноценного контакта сканирующей поверхности датчика с поверхностью языка при поверхностных образованиях. Опухоли дна полости рта хорошо визуализируются, если имеют нестелящийся характер и расположены ближе к основанию языка. Существенно легче осматривать опухоли значительного размера.
Лучевая диагностика. Полость рта и челюстно-лицевая область - Кениг Лиза Дж.
Книга посвящена вопросам лучевой диагностики заболеваний полости рта, нижней и верхней челюстей, зубов, височно‑нижнечелюстного сустава, верхнечелюстных пазух и полости носа, жевательного и околоушного пространств. Особое внимание уделено злокачественным опухолям, доброкачественным новообразованиям, воспалительным и дегенеративным заболеваниям, а также порокам развития. В издание включено более 3000 иллюстраций.
Книга предназначена для специалистов по лучевой диагностике, челюстно-лицевых хирургов и оториноларингологов.
Мы с большой гордостью представляем вам второе издание из серии Diagnostic Imaging, посвященное лучевой диагностике заболеваний полости рта и челюстно-лицевой области. Как и первое издание, книга делится на три части: «Анатомия», «Диагностика» и «Дифференциальная диагностика». В часть «Анатомия» была добавлена глава о задних отделах основания черепа, что отражает растущую потребность рентгенологов, исследующих полость рта и челюстно-лицевую область, в интерпретации больших полей обзора. В связи с этим в диагностическую часть включены 18 новых глав, посвященных наиболее распространенным заболеваниям шейного отдела позвоночника. Также были расширены главы, посвященные оценке ВНЧС и дыхательных путей. Часть «Диагностика» теперь включает в себя более 200 глав.
Во второе издание также вошли новые рисунки наших профессиональных иллюстраторов, прекрасно отражающие анатомические и диагностические детали и призванные интенсифицировать накопление диагностического опыта. Каждую главу коснулось тщательное обновление литературных ссылок и диагностических изображений там, где возникла такая необходимость.
Мы надеемся, что второе издание, как и первое, понравится и начинающим, и опытным специалистам, в том числе оториноларингологам, челюстно-лицевым хирургам и онкологам. Для специалистов по лучевой диагностике эта книга, несомненно, также послужит ценным дополнением к третьему изданию руководства «Лучевая диагностика. Голова и шея».
Содержание книги "Лучевая диагностика. Полость рта и челюстно-лицевая область"
Рак языка и полости рта - симптомы и лечение
Что такое рак языка и полости рта? Причины возникновения, диагностику и методы лечения разберем в статье доктора Опря Анны Николаевны, онколога со стажем в 12 лет.
Над статьей доктора Опря Анны Николаевны работали литературный редактор Юлия Липовская , научный редактор Татьяна Остринская и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Рак языка и полости рта (сancer of the tongue and mouth) — это злокачественная опухоль, развивающаяся на слизистой оболочке передних 2/3 языка, дна полости рта, щёк, нёба и дёсен. Опухоль на корне языка относится уже к группе злокачественных новообразований ротоглотки.
Синонимы: карцинома слизистой оболочки полости рта.
Чаще всего рак слизистой оболочки полости рта проявляется в виде безболезненной незаживающей язвы или уплотнения. Из-за этого опухоль часто путают с травмой слизистой оболочки и не обращают на неё внимания, считая, что всё пройдёт самостоятельно. По статистике, 65 % пациентов обращаются к врачу только на III-IV стадии рака [1] .
Распространённость
97 % злокачественных опухолей полости рта представлены плоскоклеточным ороговевающим раком, происходящим из эпителиальных клеток, которые покрывают слизистую оболочку ротовой полости [3] [17] . В 3 % рак полости рта представлен злокачественными опухолями малых слюнных желёз. Кроме карциномы (рака), есть и другие злокачественные опухоли полости рта: саркома, меланома и лимфома.
Наиболее часто, примерно в 52 % случаев, рак полости рта локализуется на подвижной части языка. Дно полости рта поражается в 20 % случаев, слизистая оболочка щёк — в 7 % случаев. Поражение остальных отделов полости рта встречается реже: частота рака твёрдого нёба — 4 %, альвеолярного отростка нижней и верхней челюсти челюсти — 6 и 4 %, мягкого нёба — 5 %, передних нёбных дужек — 2 % [26] .
Мужчины болеют примерно в 3,5 раза чаще женщин. Средний возраст заболевших составляет 61 год [1] .
Причины рака языка и полости рта
Алкоголь и табак. 75 % всех злокачественных опухолей слизистой оболочки полости рта связаны с употреблением алкоголя и табака, в том числе бездымного (т. е. жевательного) [18] . По данным исследования, курение более 40 сигарет в день в 7 раз повышает риск развития рака полости рта, а потребление более 800 г крепких спиртных напитков в неделю — в 6 раз. У мужчин, которые курят более 40 сигарет в день и выпивают более 800 г крепких спиртных напитков в неделю, риск развития рака полости рта выше в 38 раз по сравнению с некурящими и непьющими людьми [19] . Жевание ореха бетеля, характерное для жителей стран Восточной Азии и Индии, также относится к факторам риска развития рака полости рта [3] [20] .
Хроническое воспаление. При пародонтите риск развития рака полости рта повышается в 2-5 раз. Считается, что это связано с различиями в составе микробиоты (совокупности микроорганизмов) полости рта [3] [5] .
Хронические травмы слизистой оболочки от острых краёв зубов или пломб, неправильно подобранных протезов или имплантов. Также травма может появиться из-за поведенческих привычек, например прикусывания слизистой оболочки [4] .
Эпителиальные поражения полости рта, которые могут стать злокачественными:
- — вероятность озлокачествления от 0 до 12,5 %, по данным разных авторов; — вероятность перехода в рак 2-3 % в год;
- эритроплакия — встречается крайне редко, однако риск озлокачествления доходит до 85 %;
- подслизистый фиброз — злокачественный потенциал 9 % [7][10][11][14] .
Вирус папилломы человека (ВПЧ). Это распространённый вирус, который не причиняет вреда большинству людей и проходит самостоятельно. В то же время он может вызвать изменения, приводящие к раку. Более 90 % опухолей, связанных с ВПЧ, вызваны 16-м типом вируса [6] . ВПЧ-ассоциированный рак более характерен для злокачественных поражений ротоглотки.
Пищевые привычки. К таким привычкам относится недостаток микронутриентов (особенно витамина А) из-за низкого потребления фруктов и овощей, а также употреблением слишком горячей и пряной пищи [8] [12] . Пищевые привычки вызывают рак полости рта в 10-15 % случаев.
Некоторые наследственные заболевания: пигментная ксеродерма, синдром Ли — Фраумени, системная красная волчанка, склеродермия и атаксия-телеангиэктазия. При этих болезнях риск развития рака, в том числе полости рта, выше из-за нарушения механизмов восстановления ДНК [12] .
Кислоты, щёлочи и другие химические вещества в виде паров и аэрозолей, например на химическом предприятии. Они повышают риск развития злокачественных новообразований языка и полости рта.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы рака языка и полости рта
Слизистую оболочку полости рта можно осмотреть самостоятельного. Это позволяет выявить рак на ранних стадиях без дополнительной диагностики.
Рак слизистой оболочки полости рта имеет три формы роста:
- Экзофитный — больший компонент опухоли растёт над слизистой оболочкой, выглядит как бляшкообразный, грибовидный нарост с чёткими границами.
- Эндофитный — опухоль распространяется вглубь без чётких границ, выглядит как язва или уплотнение.
- Смешанная форма.
![Экзофитный и эндофитный рост опухоли [24, 27]](https://probolezny.ru/media/bolezny/rak-yazyka/ekzofitnyy-i-endofitnyy-rost-opuholi-24-27_s_NduxucM.jpg)
Возможные симптомы рака слизистой оболочки полости рта:
- Непроходящее красное, розовато-красное или белое пятно, язва или узловое образование на слизистой оболочке каменистой плотности. При контакте, например при чистке зубов, эти изменения могут кровоточить.
- Постоянная боль в горле, боль при глотании, не связанная с простудой. Жжение и болезненность в поражённой области. Редко может беспокоить боль в ухе.
- Нарушение подвижности языка, если опухоль располагается в этой области, и связанное с этим изменение речи.
- Проблемы с глотанием, попёрхивание, если опухоль находится рядом с корнем языка.
- Увеличение лимфоузлов на шее.
- Необъяснимые кровотечения из языка вне травм и прикусывания.
- Онемение во рту, которое не проходит (встречается нечасто).
Перечисленные симптомы могут быть вызваны и другими заболеваниями, поэтому нужно проконсультироваться с врачом.
Как заявляет Всемирная организация здравоохранения (ВОЗ), если поражение в полости рта не проходит в течение двух недель после того, как устранили местные причины раздражения, нужно сделать биопсию [5] .
Патогенез рака языка и полости рта
Рак слизистой оболочки полости рта возникает из-за мутаций ДНК, влияющих на несколько различных генов. Часто мутации возникают спонтанно, в то же время факторы риска изменяют соотношение между мутагенными сигналами и врождёнными защитными механизмами.
Есть гены, которые регулируют клеточный цикл от момента её образования путём деления материнской клетки до собственного деления или гибели:
- Протоонкогены — это нормальные гены клеток, которые отвечают за размножение. В зрелых клетках они, как правило, неактивны, но под воздействием разных факторов могут активироваться и превратиться в онкогены, которые вызывают бесконтрольное деление клеток.
- Антионкогены — гены, которые подавляют размножение клеток.
Если соотношение этих генов нарушается, клетки начинают бесконтрольно делиться, что приводит к образованию злокачественного новообразования [13] [15] .
Когда генетические поломки накапливаются, клетки становятся автономными и проникают через базальную мембрану эпителия. Затем опухолевые клетки с током крови и лимфы перемещаются в другие ткани и органы, т. е. дают метастазы. Для рака языка на первом этапе наиболее характерно поражение лимфоузлов шеи, на втором этапе — метастазирование в отдалённые органы (лёгкие и печень, редко кости и др.).
Особенности развития рака полости рта в зависимости от причин
Различные вещества повреждают различные гены. По сути, под раком слизистой оболочки полости рта подразумевают разнородную группу плоскоклеточного рака, развившегося в одной анатомической области по разным причинам. Изучение генетики злокачественных опухолей полости рта позволит предсказывать поведение опухоли и осуществлять таргетную терапию, которая воздействует только на клетки опухоли без повреждения здоровых клеток организма.
Отличительной особенностью опухолей, связанных с курением, является высокая мутационная нагрузка. Это значит, что на ткани регулярно воздействует большое количество канцерогенов, включая специфические для табака нитрозамины, полициклические ароматические углеводороды и летучие органические соединения. Кроме этого, из-за воздействия табачного дыма на организм в целом могут появиться множественные очаги поражения в пределах пищевода, желудка, печени и поджелудочной железы, реже в двенадцатиперстной кишке.
В хроническом воспалении наибольшую роль оказывают бактерии Fusobacterium nucleatum и Porphyromonas gingivalis. Они способствуют тому, что клетка, пройдя весь свой цикл, не умирает, как это должно происходить в норме, а продолжает размножаться [3] [15] .
ВПЧ интегрирует свой геном ДНК в ядро клетки-хозяина, и клетки начинают вырабатывать онкопротеины E6 и E7. В результате нарушается процесс запрограммированной гибели клеток, который необходим для восстановления ДНК хозяина. Клетки, которые вырабатывают E6, становятся генетически нестабильными. Белок E7 нарушает клеточный цикл и приводит к размножению клеток и их злокачественной трансформации [6] .
Классификация и стадии развития рака языка и полости рта
Осложнения рака языка и полости рта
Образование в области языка может нарушать его подвижность. Если у человека не будет двигаться язык, он не сможет нормально сформировать пищевой комок и проглотить его.
Если опухоль распространяется на область височно-нижнечелюстного сустава, человеку труднее открывать рот и сложнее пережёвывать пищу. В запущенных формах человек вообще не может открыть рот, даже чтобы выпить воду. В этом случае потребуется установить гастростому (искусственный вход в полость желудка через переднюю брюшную стенку).
При распространённом процессе, который затрагивает надгортанник, слюна вместо пищевода будет попадать в трахею и приведёт к пневмонии. В этом случае может потребоваться трехеостома (искусственно созданное отверстие в трахее, которое позволяет пациенту дышать).
Злокачественная опухоль способна как прорастать в кровеносные сосуды, так и образовывать новые сосуды. Поэтому при распаде большой опухоли может возникнуть кровотечение.
Неспецифические осложнения рака слизистой оболочки полости рта:
- — отсутствие аппетита. Это состояние часто сопровождает хронические заболевания на поздней стадии. Важно понимать, что отсутствие аппетита может быть вызвано не только самой опухолью, но и сопутствующими состояниями: изменением вкуса, наличием тошноты, сухостью в полости рта, расстройством пищеварения, усталостью, депрессией и хроническим болевым синдромом. Сопутствующие состояния могут быть связаны как с самим раком так и с его лечением. Для коррекции анорексии важно понимать, почему она возникла. Например, если причина в депрессии, то нужна будет помощь психолога или психиатра [21] . — общее похудание и истощение. Основная роль в развитии кахексии принадлежит полипептидам и цитокинам. Они запускают в организме различные изменения, приводящие к гиперметаболизму (повышенному расходу энергии в состоянии покоя), который характерен для онкологического процесса. При кахесии, кроме общего истощения, иногда наблюдается депрессия и расстройство пищеварения, вызванное снижением сократительной активности мышц желудка. — низкий уровень гемоглобина (меньше 120 г/л) или его снижение более чем на 20 г/л от исходного значения. Может быть обусловлена как наличием самой опухоли, так и её лечением [22] .
В запущенном периоде опухоль разрушает окружающие ткани: преддверие рта, кости, кожу и мышцы с последующим некрозом (омертвением) тканей.
Диагностика рака языка и полости рта
При обнаружении незаживающей язвы или уплотнения на слизистой оболочке полости рта нужно обратиться к стоматологу, парадонтологу, специалисту по патологии слизистой оболочки полости рта или оториноларингологу. Если жалобы беспокоят белее двух недель, лучше сразу идти к онкологу, который специализируется на опухолях головы и шеи.
Осмотр
Диагностика начинается с клинического осмотра полости рта, который состоит из визуального осмотра и пальпации (прощупывания). Тщательное клиническое обследование позволяет выявить до 99 % случаев рака языка и полости рта [23] .
Инструментальная диагностика
- Фиброларингоскопия (ФЛС). Это обследование гортани и глотки с помощью гибкого эндоскопа с видеокамерой на конце. Обычно проводится, если опухоль распространяется на корень языка. Но, в зависимости от выраженности рвотного рефлекса у пациента и его анатомических особенностей, опытный ЛОР-онколог в большинстве случаев может рассмотреть опухоль и без ФЛС.
- Биопсия. При этом исследовании берут небольшие образцы ткани опухоли, чтобы установить её морфологическую структуру. Биопсию нужно проводить при всех подозрительных поражениях. Это наиболее информативный метод диагностики рака любой локализации.
- УЗИ языка. Позволяет определить, насколько глубоко проникла опухоль. Если есть техническая возможность, это исследование нужно выполнять всем пациентам со злокачественными новообразованиями языка.
- КТ и/или МРТ поражённой области с внутривенным контрастированием. Выполняется, чтобы оценить первичную распространённость опухоли, глубину её проникновения, наличие инвазии в кости нижней или верхней челюсти, основание черепа или в окружающие мягкие ткани. Если нет противопоказаний, МРТ рекомендуется при планировании лучевой или химиолучевой терапии.
- УЗИ лимфоузлов шеи с пункцией изменённых лимфоузлов. Исследование показывает, затрагивает ли опухолевый процесс регионарные лимфоузлы.
- УЗИ органов брюшной полости и забрюшинного пространства. Позволяет исключить метастазы в этих областях.
- Рентгенография органов грудной клетки или КТ. Проводится, чтобы выявить отдалённые метастазы и заболевания, которые могут повлиять на тактику лечения: туберкулёз, саркоидоз, пневмонию, рак лёгкого и т. д.
- ПЭТ/КТ с флудезоксиглюкозой. В некоторых случаях это исследование рекомендуется пациентам с III-IV стадиями, чтобы исключить отдалённые метастазы. Также оно может проводиться по индивидуальным показаниям [17][18] .
Лабораторная диагностика
Иммуногистохимическое исследование белка p16. Повышение его уровня указывает на предраковые изменения, связанные с ВПЧ-инфекцией. Этот анализ позволяет выявить рак на ранней стадии [16] .
Дифференциальная диагностика
Рак полости рта нужно отличать от доброкачественных опухолей языка (фибромы, миомы, липомы, гемангиомы, лимфангиомы), одной из форм первичного сифилиса, туберкулёзной язвы, лейкоплакии и эритроплакии.
![Лейкоплакия языка [29]](https://probolezny.ru/media/bolezny/rak-yazyka/lyaykoplakiya-yazyka-29_s.jpg)
Лечение рака языка и полости рта
Основным методом лечения рака слизистой оболочки полости рта остаётся хирургический. Также может применяться лекарственное лечение, лучевая терапия или их комбинация.
Первичный рак рекомендуется удалять единым блоком вместе с лимфоузлами на шее. Это позволяет снизить риск рецидива. Объём лимфодиссекции зависит от размеров опухоли и наличия метастазов в лимфоузлах шеи.
При наличии неблагоприятных факторов прогноза после операции назначается лучевая или химиолучевая терапия. К таким факторам относят:
- III-IV стадию;
- метастазы в одном или нескольких лимфоузлах;
- прорастание опухоли за капсулу лимфоузла;
- периневральную инвазию (распространение опухолевых клеток на нервы);
- опухолевые эмболы в лимфатических сосудах.
Если есть абсолютные противопоказания к оперативному вмешательству или пациент отказывается от операции:
- при I и II стадиях рекомендуется провести дистанционную лучевую терапию или брахитерапию в самостоятельном варианте , при которой источник излучения располагается как можно ближе к опухоли или непосредственно в ней;
- при III и IV стадиях выполняется химиолучевое лечение.
Лечение опухоли, которую нельзя удалить хирургическим путём
Хирургическое лечение не целесообразно в следующих случаях:
- стадия Т4b (опухоль прорастает в крылонёбную ямку, боковую стенку глотки или основание черепа; или затрагивает внутреннюю сонную артерию);
- опухоль распространилась из регионарных лимфоузлов на кожу, такое встречается при запущённых формах;
- опухоль распространилась на структуры средостения, предпозвоночную фасцию или шейные позвонки.
При изначально неоперабельном процессе выбор метода лечения зависит от общего состояния пациента [17] . Может проводиться один из вариантов лечения:
- Химиолучевая терапия или индукционная полихимиотерапия с последующим проведением дистанционной лучевой или химиолучевой терапии. Далее решается вопрос о хирургическом лечении.
- Дистанционная лучевая терапия +/- конкурентная химиотерапия (в зависимости от общего состояния).
- Паллиативная дистанционная лучевая терапия, или монохимиотерапия, или паллиативная помощь [24] .
Прогноз. Профилактика
Прогноз заболевания определяется стадией. Общая 5-летняя выживаемость составляет 85 % для I стадии, 75 % для II стадии, 60 % для III стадии, 30 % для IV стадии. При распространённых стадиях прогноз неблагоприятный [25] .
Профилактика рака языка и полости рта
Чтобы предотвратить развитие рака слизистой полости рта, необходимо:
- отказаться от вредных привычек: курения, приёма алкоголя, жевания бетеля;
- устранить причины, травмирующие слизистую оболочку полости рта: острые края зубов или пломб, неправильно подобранные зубные протезы или импланты;
- соблюдать гигиену полости рта;
- регулярно самостоятельно осматривать ротовую полость;
- проходить профилактические осмотры у стоматолога, своевременно лечить периодонтит.
Когда канцерогенный процесс уже начался, основой вторичной профилактики является своевременное обследование и раннее лечение предраковых заболеваний полости рта и рака на ранних стадиях.
Несмотря на то, что всё больше людей узнают о раке полости рта, процент пациентов, которые обращаются за медицинской помощью с запущенным заболеванием, за последние 40 лет существенно не изменился.
Рак языка и полости рта может возникнуть у любого человека, но чаще он развивается под воздействием факторов риска. Большинство этих факторов возможно устранить, поэтому рак полости рта можно рассматривать как заболевание, которое можно предотвратить [3] [5] .
Сиалоцеле полости рта - лучевая диагностика
НИО гибридных технологий лучевой медицины Первого МГМУ им. И.М. Сеченова Минздрава России, Москва, Россия, 119991
Лучевая диагностика одонтогенного верхнечелюстного синусита
Журнал: Вестник оториноларингологии. 2017;82(2): 46‑50
Цель исследования — проанализировать возможности таких методов лучевой диагностики, как рентгенография, мультиспиральная компьютерная томография (МСКТ) и конусно-лучевая компьютерная томография (КЛКТ) в диагностике одонтогенного верхнечелюстного синусита, а также описать изменения верхнечелюстных синусов, выявляемые с помощью вышеуказанных методов. Были обследованы 166 пациентов с верхнечелюстным синуситом в возрасте от 21 до 81 года, всем пациентам было проведено рентгенологическое исследование. Выявлена низкая эффективность проекционных методов рентгенографии. Применение компьютерной томографии позволило из 166 обследованных пациентов у 110 (66,2%) больных верифицировать диагноз, определить рентгенологические признаки одонтогенной этиологии выявленных изменений и грамотно подобрать дальнейшую тактику лечения. МСКТ и КЛКТ является наиболее информативными методами в диагностике изменений верхнечелюстных синусов одонтогенной этиологии.
Несмотря на значительный прогресс стоматологической помощи населению, в последние годы отмечается увеличение заболеваемости одонтогенным верхнечелюстным синуситом (ОВЧС), что связано со стремительным развитием интервенционной стоматологии [1, 2]. ОВЧС занимает одно из ведущих мест среди воспалительных процессов одонтогенной этиологии [1—4]. Связь ОВЧС с заболеванием зубов зачастую недооценивается специалистами, особенно если она не является очевидной, а зачастую ОВЧС рассматривается как риногенный, что может приводить к неправильному ведению пациентов. В первую очередь это касается хронических форм одонтогенного синусита при относительно бессимптомном его течении [4—8].
По данным отечественных и зарубежных исследователей, ОВЧС составляет не менее 5—8% от общего числа воспалительных заболеваний челюстно-лицевой области [9, 10]. Это объясняется тем, что очаги хронической одонтогенной инфекции не всегда удается установить при визуальном осмотре полости рта. Также они могут быть сопутствующими при риногенной форме синусита и усугублять его течение. Нередко хронический ОВЧС выявляется случайно при рентгенологическом исследовании костей лицевого черепа по поводу другой патологии [5, 7].
Частой причиной развития ОВЧС являются ошибки в эндодонтическом лечении зубов и стоматологической имплантации — проведение инструментов для обработки корневых каналов (корневые иглы, дрильборы, каналонаполнители, пульпэкстракторы), а также пломбировочного материала и импланта за верхушку корня зуба в полость пазухи. Реже инородными телами в полости синусов являются фрагменты корней зубов [1, 2, 5, 12]. К причинам развития ОВЧС также относят инфицирование пазухи при оперативном вмешательстве с перфорацией дна полости верхнечелюстного синуса: наиболее часто (до 80%) при случайном вскрытии пазухи при экстракции и кюретаже лунки после экстракции первого и второго моляров верхней челюсти, реже — при резекции верхушки корня, цистэктомии, удалении ретинированных зубов, секвестрэктомии, подсадке зубного имплантата, удалении новообразования этой области [1, 10, 15].
Ведущая роль в диагностике ОВЧС по-прежнему остается за лучевыми методами исследования. Традиционно для оценки околоносовых синусов, в том числе верхнечелюстных, применяется рентгенография в носо-подбородочной проекции, обзорные рентгенограммы черепа в прямой и боковых проекциях. Для визуализации зубов используются ортопантомография или внутриротовая контактная рентгенография, которые не позволяют достоверно оценить состояние верхнечелюстных синусов [11—14]. С внедрением современных высокотехнологичных методов лучевой диагностики — мультиспиральной компьютерной томографии (МСКТ), конусно-лучевой компьютерной томографии (КЛКТ), магнитно-резонансной томографии (МРТ) — многие врачи стали отказываться от классических рентгенологических методик ввиду их малой информативности [12—14]. При этом в протоколы описания околоносовых синусов не всегда включаются данные о состоянии альвеолярного отростка, зубов верхней челюсти [11, 13]. Это может привести к несвоевременной диагностике и различным местным и общим осложнениям у таких пациентов [15, 16].
Цель исследования — определение возможностей современных лучевых методов исследования — МСКТ и КЛКТ — в диагностике воспалительных изменений верхнечелюстных синусов (ВЧС) одонтогенной этиологии.
Пациенты и методы
В период с 2013 г. по 2015 г. в отделении лучевой диагностики УКБ № 1 Первого МГМУ им. И.М. Сеченова были обследованы 166 пациентов с верхнечелюстными синуситами различной этиологии. У 110 больных (66,2%) была подтверждена одонтогенная этиология заболевания. Анализ распределения больных в соответствии с возрастом и полом показал, что из обследованных больных с ОВЧС большинство — 91 (54,8%) человек — были в молодом и зрелом возрасте от 21 года до 60 лет. Пациентов старше 60 лет было 19 (11,4%) человек, средний возраст пациентов составил 48 лет (от 21 до 81 года). Преобладали лица женского пола (62 (37,3%) женщины и 48 (28,9%) мужчин) трудоспособного возраста.
Сопоставление клинических проявлений одонтогенного ВЧС и рентгенологической картины позволило условно объединить пациентов в две группы: 66 (39,7%) пациентов с острым воспалительным процессом в верхнечелюстном синусе имели соответствующие клинические симптомы заболевания, а 44 (26,5%) пациента жалоб со стороны верхнечелюстных синусов не предъявляли (воспалительный процесс в верхнечелюстном синусе был хроническим).
Комплексное рентгенологическое исследование проводилось во всех случаях. Всем больным была выполнена компьютерная томография (МСКТ или КЛКТ): МСКТ — 76 (45,8%) пациентам, КЛКТ — 90 (54,2%) пациентам. 122 (73,5%) пациентам была выполнена рентгенография околоносовых синусов в носо-подбородочной, полуаксиальной проекциях. Для уточнения состояния зубов верхней челюсти проводилась ортопантомография (n=166, 100%) и внутриротовая контактная рентгенография (n=12, 7,3%).
При оценке и анализе диагностических изображений критериями одонтогенного синусита были следующие признаки: наличие инородного тела металлической плотности, соответствующего пломбировочному материалу или имплантату в полости синуса; глубокий кариес и признаки периодонтита премоляров и моляров верхней челюсти; разрушение нижней костной стенки верхнечелюстных синусов в области патологически измененных зубов.
Результаты и обсуждение
Анализ результатов методов лучевой диагностики позволил выявить признаки ОВЧС в 110 (66,2%) из 166 случаев. 66 (39,7%) пациентов имели характерные клинические симптомы заболевания (головная боль, субфебрильная температура, нарушение сна, ощущение тяжести в соответствующей половине лица при наклоне головы кпереди, заложенность носа только с одной стороны); эти больные были направлены на лучевое обследование оториноларингологами. Остальные 44 (26,5%) человека жалоб со стороны верхнечелюстных синусов не предъявляли; ранее они были направлены на обследование стоматологами и челюстно-лицевыми хирургами по следующим показаниям: 22 (13,2%) пациента — для уточнения стоматологического статуса, 12 (7,3%) пациентов — перед дентальной имплантацией, 10 (6%) пациентов — для послеоперационного контроля после хирургических вмешательств на верхней челюсти. В этих случаях выявленное воспаление верхнечелюстного синуса было диагностической находкой.
Как известно, острое одонтогенное воспаление верхнечелюстного синуса развивается в течение 1—3 дней. Достаточно часто причиной является воспалительный процесс верхней челюсти (острый или обострение хронического). К таким состояниям относят осложнения кариеса зубов, периодонтиты, периостит, остеомиелит, а также нагноение кист зубов или гранулем [7, 8].
Характерными жалобами пациентов с острым верхнечелюстным синуситом были: затруднение носового дыхания, ринорея, потеря обоняния, головная и лицевая боль, ощущение тяжести в соответствующей половине лица при наклоне головы кпереди, субфебрильная лихорадка, а также ночной кашель и нарушение сна. Одонтогенный синусит в отличие от риногенного имеет следующие отличительные признаки: изолированное поражение одного из верхнечелюстных синусов, боль в зубе или в пародонтальных тканях, предшествующая заболеванию, нарушение конфигурации лица в результате отека мягких тканей щеки и боль при пальпации переднелатеральной стенки верхнечелюстной пазухи.
При остром синусите на рентгенограммах определялась утолщенная слизистая оболочка, затемнение и уровень жидкости. При хроническом синусите отмечалось снижение прозрачности синуса.
При оценке и анализе диагностических изображений критериями одонтогенного синусита были следующие признаки: наличие инородного тела металлической плотности, соответствующего пломбировочному материалу или импланту в полости синуса; глубокий кариес и признаки периодонтита премоляров и моляров верхней челюсти; разрушение нижней костной стенки верхнечелюстных синусов в области патологически измененных зубов, а также частичная адентия верхней челюсти в зоне, соответствующей изменениям верхнечелюстного синуса.
При рентгенологическом исследовании у 44 (26,5%) пациентов с острым верхнечелюстным синуситом на обзорной рентгенограмме определялись утолщенная слизистая оболочка и/или субтотальное затемнение с горизонтальным уровнем жидкости. У 78 (47%) пациентов отмечалось тотальное снижение прозрачности синуса, из них у 38 (22,8%) пациентов в полости синуса были обнаружены инородные тела металлической плотности (соответствующие пломбировочному материалу). Однако низкая контрастность жидкости и мягких тканей, суммация теней затрудняли объективную оценку полученных рентгенограмм. Для дополнительной оценки состояния зубов верхней челюсти всем пациентам выполнялась ортопантомография, которая не позволяла достоверно судить о состоянии верхнечелюстных синусов, а у 13 (7,8%) пациентов — точно интерпретировать изменения в области верхушек зубов верхней челюсти (вследствие отражения проекционного наслоения сложных анатомических структур).
По результатам нашего исследования у 24 (14,5%) пациентов были обнаружены признаки хронического периодонтита в области премоляров и моляров верхней челюсти (рис. 1). Глубокий кариес был диагностирован у 4 (2,4%) пациентов, кисты верхней челюсти в области корней премоляров и моляров визуализировались в 6 (3,6%) случаях.
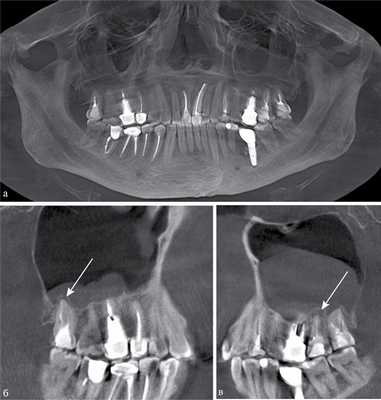
Рис. 1. КЛКТ. Панорамная (а) и мультипланарные реконструкции правого (б) и левого (в) верхнечелюстных синусов пациента М., 37 лет. Диагноз: двусторонний одонтогенный хронический верхнечелюсной синусит. Отмечаются КТ-признаки хронического гранулематозного периодонтита зубов 1.8, 2.7, 2.8 (в виде очагов деструкции у верхушек корней, округлой формы, с четкими ровными контурами). Нижние костные стенки синусов истончены, не прослеживаются в области периодонта зубов 1.8 и 2.8 (указаны стрелками). В нижнем отделе правого верхнечелюстного синуса определяется пристеночное мягкотканное образование гомогенной структуры с полицикличным верхним контуром. Левый верхнечелюстной синус субтотально заполнен мягкотканным содержимым гомогенной структуры с округлым верхним контуром.
Пломбировочный материал был обнаружен у 38 (22,8%) пациентов (рис. 2). Из них у 34 (20,4%) больных в подслизистом слое нижней стенки синуса, у 4 (2,4%) — в верхнем отделе у медиальной стенки синуса (рис. 3). У 8 (4,8%) пациентов диагностированы ошибки стоматологической имплантации: верхушка импланта была погружена в полость синуса, что стало причиной развития хронического одонтогенного верхнечелюстного синусита, а также осложнений в виде хронического полисинусита (n=4; 2,4%).
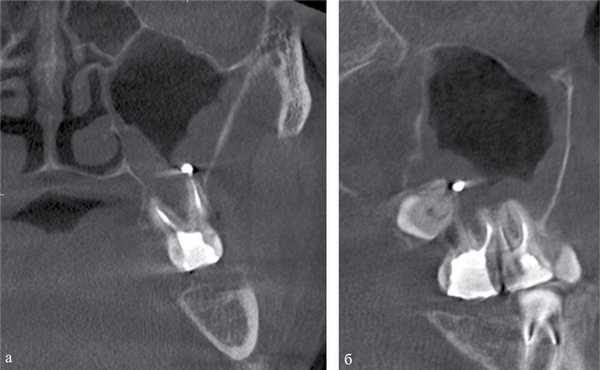
Рис. 2. МСКТ. Коронарная (а) и сагиттальная (б) реконструкции правого верхнечелюстного синуса пациента К., 29 лет. Диагноз: правосторонний одонтогенный хронический верхнечелюстной синусит. Корни зубов 1.6, 1.7 и 1.8 погружены в полость верхнечелюстного синуса. Состояние после эндодонтического лечения зубов 1.6 и 1.7, с выведением пломбировочного материала за верхушку небного корня 1.7. В области корней зубов 1.6 и 1.7 отмечается разрежение костной ткани с нечеткими неровными контурами (рентгенологические признаки гранулирующего периодонтита). В нижнем отделе синуса определяется пристеночное мягкотканное образование с полицикличным контуром, костные стенки синуса в данной области не прослеживаются.
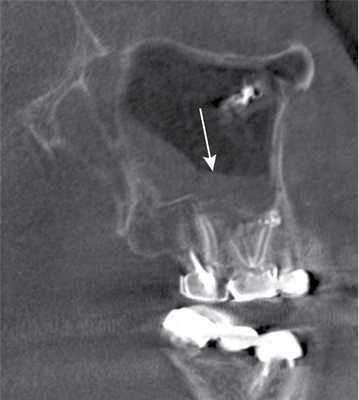
Рис. 3. КЛКТ. Сагиттальная реконструкция, правый верхнечелюстной синус. Пациент У., 48 лет. Диагноз: правосторонний одонтогенный хронический верхнечелюстной синусит. Зубы 1.6 и 1.7 после эндодонтического лечения, отмечается выведение пломбировочного материала за верхушки корней зуба 1.6 (материал располагается в костной ткани альвеолярного отростка и в подслизистом слое синуса). Определяется разрежение костной ткани в области корней 1.6 и 1.7, костная стенка синуса в данной области не прослеживается (стрелка). В нижнем отделе синуса определяется утолщение слизистой оболочки до 10 мм, в верхнемедиальном отделе синуса визуализируется инородное тело неправильной формы металлической плотности (соответствует фрагментам пломбировочного материала).
В нашем исследовании у 30 (18,1%) пациентов наблюдалось отсутствие зубов верхней челюсти в зоне, соответствующей изменениям верхнечелюстного синуса, что также позволяло судить об одонтогенности верхнечелюстного синусита.
Выводы
1. Высокотехнологичные методы лучевой диагностики (МСКТ или КЛКТ) являются необходимой составляющей комплексной диагностики ОВЧС.
2. Применение компьютерной томографии (МСКТ или КЛКТ) позволяет определить причину ОВЧС и, таким образом, выбрать правильную тактику ведения пациентов.
3. МСКТ или КЛКТ должны быть рекомендованы пациентам до и после эндодонтического лечения зубов и стоматологической имплантации, а также при хирургических вмешательствах на верхней челюсти с целью своевременного выявления возможных патологических изменений верхнечелюстных синусов (в том числе бессимптомных).
Конфликт интересов: авторы статьи подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Читайте также:
