Синдром Берна-Кункеля (Bearn-Kunkel) - синонимы, авторы, клиника
Добавил пользователь Alex Обновлено: 22.01.2026
Статья посвящена актуальной междисциплинарной проблеме — тазовому конгестивному синдрому. Это заболевание венозного отдела кровообращения, которое сопровождается расширением гонадных вен и/или внутритазовых венозных сплетений с формированием венозного полнокровия органов малого таза. В обзоре представлены данные о распространенности синдрома, причинах, патофизиологических механизмах, лежащих в основе его развития, основных клинических проявлениях, методах диагностики, подходах к лечению. Отмечено, что медикаментозная терапия (агонисты гонадотропин-рилизинг-гормона, даназол, комбинированные пероральные контрацептивы, прогестины, флеботоники и др.) является первой линией лечения, однако обеспечивает лишь временный эффект. Среди хирургических методик лечения особое внимание уделено рентгеноэндоваскулярным методам (эмболизация, стентирование). Описаны техника проведения вмешательств, основные результаты исследований по оценке эффективности эмболизации гонадных вен, которая варьирует от 47% до 100%. Перечислены основные осложнения данных вмешательств, обозначены вопросы, требующие дальнейшего изучения: влияние на фертильность женщины, прогнозы на полное выздоровление с учетом отягощения соматического и/или гинекологического анамнеза. Отмечена важность своевременной постановки диагноза, повышения осведомленности специалистов первичного звена о признаках и симптомах данной патологии, а также необходимость консультирования пациенток у сосудистых хирургов.
Ключевые слова: тазовый конгестивный синдром, эмболизация гонадных вен, тазовая боль, синдром Мэя — Тернера, синдром «щелкунчика».
E.Yu. Antropova 1 , B.M. Sharafutdinov 1,2 , M.I. Mazitova 1 , E.A. Gaziev 2 ,
G.A. Khisamieva 1 , V.V. Shtern 1
1 Kazan State Medical Academy — Branch of the Russian Medical Academy
of Continuous Professional Education, Kazan, Russian Federation
2 Kazan (Volga Region) Federal University, Kazan, Russian Federation
This paper discusses an essential interdisciplinary issue, pelvic congestion syndrome (PGS). PGS is a venous disorder with gonadal vein and/or pelvic venous plexus dilation that results in pelvic venous plethora. The authors address PGS prevalence, causes, underlying pathophysiological mechanisms, major clinical manifestations, diagnostic tools, and treatment approaches. Pharmacotherapy (gonadotropin-releasing hormone agonists, danazol, combined oral contraceptives, progestins, phlebotonics, etc.) is the first-line treatment that provides only a temporary effect. Image-guided vascular surgery (embolization, stenting) is of particular importance among surgical interventions. Surgical technique and critical results of the studies on the efficacy of gonadal vein embolization (from 47% to 100%) are described. The paper details major complications of surgical interventions and highlights issues requiring further researches, i.e., the effects on female fertility, predicted f ull recovery considering compromised somatic and/or gynecological anamnesis. Finally, the importance of timely diagnosis, greater awareness of primary care physicians on the signs and symptoms of this disorder, and a need to refer these women to vascular surgeons are addressed.
Keywords: pelvic congestion syndrome, gonadal vein embolization, pelvic pain, May-Thurner syndrome, nutcracker syndrome.

Введение
Тазовый конгестивный синдром (Pelvic congestion syndrome (PCS), тазовый венозный стаз, синдром тазового венозного полнокровия, овариоцеле) — заболевание венозного отдела кровообращения, которое сопровождается расширением гонадных вен или внутритазовых венозных сплетений с формированием венозного полнокровия органов малого таза. Термин «синдром тазового венозного застоя» впервые был предложен Тейлором в 1949 г. [1]. PCS — это одна из частых причин хронической тазовой боли у женщин репродуктивного возраста, которая часто неправильно диагностируется. Истинная частота данного синдрома неизвестна из-за трудностей диагностики, обусловленных маскировкой заболевания различными формами гинекологической (воспалительные заболевания матки и ее придатков, эндометриоз), урологической (цистит), хирургической (колит, болезнь Крона) и ортопедической патологии.
Особенности патогенеза
По данным литературы, PCS чаще встречается у женщин в пременопаузе, имеющих в анамнезе несколько родов. О возникновении PCS у женщин в постменопаузальном периоде не сообщается [2]. Полное исчезновение симптомов после менопаузы свидетельствует о влиянии гормонов на PCS. Известно, что под влиянием эстрогенов может происходить эндотелийзависимое и эндотелийнезависимое расширение сосудов. Предполагают, что эти эффекты обусловлены наличием в кавеолах мембран эндотелиальных клеток эстрогеновых рецепторов. Таким образом, эстрогены могут вызывать расширение вен, служащее патофизиологической основой конгестивного синдрома. Среди пациенток с жалобами на хроническую тазовую боль распространенность данного заболевания достигает 30% [3].
Застой в тазовых венах (внутренней подвздошной, яичниковой, левой почечной) может быть вызван гормональными изменениями, нарушением в системе оттока венозной крови или непроходимостью какой-либо вены яичника, увеличением внутрисосудистого давления, не контролируемого венозным тонусом на уровне таза [4]. Примерами влияния гормонов на тонус сосудов являются расширение вен на фоне влияния прогестерона во время беременности, изменение тонуса сосудов перед менструацией, в период овуляции как результат увеличения выработки простагландинов вследствие гормональных колебаний [5].
Клинические проявления и подходы к диагностике
Клинически PCS выражается тупой болью или ощущением тяжести в тазу, которая безуспешно лечится как дисменорея. Любой фактор, повышающий давление в брюшной полости (ходьба, изменение осанки, поднятие тяжестей и длительное положение стоя), может увеличить интенсивность боли. Она часто обостряется до или во время менструации. Интенсивность болевого синдрома увеличивается во время или после полового акта, и с каждой последующей беременностью боль становится более выраженной. Нужно отметить, что на интенсивность боли влияет также время суток, она усиливается в конце дня [7].
Перед планируемым лечением PCS пациенткам необходимо провести оценку тазового венозного рефлюкса с помощью УЗИ, ретроградную венографию внутренней подвздошной или яичниковой вен, КТ или МРТ [8]. При допплерографии, помимо гонадных, следует выполнить визуализацию внутренних подвздошных вен с проведением пробы Вальсальвы. Рекомендуется также оценить состояние запирательных и срамных вен как возможных коллатеральных путей, а также общей подвздошной вены, нижней полой и почечной вены — для исключения обструкции. В настоящее время нет «золотого стандарта» для диагностики рефлюкса тазовых вен, предпочтение здесь отдается трансвагинальной дуплексной ультрасонографии [9].
Лечение
Выбор метода лечения PCS у женщин — еще один предмет оживленных дискуссий в профессиональной среде, что связано с высокой частотой рецидивов как после консервативного, так и после хирургического лечения. Медикаментозное лечение, связанное с меньшими осложнениями по сравнению с инвазивными процедурами, на современном этапе является первой линией лечения PCS. Агонисты гонадотропин-рилизинг-гормона, даназол, комбинированные пероральные контрацептивы, прогестины, флеботоники и нестероидные противовоспалительные препараты показали эффективность в купировании боли при PCS [3, 10]. Однако при этом необходимо понимать, что медикаментозная терапия обеспечивает лишь временный эффект.
Хирургическое лечение в виде перевязки несостоятельных вен яичников характеризуется довольно высокой результативностью — почти у 75% женщин данная операция приводит к исчезновению симптомов. Выполнение же двусторонней сальпингоофорэктомии и гистерэктомии в качестве лечения PCS, несмотря на свою радикальность, не дает благоприятных результатов [11].
Бурное развитие эндоваскулярных методов лечения заболеваний различных локализаций позволило рассматривать внутрисосудистые вмешательства как перспективный вариант терапии PCS. Среди внутрисосудистых методик наиболее распространены механическая окклюзия, склеротерапевтическая облитерация яичниковых вен, а также комбинированные методики эмболизации [12].
Двусторонняя эмболизация яичниковой вены как метод лечения PCS впервые была описана R.D. Edwards et al. в 1993 г. [13]. В России о первых результатах освоения метода доложил Е.В. Галкин в 1991 г., и к сегодняшнему дню уже опубликовано довольно большое количество отчетов о случаях и когортных исследованиях, в которых успешность вмешательств оценивается в среднем на 75-80% [14]. Проведенный поиск в доступной нам литературе 17 позволил проанализировать данные об эндоваскулярных вмешательствах (табл. 1).
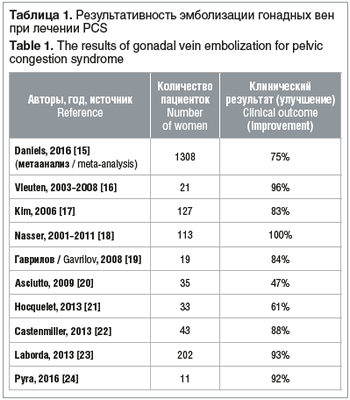
Использование рентгеноэндоваскулярных методов расширяет возможности диагностики и лечения PCS.
Доступ для проведения эмболизации варикозно расширенных вен таза может осуществляться через правую общую бедренную, яремную вены, через медиальную или латеральную подкожные вены верхней конечности (v. basilica, v. cephalica). Правая внутренняя яремная вена представляет собой наиболее удобный доступ, поскольку обычно не реагирует спазмом в отличие от плечевых вен. После проведения катетеризации левой почечной вены проводится флебография в покое для оценки рефлюкса по всей длине вены, затем во время пробы Вальсальвы для оценки контралатерального венозного рефлюкса, а также рефлюкса в нижние конечности. Агентами для проведения эмболизации являются микроспирали из платины, эмболизационный клей и пена, а также жидкие склерозанты (полидоканол, 3% тетрадецилсульфат) [25]. Данные агенты можно использовать по отдельности или вместе [26]. Предпочтение отдается использованию спиралей, механически прикрепляющихся к спиралевидному доставляющему проводнику с внутренним диаметром 0,021 дюйма. Использование спиралей данного типа с фиксирующейся конструкцией дает возможность перемещать эти спирали вперед и возвращать обратно до окончательной оптимальной установки в вене. Стандартный диаметр используемого гайд-катетера — 5F, однако оптимальным следует признать выбор в пользу катетера диаметром 6F, позволяющего извлечь неправильно размещенную или смещенную микроспираль.
Осложнения эмболизации гонадных вен — редкое явление. Они делятся на непосредственные, возникающие во время проведения интервенционного вмешательства, и отсроченные. К непосредственным относятся осложнения, связанные с приемом лекарственных средств, к примеру гиперчувствительная реакция на йодсодержащий контрастный препарат [27], гематомы в месте пункции вены, пневмоторакс при катетеризации шейных вен, эмболизация нецелевых вен, в том числе смещение спиралей [28], инсульт, связанный с парадоксальной эмболией при миграции спирали или неконтролируемой эмболизацией с помощью пены. К отсроченным осложнениям относится миграция спиралей при неправильном подборе размера микроспиралей.
В исследовании A. Laborda et al. [23] оценивался клинический исход 5-летнего периода наблюдения после проведения эмболизации спиралями у пациенток с PCS. Дополнительно проводилась оценка уровня боли до и после лечения с использованием визуальной аналоговой шкалы (ВАШ). Технический успех интервенционного вмешательства составил 100%. Клинический успех достигнут в 93,85% случаев. Оценка по ВАШ перед процедурой составила 7,34±0,7, в конце периода наблюдения — 0,78±1,2.
Ретроспективное исследование, проведенное F. Nasser et al. [18], также показало высокую эффективность эмболизации спиралями при PCS. Технический и клинический успех в данном ретроспективном анализе составил 100%. Через 1 год после вмешательства 53% пациенток не отмечали болевого синдрома в тазовой области, 47% сообщили о значимом снижении выраженности боли. Оценка по ВАШ до эмболизации составила в среднем 7,34, через 12 мес. после эмболизации — 0,47.
Также был проведен ряд исследований, посвященных сравнению эмболизации с другими методами лечения. M.H. Chung et al. [28] продемонстрировали, что эмболизация превосходит гистерэктомию и овариэктомию в облегчении симптомов когнестии. Средний балл по ВАШ снизился с 7,8 до 3,2 в группе эмболизации по сравнению с 4,6 в группе двусторонней овариэктомии и 5,6 в группе пациенток, перенесших одностороннюю овариэктомию.
Отдельного внимания заслуживает синдром аортомезентериального пинцета (синдром «щелкунчика»), при котором левая почечная вена сдавливается между верхней брыжеечной артерией и аортой. В этой ситуации яичниковая вена является основным коллатеральным путем венозного оттока и может вызывать боли даже в отсутствие гематурии, как при классическом синдроме «щелкунчика». МРТ, КТ и УЗИ с дуплексным сканированием наряду с внутрисосудистым УЗИ позволяют выявить значимый стеноз левой почечной вены [29]. Венография с пробой Вальсальвы все еще является полезным методом определения гемодинамически значимого стеноза, поскольку стеноз >50% при внутрисосудистом УЗИ не всегда обозначает клиническую значимость стеноза. В настоящее время для лечения данной патологии используются специальные нитиноловые стенты с высокой радиальной устойчивостью.
Синдром Мэя — Тернера, при котором происходит сдавление левой общей подвздошной вены правой общей подвздошной артерией, являясь предиктором возникновения илеофеморального тромбоза, также может приводить к развитию PCS. Для коррекции возникающих нарушений наряду со специальными венозными стентами используются саморасширяющиеся стенты. Однако в настоящее время нет убедительных доказательств преимущества какого-либо типа стентов для эндоваскулярного лечения данной патологии. S.F. Daugherty et al. [30] провели серию стентирований левой подвздошной вены при PCS. Дальнейшее наблюдение показало полное исчезновение тазовой боли у 15 из 19 пациенток. Ограничением данного исследования является исключение пациенток, у которых жалобы со стороны нижних конечностей превалировали над болью, связанной с PCS. Однако стентирование подвздошных вен, связанное с варикозной болезнью нижних конечностей, показывает хорошие клинические результаты [31].
Заключение
Таким образом, несмотря на то, что PCS является сравнительно молодой нозологией, сегодня имеются достаточные знания о патогенезе, клиническом проявлении данного заболевания и возможных методах коррекции. Что же касается дифференциальной диагностики, то необходимо отметить, что она вызывает значительные трудности у практикующих гинекологов. Улучшить диагностику PCS возможно, повышая осведомленность специалистов первичного звена о признаках и симптомах данной патологии, а также о необходимости консультирования соответствующих пациенток у сосудистых хирургов.
Эндоваскулярное вмешательство, на наш взгляд, — лучший вариант лечения PCS у пациенток с расширением яичниковых вен более 5-6 мм (что является верхним пределом нормы диаметра венозных сосудов) и присутствием признаков рефлюкса и венозной конгестии. Эмболизация гонадных вен — мини-инвазивный, безопасный и достаточно эффективный метод. Однако, несмотря на немалый опыт его использования (преимущественно в США и странах Западной Европы), вопросы влияния на последующую фертильность женщины, прогнозы в отношении полного выздоровления с учетом отягощения соматического и/или гинекологического анамнеза недостаточно освещены и нуждаются в более глубоком изучении. Требуется проведение многоцентровых рандомизированных исследований для оптимизации критериев отбора пациенток с PCS и введения их в повседневную клиническую практику.
Сведения об авторах:
Антропова Елена Юрьевна — к.м.н., доцент кафедры акушерства и гинекологии КГМА — филиала ФГБОУ ДПО РМАНПО Минздрава России; 420012, Россия, г. Казань, ул. Муштари, д. 11; ORCID iD 0000-0002-5991-5163.
Шарафутдинов Булат Марсович — к.м.н., ассистент кафедры кардиологии, рентгенэндоваскулярной и сердечно-сосудистой хирургии КГМА — филиала ФГБОУ ДПО РМАНПО Минздрава России; 420012, Россия, г. Казань, ул. Муштари, д. 11; заведующий отделением ангиографических и рентгеноперационных исследований МСЧ ФГАОУ ВО «Казанский (Приволжский) федеральный университет»; 420043, Россия, г. Казань, ул. Чехова, д. 1а; ORCID iD 0000-0002-4149-118X.
Газиев Эдгар Айратович — врач отделения ангиографических и рентгеноперационных исследований МСЧ ФГАОУ ВО «Казанский (Приволжский) федеральный университет»; 420043, Россия, г. Казань, ул. Чехова, д. 1а.
Хисамиева Гузель Альфредовна — ординатор кафедры акушерства и гинекологии КГМА — филиала ФГБОУ ДПО РМАНПО Минздрава России; 420012, Россия, г. Казань, ул. Муштари, д. 11; ORCID iD 0000-0002-2277-1290.
Штерн Вячеслав Владимирович — ординатор кафедры акушерства и гинекологии КГМА — филиала ФГБОУ ДПО РМАНПО Минздрава России; 420012, Россия, г. Казань, ул. Муштари, д. 11; ORCID iD 0000-0002-0444-5088.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 18.05.2021.
Поступила после рецензирования 10.06.2021.
Принята в печать 06.07.2021.
About the authors:
Elena Yu. Antropova — C. Sc. (Med.), associate professor of the Department of Obstetrics and Gynecology, Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education; 11, Mushtari str., Kazan, 420012, Russian Federation; ORCID iD 0000-0002-5991-5163.
Bulat M. Sharafutdinov — C. Sc. (Med.), assistant of the Department of Cardiology, Endovascular, and Cardiovascular Surgery, Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education; 11, Mushtari str., Kazan, 420012, Russian Federation; Head of the Department of Angiography and Interventional Radiology, Medical Wing of the Kazan (Volga Region) Federal University; 1а, Chekhova str., Kazan, 420043, Russian Federation; ORCID iD 0000-0002-4149-118X.
Edgar A. Gaziev — physician of the Department of Angiography and Interventional Radiology, Medical Wing of the Kazan (Volga Region) Federal University; 1а, Chekhova str., Kazan, 420043, Russian Federation.
Guzel A. Khisamieva — clinical resident of the Department of Obstetrics and Gynecology, Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education; 11, Mushtari str., Kazan, 420012, Russian Federation; ORCID iD 0000-0002-2277-1290.
Vyacheslav V. Shtern — clinical resident of the Department of Obstetrics and Gynecology, Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education; 11, Mushtari str., Kazan, 420012, Russian Federation; ORCID iD 0000-0002-0444-5088.
There is no conflict of interests.
Received 18.05.2021.
Revised 10.06.2021.
Accepted 06.07.2021.
Список литературы Свернуть Развернуть
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
БИРНА-КУНКЕЛЯ СИНДРОМ
описан американскими врачами A. G. Bearn, 1923-1983, H. G. KUnkel, 1916-1983, и R. J. Slater, род. в 1923; синоним - люпоидный гепатит) - аутоиммунный хронический активный гепатит с клиническими и лабораторными признаками мультисистемного поражения, напоминающего системную красную волчанку. Чаще болеют молодые женщины. Характерны астеновегетативный синдром (недомогание, анорексия, быстрая утомляемость и др.), желтуха, гепатомегалия, спленомегалия, а также лихорадка, полиартрит, полимиозит, лимфаденопатия, разнообразные кожные высыпания, дис- или аменорея и др. При развитии цирроза печени выявляют признаки портальной гипертензии и печеночной энцефалопатии. При лабораторном обследовании обнаруживают повышение уровня печеночных ферментов, гипербилирубинемию; диагностически значимы гипергаммаглобулинемия и высокие титры характерных специфических аутоантител - к гладкой мускулатуре (SMA), антинуклеарных (ANA), к печеночно-почечным микросомам I типа (анти-LKM-I), а также результаты гистологического исследования биоптатов печени. Важным диагностическим критерием является быстрый эффект глюкокортикоидной терапии.
A. G. Bearn, H. G. KUnkel, R. J. Slater. The problem of chronic liver disease in young women. American Journal of Medicine, New York, 1956; 21: 3-15.
Синдром Жильбера - симптомы и лечение
Что такое синдром Жильбера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Синдром Жильбера — это генетический пигментный гепатоз с аутосомно-доминантным типом наследования, протекающий с повышением уровня неконъюгированного (свободного) билирубина, чаще проявляющееся в период полового созревания и характеризующийся доброкачественным течением [1] .
Краткое содержание статьи — в видео:
Синонимы названия болезни: простая семейная холемия, конституциональная или идиопатическая неконъюгированная гипербилирубинемия, негемолитическая семейная желтуха.
По распространённости данное заболевание встречается не менее, чем у 5 % населения, в соотношении мужчин и женщин — 4:1. Впервые заболевание описал французский терапевт Августин Жильбер в 1901 году.
Чаще синдром Жильбера проявляется в период полового созревания и характеризуется доброкачественным течением. Основным проявлением этого синдрома является желтуха.
К провоцирующим факторам проявления синдрома можно отнести:
- голодание или переедание;
- жирную пищу;
- некоторые лекарственные средства;
- алкоголь;
- инфекции (грипп, ОРЗ, вирусный гепатит);
- физические и психические перегрузки;
- травмы и оперативные вмешательства.
Причина заболевания — генетический дефект фермента УДФГТ1*1, который возникает в результате его мутации. В связи с этим дефектом функциональная активность данного фермента снижается, а внутриклеточный транспорт билирубина в клетках печени к месту соединения свободного (несвязанного) билирубина с глюкуроновой кислотой нарушается. Это и приводит к увеличению свободного билирубина.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Жильбера
Некоторые специалисты трактуют синдром Жильбера не как болезнь, а как физиологическую особенность организма.
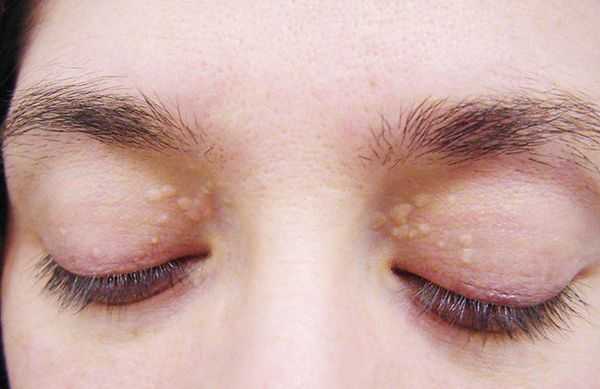
До периода полового созревания данный синдром может протекать бессимптомно. Позже (после 11 лет) возникает характерная триада признаков:
- желтуха различной степени выраженности;
- ксантелазмы век (жёлтые папулы);
- периодичность появления симптомов [1] .
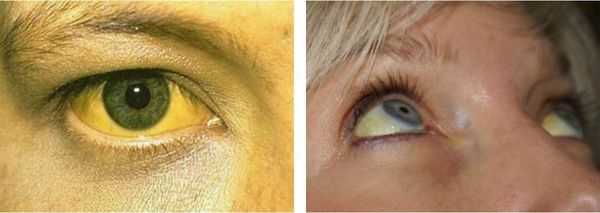
Желтуха чаще всего проявляется иктеричностью (желтушностью) склер, матовой желтушностью кожных покровов (особенно лица), иногда частичным поражением стоп, ладоней, подмышечных впадин и носогубного треугольника.
Заболевание нередко сочетается с генерализованной дисплазией (неправильным развитием) соединительной ткани.
Усиление желтухи может наблюдаться после перенесения инфекций, эмоциональной и физической нагрузки, приёма ряда лекарственных препаратов (в частности, антибиотиков), голодания и рвоты.
Клиническими проявлениями заболевания общего характера могут быть:
- слабость;
- недомогание;
- подавленность;
- плохой сон;
- снижение концентрации внимания.
В отношении ЖКТ синдром Жильбера проявляется снижением аппетита, изменением привкуса во рту (горечь, металлический привкус), реже возникает отрыжка, тяжесть в области правого подреберья, иногда наблюдается боль ноющего характера и плохая переносимость лекарственных препаратов.
При ухудшении течения синдрома Жильбера и существенном повышении токсичной (свободной) фракции билирубина может появляться скрытый гемолиз, усиливая при этом гипербилирубинемию и добавляя в клиническую картину системный зуд.
Патогенез синдрома Жильбера
В норме свободный билирубин появляется в крови преимущественно (в 80-85 % случаев) при разрушении эритроцитов, в частности комплекса ГЕМ, входящего в структуру гемоглобина. Это происходит в клетках макрофагической системы, особенно активно в селезёнке и купферовских клетках печени. Остальная часть билирубина образуется из разрушения других гемсодержащих белков (к примеру, цитохрома P-450).
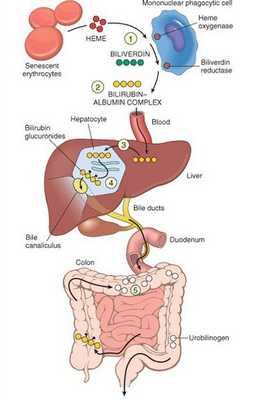
У взрослого человека в сутки образуется приблизительно от 200 мг до 350 мг свободного билирубина. Такой билирубин слаборастворим в воде, но при этом хорошо растворяется в жирах, поэтому он может взаимодействовать с фосфолипидами ("жирами") клеточных мембран, особенно головного мозга, чем можно объяснить его высокую токсичность, в частности токсичное влияние на нервную систему.
Первично после разрушения комплекса ГЕМ в плазме билирубин появляется в неконъюгированной (свободной или несвязанной) форме и транспортируется с кровью при помощи белков альбуминов. Свободный билирубин не может проникнуть через почечный барьер за счёт сцепления с белком альбумином, поэтому сохраняется в крови.
В печени несвязанный билирубин переходит на поверхность гепатоцитов. С целью снижения токсичности и выведения в клетках печени свободного билирубина при помощи фермента УДФГТ1*1 он связывается с глюкуроновой кислотой и превращается в конъюгированный (прямой или связанный) билирубин. Конъюгированный билирубин хорошо растворим в воде, он является менее токсичным для организма и в дальнейшем легко выводится через кишечник с желчью.
При синдроме Жильбера связывание свободного билирубина с глюкуроновой кислотой снижается до 30% от нормы, тогда как концентрация прямого билирубина в желчи увеличивается.
В основе синдрома Жильбера лежит генетический дефект — наличие на промонторном участке A(TA)6TAA гена, кодирующего фермент УДФГТ1*1, дополнительного динуклеотида ТА. Это становится причиной образования дефектного участка А(ТА)7ТАА. Удлинение промонторной последовательности нарушает связывание фактора транскрипции IID, в связи с чем уменьшается количество и качество синтезируемого фермента УДФГТ1, который участвует в процессе связывания свободного билирубина с глюкуроновой кислотой, преобразуя токсичный свободный билирубин в нетоксичный связанный.
Вторым механизмом развития синдрома Жильбера является нарушение захвата билирубина микросомами сосудистого полюса клетки печени и его транспорта глутатион-S-трансферазой, которая доставляет свободный билирубин к микросомам клеток печени.
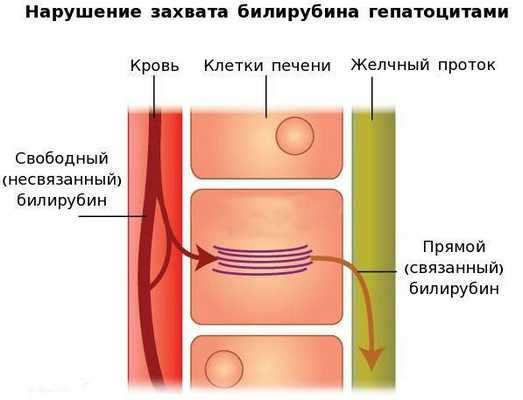
В конечном итоге вышеперечисленные патологические процессы приводят к увеличению содержания свободного (несвязанного) билирубина в плазме, что обуславливает клинические проявления заболевания [6] .
Классификация и стадии развития синдрома Жильбера
Общепринятой классификации синдрома Жильбера не существует, однако условно можно разделить генотипы синдрома по полиморфизму.
Болезнь Кёнига (рассекающий остеохондрит) - симптомы и лечение
Что такое болезнь Кёнига (рассекающий остеохондрит)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Коновалова Евгения Александровича, ортопеда со стажем в 13 лет.
Над статьей доктора Коновалова Евгения Александровича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Болезнь Кёнига (рассекающий остеохондрит коленного сустава) — это очаговое идиопатическое изменение субхондральной кости, при котором примыкающей к ней суставной хрящ становится нестабильным или разрушается, приводя к изменениям самой кости. Это ортопедическое заболевание может спровоцировать преждевременное развитие остеоартрита [1] .
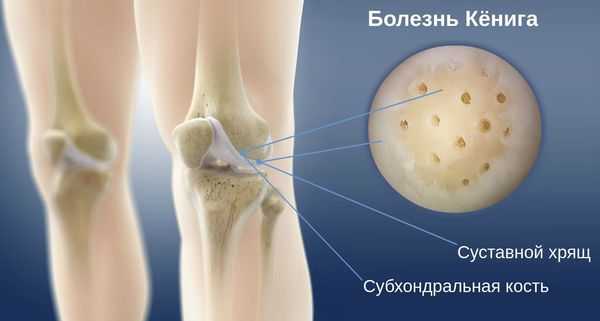
Болезнь Кёнига может возникнуть в любом возрасте. В большинстве случаев она развивается у молодых людей, обычно в подростковом возрасте [16] . Встречается заболевание относительно редко. По данным литературы, его распространённость в среднем достигает 21 человека на 100 000 населения [15] [16] .
Рассекающий остеохондрит развивается в одном или нескольких местах формирования кости (центрах оссификации). Ему свойственна постепенная дегенерация или асептический некроз — отмирание участков костной ткани. В этот патологический процесс вовлекается как кость, так и суставной хрящ, однако в первую очередь поражается субхондральная кость [11] .
Описание рассекающего остеохондрита впервые встречается во второй половине XIX века. В 1840 году французский хирург Malgaigne первыми описали удаление свободных костно-хрящевых тел из коленного сустава [2] , а в 1870 году английский хирург Paget дал определение этому состоянию — "тихий некроз" [3] .
В 1888 году немецкий врач Kӧnig предположил, что формирование свободных внутрисуставных тел происходит под влиянием различных факторов [4] . Основная причина — идиопатическое воспаление, вызывающее отделение фрагмента от здоровой кости, прогрессию которого он именовал термином "рассекающий остеохондрит".
Точная причина развития этой патологии доподлинно неизвестна до сих пор. Сегодня существуют различные теории возникновения болезни Кёнгиа, включая острые травмы, повторяющиеся микротравмы, генетический фактор, ишемию и нарушение остеохондральной оссификации [5] . Чаще всего развитие заболевания провоцируют неоднократное травмирование [17] . Поэтому к факторам риска заболевания относятся занятия такими видами спорта, которые чаще всего приводят к повреждениям колена — футбол, баскетбол, гимнастика, дзюдо, вольная борьба, тхэквондо, самбо и другие [16] .
На практике Болезнь Кёнига часто обнаруживается у пациентов, профессионально занимающихся танцами, а также курсантов военных училищ.
Симптомы болезни Кёнига
При рассекающем остеохондрите возможно поражение различных суставов — локтевых, голеностопных и тазобедренных. При болезни Кёнига повреждаются только коленные суставы.
Клиническая картина болезни Кёнига может сильно варьироваться. Как правило, дети и подростки предъявляют жалобы на диффузную, неспецифическую боль в переднем отделе коленного сустава. Некоторые пациенты сталкиваются с перемежающимися болезненными ощущениями в колене, которые сопровождаются блокированием сустава и его периодичной отёчностью.
Подобные признаки заболевания могут возникать в обоих коленных суставах, но, как показывает практика, симптоматика возникает поочерёдно: сначала беспокоит один сустав, и через какое-то время присоединяется второй.
В начале заболевания боль и отёк в поражённом суставе проявляют себя более ярко при физической активности [17] . В запущенной стадии эти симптомы беспокоят пациента постоянно, боли становятся ноющими.
Lefort и другие авторы отмечают, что болевая симптоматика встречается более чем у 80% пациентов [6] . Если фрагмент кости нестабилен, у пациентов отмечаются такие механические признаки болезни, как неустойчивость, блок и хруст. При физикальном осмотре наблюдается хромота при ходьбе или беге.
Отёчность, боль, ограничение движений могут также указывать на синовит. Однако при болезни Кёнига у части пациентов боль в области поражённого сустава возникает при пальпации (прощупывания) во время проведения теста Вильсона. При рассекающем остеохондрите этот тест положителен в 25 % наблюдений, а при прекращении воспалительного процесса его результат становится отрицательным.
Иногда при длительно прогрессирующей симптоматике может развиваться атрофия четырёхглавой мышцы бедра, в результате которого бедро становится более худым.
Патогенез болезни Кёнига
Патогенез рассекающего остеохондрита до настоящего времени полностью не изучен. Специалистами были предложены различные теории, но ни одна из них не является основной. Поэтому рассмотрим подробнее каждую.
Воспаление
Многие авторы описывали признаки воспаления в гистологических образцах. Так, в течение шести лет King описал 24 подобных случая рассекающего остеохондрита, а Lavner — 42 случая за два года.
При микроскопическом изучении медиального бедренного мыщелка поражение можно охарактеризовать, как некротическое, неспецифическое, асептическое (негниющее) продуктивное воспалительное изменение. Другие гистологические анализы и вовсе не обнаружили схожие виды воспалительных изменений. Несмотря на имеющиеся доказательства, эта теория развития болезни Кёнига не подкрепляется литературой.
Острая травма
Ray и Coughlin описали 14 случаев рассекающего остеохондрита и предположили, что хроническая или острая травма, совмещённая с ишемией, вызывает прогрессирующее ухудшение и формирование свободных костно-хрящевых тел [7] . Изменения начинаются в субхондральной кости со сниженной массой, которая обнаруживается только с помощью МРТ и выглядит как трабекулярный отёк. В дальнейшем трабекулы костной ткани разрушаются, и формируется склеротическое кольцо — на этой стадии изменений в хрящевой ткани нет. Впоследствии склероз субхондральной кости нарастает, развивается микронестабильность фрагмента, что влечёт за собой изменения хрящевой ткани и приводит к отслоению костно-хрящевого фрагмента или фрагментов.
Повторяющиеся микротравмы
Одной из важных причин развития болезни Кёнига являются повторяющиеся микротравмы. Fairbank предположил, что удары мыщелков голени о мыщелки бедренной кости могут вызвать рассекающий остеохондрит в классической локации, т.е. в коленном суставе [8] .
Другие авторы описывали различные причины возникновения рассекающего остеохондрита и заключили, что травма, особенно повторяющаяся микротравма, может быть основным фактором развития заболевания. В частности, Cahill предположил, что рассекающий остеохондрит, особенно у детей, возник в результате длительного воздействия на субхондральную кость [9] . К такому мнению на сегодняшний день склоняется большинство учёных.
Генетические факторы
Нередко в научной литературе говорится о влиянии генетического фактора на возникновение и развитие болезни Кёнига, но точных данных о связи формирования рассекающего остеохондрита и генетической предрасположенности нет.
Ишемия
Невозможность спонтанного излечения рассекающего остеохондрита долгое время объяснялось ишемией или снижением сосудистого питания в месте поражения. Так, в итоге многих гистологических анализов поражений субхондральной кости был обнаружен некроз или снижение количества сосудов. Теоретически нарушить поступление крови в вовлечённый участок может сочетанная травма.
В связи с этим Enneking предположил, что недостаточность артериального разветвления в субхондральной кости может стать причиной нарушения и последующего образования рассекающего остеохондрита.
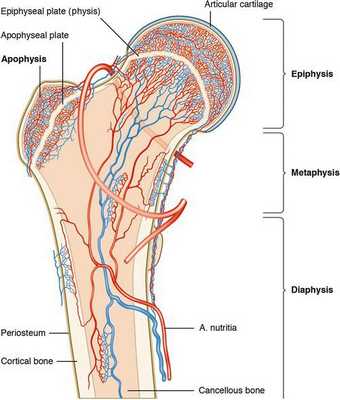
Классификация и стадии развития болезни Кёнига
Существует несколько классификаций заболевания. Они основываются на возрасте, в котором возникают первые проявления заболевания, рентгенологических признаках, патологической анатомии и артроскопической оценке коленного сустава [11] .
Smillie различает две формы рассекающего остеохондрита: ювенальную и взрослую. Считается, что ювенальная форма связана с нарушением развития эпифиза — концевого отдела трубчатой кости, а патология у взрослых — с прямой травмой.
Предложенная Conway и дополненная Guhl патологоанатомическая классификация учитывает анатомические характеристики очага поражения и выделяет четыре стадии заболевания:
- I стадия — отображение очаговых поражений на рентгенограммах, КТ- или МРТ-изображениях в виде склерозированной линии, при этом хрящ интактен, т. е. не повреждён;
- II и III стадии — появление на хряще трещин и частично отщеплённого фрагмента;
- IV стадия — смещение костно-хрящевого фрагмента и признаки дегенеративного поражения хряща.
Международное общество восстановления хряща, классифицируя рассекающий остеохондрит по данным артроскопии, также выделяет четыре стадии болезни [12] :
- I стадия — стабильное повреждение с непрерывной, но размягчённой зоной, покрытой интактным хрящом;
- II стадия — повреждение с частичным нарушением целостности хряща, стабильное при исследовании зондом;
- III стадия — повреждение с нестабильным, но не смещённым фрагментом;
- IV стадия — пустой дефект со смещенным фрагментом.
Dipaola и другие авторы создали классификацию рассекающего остеохондрита на основании МРТ-признаков:
- поражение I класса — отсутствуют повреждения пластинки суставного хряща, но в нём отмечаются утолщения;
- поражение II класса — имеются нарушения в суставном хряще с сигналом низкой интенсивности по краям позади фрагмента;
- поражения III класса — имеются повреждение в суставном хряще с сигналом высокой интенсивности, меняющимся позади фрагмента (в частоте Т-2), предполагая наличие жидкости позади поражения;
- поражения IV класса — запущенная форма заболевания, при котором отмечается наличие свободного костно-хрящевого тела с дефектом поверхностного суставного хряща [10] .
Осложнения болезни Кёнига
Крайняя степень осложнения данного заболевания — это деформирующий артроз с нарушением двигательной активности (блокадой сустава) и изменением оси конечности в целом.
Нарушение биомеханики сустава из-за асептического некроза субхондральной кости и наличие свободных тел внутри сустава приводят к развитию деформирующего гонартроза. Его первым клиническим симптомом является боль, усиливающаяся при физической нагрузке, хромота, особенно при спуске по лестнице. Пациенты отмечают "блоки" коленного сустава и чувство инородного тела в нём. На рентгенограммах можно обнаружить сужение суставной щели, внутрисуставные тела и остеосклероз.
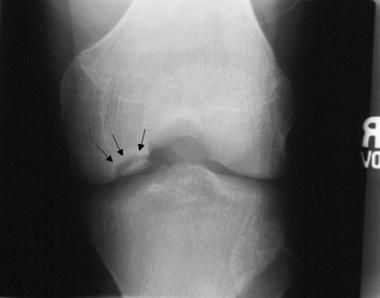
По мере прогрессирования заболевания:
- развивается контрактура (ограничение движений) и крепитация (ощущение хруста при пальпации);
- возникает деформация контуров сустава из-за изменения костной ткани и потери суставного хряща, а также гипотрофия мышц бедра;
- суставная щель в поражённом коленном суставе становится в 2-3 раза уже, чем та же щель в другом колене;
- по краям суставной щели и в зоне межмыщелкового возвышения появляются костные разрастания.
В более тяжёлых стадиях болезни пациент не может до конца выпрямить или согнуть ногу в колене, его беспокоят резко выраженные боли и хромота, а конечности деформируются во внешнюю или внутреннюю сторону. На рентгенограмме суставные поверхности значительно деформированы и склерозированы, отмечается субхондральный некроз, суставной щели практически нет, костные разрастания становятся обширными, появляются свободные суставные тела.
В клетках и сосудах синовиальной оболочки сустава развиваются реакции гиперчувствительности замедленного типа, в результате чего в полости сустава накапливается экссудат (жидкость, возникающая при воспалении) и нарушается функция синовиальной жидкости, которая обычно выполняет роль внутрисуставной смазки.
Диагностика болезни Кёнига
По характеру боли во время осмотра можно определить область поражения:
- при вовлечении внутреннего мыщелка бедра болевая зона располагается по передненаружной поверхности сустава;
- при поражении надколенника возникают фронтальные боли;
- при отшнуровавшемся внутрисуставном теле беспокоят острые болезненные ощущения, локализация которых зависит от расположения ущемлённого фрагмента.
Инструментальная диагностика начинается с рентгенографии сустава в прямой и боковой проекциях, а также в специальных укладках — рентгенография в заднепередней проекции при сгибании в колене до 45 ° и аксиальная (осевая) рентгенограмма надколеннико-бедренного сустава. Рекомендуется проводить рентгенографию обоих коленных суставов, если даже признаки нарушения наблюдаются только в одном, так как в практике около 25 % случаев приходится на билатеральное поражения суставов.
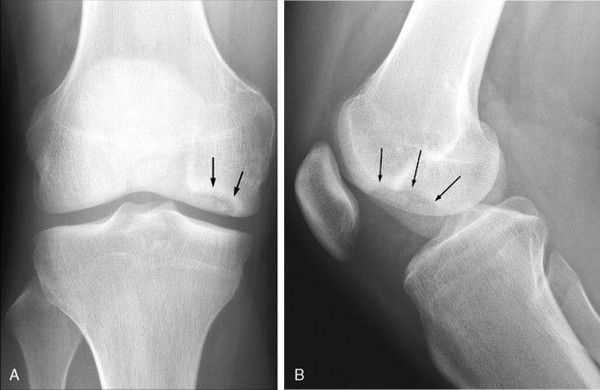
Также необходимо проводить билатеральную полноразмерную рентгенографию нижних конечностей, потому как их оси могут быть связаны с локализацией рассекающего остеохондрита и влиять на методы и успешность лечения.
МРТ обычно используется для точного установления размеров поражения, прогнозирования стабильности фрагмента, соответствия формы суставной поверхности, определения размеров костного отёка и наличия свободных костно-хрящевых тел. Это обследование следует проводить в случаях, когда у пациента есть стойкие симптомы заболевания, но на рентгенограммах никаких признаков рассекающего остеохондрита не обнаруживается [16] .
Дифференциальная диагностика проводиться с деформирующим гонартрозом и повреждение мениска.
Лечение болезни Кёнига
Лечение зависит от нескольких факторов: возраста, размера патологического очага и стабильности фрагмента. В лечении используется, как консервативная терапия, так и хирургические методы лечения.
К консервативной терапии прибегают при лечении отдельных групп пациентов. Её цель — стимулирование регенерации повреждённого очага и предотвращение смещения фрагмента. Добиться этого удаётся в 50-94 % случаев [14] . У пациентов с незрелым скелетом прогноз обычно лучше, чем у других. Лечение патологических очагов более 1 см оказывается неэффективным.
Основным принципом консервативной терапии является прекращение нагрузок на срок до 6-12 недель и ежедневное выполнение упражнений, направленных на поддержание объёма движений в суставе. Производится коррекция повседневной нагрузки, прекращаются занятия спортом и производится иммобилизация. Если после 12 недель пациент не предъявляет жалоб на болевой синдром, а на контрольных рентгенограммах и МРТ отмечается регресс процесса, то разрешается постепенное увеличение физической нагрузки до полной.
Хирургическое вмешательство следует рассматривать при отсутствии на рентгенограмме признаков регенерации после 6-12 месяцев консервативной терапии [13] .
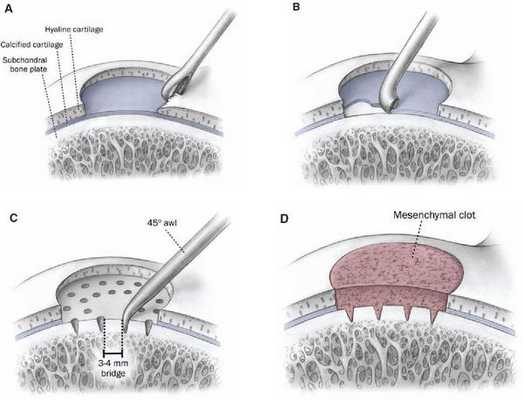
К методам оперативного лечения относятся:
- антеградное и ретроградное рассверливание;
- удаление внутрисуставного тела;
- удаление внутрисуставного тела с микрофрактурированием (перфорированием);
- фиксация внутрисуставного тела;
- пересадка остеохондральных аутотранс-плантатов (OATS);
- имплантация аутологичных хондроцитов (ACI);
- применение аллографтов.
Выбор метода зависит от стадии развития патологического процесса и размеров очага.
Прогноз. Профилактика
Болезнь Кёнига — сложная лечебно-диагностическая задача для ортопедов, так как ни одна из методик выявления и устранения патологии не является абсолютно эффективной. И хотя современные методы лечения с помощью биоматериалов показывают хорошие промежуточные результаты, всё же они требуют анализа на протяжении десятков лет.
В целом, подходы консервативного и хирургического лечения принимают во внимание зрелость зон роста, расположение, стабильность и размеры фрагмента, а также целостность хряща. Чем младше пациент и чем раньше произведена диагностика и установлен диагноз, тем лучше отдалённые результаты лечения.
По результатам 30-летнего наблюдения стало известно, что у пациентов с формированными зонами роста деформирующий гонартроз развивается в 50 % случаев и на 10 лет раньше, чем у населения в целом. Это исследованин также показало, что худшим прогнозом обладают люди с поражением латерального мыщелка бедренной кости [18] .
Синдром Криглера-Найяра
Синдром Криглера-Найяра - генетическое заболевание из класса ферментопатий, характеризующееся нарушением одного из звеньев процесса обезвреживания и выведения билирубина - конъюгации. Симптомами этого состояния являются желтуха печеночного генеза и тяжелые неврологические нарушения, которые могут привести к летальному исходу еще в младенческом возрасте. Диагностика синдрома Криглера-Найяра производится посредством биохимических проб и определения уровня неконъюгированного билирубина в плазме крови, а также молекулярно-генетическими методиками. Специфического лечения заболевания не существует (за исключением трансплантации печени), терапия сводится к увеличению разрушения и элиминации билирубина из организма (гемосорбция, фототерапия, плазмаферез, прием барбитуратов).
Общие сведения
Синдром Криглера-Найяра - тяжелое генетическое заболевание, характеризующееся нарушением связывания билирубина с глюкуроновой кислотой, что является ключевым этапом его обезвреживания и выведения из организма. Впервые это заболевание было описано в 1952 году двумя американскими педиатрами - Джоном Криглером и Виктором Найяром. Дальнейшее изучение синдрома Криглера-Найяра показало, что это состояние имеет генетическую природу и аутосомно-рецессивный характер наследования, кроме того, удалось выявить две клинические разновидности данной патологии. Заболевание достаточно редкое, поэтому точные цифры встречаемости не определены - большинство исследователей полагает, что она находится на уровне 1:1 000 000. Половое распределение больных синдромом Криглера-Найяра не имеет особенностей, заболевание с одинаковой частотой поражает как мальчиков, так и девочек. В лечении этого состояния крайне важна ранняя (в идеале - пренатальная) диагностика, так как от своевременности начатой терапии очень сильно зависят прогноз заболевания и качество жизни больного.
Причины
Синдром Криглера-Найяра относят к классу ферментопатий (по другой классификации - к группе неконъюгированных гипербилирубинемий), причина этого заболевания кроется в недостаточности уридиндифосфатглюкуронидазы 1, функцией которой является связывание билирубина с двумя молекулами глюкуроновой кислоты. В итоге этого биохимического процесса билирубин становится способным растворяться в воде, выводиться в составе желчи и, главное, значительно падает его токсичность. При синдроме Криглера-Найяра этот процесс резко замедлен или не происходит совсем, вследствие чего возникает задержка элиминации билирубина из организма и его накопление.
Билирубин обладает выраженной нейротоксичностью, при повышении концентрации в крови это вещество начинает откладываться в тканях кожных покровов и слизистых оболочек, приводя к развитию желтухи. Когда концентрация билирубина превышает определенный порог, соединение начинает проникать через гематоэнцефалический барьер в головной мозг, приводя к тяжелой энцефалопатии (особенно повреждаются базальные ядра). При отсутствии лечения больные синдромом Криглера-Найяра погибают от многочисленных неврологических расстройств и нарастающей печеночной комы.
Причиной низкой активности уридиндифосфатглюкуронидазы являются мутации гена UGT1A1, который располагается на 2-й хромосоме, отвечает за аминокислотную последовательность и выделение этого фермента. Помимо синдрома Криглера-Найяра дефекты этого гена могут приводить к ряду других нарушений билирубинового обмена наследственного характера - синдрому Жильбера, транзиторной неонатальной билирубинемии семейного типа. Механизм наследования мутаций гена UGT1A1 при синдроме Криглера-Найяра аутосомно-рецессивный. При этом описано несколько вариантов возможного повреждения этого гена, которые приводят к разному течению данного заболевания.
Классификация и симптомы синдрома Криглера-Найяра
В настоящее время описаны две основные клинические формы синдрома Криглера-Найяра, в основном различающиеся между собой тяжестью проявлений и прогнозом заболевания. Это обусловлено типом генетического дефекта в UGT1A1. Первый тип заболевания (СКН-1) вызывается миссенс-мутациями, приводящими к появлению неполноценного фермента, имеющего сигнальную последовательность аминокислот, характерную для подвергающихся внутриклеточной утилизации белков. Таким образом, при этой форме дефект гена поражает кодирующие участки (экзоны), что вызывает развитие патологии у гомозигот. Вскоре после своего образования уридиндифосфатглюкуронидаза 1 разрушается и конъюгации билирубина не происходит совсем.
Синдром Криглера-Найяра 1-го типа характеризуется тяжелым и стремительным течением - первые признаки гипербилирубинемии в виде желтухи обнаруживаются уже через несколько часов после рождения. Со временем к ним присоединяются неврологические нарушения - нистагм, судорожные приступы, иногда возникает опистотонус. Желтуха сохраняется на протяжении всей жизни ребенка, его умственное развитие резко отстает от такового у сверстников, симптомы заболевания неуклонно нарастают даже при интенсивном лечении. Обычно больные синдромом Криглера-Найяра 1-го типа умирают на протяжении первого года жизни из-за интоксикации билирубином и поражения базальных подкорковых ядер (ядерная энцефалопатия).
Причиной синдрома Криглера-Найяра 2-го типа также являются миссенс-мутации гена UGT1A1, однако они могут возникать как в кодирующей последовательности (экзонах), так и в промоторе - участке, отвечающем за экспрессию данного гена. У большинства больных СКН-2 наблюдается наличие на одной хромосоме дефекта экзона, на другой - промотора, то есть, такие лица являются компаунд-гетерозиготами. Результатом нарушения является продукция дефектной формы фермента уридиндифосфатглюкуронидазы, которая не разрушается, но имеет пониженную (на уровне 20-25% от нормы) функциональную активность. Поэтому синдром Криглера-Найяра 2-го типа характеризуется менее тяжелой клинической картиной и более благоприятным прогнозом.
В первые месяцы и даже годы жизни больных синдром Криглера-Найяра этого типа нередко проявляется только незначительной желтухой, при отсутствии лечения к подростковому периоду могут развиваться неврологические отклонения. В ряде случаев, особенно при правильно назначенных терапевтических мероприятиях, никаких нарушений со стороны центральной нервной системы не возникает вовсе. Проявления желтухи различной степени выраженности у больных синдромом Криглера-Найяра 2-го типа могут сохраняться на протяжении всей жизни и нередко расцениваются как индикатор осложнений и ухудшения состояния пациента. С возрастом иногда появляется нистагм, могут регистрироваться судорожные припадки, однако течение и выраженность симптомов заболевания всецело зависят от качества лечения и выполнения рекомендаций специалистов.
Диагностика
Диагностика синдрома Криглера-Найяра производится на основании данных общего осмотра ребенка, биохимических исследований крови, желчи и мочи, молекулярно-генетических анализов. При осмотре выявляется желтуха, возникшая в первые часы (при СКН-1) или месяцы (СКН-2) жизни, признаки неврологических нарушений (опистотонус, нистагм, длительное сохранение транзиторных рефлексов). У больных 2-м типом синдрома Криглера-Найяра неврологические расстройства могут регистрироваться во взрослом возрасте, тогда как у детей наблюдается только желтуха. Также с возрастом могут присоединяться такие проявления, как нейросенсорная глухота или хореоатетоз.
При биохимическом исследовании крови выявляется выраженная непрямая гипербилирубинемия (вплоть 200-350 мкмоль/л), отсутствие (при синдроме Криглера-Найяра 1-го типа) или резкое снижение концентрации прямого билирубина. Конъюгированная фракция этого соединения отсутствует в желчи при СКН-1 и присутствует в незначительных количествах при СКН-2. Фенобарбиталовая проба при синдроме Криглера-Найяра положительна только в случае наличия уридиндифосфатглюкуронидазы, то есть при СКН-2. Изучение концентрации неконъюгированного билирубина в моче показывает его увеличение. Молекулярно-генетическая диагностика синдрома Криглера-Найяра производится врачом-генетиком - он совершает прямое секвенирование последовательности гена UGT1A1 с целью выявления мутаций. При отягощенной по этому заболеванию наследственности у родителей может осуществляться пренатальная диагностика патологии. Дифференциальный диагноз следует проводить с обычной транзиторной желтухой новорожденных и синдромом Жильбера.
Лечение синдрома Криглера-Найяра
Специфического или этиотропного лечения синдрома Криглера-Найяра на сегодняшний день не существует, все терапевтические мероприятия назначаются для ускорения распада билирубина, его выведения из организма и защиты ЦНС. Особых отличий в терапии 1-го или 2-го типа заболевания нет (за исключением активизации микросомального окисления барбитуратами, которая не производится при 1-м типе), однако при СКН-1 лечение лишь незначительно оттягивает наступление летального исхода. Самым радикальным методом лечения синдрома Криглера-Найяра в настоящее время является операция по аллотрансплантации печени от родственника или генетически сходного донора - в этом органе происходит образование уридиндифосфатглюкуронидазы.
Синдром Криглера-Найяра 2-го типа лечат назначением умеренных доз барбитуратов для активации окисления билирубина и увеличения образования нужного фермента. Кроме того, показаны плазмаферез, гемосорбция, заместительное переливание крови - все эти процедуры направлены на удаление неконъюгированного билирубина из организма. Неплохие результаты у больных синдромом Криглера-Найяра дает фототерапия - облучение кожных покровов приводит к частичному разрушению билирубина и освобождению рецепторов тканей для новых порций этого токсина, что снижает его концентрацию в крови. Правильный питьевой режим и повышенное потребление жидкости ускоряет выведение токсина из организма, поэтому следует избегать обезвоживания. Необходим постоянный мониторинг уровня этого вещества в плазме крови, особенно опасным считается его количество свыше 300-340 мкмоль/л - при такой концентрации билирубин становится способным проникать через гематоэнцефалический барьер.
Прогноз и профилактика
Прогноз синдрома Криглера-Найяра 1-го типа исключительно плохой - из-за полного отсутствия активности фермента уридиндифосфатглюкуронидазы 1 больные умирают на протяжении первого года жизни из-за осложнений ядерной энцефалопатии. Течение СКН-2 зависит от таких факторов, как выраженность проявлений, своевременность диагностики и начала лечения, соблюдения рекомендаций специалистов, наличия или отсутствия сопутствующих заболеваний. В большинстве случаев прогноз относительно благоприятный - больные синдромом Криглера-Найяра 2-го типа могут прожить до преклонного возраста, из характерных проявлений патологии их может беспокоить только желтуха. Профилактика этого состояния возможна только в рамках консультации генетика для родителей, имеющих отягощенную наследственность по этому заболеванию, а также при помощи пренатальной диагностики.
Читайте также:
