Синдром мнимого избытка минералокортикоидов - причины, клиника, диагностика
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
Альдостерома - это гормонально активная опухоль клубочкового эпителия коры надпочечников, приводящая к развитию клинического синдрома Конна - первичного альдостеронизма. Среди симптомов альдостеромы выделяют сердечно-сосудистые (артериальную гипертензию, головные боли, кардиалгию, нарушение зрения), нервно-мышечные (миопатию, миалгию, парестезии, судороги), почечные (полиурию, полидипсию, изостенурию). Диагноз альдостеромы устанавливают по характерной клинической картине заболевания, результатам лабораторных анализов и инструментальных исследований: УЗИ, сцинтиграфии, КТ (МРТ), ангиографии и селективной венографии надпочечников. При альдостероме показано радикальное удаление опухоли с пораженным надпочечником (адреналэктомия).
МКБ-10
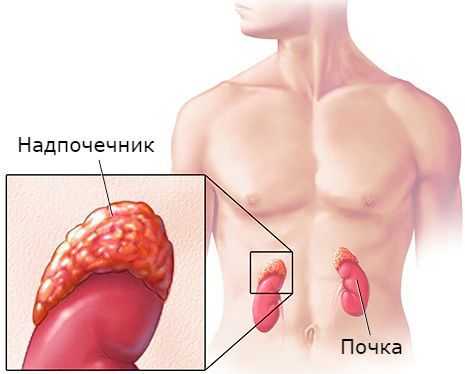
Общие сведения
Симптомокомплекс, обусловленный повышенной продукцией минералокортикоидного гормона альдостерона, был впервые описан Д. Конном, и получил название «первичного альдостеронизма» или синдрома Конна. В 70-85 % случаев причиной первичного гиперальдостеронизма являются аденомы надпочечников, в остальных случаях - гиперплазия коры надпочечников, опухоли щитовидной железы или яичников, обладающие гормональной активностью.
Под альдостеромой в клинической эндокринологии понимают альдостеронсекретирующую аденому надпочечников, развитие которой сопровождается признаками первичного альдостеронизма. Альдостеромы в большинстве случаев имеют доброкачественный характер, менее чем в 5% случаев - злокачественный. Альдостерома, как правило, выявляется в возрасте от 30 до 50 лет, причем у женщин в 3 раза чаще, чем у мужчин. Описаны случаи развития альдостеромы в детском возрасте.
Причины альдостеромы
Причины возникновения альдостеромы, как и многих других опухолевых образований коры надпочечников, достоверно неизвестны. Предположительно определенную роль в ее развитии играет наследственность.
Патогенез
Альдостерома проявляется автономной избыточной (увеличенной в 40-100 раз) секрецией минералокортикоидного гормона - альдостерона, регулирующего водно-электролитный обмен в организме. Высокий уровень альдостерона приводит к усилению реабсорбции ионов натрия в почечных канальцах и повышенной экскреции ионов калия, магния и водорода с мочой, что способствует задержке жидкости, гиперволемии, гипокалиемии и метаболическому алкалозу, патологическим изменениям в различных органах и системах. Особенностью первичного альдостеронизма при альдостероме является низкая активность ренина в плазме крови.
Доброкачественная альдостерома представляет собой небольшую (не более 1-3 см) опухоль надпочечника желто-коричневого цвета, окруженную тонкой соединительнотканной капсулой. Доброкачественная альдостерома может сочетаться с атрофией или гиперплазией окружающих ее зон коры надпочечников. Первичная злокачественная альдостерома, развивающаяся из собственных элементов коры надпочечников, характеризуется быстрым ростом, большим размером и массой; иногда при небольших размерах образования уже могут быть признаки метастазирования.
Альдостеромы чаще бывают одиночные (до 70-90% случаев), в 6% случаев - множественные с двусторонней локализацией. Морфологически альдостеромы имеют неоднородное строение: могут состоять из клеток, сходных с клетками пучковой или сетчатой зоны.
Симптомы альдостеромы
Клинические проявления альдостеромы обусловлены нарушениями, связанными с первичным альдостеронизмом, и представлены тремя основными синдромами - сердечно-сосудистым, нервно-мышечным и почечным.
Сердечно-сосудистый синдром при альдостероме вызван, главным образом, задержкой натрия и воды, гиперволемией, развитием отека внутренней оболочки сосудистой стенки (интимы) и сужением просвета сосудов, увеличением периферического сопротивления, повышением реактивности сосудов на действие прессорных факторов, в частности, альдостерона. Клиническая картина альдостеромы характеризуется постоянной умеренной или выраженной артериальной гипертензией, головной болью, развитием изменений глазного дна (гипертонической ангиопатией, ангиосклерозом, ретинопатией и нейроретинопатией), кардиалгией, гипертрофией, а в дальнейшем - дистрофией миокарда левого желудочка.
Нервно-мышечный синдром связан с дефицитом калия и магния, гиперхлоремическим ацидозом, дистрофическими изменениями мышечной и нервной ткани. При альдостероме это проявляется утомляемостью, мышечной слабостью различной степени выраженности, запорами, болями в пальцах рук и стоп, икроножных мышцах, нередко - парестезиями и судорогами. При альдостероме могут наблюдаться гипокалиемические кризы, сопровождающиеся острой головной болью, рвотой, одышкой, снижением (потерей) зрения, миоплегией, иногда наступлением вялого паралича или судорожными приступами, осложняющиеся развитием острой коронарной недостаточности, острого нарушения мозгового кровообращения (инсульта).
При злокачественных альдостеромах наряду с основными симптомами могут появляться боли в животе, повышение температуры тела и другие признаки интоксикации. Около 10% альдостером протекают бессимптомно.
Осложнения
При альдостероме развивается калиепеническая нефропатия, проявляющаяся нарушением концентрационной способностью почек, жаждой, обильным и частым мочеиспусканием (суточный диурез до 10 литров), никтурией, изостенурией. Периферические отеки для альдостеромы не характерны. При выраженной хронической гипокалиемии нарушаются возбудимость миокарда, секреция инсулина b-клетками поджелудочной железы и толерантность к глюкозе.
Диагностика
Диагностика альдостеромы основана на характерных клинических проявлениях синдрома, результатах лабораторных анализов, функциональных проб, инструментальных исследований. За 2 недели до обследования пациенту желательно прекратить прием гипотензивных препаратов.
- Инструментальная визуализация. УЗИ надпочечников и радиоизотопное сканирование (сцинтиграфию) надпочечников используют для выявления имеющихся патологических изменений и уточнения их характера (гиперплазия, опухоль), КТ надпочечников и МРТ надпочечников - для определения локализации и величины альдостеромы.
- Ангиография. Рентгенологические методы диагностики альдостеромы - пневмосупраренография и ангиография надпочечников могут давать неточные результаты из-за малых размеров опухоли и ее плохой васкуляризации. Селективная венография надпочечников с одновременным определением уровней альдостерона и кортизола в крови надпочечниковых вен является наиболее информативной, хотя ее проведение технически сложно и чревато осложнениями. Для альдостеромы характерно многократное увеличение соотношения альдостерон/кортизол.
- Лабораторная диагностика. В общем анализе мочи при альдостероме выявляется низкая относительная плотность и щелочная реакция, протеинурия, повышение суточной экскреции калия и альдостерона. Биохимический анализ крови обнаруживает гипернатриемию, гипокалиемию, высокий базальный уровень альдостерона в сыворотке, снижение активности ренина плазмы, гипохлоремический алкалоз.
- Специальные пробы. С целью диагностики первичного альдостеронизма при альдостероме проводят пробу с спиронолактоном, пробу с нагрузкой гидрохлоротиазидом, «маршевую» пробу.
Дифференциальная диагностика
Дифференциальная диагностика альдостеромы проводится с диффузной мелкоузелковой гиперплазией коры надпочечников, артериальной гипертонией, обусловленной другими синдромами (синдромом Иценко-Кушинга, злокачественной АГ, реноваскулярной АГ, синдромом мнимого избытка минералокортикоидов и др.), нефритом с потерей калия, несахарным диабетом, гиперпаратериозом, тетанией, вторичным альдостеронизмом.
Лечение альдостеромы
Лечение больных с альдостеромой заключается в проведении радикального удаления опухоли вместе с пораженным надпочечником - адреналэктомии. Если локализация альдостеромы известна, при оперативном вмешательстве применяется поясничный или торако-люмбальный доступы на соответствующей стороне, если локализация не определена - используется чрезбрюшинный доступ к обоим надпочечникам.
В предоперационном периоде (в течение 7-10 дней) назначают диету с ограничением содержания натрия, прием препаратов калия и антагонистов альдостерона. Для профилактики развития острой недостаточности коры надпочечников вследствие хирургического вмешательства по поводу альдостеромы показана терапия глюкокортикоидами. После операции необходим контроль уровня электролитов и показателей ЭКГ.
Прогноз
Удаление альдостеромы в 50-70% случаев способствует нормализации или значительному снижению артериального давления, в случае сохранения умеренной гипертензии проводится корректирующая консервативная терапия. При доброкачественной альдостероме и отсутствии необратимых изменений со стороны почек прогноз благоприятный. Злокачественные альдостеромы имеют неблагоприятное течение и прогноз.
2. Случай из клинической практики: Альдостерома надпочечника/ Жансеитова Д.П.// Вестник Казахского Национального медицинского университета. - 2013.
4. Первичный гиперальдостеронизм в терапевтической практике/ Киселева Е.Р. и др.// Сибирский медицинский журнал. - 2016.
Синдром Иценко-Кушинга (гиперкортицизм)
Синдром Иценко-Кушинга - патологический симптомокомплекс, возникающий вследствие гиперкортицизма, т. е. повышенного выделения корой надпочечников гормона кортизола либо длительного лечения глюкокортикоидами. Следует отличать синдром Иценко-Кушинга от болезни Иценко-Кушинга, под которой понимают вторичный гиперкортицизм, развивающийся при патологии гипоталамо-гипофизарной системы. Диагностика синдрома Иценко-Кушинга включает исследование уровня кортизола и гипофизарных гормонов, дексаметазоновую пробу, МРТ, КТ и сцинтиграфию надпочечников. Лечение синдрома Иценко-Кушинга зависит от его причины и может заключатся в отмене глюкокортикоидной терапии, назначении ингибиторов стероидогенеза, оперативном удалении опухоли надпочечников.
Синдром Иценко-Кушинга - патологический симптомокомплекс, возникающий вследствие гиперкортицизма, т. е. повышенного выделения корой надпочечников гормона кортизола либо длительного лечения глюкокортикоидами. Глюкокортикоидные гормоны участвуют в регуляции всех видов обмена веществ и многих физиологических функций. Работу надпочечников регулирует гипофиз путем секреции АКТГ - адренокортикотропного гормона, активизирующего синтез кортизола и кортикостерона. Деятельностью гипофиза управляют гормоны гипоталамуса - статины и либерины.
Такая многоступенчатая регуляция необходима для обеспечения слаженности функций организма и обменных процессов. Нарушение одного из звеньев этой цепи может вызвать гиперсекрецию глюкокортикоидных гормонов корой надпочечников и привести к развитию синдрома Иценко-Кушинга. У женщин синдром Иценко-Кушинга встречается в 10 раз чаще, чем у мужчин, развиваясь, преимущественно, в возрасте 25-40 лет.
Различают синдром и болезнь Иценко-Кушинга: последняя клинически проявляется той же симптоматикой, но в ее основе лежит первичное поражение гипоталамо-гипофизарной системы, а гиперфункция коры надпочечников развивается вторично. У пациентов, страдающих алкоголизмом или тяжелыми депрессивными расстройствами, иногда развивается псевдо-синдром Иценко-Кушинга.
Причины и механизм развития синдрома Иценко-Кушинга
Синдром Иценко-Кушинга - широкое понятие, включающее комплекс различных состояний, характеризующихся гиперкортицизмом. Согласно современным исследования в области эндокринологии более 80% случаев развития синдрома Иценко-Кушинга связано с повышенной секрецией АКТГ микроаденомой гипофиза (болезнь Иценко-Кушинга). Микроаденома гипофиза представляет небольшую (не более 2 см), чаще доброкачественную, железистую опухоль, продуцирующую адренокортикотропный гормон.
У 14-18% пациентов причиной синдрома Иценко-Кушинга является первичное поражение коры надпочечников в результате гиперпластических опухолевых образований коры надпочечников - аденомы, аденоматоза, аденокарциномы.
1-2% заболевания вызывается АКТГ-эктопированным или кортиколиберин-эктопированным синдромом - опухолью, секретирующей кортикотропный гормон (кортикотропиномой). АКТГ-эктопированный синдром может вызываться опухолями различных органов: легких, яичек, яичников, тимуса, околощитовидных, щитовидной, поджелудочной, предстательной железы. Частота развития лекарственного синдром Иценко-Кушинга зависит от правильности применения глюкокортикоидов в лечении пациентов с системными заболеваниями.
Гиперсекреция кортизола при синдроме Иценко-Кушинга вызывает катаболический эффект - распад белковых структур костей, мышц (в том числе и сердечной), кожи, внутренних органов и т. д., со временем приводя к дистрофии и атрофии тканей. Усиление глюкогенеза и всасывания в кишечнике глюкозы вызывает развитие стероидной формы диабета. Нарушения жирового обмена при синдроме Иценко-Кушинга характеризуется избыточным отложением жира на одних участках тела и атрофией на других ввиду их разной чувствительности к глюкокортикоидам. Влияние избыточного уровня кортизола на почки проявляется электролитными расстройствами - гипокалиемией и гипернатриемией и, как следствие, повышением артериального давления и усугублением дистрофических процессов в мышечной ткани.
В наибольшей степени от гиперкортицизма страдает сердечная мышца, что проявляется в развитии кардиомиопатии, сердечной недостаточности и аритмий. Кортизол оказывает угнетающее действие на иммунитет, вызывая у пациентов с синдромом Иценко-Кушинга склонность к инфекциям. Течение синдрома Иценко-Кушинга может быть легкой, средней и тяжелой формы; прогрессирующим (с развитием всего симптомокомплекса за 6-12 месяцев) или постепенным (с нарастанием в течение 2-10 лет).
Симптомы синдрома Иценко-Кушинга
Наиболее характерным признаком синдрома Иценко-Кушинга служит ожирение, выявляемое у пациентов более чем в 90% случаев. Перераспределение жира носит неравномерный характер, по кушингоидному типу. Жировые отложения наблюдаются на лице, шее, груди, животе, спине при относительно худых конечностях («колосс на глиняных ногах»). Лицо становится лунообразным, красно-багрового цвета с цианотичным оттенком («матронизм»). Отложение жира в области VII шейного позвонка создает, так называемый, «климактерический» или «бизоний» горб. При синдроме Иценко-Кушинга ожирение отличает истонченная, почти прозрачная кожа на тыльных сторонах ладоней.
Со стороны мышечной системы наблюдается атрофия мышц, снижение тонуса и силы мускулатуры, что проявляется мышечной слабостью (миопатией). Типичными признаками, сопровождающими синдром Иценко-Кушинга, являются «скошенные ягодицы» (уменьшение объема бедренных и ягодичных мышц), «лягушачий живот» (гипотрофия мышц живота), грыжи белой линии живота.
Кожа у пациентов с синдромом Иценко-Кушинга имеет характерный «мраморный» оттенок с хорошо заметным сосудистым рисунком, склонна к шелушению, сухости, перемежается с участками потливости. На коже плечевого пояса, молочных желез, живота, ягодиц и бедер образуются полосы растяжения кожи - стрии багровой или цианотичной окраски, длиной от нескольких миллиметров до 8 см и шириной до 2 см. Наблюдаются кожные высыпания (акне), подкожные кровоизлияния, сосудистые звездочки, гиперпигментация отдельных участков кожи.
При гиперкортицизме нередко развивается истончение и повреждение костной ткани - остеопороз, ведущий к сильным болезненным ощущениям, деформации и переломам костей, кифосколиозу и сколиозу, более выраженных в поясничном и грудном отделах позвоночника. За счет компрессии позвонков пациенты становятся сутулыми и меньше ростом. У детей с синдромом Иценко-Кушинга наблюдается отставание в росте, вызванное замедлением развития эпифизарных хрящей.
Нарушения со стороны сердечной мышцы проявляются в развитии кардиомиопатии, сопровождающейся аритмиями (фибрилляцией предсердий, экстрасистолией), артериальной гипертензией и симптомами сердечной недостаточности. Эти грозные осложнения способны привести к гибели пациентов. При синдроме Иценко-Кушинга страдает нервная система, что выражается в ее нестабильной работе: заторможенности, депрессиях, эйфории, стероидных психозах, суицидальных попытках.
В 10-20% случаев в ходе заболевания развивается стероидный сахарный диабет, не связанный с поражениями поджелудочной железы. Протекает такой диабет довольно легко, с длительным нормальным уровнем инсулина в крови, быстро компенсируется индивидуальной диетой и сахароснижающими препаратами. Иногда развиваются поли- и никтурия, периферические отеки.
Гиперандрогения у женщин, сопровождающая синдром Иценко-Кушинга, вызывает развитие вирилизации, гирсутизма, гипертрихоза, нарушений менструального цикла, аменореи, бесплодия. У пациентов-мужчин наблюдаются признаки феминизации, атрофия яичек, снижение потенции и либидо, гинекомастия.
Хроническое, прогрессирующее течение синдрома Иценко-Кушинга с нарастающей симптоматикой может приводить к гибели пациентов в результате осложнений, несовместимых с жизнью: декомпенсации сердечной деятельности, инсультов, сепсиса, тяжелого пиелонефрита, хронической почечной недостаточности, остеопороза с множественными переломами позвоночника и ребер.
Неотложным состоянием при синдроме Иценко-Кушинга является адреналовый (надпочечниковый) криз, проявляющийся нарушением сознания, артериальной гипотензией, рвотой, болями в животе, гипогликемией, гипонатриемией, гиперкалиемией и метаболическим ацидозом.
В результате снижения резистентности к инфекциям у пациентов с синдромом Иценко-Кушинга нередко развиваются фурункулез, флегмоны, нагноительные и грибковые заболевания кожи. Развитие мочекаменной болезни связано с остеопорозом костей и выделением с мочой избытка кальция и фосфатов, приводящих к образованию оксалатных и фосфатных камней в почках. Беременность у женщин с гиперкортицизмом часто заканчивается выкидышем или осложненными родами.
Диагностика синдрома Иценко-Кушинга
При подозрении у пациента синдрома Иценко-Кушинга на основании амнестических и физикальных данных и исключении экзогенного источника поступления глюкокортикоидов (в т. ч. ингаляционного и внутрисуставного), в первую очередь выясняется причина гиперкортицизма. Для этого используется скрининговые тесты:
- определение экскреции кортизола в суточной моче: повышение кортизола в 3-4 раза и более свидетельствует о достоверности диагноза синдрома или болезни Иценко-Кушинга.
- малую дексаметазоновую пробу: в норме прием дексаметазона снижает уровень кортизола более чем в половину, а при синдроме Иценко-Кушинга снижения не происходит.
Дифференциальную диагностику между болезнью и синдромом Иценко-Кушинга позволяет провести большая дексаметазоновая проба. При болезни Иценко-Кушинга прием дексаметазона приводит к снижению концентрации кортизола более чем в 2 раза от исходного; при синдроме снижения кортизола не происходит.
В моче повышено содержание 11-ОКС (11-оксикетостероидов) и снижено 17-КС. В крови гипокалиемия, увеличение количества гемоглобина, эритроцитов и холестерина. Для определения источника гиперкортицизма (двусторонняя гиперплазия надпочечников, аденома гипофиза, кортикостерома) проводится МРТ или КТ надпочечников и гипофиза, сцинтиграфия надпочечников. С целью диагностики осложнений синдрома Иценко-Кушинга (остеопороза, компрессионных переломов позвонков, перелома ребер и т. д.) проводится рентгенография и КТ позвоночника, грудной клетки. Биохимическое исследование показателей крови диагностирует электролитные нарушения, стероидный сахарный диабет и др.
Лечение синдрома Иценко-Кушинга
При ятрогенной (лекарственной) природе синдрома Иценко-Кушинга необходима постепенная отмена глюкокортикоидов и замена их на другие иммунодепрессанты. При эндогенной природе гиперкортицизма назначаются препараты, подавляющие стероидогенез (аминоглютетимид, митотан).
При наличии опухолевого поражения надпочечников, гипофиза, легких проводится хирургическое удаление новообразований, а при невозможности - одно- или двусторонняя адреналэктомия (удаление надпочечника) или лучевая терапия гипоталамо-гипофизарной области. Лучевую терапию часто проводят в комбинации с хирургическим или медикаментозным лечением для усиления и закрепления эффекта.
Симптоматическое лечение при синдроме Иценко-Кушинга включает применение гипотензивных, мочегонных, сахароснижающих препаратов, сердечных гликозидов, биостимуляторов и иммуномодуляторов, антидепрессантов или седативных средств, витаминотерапию, лекарственную терапию остеопороза. Проводится компенсация белкового, минерального и углеводного обмена. Послеоперационное лечение пациентов с хронической надпочечниковой недостаточностью, перенесших адреналэктомию, состоит в постоянной заместительной гормональной терапии.
Прогноз синдрома Иценко-Кушинга
При игнорировании лечения синдрома Иценко-Кушинга развиваются необратимые изменения, приводящие к летальному исходу у 40-50% пациентов. Если причиной синдрома явилась доброкачественная кортикостерома, прогноз удовлетворительный, хотя функции здорового надпочечника восстанавливаются только у 80% пациентов. При диагностике злокачественных кортикостером прогноз пятилетней выживаемости - 20-25% (в среднем 14 месяцев). При хронической надпочечниковой недостаточности показана пожизненная заместительная терапия минерало- и глюкокортикоидами.
В целом прогноз синдрома Иценко-Кушинга определяется своевременностью диагностики и лечения, причинами, наличием и степенью выраженности осложнений, возможностью и эффективностью оперативного вмешательства. Пациенты с синдромом Иценко-Кушинга находятся на динамическом наблюдении у эндокринолога, им не рекомендуются тяжелые физические нагрузки, ночные смены на производстве.
Первичный гиперальдостеронизм: симптомы, диагностика, лечение синдрома Конна

Врач гинеколог-эндокринолог. Стаж 23+ лет. Принимает в Университетской клинике в Санкт-Петербурге. Стоимость приема 2000 руб.
- Запись опубликована: 19.09.2022
- Reading time: 6 минут чтения
Гиперальдостеронизм — одна из наиболее распространенных причин вторичной гипертензии. Это патологическое состояние вызвано чрезмерной выработкой гормона альдостерона надпочечниками. При первичном гиперальдостеронизме увеличение секреции альдостерона связано с аномалиями, расположенными внутри самих надпочечников. При вторичном гиперальдостеронизме аномалии, вызывающие повышение концентрации альдостерона, возникают вне надпочечников.
Альдостерон влияет на поддержание натриевого и калиевого баланса. Избыток альдостерона вызывает задержку натрия и воды в организме, что приводит к повышению артериального давления. Повышенное кровяное давление вызывает повышенный риск инсульта, инфаркта, сердечной и почечной недостаточности.
Что такое гиперальдостеронизм
Первичный гиперальдостеронизм - это ренин-независимый синдром перепроизводства альдостерона, характеризующийся повышенной концентрацией альдостерона, снижением активности ренина плазмы, повышением артериального артериального давления, гипокалиемией и метаболическим алкалозом. Проблема связана с органической патологией надпочечников, например, аденомой или гиперплазией.
Классические симптомы первичного гиперальдостеронизма - гипертония и гипокалиемия, но уровень калия также может находиться в пределах нормы.
Патология была впервые описана в 1954 г. доктором Конном, который диагностировал у пациента резистентную гипертензию, гипокалиемию и альдостерон-продуцирующий аденому надпочечников. Поэтому гиперальдостеронизм, развившийся из-за аденомы, продуцирующей альдостерон, называется синдром Конна.
Статистика распространенности заболевания
Точная распространенность первичного гиперальдостеронизма неизвестна, но последние исследования показывают, что проблема затрагивает 10-13% случаев артериальной гипертензии. Наиболее частая причина - реципрокная гиперплазия надпочечников. Такая патология чаще диагностируется у мужчин после 50 лет. У женщин обычно выявляется альдостерома. Классический возраст больных - 30-30 лет.
Таблица 1. Наиболее распространенные причины и классификация первичного гиперальдостеронизма
| Причина ПГ | Случаи, % |
| Односторонняя или двусторонняя альдостерон-продуцирующая аденома надпочечников | до 40 |
| Идиопатический гиперальдостеронизм и гиперплазия обоих надпочечников | 25-60 |
| Первичная гиперплазия одного надпочечника | 2 |
| Альдостерон-продуцирующая карцинома | 1 |
| Семейный гиперальдостеронизм:Тип I - глюкокортикоид-зависимый гиперальдостеронизм, Тип II - односторонняя или двусторонняя альдостерон-продуцирующая аденома или идиопатический гиперальдостеронизм и гиперплазия обоих надпочечников | |
| Эктопическая альдостерон-продуцирующая аденома или карцинома (может присутствовать при наличии опухолей яичников и почек) |
Патофизиология ПГ
При первичном гиперальдостеронизме надпочечники автономно выделяют альдостерон, что приводит к ингибированию (подавлению) эндогенной системы ренина и ангиотензина. Альдостерон вызывает задержку соли в почках и потерю калия, результатом чего становится повышение содержания натрия в организме, что приводит к угнетению синтеза ренина в почках.
Прямое влияние альдостерона на дистальный нефрон приводит к задержке натрия и потере ионов водорода и калия, что приводит к развитию гипокалимического алкалоза, хотя концентрации калия в плазме могут сохраняться и существенно не снижаться или соответствовать норме у каждого второго больного.
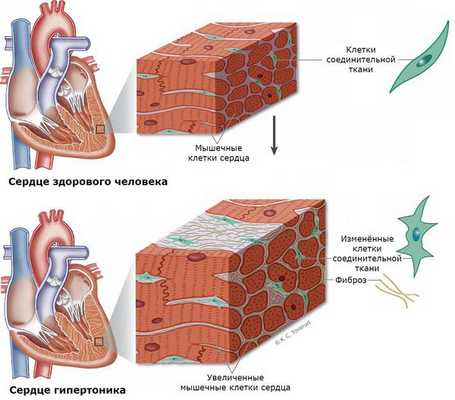
Кроме того, альдостерон оказывает патофизиологическое действие на многие другие ткани, например, может привести к фиброзу сердца, дисфункции эндотелия сосудов и нефросклерозу.
Клинические признаки первичного гиперальдостеронизма
Наиболее важный первичный клинический признак ПГ - гипертония, обычно умеренная или высокая (>180/110 мм рт.ст.), устойчивая к обычному лечению, требующая применения 3-х и более препаратов, снижающих артериальное давление. Гипертония, вызванная альдостерон-продуцирующей аденомой надпочечников, характеризуется более тяжелой гипертензией и более частым выявлением гипокалиемии, а при идиопатической гиперплазии надпочечников клинические признаки могут быть менее выраженными. К сожалению, эти клинические признаки не считаются надежными в плане дифференциации альдостерон-продуцирующей аденомы от идиопатической гиперплазии надпочечников.
Повышенное артериальное давление может проявляться головными болями, нарушениями зрения, болями в груди. Плохо контролируемая гипертония может привести к опасным для жизни осложнениям, поэтому важно определить причину повышенного артериального давления и быстро начать лечение.
Второй признак первичного гиперальдостеронизма - гипокалиемия, обычно бессимптомная. Гипокалиемия может привести к аритмии, мышечной слабости, болезненным мышечным спазмам, повышенной жажде и усилению мочеиспускания. Ранее гипокалиемия считалась одним из наиболее важных клинических признаков ПГ, но затем исследования показали, что этот симптом есть менее, чем у 40% больных.
Иногда из-за выраженной гипокалиемии у пациентов могут наблюдаться:
- тетания - болезненные и непроизвольные сокращения мышц;
- миопатия - хронические нервные заболевания с первичным поражением мышц;
- полиурия - чрезмерная выработка мочи; - активный ночной диурез (гипокалиемический нефрогенный несахарный диабет).
Также возможна ассоциация с остеопорозом. Снижение концентрации калия в плазме крови сопровождается метаболическим алкалозом.
Пациенты с первичным гиперальдостеронизмом имеют более высокую частоту и смертность от сердечно-сосудистых заболеваний по сравнению с больными с первичной артериальной гипертензией с таким же увеличением артериального давления. Влияние гиперальдостеронизма на сердечно-сосудистую систему не зависит от концентрации калия в плазме. Пациенты с диагнозом гиперальдостеронизм имеют большие размеры левого желудочка. Из-за повышенного риска сердечно-сосудистых патологий повышается риск развития инсульта, инфаркта миокарда и фибрилляции предсердий.
Возможны и другие клинические признаки, такие как гипернатриемия (концентрация натрия в плазме крови у пациентов с ЛГ составляет 143-147 ммоль/л), гипомагниемия.
Что делать при появлении симптомов гиперальдостеронизма?
При появлении симптомов следует обратиться к эндокринологу, который после сбора анамнеза, осмотра и измерения артериального давления назначит анализы на концентрации электролитов в сыворотке крови. В случае выявления отклонений и подозрения на первичный гиперальдостеронизм он направит пациента на дальнейшую диагностику.
Диагностика первичного гиперальдостеронизма
В 2016 г. Европейское Общество эндокринологов обновило клинические рекомендации по диагностике и лечению первичного гиперальдостеронизма. Ранее рекомендовалось обследование на гиперальдостеронизм всем пациентам с умеренной и тяжелой гипертензией (>160/100 мм рт.ст.), независимо от уровня калия в крови.
Новые руководящие принципы расширили этот список. В него включили больных с постоянно повышенным артериальным давлением (>150 мм рт.ст. (систолическое) и >100 мм рт.ст. (диастолическое)) и пациентов с гипертонией и апноэ сна.
Рекомендуемый в Европе алгоритм диагностики первичного гиперальдостеронизма включает 4 этапа.
Таблица 2. Этапы диагностики ЛГ первичного гиперальдостеронизма
| Этап | Диагностика |
| 1 | Выявление симптомов, дающих основание подозревать гиперальдостеронизм. Пациента нужно обследовать, если у него есть хотя бы 1 из 5 состояний (см. таблицу 3) |
| 2 | Первичный скрининговый тест - изучаются концентрация альдостерона в плазме и прямая концентрация ренина, затем рассчитывается отношение альдостерона к ренину |
| 3 | Анализы для подтверждения диагноза |
| 4 | Определение подтипа патологии |
Таблица 3. Признаки, требующие диагностики первичного гиперальдостеронизма
| Состояние | |
| 1 | Лечение устойчивой артериальной гипертензии (АКС >140/90 мм рт.ст. при лечении 3 группами антигипертензивных препаратов) |
| 2 | Артериальная гипертензия и спонтанная или мочегонная гипокалиемия |
| 3 | Артериальная гипертензия и эпизодиома |
| 4 | Раннее начало артериальной гипертензии и/или инсульта ( |
| 5 | Все пациенты с артериальной гипертензией с родственниками первой линии с диагнозом гиперальдостеронизм |
Результаты исследования могут быть искажены многими факторами и лекарствами, поэтому анализы проводятся в стандартизированных условиях. Перед проведением лабораторных исследований необходимо скорректировать уровень калия и натрия, прекратить прием препаратов (временная отмена некоторых препаратов, обычно за 4-6 недель до теста), способных повлиять на результаты исследования. В их числе:
- спиронолактон;
- ингибиторы ангиотензинпревращающего фермента;
- блокаторы рецепторов ангиотензина II;
- ингибиторы ренина, бета-адреноблокаторы; ;
- дигидропиридины;
- агонисты центрального действия α-2 (клонидин, α-метилдопа); .
Для коррекции артериальной гипертензии препаратами с минимальным воздействием на соотношение ПАК/ТРК рекомендуемый препарат первого выбора - не дигидропиридиновый блокатор кальциевых каналов, например, верапамил. При персистенции неконтролируемой гипертензии могут добавляться альфа-адреноблокаторы, например, доксазозин.
У пациентов с первичным альдостеронизмом обычно наблюдается снижение концентрации калия в крови, повышение концентрации альдостерона, снижение активности ренина плазмы и повышение альдостерон-ренинового индекса, обусловленное коэффициентом двух предыдущих значений. Первичный гиперальдостеронизм подозревается, если концентрация альдостерона в плазме (ng/dl)/прямая концентрация ренина (ng/l) составляет >5,7. Пределы соотношения могут варьироваться в зависимости от системы единиц измерения, используемой в лабораториях.
Обнаружив вышеперечисленные отклонения, врач примет решение о необходимости проведения дальнейших тестов, оценивающих гормональную функцию надпочечников, так называемых функциональных проб.
Третий этап представляет собой тест на подтверждение диагноза, направленный на подтверждение автономной выработки альдостерона. Рекомендуется проводить 1 из 4 проб: с пероральным прием соли, с 0,9% раствором NaCl, супрессионный тест на флудрокортизон, провокацию каптоприлом. Наиболее часто используемый тест с NaCl. Концентрация альдостерона после введения NaCl не снижается ниже 10 нг/дл, а у здоровых людей составляет менее 5 нг/дл.
Пациентам с неконтролируемой гипертензией, сердечной недостаточностью, почечной недостаточностью, аритмией, гипокалиемией рекомендуется пройти тест с провокацией каптоприлом, измеряющим изменение уровней ренина в плазме в ответ на препарат каптоприл.
После подтверждения диагноза проводится компьютерная томография (КТ) органов брюшной полости для определения подтипа патологии. КТ проводится для определения причины гиперальдостеронизма - аденомы надпочечников, гиперплазии или карциномы (подозревается при обнаружении односторонней опухоли >4 см). Магнитно-резонансная томография (МРТ) не имеет преимуществ перед КТ, поэтому не рекомендуется в качестве стандартного метода обследования. Чувствительность КТ - 78%, специфичность - 75%.
Данные КТ надпочечников определяют дальнейшую тактику обследования и лечения. Например, если при КТ обнаружен односторонний гиподенсный узел (участок, отличающийся по плотности или цвету и четкими границами на изображении) и пациенту более 35 лет, следующий диагностический этап - исследование венозной крови надпочечников. Для уточнения того, где происходит перепроизводство альдостерона, проводят катетеризацию надпочечниковых вен и тест на венозную кровь надпочечников. Это золотой стандарт оценки латерализации первичного гиперальдостеронизма, с чувствительностью - 95% и специфичностью - 100%.
Если патология выявлена у больного в возрасте до 20 лет с положительным семейным анамнезом или инсультом до 40 лет, необходима консультация генетика.
Лечение первичного гиперальдостеронизма
Цель лечения гиперальдостеронизма - нормализация артериального давления и концентрации калия в крови.
Тактика лечения зависит от причины патологии. При одностороннем гиперальдостеронизме, когда причина первичного альдостеронизма - опухоль надпочечников, секретирующая альдостерон, лечение выбора заключается в хирургическом удалении надпочечников вместе с опухолью лапароскопическим методом - лапароскопическая адреналэктомия. Важная предоперационная подготовка - коррекция гипокалиемии и гипертонической болезни. Лекарства первого выбора - антагонисты минералкортикоидных рецепторов. Рекомендуемая продолжительность лечения - до 5 недель.
После операции необходимо наблюдать за уровнем калия, так как из-за временного гипоальдостеронизма, вызванного контраллатеральной супрессией надпочечников, может возникнуть гиперкалиемия. По возможности следует уменьшить дозы антигипертензивных препаратов.
На следующий день после операции следует проверить активность альдостерона и ренина в плазме крови - это ранний биохимический показатель операционного успеха.
Первые несколько недель после операции не следует уменьшать количество поваренной соли в еде.
Важно понимать, что операция помогает снять давление не всем больным. После хирургического лечения артериальная гипертензия сохраняется примерно в половине случаев.
Пациентам после односторонней адреналэктомии требуется длительное наблюдение. Каждые 6-12 месяцев придется сдавать анализы на альдостерон, ренин, электролиты, и ежедневно измерять давление. Через год после операции нужно сделать КТ органов брюшной полости с последующим повторением КТ каждые 1-3 года.
При диагностике двусторонней гиперплазии надпочечников терапия включает фармакологическое лечение и модификацию образа жизни (рекомендуется поддерживать нормальную массу тела, умеренные физические нагрузки и диету с ограничением потребления соли
Для медикаментозного лечения используются диуретики, которые снижают действие альдостерона и повышают концентрацию калия в крови (спиронолактон и эплеренон). Эти препараты также применяются у пациентов с аденомой надпочечников, секретирующих альдостерон перед операцией или в случае противопоказаний к процедуре.
В случае семейного гиперальдостеронизма также назначается медикаментозное лечение.
- Антагонисты минералокортикоидных рецепторов. Это препараты первого выбора. Первым назначается спиронолактон. Начальная доза 12,5-25 мг 1 к./сут, постепенно дозу увеличивают до 100 мг. При персистенции неконтролируемого артериального давления, гипокалиемии доза может быть увеличена до 400 мг. Основные нежелательные эффекты после приема этого препарата: у мужчин - гинекомастия, у женщин - нарушения менструального цикла, болезненность груди. При плохой переносимости спиронолактона назначают эплеренон, не обладающий антиандрогенным действием прогестерона. Начальная доза - 25 мг 2 к./сут, стандартная доза - 50-200 мг/сут.
- Калийсберегающие диуретики. Например, триамтерен или амилорид. Препараты второй линии назначаются, когда не переносятся антагонисты минералокортикоидных рецепторов. В большинстве случаев требуется повышенная доза амилорида (до 40 мг/сут). При его приеме необходимо контролировать уровень калия в крови.
- Блокаторы кальциевых каналов. Например, нифедипин. Могут быть полезны, потому что, блокируя диффузию кальция в адренокортикальную клетку, они уменьшают выработку альдостерона. При наследственном гиперальдостеронизме требуется длительное наблюдение за больными - каждые 3-6 месяцев нужно проводить анализы на концентрацию калия, креатинина в крови, ежедневно измерять давление, при наличии опухолей и др. изменений повторять КТ надпочечников каждые 3-4 года.
- Глюкокортикоиды. Могут назначаться небольшие дозы для лечения глюкокортикоид-зависимого гиперальдостеронизма. Например, может быть выписан дексаметазон 0,25-0,5 мг перед сном.
При лечении глюкокортикоидами необходимо каждые 2-3 года проходить обследование на минеральную плотность костей на предмет возможного остеопороза.
Можно ли полностью вылечить гиперальдостеронизм?
Хирургическое лечение альдостеронсекрецирующей аденомы приводит к полному разрешению симптомов гиперальдостеронизма у 35-70% больных. Пациентам с двусторонней гиперплазией надпочечников рекомендуется постоянно соблюдать ограниченную солью диету и поддерживать пожизненное фармакологическое лечение, направленное на нормализацию концентрации калия в крови и контроль артериального давления. Только хорошо контролируемое артериальное давление позволит избежать органных осложнений (инсульт, инфаркт).
Что нужно сделать после окончания лечения гиперальдостеронизма?
После хирургического лечения альдостерон-секретирующей аденомы надпочечников некоторым пациентам требуется продолжение лечения гипертонической болезни. После хирургического лечения требуется оценка концентрации кортизола в крови, что обусловлено возможным риском развития надпочечниковой недостаточности. Рекомендуется регулярный контроль артериального давления.
Также нужно вести здоровый образ жизни, положительно влияющий на контроль артериального давления, в том числе: снижение соли в рационе, поддержание здоровой массы тела, регулярные физические упражнения, ограничение количества потребляемого алкоголя и отказ от курения.
Что делать, чтобы не заболеть гиперальдостеронизмом?
Способов предотвратить возникновение первичного гиперальдостеронизма пока не разработано. Однако ранняя диагностика и применение соответствующего лечения, направленного на надлежащий контроль артериального давления, позволяет уменьшить сердечно-сосудистые осложнения и, таким образом, снизить смертность.
Выводы
Первичный гиперальдостеронизм приводит более чем к каждому десятому случаю гипертонии - это одна из самых распространенных причин вторичной гипертонии. У пациентов с гиперальдостеронизмом заболеваемость и смертность от сердечно-сосудистых заболеваний выше по сравнению с пациентами с первичной артериальной гипертензией, которые имеют такой же порог артериального давления.
Поэтому первичный гиперальдостеронизм следует подозревать, если больной соответствует хотя бы 1 из 5 критериев. Перед проведением скринингового теста необходимо скорректировать уровень калия и натрия в крови, прекратить прием лекарств, способных повлиять на результаты исследования. После подтверждения диагноза проводится КТ органов брюшной полости, данные которой определяют дальнейшую тактику обследования и лечения.
Синдром Кушинга: симптомы, диагностика, лечение

- Запись опубликована: 27.07.2022
- Reading time: 9 минут чтения
Синдром Кушинга - группа симптомов, возникающих в результате избытка в организме гормонов коры надпочечников: глюкокортикоидов, андрогенов, минералокортикоидов. Патология может развиться в любом возрасте. Помимо ожирения и растяжек, состояние приводит к серьезным осложнениям.
Синдром Кушинга может быть первым симптомом злокачественной опухоли.
Что такое надпочечники
Надпочечники - парные эндокринные железы. Они имеют небольшие размеры и расположены над почками. Вес одного надпочечника колеблется от 10 до 18 грамм.
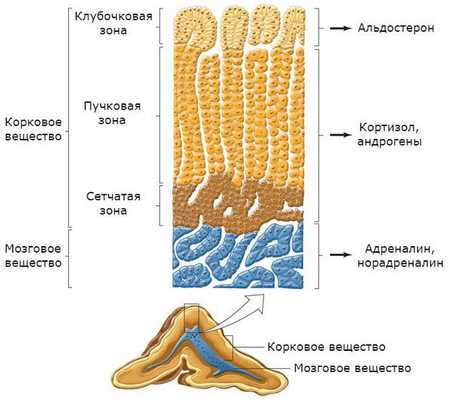
Надпочечники состоят из коркового (80-90% железы) и мозгового (10-20% железы) отделов, различающихся по строению и функциям.
За иннервацию надпочечников отвечает надпочечниковое сплетение, состоящее из волокон блуждающего, диафрагмального и висцерального нервов.
Основная работа надпочечников заключается в выработке гормонов, управляющих многими процессами в организме.
Гормоны коры надпочечников и их функции
В надпочечниках вырабатываются разные гормоны с абсолютно разными функциями. По этому признаку их можно разделить на группы.
Гормоны, выделяемые корковым отделом надпочечников
Наиболее сильную активность среди этих гормонов демонстрирует альдостерон - органическое химическое соединение из группы стероидов. Функции альдостерона:
- участвует в регуляции водно-минерального баланса организма, поддерживает надлежащий уровень минеральных солей и воды в организме;
- влияет на функционирование почечных канальцев, увеличивая всасывание солей натрия и ограничивая их экскрецию с мочой;
- уменьшает количество крови, проходящей через почки, тем самым уменьшая количество выделяемой мочи;
- участвует в транспортных процессах в почках;
- вместе с ренином и ангиотензином регулирует кровяное давление.
Наиболее важный гормон в группе глюкокортикоидов - кортизол, известный как гормон стресса. Характерная особенность кортизола - циркадный ритм секреции, поэтому наибольшая его концентрация наблюдается в утренние часы, а наименьшая около полуночи.
- обладает противовоспалительными свойствами, поэтому часто входит в состав сильнодействующих препаратов для противодействия воспалению;
- влияет на уровень глюкозы в крови, вызывает повышение уровня глюкозы, например, в стрессовые моменты;
- способствует высвобождению аминокислот, ускорению глюконеогенеза - образованию глюкозы из неуглеводных соединений, задержке солей в организме;
- участвует в расщеплении жирных кислот и снижает использование глюкозы скелетными мышцами при интенсивных физических нагрузках.
Половые гормоны - андрогены
Андрогены, например, тестостерон, вырабатываются в надпочечниках в небольшом количестве. Эти гормоны ускоряют рост организма и отвечают за формирование вторичных мужских половых признаков.
Гормоны, выделяемые мозговым веществом надпочечников
Задача адреналина - повлиять на реакцию организма в ситуации стресса или возникающей опасности. При увеличении уровня адреналина в крови:
- учащается сердцебиение;
- повышается артериальное давление;
- расширяются зрачки;
- угнетается перистальтика кишечника;
- увеличивается уровень глюкозы в крови.
Адреналин вводят больным в случаях анафилактического шока или реанимации.
Норадреналин вырабатывается не только в мозговом веществе надпочечников, но и в ядрах ствола головного мозга. Функции норадреналина:
- воздействует на систему кровообращения, повышая систолическое и диастолическое артериальное давление;
- действуя на симпатические нервы кишечника, снижает тонус кишечника.
Во время сна выделение норадреналина незначительно, при пробуждении и вставании оно увеличивается;
Дофамин вырабатывается в небольших количествах в мозговом веществе надпочечников, но в основном синтезируется в нейронах. Функции дофамина:
- способствует выработке положительного психоэмоционального настроя, проявлению эмоций;
- регулирует концентрацию других гормонов, особенно пролактина;
- повышает кровяное давление и силу мышечного сокращения - это свойство дофамина используется при лечении травматического, септического и кардиогенного шоков.
Варианты синдрома Кушинга
Болезнь проявляется по-разному:
Экзогенный синдром Кушинга. Экзогенный синдром Кушинга возникает при длительном лечении глюкокортикостероидами. Глюкокортикоиды применяют при лечении: астмы, ревматоидного артрита, системной красной волчанки, воспалительных заболеваний, у больных после трансплантации органов для предотвращения отторжения пересаженного органа.
Эндогенный синдром Кушинга. При эндогенном синдроме Кушинга организм сам вырабатывает слишком много глюкокортикоидов.
Это может произойти по 3 причинам:
- Доброкачественная опухоль гипофиза - микроаденома, продуцирующая гормон АКТГ, стимулирующий работу надпочечников и выработку ими гормонов;
- Первичная гиперфункция надпочечников, вызванная опухолью или гиперплазией надпочечников - увеличением количества клеток железы;
- Опухоль за пределами гипофиза, вырабатывающая АКТГ - эктопическая секреция АКТГ.
Статистика заболеваемости синдромом Кушинга
Эндогенный синдром Кушинга — очень редкое заболевание. Женщины болеют примерно в 3 раза чаще, чем мужчины. Чаще всего страдают люди в возрасте около 40 лет, но дети и подростки тоже могут заболеть синдромом Кушинга. С другой стороны, экзогенный синдром Кушинга, вызванный лекарствами, встречается относительно часто.
Синдром Кушинга: признаки и симптомы
Перепроизводство стероидов вызывает ряд изменений в организме.
Симптомы синдрома Кушинга:
- накопление жира на туловище при сохранении стройности верхних и нижних конечностей;
- большое круглое лицо;
- увеличение количества жировой ткани вокруг шеи и плеч - шея буйвола;
- тонкая, нежная кожа, склонная к синякам и медленному заживлению ран;
- на коже живота, бедер, груди, вокруг подмышек и коленных впадин появляются сине-красные растяжки, кожа становится дряблой; ;
- боли в костях, серьезные переломы;
- высокое кровяное давление; в крови; ;
- обильное выделение мочи - полиурия, сильная жажда;
- пациенты становятся более восприимчивыми к инфекциям;
- затуманенное зрение;
- нервно-психические расстройства - депрессия, нарушения сна;
- у детей: склонность к ожирению, раннее появление полового оволосения, андрогенизация в виде гиперплазии клитора, макрогенитосомия без увеличения объема яичек, задержка развития молочных желез;
- у женщин: появление волос на теле по мужскому типу - гирсутизм, нарушения менструального цикла;
- у мужчин: снижение потенции, импотенция.
Таблица 1. Основные симптомы синдрома Кушинга и их распространенность
| Симптомы | Приблизительная частота |
| Ожирение туловища - большой живот, сильные плечи и грудь | 90% |
| Широкое лицо | 85% |
| Чрезмерное оволосение у женщин или гирсутизм | 80% |
| Нарушение менструального цикла, импотенция | 75% |
| Высокое кровяное давление | 75% |
| Остеопороз | 60% |
| Красные растяжки на коже | 60% |
| Мышечная слабость | 60% |
Осложнения, возникающие при избытке глюкокортикостероидов или синдроме Кушинга:
- ; ;
- дислипидемия - нарушение липидного обмена, ведуще к атеросклерозу; ; ;
- катаракта;
- глаукома; ;
- язвы желудка и двенадцатиперстной кишки; ; - от депрессивных состояний до редких психотических эпизодов.
Синдром Кушинга: обследование и диагностика
Диагноз ставится на основании истории болезни, физического осмотра и лабораторных анализов.
Эндокринолог сначала опрашивает пациента о принимаемых им лекарствах, чтобы исключить экзогенный характер синдрома Кушинга, возникающий при приеме препаратов, содержащих кортикостероиды.
Лабораторные анализы
Врачи для диагностики синдрома Кушинга назначают анализы мочи, слюны или крови
Виды лабораторной диагностики при синдроме Кушинга:
- 24-часовой тест мочи на свободный кортизол. Для этого анализа необходимо собрать всю мочу за сутки. При содержании в моче кортизола выше нормы диагностируют синдром Кушинга. Референсные значения кортизола в моче 58 - 403 мкг/сут.
- Ночной тест на кортизол в слюне. При этом анализе измеряют количество кортизола в слюне поздним вечером. Обычно выработка кортизола падает сразу после того, как человек засыпает. При синдроме Кушинга уровень кортизола не снижается. Референсные значения кортизола в слюне:
- утро (08,00 - 10,00) -
- день (16,00 - 20,00) -
- вечер (23.30 - 00.30) -
- Супрессивный тест с низкими дозами дексаметазона или LDDST. При анализе ингибирования дексаметазона пациент принимает 2 миллиграмма глюкокортикоидного гормона дексаметазона в полночь. На следующее утро берется образец крови натощак, чтобы увидеть, присутствует ли в ней кортизол. Дексаметазон - препарат, заставляющий организма прекратить выработку АКТГ и, следовательно, кортизола. У здоровых людей концентрация кортизола составляет менее 2 мкг на децилитр крови. Однако при синдроме Кушинга уровень кортизола будет более 2 мкг. Исследование проводится амбулаторно. В норме уровень кортизола в крови падает после приема дексаметазона. Если уровень кортизола не падает, то это свидетельствует о синдроме Кушинга.
- Анализ с дексаметазон-CRH. Тест дексаметазон-CRH показывает, вызван ли избыток кортизола синдромом Кушинга или чем-то другим.
Некоторые люди время от времени имеют высокий уровень кортизола, но у них не развиваются долгосрочные осложнения синдрома Кушинга. У этих людей может быть псевдосиндром Кушинга - состояние, иногда встречающееся у пациентов, страдающих депрессией или тревогой, злоупотребляющих алкоголем, страдающих ожирением или диабетом со слишком высоким уровнем глюкозы в крови.
Этот тест сочетает в себе тест LDDST и тест стимуляции CRH — кортиколиберина. CRH — это гормон, вырабатываемый в гипоталамусе. Он “приказывает” гипофизу вырабатывать АКТГ, стимулирующий работу надпочечников. Когда уровень кортизола повышается достаточно, надпочечники отключают сигнал КРГ, поэтому уровни АКТГ и кортизола падают.
Если у пациента синдром псевдо-Кушинга, дексаметазон снизит уровни АКТГ и кортизола и предотвратит их повышение. Если уровень кортизола непосредственно перед инъекцией КРГ высокий или повышается во время этого анализа, предполагают синдром Кушинга.
Как врачи находят причину синдрома Кушинга?
Если врач-эндокринолог диагностирует синдром Кушинга, то назначаются дополнительные исследования и анализы. Они помогают определить источник проблемы - гипофиз, эктопия или надпочечники. Знание источника важно при выборе наилучшего типа лечения.
Первый шаг - измерение уровня АКТГ в крови. Если уровни АКТГ низкие, то вероятная причина - опухоль надпочечников. Людям с опухолями надпочечников дополнительные анализы крови не нужны.
Если уровень АКТГ нормальный или высокий, то вероятная причина - опухоль гипофиза или эктопическая опухоль.
Другие анализы крови помогают отличить опухоли гипофиза от эктопических опухолей. Эндокринолог обычно назначает следующие анализы:
- Тест стимуляции кортиколиберином. Для этого анализа пациенту сделают укол CRH. Если у него опухоль гипофиза, КРГ повысит уровень АКТГ и кортизола в крови. Это редко случается у людей с эктопическими опухолями.
- Супрессивный тест с высокими дозами дексаметазона - HDDST. Этот тест аналогичен LDDST, за исключением того, что в нем используются более высокие дозы дексаметазона. Если уровень кортизола в крови падает после приема высокой дозы дексаметазона, у пациента, вероятно, опухоль гипофиза. Если уровень кортизола не снижается, то возможна опухоль в другой части тела.
Другие исследования
Другие исследования ищут опухоли и помогают отличить опухоли гипофиза от эктопических опухолей.
Процедуры визуализации — УЗИ, КТ, МРТ при синдроме Кушинга
Если лабораторные тесты выявили опухоль как причину повышенного уровня кортизола, ее исследуют более тщательно с использованием соответствующих методов визуализации:
- Опухоль в коре надпочечников диагностируют с помощью УЗИ, компьютерной томографии или магнитно-резонансной томографии брюшной полости;
- При наличии опухоли в гипофизе исследование проводят с помощью магнитно-резонансной томографии;
- Если в гипофизе нет опухоли, врач ищет ее в другом органе, с помощью УЗИ, КТ или МРТ.
Визуализирующие тесты показывают размер и форму гипофиза и надпочечников и ищут опухоли, помогают определить их местонахождение.
Анализ крови из каменистого синуса
Опухоли гипофиза обычно небольшие и могут не обнаруживаться при визуализации. Если МРТ не показывает опухоль гипофиза, то проводится анализ крови из каменистого синуса. Этот тест - лучший способ отличить опухоль гипофиза от эктопических причин синдрома Кушинга.
Врач возьмет образцы крови из каменистых синусов — вен, дренирующих гипофиз. В то же время берется образец крови из кровеносного сосуда, находящегося далеко от гипофиза.
Более высокие уровни АКТГ в крови из каменистых синусов, чем из других кровеносных сосудов, указывают на опухоль гипофиза. Сходные уровни АКТГ во всех образцах крови свидетельствуют об эктопической опухоли.
Лечение синдрома Кушинга
Лечение зависит от причины и может включать:
- хирургическое вмешательство;
- лучевую терапию;
- химиотерапию;
- препараты, снижающие уровень кортизола.
Если причина синдрома Кушинга - длительное использование глюкокортикоидов для лечения другого расстройства, то врач-эндокринолог будет постепенно снижать дозировку до самой низкой дозы, необходимой для лечения этого заболевания. Иногда заболевания, которые врачи лечат глюкокортикоидами, можно лечить другими препаратами.
Опухоли надпочечников
Операция по удалению надпочечника с опухолью - наиболее распространенный метод лечения. Некоторые редкие заболевания вызывают множество узелков в обоих надпочечниках и требуют хирургического вмешательства для удаления обеих желез. Если у пациента удалены оба надпочечника, то нужно будет пожизненно принимать лекарства, заменяющие кортизол и другие гормоны, вырабатываемые надпочечниками.
Опухоли гипофиза
Наиболее распространенный метод лечения опухолей гипофиза - хирургическое удаление опухоли. Ели операция по удалению опухоли гипофиза проводится опытным хирургом, то вероятность излечения после операции достигает 90%.
После того как хирург удалит опухоль, гипофиз какое-то время не вырабатывает достаточное количество АКТГ. Врач назначит кортизол, так как АКТГ для стимуляции работы надпочечников недостаточно. Прием кортизола после операции длится 6-18 месяцев.
Если операция не удалась или невозможна, используется лучевая терапия:
- один тип лучевой терапии использует небольшие дозы радиации для гипофиза в течение 6-недельного периода;
- в другом типе используется однократная высокая доза радиации.
Уровень кортизола может не вернуться к норме после лучевой терапии в течение нескольких лет. Врач будет назначать лекарства для нормализации уровня кортизола до тех пор, пока не подействует лучевая терапия.
Эктопические опухоли, продуцирующие АКТГ
Основной метод лечения эктопических опухолей - их хирургическое удаление. Часто АКТГ вырабатывается новообразованием легких, поджелудочной железы.
Если опухоль, продуцирующая АКТГ, злокачественная, ее невозможно удалить из-за того, что пациент не может быть прооперирован из-за сопутствующих заболеваний либо из-за слишком сильного прогрессирования онкологического заболевания, то потребуется химиотерапия, лучевая терапия или другие методы лечения рака.
Частью лечения будут лекарства для снижения уровня кортизола.
Препараты, снижающие уровень кортизола
Для лечения синдрома Кушинга врач назначает препараты, подавляющие выработку кортизола в коре надпочечников - адреностатики. К адреностатикам относятся: аминоглютетимид или метопирон, лизурид, бромокриптин, кетоконазол + октреотид. Последние подавляют синтез АКТГ и косвенно замедляют работу коры надпочечников.
Синдром Кушинга: прогноз излечения
После операции пациент должен проходить регулярные осмотры. Врач будет проверять успешность проведения операции на основе анализа крови. Это необходимо для выявления рецидивов на ранней стадии.
Эндокринолог проверяет, нужно ли увеличить или уменьшить дозу кортизола, поскольку кортизол - важный стрессовый гормон в организме. В некоторых ситуациях организму требуется больше кортизола - при лихорадочных заболеваниях, операциях или других стрессовых ситуациях дозу кортизола необходимо увеличить.
Пациентам с аденомой гипофиза тоже необходимо временно принимать кортизол после операции.
Если у пациента на одном надпочечнике есть опухоль, вырабатывающая кортизол, то кора второго надпочечника обычно значительно снижает выработку этого гормона. После удаления опухоли здоровому надпочечнику нужно время, чтобы восстановиться. Поэтому этим пациентам приходится принимать кортизол в течение 2 лет и более после операции.
Читайте также:
