Синдром Швахмана-Даймонда. Метафизариая хондродисплазия тип Мак-Кьюсика и гликогеноз
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Материалы и методы исследования. Нами представлено первое описание клинико-генетических характеристик двух российских больных с МХДМ, обусловленной мутациями в гене RMRP, и проведено их сопоставление с литературными данными. Диагноз в обоих случаях был подтвержден при анализе гена RMRP методом прямого автоматического секвенирования по Сенгеру.
Результаты. Анализ особенностей клинических проявлений наблюдаемых нами больных и пациентов, описанных в литературе, показал наличие типичных скелетных и внескелетных проявлений, позволяющих заподозрить наличие МХДМ при клиническом осмотре. У наблюдаемых нами российских больных обнаружена мажорная мутация в популяциях амишей и финнов, n.71A>G, в компаунд-гетерозиготном состоянии с двумя другими: у одного больного с ранее описанной мутацией n.80G>A, а у другого — с вновь выявленной мутацией n.76C>T. Все обнаруженные мутации были локализованы в высококонсервативной области первого домена, которому принадлежит основная роль в функционировании эндорибонуклеазного комплекса.
Выводы. Учитывая малые размеры гена и наличие специфических признаков МХДМ, самым точным и дешевым способом молекулярно-генетической диагностики является определение мутаций в гене RMRP методом прямого автоматического секвенирования по Сенгеру. Своевременная диагностика МХДМ позволяет выбрать правильную тактику наблюдения пациентов с данной патологией.
Ключевые слова
Об авторах
Медико-генетический научный центр имени академика Н.П. Бочкова Министерства образования науки России
Россия
Национальный медицинский исследовательский центр детской травматологии и ортопедии имени Г.И. Турнера Министерства здравоохранения России
Россия
Кенис Владимир Маркович, доктор медицинских наук, врач травматолог-ортопед Консультативно-диагностического центра на Лахтинской улице
197136, Санкт-Петербург, ул. Лахтинская, д. 12, лит. А
Список литературы
1. McKusick VA, Eldridge R, Hostetler JA, et al. Dwarfism in the Amish. II. Cartilage-hair hypoplasia. Bull Johns Hopkins Hosp. 1965;116:285-326.
2. Mäkitie O, Kaitila I. Cartilage-hair hypoplasia-clinical manifestations in 108 Finnish patients. Eur J Pediatr. 1993;152(3):211-217. doi: 10.1007/BF01956147
3. Ridanpää M, van Eenennaam H, Pelin K, et al. Mutations in the RNA component of RNase MRP cause a pleiotropic human disease, cartilage-hair hypoplasia. Cell. 2001;104(2):195-203. doi: 10.1016/s0092-8674(01)00205-7
4. Mäkitie O, Rajantie J, Kaitila I. Anaemia and macrocytosis — unrecognized features in cartilage-hair hypoplasia. Acta Paediatr. 1992;81(12):1026-9. doi: 10.1111/j.1651-2227.1992.tb12168.x
6. Mäkitie O, Pukkala E, Teppo L, Kaitila I. Increased incidence of cancer in patients with cartilage-hair hypoplasia. J Pediatr. 1999;134(3):315-318. doi: 10.1016/s0022-3476(99)70456-7
7. Taskinen M, Ranki A, Pukkala E, et al. Extended follow-up of the Finnish cartilage-hair hypoplasia cohort confirms high incidence of non-Hodgkin lymphoma and basal cell carcinoma. Am J Med Genet A. 2008;146A(18):2370-2375. doi: 10.1002/ajmg.a.32478
8. Kaitila I, Perheentupa J. Cartilage-hair hypoplasia (CHH). In: Eriksson AW, Forsius HR, Nevanlinna HR, eds. Population Structure and Genetic Disorders. New York: Academic Press (pub.); 1980. pp. 588-591.
9. Mäkitie O. Cartilage-hair hypoplasia in Finland: epidemiological and genetic aspects of 107 patients. J Med Genet. 1992;29(9):652- 655. doi: 10.1136/jmg.29.9.652
11. Clayton DA. A big development for a small RNA. Nature. 2001;410(6824):29-31. doi: 10.1038/35065191
12. Bonafe L, Schmitt K, Eich G, et al. RMRP gene sequence analysis confirms a cartilage-hair hypoplasia variant with only skeletal manifestations and reveals a high density of single-nucleotide polymorphisms. Clin Genet. 2002;61(2):146-151. doi: 10.1034/j.1399-0004.2002.610210.x
15. Ridanpää M, Sistonen P, Rockas S, et al. Worldwide mutation spectrum in cartilage-hair hypoplasia: ancient founder origin of the major 70A-G mutation of the untranslated RMRP. Eur J Hum Genet. 2002;10(7):439-447. doi: 10.1038/sj.ejhg.5200824
16. Ridanpää M, Jain P, McKusick VA, et al. The major mutation in the RMRP gene causing CHH among the Amish is the same as that found in most Finnish cases. Am J Med Genet C Semin Med Genet. 2003;121C(1):81-83. doi: 10.1002/ajmg.c.20006
17. Nakashima E, Mabuchi A, Kashimada K, et al. RMRP mutations in Japanese patients with cartilage-hair hypoplasia. Am J Med Genet A. 2003;123A(3):253-256. doi: 10.1002/ajmg.a.20281
18. Gomes ME, Calatrava Paternostro L, Moura VR, et al. Identification of Novel and Recurrent RMRP Variants in a Series of Brazilian Patients with Cartilage-Hair Hypoplasia: McKusick Syndrome. Mol Syndromol. 2020;10(5):255-263. doi: 10.1159/000501892
20. Mäkitie O, Sulisalo T, de la Chapelle A, Kaitila I. Cartilage-hair hypoplasia. J Med Genet. 1995;32(1):39-43. doi: 10.1136/jmg.32.1.39
21. Coupe RL, Lowry RB. Abnormality of the hair in cartilagehair hypoplasia. Dermatologica. 1970;141(1):329-334. doi: 10.1159/000252497
23. Kostjukovits S, Klemetti P, Föhr A, et al. High prevalence of bronchiectasis in patients with cartilage-hair hypoplasia. J Allergy Clin Immunol. 2017;139(1):375-378. doi: 10.1016/j.jaci.2016.07.023
24. Rider NL, Morton DH, Puffenberger E, et al. Immunologic and clinical features of 25 Amish patients with RMRP 70 A-->G cartilage hair hypoplasia. Clin Immunol. 2009;131(1):119-128. doi: 10.1016/j.clim.2008.11.001
25. Faitelson Y, Manson D. Cartilage-hair hypoplasia: a spectrum of clinical and radiological findings. LymphoSign Journal. 2015;2(3):157-164. doi: 10.14785/lpsn-2015-0009
26. Klemetti P, Valta H, Kostjukovits S, et al. Cartilage-hair hypoplasia with normal height in childhood-4 patients with a unique genotype. Clin Genet. 2017;92(2):204-207. doi: 10.1111/cge.12969
27. Mäkitie O, Heikkinen M, Kaitila I, Rintala R. Hirschsprung's disease in cartilage-hair hypoplasia has poor prognosis. J Pediatr Surg. 2002;37(11):1585-1588. doi: 10.1053/jpsu.2002.36189
28. Thiel CT, Mortier G, Kaitila I, et al. Type and level of RMRP functional impairment predicts phenotype in the cartilage hair hypoplasia-anauxetic dysplasia spectrum. Am J Hum Genet. 2007;81(3):519-529. doi: 10.1086/521034
29. Vakkilainen S, Costantini A, Taskinen M, et al. Metaphyseal dysplasia without hypotrichosis’ can present with late-onset extraskeletal manifestations. J Med Genet. 2020;57(1):18-22. doi: 10.1136/jmedgenet-2019-106131
Хондродисплазия метафизарная тип Мак-Кьюсика
Метафизарная хондродисплазия (хряще-волосяная гипоплазия, СНН; тип Мак-Кьюсика, MIM 250250) - форма карликовости с короткими конечностями, возникающей в результате скелетной дисплазии. Скелетные особенности включают неполное разгибание в локтевом суставе, килевидная грудная клетка, искривление ног, удлинение малоберцовой кости относительно большеберцовой. У больных наблюдаются укорочение и утолщение кистей, разболтанные суставы кистей и стоп, недоразвитые ногти. При рентгенологическом исследовании выявляются изменения, названные метафизарным дизостозом: расширенные метафизы с фестончатым, неровно склерозированным краем. Биопсия выявляет гипоплазию хрящей. Волосы у больных тонкие, короткие, редкие, светлые. Поражаются также брови и ресницы. У многих больных имеются иммунологические дефекты, нарушается как клеточный, так и гуморальный иммунитет. Они чувствительны к инфекциям, могут иметь лимфопению, нейтропению, анемию. У некоторых больных нарушается кишечное всасывание, а также у них повышен риск опухолеобразования, преимущественно лимфом.
Метафизарная хондродисплазия типа Мак-Кьюсика наследуется по аутосомно-рецессивному типу, встречается с частотой 1:23000 новорожденных.
К метафизарной хондродисплазии приводят мутации в гене RMRP (RNA component of mitochondrial RNA-processing endoribonuclease, OMIM 157660). Ген картирован на хромосоме 9р21-р12 и является нетранслируемым. Синтезирующаяся с него РНК входит в состав митохондриальной эндорибонуклеазы. Мутации в гене ведут к уменьшению клеточного роста в результате повреждения сборки рибосом и в результате изменения циклин-зависимой регуляции клеточного цикла. Мутации, выявляемые у больных хондродисплазией типа Мак-Кьюсика, можно разделить на два типа. Одни мутации представляют собой дупликации или вставки от 6 до 30 нуклеотидов между ТАТА box и сайтом инициации транскрипции и изменяют транскрипцию гена. Другие мутации являются однонуклеотидными заменами или изменениями, затрагивающими не менее двух нуклеотидов, эти изменения затрагивают высоко консервативные остатки транскрибируемой последовательности. Наиболее частой заменой является транзиция A-G в положении 70.
В Центре Молекулярной Генетики проводится поиск мутаций в гене RMRP методом прямого автоматического секвенирования.
Случай диагностики синдрома Швахмана
Информация только для специалистов в сфере медицины, фармации и здравоохранения!
В статье представлен случай диагностики редко встречающегося синдрома Швахмана. Рассмотрены особенности клинической картины заболевания, дана оценка результатов проведённого обследования. Особое внимание уделено вопросам дифференциальной диагностики данной патологии.
Синдром Швахмана - редко встречающееся аутосомно-рецессивное заболевание, характеризующееся врождённой экзокринной гипоплазией поджелудочной железы, дисфункцией костного мозга, нарушениями развития скелета, повышенной чувствительностью к кокковым инфекциям. Заболевание подробно описано в 1964 г. Schwachman и сотр. и поэтому носит его имя. Популяционная частота по данным различных авторов составляет 20-200:100 тыс. населения, соотношение числа мальчиков и девочек 1,8:1 [1]. Первые проявления болезни в виде частого, кашицеобразного и жирного стула с резким неприятным запахом появляются после введения прикорма или после прекращения грудного вскармливания. У больных быстро развивается гипотрофия и отставание в росте. Может быть задержка психомоторного развития. Заболевание протекает с различной степенью экзокринной панкреатической недостаточности со снижением уровня трипсиновой и липолитической активности на фоне тяжёлой ацинарной дисфункции. У этих детей секреция жидкости и бикарбонатов не изменена, показатели натрия и хлора в потовой жидкости в пределах нормы. Постоянное лечение ферментными препаратами поджелудочной железы дает хороший терапевтический эффект. Наиболее ранним и постоянным признаком является нейтропения, реже - анемия и тромбоцитопения. Прогноз серьёзный - многие дети погибают в первые годы жизни по причине присоединения тяжёлых рецидивирующих вирусно-бактериальных инфекций кожи и слизистых, пневмонии. Если ребёнок переживает ранний возраст, в дальнейшем болезнь может протекать более благоприятно [2, 3].
К сожалению, практические врачи мало знакомы с этим редким заболеванием, к тому же проявления синдрома Швахмана разнообразны и многолики. Это и побудило нас дать описание данного случая.
Больная Е., 1 год 9 месяцев, направлена в клинику с диагнозом: Целиакия, с жалобами при поступлении на задержку физического развития, неустойчивый характер стула кратностью до 3-5 раз в день с неприятным запахом, периодически с примесью жира, явления метеоризма в вечернее время.
Из анамнеза жизни известно, что ребенок от 3-й беременности, протекавшей с токсикозом в первой половине. По данным УЗИ обращалось внимание на задержку внутриутробного развития плода. Роды 2-е срочные, плановое кесарево сечение. Девочка вторая из двойни. Оценка по шкале Апгар 7-8 баллов. Масса тела при рождении 2300 г, длина 48 см. Выписана из роддома на 4-е сутки с диагнозом: Задержка внутриутробного развития 2-й степени по типу гипотрофии.
В возрасте 1-го месяца неврологом диагностирован синдром двигательных нарушений на фоне перинатального поражения центральной нервной системы.
На естественном вскармливании до 3 месяцев. В дальнейшем ребёнок находился на искусственном вскармливании адаптированными молочными смесями. Первый прикорм в виде кефира введен в рацион с 9 месяцев жизни.
С первых дней жизни обращалось внимание на задержку физического развития по типу гипостатуры. В возрасте 11 месяцев появились проявления энтерального синдрома в виде объёмного кашицеобразного стула до 6-8 раз в сутки, со зловонным, кислым запахом, видимой примесью жира, метеоризм.
Со второго полугодия жизни девочка часто болеет простудными заболеваниями. В 6 месяцев перенесла затяжной трахеобронхит, в 10 месяцев пневмонию, в 11 месяцев обструктивный бронхит, острый энтероколит, острый двухсторонних катаральный средний отит.
В возрасте 1,5 лет девочка впервые обследована стационарно по месту жительства, проконсультирована генетиком, гастроэнтерологом. Заподозрена целиакия. В лечении была рекомендована аглиадиновая диета, соблюдение которой в течение 1,5 месяцев не дало видимой положительной динамики течения заболевания. Улучшение характера стула, уменьшение его кратности отмечено на фоне приёма ферментных препаратов (креон). Для уточнения диагноза девочка направлена в Нижегородский научно-исследовательский институт детской гастроэнтерологии.
При поступлении состояние больной средней степени тяжести. Положение активное. Аппетит повышен. Сон спокойный. Физическое развитие расценено как очень низкое, гармоничное (рост 72 см (1-й центильный интервал)), масса тела 9 кг (1-й центильный интервал). Кожные покровы бледные, периорбитальный цианоз. Слизистая полости рта розовая, чистая, зубы здоровые. В лёгких дыхание везикулярное. Тоны сердца ясные, ритмичные. Живот обычной формы, слегка вздут, при пальпации зон болезненности не выявлено. Стул 2 раза, мазевидный, без видимой примеси жира (на фоне приема креона 40 000 Ед/сут.).
Общий анализ мочи без особенностей.
По данным копрологического исследования и биохимического анализа кала, взятого после отмены ферментных препаратов, отмечено наличие полифекалии до 190 г/сут. (норма 92±8,21 г/сут.), стеатореи за счёт общих жирных кислот, амилореи.
При этом исследование содержания эластазы-1 в кале выявило тяжёлую степень внешнесекреторной недостаточности поджелудочной железы (16,66 мкг э/г при норме более 200 мкг э/г).
Хлориды пота (прибор «Macroduct+Sweat-Chek (фирмы Wescor, США) 24,0 ммоль/л (норма до 60).
При проведении молекулярно-генетического исследования мутаций в гене трансмембранного регуляторного белка муковисцидоза не выявлено.
Всасывательная функция тонкой кишки, оцениваемая по нагрузке глюкозой, не нарушена. Активность лактазы, сахаразы по результатам нагрузочных тестов с дисахарами сохранена.
Ретроспективное патологогистологическое исследование биопсийного материала, взятого из проксимального отдела тощей кишки по месту жительства до назначения аглиади-новой диеты, показало наличие признаков диффузного еюнита и отсутствие морфологических критериев целиакии. Ворсинки высокие с выраженной фестончатостью, листовидной и пальцевидной формы. Содержание межэпителиальных лимфоцитов в эпителии ворсинок в пределах нормы. Криптальный слой не расширен. Собственная пластинка усиленно инфильтрирована преимущественно лимфоцитами с присутствием плазмоцитов.
Титр IgG - антител к глиадину был отрицательным, а уровень IgА к тканевой трансглутаминазе не превышал нормальных значений.
При ультразвуковом исследовании обращалось внимание на нерезкое уплотнение печени и поджелудочной железы, увеличение хвоста поджелудочной железы. Размеры поджелудочной железы: головка - 11 мм, тело - 13 мм, хвост - 17 мм.
В биохимическом анализе крови отмечалось уменьшение активности панкреатических ферментов: амилазы до 6 Ед/л, липазы до 6 Ед/л, наличие гипохолестеринемии (2,16 ммоль/л), что указывало на снижение внешнесекреторной функции поджелудочной железы.
При микробиологическом исследовании кала отмечен рост единичных колоний гемолизирующих эшерихий.
В иммунограмме имело место снижение абсолютных значений общей популяции Т-лимфоцитов (СD 3 - 0,9*109/л (норма 1,82-3,01)), субпопуляций Т-хелперов (СD 4 - 0,53*109/л (норма 1,02-1,84)), Т-супрессоров (СD 8 - 0,28*109/л (норма 1,82-3,01)); общей популяции В-лимфоцитов (СD 19 - 0,30*109/л (норма 0,74-1,33)). Среди показателей гуморального иммунитета отмечено повышение ЦИК до 220 мкг/мл (норма 0-160 мкг/мл); снижение резервов фагоцитоза. Выявленные изменения свидетельствовали о наличии вторичного иммунодефицитного состояния, обусловленного основным заболеванием, а также хроническим течением микст-инфекции (цитомегало-вирусной, Эпштейн-Барра), что было подтверждено методом полимеразной цепной реакции.
Изменения костно-мышечной системы проявлялись отставанием в росте.
Рентгенологическое обследование костей в данную госпитализацию не проводилось, поскольку, согласно литературным данным [1], формирование метафизарного дизостоза и остеопороза костей наблюдается только у 22-37% детей. Планируется проведение данного обследования в процессе динамического наблюдения за ребёнком.
Девочка проконсультирована неврологом. Поставлен диагноз: Последствия перинатального поражения центральной нервной системы с задержкой психоречевого и физического развития.
Учитывая наличие признаков внешнесекреторной недостаточности поджелудочной железы (неустойчивый характер стула, полифекалия стеаторея 1-го типа, амилорея; снижение содержания эластазы-1 в кале, нарушения липидного обмена организма в виде снижения уровня холестерина и алипопротеидов в сыворотке крови); дисфункции костного мозга, проявляющейся преимущественно в виде лейкопении, нейтропении, анемии лёгкой степени тяжести; задержку физического развития, отмеченную ещё с периода внутриутробного развития ребёнка; отставание психоречевого развития; частые инфекционные процессы в виде пневмонии, отита, обструктивного бронхита, острых респираторных вирусных инфекций, острой кишечной инфекции, ребёнку был поставлен диагноз: Синдром Швахмана.
В ходе комплексного обследования был отвергнут диагноз целиакии и параллельно исключен муковисцидоз.
При выписке из стационара рекомендовано: диета № 4 с повышенным содержанием белка, заместительная терапия ферментными препаратами (креон), обменная метаболическая терапия, витамины, препараты железа, пробиотики, лечение хронической вирусной инфекции противовирусными препаратами (виферон).
Литература
1. Детская гастроэнтерология (избранные главы). / Под ред. А.А. Баранова, Е.В. Климанской, Г.В. Римарчук. М.: 2002. 592 с.
2. Римарчук Г.В., Полякова СИ. Редкие болезни поджелудочной железы у детей. //Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 1999. № 5. С. 72-77.
3. Мухина Ю.Г. Энтеропатии у детей. Лекции по актуальным вопросам
педиатрии. /Под ред. В.Ф. Демина и СО. Ключникова. М.: РГМУ. 2000
Синдром Швахмана-Даймонда
Синдром Швахмана-Даймонда - это генетическая патология, проявляющаяся секреторной недостаточностью поджелудочной железы, костномозговыми нарушениями и серьезными гематологическими изменениями. Первые симптомы (диарея, метеоризм, снижение аппетита, дистрофия, деформация скелета, анемия и т. п.) регистрируются на 5-6 месяце во время введения прикорма. Основные диагностические мероприятия: биохимический и общий анализ крови и кала, гормональные исследования, УЗИ, КТ и МРТ органов брюшной полости, рентгенография скелета. Лечение направлено на устранение клинических признаков и поддержание жизнедеятельности.
Общие сведения
Синдром Швахмана-Даймонда - редкое генетическое заболевание, для которого характерны нарушение работы поджелудочной железы и дисфункция костного мозга. Болезнь проявляется всесторонней задержкой развития (умственного, психического и физического), отмечена повышенная восприимчивость к инфекциям. Распространенность заболевания составляет 1:50 000 рожденных детей. Синдром несколько чаще встречается у мальчиков. Прогноз крайне неблагоприятный, так как большинство пациентов не доживают до 7 лет.
Впервые патология была описана Bodian и Sheldon в 1964 году у пациентов с врожденной гипоплазией поджелудочной железы, задержкой роста и панцитопенией. В том же году Швахмоном и Даймондом была детально изучена экзокринная панкреатическая недостаточность и дисфункция костного мозга при данном заболевании. Многообразие проявлений синдрома требует согласованного междисциплинарного подхода к лечению патологии с участием специалистов в области гастроэнтерологии, генетики, педиатрии.
Причины
Причиной развития синдрома Швахмана-Даймонда является генетическая аномалия. Патология вызвана мутацией одного из участков 7 хромосомы (ген SBDS), она наследуется по аутосомно-рецессивному типу, то есть оба родителя должны передать дефектный ген своему ребенку. Регистрируются и спорадические случаи синдрома Швахмана-Даймонда - в их этиологии важную роль отводят воздействию вирусов паротита и Коксаки на ткани эмбриона. Клинические признаки начинают появляться на 5-6 месяц после рождения.
Хотя точная функция гена SBDS не определена, его мутация вызывает задержку развития; жировое перерождение ткани поджелудочной железы; гипоплазию костного мозга, которая приводит к серьезным гематологическим изменениям.
Симптомы
Клинические признаки синдрома Швахмана-Даймонда появляются после начала введения прикорма (5-6 месяцев). Первый симптом патологии - диарея, а точнее, стеаторея, для которой характерно значительное увеличение доли жира в каловых массах. На фоне нарушения стула снижается аппетит, появляется метеоризм. Эти признаки обусловлены недостаточностью секреторной функции поджелудочной железы. Помимо этого, выявляются и другие эндокринные нарушения, результатом которых является развитие субнанизма - низкорослости. Постепенно развивается дистрофия костной ткани, задерживается физическое и психическое развитие ребенка. У большинства пациентов регистрируется деформация костей, сопровождающаяся беспричинными переломами.
С первого дня жизни ребенка определяется измененная картина крови: снижается количество нейтрофилов (нейтропения), резко сокращается число эритроцитов (анемия) и тромбоцитов (тромбоцитопения), все это сочетается с геморрагическим синдромом (повышенная кровоточивость на фоне нарушения свертываемости). Пациенты подвержены развитию инфекционных заболеваний различных систем организма (органов дыхания, мочевыделительной системы, кожи и пр.).
При легкой форме симптомы, характерные для заболевания, не ярко выражены, при адекватной терапии такие пациенты доживают до 20 лет. При тяжелой форме клинические признаки рано появляются и быстро прогрессируют, любые терапевтические мероприятия не дают положительного эффекта, эти больные погибают очень рано.
Диагностика
Диагностика синдрома Швахмана-Даймонда не представляет трудностей, заподозрить наличие патологии может педиатр при проведении профилактического осмотра и появлении характерных симптомов. Врач тщательно собирает анамнез, выявляет хронические заболевания, а также случаи возникновения синдрома у ближайших родственников. Так как первые признаки связаны с диспепсическими нарушениями, то патологию может заподозрить и гастроэнтеролог.
Чтобы поставить окончательный диагноз, необходимо провести инструментальные и лабораторные методы обследования: анализ кала и крови, гормональные исследования, КТ, МРТ, УЗИ органов брюшной полости, рентгенографию скелета.
Анализ каловых масс выявляет стеаторею, общий анализ крови - нейтропению, тромбоцитопению, анемию, иногда панцитопению - снижение количества всех клеток крови. Биохимический анализ крови показывает состояние обменных процессов, а также концентрацию и свойства ферментов.
КТ, МРТ, УЗИ органов брюшной полости выявляют изменение ткани поджелудочной железы, эти исследования проводят также для исключения других болезней пищеварительной системы. Рентгенография костей определяет степень деформации скелета. Всем пациентам назначается консультация невролога, генетика с проведением молекулярно-генетического анализа.
Лечение синдрома Швахмана-Даймонда
Лечение синдрома Швахмана-Даймонда направлено на устранение неблагоприятных симптомов и поддержание жизненно важных функций. Всем пациентам прописывают строгую диету: ограничивают жиры, повышают содержание белков. Обязательна заместительная терапия, восполняющая недостающие ферменты поджелудочной железы. При появлении инфекционных заболеваний выписывают антибактериальные препараты. Также необходимо восстановить показатели картины крови; анемия успешно поддается терапии, другие изменения трудно корректируются. Если развивается тяжелая форма патологии и серьезные гематологические нарушения, проводят химио- и лучевую терапию, трансплантацию костного мозга.
Прогноз
Прогноз синдрома Швахмана-Даймонда крайне неблагоприятный. Согласно статистике, пациенты умирают в 7-10 лет, очень редко они доживают до 20 лет. Это связано с сильным снижением иммунитета и развитием серьезных инфекционных заболеваний. В редких случаях характер течения патологии меняется в сторону улучшения, как правило, постепенно уменьшается секреторная недостаточность, но при этом гематологические нарушения не восстанавливаются.
Метафизарная дисплазия

Метафизарная дисплазия - тяжелое и редкое заболевание костной ткани. У пациентов наблюдаются нарушения в строении стволов длинных костей и их метафизов, формирование широкого основания. По мере развития форма начинает напоминать лодочное весло, увеличивается губчатый внутренний слой. Пациенты с подобной патологией часто сталкиваются с деформацией скелета, патологическими переломами и другими осложнениями, угрожающими жизни и здоровью.
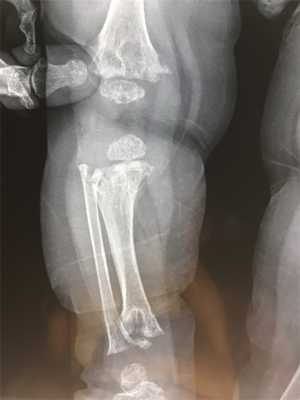
Общие сведения о болезни
Метафизарная дисплазия плохо изучена врачами, но доказана ее наследственная передача. Болезнь приводит к порокам развития костной ткани скелета, при которой наблюдается аномальное строение метафиза в длинных трубчатых костях. В зависимости от симптомов, тяжести поражения опорно-двигательной системы врачи выделяют несколько основных форм.
Все формы метафизарной дисплазии передаются двумя механизмами наследования:
- аутосомно-рецессивным;
- аутосомно-доминантным.
Это влияет на проявление, симптоматику и тип заболевания. Патология с одинаковой частотой встречается среди мужчин и женщин, в большинстве случаев проявляется в первые годы жизни. Некоторые типы болезни отличаются высокой степенью летальности.
Основные причины метафизарной дисплазии
У специалистов недостаточно информации о путях передачи заболевания. В большинстве случаев при изучении генетического материала и сборе анамнеза выявляется аутосомно-доминантная форма, которая связана с мутацией гена SFRP4 в 5 хромосоме. Он отвечает за кодирование белков, переносящих пирофосфат. Активное вещество необходимо для полноценных и активных процессов резорбции костной ткани. При его недостатке плотность кости уменьшается до критического уровня, меняются ее структура и форма.
Мутация белка-переносчика пирофосфата приводит к аномальному строению трубчатых длинных костей скелета. На генетическом уровне меняется процесс активности остеокластов.
Аутосомно-рецессивная форма болезни встречается реже, связана с аномалией генов в 7-й хромосоме. Мутация приводит к поражению белка, который принимает участие в формировании межклеточных контактов в костной ткани. Нарушается процесс передачи информации низкомолекулярными соединениями. Но врачам не удается до конца понять причину избирательного поражения метафиза костей.
Для аутосомно-рецессивной формы характерно поражение внутренних органов и тканей, в которых также присутствуют мутировавшие белки. У пациентов чаще наблюдаются вторичные нарушения, связанные с патологическим ростом костей и давлением на нервные окончания.
Метафизарная дисплазия у детей при аутосомно-рецессивной форме наследования проявляется, когда оба родителя являются носителями мутированного гена.

Виды заболевания
При метафизарной дисплазии происходит генетическое нарушение в строении костей скелета. При этом практически не меняется форма черепа, не возникают мутации нижней или верхней челюсти, характерные для краниометафизарной формы.
Заболевание сложно обнаружить без рентгенологического исследования. Среди характерных признаков - конусообразное расширение в трубчатых костях нижних конечностей. Они по форме начинают напоминать стеклянные колбы, используемые в лабораториях.
В некоторых медицинских источниках метафизарная дисплазия носит название "болезнь Пайла" - в честь ученого, который впервые описал патологию в 1931 году. На сегодняшний день существует 8 основных типов. Они различаются внешними симптомами и характером течения болезни:
- тип Янсена;
- Шмидта;
- МакКьюзика;
- метафизарная анадисплазия;
- дисплазия Швахмана-Даймонда;
- дисплазия с дефицитом аденозинд-дофаминазы по типу Шпар;
- метафизарная хондродисплазия (болезнь Пайла);
- метафизарная акроскифодисплазия.
Установить вид заболевания помогает комплексное обследование, включающее генетическое исследование биологического материала пациента.
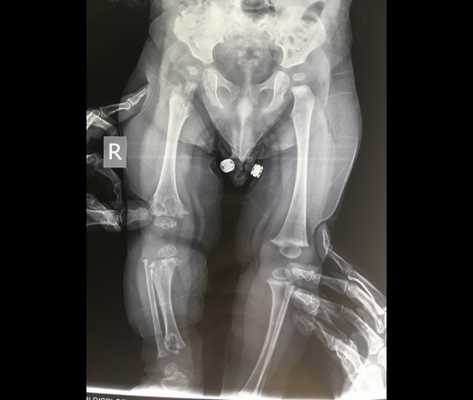
Симптомы метафизарной дисплазии
Характерным признаком заболевания является сильное смещение трубчатых костей при одновременном и значительном расширении колбы Эрленмейера в ногах. Особенно симптомы выражены при поражении бедренной части. При метафизарной дисплазии негативные изменения в строении черепа минимальны. В редких случаях сильно выступают лобные доли над глазницами, создавая асимметричное строение лица.
При заболевании наблюдаются расширение грудной клетки, неправильное строение таза с искривлением, поражением тазобедренного сустава. Меняется угол наклона нижней челюсти, плечевые кости также по ширине превышают норму.
У многих больных сильная степень искривления позвоночника, тяжелые формы сколиоза. Даже в детском возрасте плотность костной ткани значительно меньше нормы, что приводит к остеопорозу. Кости становятся слишком хрупкими, с трудом выдерживают вес тела при ходьбе и активных движениях. Это основная причина частых патологических переломов ребер и нижних конечностей.
Не менее распространены симптомы метафизарной дисплазии:
- тяжелые формы кариеса с многочисленным поражением зубов в пришеечной части;
- аномальное строение околоносовых, лобных пазух;
- ограничение подвижности верхних конечностей в локтевом суставе;
- сильная мышечная слабость;
- гипотонус нижних конечностей;
- неправильный прикус;
- плоскостопие.
При некоторых формах заболевания быстро прогрессирует сколиоз. Происходит сдавливание нервных окончаний спинного мозга, которые иннервируют внутренние органы. Это одна из причин проблем с сердечно-сосудистой и эндокринной системами, органами пищеварения, головных и мышечных болей.
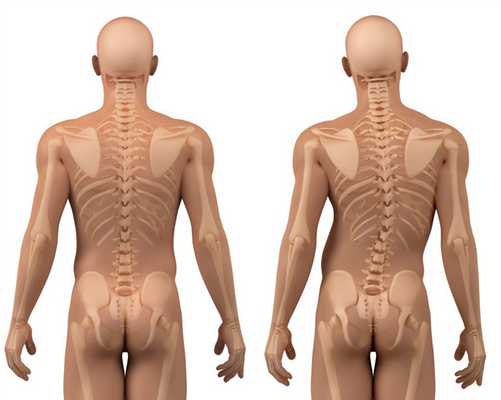
Метафизарная дисплазия типа Янсена
Крайне редкое заболевание: на сегодняшний день достоверно описано не более 10 случаев патологии. Среди характерных признаков, указывающих на этот тип болезни:
- широко расставленные глаза;
- развитие экзофтальма;
- неестественно широкая и укороченная переносица;
- недоразвитие нижней челюсти, которое приводит к неправильному прикусу, проблемам с зубами;
- низкий рост, связанный с укорочением бедренной кости.
При дисплазии Янсена происходит тяжелое поражение тазобедренных и коленных суставов. Постепенно нарастают сгибательные контрактуры в суставах нижних конечностей, что создает трудности в ходьбе, меняет походку, приводит к хромоте. Средний рост пациентов не превышает 120−125 см.
Искривление позвоночника прогрессирует по мере взросления, приводит к неестественному положению тела. Человек ходит, сильно наклонившись вперед, руки свисают, кисти могут доставать до колен. Суставы сильно увеличены в размере за счет патологического строения метафизов.
При метафизарной дисплазии Янсена показано хирургическое вмешательство. Необходимо восстановить оси конечностей для улучшения походки. Корректирующее вмешательство помогает повысить выносливость и улучшить качество жизни больного. Таким пациентам противопоказаны занятия спортом, связанные с переносом тяжестей, длительные пешие прогулки.
Метафизарная дисплазия типа Шмидта
При этом виде заболевании пациенты значительно отстают в росте. Наблюдается выраженная деформация нижних конечностей. Первые симптомы проявляются уже на 1-2-м году жизни. У детей появляется "утиная походка", сильная хромота. Они отказываются от активных игр, могут жаловаться на боли в коленных или тазобедренных суставах.
У пациента с типом Шмидта наблюдаются следующие патологии:
- выраженный поясничный лордоз;
- варусная деформация бедер;
- О-образная форма ног.
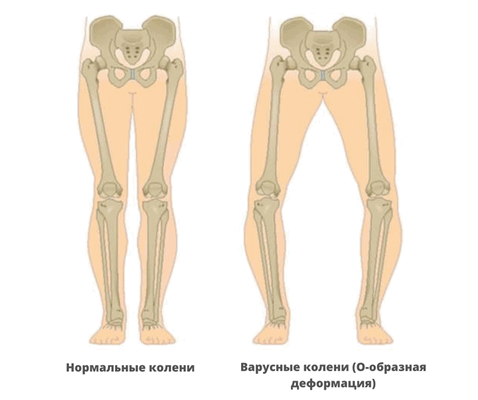
При диагностике врачи обращают внимание на характерное поражение проксимального отдела шейки бедра. Кости имеют неправильную форму, недостаточную плотность, низкое содержание кальция и микроэлементов. На рентгеновских снимках заметны неровные контуры, расширенные участки эпифизов.
При метафизарной дисплазии Шмидта не наблюдается поражение внутренних органов и систем. У больных практически отсутствуют аномалии в строении черепа и лица. Основное поражение приходится на нижние конечности и позвоночный столб.
По мере взросления проводится хирургическая коррекция. Она позволяет устранить выраженные деформации костей, сохранить здоровье суставов. При необходимости выполняется эндопротезирование.
Метафизарная дисплазия МакКьюзика
Метафизарная хондродисплазия Мак-Кьюсика (гипоплазия хряща и волос) - редкое заболевание, которое является причиной карликовости. У пациентов наблюдается сильное укорочение конечностей (до 20 см), что связано с дисплазией скелета.
Также для заболевания характерна предрасположенность к онкологическим опухолям, низкий уровень иммунитета. Основные признаки дисплазии МакКьюзика:
- короткие конечности;
- аномально низкий рост человека;
- тонкие светлые волосы, брови и ресницы;
- высокая степень растяжимости суставов рук и ног;
- заболевания позвоночника (сколиоз, лордоз, кифоз);
- дефектный иммунитет, связанный с недостатком антител.

Заболевание передается аутосомно-рецессивным путем. Пациенты часто страдают от клеточного иммунодефицита. Кроме карликовости и патологического строения скелета, у них наблюдается повышенная восприимчивость к вирусным, инфекционным заболеваниям, которые протекают с особой степенью тяжести. Дети с метафизарной дисплазией МакКьюзика часто погибают в раннем возрасте от обычной простуды или ветряной оспы.
Для пациентов с типом MакКьюзика характерны хроническая анемия, патологии кишечника. На рентгеновских снимках заметно увеличение метафизов в области коленного сустава. В детском возрасте нередко встречается двояковыпуклое строение позвонков, которое постепенно исчезает после взросления.
Акроскифодисплазия
У пациентов с этим типом заболевания отмечается сильная задержка роста. При этом метафизарные части трубчатых костей аномально большие, особенно в нижних конечностях. Одновременно нарушено строение диафиза в бедрах, развивается вальгусное искривление ног.
У больных наблюдается сильная косолапость, умеренная деформация трубчатых костей рук и фаланг кистей. Нередко заболевание приводит к брахидактилии, психомоторной задержке развития.
Некоторые дети появляются с аномально короткими ребрами, что приводит к врожденной асфиксии. Отмечаются укорочение основания черепа, аномалии развития гениталий, желудочно-кишечного тракта, анального отверстия, желудка. Некоторые патологические изменения несовместимы с жизнью.
Дисплазия Швахмана-Даймонда
При заболевании происходит поражение скелета человека, кроме того, возникают изменения в работе поджелудочной железы: снижается выработка ферментов, ответственных за расщепление жиров. Из-за патологического строения возникают дисфункция костного мозга, сколиоз и другие заболевания позвоночного столба.
Среди характерных симптомов:
- низкий рост;
- хроническая анемия;
- тяжелые патологии печени;
- гематологические нарушения;
- низкий уровень лейкоцитов.
Первые признаки проявляются на 5-6-м месяце жизни ребенка. У детей с синдромом Швахмана-Даймонда критически снижено количество тромбоцитов, эритроцитов. Они часто болеют простудными заболеваниями, бактериальными инфекциями, пневмониями, страдают хроническим средним отитом.
При недостаточности и липоматозе поджелудочной железы возникают проблемы с усвоением жиров, требующие постоянной медикаментозной терапии. При постоянном наблюдении врачей пациенты доживают до 18−20 лет.
Метафизарная дисплазия типа Спарк (Шпар)
Это одно из нескольких расстройств, которые раньше называли метафизарным дизостозом. Редкое заболевание, при котором у человека изогнуты ноги, возникает низкорослая карликовость. В некоторых случаях сгибание колен настолько сильно, что требует хирургической коррекции.
Тип Спарк по симптоматике и течению болезни во многом напоминает метафизарную дисплазию Шмидта. Патология имеет аутосомно-рецессивное наследование.
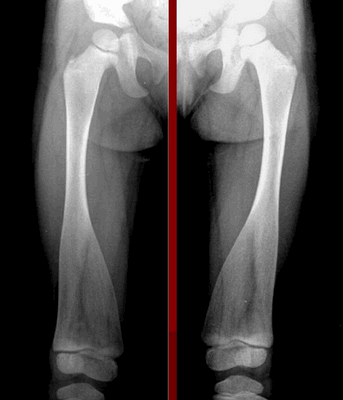
Болезнь Пайла
В отличие от других форм метафизарной дисплазии при болезни Пайла наблюдается аномальный рост трубчатых костей. У пациента появляется выраженная деформация коленных суставов, сколиоз 1-2-й степени. Уже в 8−9 лет у детей развиваются дисплазия тазобедренных суставов, поражение метафизов большеберцовых костей. Среди характерных симптомов:
- позднее выпадение молочных зубов, дисплазия эмали, увеличенные межзубные промежутки, склонность к кариесу;
- высокий рост;
- черный акантоз по линии роста волос;
- повышенная сухость кожного покрова;
- стрии в области сгибания суставов;
- конусовидные пальцы.
Такие дети значительно опережают в росте сверстников, часто сталкиваются с патологическими переломами в раннем возрасте. У многих пациентов наблюдаются патологии эндокринной системы, диффузный зоб. По мере роста больные жалуются на боли в суставах, которые ограничивают движения. Развиваются артроз и другие дегенеративные заболевания, влияющие на общее самочувствие.
Методы лечения
При некоторых формах метафизарной дисплазии у пациентов отмечается сильный дефицит костной массы. После определения плотности кости врач может порекомендовать курсы минерализующих препаратов на основе кальция, фтора, магния, витамина D. Они не меняют структуру, но снижают риск патологических переломов.
Любая медикаментозная терапия при метафизарной дисплазии носит вспомогательный характер, применяется для устранения симптомов. В современной медицине не существует препаратов, способных остановить патологическое изменение метафизарных частей костей. При болезни Пайла необходимо дополнительно отслеживать гормональный фон, корректировать его уровень.
При частых вывихах и подвывихах тазобедренного сустава рекомендуется ношение специальных протезов. Пациентам индивидуально изготавливают ортопедическую обувь для коррекции укороченной конечности. Для замедления развития сколиоза требуется корсет и постоянная лечебная физкультура. При отсутствии эффекта назначается операция.

Хирургическое лечение
Корригирующая остеотомия показана при деформации кости, помогает избавиться от дефекта и искривления кости. Она заключается в создании искусственного перелома, после которого отломки фиксируют в анатомически правильном положении.
Корригирующая остеотомия позволяет правильно распределить нагрузки на суставы и кости, снижает риск патологических переломов. Во время манипуляции хирурги могут убрать костные наросты, которые образовались при неправильном срастании, восстановить функциональность конечностей и позвоночника.
Операция проводится под общей анестезией. Хирург осторожно распиливает кость, после чего укрепляет и соединяет фрагменты с помощью наружной или внутренней фиксации. Если необходимо удлинить конечность, используется аппарат Илизарова.
Реабилитация занимает от 3 месяцев до года, позволяет избавиться от О и Х-образной деформации нижних конечностей, тяжелой степени кифоза, лордоза или сколиоза. Некоторым пациентам с тяжелой формой метафизарной дисплазии рекомендуется операция по устранению стеноза спинного мозга и суставных контрактур.
После операции для сохранения эффекта назначается комплексная реабилитация. Она может включать: лечебную физкультуру и массаж, физиотерапию для устранения мышечного напряжения или гипотонуса.
Прогноз для больного зависит от типа метафизарной дисплазии. Некоторые виды приводят к гибели плода во время беременности, имеют высокую степень летальности. Многие патологии при правильно подобранном лечении и проведении операции позволяют пациенту активно работать, вести обычный образ жизни.
Читайте также:
