Система кальций—кальмодулин. Взаимосвязи вторичных посредников.
Добавил пользователь Евгений Кузнецов Обновлено: 01.02.2026
Циклический АМФ (циклоАМФ, цАМФ) образуется в клетке, когда действуют гормоны гипофиза (ТТГ, ЛГ, МСГ, ФСГ. АКТГ), кальцитонин, соматостатин, глюкагон, паратгормон, адреналин (через α2- и β-адренорецепторы), вазопрессин (через V2-рецепторы). Этапы передачи сигнала:
1) Взаимодействие лиганда с рецептором приводит к изменению конформации последнего.
2)Это изменение передается на G-белок, который состоит из трех субъединиц (α, β и γ), α-субъединица связана с ГДФ.В составе G-белков α-субъединицы бывают 2х типов по отношению к аденилатциклазе: активирующие αS и ингибирующие αI.
3)В результате взаимодействия с рецептором β- и γ-субъединицы отщепляются, одновременно на α-субъединице ГДФ заменяется на ГТФ.
4)Активированная таким образом αS-субъединица стимулирует аденилатциклазу, которая начинает синтез цАМФ.
Если в действо была вовлечена αI-субъединица - она ингибирует аденилатциклазу, все останавливается.
5) Циклический АМФ - вторичный мессенджер - в свою очередь, взаимодействует с протеинкиназой А и активирует ее. Протеинкиназа А фосфорилирует ряд ферментов, среди которых киназа фосфорилазы гликогена, гликогенсинтаза, ТАГ-липаза.
6)Наработка цАМФ продолжается некоторое время, пока α-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.
7) Как только ГТФ превратился в ГДФ, то α-субъединица инактивируется, теряет свое влияние на аденилатциклазу, обратно соединяется с β- и γ-субъединицами. Все возвращается в исходное положение.
8)Гормон отрывается от рецептора еще раньше:
- если концентрация гормона в крови велика, то следующая его молекула присоединится к рецептору через малый промежуток времени и повторный запуск АЦ-механизма произойдет быстро - в клетке активируются соответствующие процессы.
- если гормона в крови мало - для клетки наступает некоторая пауза, изменения метаболизма нет. Механизм наработки цАМФ связан с активацией фермента аденилатциклазы и называется аденилатциклазный механизм.
Гормоны, для которых циклический АМФ служит в качестве вторичного медиатора:
Гормон Мишень: орган/ткань Типичное действие
Адренокортикотропный гормон Кора надпочечников Продуцирование кортизола
Кальцитонин Кости Концентрация кальция в сыворотке крови
Катехоламины (b-адренергические) Сердце ЧСС, сократимость миокарда
Хорионический гонадотропин Яичники, семенники Продуцирование половых гормонов
Фолликулостимулирующий гормон Яичники, семенники Гаметогенез
Глюкагон Печень Гликогенолиз, высвобождение глюкозы
Лютеинизирующий гормон Яичники, семенники Продуцирование половых гормонов
Рилизинг-фактор лютеинизирующего гормона Гипофиз Высв-е лютеинизирующего гормона
Меланоцитстимулирующий гормон Кожа (меланоциты) Пигментация
Гормон паращитовидных желез Кости, почки Концентрация Са и Р в сыворотке крови
Простациклин, простагландин Тромбоциты Агрегация тромбоцитов
Тиреотропный гормон Щитовидная железа Продуцирование и высвобождение Тз и Т 4
Рилизинг-фактор тиреотропного гормона Гипофиз Высвоб-е тиреотропного гормона
Вазопрессин Почки Концентрация мочи
По этому механизму, который получил название кальций-фосфолипидный механизм, действуют вазопрессин (через V1-рецепторы), адреналин (через α1-адренорецепторы), ангиотензин II.
Принцип работы этого механизма совпадает с предыдущим, но вместо аденилатциклазы мишеневым ферментом для α-субъединицы служит фосфолипаза С. Фосфолипаза С расщепляет мембранный фосфолипид фосфатидилинозитолдифосфат (ФИФ2) до вторичных мессенджеров инозитолтрифосфата (ИФ3) и диацилглицерола (ДАГ).
Этапы передачи сигнала:
1)Взаимодействие гормона с рецептором приводит к изменению конформации последнего.
2) Это изменение передается на G-белок, который состоит из трех субъединиц (αP, β и γ), α-субъединица связана с ГДФ.
3)В результате взаимодействия с рецептором β- и γ-субъединицы отщепляются, одновременно на αP-субъединице ГДФ заменяется на ГТФ.
4)Активированная таким образом αP-субъединица стимулирует фосфолипазу С, которая начинает расщепление ФИФ2 до двух вторичных мессенджеров - ИФ3 и ДАГ.
5)Инозитолтрифосфат открывает кальциевые каналы в эндоплазматическом ретикулуме, что вызывает увеличение концентрации ионов Cа2+. Диацилглицерол совместно с ионами Са2+ активирует протеинкиназу С. Кроме этого, диацилглицерол имеет и другую сигнальную функцию: он может распадаться на 1-моноацилглицерол и полиеновую жирную кислоту (обычно арахидоновую), из которой образуются эйкозаноиды.
6)Протеинкиназа С фосфорилирует ряд ферментов и в целом участвует в процессах клеточной пролиферации. Накопление ионов Са2+ в цитоплазме вызывает активацию определенных кальций-связывающих белков (например, кальмодулина).
7)Гидролиз ФИФ2 продолжается некоторое время, пока αP-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.
8)Как только ГТФ превратился в ГДФ, то αP-субъединица инактивируется, теряет свое влияние на фосфолипазу C, обратно соединяется с β- и γ-субъединицами. Все возвращается в исходное положение.
9) Гормон отрывается от рецептора еще раньше:
- если концентрация гормона в крови велика, то следующая его молекула присоединится к рецептору через малый промежуток времени и повторный запуск механизма произойдет быстро - в клетке активируются соответствующие процессы.
- если гормона в крови мало - для клетки наступает некоторая пауза, изменения метаболизма нет.
Гуанилатциклазный механизм пока изучен недостаточно подробно, но известно, что по нему работает атриопептин (предсердный натрийуретический пептид), оксид азота (NO) и другие, пока малоизученные, соединения.
Гуанилатциклазный механизм передачи сигнала в общих чертах схож с аденилатциклазным: после появления какой-либо сигнальной молекулы сигнал воспринимается ферментом гуанилатциклазой и далее передается при помощи вторичного мессенджера цГМФ. Он воздействует на протеинкиназу G, которая фосфорилирует определенные белки, чем изменяет активность клетки.Но, в отличие от аденилатциклазы, данный фермент имеет четыре разновидности, три из которых связаны с мембраной, четвертый - цитозольный:
мембраносвязанные формы гуанилатциклазы работают как рецепторы, обладающие каталитической активностью.
цитозольный фермент является димером и содержит в своем составе гем, он непосредственно взаимодействует в цитозоле с сигнальной молекулой (например, оксидом азота). Система, генерирующая цГМФ как вторичный посредник, сопряжена с гуанилатциклазой. Этот фермент катализирует реакцию образования цГМФ из ГТФ (подобно аденилатциклазе). Молекулы цГМФ могут активировать транспортные системы мембран клеток или активируют цГМФ-зависимую протеинкиназу G, которая участвует в фосфорилировании других белков в клетке. Циклические нуклеотиды запускают каскады реакций аденилатциклазного или гуанилатциклазного механизмов регуляции активности ферментов. Одна молекула гормона, активирующая рецептор, может «включать» несколько G-белков. Каждый из них в свою очередь активирует несколько молекул аденилатциклазы с образованием тысяч молекул цАМФ или цГМФ. Образующийся вторичный посредник усиливает сигнал в тысячу раз. Суммарное усиление сигнала равно 106 - 107 раз. Снятие гормонального сигнала достигается уменьшением концентрации вторичного посредника. Реакции превращения цАМФ или цГМФ в неактивные метаболиты АМФ или ГМФ катализируют ферменты фосфодиэстеразы. К настоящему времени получено много данных, что цГМФ принадлежит самостоятельная роль в регуляции функции клеток. В частности, в почках и кишечнике он контролирует ионный транспорт и обмен воды, в сердечной мышце служит сигналом релаксации и т.д. Гуанилатциклаза открыта во многих органах (сердце, легкие, почки, надпочечники, эндотелий кишечника, сетчатка и др.), что свидетельствует о широком ее участии в регуляции внутриклеточного метаболизма, опосредованном через цГМФ. Мембраносвязанный фермент активируется через соответствующие рецепторы короткими внеклеточными пептидами в частности гормоном предсердным натрийуретическим пептидом.
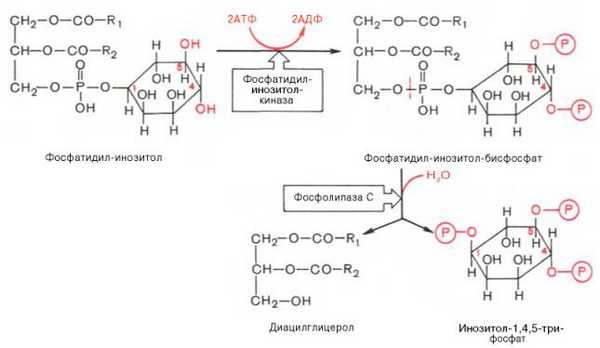
Инозитолтрифосфат - это вещество, которое является производным сложного липида - инозитфосфатида. Оно образуется в результате действия специального фермента - фосфолипазы "С", который активируется в результате конформационных изменений внутриклеточного домена мембранного белка-рецептора. Функционирование инозитолфосфатной системы трансмембранной передачи сигнала обеспечивают: R (рецептор), фосфолипаза С, Gplc - белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля. Этот фермент гидролизует фосфоэфирную связь в молекуле фосфатидил-инозитол-4,5-бисфосфата и в результате образуются диацилглицерин и инозитолтрифосфат.
Известно, что образование диацилглицерина и инозитолтрифосфата приводит к увеличению концентрации ионизированного кальция внутри клетки. Это приводит к активации многих кальций-зависимых белков внутри клетки, в том числе активируются различные протеинкиназы. И здесь, как и при активации аденилатциклазной системы, одной из стадий передачи сигнала внутри клетки является фосфорилирование белков, которое в приводит к физиологическому ответу клетки на действие гормона (Пример - АКТГ). В работе фосфоинозитидного механизма передачи сигналов в клетке-мишени принимает участие специальный кальций-связывающий белок - кальмодулин. Это низкомолекулярный белок (17 кДа), на 30 % состоящий из отрицательно заряженных аминокислот (Глу, Асп) и поэтому способный активно связывать Са+2. Одна молекула кальмодулина имеет 4 кальций-связывающих участка. После взаимодействия с Са+2 происходят конформационные изменения молекулы кальмодулина и комплекс "Са+2-кальмодулин" становится способным регулировать активность (аллостерически угнетать или активировать) многие ферменты - аденилатциклазу, фосфодиэстеразу, Са+2,Мg+2-АТФазу и различные протеинкиназы. В разных клетках при воздействии комплекса "Са+2-кальмодулин" на изоферменты одного и того же фермента (например, на аденилатциклазу разного типа) в одних случаях наблюдается активация, а в других - ингибирование реакции образования цАМФ. Такие различные эффекты происходят потому, что аллостерические центры изоферментов могут включать в себя различные радикалы аминокислот и их реакция на действие комплекса Са+2-кальмодулин будет отличаться.
Рис. 6.2. Опосредование гормонального сигнала системой фосфолипаза С-инози- тол-3-фосфат.
Образование гормон-рецепторного комплекса при участии регуляторного G-белка активирует мембранную фосфолипазу С, вызывающую гидролиз фосфолипидов мембраны с образованием двух вторичных посредников: инозитол-3-фосфата и диацил глицерола. Инозитол-З-фосфат ведет к выходу Са 2+ из внутриклеточных депо. Связывание ионизированного кальция со специализированным белком кальмодулином активирует протеинкиназы и вызывает фосфорилирование внутриклеточных структурных белков и ферментов. Диацилглицерол повышает сродство протеинкиназы С к Са 2+ , способствуя ее активации, что также завершается процессами фосфорилирования белков. Диацилглицерол одновременно реализует другой путь опосредования гормонального эффекта, активируя фосфолипазу А-2 и образование простаноидов.
ский эффект гормона. Через рассмотренную систему вторичных посредников реализуются эффекты адреналина (при связи с альфа-адренорецептором), вазопрессина (при связи с V-1-рецептором), ангиотензина-II, соматостатина, окситоцина.
4. Система кальций—кальмодулин. Ионизированный кальций поступает в клетку после образования гормон-рецепторного комплекса либо из внеклеточной среды за счет активирования медленных кальциевых каналов мембраны (как это происходит, например, в миокарде), либо из внутриклеточных депо под влиянием инозитол-3-фосфата. В цитоплазме немышечных клеток кальций связывается со специальным белком-кальмодули- ном, а в мышечных клетках роль кальмодулина выполняет тропонин С. Связанный с кальцием кальмодулин изменяет свою пространственную организацию и активирует многочисленные протеинкиназы, обеспечивающие фосфорилирование, а следовательно изменение структуры и свойств белков. Кроме того комплекс кальций—кальмодулин активирует фосфодиэстеразу цАМФ, что подавляет эффект циклического соединения как вторичного посредника. Вызываемое гормональным стимулом кратковременное увеличение в клетке кальция и его связывание с кальмодулином является пусковым стимулом для многочисленных физиологических процессов — сокращения мышц, секреции гормонов и выделения медиаторов, синтеза ДНК, изменения подвижности клеток, транспорта веществ через мембраны, изменения активности ферментов.
6.1.1.2. Взаимосвязи вторичных посредников
В клетках организма присутствуют или могут образовываться одновременно несколько вторичных посредников. В связи с этим между вторичными посредниками устанавливаются различные взаимоотношения: 1) равнозначное участие, когда разные посредники необходимы для полноценного гормонального эффекта; 2) один из посредников является основным, а другой лишь способствует реализации эффектов первого; 3) посредники действуют последовательно (например, инозитол-3-фосфат обеспечивает освобождение кальция, диацилглицерол облегчает взаимодействие кальция с протеинкиназой С); 4) посредники дублируют друг друга для обеспечения избыточности с целью надежности регуляции; 5) посредники являются антагонистами, т. е. один из них включает реакцию, а другой — тормозит (например, в гладких мышцах сосудов инозитол-3-фосфат и кальций реализуют их сокращение, а цАМФ — расслабление).
6.1.2. Механизм действия стероидных гормонов
Стероидные гормоны (рис. 6.3) обладают двумя путями действия на клетки: 1) классическим геномным или медленным и 2) быстрым негеномным.
6.1.2.1. Геномный механизм действия
Геномный механизм действия на клетки-мишени начинается трансмембранным переносом молекул стероидных гормонов в клетку (благодаря их растворимости в липидном бислое клеточной мембраны), с последующим связыванием гормона с цитоплазменным белком-рецептором. Эта связь с рецепторным белком необходима для поступления стероидного гормона в ядро, где происходит его взаимодействие с ядерным рецептором. Последующее взаимодействие комплекса гормон—ядерный рецептор с хроматиновым акцептором, специфическим кислым белком и ДНК влечет за собой: активацию транскрипции специфических мРНК, синтез транспортных и рибосомных РНК, процессинг первичных РНК-транскриптов и транспорт мРНК в цитоплазму, трансляцию мРНК при достаточном уровне транспортных РНК с синтезом белков и ферментов в рибосомах. Все эти явления требуют длительного (часы, сутки) присутствия гормон-рецеп- торного комплекса в ядре.
6.1.2.2. Негеномный механизм действия
Эффекты стероидных гормонов проявляются не только спустя несколько часов, что требуется для ядерного влияния, часть из них проявляется очень
быстро, в течение нескольких минут. Это такие эффекты, как повышение проницаемости мембран, усиление транспорта глюкозы и аминокислот, освобождение лизосомальных ферментов, сдвиги энергетики митохондрий. К числу быстрых негеномных эффектов стероидных гормонов относятся, например, увеличение в течение 5 мин после введения человеку альдостерона общего периферического сосудистого сопротивления и артериального давления, изменение транспорта натрия через мембрану эритроцитов (вообще лишенных ядра) под влиянием альдостерона в опытах in vitro, быстрый вход Са 2+ в клетки эндометрия под влиянием эстрогенов и др. Механизм негеномного действия стероидных гормонов заключается в связывании на плазматической мембране клетки со специфическими рецепторами и активации каскадных реакций систем вторичных посредников, например фосфолипазы С, инозитол-3-фосфата, ионизированного Са 2+ , протеинкиназы С. Под влиянием стероидных гормонов в клетке может увеличиваться содержание цАМФ и цГМФ. Негеномный эффект стероидных гормонов
1 — классический геномный путь действия (гормон проникает через клеточную мембрану и цитоплазму в ядро, где после взаимодействия с ядерным рецептором воздействует на гены-ми- шени, активируя их). 2а и 2б — негеномные пути действия через мембранные рецепторы: 2а — пути, связанные с мембранным ферментом и образованием вторичного посредника, ведущего к активации протеинкиназ. Последние через фосфорилирование в ядре белка-коактиватора (БКА) активируют гены-мишени; 26 — пути, связанные с ионными каналами клеточной мембраны, в результате чего гормон-рецепторный комплекс активирует ионные каналы, меняя возбудимость клетки. 3 — альтернативный негеномный путь действия (молекула гормона, проникая через мембрану в цитоплазму, взаимодействует с цитозольным рецептором, что приводит к активации цитозольных киназ.
может быть реализован и после их связывания с цитоплазматическими рецепторами. Часть негеномных эффектов стероидных гормонов осуществляется благодаря их взаимодействию с рецепторами, связанными с воротным механизмом ионных каналов мембран нервных клеток, являясь тем самым модуляторами, например, глицин-, серотонин- или гамма-аминобу- тиратергических нейронов. Наконец, растворяясь в липидном бислое мембраны, стероидные гормоны могут менять физические свойства мембраны, такие как ее текучесть или проницаемость для гидрофильных молекул, что также является негеномным эффектом.
Таким образом, механизмы действия гормонов разной химической структуры имеют не только различия, но и общие черты. Как и стероиды, пептидные гормоны обладают способностью избирательно влиять на транскрипцию генов в ядре клетки. Этот эффект пептидных гормонов может быть реализован не только с поверхности клетки при образовании вторичных посредников, но и путем поступления пептидных гормонов внутрь клетки за счет интернализации гормон-рецепторного комплекса.
6.L3. Саморегуляция чувствительности эффектора к гормональному сигналу
Изменение характера и интенсивности регуляторных сигналов, поступающих к клетке, ведет к адаптивной перестройке ее рецепторных структур за счет специальных механизмов саморегуляции, изменяющих чувствительность клетки к этому сигналу. Так, при избыточности внеклеточного гуморального сигнала формируется десенситизация соответствующего рецептора, т. е. уменьшение его чувствительности к гуморальному регулятору из-за ослабления сродства рецептора к молекуле лиганда или числа рецепторных молекул. Механизм десенситизации рецепторов, реализующих регуляторный эффект через системы вторичных посредников, представлен на рис. 6.4. При наличии во внеклеточной среде избыточного гуморального сигнала и/или увеличении времени связывания лиганда с рецептором активируемая лиганд-рецепторным взаимодействием протеинкиназа плазматической мембраны фосфорилирует рецептор, в результате его аффинность к лиганду уменьшается в 2—5 раз, что предотвращает чрезмерность регуляторного эффекта. Если этого снижения чувствительности рецептора недостаточно, рецептор фосфорилируется другой протеинкиназой, активируемой соответствующим вторичным посредником. Следствием такого фосфорилирования является нарушение сопряжения рецепторов с G-белками и нарушение эффектов G-белков (активирующих или ингибирующих) на системы вторичных посредников и ионные каналы. Наконец, в случаях недостаточной эффективности двух указанных механизмов десенситизации гормон-рецепторные комплексы интернализуются внутрь клетки с образованием рецепторосомы (вакуоль с рецептором). В последующем, если уровень гуморального регулятора во внеклеточной микросреде снизится в течение 2—3 ч, интернализированный рецептор может вновь встроиться в мембрану, а если повышенная концентрация регулятора сохраняется — рецепторосомы сливаются с лизосомами и рецепторы разрушаются. Десенситизация рецепторов может быть гомологической, проявляющейся в снижении чувствительности только к тому гуморальному регулятору, избыток которого ее вызвал, и гетерологической, заключающейся в снижении чувствительности и к другим гуморальным факторам регуляции, но также реализующим эффект через связанные с G-белком рецепторы и те же вторичные посредники.
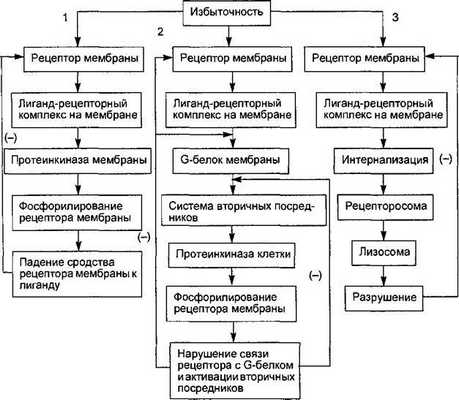
Рис. 6.4. Схема трех путей десенситизации клетки к избыточному внешнему регуляторному сигналу.
1. Снижение сродства рецептора к лиганду из-за фосфорилирования рецептора мембранной протеинкиназой. 2. Нарушение связи молекулы рецептора с G-белком при фосфорилировании рецептора цитоплазматическими протеинкиназами. 3. Интернализация лиганд-рецептор- ного комплекса и разрушение рецептора ферментами лизосом. Стрелками со знаком (—) обозначено подавление процесса взаимодействия.
Чувствительность клеток к внешним регуляторным сигналам зависит также и от числа так называемых свободных, или резервных, рецепторов, т. е. доступных для лиганда. Увеличивая синтез этих мембранных структур или их «всплывание» на поверхность мембраны, клетка способна повышать чувствительность к регуляторному сигналу (сенситизация), например в случаях недостаточного количества молекул гуморального регулятора во внеклеточной микросреде. Повышение чувствительности к регуляторному сигналу является также следствием возросшего сопряжения рецепторов с G-белком и системой вторичных посредников.
Клетки организма, как правило, используют не один, а несколько путей реализации одного гуморального регуляторного сигнала, в связи с чем для каждого лиганда (например, молекул одного гормона) на мембранах существуют несколько типов рецепторов. Так, для ацетилхолина, гистамина, катехоламинов, опиоидных пептидов, серотонина, вазопрессина иденти
фицировано два (вазопрессин), три (опиоиды), четыре (мускариновые для ацетилхолина) и более (катехоламины, серотонин) мембранных рецепторов. Соответственно, меняя за счет саморегуляции чувствительность рецепторов одного типа, клетка изменяет характер функционирования и способна компенсировать неадекватные сдвиги в регуляторных влияниях.
Одним из регуляторных эффектов, реализуемых внутри клетки с помощью систем вторичных посредников мембранного лиганд-рецепторного взаимодействия, является изменение функционального состояния генома клетки и биосинтеза белка. Но и ядро клетки способно менять состояние плазматической мембраны, ее чувствительность к сдвигам внеклеточной среды, в том числе и изменению в ней количества и характера регуляторных сигналов. В клетках под контролем генома происходит синтез специальных белков — инверторов, оказывающих различное влияние на функциональное состояние мембраны в зависимости от адаптивно-компенсаторных потребностей клетки — изменение активности рецепторов, состояния ионных каналов и насосов. Эти белки могут вести к гиперполяризации клеточной мембраны, ослаблению функциональной активности клетки, с одновременным повышением синтеза белка и процессов регенерации внутриклеточных структур.
Система кальций—кальмодулин. Взаимосвязи вторичных посредников.
Гормоны. Гидрофильные гормоны
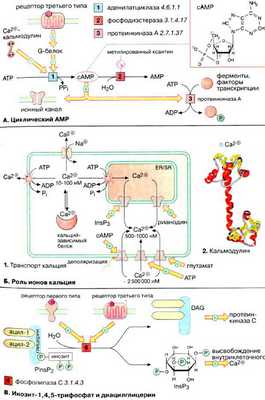
Вторичные мессенджеры, или посредники, это внутриклеточные вещества, концентрация которых строго контролируется гормонами, нейромедиаторами и другими внеклеточными сигналами (см. с. 372). Такие вещества образуются из доступных субстратов и имеют короткий биохимический полупериод. Наиболее важными вторичными мессенджерами являются цАМФ (сAMP), цГТФ (cGTP), Са 2+ , инозит-1,4,5-трифосфат [ИФ 3 (lnsP 3 )], диацилглицерин [ДАГ (DAG)] и монооксид азота (NO).
А. Циклический АМФ
Биосинтез. Нуклеотид цАМФ (3',5'-циклоаденозинмонофосфат, сАМР> синтезируется мембранными аденилатциклазами [ 1 ] — семейством ферментов, катализирующих реакцию циклизации АТФ (АТР) с образованием цАМФ и неорганического пирофосфата. Расщепление цАМФ с образованием АМФ (AMP) катализируется фосфодиэстеразами [ 2 ], которые ингибируются при высоких концентрациях метилированных производных ксантина, например кофеином.
Активность аденилатциклазы контролируется G-белками, которые в свою очередь сопряжены с рецепторами третьего типа , управляемыми внешними сигналами (см. с. 372). Большинство G-белков (G s -белки) активируют аденилатциклазу, некоторые G-белки ее ингибируют (G i -белки). Некоторые аденилатциклазы активируются комплексом Са 2+ /кальмодулин.
Механизм действия. цАМФ является аллостерическим эффектором протеинкиназ А (ПК-Α) [ 3 ] и ионных каналов (см. с. 372). В неактивном состоянии ПК-Α является тетрамером, две каталитические субъединицы (К-субъединицы) которого ингибированы регуляторными субъединицами (Р-субъединицы) (аутоингибирование). При связывании цАМФ Р-субъединицы диссоциируют из комплекса и К-единицы активируются. Фермент может фосфорилировать определенные остатки серина и треонина в более чем 100 различных белках, в том числе во многих ферментах (см. с. 158) и факторах транскрипции. В результате фосфорилирования изменяется функциональная активность этих белков.
Наряду с цАМФ функции вторичного мессенджера может выполнять и цГМФ (cGMP) (см. с. 346). Оба соединения различаются по метаболизму и механизму действия.
Б. Роль ионов кальция
Уровень ионов кальция. Концентрация ионов Са 2+ в цитоплазме нестимулированной клетки очень низка (10-100 нМ). Низкий уровень поддерживается кальциевыми АТФ-азами (кальциевыми насосами) и натрий-кальциевыми обменниками. Резкое повышение концентрации ионов Са 2+ в цитоплазме (до 500-1000 нМ) происходит в результате открывания кальциевых каналов плазматической мембраны или внутриклеточных кальциевых депо (гладкого и шероховатого эндоплазматического ретикулума). Открывание каналов может быть вызвано деполяризацией мембран или действием сигнальных веществ, нейромедиаторов (глутамат и АТФ, см. с. 342), вторичных мессенджеров ( ИФ 3 и цАМФ ), а также вещества растительного происхождения рианодина. В цитоплазме и клеточных органеллах имеется множество белков способных связывать Са 2+ , некоторые из них выполняют роль буфера.
При высокой концентрации в цитоплазме ионы Са 2+ оказывает на клетку цитотоксическое действие. Поэтому уровень кальция в отдельной клетке испытывает кратковременные всплески, увеличиваясь в 5-10 раз, а стимуляция клетки увеличивает лишь частоту этих флуктуаций.
Действие кальция опосредовано специальными Са 2+ -связывающими белками ( «кальциевыми сенсорами» ), к которым принадлежат аннексин, кальмодулин и тропонин (см. с. 326). Кальмодулин — сравнительно небольшой белок (17 кДа) — присутствует во всех животных клетках. При связывании четырех ионов Са 2+ (на схеме голубые кружочки) кальмодулин переходит в активную форму, способную взаимодействовать с многочисленными белками. За счет активации кальмодулина ионы Са 2+ оказывают влияние на активность ферментов, ионных насосов и компонентов цитоскелета.
B. Инозит-1,4,5-трифосфат и диацилглицерин
Гидролиз фосфатидилинозит-4,5-дифосфата [ФИФ 2 (PlnsP 2 )] фосфолипазой С [ 4 ] приводит к образованию двух вторичных мессенджеров: инозит-1,4,5-трифосфата и диацилглицерина. Гидрофильный ИФ 3 поступает в эндоплазматический ретикулум [ЭР (ЕR)] и индуцирует высвобождение ионов Са 2+ из запасающих везикул. Липофильный ДАГ остается в мембране и активирует протеинкиназу C , которая в присутствии Са 2+ фосфорилирует различные белковые субстраты, модулируя их функциональную активность.
Са 2+ -мессенджерная система
К внутриклеточной системе мессенджеров относят также производные фосфолипидов мембран эукариотических клеток, в частности фосфорили-рованные производные фосфатидилинозитола. Эти производные освобождаются в ответ на гормональный сигнал (например, от вазопрессина или тиротропина) под действием специфической мембраносвязанной фосфо-липазы С. В результате последовательных реакций образуются два потенциальных вторичных мессенджера - диацилглицерол и инозитол-1,4,5-три-фосфат.
Биологические эффекты этих вторичных мессенджеров реализуются по-разному. Действие диацилглицерола, как и свободных ионов Са 2+ , опосредовано через мембраносвязанный Са-зависимый фермент протеин-киназу С, которая катализирует фосфорилирование внутриклеточных ферментов, изменяя их активность. Инозитол-1,4,5-трифосфат связывается со специфическим рецептором на эндоплазматическом ретикулуме, способствуя выходу из него ионов Са 2+ в цитозоль.
Таким образом, представленные данные о вторичных мессенджерах свидетельствуют о том, что каждой из этих систем посредников гормонального эффекта соответствует определенный класс протеинкиназ, хотя нельзя исключить возможности существования тесной связи между этими системами. Активность протеинкиназ типа А регулируется цАМФ, протеинкиназы G - цГМФ; Са 2+ -кальмодулинзависимые протеинкиназы находятся под контролем внутриклеточной [Са 2+ ], а протеинкиназа типа С регулируется диацилглицеролом в синергизме со свободным Са 2+ и кислыми фосфолипидами. Повышение уровня какого-либо вторичного мес-сенджера приводит к активации соответствующего класса протеинкиназ и последующему фосфорилированию их белковых субстратов. В результате меняется не только активность, но и регуляторные и каталитические свойства многих ферментных систем клетки: ионных каналов, внутриклеточных структурных элементов и генетического аппарата.
Известно, что эффект стероидных гормонов реализуется через генетический аппарат путем изменения экспрессии генов. Гормон после доставки с белками крови в клетку проникает (путем диффузии) через плазматическую мембрану и далее через ядерную мембрану и связывается с внутриядерным рецептором-белком. Комплекс стероид-белок затем связывается с регуляторной областью ДНК, с так называемыми гормончувствительны-ми элементами, способствуя транскрипции соответствующих структурных генов, индукции синтеза белка de novo (см. главу 14) и изменению метаболизма клетки в ответ на гормональный сигнал.
Следует подчеркнуть, что главной и отличительной особенностью молекулярных механизмов действия двух основных классов гормонов является то, что действие пептидных гормонов реализуется в основном путем посттрансляционных (постсинтетических) модификаций белков в клетках, в то время как стероидные гормоны (а также тиреоидные гормоны, ретиноиды, витамин D3-гормоны) выступают в качестве регуляторов экспрессии генов. Это обобщение, однако, не является абсолютным, и здесь возможны модификации, рассмотренные при описании отдельных гормонов.
Системы вторичных посредников
Мембранный фермент аденилатциклаза может находиться в двух формах — активированной и неактивированной. Активация аденилатциклазы происходит под влиянием гормон-рецепторного комплекса, образование которого приводит к связыванию гуанилового нуклеотида (ГТФ) с особым регуляторным стимулирующим белком (GS-белок), после чего GS-белок вызывает присоединение Mg к аденилатциклазе и ее активацию (рис.3.14).
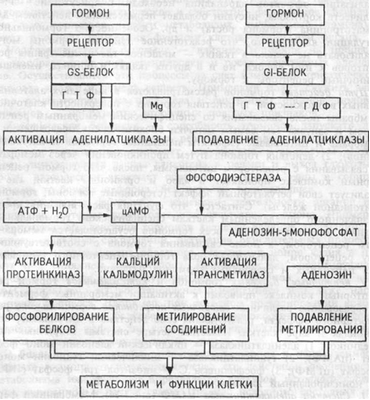
Рис.3.14. Механизм опосредования гормонального стимула системой аденилатциклаза-цАМФ.
Так действуют активирующие аденилатциклазу гормоны — глюкагон, тиротропин, паратирин, вазопрессин (через V-2-рецепторы), гонадотропин и др. Ряд гормонов, напротив, подавляет аденилатциклазу — соматостатин, ангиотензин- II и др. Гормон-рецепторные комплексы этих гормонов взаимодействуют в мембране клетки с другим регуляторным ингибирующим белком (GI-белок), который вызывает гидролиз ГТФ до ГДФ и, соответственно, подавление активности аденилатциклазы. Адреналин через бета-адренорецепторы активирует аденилатциклазу, а через альфа-1-адренорецепторы ее подавляет.
Под влиянием аденилатциклазы из АТФ синтезируется цАМФ, вызывающий активацию двух типов протеинкиназ в цитоплазме клетки, ведущих к фосфорилированию многочисленных внутриклеточных белков. Это меняет проницаемость мембран, активность и количество ферментов, т.е. вызывает типичные для гормона метаболические и, соответственно, функциональные сдвиги. В табл.3.3 приведены основные эффекты активации цАМФ-зависимых протеинкиназ.
| Виды белков | Эффекты фосфорилирования |
| Компоненты мембраны | Изменения проницаемости |
| Ферменты, лимитирующие скорость метаболического процесса | Активация или подавление |
| Белки рибосом | Активирование или подавление трансляции |
| Ядерные белки | Активирование или подавление транскрипции |
| Белки микротрубочек | Секреторный, двигательный эффекты или изменение конфигурации клетки |
Кроме активации протеинкиназ внутриклеточные эффекты цАМФ реализуются также через три других механизма:
1) Систему кальций-кальмодулин,
2) Трансметилазную систему,
3) Аденозин-5-монофосфат — аденозин.
О роли системы кальций-кальмодулин будет сказано ниже. Трансметилазная система обеспечивает метилирование ДНК, всех типов РНК, белков хроматина и мембран, ряда гормонов на уровне тканей, фосфолипидов мембран. Это способствует реализации многих гормональных влияний на процессы пролиферации, дифференцировки, состояние проницаемости мембран и свойства их ионных каналов и, что важно подчеркнуть особо, влияет на доступность мембранных реиепторных белков молекулам гормонов.
Прекращение гормонального эффекта, реализуемого через систему аденилатциклаза-цАМФ, осуществляется с помощью специального фермента фосфодиэстеразы цАМФ, вызывающей гидролиз этого вторичного посредника с образованием аденозин-5-монофосфата. Однако, этот продукт гидролиза превращается в клетке в аденозин, обладающий четким эффектом подавления процессов метилирования, что также играет роль в реализации определенных гормональных влияний.
2. Система гуанилатциклаза-цГМФ
Система гуанилатциклаза-цГМФ. Активация мембранной гу-анилатциклазы происходит не под непосредственным влиянием гормон-рецепторного комплекса, а опосредованно через ионизированный кальций и оксидантные системы мембран. Типичная стимуляция активности гуанилатциклазы ацетилхолином также реализуется опосредованно через Са++ . Через активацию гуанилатциклазы реализует эффект и натриуретический гормон предсердий — атриопептид. Путем активации перекисного окисления стимулирует гу-анилатциклазу биологически активное вещество (тканевой гормон) сосудистой стенки — расслабляющий эндотелиальный фактор. Под влиянием гуанилатциклазы из ГТФ синтезируется цГМФ, активирующий цГМФ-зависимые протеинкиназы, которые уменьшают скорость фосфорилирования легких цепей миозина в гладких мышцах стенок сосудов, приводя к их расслаблению. В большинстве тканей биохимические и физиологические эффекты цАМФ и цГМФ проти-воложны. Примерами могут служить стимуляция сокращений сердца под влиянием цАМФ и торможение их цГМФ, стимуляция сокращения гладких мышц кишечника цГМФ и подавление цАМФ. цГМФ играет роль в гиперполяризации рецепторов сетчатки глаза под влиянием фотонов света. Ферментативный гидролиз цГМФ осуществляется с помощью специфической фосфодиэстеразы.
3. Система фосфолипаза С — инозитол-три-фосфат
Гормонрецепторный комплекс с участием регуляторного G-белка ведет к активации мембранного фермента фосфолипазы С, вызывающей гидролиз фосфолигшдов мембраны с образованием двух вторичных посредников: инозитол-3-фосфата и диадилглицерола. Инозитол-3-фосфат вызывает выход Са++ из внутриклеточных депо, в основном из эндоплазматического ретикулума, ионизированный кальций связывается со специализированным белком кальмодулином, что обеспечивает активацию ряда протеинкиназ и фосфорилирование внутриклеточных структурных белков и ферментов (рис.3.15).
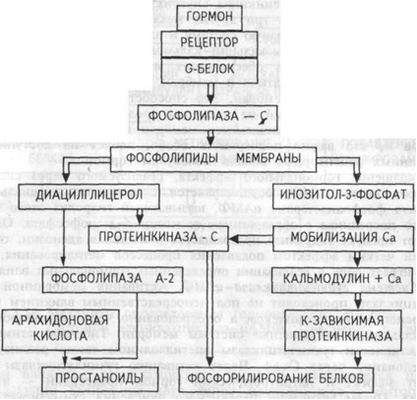
Рис.3.15. Механизм опосредования гормонального стимула системой фосфолипаза С — инозитол-3-фосфат. Пояснения в тексте.
В свою очередь диацилглицерол способствует резкому повышению сродства протеинкиназы С к ионизированному кальцию, последний без участия кальмодулина ее активирует, что также завершается процессами фосфорилирования других белков. Диацилглицерол одновременно может реализовывать и другой путь опосредования гормонального эффекта, так как он активирует фосфолипазу А-2. Под влиянием последней из мембранных фосфолипидов образуется арахидоновая кислота, являющаяся источником мощных по метаболическим и физиологическим эффектам веществ — простагландинов и лейкотриенов. Необходимо указать, что в разных клетках превалирует один или другой пути образования вторичных посредников, что в конечном счете и определяет физиологический эффект гормона. Через рассмотренные системы вторичных посредников реализуются эффекты адреналина (при связи с альфа-адренорецептором), вазопрессина (при связи с V- 1-рецептором), ангиотензина- II, соматостатина, окситоцина и других гормонов.
4. Система Са — кальмодулин
Система Са — кальмодулин. Ионизированный кальций поступает в клетку после образования гормон-рецепторного комплекса либо из внеклеточной среды за счет активирования медленных кальциевых каналов мембраны (как это происходит, например, в миокарде), либо из внутриклеточных депо, под влиянием вышеописанных внутриклеточных процессов. В цитоплазме немышечных клеток кальций связывается со специальным белком-кальмодулином, а в мышечных клетках роль кальмодулина выполняет тропонин С. Связанный с кальцием кальмодулин изменяет свою пространственную организацию и активирует многочисленные протеинкиназы, обеспечивающие фосфорилирование белков. Кроме того комплекс кальций-кальмодулин активирует фосфодиэстеразу цАМФ, что подавляет ее эффект как вторичного посредника. Кратковременное увеличение в клетке кальция и его связывание с кальмодулином является пусковым стимулом для многочисленных физиологических процессов — сокращения мышц, секреции гормонов и выделения медиаторов, синтеза ДНК, изменения подвижности клеток, транспорта веществ через мембраны, изменения активности ферментов.
Читайте также:
- Вторичная аменорея: причины, симптомы и лечение
- Гигантские многоядерные клетки раны. Динамика цитологических изменений раны
- Техника, этапы операции ревизии несвязанного эндопротеза плечевого сустава
- Атрезия и гипоплазия. Объем циркулирующей крови. Объем кровотока и величина шунта.
- Профилактика ятрогенных осложнений у пожилых людей
