Система PASCAL - PatternSCAnLaser для лазерной фотокоагуляции. Возможности
Добавил пользователь Владимир З. Обновлено: 22.01.2026
1 ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. академика С.Н. Федорова» Минздрава России, Тамбовский филиал
В статье рассматривается современная система «NAVILAS», которая представляет собой универсальный лечебно-диагностический прибор, описываются ее технические характеристики, область применения, преимущества и недостатки. Цель работы: оценить возможности навигационной лазерной установки «NAVILAS» на конкретных клинических примерах. Представлены клинические случаи пациентов с диабетической ретинопатией, посттромботической ретинопатией, периферической витреохориоретинальной дистрофией сетчатки. Всем пациентам проводились стандартные офтальмологические исследования: визометрия на фороптере «TOPCON» СV-5000 (Япония), рефрактокератометрия - на аппарате «TOPCON» KR-890 (Япония), биометрия - на аппарате «TOMEY» AL-3000 (Япония), исследование глазного дна - контактная биомикроскопия с помощью трехзеркальной линзы Гольдмана на щелевой лампе «TAKAGI» SLITLAMPMICROSCOPESM-70N, оптическая когерентная томография (ОКТ) на аппарате Copernicus HR («Optorol», Польша). Послеоперационный период у представленных пациентов проходил без осложнений, острота зрения оставалась без изменений, отека по лазерным коагулятам нет. Всем назначен нестероидный противовоспалительный препарат по схеме. Совершенствование новых приборов и лазерных технологий продолжается. Разработанная методика персонализированного лечения с индивидуальным подбором на навигационной лазерной системе «NAVILAS» свидетельствует о высокой эффективности и безопасности, которые обусловлены применением системы eye-tracker и сохранением функциональной активности тканей. Навигационная технология позволяет использовать возможности современных методов диагностики для повышения эффективности и безопасности лазерного лечения центральных отделов сетчатки. Технология навигационного лазерного лечения является перспективным методом высокодозированного топографически ориентированного лазерного лечения, особенно макулярной патологии широкого спектра.
1. Казанцев А.Д., Казанцев А.Д. Эволюция и современная ступень развития эксимерного лазера как средства оптической коррекции зрения // Вестник Совета молодых ученых и специалистов Челябинской области. 2016. Т. 2. №2. С. 54-57.
2. Гафуров С.Д., Катахонов Ш.М., Холмонов М.М. Особенности применения лазеров в медицине // European Science. 2019. № 3 (45). С. 92-95.
4. Володин П.Л., Иванова Е.В. Компьютерное моделирование лазерного воздействия в режиме единичного микроимпульса и реакции белков хориоретинального комплекса для селективного и эффективного воздействия на клетки ретинального и пигментного эпителия // Лазерная медицина. 2018. № 1. С. 61-66.
5. Гойдин А.П., Фабрикантов О.Л., Сухорукова Е.В. Эффективность применения классической и паттер-лазеркоагуляции при диабетической ретинопатии // Вестник Тамбовского университета. 2014. № 4. С. 1163-1165.
6. Куликов А.Н., Мальцев Д.С., Бурнашева М.А., Волков В.В., Даниличев В.Ф., Трояновский Р.Л. Широкопольная визуализация с помощью лазерной системы NAVILAS // Офтальмология. 2019. № 2. С. 210-217. DOI: 10.18008/1816-5095-2019-2-210-217.
7. Шухаев С.В., Науменко В.В., Бойко Э.В. VICTUS VS ZIEMER // Современные технологии в офтальмологии. 2017. № 3. С. 312-315.
8. Shoughy S.S., Arevalo J.F., Kozak I. Update on widean ultra-widefield retinal imaging. Indian J. Ophthalmol. 2015. Vol. 63. No. 7. P. 575-581. DOI: 10.4103/0301-4738.167122.
9. Гойдин А.П., Гурко Т.С., Крылова И.А., Попова Н.В., Яблокова Н.В. Способ комбинированного лечения диабетического диффузного макулярного отека // Патент РФ № 2486878. Патентообладатель ФГБУ «МНТК "Микрохирургия глаза" имени академика С.Н. Федорова" Минздрава России. 2013. Бюл. № 19.
10. Куликов А.Н., Мальцев Д.С., Бойко Э.В. Сравнительное исследование навигационной паттернсканирующей лазерной системы и одноточечной лазерной системы в послеоперационной лазерной ретинопексии // Офтальмология. 2019. Т. 16. № 3. С. 296-303.
11. Arsan A., Kanar H.S., Sonmez A. Visual outcomes and anatomic changes after subthreshold micropulse yellow laser (577 nm) treatment for chronic central serous chorioretinopathy: long-term follow-up. Eye. 2018. 32 (4). P. 726-733. DOI: 10.1038/eye 2017.293.
12. Попова Н.В., Гойдин А.П. Периферическая витреохориоретинальная дистрофия (обзор литературы) // Сибирский научный медицинский журнал. 2017. № 3. С. 54-60.
13. Фабрикантов О.Л., Попова Н.В., Гойдин А.П. Диагностические возможности оптической когерентной томографии-ангиографии при хориоидальной неоваскуляризации (обзор клинических случаев) // Медицина. 2017. № 2 (18). С. 55-63.
14. Попова Н.В., Фабрикантов О.Л., Гойдин А.П. Частота встречаемости различных клинических форм периферических витреохориоретинальных дистрофий в зависимости от степени миопии // Вестник Тамбовского университета. 2017. № 22 (6-2). С. 1484-1487.
История развития лазерной офтальмохирургии насчитывает свыше 50 лет. Американский физик T. Maiman в 1960 г. создал первый лазер на основе кристалла рубина. Значимую роль в разработке первых лазеров сыграли и отечественные ученые Н.Г. Басов, А.М. Прохоров, американский исследователь Ч. Таунс, за что были удостоены Нобелевской премии в 1964 г. В 1970 г. впервые в офтальмологической практике был применен газовый аргоновый лазер, оснащенный щелевой лампой (H. Zweng). В 1970-е гг. появился иттрий-алюминиевый лазер (Nd:YAG), который дал возможность выполнять фотодестуктивные операции - дисцизию вторичной катаракты, лазерную иридэктомию [1, 2].
Глобальным прорывом в офтальмологии было появление в начале 1990-х гг. твердотельного YAG-лазера с удвоением частоты и длиной волны 532 нм, который обладал рядом преимуществ перед аргоновым лазером. Отсутствие в его спектре синей составляющей позволило выполнять лазерные вмешательства в центральной зоне сетчатки. Несмотря на широкое использование лазеров в офтальмологической практике, прогресс в развитии лазерного оборудования не останавливается [2]. В последнее десятилетие появились лазерные системы, с помощью которых стало возможно проводить паттерн- коагуляцию, когда одним нажатием на педаль на сетчатке пациента появляется сразу несколько коагулятов [2]. Совершенствование лазерных систем продолжается, но остаются неизменными способ доставки лазерного излучения и способ контроля над нанесением лазерных коагулятов - через объектив щелевой лампы [3].
Принципиально новым подходом в лазерной хирургии явилась разработка в 2009 г. немецкой компанией OD-OS автоматизированной навигационной системы «NAVILAS», которая представляет собой универсальный лечебно-диагностический прибор. Данная система включает лазерный коагулятор с интегрированной ретинальной камерой на основе сканирующего лазерного офтальмоскопа. Лазерная система позволяет использовать навигацию, с помощью которой появилась возможность получать и сохранять топографические параметры глазного дна для выполнения последующей лазеркоагуляции. Особенно важным дополнением системы является возможность одномоментного выполнения диагностических обследований (флюоресцентной ангиографии (ФАГ), оптической когерентной томографии (ОКТ)) с импортом полученных данных, сохранением и совмещением с «живой» картиной глазного дна пациента [4, 5].
Технические характеристики лазерной системы «NAVILAS»:
- длина волны лазерного излучения 577 нм;
- мощность 50-2000 мВт;
- длительность импульса 10-5000 мсек;
- диаметр пятна 50-500 мкм;
- поле обзора 50-165/180 (в динамике);
- возможность работы в одиночном, микроимпульсном, паттерновом режимах;
- высокоскоростной трекинг - 50 Гц - существенно повышает безопасность нанесения коагулятов при лазерном лечении и отслеживает микродвижения глаз.
Существуют два основных отличия навигационной лазерной системы «NAVILAS» от стандартной, совмещенной со щелевой лампой.
1. В системе «NAVILAS» изображение выводится на экран компьютера, предусмотрена возможность импорта и наложения результатов диагностических исследований: ОКТ, ФАГ, что является необходимым для точного сопоставления зон патологии и прицельного лазерного лечения этой области.
2. Работа с системой «NAVILAS» основана на выполнении трех последовательных этапов.
Первый этап - изображение (Image) - заключается в получении изображения глазного дна - цветного, инфракрасного. Эти изображения служат основанием для следующего этапа - планирования лазеркоагуляции (Plan). Хирург обозначает опасные зоны - макулярную зону, диск зрительного нерва, намечает точки нанесения лазерных коагулятов, а также регулирует уровень энергии в импульсе.
Заключительный этап - лечение (Treat) c учетом движений глаз пациента. Система eye-tracker дает возможность обеспечить высокую точность и безопасность нанесения коагулятов. После выполненной коагуляции доктор получает точный отчет о количестве коагулятов, используемом уровне энергии. Эта информация далее хранится в электронной истории болезни пациента 5.
Данная лазерная установка может применяться при диагностике и лечении патологических изменений на глазном дне, таких как: диабетическая ретинопатия, макулярный отек, хориоидальная неоваскуляризация, сосудистые заболевания глаз (посттромботическая ретинопатия), центральная серозная хориоретинопатия, периферические витреохориоретинальные дистрофии.
Навигационная технология лазерного лечения позволяет с высокой точностью наносить лазерные коагуляты, в том числе и в микроимпульсном режиме, а также сокращать продолжительность лазерного вмешательства. При работе на лазерной системе «NAVILAS» хирург получает лазерные коагуляты более правильной формы, в том числе и на периферии глазного дна. Отмечена хорошая субъективная переносимость лазерного лечения, обусловленная проведением операции в инфракрасном свете без применения контактной линзы.
К условным недостаткам можно отнести особенности визуализации околопороговых тестировочных коагулятов, отсутствие трехмерной визуализации, необходимость тщательного подбора энергетических параметров для субпорогового лечения 8.
В июне 2019 г. навигационная лазерная система «NAVILAS» появилась во ФГАУ НМИЦ ТФ «Микрохирургия глаза». За 18 месяцев на этой установке выполнено 249 операций:
- периферическая лазеркоагуляция сетчатки - 41;
- решетчатая лазеркоагуляция сетчатки - 28;
- ограничительная лазеркоагуляция сетчатки - 21;
- микроимпульсная решетчатая коагуляция - 60;
- панретинальная лазеркоагуляция - 99.
Цель работы: оценить возможности навигационной лазерной установки «NAVILAS» на конкретных клинических примерах.
Материалы и методы исследования. В качестве примеров рассмотрим следующие клинические случаи пациентов с диабетической ретинопатией, посттромботической ретинопатией, периферической витреохориоретинальной дегенерацией 14. Всем пациентам проводилось стандартное офтальмологическое диагностическое обследование - визометрия на фороптере фирмы «TOPCON» CV-5000 (Япония), рефрактокератометрия - на аппарате «TOPCON» KR-8900 (Япония), биометрия - на аппарате «TOMEY» AL-3000 (Япония), исследование глазного дна - контактная биомикроскопия с помощью трехзеркальной линзы Гольдмана на щелевой лампе «TAKAGI» SLITLAMPMICROSCOPESM-70N, ув.16., оптическая когерентная томография (ОКТ) на аппарате Copernicus HR («Optorol», Польша).
Клинический случай № 1 (рис. 1).
Пациент А., 1951 года рождения.
Рис. 1. Глазное дно пациента с диабетической ретинопатией
Диагноз: OU - Начальная пролиферативная диабетическая ретинопатия. Начальная диабетическая макулопатия. Артифакия.
Vis OS 0,3c+1,0;cyl-0,5ax155=0,5
ВГД OD 13,7 mmHg; OS 14,3 mmHg.
Энергетические параметры (микроимпульсное лазерное воздействие):
мощность - 200 мВт, экспозиция - 100 мсек, диаметр луча - 100 мкм, скважность - 5% (рис. 1а, 1б, 1в).
Энергетические параметры (панретинальная лазерная коагуляция):
мощность - 356 мВт, экспозиция - 200 мсек, диаметр луча - 490 мкм (рис. 1г, 1д).
Клинический случай № 2 (рис. 2).
Пациент К., 1970 года рождения.
Рис. 2. Глазное дно пациента с посттромботической ретинопатией
Диагноз: OS - Посттромботическая ретинопатия.
Vis OS 0,7cyl+0,5ax170=0,8
ВГД OD 14,5 mmHg; OS 12,8 mmHg
Энергетические параметры (секторальная панретинальная лазеркоагуляция): мощность - 240 мВт, экспозиция - 200 мсек, диаметр луча - 235 мкм.
Клинический случай № 3.
Пациент К., 1968 года рождения.
Рис. 3. Глазное дно пациента с ПВХРД
Диагноз: OU - Пресбиопия. OS - ПВХРД.
ВГД OD 16,4 mm Hg; OS 15,8 mm Hg
Энергетические параметры (периферическая лазеркоагуляция сетчатки): мощность - 240 мВт, экспозиция - 200 мсек, диаметр луча - 235 мкм.
Результаты исследования и их обсуждение
Клинический пример № 1 (рис. 4, 5).
Рис. 4. Этап лечения диабетической макулопатии на лазерной системе «Navilas»
Рис. 5. Схема лечения диабетической ретинопатии на лазерной системе «Navilas»
Послеоперационный период прошел без осложнений, острота зрения составила 1,0 с коррекцией, ВГД оперируемого глаза OD - 13,7 mm Hg. В макулярной зоне следов от ЛК не обнаружено, по сосудистым аркадам ЛК второй степени по L’Speranse, отека по коагулятам нет. Пациенту назначен нестероидный противовоспалительный препарат по схеме на 10-14 дней.
Клинический пример № 2 (рис. 6).
Рис. 6. Схема лечения посттромботической ретинопатии на лазерной системе «Navilas»
Послеоперационный период прошел без осложнений, острота зрения составила 0,8 с коррекцией, ВГД оперируемого глаза - OS 12,8 mm Hg. По нижневисочной сосудистой аркаде ЛК второй степени по L’Speranse, отека по коагулятам нет. Пациенту назначен нестероидный противовоспалительный препарат по схеме на 10-14 дней.
Клинический пример № 3 (рис. 7).
Рис. 7. Схема лечения периферической хориоретинальной дегенерации на лазерной системе «Navilas»
Послеоперационный период прошел без осложнений, острота зрения составила 1,0 с коррекцией, ВГД оперируемого глаза - OS 15,8 mm Hg. На крайней периферии ЛК второй степени по L’Speranse вокруг зоны дистрофии, отека по коагулятам нет. Пациенту назначен нестероидный противовоспалительный препарат по схеме на 10-14 дней.
Совершенствование новых приборов и лазерных технологий продолжается. Разработанная методика персонализированного лечения с индивидуальным подбором на навигационной лазерной системе «NAVILAS» свидетельствует о высокой эффективности и безопасности, которые обусловлены применением системы eye-tracker и сохранением функциональной активности тканей.
Заключение. Навигационная технология позволяет использовать возможности современных методов диагностики для повышения эффективности и безопасности лазерного лечения центральных отделов сетчатки. Технология навигационного лазерного лечения является перспективным методом высокодозированного топографически ориентированного лазерного лечения, особенно макулярной патологии широкого спектра.
Система фотокоагуляции PASCAL

Система фотокоагуляции (шаблонное лазерное сканирование) является широко используемым способом лечения диабетической ретинопатии за счёт точечных выстрелов или рисунком до 25 точек .
Созданный для повышения эффективности лечения заболеваний сетчатки, лазерная система PASCAL широко используется для лечения тысяч пациентов во всем мире.
Система включает в себя сенсорный экран и передовые оптические технологии лампы.
Что лечат лазерной системой PASCAL?
Система фотокоагуляции PASCAL используется для лечения различных заболеваний сетчатки, таких как диабетическая ретинопатия, дегенерация желтого пятна свящанная с возрастными изменениями, а также окклюзионую болезнь сосудов сетчатки.
Как работает Система фотокоагуляции PASCAL?
Технология Системы фотокоагуляции PASCAL состоит в использовании модели полуавтоматического лазера с длительностью импульсов до 20 миллисекунд (что в пять раз короче, чем у обычных систем).
Каковы преимущества метода PASCAL?
Система фотокоагуляции PASCAL придерживается стандартных протоколов. Обосновано на основании клинических исследований.
Производительность: максимальная эффективность. Сокращение времени лечения.
Повышенный комфорт для пациента: существенно более комфортный терапевтический опыт.
Повышенная точность: лечение макулярной сетки с использованием дозиметрического контроля обеспечивает точность и безопасность импульсов.
Воспроизводимость: предсказуемый размер импульсов в воздействие на сетчатку приводит к более точные соблюдения протоколов лечения сетчатки.
Каковы клинические показания для применения Системы фотокоагуляции PASCAL ?
Система фотокоагуляции PASCAL является лучшим выбором для лечения глазных болезней и использование фотокоагуляции передних и задних сегментов глаза, включая:
Опыт применения паттерной лазерной коагуляции (Паскаль) у детей с периферическими дистрофиями сетчатки
В последние годы отмечена устойчивая тенденция к увеличению распространенности периферических дистрофий сетчатки в детском и подростковом возрасте, в особенности при прогрессирующей миопии высокой степени [1, 4, 5].
По данным статистических исследований, частота различных видов периферических дистрофий у детей школьного возраста достигает 56%, при этом «пик накопления» периферических дистрофий соответствует среднему возрасту 11-13 лет, что указывает на актуальность раннего выявления и проведения адекватных лечебно-профилактических мероприятий в данной возрастной группе [1, 3].
Своевременное выполнение ограничительной лазерной коагуляции является общепризнанным эффективным методом профилактики отслойки сетчатки у детей с периферическими витреохориоретинальными дистрофиями [2, 4].
В этой связи представляет научный и практический интерес возможность использования при данной патологии инновационной технологии лазерной коагуляции ПАСКАЛЬ, основанной на полуавтоматизированном методе сканирующей паттерной генерации ультракоротких лазерных импульсов, успешно применяемой в детской офтальмологии в лечении активных стадий ретинопатии недоношенных [6].
Оценка эффективности сканирующей паттерной лазеркоагуляции сетчатки (ЛКС) у детей с периферическими витреохориоретинальными дистрофиями (ПВХРД) в сравнении со стандартной методикой лазерного лечения.
Материал и методы
Под наблюдением находилось 86 детей (167 глаз) с периферическими витреохориоретинальными дистрофиями сетчатки в возрасте от 7 до 17 лет (средний возраст 13,6±0,25 лет) (рис.1). Все дети были обследованы по общепринятым методикам, включая обязательное исследование глазного дна с контактной 3-зеркальной линзой Гольдмана, цифровую ретиноскопию на ретинальной камере «Retcam-3» (Clarity medical systems, США) в условиях максимального медикаментозного мидриаза.
Показанием для проведения ограничительной коагуляции являлись витреоретинальные формы периферических дистрофий с наличием витреоретинальных сращений по краю зоны дистрофии, определяемых при биомикроскопии с контактной линзой Гольдмана.
Преимущественно выявлялась дистрофия «след улитки» - на 92 глазах (55,1%); «решетчатая» дистрофия - 52 (31,1%), на 16 глазах (9,6%) имела место смешанная форма дистрофии и в 7 случаях (4,2%) - изолированные разрывы сетчатки (рис. 2).
Миопия высокой степени была выявлена на 64 глазах (38,3%), миопия средней степени - на 50 глазах (29,9%), миопия слабой степени - на 47 глазах (28,2%). В 2-х случаях (1,2%) определялась гиперметропия слабой степени, а в 4 (2,4%) - эмметропическая рефракция. Средний сфероэквивалент - -5,2±0,25 Д.
Все дети были разделены на две сопоставимые (по возрасту, рефракции и видам дистрофий) группы в зависимости от применяемой методики лазерной коагуляции сетчатки (ЛКС).
Техническими условиями для проведения коагуляции являлись наличие максимального медикаментозного мидриаза, достаточная прозрачность оптических сред, отсутствие выраженной светобоязни и четкая фиксация взора.
В основной группе (42 ребенка, 82 глаза) периферическая ЛКС выполнялась на лазерной установке Pascal Photocoagulator «Optimedica» (США) в полуавтоматическом сканирующем режиме с использованием различных паттернов (шаблонов) (рис. 3).
В зависимости от вида и формы дистрофии (разрыва сетчатки) использовались «матричные» (квадратная решетка с количество точек - 3х3, 2х2) либо «аркуатные» (дугообразные) паттерны (рис. 4).
Позиционирование паттернов осуществлялось в интервале не менее 1 диаметра коагулята от зоны дистрофии. Плотность лазерной коагуляции (интервал между коагулятами) варьировала в зависимости от вида дистрофии и наличия разрывов сетчатки (от 1,5 до 2 диаметра коагулята). Параметры излучения: мощность - 175-250 мВт, экспозиция - 0,02 сек, диаметр лазерного пятна - 200 мкм.
В контрольной группе (44 ребенка, 85 глаз) проводилась стандартная периферическая ЛКС в режиме одиночного импульса на лазерной установке «Zeiss-532s» (Германия). Используемые параметры излучения: мощность 100-150 мВт, время экспозиции - 0,1 сек, диаметр коагулята - 200 мкм.
Результаты и обсуждение
В ходе выполнения лазеркоагуляции в обеих группах ни в одном случае осложнений не наблюдалось. В раннем послеоперационном периоде (на 1-е сутки после ЛКС) у всех пациентов отмечался незначительный перифокальный отек лазерных коагулятов, более выраженный в контрольной группе. На 3-е сутки на 49 глазах (59%) в основной группе и на 23 глазах (27%) в контрольной группе отмечалась начальная пигментация коагулятов.
При осмотре на 10-е сутки после операции на всех глазах обеих групп определялась умеренная пигментация коагулятов. На контрольном осмотре через 3 месяца грубой хориоретинальной атрофии не выявлено, лазеркоагуляты с умеренно выраженной пигментацией на всех оперированных глазах (рис. 5а-в).
В сравнительном аспекте следует отметить однородность получаемых лазерных коагулятов при использовании паттерной технологии и отсутствие «конфлюентной» хориоретинальной атрофии в поздние сроки наблюдения (от 3 месяцев до 1 года).
Несомненными преимуществами паттерной лазеркоагуляции являются: высокая скорость нанесения лазерных аппликаций, однородность получаемых лазерных коагулятов, строгое соблюдение интервала между коагулятами.
Оценка переносимости лазерной процедуры у детей проводилась по анкетам «Faces Scale» (Wong-Baker, 2009), модифицированных нами применительно к офтальмологии, в которых дети отмечали свои субъективные болевые ощущения после проведения лазерной операции (рис. 6). Представленная рейтинговая шкала оптимальна для использования у детей в возрасте от 3-х лет и старше. Каждой картинке в анкете соответствует определенное количество баллов. При заполнении анкеты ребенок указывает на картинку, которая соответствует его субъективным болевым ощущениям.
На основании полученной суммы баллов оценивалась степень интенсивности болевых ощущений. В результате при проведении паттерной коагуляции практически в половине случае значимые болевые ощущения отсутствовали. И только в 4% случаев отмечались болевые ощущения, при которых потребовалось изменение энергетических параметров лазерного воздействия (рис. 7).
Анализ временных параметров лазерной коагуляции показал значительное уменьшение средней продолжительности лазерной операции с использованием технологии паттерной сканирующей ЛК в сравнении со стандартной методикой коагуляции в режиме одиночного импульса (более чем в 2 раза) (табл.).
Повторная коагуляция в связи с появлением новых очагов дистрофии потребовалась 1 пациенту из основной группы и 2 пациентам из контрольной группы. В сроки наблюдения до 1 года отслойка сетчатки не диагностирована ни у одного пациента.
Метод полуавтоматизированной сканирующей паттерной коагуляции сетчатки (Паскаль) наиболее оптимален для выполнения профилактической лазеркоагуляции при периферических дистрофиях сетчатки у детей. Данная технология характеризуется более прогнозируемым клиническим ответом на лазерное воздействие, позволяет сократить длительность лазерной процедуры, обладает меньшей болезненностью, что обеспечивает лучшую переносимость лазерного лечения у пациентов детского возраста.
Система PASCAL - PatternSCAnLaser для лазерной фотокоагуляции. Возможности
ООО "Центр "Зрение"
Южно-Уральский государственный медицинский университет
Кафедра офтальмологии Военно-медицинской академии им. С.М. Кирова, Санкт-Петербург
ФГБОУ ВО «Челябинский государственный университет», Челябинск, Россия
ГБУЗ «Многопрофильный центр лазерной медицины» Минздрава Челябинской области, Челябинск, Россия
ООО «ЦЕНТР ЗРЕНИЯ», Челябинск, Россия
ГБУЗ «Областная клиническая больница № 3», Челябинск, Россия
ФГБНУ «НИИ глазных болезней»
Отдаленные результаты профилактического лазерного лечения тракционных симптоматических клапанных разрывов сетчатки
Журнал: Вестник офтальмологии. 2020;136(3): 32‑38
Тракционные клапанные разрывы являются главной причиной развития регматогенной отслойки сетчатки (РОС), и основным незамедлительным методом для ее лечения остается лазерная коагуляция. Цель исследования — динамическое наблюдение за состоянием тракционных симптоматических клапанных разрывов после лазерного лечения. Материал и методы. Под нашим наблюдением с 2014 по 2019 г. находились 119 пациентов (130 глаз) с периферическими клапанными (подковообразными) разрывами сетчатки на фоне острой задней отслойки стекловидного тела. Лазерную коагуляцию проводили с помощью установок Navilas 577s (577 нм), OcuLight GL (532 нм), лазерную ретинотомию клапанов подковообразных разрывов и рассечение нависающих сосудов выполняли с использованием Nd: YAG-лазера Ultra Q Reflex (1064 нм) под ОКТ-контролем RTVue XR Avanti. Результаты. При первичном обращении пациентов с симптоматическими клапанными разрывами до проведения профилактической лазерной коагуляции были выявлены: регматогенная отслойка сетчатки (РОС) — 8 (6,2%) глаз, частичный гемофтальм — 29 (22,3%), преретинальное кровоизлияние — 15 (11,5%), эпиретинальная мембрана — 9 (6,9%), несквозной макулярный разрыв сетчатки — 6 (4,6%), периферические изменения: дырчатый разрыв — 16 (12,3%), разрыв с «крышечкой» — 5 (3,8%), дегенерации сетчатки — 40 (30,8%) глаз. Наблюдение в течение 5 лет после лазерной ретинопексии выявило новые патологические изменения: клапанные разрывы — 13 (10,6%); дырчатые разрывы — 9 (7,4%); разрывы с «крышечкой» — 5 (4,1%); витреоретинальный пучок — 6 (4,9%); РОС в 3 (2,5%) случаях. У 16 пациентов (16 глаз) с подковообразным разрывом, выраженной витреоретинальной тракцией проведена ретинотомия клапана, которая устранила тракционный компонент и предупредила развитие РОС. Заключение. Динамическое наблюдение в течение 5 лет после проведения профилактической лазерной ретинопексии симп-томатических тракционных клапанных разрывов выявило РОС в 2,5% случаев. Лазерная ретинотомия клапана подковообразного разрыва после барьерной ретинопексии устраняет тракционный компонент и может способствовать профилактике развития РОС.
Важной причиной снижения зрения и слепоты во всем мире является регматогенная отслойка сетчатки (РОС) [1, 2], к развитию которой приводят тракционные клапанные (подковообразные) разрывы. В связи с этим лазерная коагуляция сетчатки остается основным незамедлительным методом лечения данной патологии [3—6].
Цель профилактической лазерной фотокоагуляции разрывов сетчатки — создание плотной хориоретинальной спайки, полностью окружающей разрыв сетчатки, для противодействия витреоретинальной тракции и предотвращения прохождения жидкой фракции стекловидного тела в субретинальное пространство с образованием отслоения сетчатки [2, 7, 8].
Профилактическое лечение рекомендуется всем больным с симптоматическими клапанными разрывами, но даже после профилактического лечения устойчивая тракция стекловидного тела может стать причиной развития новых разрывов (7,3—14%) [9] и РОС [6, 8, 10—12]. По данным литературы, частота РОС в нелеченых глазах c клапанными разрывами составляет 52—85% [5, 13], а частота регматогенной отслойки сетчатки после проведения профилактического лазерного лечения — 1,4—8,8% [9, 14—18]. В связи с этим для оценки состояния витреоретинального интерфейса периферических разрывов и дегенеративных изменений сетчатки, выявления характера витреоретинальных тракций до лазерного лечения, определения состоятельности витреоретинальных сращений после лазерной ретинопексии, необходимости дополнительной лазерной коагуляции рекомендуется широко внедрять в клиническую практику оптическую когерентную томографию (ОКТ) для исследования периферии сетчатки [8, 19, 20].
Цель работы — динамическое наблюдение за состоянием тракционных симптоматических клапанных разрывов после лазерного лечения.
Материал и методы
Под нашим наблюдением с 2014 по 2019 г. находились 119 пациентов (130 глаз) с периферическими клапанными (подковообразными) разрывами сетчатки на фоне острой задней отслойки стекловидного тела. Мужчин — 39 (32,8%), женщин — 80 (67,2%), средний возраст пациентов 58,29±11,8 года.
Исследование рефракции выявило в большинстве случаев миопию в 83 (63,8%) глазах: слабой степени — 32, средней степени — 26, высокой степени — 25; реже — гиперметропию — 25 (19,2%) глаз: слабой степени — 24, средней степени — 1; эмметропию — 22 (16,9%) глаза. Артифакия отмечена на 22 глазах (16,9%).
Обследование пациентов при первичном обращении и в динамике было не только традиционное, но и включало дополнительно спектральную ОКТ с использованием томографа RTVue XR Avanti (Optovue, США) по методу, описанному нами ранее [8], фоторегистрацию с применением фундус-камеры VISUCAM 500 («Zeiss», Германия), ультрасонографию (В-scan plus Accutome, США; Toshiba Aplio 300, Япония). Лазерную коагуляцию проводили с помощью лазерных систем Navilas 577s — длина волны 577 нм (OD-OS, Германия), OcuLight GL — длина волны 532 нм, (IRIDEX, США), лазерную ретинотомию клапанов подковообразных разрывов и лазерное рассечение нависающих сосудов выполняли посредством YAG-лазерной системы Ultra Q-Reflex — длина волны 1064 нм («Ellex», Австралия) после предварительной лазерной коагуляции места рассечения сосуда лазером OcuLight GL.
Описательный статистический анализ (определение среднего, стандартного отклонения, частот) и визуальное представление данных осуществляли с помощью программ Excel 2010 («Microsoft», США) и Statistica 6.0 («Statsoft», США).
Результаты
Результаты исследования 130 глаз при первичном обращении с симптоматическими периферическими клапанными разрывами на фоне острой задней отслойки стекловидного тела (без проведения профилактической лазерной коагуляции) выявило следующую патологию: РОС — 8 (6,2%) глаз, частичный гемофтальм — 29 (22,3%), преретинальное кровоизлияние — 15 (11,5%), эпиретинальная мембрана — 9 (6,9%), несквозной макулярный разрыв сетчатки — 6 (4,6%), периферический дырчатый разрыв — 16 (12,3%), периферический разрыв с «крышечкой» — 5 (3,8%), периферические дегенерации сетчатки — 40 (30,8%) глаз. Среди периферических дегенераций выявлены преимущественно решетчатая — 21, реже — витреоретинальный пучок — 5, кистовидная дегенерация — 4, «булыжная мостовая» — 3, «след улитки» — 2, инееподобная дегенерация — 2, плоский ретиношизис — 2, периферические друзы — 1 глаз.
Чаще всего клапанные разрывы наблюдались в верхненаружном сегменте — 59 (45,4%) глаз (рис. 1), реже — верхневнутреннем — 19 (14,6%), в нижненаружном — 14 (10,8%), нижневнутреннем — 6 (4,6%), в верхнем и наружном по 13 (10%), нижнем — 5 (3,8%), внутреннем сегментах — 1 (0,8%) глазного дна. Периферические тракционные клапанные разрывы в большинстве случаев были изолированными в 113 (86,9%) глазах, реже — на фоне решетчатой дистрофии в 17 (13,1%) глазах; в 8 (6,2%) глазах клапанные разрывы были множественными (от 2 до 5). В 74 (56,9%) глазах с симптоматическими клапанными разрывами была отмечена полная отслойка задней гиалоидной мембраны с наличием кольца Вейса.
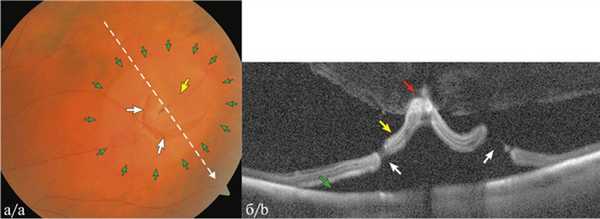
Рис. 1. Клапанный разрыв с субклинической отслойкой сетчатки у пациента Г.
а — цветная фотография: тракционный разрыв (указан белыми стрелками) с клапаном (указан желтой стрелкой) с субклинической отслойкой сетчатки вокруг разрыва (указан зелеными стрелками); белая пунктирная стрелка указывает направление кросс-секционного сканирования; б — соответствующий ОКТ-скан в режиме Enhanced HD Line (RTVue XR Avanti) ретинального разрыва (указан белыми стрелками), клапан (указан желтой стрелкой) с выраженной тракцией стекловидного тела (указано красной стрелкой), отслойка нейросенсорной сетчатки (НС) (показана зеленой стрелкой).
Пациенты с РОС, выявленной при первичном обращении, были направлены в офтальмологический стационар для проведения оперативного лечения. Профилактическая барьерная лазерная коагуляция клапанных разрывов сетчатки выполнена на 122 (93,8%) глазах контактным и бесконтактным методами. Бесконтактным методом лазерную ретинопексию провели 15 пациентам (15 глаз) с помощью лазерной системы Navilas 577s (без анестезии и контактного геля) в связи с аллергической реакцией: на анестетики, контактные гели, а также при наличии синдрома сухого глаза. Бесконтактную лазерную коагуляцию (ЛК) сетчатки с помощью бесконтактного объектива PRP проводили по традиционной технологии: лазерные коагуляты наносили в три ряда и более, располагая их слитно по отношению друг к другу по всей границе клапанного разрыва (рис. 2), интенсивность соответствовала II—III степени по L’Esperance [21]. Контроль за качеством выполнения ЛК осуществляли посредством ОКТ-сканирования лазерных коагулятов [8, 19, 20].
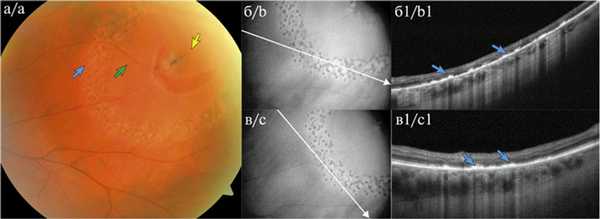
Рис. 2. Клапанный разрыв с субклинической отслойкой сетчатки после лазерной ретинопексии через 2 нед у пациента Г.
а — цветная фотография клапанного разрыва (указан желтой стрелкой), зеленой стрелкой указана область субклинической отслойки, синей — плотный барьер лазерных коагулятов (навигационная лазерная система Navilas 577s); б, в — снимки инфракрасной камерой (ИК) наведения спектрального ОКТ RTVue XR Avanti, белой стрелкой указано направление сканирования вдоль лазерных коагулятов; б1, в1 — соответствующие линейные ОКТ-сканы: видны посткоагуляционные хориоретинальные спайки через 2 нед после ретинопексии (указаны синими стрелками).
Наблюдение за состоянием сетчатки в динамике осуществляли через 2 нед, 6 мес, затем ежегодно после лазерной ретинопексии. За период наблюдения выявлены новые патологические изменения: клапанные разрывы — 13 (10,6%); дырчатые разрывы — 9 (7,4%); разрывы с «крышечкой» — 5 (4,1%); витреоретинальный пучок — 6 (4,9%); РОС в 3 (2,5%) случаях (через 1, 6 и 18 мес соответственно). Анализ ОКТ-сканов развития отслойки сетчатки после лазерной коагуляции показал, что основной причиной РОС явилась выраженная витреоретинальная тракция (рис. 3) в виде тяжа, фиксированного к клапану подковообразного разрыва, что в свою очередь во время прогрессирующего развития аномальной задней отслойки стекловидного тела провоцировало прорыв субретинальной жидкости через зону лазерных коагулятов с развитием последующей отслойки сетчатки у основания клапанного разрыва [19]. В связи с этим у 16 пациентов (16 глаз) с клапанным разрывом, с выраженной витреоретинальной тракцией и угрозой РОС проводили профилактическую отграничивающую лазерную коагуляцию сетчатки, затем через 2 нед выполняли лазерную ретинотомию тракционного клапана, при необходимости с предварительным рассечением сосудов, нависающих над разрывом. Ретинотомию тракционного клапана проводили у основания витреоретинальной тракции для перевода клапанного разрыва в дырчатый. Наблюдение и лазерную ретинотомию проводили под ОКТ-контролем периферии сетчатки (рис. 4).
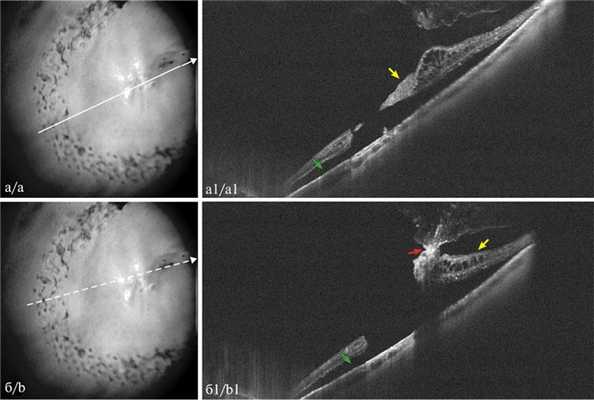
Рис. 3. Определение локализации витреоретинальной тракции клапанного разрыва посредством ОКТ у пациента Г.
а — снимок ИК камерой наведения ОКТ с направлением линии сканирования (указана белой стрелкой) по краю клапана тракционного разрыва; a1 — соответствующий ОКТ-скан линии сканирования: клапан (указан желтой стрелкой), отслойка НС (указана зеленой стрелкой); б — снимок ИК камерой наведения ОКТ с направлением линии сканирования по пигментированному участку центра клапана (указан белой пунктирной стрелкой); б1 — соответствующий линейный скан: выраженная витреоретинальная тракция (указана красной стрелкой) на верхушке клапана (указан желтой стрелкой).
Рис. 4. Результат ОКТ тракционного разрыва до лечения (а) и после лазерной ретинотомии клапана (б) у пациента С.
а — линейный ОКТ-скан тракционного разрыва: клапан (указан желтой стрелкой) с витреоретинальной тракцией (указана красными стрелками), белой пунктирной стрелкой показано направление лазерной ретинотомии клапана посредством YAG-лазера (Q — Reflex); б — ОКТ дырчатого разрыва после ретинотомии клапана: остатки иссеченного клапана (указан желтой стрелкой) с адгезией к стекловидному телу (указано красной стрелкой) расположены над дырчатым разрывом.
Таким образом, комплексное лечение осложненных клапанных разрывов осуществляли в три этапа: плотная барьерная лазерная коагуляция до 5 рядов вокруг разрыва, лазерное иссечение при наличии нависающего сосуда, лазерная ретинотомия клапана; при этом каждый этап проводили под ОКТ-контролем. Результаты наблюдения показали положительную динамику и отсутствие развития РОС.
Периферические тракционные разрывы сетчатки остаются основной причиной развития РОС, в связи с этим необходимость раннего выявления разрывов сетчатки является чрезвычайно актуальной проблемой [6, 9, 22]. По мнению ряда авторов, изолированные клапанные разрывы возникают вследствие витреоретинального пучка, аномальной витреоретинальной адгезии, которые могут привести к острым тракционным разрывам сетчатки во время острой задней отслойки стекловидного тела [23, 24].
По данным литературы, для профилактики развития отслойки сетчатки при наличии тракционных клапанных разрывов рекомендуют лазерную ретинопексию проводить в 3—5 слитых рядов коагулятов, расположенных близко друг к другу и полностью окружающих разрыв, для создания области плотной хориоретинальной адгезии [2, 6, 25]. Это лечение имеет особенно большое значение при симптоматическом характере течения клапанных разрывов, с фотопсиями и плавающими помутнениями, так как такие разрывы могут быть связаны с высокой вероятностью развития отслойки сетчатки [10, 11].
По данным D. Brinton и соавт. (2009), эффективность профилактического лечения зависит от относительного риска образования отслойки до и после лечения, наличия фактора прогрессирования заболевания: если отслойка сетчатки происходит в течение нескольких дней после профилактического лечения, то можно говорить о том, что лечение вызывает отслойку; если отслойка развивается через несколько недель, вероятнее всего это результат продолжающейся прогрессирующей природы основного витреоретинального заболевания, и ее не следует рассматривать как ятрогенное осложнение [6]. В связи с этим применение метода ОКТ для диагностики состояния периферии сетчатки имеет важное значение [7, 8, 19, 20].
В нашем исследовании частота возникновения РОС после проведения профилактического лечения составила 2,5%, что совпадает с данными литературы (1,4—8,8%) [9, 14—18].
По данным большинства авторов, существуют три основные причины развития РОС [26], возникающей несмотря на профилактическую лазерную ретинопексию:
ФГБНУ «Научно-исследовательский институт глазных болезней»
Показания к применению лазерной коагуляции сетчатки в лечении ретиношизиса и регматогенной отслойки сетчатки
Журнал: Вестник офтальмологии. 2020;136(6): 50‑56
ЦЕЛЬ ИССЛЕДОВАНИЯ
Определить показания и оценить эффективность лазерной коагуляции сетчатки (ЛКС) после различных видов хирургического лечения отслойки сетчатки (ОС), кроме витрэктомии.
МАТЕРИАЛ И МЕТОДЫ
Под наблюдением находилось 160 пациентов (165 глаз) с различными видами ОС и ретиношизиса, период наблюдения составил 11 лет.
РЕЗУЛЬТАТЫ
При наличии разрыва с незначительной локальной ОС (менее одного квадранта) мы рекомендуем применять ЛКС в качестве монотерапии. Таким пациентам показано регулярное наблюдение (1, 3, 6 мес, 1 год). В связи с риском возникновения тракционных дефектов сетчатки в нижних квадрантах во время введения газовоздушной смеси в полость стекловидного тела при патологии сетчатки рекомендуется проводить ЛКС до этапа пневморетинопексии. При наличии больших разрывов, несмотря на их верхнюю локализацию, проведение пневморетинопексии не показано из-за возможности попадания газа за края разрыва — под сетчатку, приводящего к увеличению исходного размера разрыва и распространению ОС. Нами отмечена эффективность ЛКС в виде монотерапии при ОС различной локализации. После склеропломбирования мы считаем необходимым проведение ЛКС по пломбе на валу, отграничивающей разрыв по краю, так как с течением времени пломба может сместиться, вызвав рецидив ОС.
Заключение. Результаты исследования подтвердили эффективность лазерной коагуляции сетчатки как самостоятельного метода лечения ретиношизиса и разрывов сетчатки с локальным отслоением.
Дата принятия в печать:
Лазерная коагуляция сетчатки (ЛКС) — современный и востребованный метод лечения патологии сетчатки, однако на данный момент ЛКС чаще рассматривают как вспомогательный метод, дополняющий основное хирургическое вмешательство [1—7]. На наш взгляд, своевременно выполненная коагуляция сетчатки на ранних стадиях развития отслойки сетчатки (ОС) не уступает по эффективности традиционным хирургическим методам. Некоторые авторы утверждают, что ЛКС способствует лучшим результатам хирургического лечения после применения склерального пломбирования и пневморетинопексии [1, 8—10]. Единого метода лечения ОС не существует [11, 12], и тактика лечения во многом зависит от места локализации, занимаемой площади, размера и формы разрыва. ЛКС является неотъемлемой частью хирургии отслоек сетчатки, выступая при этом в качестве основного метода лечения ретиношизиса и локальной отслойки сетчатки [1, 12—14].
Хотя на сегодняшний день отсутствуют явные показания к ЛКС как самостоятельному методу лечения при разрывах сетчатки с ее локальной отслойкой, цель работы — определить эти показания и оценить эффективность ЛКС после различных видов хирургического лечения ОС, кроме витрэктомии. Пациенты, которым была выполнена витрэктомия, в данное исследование включены не были, а данный метод лечения будет нами подробно освещен в следующих статьях.
Под наблюдением находилось 160 пациентов (165 глаз) с различными видами ОС и ретиношизиса, период наблюдения составил 11 лет. Все пациенты были разделены на пять групп.
В 1-ю группу вошли пациенты, которым было выполнено пломбирование (секторальное либо циркулярное) совместно с отграничительной ЛКС (рис. 1, а, б). Группу составил 41 пациент (41 глаз). Сюда не вошли пациенты с разрывами, локализованными в верхнем секторе. При распространении субретинальной жидкости в межаркадную зону (без вовлечения макулы) проводили ЛКС по границе отслоенной сетчатки как подготовку к оперативному вмешательству. Далее ЛКС проводили после пломбирования по краю разрыва на валу.
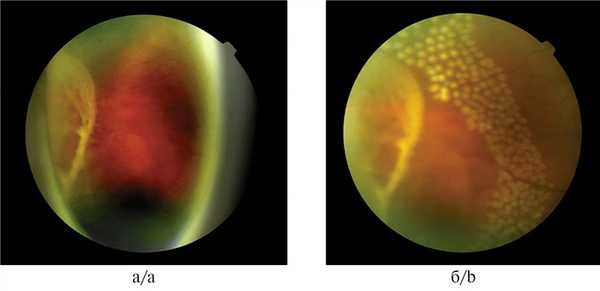
Рис. 1. Результат склеропломбирования с последующей ЛКС разрыва на пломбе.
а — разрыв с ОС до этапа оперативного вмешательства; б — состояние после выполненного пломбирования и отграничительной коагуляции сетчатки.
Во 2-й группе 24 пациентам (24 глаза) с периферической хориоретинальной дистрофией в нижних отделах была выполнена пневморетинопексия совместно с отграничительной ЛКС. Разрывы, приведшие к ОС, у пациентов этой группы были локализованы преимущественно в верхних квадрантах, при этом граница отслоенной сетчатки была выше верхней височной сосудистой аркады. Данную группу мы разделили на две подгруппы, по 12 человек (12 глаз) в каждой. В 1-й подгруппе всем пациентам провели профилактическую отграничительную ЛКС в нижних квадрантах, во 2-й подгруппе ее не проводили.
В 3-ю группу вошли 19 пациентов (24 глаза) с прогрессирующим ретиношизисом с разрывом во внутреннем листке (рис. 2, а, б; 3, а, б). Пациентам данной группы была выполнена только отграничительная ЛКС без дополнительных хирургических вмешательств.
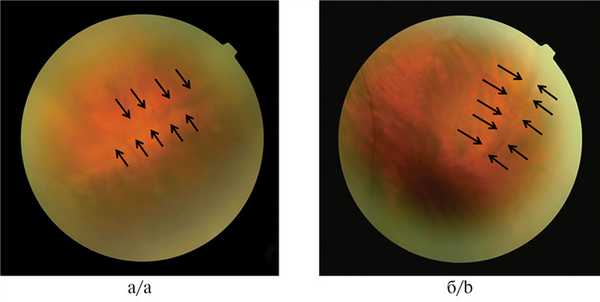
Рис. 2. Изображение разрывов во внутреннем листке ретиношизиса.
Стрелками указаны границы ретиношизиса.
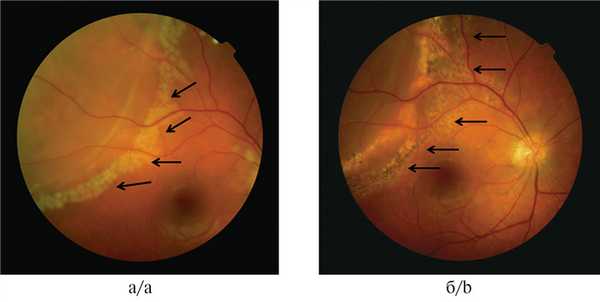
Рис. 3. Изображение прогрессирующего ретиношизиса с разрывом в верхненаружном квадранте.
а — ЛКС в виде монотерапии неэффективна. Выполнена дополнительная лазерная коагуляция по новой границе ретиношизиса с пневморетинопексией и последующей ЛКС разрыва; б — дополнительная ЛКС по новой границе ретиношизиса проведена с целью профилактики смещения уровня ретиношизиса в макулярную зону при введении газа в полость стекловидного тела. Стрелками обозначены следы поэтапной ЛКС.
В 4-й группе у 26 человек (26 глаз) были выполнены пневморетинопексия, пломбирование и отграничительная ЛКС. Разрывы у пациентов данной группы были локализованы в верхних квадрантах сетчатки (рис. 4, а—в).
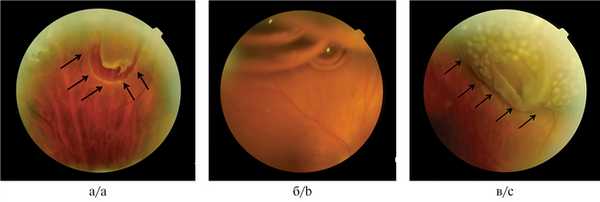
Рис. 4. Состояние после склеропломбирования и пневморетинопексии с последующей ЛКС разрыва на валу.
а — свежий клапанный разрыв; б — пневморетинопексия (пузырь газовоздушной смеси в полости стекловидного тела); в — склеропломбирование с последующей ЛКС на валу. Стрелками указаны края разрыва с ОС.
5-ю группу составили 50 пациентов (50 глаз) с локальной ОС, которые также были разделены на две подгруппы: в 1-ю (20 пациентов — 20 глаз) вошли пациенты с ОС, занимающей два квадранта, при этом с верхней локализацией — 8 пациентов (8 глаз, 40%), с нижней — 12 пациентов (12 глаз, 60%), в то время как во 2-ю были включены 30 пациентов (30 глаз) с ОС, занимающими один квадрант, из них у 11 пациентов (11 глаз, 37%) — верхняя локализация, а у 19 пациентов (19 глаз, 63%) — нижняя (рис. 5, а, б). Пациентам 5-й группы выполнили отграничительную ЛКС в качестве монотерапии (рис. 6, а, б).
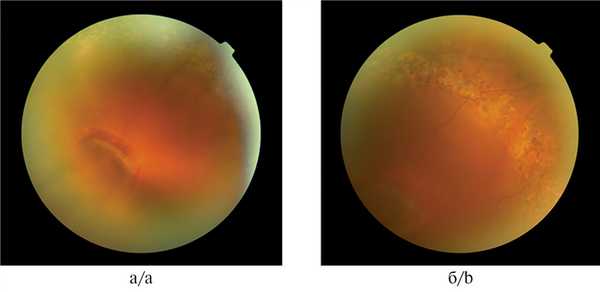
Рис. 5. Результат отграничительной ЛКС клапанного разрыва с ОС.
а — клапанный разрыв в нижненаружном квадранте с ОС, занимающей весь квадрант; б — состояние после ЛКС по границе ОС. Период наблюдения — 6 лет.
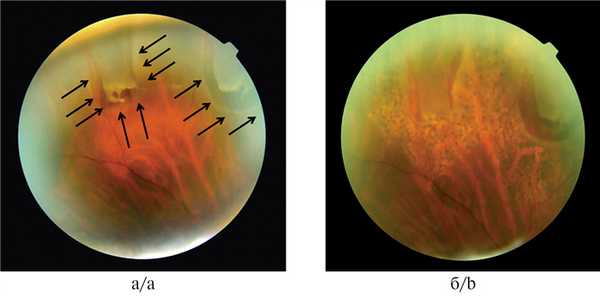
Рис. 6. Изображение свежих крупных клапанных разрывов в верхних квадрантах.
а — до; б — после отграничительной ЛКС. Стрелками указаны края разрыва.
Лазерную коагуляцию сетчатки проводили диодным лазером с длиной волны 0,81 мкм с помощью отечественной лазерной установки «LAHTA» фирмы «Милон». Для биомикроскопического контроля во время операции использовали трехзеркальную линзу Гольдмана. Параметры излучения: диаметр пятна 150—200 мкм, мощность излучения от 300 до 1700 мВт (выбор мощности зависел от интенсивности пигментации глазного дна, помутнения в оптических средах, а также присутствия газовоздушной смеси в полости глазного яблока), добивались при этом получения желтого коагулята, соответствующего 2—3-й степени по классификации L’Esperance.
Пломбирование было стандартным: обрабатывали операционное поле, разрезали конъюнктиву, прямые мышцы брали на уздечные швы. Разрывы локализовали силиконовой губчатой пломбой, офтальмоскопически убеждались в правильном контакте с разрывом и фиксировали пломбу, ушивали зоны хирургического вмешательства.
Пневморетинопексию проводили по стандартной методике: после обработки операционного поля через плоскую часть цилиарного тела, в 3,5 мм от лимба, в полость стекловидного тела вводили 0,5 мл перфторциклобутана (газ C2F6), далее производили пункцию передней камеры, удаляя при этом некоторое количество переднекамерной влаги до нормализации уровня внутриглазного давления (ВГД).
Всем пациентам был назначен постельный режим, в зависимости от локализации разрыва требовалось строгое соблюдение положения головы.
При частичном прилегании сетчатки после отграничительной ЛКС применяли поэтапную или наступательную лазерную коагуляцию, начиная с коагуляции в зоне между отслоенной и интактной сетчаткой. Коагуляцию проводили в шахматном порядке в 4—5 рядов. При этом коагуляты в первых рядах наносили значительно чаще и плотнее друг к другу, чем в остальных рядах. Затем пациенту назначали повторный постельный режим в течение 1—2 дней и проводили следующий этап лазерной коагуляции по новой границе отслоенной сетчатки. Таким образом, проводили наступательную ЛКС.
После ЛКС пациентам назначали антибактериальные и нестероидные противовоспалительные препараты в каплях в течение 1 нед. При необходимости проводили дополнительную отграничительную ЛКС.
В дальнейшем осмотр пациентов проводили через 3, 6 мес и 1 раз в год.
Результаты и обсуждение
У пациентов 1-й группы во всех случаях после ЛКС отмечали полное блокирование разрывов и зоны отслоения сетчатки. При распространении субретинальной жидкости (СРЖ) в межаркадную зону (без вовлечения макулы) в процессе склеропломбирования уровень СРЖ может сместиться в макулу. С целью профилактики распространения отслойки пациентам проводили барьерную ЛКС в два плотных ряда во избежание последующего фиброза макулы.
Всем пациентам этой группы после склеропломбирования проводили ЛКС по краю разрыва на валу. При невозможности полного блокирования разрыва по краю коагуляцию выполняли вдоль вала.
У 5 пациентов (12% случаев) в отдаленном периоде отмечено смещение пломбы с рецидивом ОС, что явилось основанием для профилактической лазерной коагуляции сетчатки по валу вдавления у тех пациентов, которым было выполнено склеропломбирование.
Во 2-й группе в одном случае не удалось достичь прилегания сетчатки в связи с большим размером разрыва.
Газовоздушная смесь попала за края разрыва, вследствие чего возникла необходимость проведения дополнительного пломбирования разрыва с последующей витрэктомией.
Отграничительную ЛКС проводили по стандартной методике. Пневморетинопексия нами выполнялась реже, чем другие вмешательства, в первую очередь это связано с быстрым прогрессированием верхних ОС и поздним обращением пациентов.
В нашей практике при проведении пневморетинопексии частым осложнением были нижние разрывы сетчатки вследствие перераспределения силы натяжения (тракции). Это объясняется отсутствием тотальной отслойки стекловидного тела.
В 1-й подгруппе 2-й группы, пациентам которой проводили профилактическую ЛКС в нижних квадрантах, не отмечено ни одного случая разрыва как результата введения газовоздушной смеси. В то время как во 2-й подгруппе 2-й группы в трех случаях из двенадцати (25%) возникли разрывы в нижних квадрантах.
В связи с этим было принято решение провести профилактическую ЛКС в нижних квадрантах до этапа введения газа на глазах с имеющимися периферическими витреохориоретинальными очагами.
В 3-й группе пациентов удалось блокировать прогрессирование ретиношизиса во всех случаях. У 5 пациентов (5 глаз) (26%) ретиношизис отступил к периферии от созданного барьера коагулятов. В этих случаях проводили наступательную ЛКС по новой границе ретиношизиса (рис. 7).
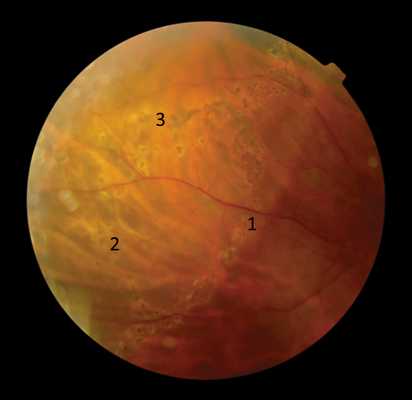
Рис. 7. Состояние после наступательной ЛКС при регрессе ретиношизиса.
Интервал между этапами ЛКС — 2 нед. Цифрами обозначены этапы наступательной коагуляции.
Данный метод лазерной коагуляции выполняли в несколько этапов: сначала проводили отграничительную лазерную коагуляцию по границе ретиношизиса в 3—4 ряда на расстоянии 0,5 диаметра коагулята в шахматном порядке. После процедуры пациенту рекомендовали постельный режим в течение 10 дней. У 6 пациентов (7 глаз) (32%) граница ретиношизиса отступила от созданного барьера на 0,5—1 диаметр диска зрительного нерва. Этим пациентам проводили второй сеанс ЛКС, что позволило зафиксировать новые границы ретиношизиса. Необходимость в третьем сеансе ЛКС возникла в двух случаях (2 глаза, 29%) из семи, где граница ретиношизиса отступила более чем на 2 диаметра диска зрительного нерва в течение 1-го месяца после проведения второго сеанса ЛКС.
В одном случае в отдаленном периоде (2 года) отмечено прогрессирование ретиношизиса за пределы созданного барьера в связи с выраженной тракцией стекловидного тела при его задней отслойке. В этом случае был создан новый состоятельный барьер лазерных коагулятов (период наблюдения 4 года).
В 4-й группе пациентов прилегания сетчатки удалось достичь во всех случаях. ЛКС проводили по стандартной методике.
В 1-й подгруппе 5-й группы у двух пациентов (2 глаза, 10%) с отслойкой сетчатки, занимающей два квадранта (оба верхних), отмечено прогрессирование ОС после ЛКС в течение 1-го месяца, что объясняется тем, что пациенты не соблюдали постельный режим и допускали чрезмерную физическую нагрузку. В связи с этим была выполнена эффективная отграничительная ЛКС по новой границе ОС (период наблюдения составил 5 лет).
Во 2-й подгруппе у 30 пациентов в 100% случаев удалось отграничить зону локальной отслойки, добившись устойчивого результата (период наблюдения 10 лет). Такую ситуацию можно объяснить в том числе площадью поражения сетчатки (задействованных квадрантах), при этом, чем меньше занимаемая площадь отслойки сетчатки, тем эффективнее ЛКС в виде монотерапии.
Также ЛКС подвергались частично самоотграниченные отслойки сетчатки, при этом проводили коагуляцию на границе отслоенной и интактной сетчатки, где демаркация была несостоятельна (рис. 8). Эти пациенты не были включены в исследование в связи с отсутствием риска прогрессирования в большинстве случаев.
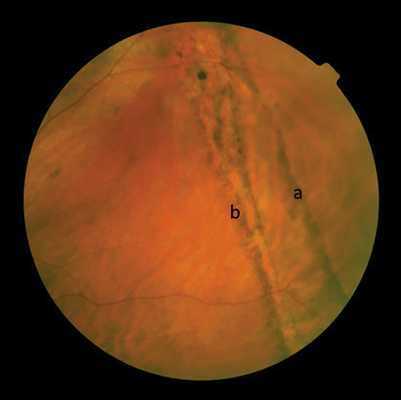
Рис. 8. Изображение ретиношизиса с демаркационными линиями.
а — с несостоятельной; б — с состоятельной.
Заключение
При наличии разрыва с незначительной локальной отслойкой сетчатки (менее одного квадранта) рекомендовано применять ЛКС в качестве монотерапии с последующим регулярным наблюдением (1, 3, 6 мес, 1 год). В связи с риском возникновения тракционных дефектов сетчатки в нижних квадрантах во время введения газовоздушной смеси в полость стекловидного тела при наличии патологии сетчатки рекомендуется проводить ЛКС до этапа пневморетинопексии. При наличии больших разрывов, несмотря на их верхнюю локализацию, проведение пневморетинопексии не показано в связи с возможностью попадания газа за края разрыва — под сетчатку, приводящего к увеличению исходного размера разрыва и распространению ОС. После проведения склеропломбирования необходимо проведение ЛКС по пломбе на валу вдавления, отграничивающей разрыв по краю, так как с течением времени пломба может сместиться, вызвав рецидив ОС.
Читайте также:
