Сканирующий электронный микроскоп. Фракционирование клеток.
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Органеллы и другие компоненты клеток и тканей можно выделить путем фракционирования клеток. Это — физический процесс, основанный на использовании центробежной силы для разделения органелл и клеточных компонентов в зависимости от их коэффициентов седиментации. Коэффициент седиментации (осаждения) частицы зависит от ее размера, формы и плотности, а также от вязкости среды. Органеллы, полученные этим методом, можно проанализировать на их чистоту, используя электронный микроскоп, а их химический состав и функции можно изучать in vitro.
Термины гистохимия и цитохимия используют для обозначения методов выявления веществ в срезах тканей. Для получения такой информации применяют ряд процедур, большей частью основанных на специфических химических реакциях или на высокоаффинных (с высоким сродством) взаимодействиях между макромолекулами. При использовании этих методов обычно получают нерастворимые окрашенные или электронно-плотные соединения, которые дают возможность обнаружения локализации определенных веществ посредством световой или электронной микроскопии.
Ионы. Ряд ионов (например, кальций, железо, фосфаты) выявляют в тканях с помощью этих методов при использовании химических реакций, дающих темный нерастворимый продукт.
Нуклеиновые кислоты. ДНК можно идентифицировать и оценить количественно в ядрах клеток с помощью реакции Фельгена, которая окрашивает ДНК в красный цвет. Определение ДНК и РНК можно также провести путем окрашивания клеток или срезов тканей основным красителем.
Белки. Хотя существуют общие методики выявления белков в срезах тканей, гистохимические методы обычно не позволяют идентифицировать конкретные белки в клетках и тканях. Этого результата позволяет достичь иммуноцитохимия, которая представлена в этой главе далее.
Фракционирование клеток дает возможность выделять клеточные компоненты путем дифференциального центрифугирования.
Рисунки справа показывают клеточные органеллы, находящиеся на дне каждой пробирки после центрифугирования.
Центробежная сила выражается в единицах g, которые эквивалентны силе гравитации. Кусочек ткани измельчают лезвиями бритв или ножницами и диссоциируют с помощью гомогенизатора или ультразвука (1).
Диссоциированную ткань оставляют примерно на 20 мин. Скопления клеток и волокна межклеточного вещества осаждаются на дно (2).
Супернатант центрифугируют при 1000 g в течение 20 мин. Осаждаются ядра (3). Супернатант центрифугируют при 10 000 g в течение 20 мин. Осаждаются митохондрии и лизосомы (4).
Супернатант центрифугируют при 105 000 g в течение 120 мин. Осаждаются микросомы (5).
Если супернатант сначала обрабатывают дезоксихолатом натрия, а потом центрифугируют при 105 000 g в течение 120 мин, микросомы диссоциируют и осаждаются отдельно в виде мембран гранулярной эндоплазматической сети (грЭПС) и рибосом (6). Три клеточные фракции, выделенные центрифугированием в градиенте плотности.
А — митохондриальная фракция, загрязненная микросомами.
Б — микросомальная фракция.
В — лизосомальная фракция.
Электронные микрофотографии. Большое увеличение. Кость после гистохимического выявления ионов кальция.
Темный осадок указывает на присутствие фосфата кальция в обызвествленной кости и хряще.
Необызвествленная ткань хряща (окрашенная в розовый цвет) находится в верхней части снимка.
Среднее увеличение. Почка крысы. Выявление фермента щелочной фосфатазы методом Гомори.
Участки, содержащие этот фермент, покрыты черным осадком (стрелки).
Среднее увеличение. Выявление кислой фосфатазы. В клетке почки крысы вблизи ядра (Я) обнаруживаются три лизосомы (Л).
Темный материал над лизосомами — фосфат свинца, который образовал осадок в участках расположения кислой фосфатазы.
Электронная микрофотография.
Ряд гистохимических методов можно использовать для того, чтобы выявить более или менее специфические ферменты, которые представляют собой большую группу белков. Эти методы (называемые гистоэнзимологическими) обычно основаны на способности ферментов воздействовать на специфические химические связи. Использование большинства гистоэнзимологических методов включает следующие этапы:
1) срезы ткани погружают в раствор, содержащий субстрат изучаемого фермента;
2) фермент воздействует на свой субстрат;
3) на этой или последующей стадии происходит взаимодействие среза с маркерным соединением;
4) это соединение реагирует с молекулой, которая получается в результате расщепления или изменения субстрата;
5) конечный продукт реакции, который должен быть нерастворимым и видным при использовании световой или электронной микроскопии, осаждается над участками, содержащими фермент. При изучении такого среза под микроскопом можно увидеть клетки (или органеллы), покрытые окрашенным или электронно-плотным материалом.
Ниже приведены примеры ферментов, которые можно выявить гистохимическими методами.
Фосфатазы — это ферменты, широко распространенные в организме. Они расщепляют связь между фосфатными группами и спиртовым остатком в фосфорилированных молекулах. Окрашенным нерастворимым продуктом реакции выявления фосфатаз обычно служит фосфат свинца или сульфид свинца. На срезах можно выявить щелочные фосфатазы, максимальная активность которых соответствует щелочным значениям рН. Кислую фосфатазу часто выявляют, поскольку она маркирует лизосомы — органеллы цитоплазмы, содержащие этот фермент.
Дегидрогеназы переносят водород с одного субстрата на другой. В организме существует много дегидрогеназ, которые играют важную роль в ряде обменных процессов. Дегидрогеназы выявляют гистохимически путем инкубации срезов нефиксированной ткани в растворе субстрата, содержащем молекулу, которая воспринимает водород и выпадает в осадок в виде нерастворимого окрашенного соединения. Этим методом в митохондриях можно выявить сукцинатдегидрогеназу — ключевой фермент цикла лимонной кислоты (цикла Кребса).
Пероксидаза, которая присутствует в клетках нескольких типов, — фермент, обеспечивающий окисление некоторых субстратов с переносом водородных ионов на перекись кислорода и образованием молекул воды. Для выявления пероксидазы срезы адекватно фиксированной ткани инкубируют в растворе, содержащем перекись водорода и 3,3'-диаминоазобензидин.
Последнее соединение окисляется в присутствии пероксидазы, давая нерастворимый, коричневый, электронно-плотный осадок, который дает возможность локализовать активность пероксиды на уровне световой и электронной микроскопии. Этим методом выявляют активность пероксидазы в клетках крови, которая имеет большое значение в диагностике лейкозов.
Поскольку пероксидаза чрезвычайно активна и за короткое время образует значительное количество нерастворимого осадка, она получила широкое распространение для практических целей — маркировки других соединений. Молекулы пероксидазы очищают, изолируют и связывают с другой молекулой.
Фракционирование клеток
С середины XX в. цитологи получили возможность исследовать не только целые клетки, но и отдельные органоиды, выделенные из клеток в жизнеспособном состоянии. Для этого используется метод фракционирования клеток, основанный на дифференциальном центрифугировании.
Для получения образцов органоидов фрагменты ткани разрушают таким образом, чтобы клеточные структуры остались неповрежденными. С этой целью подбирают подходящие условия гомогенизации, т. е. разрушения клеток, подходящую среду для выделения клеточных структур, буфер для поддержания определенного рН, в процессе выделения поддерживают низкую температуру, близкую к нулю. В результате получают суспензию клеточных органоидов, которая содержит ядра, митохондрии, лизосомы, аппарат Гольджи, фрагменты эндоплазматического ретикулума, рибосомы и обрывки клеточных мембран. Суспензию начинают центрифугировать на специальных приборах - центрифугах. Разные органоиды осаждаются на дно пробирки при разных скоростях центрифугирования. Скорость оседания зависит от размера частицы и ее плотности. При низких скоростях центрифугирования в первую очередь осаждаются ядра. Получив осадок ядер, оставшуюся суспензию переливают в другую пробирку для следующего этапа центрифугирования. Осадок, состоящий из клеточных ядер, размешивают и используют в экспериментальной работе. Так повторяют несколько раз, увеличивая скорость и продолжительность центрифугирования. Самые высокие скорости центрифугирования необходимы для получения самых маленьких органелл - рибосом. Ядра осаждаются на дно пробирки при центрифугировании в течение двух минут с ускорением 2000 g. Осадок митохондрий получают через 30 минут центрифугирования с ускорением 15 000 g, а рибосомы собирают через 3 часа центрифугирования с ускорением 40 000 g.
С помощью этого метода впервые в клетках были открыты лизосомы - небольшие вакуоли, содержащие гидролитические ферменты и выполняющие пищеварительные функции в клетках. После открытия лизосом методом фракционирования, их обнаружили на срезах клеток под световым и электронным микроскопом с помощью метода цитохимии, выявив работу специфических ферментов.
Возможность получения чистых фракций отдельных органоидов позволила изучить их химический состав, набор ферментов и, в конечном итоге, понять, как работает та или иная клеточная структура.
Вопросы
1. Что такое гомогенизация клеток?
2. Почему разные органоиды клетки при центрифугировании осаждаются на дно не одновременно?
3. Какие клеточные органоиды были открыты именно с помощью метода фракционирования клеток?
Метод авторадиографии
Метод авторадиографии используют для выяснения, в каких местах в клетке идет синтез тех или иных полимерных молекул, для изучения, куда переносятся синтезированные вещества. Иначе метод называют радиоавтографией. Он может использоваться применительно и к световой, и к электронной микроскопии. Метод позволяет обнаруживать в клетке биологические полимерные молекулы, меченые радиоактивными изотопами. Ядра радиоактивных изотопов нестабильны, подвергаются распаду, испуская заряженные частицы или ?-лучи. Экспериментатор регистрирует этот радиоактивный распад на фотопленке.
Обычно в кровь животному вводится мономер биополимера, в котором один из атомов водорода замещен на радиоактивный тритий. Например, в состав молекулы ДНК входит нуклеотид тимидин. В молекуле тимидина один из атомов водорода замещают на тритий. Тимидин, распространяясь с кровью, будет включаться в те клетки, где в данный момент идет репликация ДНК. На окрашенных срезах тканей можно будет выявить клетки, находящиеся в S-фазе клеточного цикла. Для этого на окрашенный срез в темноте наносят обычную фотоэмульсию, которая при хранении препаратов засвечивается под действием энергии, излучаемой изотопами. После проявления фотоэмульсии над клетками, находящимися в S-фазе клеточного цикла, появляются черные гранулы восстановленного серебра, образующиеся в фотоэмульсии.
Именно так в 60-е гг. XX в. было показано, что в составе нейронов головного мозга, в некоторых его отделах, возможна репликация ДНК. Но в то время было трудно представить, что в головном мозге млекопитающих присутствуют стволовые клетки, способные к делению. Тогда предположили, что репликация ДНК в нейронах головного мозга связана с процессом памяти.
Именно методом авторадиографии было показано, что ДНК всегда находится в ядре и никуда оттуда не выходит. РНК, напротив, синтезируется в ядре, а затем выходит в цитоплазму. Белок никогда не синтезируется в ядре. Место синтеза белка - рибосомы цитоплазмы. Отсюда белок может перемещаться и в ядро, и внутрь органелл цитоплазмы.
В заключение следует отметить, что каждый метод имеет свои преимущества и недостатки. Исследователь должен использовать несколько взаимодополняющих методов, чтобы сделать окончательный вывод.
Сканирующий электронный микроскоп. Фракционирование клеток.
Трансмиссионная и сканирующая электронная микроскопия основаны на взаимодействии между электронами и компонентами тканей.
Трансмиссионная электронная микроскопия. Трансмиссионный электронный микроскоп — это система визуализации изображения, которая теоретически обеспечивает очень высокое разрешение (0,1 нм). На практике, однако, разрешение, получаемое большинством хороших приборов, составляет около 3 нм.
Такое высокое разрешение делает возможным изучение деталей при увеличении вплоть до 400 000 раз. К сожалению, этот уровень увеличения применим только к изолированным молекулам или частицам. Очень тонкие тканевые срезы можно детально изучать при увеличениях примерно до 120 000 раз.
В основе действия трансмиссионного электронного микроскопа лежит принцип, согласно которому электромагнитные поля способны отклонять пучок электронов таким же образом, что и стеклянные линзы, отклоняющие свет. В электронном микроскопе электроны испускаются в результате нагревания в вакууме очень тонкой металлической (обычно вольфрамовой) нити (катода).
Испускаемые электроны далее попадают в условия разницы потенциалов порядка 60—120 кВ между катодом и анодом, представляющим собой металлическую пластинку с отверстием в центре. Электроны, таким образом, привлекаются к аноду и разгоняются до высоких скоростей. Они проходят через центральное отверстие в аноде, формируя постоянный поток (или пучок) электронов, который проникает в колонну микроскопа.
Пучок проходит внутри электрических катушек и отклоняется примерно так же, как и свет в оптических линзах, поскольку электроны изменяют свой ход под действием электромагнитных полей. По этой причине электрические катушки электронных микроскопов называются электромагнитными линзами.
Устройство электронного микроскопа очень сходно с конструкцией оптического микроскопа, хотя оптика электронного микроскопа обычно располагается в обратном порядке. Первая линза — это конденсор, который фокусирует пучок электронов на срезе. Некоторые электроны взаимодействуют с атомами в срезе и продолжают свой ход, тогда как другие просто проходят сквозь образец без взаимодействия.
Большая часть электронов достигает линзы объектива, которая образует увеличенное изображение, далее проецирующееся через другие увеличивающие линзы. Поскольку глаз человека не воспринимает электроны, изображение в конечном итоге проецируется на флюоресцентный экран или регистрируется на фотопластинках или в камере прибора с зарядовой связью.
Так как большая часть изображения в трансмиссионном электронном микроскопе образуется в результате баланса между электронами, которые попадают на флюоресцентный экран (или фотопластинку), и электронами, которые остались в колонне микроскопа, получающееся изображение всегда черно-белое. Темные участки электронных микрофотографий обычно называют электронно-плотными, тогда как светлые участки именуют электронно-прозрачными.
Чтобы создать хорошее взаимодействие между образцом и электронами, в электронной микроскопии используют очень тонкие срезы (40—90 нм), поэтому заливку производят в смолу, которая очень сильно затвердевает. Полученные блоки настолько твердые, что для изготовления срезов требуются стеклянные или алмазные ножи. Чрезвычайно тонкие срезы помещают на маленькие металлические сетки и помещают внутрь микроскопа для изучения.
Метод замораживания позволяет исследовать ткани с помощью электронной микроскопии, при этом необходимость в фиксации и заливке отсутствует. Метод дает меньше артефактов, чем стандартная подготовка тканей, хотя он обычно отличается трудоемкостью. Можно получить срезы замороженных тканей с их последующим исследованием методами цитохимии или иммуноцитохимии, или эти ткани подвергнуть скалыванию (криофрактографии, замораживанию-скалыванию) для выявления деталей внутренней структуры мембран.
Общий вид трансмиссионного электронного микроскопа JEM-1230. Трансмиссионный электронный микроскоп. Схема показывает его линзы и ход электронного луча. ПЗС — прибор с зарядовой связью.
Сканирующая электронная микроскопия позволяет получать псевдотрехмерные изображения поверхности клеток, тканей и органов. В таком электронном микроскопе образуется очень узкий пучок электронов, который последовательно перемещается от одной точки к другой по всему образцу (сканирование).
В отличие от трансмиссионного электронного микроскопа, в сканирующем электронном микроскопе электроны не проходят сквозь образец. Электронный пучок взаимодействует с очень тонким металлическим покрытием, ранее нанесенным на образец, в результате чего возникают отраженные, или испускаемые, электроны.
Эти электроны обнаруживаются детектором, который передает их на усилители и другие приборы таким образом, что в конечном итоге сигнал проецируется на катодно-лучевую трубку (монитор), давая черно-белое изображение.
Получаемые фотографии легко воспринимаются, поскольку на них объекты представлены при освещении сверху, точно так же, как наш обычный макроскопический мир вследствие освещения сверху заполнен ярко освещенными и затененными участками. Сканирующий электронный микроскоп дает лишь изображения поверхностей структур.
Внутреннее строение органов можно анализировать путем их замораживания и скалывания, в результате чего обнажаются их внутренние поверхности.
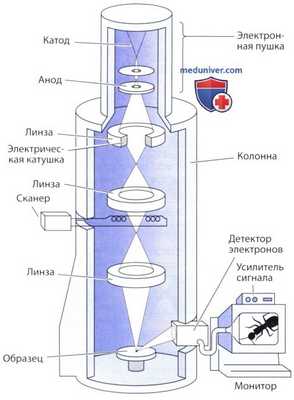
Сканирующий электронный микроскоп (схема).
Читайте также:
