Соотношение между осмотическим давлением и осмолярностью. Осмолярность жидких сред организма
Добавил пользователь Morpheus Обновлено: 21.01.2026
Водные среды организма и осмолярность. Осмотическое давление раствора может быть выражено гидростатическим давлением, которое должно быть приложено к раствору, чтобы удержать ею в объемном равновесии с простым растворителем, когда раствор и растворитель разделены мембраной, проницаемой только для растворителя. Осмотическое давление определяется количеством частиц, растворенных в воде, и не зависит от их массы, размеров и валентности.
Осмолярность раствора, выраженная в миллиосмолях (мОсм), может быть определена количеством миллимолей (но не миллиэквивалентов), растворенных в 1 л воды солей, плюс число недиссоциированных субстанций (глюкоза, мочевина) или слабодиссоциированных субстанций (белок). Осмолярность определяют с помощью осмометра.
Осмолярность нормальной плазмы — величина достаточно постоянная и равна 285—295 мОсм. Из общей осмолярности лишь 2 мОсм обусловлены растворенными в плазме белками. Таким образом, главным компонентом плазмы, обеспечивающим ее осмолярность, являются растворенные в ней ионы натрия и хлора (около 140 и 100 мОсм соответственно).
Как полагают, внутриклеточная и внеклеточная молярная концентрация должна быть одинаковой, несмотря на качественные различия в ионном составе внутри клетки и во внеклеточном пространстве.
В соответствии с Международной системой (СИ) количество веществ в растворе принято выражать в миллимолях на 1 л (ммоль/л). Понятие «осмолярность», принятое в зарубежной и отечественной литературе, эквивалентно понятию «молярность», или «молярная концентрация». Единицами «мэкв» пользуются тогда, когда хотят отразить электрические взаимоотношения в растворе; единицу «ммоль» используют для выражения молярной концентрации, т. е. общего числа частиц в растворе независимо от того, несут ли они электрический заряд или нейтральны; единицы «мОсм» удобны для того, чтобы показать осмотическую силу раствора. По существу понятия «мОсм» и «ммоль» для биологических растворов идентичны.
Электролитный состав человеческого организма. Натрий является преимущественно катионом внеклеточной жидкости. Хлориды и бикарбонат представляют собой анионную электролитную группу внеклеточного пространства. В клеточном пространстве определяющим катионом является калий, а анионная группа представлена фосфатами, сульфатами, белками, органическими кислотами и в меньшей степени бикарбонатами.
Анионы, находящиеся внутри клетки, обычно поливалентны и через клеточную мембрану свободно не проникают. Единственным клеточным катионом, для которого клеточная мембрана проницаема и который находится в клетке в свободном состоянии в достаточном количестве, является калий.
Преимущественная внеклеточная, локализация натрия обусловлена его относительно низкой проникающей способностью через клеточную мембрану и особым механизмом вытеснения натрия из клетки — так называемым натриевым насосом. Анион хлора также внеклеточный компонент, но его потенциальная проникающая способность через клеточную мембрану относительно высока, она не реализуется главным образом потому, что клетка имеет достаточно постоянный состав фиксированных клеточных анионов, создающих в ней преобладание отрицательного потенциала, вытесняющего хлориды. Энергия натриевого насоса обеспечивается гидролизом аденозинтрифосфата (АТФ). Эта же энергия способствует движению калия внутрь клетки.
Элементы контроля водно-электролитного баланса. В норме человек должен потреблять воды столько, сколько бывает необходимо, чтобы возместить суточную ее потерю через почки и внепочечными путями. Оптимальный суточный диурез 1400—1600 мл. При нормальных температурных условиях и нормальной влажности воздуха организм теряет через кожу и дыхательные пути от 800 до 1000 мл воды — это так называемые неощутимые потери. Таким образом, общее суточное выведение воды (моча и перспирационные потери) должно составлять 2200—2600 мл. Организм в состоянии частично покрыть свои потребности за счет использования образующейся в нем метаболической воды, объем которой составляет около 150—220 мл. Нормальная сбалансированная суточная потребность человека в воде от 1000 до 2500 мл и зависит от массы тела, возраста, пола и других обстоятельств. В хирургической и реанимационной практике существуют три варианта определения диуреза: сбор суточной мочи (при отсутствии осложнений и у легких больных), определение диуреза каждые 8 ч (у больных, получающих в течение суток инфузионную терапию любого типа) и определение часового диуреза (у больных с выраженным расстройством водно-электролитного баланса, находящихся в шоке и при подозрении на почечную недостаточность). Удовлетворительный для тяжелого больного диурез, обеспечивающий электролитное равновесие организма и полное выведение шлаков, должен составлять 60 мл/ч (1500 ± 500 мл/сут).
Олигурией считается диурез меньше 25—30 мл/ч (меньше 500 мл/сут). В настоящее время выделяют олигурию преренальную, ренальную и постренальную. Первая возникает в результате блока почечных сосудов или неадекватного кровообращения, вторая связана с паренхиматозной почечной недостаточностью и третья с нарушением оттока мочи из почек.
Клннические признаки нарушения водного баланса. При частой рвоте или диарее следует предполагать существенный водно-электролитный дисбаланс. Жажда свидетельствует о том, что у больного объем воды во внеклеточном пространстве уменьшен относительно содержания в нем солей. Больной с истинной жаждой в состоянии быстро устранить дефицит воды. Потеря чистой воды возможна у больных, которые не могут самостоятельно пить (кома и др.), а также у больных, которым резко ограничивают питье без соответствующей внутривенной компенсации Потеря возникает также при обильном потении (высокая температура), диарее и осмотическом диурезе (высокий уровень глюкозы при диабетической коме, применение маннита или мочевины).
Сухость в подмышечных и паховых областях является важным симптомом потери воды и свидетельствует о том, что дефицит ее в организме составляет минимум 1500 мл.
Снижение тургора тканей и кожи рассматривают как показатель уменьшения объема интерстициальной жидкости и потребности организма во введении солевых растворов (потребность в натрии). Язык в нормальных условиях имеет единственную более или менее выраженную срединную продольную борозду. При дегидратации появляются дополнительные борозды, параллельные срединной.
Масса тела, меняющаяся на протяжении коротких промежутков времени (например, через 1- 2 ч), является показателем изменений внеклеточной жидкости. Однако данные определения массы тела надо интерпретировать только в совместной оценке с другими показателями.
Изменения АД и пульса наблюдаются лишь при существенной потере воды организмом и в наибольшей степени связаны с изменением ОЦК. Тахикардия — довольно ранний признак снижения объема крови.
Отеки всегда отражают увеличение объема интерстициальной жидкости и указывают на то, что общее количество натрия в организме повышено. Однако отеки не всегда являются высокочувствительным показателем баланса натрия, поскольку распределение воды между сосудистым и интерсгициальным пространством обусловлено в норме высоким белковым градиентом между этими средами. Появление едва заметной ямки от надавливания в области передней поверхности голени при нормальном белковом балансе указывает на то, что в организме имеется избыток по крайней мере 400 ммолей натрия, т. е. более 2,5 л интерстициальной жидкости.
Жажда, олигурия и гипернатриемия являются главными признаками дефицита воды в организме.
Гипогидратация сопровождается снижением ЦВД, которое в ряде случаев становится отрицательным. В клинической практике нормальными цифрами ЦВД принято считать 60—120 мм вод. ст. При водной перегрузке (гипергидратация) показатели ЦВД могут значительно превышать эти цифры. Однако чрезмерное использование кристаллоидных растворов может иногда сопровождаться водной перегрузкой интерстициального пространства (в том числе и интерстициальным отеком легких) без существенного повышения ЦВД.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
© cyberpedia.su 2017-2020 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!
Осмотическое состояние биологических жидкостей
Осмосом называют спонтанное движение растворителя из раствора с низкой концентрацией частиц в раствор с высокой концентрацией их через мембрану, проницаемую только для растворителя. Осмотическое давление — избыточная величина гидростатического давления, которое должно быть приложено к раствору, чтобы уравновесить диффузию растворителя, через., полупроницаемую мембрану 1 .
1 Энциклопедический словарь медицинских терминов.— М.: Советская энциклопедия, 1983, с. 270.
Осмотическое давление плазмы крови составляет в среднем 6,62 атм (пределы колебаний 6,47—6,72 атм). Осмотическое давление зависит только от концентрации частиц, растворенных в растворе, и не зависит от их массы, размера и валентности. Таким образом, осмотическое давление создают в растворе все ц частицы — как ионы (Na+, К + , С1 — , НСО3 — ), так и нейтральные молекулы (глюкоза, мочевина).
В биологии и медицине осмотическое состояние сред принято выражать двумя понятиями: осмолярностью, представляющей собой суммарную концентрацию растворенных частиц в 1 л раствора (в миллиосмолях на литр), и осмоляльностью, являющейся концентрацией частиц в 1 кг растворителя, т. е. воды (мосмоль/кг).
Среднее содержание воды в крови составляет по объему 92%, следовательно, осмоляльность= осмолярность/0,92.
Осмоляльность раствора численно равна суммарной концентрации, выраженной в количестве веществ (в миллимолях, но не в миллиэквивалентах), содержащихся в 1 кг растворителя (вода), плюс количество полностью диссоциированных электролитов, недиссоциированных веществ (глюкоза, мочевина) или слабодиссоциированных субстанций, таких как белок. Поскольку с помощью специального прибора осмометра определяется осмоляльность (но не осмолярность), мы будем пользоваться этим термином.
Все одновалентные ионы (Na + , К + , Cl — ) образуют в растворе число осмолей, равное числу молей и эквивалентов (электрических зарядов). Двухвалентные ионы образуют в растворе каждый по одному осмолю (и молю), но по два эквивалента.
Осмоляльность нормальной плазмы — величина достаточно постоянная и равна 285—295 мосмоль/кг. Из общей осмоляльности плазмы лишь 2 мосмол/кг обусловлены наличием растворенных в ней белков. Таким образом, главными компонентами, обеспечивающими осмоляльность плазмы, являются Na+ и С1- (около 140 и 100 мосмоль/кг соответственно). Постоянство осмотического давления внутриклеточной и внеклеточной 1 жидкости предполагает равенство молярных концентраций содержащихся в них электролитов, несмотря на различия в ионном составе внутри клетки и во внеклеточном пространстве. С 1976 г. в соответствии с Международной системой (СИ) концентрацию веществ в растворе, в том числе осмотическую, принято выражать в миллимолях на 1 л (ммоль/л). Понятие «осмоляльность», или «осмотическая концентрация», эквивалентно понятию «моляльность», или «моляльная концентрация». По существу понятия «миллиосмоль» и «миллимоль» для биологических растворов близки, хотя и не идентичны.
Часть осмотического давления, создаваемую в биологических жидкостях белками, называют коллоидно-осмотическим (онкотическим) давлением (КОД). Оно составляет примерно 0,7% осмотического давления (или осмотической концентрации), т. е. около 30 мм рт. ст. (2 мосмоль/кг), но имеет исключительно большое функциональное значение в связи с высокой гидро-фильностью белков и неспособностью их свободно проходить через полупроницаемые биологические мембраны.
КОД плазмы крови и других сред определяют с помощью специальных приборов онкометров. Нормальные величины осмоляльности биологических сред и жидкостей человеческого организма приведены в табл. 1.2.
Таблица 1.2. Нормальные значения осмоляльности биологических сред
| Среда | Осмоляльность, мосмоль на 1 кг воды |
| Плазма крови | 285—295 |
| Цереброспинальная жидкость | 285—295 |
| Желудочный сок | 160—340 |
| Слюна | 110—210 |
| Желчь | 290—300 |
| Моча | 600—1200 (в зависимости от диеты и диуреза) |
Наиболее распространенный метод определения осмотической концентрации в биологической среде — криоскопический — основан на изменении температуры замерзания исследуемого раствора. Присутствие растворенного вещества понижает точку замерзания (для дистиллированной воды 0°С) тем сильнее, чем концентрированнее раствор. Основанные на этом принципе осмометры позволяют определять осмоляльность в очень малой пробе (0,05—0,15 мл).
Если непосредственное определение осмоляльности невозможно (например, в случае отсутствия осмометра), ее можно рассчитать по одной из нескольких предложенных для этой цели формул. Одна из них [Fabri P. J., 1988] имеет вид:
где [Na+], [Гл], [М] — концентрации Na+, глюкозы, мочевины (ммоль/л), 1,86 — удвоенный осмотический коэффициент Na+ (с учетом сопутствующего аниона; мосмоль/ммоль). Предлагают также рассчитывать так называемый градиент, или дискриминанту, осмоляльности («osmolal gap»; см. главу 2, где говорится о близком по смыслу показателе «anion gap»), т. е. разность между измеренной и расчетной осмоляльностью.
Обычно осмоляльный градиент не превышает 10 мосмоль/кг. Более высокий градиент указывает на то, что в формировании высокой осмоляльности принимают участие другие (обычно не учитываемые) субстанции — лактат, этанол, маннитол.
Осмоляльность внеклеточной жидкости, определяемая концентрацией растворенных в ней веществ, поддерживается постоянной благодаря почечному механизму регуляции, осуществляемому с участием антидиуретического гормона (АДГ) и альдостерона. Почечный механизм работает на основе концентрации субстанций во внеклеточной жидкости. Эта концентрация может быть оценена отношением количества растворенных субстанций к количеству растворителя. Следовательно, варианты патологии этой функции могут выражаться в отклонениях от нормы: изменении количеств растворенных веществ, объема воды или того и другого показателя.
Наиболее распространенной ошибкой в клинической практике является предположение, что изменения осмоляльности отражают повышение или понижение содержания воды. В действительности осмоляльность отражает концентрационные взаимоотношения и увеличивается либо в зависимости от увеличения содержания растворенного субстрата (например, при азотемии), либо в результате абсолютного уменьшения содержания растворителя (воды), в частности при дегидратации, либо, наконец, в результате изменения обоих компонентов (гиперосмоляльная кома).
Осмос, осмотическое давление. Закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей.
Осмос - процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации растворённого вещества (меньшей концентрации растворителя).
Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.

Термины «осмолярность» и «осмоляльность» часто путают. Осмоляльность — это количество осмотически активных частиц в 1000 г воды в растворе (единицы измерения — мосмоль/кг), тогда как осмолярность — это количество осмотически активных частиц в единице объема раствора (единицы измерения — мосмоль/л). Значительную часть объема плазмы составляют белки, поэтому ее осмоляльность обычно выше, чем осмолярность. При расчете осмотических соотношений лучше использовать осмоляльность.
1)Осмоляльность внеклеточной жидкости несколько выше, чем внутриклеточной, за счет белков плазмы.
2)Молекулы воды перемещаются в соответствии с осмотическим градиентом ионов так, что концентрации растворов выравниваются.
3)Осмоляльность определяют по снижению точки замерзания раствора. Существует также эмпирическое правило: осмоляльность = 2 [Na + ], мэкв/л + АМК, мг% / 2,8 + глюкоза, мг% / 18. Осмоляльность мочи зависит от концентрационной способности почек. При минимальном объеме мочи ее осмоляльность максимальна. Максимальная осмоляльность мочи варьирует от 1200 мосмоль/кг у здорового ребенка (у грудных детей — 600—700 мосмоль/кг) до 300 мосмоль/кг при заболеваниях почек.
Осмос, осмотическое давление, закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей.
Осмос - самопроизвольный переход растворителя в р-р через полунепроницаемую перегородку.
Осмотическое давление - избыточное давление, которое необходимо приложить к раствору на высоте h=0, чтобы воспрепятствовать проникновению растворителя в раствор.
ЗАКОН ВАНТ-ГОФФА описывает зависимость ОСМОТИЧЕСКОГО ДАВЛЕНИЯ разбавленных растворов от температуры и молярной концентрации раствора.
Вант-Гофф выразил осмотическое давление формулой РV = iRT, где Р означает осмотическое давление вещества, растворенного в жидкости; V - объем; R - газовую постоянную; Т - температуру, i - коэффициент, который для газов часто равен 1, а для растворов, содержащих соли, - больше единицы.
Осмоляльность — это количество осмотически активных частиц в 1000г воды в растворе.
Осмолярность — это количество осмотически активных частиц в единице объема раствора.
11.Понятие о коллоидных растворах. Методы получения и очистки коллоидных растворов. Строение мицеллы. Коагуляция, порог коагуляции.
Коллоидные растворы - высокодисперсные двухфазные системы, состоящие из дисперсионной среды и дисперсной фазы.
Методы очистки коллоидно -дисперсных систем:
А)Диализ — очистка золей от примесей с помощью полупроницаемых мембран, омываемых чистым растворителем.
Б)Электродиализ — диализ, ускоренный за счет электрического поля.
В)Ультрафильтрация — очистка путем продавливания дисперсионной среды вместе с низкомолекулярными примесями через полупроницаемую мембрану (ультрафильтр).
Дисперсионные методы получения золей:
3. электрическое распыление в вольтовой дуге;
4. химическое диспергирование (пептизация):
5. Пептизация — переход осадка в золь под влиянием диспергирующих веществ — пептизаторов: электролитов, ПАВ, ВМС.
6. Адсорбционная пептизация. К осадку Fe(OH)3 добавляют раствор FeCl3. Ионы Fe3+ адсорбируются на кристаллах Fe(OH)3, достраивают кристаллическую решетку и образуют слой потенциалопределяющих ионов, ионы Cl- являются противоионами. Частицы приобретают заряд и переходят в золь
7. Диссолюционная пептизация -- обработка осадка электролитом, частично растворяющим его. В осадок Fe(OH)3 добавляется небольшое количество HCl.
Конденсационные методы получения золей:
1. Физический метод конденсации -- метод замены растворителя
2. Химические методы конденсации основаны на реакциях гидролиза, окисления, восстановления, обмена.
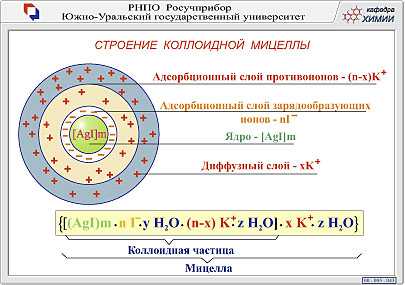
Коагуляция - это самопроизвольный физический процесс укрупнения частиц дисперсной фазы в результате потери агрегативной устойчивости под влиянием внешних факторов.
Порог коагуляции - наименьшее количество электролита, которое вызывает начало явной (заметной) коагуляции.
Следует отметить, что коагулирующая способность электролитов (ионов) неодинакова и может быть определена как величина, обратная порогу коагуляции: КС=1/ПК, где КС — коагулирующая способность электролитов; ПК — порог коагуляции, ммоль/л.
Клиническая биохимия
В мировой практике осмоляльность биологических жидкостей измеряется с помощью высокочувствительных приборов, называемых осмометрами.
Водные растворы, какими являются биологические жидкости, характеризуются группой связанных друг с другом свойств, называемых коллигативными (коллективными). Четыре свойства из группы коллигативных свойств рассматриваются обычно вместе, а именно:
1. Понижение давления пара растворителя над раствором
где m - моляльность; Кпар - константа давления пара.
2. Повышение температуры кипения раствора
где m - моляльность; Ккип - эбулиоскопическая константа.
3. Понижение температуры замерзания раствора
где m - моляльность; Кзам - криоскопическая константа.
4. Осмотическое давление
где m - моляльность; Косм - константа осмотического давления.
Как видно, эти свойства изменяются пропорционально концентрации m растворенного вещества. Причем, эти свойства не зависят от природы и химического состава растворенного вещества. Каждое из перечисленных коллигативных свойств может быть измерено (причем, измерив одно свойство, можно рассчитать другие по известным формулам) и использовано для построения приборов, называемых осмометрами, которые широко применяются в мировой клинической практике для контроля осмоляльности биологических жидкостей (кровь, моча, ликвор идр.) и водных растворов (инфузионные растворы, кровезаменители, растворы парентерального и энтерального питания и др.).
В соответствии с перечисленными свойствами на мировом рынке медицинской техники существуют:
• осмометры давления пара;
• осмометры по точке замерзания (криоскопические);
• мембранные осмометры (осмометры прямого действия).
учитывая специфический характер второго свойства, на практике осмометры по температуре кипения для биологических объектов не нашли применения.
При выборе осмометра необходимо понимать, что по некоторым характеристикам они не взаимозаменяемы. Дадим характеристику каждому.
Осмометры давления пара
Этот тип приборов отличается тем, что для измерения требуется минимальный объем пробы (единицы микролитров), что имеет большое значение, когда из объекта исследования нельзя взять больший объем. Однако по причине малости объема пробы осмометры давления пара имеют большую погрешность по сравнению с другими. Кроме того, результат измерения зависит от изменения атмосферного давления. Основное применение эти приборы нашли в научных исследованиях и педиатрической практике для исследований крови новорожденных, взятой из пальчика или пяточки. Диапазон измеряемых концентраций ограничивается 2000 ммоль/кг Н2О. В российских ЛПУ они не нашли широкого применения. В Европейском союзе осмометры давления пара производит фирма Dr . Knauer , Gonotec (Германия), в США - фирма Wescor .
Мембранные осмометры
Осмосом называется процесс, при котором происходит движение молекул растворителя из раствора с низкой концентрацией в раствор с высокой концентрацией через мембрану, проницаемую только для молекул растворителя. На этом свойстве строятся осмометры, называемые мембранными. В их конструкции могут использоваться как искусственные мембраны (например, целлофан), так и природные (например, кожа лягушки).
Приборы этого типа используются для измерения так называемого коллоидно-осмотического давления крови (КОД), которое создается высокомолекулярной (более 30000 Д) составляющей общей концентрации осмотически активных частиц, содержащихся в плазме крови. Это давление называется также онкотическим и создается преимущественно белками. КОД составляет менее 3 ммоль/кг Н2О и поэтому незначительно влияет на общее осмотическое давление, но имеет определяющее значение для процессов транскапиллярного обмена. Эта составляющая общего давления имеет важное диагностическое значение. Мембранные осмометры производят фирмы Dr. Knauer , Gonotec , Германия ( Osmomat 050 ), в США - фирма Wescor . Интересно, что фирма доктора Кнауэра предлагает всю линейку осмометров, перекрывая, таким образом, весь диапазон частиц с молекулярной массой, включая миллионные.
Приборы этого типа в России не производятся. О применении зарубежных приборов имеется скудная информация.
Осмометры по точке замерзания (криоскопические)
Осмометры, принцип действия которых основан на измерении понижения (депрессии) температуры замерзания раствора в сравнении с температурой замерзания растворителя (в нашем случае воды), нашли наибольшее распространение по причине наилучшей пригодности этой методики для лабораторной клинической диагностики нарушений водного и электролитного баланса (молекулярные массы частиц биологических жидкостей не превышают 30000 Д).
Читайте также:
- Формы лекарств для лечения заболеваний кожи
- УЗИ слепой кишки, червеобразного отростка (аппендикса), илеоцекального перехода в норме
- Ювелирные украшения и психология. Как золото и бриллианты могут изменить психику?
- Инфицирование ленточными червями: диагностика, лечение, профилактика
- Наследственная фоточувствительность у ребенка
