Свойства трупной крови. Местные особенности трупной крови
Добавил пользователь Cypher Обновлено: 31.01.2026
Статья раскрывает некоторые малоизвестные обстоятельства возникновения идеи, разработки проблемы, а также особенности внедрения метода переливания трупной крови в клиническую практику и историю его развития с 20-х гг. ХХ века до настоящего времени.
Ключевые слова
Об авторах
Список литературы
1. Кулябко, А.А. Дальнейшие опыты оживления сердца. Оживление человеческого сердца / А.А. Кулябко. - СПб: Тип. Имп. Акад. наук, 1902. - 24 с.: табл. Kulyabko A.A. Dal'neyshie opyty ozhivleniya serdtsa. Ozhivlenie chelovecheskogo serdtsa [Further experiments revive the heart. The revival of the human heart]. Saint-Petersburg: Tip. Imp. Akad. Nauk Publ., 1902. 24 p. (In
3. Андреев, Ф.А. Опыты восстановления деятельности сердца, дыхания и функций центральной нервной системы: Оттиск из журнала «Вопросы научной медицины» 1913; № 2 / Ф.А. Андреев. - М.: Тип. Вильде, 1915. - 40 с. Andreev F.A. Opyty vosstanovleniya deyatel'nosti serdtsa, dykhaniya I funktsiy tsentral'noy nervnoy sistemy: Ottisk iz zhurnala «Voprosy nauchnoy meditsiny» 1913; № 2 [Experiments recovery of the heart, respiratory and central nervous system functions: A reprint from the journal «Issues of scientific medicine» in 1913; number 2]. Moscow: Tip. Vil'de Publ., 1915. 40 p. (In Russian).
4. Цуринова, Е.Г. Переливание фибринолизной крови / Е.Г. Цуринова. - М.: Медгиз, 1960. - 156 с.: ил. Tsurinova E.G. Perelivanie fibrinoliznoy krovi [Transfusion of blood fibrinoliznoy]. Moscow: Medgiz Publ., 1960. 156 p. (In Russian).
5. Шамов, В.Н. К изучению гомопластики с трупа - переливание крови от трупа / В.Н. Шамов, М.Х. Костюков // Тр. 3-го Всеукраинского съезда хирургов, Днепропетровск, 9/IX-14/ IX 1928 г. - Днепропетровск, 1929. -С. 184-188. Shamov V.N., Kostyukov M.Kh. K izucheniyu gomoplastiki s trupa - perelivanie krovi ot trupa. [By studying homoplasty a corpse - a blood transfusion from a corpse]. Tr. 3-go Vseukrainskogo s"ezda khirurgov, Dnepropetrovsk, 9/IX-14/IX 1928 g. [Proceedings of the 3rd All-Ukrainian Congress of Surgeons, Dnepropetrovsk, Sep. 9-14 1928]. Dnepropetrovsk, 1929. 184-188 p. (In Russian).
6. Шамов, В.Н. Возникновение идеи переливания крови от трупа и дальнейшие перспективы применения фибринолизной крови / В.Н. Шамов // Эксперимент. хир. - 1958. - № 5. - С. 8-14. Shamov V.N. Vozniknovenie idei perelivaniya krovi ot trupa i dal'neyshie perspektivy primeneniya fibrinoliznoy krovi [The emergence of the idea of a blood transfusion from a corpse and future prospects of the use of blood fibrinolisis]. Eksperiment. khir. 1958; 5: 8-14. (In Russian).
7. Симонян, К.С. Посмертная кровь в аспекте трансфузиологии / К.С. Симонян, К.П. Гутионтова, Е.Г. Цуринова. - М.: Медицина, 1975. - 272 с.: ил. Simonyan K.S., Gutiontova K.P., Tsurinova E.G. Posmertnaya krov' v aspekte transfuziologii [Postmortem blood transfusion aspect]. Moscow: Meditsina Publ., 1975. 272 p.: il. (In Russian).
8. Шамов, В.Н. К изучению гомопластики с трупа - переливание крови от трупа / В.Н. Шамов, М.X. Костюков // Нов. хир. архив. - 1929. - Т. 18, Кн. 1-4. - С. 184-195. Shamov V.N., Kostyukov M.Kh. K izucheniyu gomoplastiki s trupa - perelivanie krovi ot trupa [By studying homoplasty a corpse - a blood transfusion from a corpse]. Nov. khir. arkhiv. 1929; 18 (1-4): 184-195. (In Russian).
9. Сакаян, Р.Г. Переливание крови по материалам Института им. Склифосовского / Р.Г. Сакаян // Тр. 4-го Всеукраинского съезда хирургов, Харьков, 6-10/IX 1930 г. - Днепропетровск, 1931. - С. 53-54. Sakayan R.G. Perelivanie krovi po materialam Instituta im. Sklifosovskogo [Blood transfusion Materials Institute Sklifosovsky]. Tr. 4-go Vseukrainskogo s"ezda khirurgov, Khar'kov, 6-10/ IX 1930 g. [Proceedings of the 4th All-Ukrainian Congress of Surgeons, Kharkiv, Sep. 6-10 1930]. Dnepropetrovsk, 1931. 53-54 p. (In Russian).
10. Хватов, В.Б. Медико-биологические аспекты использования посмертной крови / В.Б. Хватов // Вестник АМН СССР. - 1991. - № 9. - С. 18-24. Khvatov V.B. Mediko-biologicheskie aspekty ispol'zovaniya posmertnoy krovi [Medical and biological aspects of postmortem blood]. Vestnik AMN SSSR. 1991; 9: 18-24. (In Russian).
12. Перцев, В.А. Переливание крови (Сергей Сергеевич Юдин, биографические этюды (продолжение) / В.А. Перцев // Интернет-журнал Новый хирургический архив. - 2003. - Т. 2, № 3. [Электронный ресурс]. Pertsev V.A. Perelivanie krovi (Sergey Sergeevich Yudin, biograficheskie etyudy (prodolzhenie)) [Blood transfusion (Sergey Yudin, biographical sketches (continued))]. Internet-zhurnal Novyy khirurgicheskiy arkhiv. 2003; 2 (3). (In Russian).
13. Сакаян, Р.Г. Опыты переливания крови от трупа / Р.Г. Сакаян // Сов. хирургия. - 1932. - Т. 2, Вып. 3-4. - С. 95-97. Sakayan R.G. Opyty perelivaniya krovi ot trupa [Experiments on a blood transfusion from a corpse]. Sov. khirurgiya. 1932; 2 (3-4): 95-97. (In Russian).
14. Sakajan, R. Ein Versuch der Bluttransfusion von der Leiche / R. Sakajan // Zentalblatt für Chirururgie. - 1931. - № 11. - S. 671-674.
15. Юдин, С.С. Переливание посмертной крови // Вопросы военно-полевой хирургии и переливание посмертной крови / С.С. Юдин. - М., 1960. - С. 309-545. Yudin S.S. Perelivanie posmertnoy krovi [Transfusion of postmortem blood]. In: Yudin S.S. Voprosy voenno-polevoy khirurgii i perelivanie posmertnoy krovi. Moscow, 1960. 309-545. (In Russian).
16. Спасокукоцкий, С.И. Переливание трупной крови / С.И. Спасокукоцкий, В.Я. Брайцев / Переливание крови как лечебный метод /Под ред. А.А. Богомолец, М.И. Кончаловского, С.И. Спасокукоцкого. - М. - Л: Медгиз, 1935. - С. 85-89. Spasokukotskiy S.I., Braytsev V.Ya. Perelivanie trupnoy krovi [Transfusion of cadaveric blood]. In: eds. Bogomolets A.A., Konchalovskiy M.I., Spasokukotsky S.I. Perelivanie krovi kak lechebnyy metod [Blood transfusion as a treatment method]. Moscow-Leningrad: Medgiz Publ., 1935. 85-89.
17. Swan, H. The transfusion of blood from cadavers. A historical review / H. Swan, D. Schechter // Surgery. - 1962. - Vol. 52, N. 3. - Р. 545-560.
18. Петров, Б.А. Пути развития и перспективы применении трупной крови / Б.А. Петров, Г.А. Пафомов // Тр. научн. сессии, посвящ. применению трупной крови и некоторым вопр. гомопластики (26-27 апреля 1965 г.). - Т. XIV. - М., 1967. - С. 64-68. Petrov B.A., Pafomov G.A. Puti razvitiya i perspektivy primenenii trupnoy krovi [Ways of development and prospects of using cadaveric blood]. In: Tr. nauchn. sessii, posvyashch. primeneniyu trupnoy krovi i nekotorym vopr. gomoplastiki (26-27 aprelya 1965 g.) [Proceedings of the scientific session devoted to the use of cadaveric blood and some of the issues homoplasty (Apr. 26-27 1965)]. XIV. Moscow, 1967. 64-68. (In Russian).
19. Judin, S. La transfusion du sang de cadavre á l'homme / S. Judin. - Paris: Masson et Cie, 1933. - 136 p.: ill.
20. Бокерия, Л.А. В.Н. Шамов и С.С. Юдин - пионеры переливания фибринолизной крови в хирургии (Ленинская премия 1962 г.) / Л.А. Бокерия, С.П. Глянцев, Д.Т. Логинов // Анн. хир. - 2001. - № 5. - С. 12-18. Bokeriya L.A., Glyantsev S.P., Loginov D.T. V.N. Shamov i S.S. Yudin - pionery perelivaniya fibrinoliznoy krovi v khirurgii (Leninskaya premiya 1962 g.) [V.N. Shamov and S.S. Yudin - Pioneers of fibrinolysis blood transfusion in surgery (Lenin Prize 1962)]. Ann. khir. 2001; 5: 12-18. (In Russian).
21. Скундина, М.Г. Основные этапы развития проблемы переливания трупной крови / М.Г. Скундина // Сов. хир. - 1935. - № 6. - С. 69-77. Skundina M.G. Osnovnye etapy razvitiya problemy perelivaniya trupnoy krovi [The main stages of development of cadaveric blood transfusion]. Sov. khir. 1935; 6: 69-77. (In Russian).
22. Филатов, А.Н., Головин Г.В. Успехи переливания крови в СССР и роль советских хирургов в развитии этого метода за 40 лет / А.Н. Филатов, Г.В. Головин // Вестн. хирургии им.И.И. Грекова. - 1957. - Т. 79, № 7. - С. 3-17. Filatov A.N., Golovin G.V. Uspekhi perelivaniya krovi v SSSR i rol' sovetskikh khirurgov v razvitii etogo metoda za 40 let [Advances in blood transfusion and the role of the USSR Soviet surgeons in the development of this method for 40 years]. Vestn. khirurgii im. I.I. Grekova. 1957; 79 (7): 3-17. (In Russian).
23. Шамов, В.Н. Руководство по переливанию крови / В.Н. Шамов, А.Н. Филатов. - М. - Л.: Наркомздрав СССР, 1940. - 600 с. Shamov V.N., Filatov A.N. Rukovodstvo po perelivaniyu krovi [Guidelines for Blood Transfusion]. Moscow-Leningrad: Narkomzdrav SSSR, 1940. 600 p. (In Russian).
24. Judin, S. Das Problem der Leichenbluttransfusion / S. Judin, M. Skundina // Wiener medizinische Wochenschrift. - 1934. - Jg. 84, N.7. - S. 817-822.
25. Yudin S. Transfusion of cadaver blood / S. Yudin // JAMA. - 1936. - Vol. 106, N.12. - Р. 997-999.
26. Yudin, S. Transfusion of stored cadaver blood. Practical consideration: The first thousand cases / S. Yudin // Lancet. - 1937. - Vol. 230, N. 5946. - Р. 361-366.
27. Скундина, М.Г. Переливание трупной крови: дис. … д-ра мед. наук / М.Г. Скундина. - М., 1940. - 409 с. Skundina M.G. Perelivanie trupnoy krovi: dis. … d-ra med. nauk [Transfusion of cadaveric blood. Dr. med. sci. diss.]. Moscow: 1940. 409 p. (In Russian).
28. Арапов, Д.А. Заключительное слово председателя научной сессии / Д.А. Арапов // Труды научной сессии, посвященной применению трупной крови и некоторым вопросам гомопластики (26-27 апреля 1965 г.). - Т. XIV. - М., 1967. - С. 147. Arapov D.A. Zaklyuchitel'noe slovo predsedatelya nauchnoy sessii [Concluding remarks of Chairman of the Scientific Session]. In: Trudy nauchnoy sessii, posvyashchennoy primeneniyu trupnoy krovi i nekotorym voprosam gomoplastiki (26-27 aprelya 1965 g.) [Proceedings of the scientific session devoted to the use of cadaveric blood and some of the issues homoplasty (Apr. 26-27 1965)]. XIV. Moscow, 1967. 147 p. (In Russian).
29. Lethbridge, D. «The Blood Fights on in Other Veins»: Norman Bethune and the Transfusion of Cadaver Blood in the Spanish Civil War / D. Lethbridge // CBMH/BCHM. - 2012. - Vol. 29, N. 1. - P. 69-81.
30. Письмо С.С. Юдина Б.С. Розанову и П.И. Андросову от 22 марта 1952 г. на 4 листах. - Архив П.И. Андросова. Pis'mo S.S. Yudina B.S. Rozanovu I P.I. Androsovu ot 22 marta 1952 g. na 4 listakh [Letter of S.S. Yudin to B.S. Rozanov and P.I. Androsov dated 22 March 1952 on 4 sheets]. Archive P.I. Androsov. (In Russian).
31. ЦАГМ, Ф. Р-656, оп. № 1, ед. хр. № 70, св. 5. Решения Ученого совета Минздрава РСФСР «О расширении плана научно-исследовательских работ в Институте им. Н.В. Склифосовского в 1952-1954 гг.» на 55 листах. Лист 47. Протокол от 14 сентября 1953 г. предварительного совещания по расширению научных проблем и намечаемых к разработке в 1954 г. Resheniya Uchenogo soveta Minzdrava RSFSR «O rasshirenii plana nauchnoissledovatel'skikh rabot v Institute im. N.V. Sklifosovskogo v 1952-1954 gg.» na 55 listakh. List 47. Protokol ot 14 sentyabrya 1953 g. predvaritel'nogo soveshchaniya po rasshireniyu nauchnykh problem i namechaemykh k razrabotke v 1954 g. [Decisions of the Academic Council of the RSFSR Ministry of Health "On the expansion plan of scientific research in the N.V. Sklifosovsky Institute in 1952-1954 years" on 55 sheets. Sheet 47. Minutes of September 14, 1953 premeeting on the expansion of scientific problems and planned ones to develop in 1954]. TsAGM, F. R-656, op. № 1, un. № 70, cer. 5. (In Russian).
32. Цуринова, Е.Г. Применение фибринолизной крови: дис. … д-ра мед. наук: в 2 т. / Е.Г. Цуринова. - Л., 1956. - Т.1. - 367с.; Т. 2. - 167 с. Tsurinova E.G. Primenenie fibrinoliznoy krovi: dis. … d-ra med. nauk: v 2-kh t. [Application of fibrinolysis blood. Dr. med. sci. diss. Two volumes]. Leningrad, 1956; 1: 367; 2: 167. (In Russian).
33. Сухинин, П.Л. Обменное переливание трупной крови при острых отравлениях / П.Л. Сухинин, В.Н. Дагаев, Е.А. Лужников // Тр. научн. сессии, посвящ. применению трупной крови и некоторым вопр. гомопластики (26-27 апреля 1965 г.). - Т. XIV. - М., 1967. - С. 64-68. Sukhinin P.L., Dagaev V.N., Luzhnikov E.A. Obmennoe perelivanie trupnoy krovi pri ostrykh otravleniyakh [Exchange transfusion of cadaveric blood in acute poisoning]. In: Tr. nauchn. sessii, posvyashch. primeneniyu trupnoy krovi i nekotorym vopr. gomoplastiki (26-27 aprelya 1965 g.) [Proceedings of the scientific session devoted to the use of cadaveric blood and some of the issues homoplasty (Apr. 26-27 1965)]. XIV. Moscow, 1967. 64-68. (In Russian).
34. Kevorkian, J. Transfusion of postmortem human blood / J. Kevorkian, G. Bylsma // Amer. J. Clin. Path. - 1961. - Vol. 35, N. 3. - Р. 413-419.
35. Kevorkian, J. Direct body-body human cadaver blood transfusions / J. Kevorkian, N. Neal, E. Rea // Military Med. - 1964. - Vol. 129, N. 1. - P. 24-27.
36. Братчик, A.M. Исследования трупной крови / A.M. Братчик // Пробл. гематол. перелив. крови. - 1976. - № 21. - С. 61-62. Bratchik A.M. Issledovaniya trupnoy krovi [Research on cadaveric blood]. Probl. gematol. pereliv. krovi. 1976; 21: 61-62. (In Russian).
37. Дьяков, Г.Н. Культивирование лимфоцитов из кадаверной крови / Г.Н. Дьяков, Ю.М. Лопухин, E.M. Коган // Эксп. хир. анестезиол. - 1973. - № 18. - С. 6-9. D'yakov G.N., Lopukhin Yu.M., Kogan E.M. Kul'tivirovanie limfotsitov iz kadavernoy krovi [Cultivation of cadaver blood lymphocytes]. Eksp. khir. anesteziol. 1973; 18: 6-9. (In Russian).
38. Использование суспензии тромбоцитов кадаверной крови, сохраненных в замороженном состоянии, для коррекции гипокоагуляции во время искусственного кровообращения / Г.И. Левин, А.Б. Королев, В.М. Денисов, Г.В. Вершинин // Пробл. гематол. перелив. крови. - 1979. - № 24. - С. 7-11. Levin G.I., Korolev A.B., Denisov V.M., Vershinin G.V. Ispol'zovanie suspenzii trombotsitov kadavernoy krovi, sokhranennykh v zamorozhennom sostoyanii, dlya korrektsii gipokoagulyatsii vo vremya iskusstvennogo krovoobrashcheniya [The use of cadaver blood platelet suspension stored in a frozen state, for correction of anticoagulation during cardiopulmonary bypass]. Probl. gematol. pereliv. krovi. 1979; 24: 7-11. (In Russian).
39. Seidl, S. Die Verwendung von Leichenblut für Bluttransfusion / S. Seidl // Dtsch. Med. Wochenschr. - 1970. - Jg. 95, N. 15. - S. 711-712.
40. Пафомов, Г.А. Биологическая характеристика крови внезапно умерших и ее использование в хирургической практике: дис. … д-ра мед. наук / Г.А. Пафомов. - М., 1971. - 335 c. Pafomov G.A. Biologicheskaya kharakteristika krovi vnezapno umershikh I ee ispol'zovanie v khirurgicheskoy praktike: dis. … d-ra med. nauk [The biological characteristics of a blood of suddenly deceased people and its use in surgical practice. Dr. med. sci. diss.]. Moscow, 1971. 335 p. (In Russian).
41. Хватов, В.Б. Препараты фибринолитического и антипротеиназного действия из плазмы крови внезапно умерших людей (экспериментальное исследование): дис. … д-ра мед. наук / В.Б. Хватов. - М., 1984. - 417 с. Khvatov V.B. Preparaty fibrinoliticheskogo i antiproteinaznogo deystviya iz plazmy krovi vnezapno umershikh lyudey (eksperimental'noe issledovanie): dis. … d-ra med. nauk [Fibrinolytic drugs and anti-proteinase action from the blood plasma of people who died suddenly (an experimental study). Dr. med. sci. diss.]. Moscow, 1984. 417 p. (In Russian).
42. Иммунологические аспекты использования эритроцитарной массы донора органа при трансплантации печени / В.П. Никулина, В.А. Гуляев, М.А. Годков, Е.Н. Кобзева // Актуальные вопросы трансплантации органов: Материалы гор. науч.-практич. конф. / Под ред. М.Ш. Хубутия. - М.: Триада-М, 2008. - С. 93-95. Nikulina V.P., Gulyaev V.A, Godkov M.A., Kobzeva E.N. Immunologicheskie aspekty ispol'zovaniya eritrotsitarnoy massy donora organa pri transplantatsii pecheni [Immunological aspects of the use of packed red blood cells of the donor organ in liver transplantation]. In: ed. Khubutiya M.Sh. Aktual'nye voprosy
43. transplantatsii organov: materialy gor. nauch.-praktich. konf. Moscow: Triada-M Publ., 2008. 93-95. (In Russian).
44. Использование отмытых эритроцитов донора печени при трансплантации трупной печени / М.Ш. Хубутия, В.А. Гуляев, С.В. Журавель [и др.] // Тез. докл. IV Всерос. съезда трансплантологов, посвящ. памяти акад. В.И. Шумакова, Москва, 9-10 ноября 2008 г. - М., 2008. - С. 214. Khubutiya M.Sh., Gulyaev V.A., Zhuravel' S.V., et al. Ispol'zovanie otmytykh eritrotsitov donora pecheni pri transplantatsii trupnoy pecheni [Use of washed red blood cells of a liver donor in the transplantation of cadaveric liver]. In: Tez. dokl. IV Vseross. s"ezda transplantologov, posvyashch. pamyati akad. V.I. Shumakova, g. Moskva, 9-10 noyabrya
45. g. [Abstracts of the IV All- Russian Congress of the Transplantation, dedicated to the memory of Acad. V.I. Shumakova, Moscow, Nov. 9-10 2008]. Moscow, 2008. 214 p. (In Russian).
46. Биологическая полноценность и функциональная активность клеточных компонентов крови донора органов / В.Б. Хватов, С.В. Журавель, В.А. Гуляев [и др.] // Трансплантология. - 2011. - № 4. - С.13-19. Khvatov V.B., Zhuravel' S.V., Gulyaev V.A., et al. Biologicheskaya polnotsennost' i funktsional'naya aktivnost' kletochnykh komponentov krovi donora organov [The biological usefulness and functional activity of cellular components of blood of donor of organs]. Transplantologiya. 2011; 4: 13-19. (In Russian).
47. Количественная и качественная характеристика прогениторных клеток костного мозга органных доноров / М.Ш. Хубутия, Н.В. Боровкова, И.Н. Пономарев [и др.] // Вестник трансплантологии и искусственных органов. - 2012. - Т. 14. - Прил.: VI Всероссийский съезд трансплантологов, Москва, 24-27 сентября 2012 г. - С. 295. Khubutiya M.Sh., Borovkova N.V., Ponomarev I.N., et al. Kolichestvennaya i kachestvennaya kharakteristika progenitornykh kletok kostnogo mozga organnykh donorov [Quantitative and qualitative characteristics of progenitor cells in the bone marrow organ donors]. Vestnik transplantologii i iskusstvennykh organov. 2012; 14 Suppl: VI All-Russian Congress of the Transplantation, Moscow, Sep. 24-27 2012. 295. (In Russian).
48. Использование эритроцитов доноров печени при ортотопической трансплантации трупной печени / М.Ш. Хубутия, С.В. Журавель, В.А. Гуляев [и др.] // Вестн. Рос. военно-мед. академии. - 2014. - № 4 (48). - С. 152-157. Khubutiya M.Sh., Zhuravel' S.V., Gulyaev V.A., et al. Ispol'zovanie eritrotsitov donorov pecheni pri ortotopicheskoy transplantatsii trupnoy pecheni [The use of red blood cells in the donor liver transplantation of cadaveric orthotopic liver]. Vestn. Ross. voenno-med. akademii. 2014; 4 (48): 152-157. (In Russian).
Об изменениях крови в области трупных пятен при насильственной и скоропостижной смерти
библиографическое описание:
Об изменениях крови в области трупных пятен при насильственной и скоропостижной смерти / Бакулев С.Н. // Судебно-медицинская экспертиза. — М., 1966. — №3. — С. 3-6.
код для вставки на форум:
В судебномедицинской экспертизе определение давности смерти связано с процессом формирования трупных пятен. Однако пока все еще точно не выяснено, какие изменения претерпевает кровь в капиллярах и мелких сосудах трупных пятен.
Изменения в развитии трупных пятен одни авторы объясняют быстро начинающимся гемолизом эритроцитов и имбибицией гемоглобином тканей (М.И. Авдеев, А.И. Абрикосов, А.И. Струков, Н.В. Попов, Э. Кноблох; Prokop, и др. ), другие — первоначальным сгущением трупной крови и явлениями стаза, а затем и ее гемолизом (М.И. Райский, Ю.С. Сапожников, С.Н. Бакулев, К.И. Татиев).
Материалы, которые мы получили при исследовании трупной крови, с нашей точки зрения, являются ценными и могут быть использованы при определении давности смерти.
Исследование трупных пятен мы проводили в динамике, на одном и том же трупе, начиная с первых часов после смерти до 2 и более суток, через каждые 2—4 часа. Кровь для исследования брали не только из крупных кровеносных сосудов, но и непосредственно из трупных пятен путем надреза кожи в местах наибольшей их выраженности. Мы определяли: количество гемоглобина гемометром Сали, число эритроцитов в камере Горяева, объемные соотношения плазмы и форменных элементов с помощью гематокрита, осмотическую резистентность эритроцитов с помощью гипотонических растворов поваренной соли.
Было исследовано 242 трупа (177 мужчин и 65 женщин) лиц, умерших в возрасте от 12 до 65 лет. Наблюдения на каждом трупе производили от 2 до 6—8 раз; всего выполнено 962 исследования. В 135 случаях причиной смерти была асфиксия, в 33 — травма, в 74 — скоропостижная смерть.
Асфиксия в ряде случаев была механической, в основном от повешения, токсическая, преимущественно от отравления алкоголем, и от поражения электрическим током. Часть травм сопровождалась наружным и внутренним кровотечением. Скоропостижная смерть была в основном обусловлена сердечно-сосудистыми заболеваниями (общий атеросклероз с кровоизлияниями в мозг, коронарокардиосклероз, инфаркт миокарда). Во всех случаях смерть наступала быстро на месте происшествия. При вскрытии трупов кровь в полостях сердца и крупных кровеносных сосудах была несвернувшейся.
Наши наблюдения показали, что как при асфиксии, так и при указанных видах скоропостижной смерти в развитии трупных пятен по срокам особой разницы нет, а изменения в трупной крови одинаковые.
При травмах, сопровождавшихся наружным и внутренним кровотечением, отмечалось лишь в первые часы некоторое замедление в сроках появления и развития трупных пятен. Через 6—8 часов после смерти изменения в трупной крови носили такой же характер, как и при других видах смерти.
Через 2 часа после смерти трупные пятна заметны в виде бледного синевато-красного окрашивания в области спины и особенно поясницы. При давлении динамометром силой 100 г они моментально исчезают, вновь восстанавливаясь через 5—10 сек. Кровь из разреза кожи в области поясницы выступает медленно, гемоглобина в ней 85—90 ед. (14, 1—15 г%), эритроцитов 4 500 000—5 000 000. Гематокритный показатель 45—50 мм. Столбик плазмы бесцветный.
Через 4 часа после смерти трупные пятна уже хорошо выражены, синевато-красного цвета, разлитые; при давлении силой 0, 5 кг они исчезают, вновь восстанавливаясь через 30 сек. Кровь из разреза кожи в области поясницы вытекает довольно обильно. Гемоглобина в ней 95—100 ед. (16—16, 7 г%), эритроцитов 5500000—6500000. Показатель гематокрита 40—45 мм. Столбик плазмы бесцветный.
Через 6—8 часов после смерти трупные пятна обильные, багрово-синюшного цвета, исчезают при давлении силой 2 кг, вновь восстанавливаясь через 1—2 мин. Кровь из разреза кожи на пояснице вытекает свободно. Гемоглобина 110—115 ед. (18, 3—19, 2 г%), эритроцитов 6 000 000—7 000 000. Показатель гематокрита 40—35 мм. Столбик плазмы бесцветный.
Через 10—12 часов после смерти трупные пятна багрово-фиолетового цвета, обильные, при давлении силой 3—4 кг в течение 10 сек. они исчезают, восстанавливаясь через 5—8 мин. Кровь из разреза кожи вытекает свободно. Гемоглобина 115—125 ед. (19, 2—20, 6 г%), эритроцитов 7 500 000—8 000 000. Показатель гематокрита 32—30 мм. Столбик плазмы бесцветный.
Через 14—16 часов после смерти трупные пятна обильные, багрово-фиолетового цвета, при давлении силой 4 кг в течение 10 сек. исчезают, вновь восстанавливаясь через 8—10 мин. Кровь из разреза вытекает достаточно хорошо. Гемоглобина 125—135 ед. (20, 6—22, 5 г%), эритроцитов 8 000 000—8 500 000. Показатель гематокрита 26—24 мм. Столбик плазмы бесцветный.
Через 18—20 часов после смерти количество трупных пятен и интенсивность их окраски уже не изменяются, при давлении силой 4 кг в течение 10 сек. они бледнеют и даже исчезают, вновь восстанавливаясь через 15 мин. Кровь из разреза выступает медленно. Гемоглобина 128— 135 ед. (21, 3—22, 5 г%), эритроцитов 8 200 000—8 700 000. Показатель гематокрита 24 мм. Столбик плазмы бесцветный.
Через 22—24 часа после смерти трупные пятна обильные, багрово-фиолетового цвета, при давлении силой 4 кг в течение 10 сек. бледнеют, при удлинении срока давления даже исчезают, вновь восстанавливаясь через 15—25 мин. Кровь из разреза выступает капельками медленно. Гемоглобина 135—140 ед. (22, 5—23, 3 г%), эритроцитов 8 500 000—8 800 000. Показатель гематокрита 22—20 мм. Столбик плазмы бесцветный, очень редко бледно-розоватый.
Через 48 часов после смерти трупные пятна внешне не изменяются по количеству и интенсивности окраски, однако иногда приобретают либо буроватый, либо светло-красный цвет в зависимости от температуры окружающей среды. При давлении силой 4 кг в течение 10 сек они умеренно бледнеют, вновь не восстанавливаясь даже через 4 часа. Кровь из разреза кожи не всегда удается получить. На краю разреза, иногда только после давления на кожу, отступя 1—2 см от его края, выступают капельки дегтеобразной консистенции. Гемоглобина 145—150 ед. (24, 2—25 г%), эритроцитов 9 000 000—10 000 000. Показатель гематокрита 20—15 мм. Столбик плазмы бесцветный, иногда красноватого цвета.
Все данные о количестве гемоглобина и эритроцитов и показания гематокрита по часам мы обработали методом вариационной статистики. Цифровые данные представлены в средних М±m. Вычислено среднее квадратичное отклонение (?), показатель существенной разницы (t), значение вероятности различия (P). Различие расценивалось как достоверное, начиная со значения Р
Свойства трупной крови. Местные особенности трупной крови
Кафедра фармации Майкопского государственного технологического университета, Майкоп, Россия, 385000
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Россия, Институт фармации, кафедра фармацевтической технологии, Москва, Россия
Определение оланзапина в трупной крови и ткани печени
Журнал: Судебно-медицинская экспертиза. 2014;57(4): 40‑43
Карташов В.А., Чернова Л.В. Определение оланзапина в трупной крови и ткани печени. Судебно-медицинская экспертиза. 2014;57(4):40‑43.
Kartashov VA, Chernova LV. Determination of olanzapine in cadaveric blood. Sudebno-Meditsinskaya Ekspertisa. 2014;57(4):40‑43. (In Russ.).
Приведены экспериментальные данные о выделении оланзапина из биологических объектов. Подробно описана методика экстрагирования оланзапина из трупной крови с использованием одного из амфифильных растворителей - ацетона, экстракционной очистки и ТСХ-скрининга. После хроматографирования и элюирования оланзапина количественное определение проводили методом УФ-спектрофотометрии. Показано, что при одноступенчатом экстрагировании из трупной крови по предлагаемой методике в среднем определяется 55% оланзапина. Методика апробирована при исследовании печени и крови лабораторных животных (крыс) и может быть рекомендована для исследований в химико-токсикологической лаборатории.
Оланзапин - представитель атипичных антипсихотических лекарственных средств нового поколения. Он обладает рядом преимуществ перед типичными нейролептиками. Применяется для лечения больных шизофренией, при психических расстройствах с различной симптоматикой, для купирования острых маниакальных приступов и психомоторного возбуждения. Препарат обладает высокой фармакотерапевтической активностью. Оланзапин оказывает побочные действия, приводящие к отравлениям, часто заканчивающимся летальным исходом. Описано большое количество передозировок и смертных случаев, причиной которых явился оланзапин 2. При интоксикациях оланзапином клиническая и патоморфологическая картина не характерны. Для установления причины отравления значение имеют результаты химико-токсикологического (судебно-химического) анализа. В настоящее время методы выделения оланзапина из биологических объектов, очистки, идентификации и количественного определения разработаны недостаточно.
Цель исследования - разработка методики определения оланзапина в трупной крови и ткани печени для использования в химико-токсикологическом анализе.
1. Определение оланзапина в трупной крови. В результате предварительных экспериментов были получены спектры абсорбции оланзапина, максимальное поглощение которого в этаноле наблюдалось при длинах волн 225 и 271 нм (последнюю длину волны выбрали в качестве аналитической). При использовании этанольных растворов 3 разных концентраций оланзапина в 3 повторностях установлена линейность УФ-спектрофотометрического определения, которая соблюдалась в пределах 2-15 мкг оланзапина в 1 мл раствора (длина волны 271 нм). При проведении ТСХ-скрининга [6] оланзапин попадает во ІІ хроматографичесую группу с индексом удерживания, равным 0,34±0,016. Определены потери оланзапина при хроматографировании и элюировании, которые составили около 7%.
Теоретические и экспериментальные исследования, проведенные ранее В.А. Карташовым [7] и Л.В. Черновой [8], показали преимущества амфифильных растворителей (метанол, этанол, ацетон, ацетонитрил и др.) для экстрагирования из биологического материала ряда веществ кислотного и основного характера. В связи с этим при выделении оланзапина из биологических объектов использовали ацетон как наиболее доступный, дешевый и менее токсичный (по сравнению с ацетонитрилом) растворитель.
Методика. По 5 г трупной крови помещали в пенициллиновые флаконы вместимостью 20 мл и добавляли по 0,5 мл рабочего стандартного образца, содержащего 400 мкг оланзапина в 1 мл раствора (к контрольным образцам печени добавляли 0,5 мл воды). Проводили по 5 параллельных и одному контрольному опыту. Содержимое флаконов перемешивали на аппарате для встряхивания при 70 колебаний в 1 мин в течение 2 ч при комнатной температуре. Далее в каждый флакон добавляли 10 мл ацетона и экстрагировали путем перемешивания на аппарате для встряхивания при 150 колебаний в 1 мин в течение 10 мин. В каждом случае ацетоновый экстракт отделяли от ткани центрифугированием при 2000 об/мин, фильтровали через небольшой ватный тампон в пенициллиновый флакон и выпаривали на водяной бане при температуре 40 °С и слабом потоке воздуха до удаления растворителя. К остатку во флаконе добавляли по 5 мл 0,1 н. раствора соляной кислоты и диэтилового эфира, содержимое тщательно встряхивали в течение 2 мин.
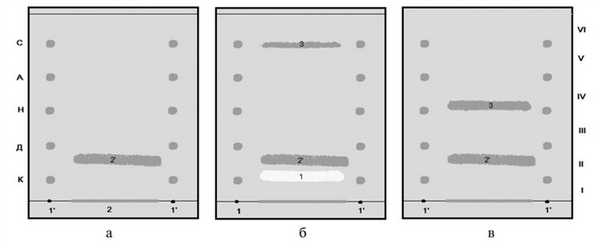
После разделения фаз отделяли водную фазу, подщелачивали раствором гидроксида аммония до рН 9 и экстрагировали 5 мл хлороформа. Хлороформный слой отделяли, выпаривали, сухой остаток растворяли в небольшом количестве хлороформа и количественно в виде полосы наносили на стартовую линию пластины Сорбфил. Хроматографирование проводили в системе ацетон параллельно со смесью 5 метчиков в камере, не насыщенной парами растворителя. Оказалось, что оланзапин, выделенный из крови, имеет такие же хроматографические характеристики, как стандартный образец оланзапина (рис. 1, а). Рисунок 1. Рис. 1. Хроматограммы оланзапина, выделенного из трупной крови (а), печени (б) и крови крысы (в).
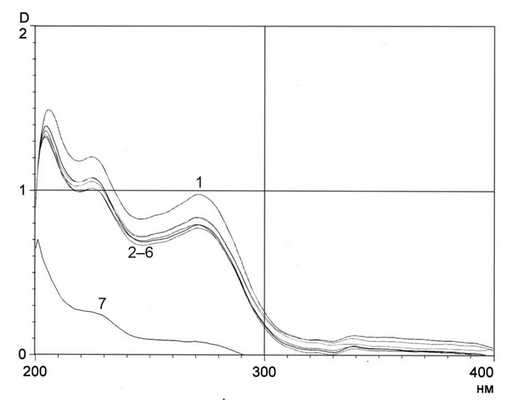
После хроматографирования оланзапин, обнаруженный с помощью реактива Драгендорфа, элюировали путем экстракции хлороформом из щелочной среды. Остаток после удаления хлороформа растворяли в 10 мл этанола, раствор спектрофотометрировали в диапазоне 200-400 нм (раствор сравнения - этанол). Полученные спектральные кривые (рис. 2, кривые 2-6) Рисунок 2. Рис. 2. Спектры абсорбции стандартного образца оланзапина (1), оланзапина, выделенного из трупной крови (2-6), контрольной пробы (7). соответствовали стандартному раствору оланзапина (см. рис. 2, кривая 1).
Количественное определение оланзапина проводили согласно стандарту. Использовали величины оптических плотностей, измеренных при длине волны 271 нм (максимум поглощения оланзапина). Данные экспериментов показали, что при одноступенчатом экстрагировании в трупной крови определяется в среднем 55% оланзапина (см. таблицу).
2. Определение оланзапина в крови и печени лабораторных животных. Для апробации разработанной методики выполнили эксперименты на лабораторных животных. Использовали 3 беспородные лабораторные крысы, каждой из которых с помощью зонда в желудок вводили суспензию таблеточной массы, содержащей 50 мг оланзапина. Через 1,5 ч крыс умертвили путем передозировки эфирного наркоза и вскрыли. По 5 г печени и средней пробы крови крыс исследовали по разработанной методике.
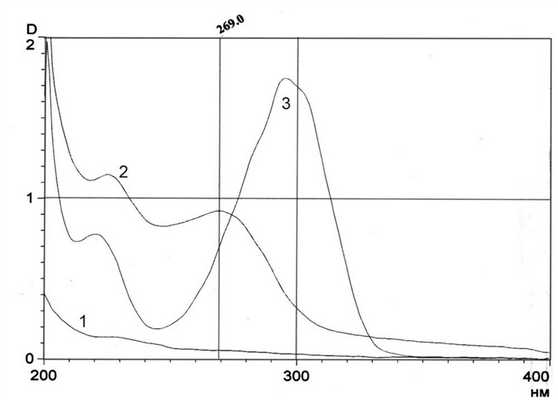
Далее провели ТСХ-скрининг экстрактов из печени и анализ хроматограмм в УФ-свете (254 нм). Обнаружили флюоресцирующую полосу в V хроматографической группе. После обработки хроматограммы реактивом Драгендорфа проявились 3 полосы желто-оранжевого цвета (см. рис. 1, б): две полосы (1, 2) во ІІ и одна (3) в V хроматографической группе (флюоресцирующая до проявления). Следует отметить, что полоса 1 во II группе через некоторое время приобрела слабую желтоватую окраску. Вещества из каждой отмеченной полосы после элюирования исследовали УФ-спектрофотометрическим методом (рис. 3). Рисунок 3. Рис. 3. Спектры абсорбции стандартного образца оланзапина (2), оланзапина, выделенного из печени крысы (3), примесного соединения (1). Оказалось, что спектр вещества полосы 2 полностью соответствует спектральной кривой оланзапина, а спектр вещества полосы 3, по-видимому, является спектром метаболита оланзапина: имеет 2 максимума поглощения, первый из которых смещен несколько гипсохромно (λ m 220 нм), а второй - батохромно (λ m 295) по сравнению с максимумами абсорбции оланзапина. Спектральная кривая вещества полосы 1, не имеющей экстремумов, и с учетом данных ТСХ-анализа, может быть отнесена к спектру примесного соединения.
При исследовании экстракта из крови крыс методом ТСХ-скрининга и рассматривании хроматограммы в УФ-свете флюоресцирующей полосы в V хроматографической группе не наблюдали. После обработки этой хроматограммы реактивом Драгендорфа обнаружили 2 полосы оранжевого цвета во ІІ и ІV группах (см. рис. 1, в). Спектральные кривые веществ после элюирования с хроматограммы приведены на рис. 3. Спектр абсорбции вещества II хроматографической группы (кривая 2) совпал со спектром оланзапина. Спектральная кривая 3 вещества IV хроматографической группы была аналогична спектру поглощения метаболита оланзапина, выделенного из печени крыс.
Следовательно, из крови и печени крыс выделены два разных метаболита, которые имеют одинаковые спектральные характеристики, но различаются по хроматографической подвижности.
Были определены количества оланзапина, выделенного из печени и крови крыс, которые составили 67,6, 109,5, 105,5 и 31,1 мкг соответственно.
Выводы
Показана возможность применения разработанной методики для экстракционного выделения оланзапина из трупных крови и ткани печени, его обнаружения и количественного определения. Методика апробирована в экспериментах на лабораторных животных и может быть рекомендована для определения оланзапина при химико-токсикологических исследованиях.
Самарский государственный медицинский университет, Самара, Россия, 443099
Кафедра токсикологической химии Пермской государственной фармацевтической академии Минздрава России, Пермь, Россия, 614070
Самарское областное бюро судебно-медицинской экспертизы, Самара, Россия, 443082
Использование некоторых судебно-биохимических показателей трупной крови при диагностике летальных отравлений
Журнал: Судебно-медицинская экспертиза. 2019;62(5): 43‑46
Цель работы — разработка математических моделей, позволяющих на основе судебно-биохимических показателей крови проводить диагностику отравлений основными группами токсикологически важных веществ. Наиболее информативными судебно-биохимическими показателями трупной крови для выявления летальных отравлений являются содержание мочевины, общего белка и отношение количества мочевины и креатинина. Математические модели отравлений могут быть использованы для диагностики отравлений наркотическими средствами, психотропными веществами и суррогатами этилового спирта.
Расширение перечня токсикологически важных веществ, особенно наркотических средств (НС) и психотропных веществ (ПВ), требует высокого уровня материально-технического и методического обеспечения судебно-химических исследований либо применения в экспертной практике альтернативных диагностических параметров, позволяющих на этапе предварительного анализа (скрининг) устанавливать летальные отравления.
В качестве дополнительных параметров диагностики отравлений следует рассматривать судебно-биохимические показатели.
Особое значение судебно-биохимические исследования приобретают при установлении причин смерти в случаях, когда морфологические проявления в исследуемых объектах отсутствуют, концентрация токсикологически важных веществ не соответствует диапазонам токсической и летальной либо информация по диапазонам этих концентраций недоступна для судебно-медицинского эксперта [1, 2].
В ряде работ показана высокая эффективность судебно-биохимических методов исследования в решении экспертных задач для ряда причин смерти, в том числе отравлений, разработаны объективные критерии, позволяющие по биохимическим показателям трупного материала (кровь, ткани) подтвердить причину смерти [3—8].
Цель исследования — разработка математических моделей, позволяющих на основе судебно-биохимических показателей крови проводить диагностику отравлений основными группами токсикологически важных веществ.
Материал и методы
Сбор данных производили в судебно-биохимическом отделении Самарского областного бюро судебно-медицинской экспертизы. Исследовали показатели 423 образцов трупной крови лиц, умерших от различных причин.
В отобранных образцах крови определяли следующие судебно-биохимические показатели: в цельной крови — содержание глюкозы (ферментативный фотометрический метод), мочевины (фотометрический метод, основанный на взаимодействии с диацетилмонооксимом), креатинина (фотометрический метод, основанный на взаимодействии с пикриновой кислотой в щелочной среде), активность холинэстеразы (метод Хестрина в модификации Б.Ф. Коровкина); в сыворотке крови — количество общего белка (биуретовый метод), молекул средней молекулярной массы (средние молекулы) — простых и сложных пептидов, гликопептидов, нуклеопептидов, являющихся вторичными эндогенными токсинами (УФ-спектрофотометрия) [9].
Умерших мужчин было 69,3%, женщин — 30,7%, из них 5,4% — лица моложе 25 лет, 33,8% — молодого возраста, 36,2% — зрелого возраста, 16,3% — пожилого возраста, 7,6% — старческого возраста и 0,7% — долгожителей (90 лет и старше).
По характеру причины смерти выделили 5 групп летальных отравлений: 1-я группа — отравление НС и ПВ, 2-я — отравление этиловым спиртом, 3-я — отравление суррогатами этилового спирта, 4-я — отравление уксусной кислотой и 5-я группа — отравление оксидом углерода (II). В двух группах умерших причина смерти не была связана с наличием в крови токсикологически важных веществ: 6-я группа (контрольная) — механическая травма, 7-я группа — другие причины (сердечно-сосудистые заболевания, пневмония, утопление и др.).
Для статистической обработки данных применяли дискриминантный анализ: выявляли отличие значений судебно-биохимических показателей в указанных группах. Оценивали значимость изученных показателей для дискриминации (разделение на группы), получали математические модели (классификационные функции) для каждой причины летального отравления и характеризовали корректность классификации. Уровень значимости p (приемлемая граница статистической значимости) для F-критерия считали равным 0,05.
Для статистического анализа использовали программу Statistica 6.0 (Statsoft Inc., USA) [10].
Результаты и обсуждение
Значения судебно-биохимических показателей трупной крови объединили в табл. 1 и использовали для создания моделей причины смерти.
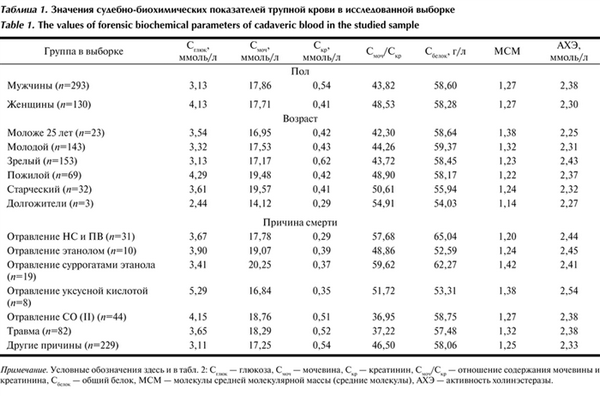
Таблица 1. Значения судебно-биохимических показателей трупной крови в исследованной выборке
При проведении дискриминантного анализа в качестве группирующей переменной использовали параметр «причина смерти», а независимыми переменными являлись судебно-биохимические показатели трупной крови. В дополнение к абсолютным показателям (содержание глюкозы, мочевины, креатинина, общего белка, активность холинэстеразы и уровень средних молекул) применяли относительный показатель — отношение содержания мочевины и креатинина.
В ходе вычислений получили следующие результаты: значение λ Уилкса 0,823; приближенное значение F-критерия (42, 1926) 1,958; для F-критерия p0,0003.
Значение λ Уилкса ближе к 1 свидетельствует о невысоком уровне дискриминации (разделения) выборки на группы по параметру «причина смерти».
В табл. 2 приведены значения λ Уилкса, являющиеся результатом исключения соответствующей переменной (судебно-биохимический показатель) из модели. Чем больше значение λ Уилкса, тем более желательно присутствие этой переменной в процедуре дискриминации.
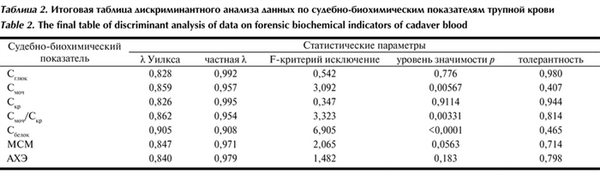
Таблица 2. Итоговая таблица дискриминантного анализа данных по судебно-биохимическим показателям трупной крови
Частная λ характеризует единичный вклад соответствующей переменной в разделительную силу модели. Чем меньше значение частной λ, тем более ценным является данный показатель.
Таким образом, наибольший вклад в дискриминацию групп вносят следующие судебно-биохимические показатели: содержание мочевины и общего белка и отношение содержания мочевины и креатинина.
Толерантность является мерой избыточности переменной в модели. Переменные с толерантностью менее 0,01 малоинформативны для соответствующей модели и в нее не включаются. Из данных табл. 2 видно, что все переменные имеют высокие значения толерантности, что свидетельствует об отсутствии тесной взаимосвязи изученных судебно-биохимических показателей между собой. Наименьшие значения толерантности у показателей содержания общего белка и мочевины, следовательно, эти переменные несут малую дополнительную информацию.
Для каждой причины летального отравления, а также для групп с другими причинами смерти и механической травмой получили классификационные функции, являющиеся линейными комбинациями наблюдаемых значений судебно-биохимических показателей:
Отравление НС и ПВ:
Отравление этиловым спиртом:
Отравление суррогатами этилового спирта:
Отравление уксусной кислотой:
Отравление оксидом углерода (II):
Исходную выборку данных изученных показателей следует считать «обучающей выборкой», а полученные математические модели необходимы для прогнозирования летальных отравлений на основе судебно-биохимических показателей для новых случаев.
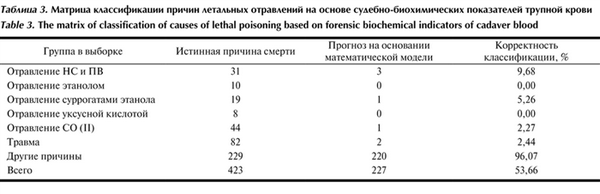
Для проверки корректности дискриминантного анализа необходима оценка матрицы классификации (табл. 3). Таблица 3. Матрица классификации причин летальных отравлений на основе судебно-биохимических показателей трупной крови Общее значение корректности классификации с помощью полученных моделей составляет 53,66%. Наибольшее количество правильно классифицированных причин смерти относится к группе «другие причины», что позволяет однозначно дифференцировать данную группу и группы отравлений.
Среди летальных отравлений наиболее эффективно выявляются отравления НС, ПВ (9,68%) и суррогатами этилового спирта (5,26%); практически не выявляются отравления этиловым спиртом и уксусной кислотой.
Заключение
В результате исследований установили, что наиболее информативными судебно-биохимическими показателями трупной крови для выявления летальных отравлений являются содержание мочевины, общего белка и отношение количества мочевины и креатинина. Получены математические модели — классификационные функции отравлений основными группами токсикологически важных веществ, которые могут быть использованы как дополнительный параметр при диагностике отравлений наркотическими средствами, психотропными веществами и суррогатами этилового спирта.
Судебно-медицинская характеристика и оценка посмертных изменений. Глава VI. Жировоск (сапонификация трупа).
Сапонификация трупа (жировоск, трупный воск, омыление трупа, adipocera) - гидролитическое расщепление жира, содержащегося в тканях трупа, с последующим его окислением и образованием солей (мыл) жирных кислот. Один из видов естественной консервации трупов, развивающийся при их пребывании во влажной среде c низким уровнем аэрации.
Жировоск может также развиваться у погибших плодов, которые после посмертно длительно оставались в полости матки, а также в тех случаях, когда погибший при внематочной беременности плод продолжительное время (до нескольких месяцев) находился в брюшной полости.
Образование жировоска нередко наблюдаются при пребывании трупов в увлажненной почве и в воде, захоронении в глинистых почвах, характеризующихся недостаточным притоком воздуха, высоком уровнем стояния и застоем почвенной воды. В подобных условиях гнилостные процессы постепенно останавливаются, развивается мацерация кожных покровов трупа с последующей отслойкой эпидермиса.
Через лишенную эпидермиса кожу ткани и органы трупа диффузно пропитываются водой, в присутствии которой начинается гидролитическое расщепление содержащегося в тканях трупа жира, приводящее к его распаду на глицерин и свободные жирные кислоты.
При температуре 18 - 20ºС растворимость жиров в воде незначительная, что обусловливает незначительную степень гидролиза жиров и, соответственно, низкую скорость образования жировоска. Небольшое каталитическое воздействие на процесс гидролиза оказывают сопутствующие жирам фосфолипиды, моноглицериды и некоторые другие соединения. Гидролиз жира ускоряется при повышении температуры.
По мере гидролитического распада жира происходит освобождение обладающих неприятным запахом летучих низкомолекулярных жирных кислот (масляной, капроновой, валериановой и т.п.).
Накоплению жирных кислот сопутствует происходящий прирост неполных глицеридов - моно- и диглицеридов, а также продуктов частичного гидролиза фосфатидов.
Образующиеся в ходе неферментативного гидролиза свободные жирные кислоты легко окисляются с образованием высокоактивных перекисных соединений, преимущественно гидроперекисного типа, которые вскоре распадаются с образованием промежуточных (спиртов, альдегидов, кетонов) и вторичных продуктов окисления (окси-, полиокси-, эпокси- и дикарбонильных соединений) обладающих резким неприятным запахом. Накопление оксикислот (например, диоксистеариновой) придает жиру более плотную консистенцию и повышает его температуру плавления.
Процесс окисления липидов ускоряют производные миоглобина — гемовые пигменты мышечной ткани, которые проявляют свою активность даже при 0 °С. Выраженным каталитическим действием обладают ионы тяжелых металлов.
Окисление липидов приводит к изменению в соотношении содержания жирных кислот. Снижается уровень низкомолекулярных и ненасыщенных кислот, увеличивается относительное количество олеиновой, стеариновой и пальмитиновой кислот. Последние вступают во взаимодействие с солями щелочных и щелочноземельных металлов (преимущественно натрия, калия, кальция и магния), которые практически всегда находятся в окружающей труп среде, что приводит к образованию солей (мыл) жирных кислот, которые являются составной частью жировоска.
Натриевые соли образуют твердые мыла, а калиевые соли — жидкие мыла.
Омыленные жиры из-за разрушения содержащихся в них пигментов обесцвечены, содержат токсические продукты распада, придающие им антисептические свойства и препятствующие развитию микроорганизмов.
Сапонификация вначале происходит в подкожно-жировой клетчатке живота, молочных желез, ягодиц, конечностей и постепенно распространяется в глубину, охватывая все мышцы и внутренние органы, развиваясь в переднем средостении, вилочковой железе, воротах печени, перикарде, жировом костном мозге.
Внешний вид трупа в состоянии жировоска определяется условиями, в которых находился труп. При судебно-медицинской экспертизе трупов, находящихся в состоянии сапонификации необходимо учитывать, что омыление жировой ткани приводит увеличением ее объема и плотности, в результате чего отмечается увеличение массы трупа и увеличение (порой значительное) его объема, что затрудняет проведение его идентификации.
При пребывании трупа во влажных почвах внешние очертания тела, а также волосяной покров обычно сохранены. При исследовании волосы легко отделяются от кожи без повреждения волосяных фолликулов. Черты лица значительно искажены, что затрудняет идентификацию умершего.
Поверхность тела покрыта легко соскабливающимися, неплотно прилежащими жирными чешуйками серовато-белого цвета, внешне и на ощупь напоминающими стеарин.
При отложении известковых солей поверхность трупа приобретает серовато-бурую окраску, местами с белесоватыми вкраплениям.
На трупах, у которых жировоск образовался во время пребывания в воде, отсутствуют волосы, а также, на некоторых участках тела, — кожный покров Отдельные части тела (конечности, голова) могут быть отделены от туловища. На конечностях мягкие ткани могут полностью либо частично отсутствовать с обнажением костей конечностей, суставные сумки и надкостница нередко отсутствуют, через секционные разрезы легко извлекаются отдельные кости.
Рис. Труп в состоянии жировоска
От поверхности и полостей трупа, находящегося в состоянии сапонификации, исходит резкий, неприятный прогорклый запах.
Кожа в состоянии жировоска мелкозернистая или крупнобугристая, с ее поверхности легко отделяются волосы. Подкожно-жировой слой изменен, плотный, четко контурируемые жировые дольки придают ему бугристый вид.
Цвет кожного покрова и тканей, находящихся в состоянии жировоска во многом определяется от условий образования жировоска и хранения трупа, а также от минерального состава почвы.
При соединении жирных кислот с солями щелочных металлов — натрием и калием образуется студневидный, грязно-серого цвета жировоск
Если происходит соединение жирных кислот с солями щелочноземельных металлов (кальцием и магнием), то формируется плотный, серовато-белого цвета, с выраженным сальным блеском жировоск, имеющий неприятный запах прогорклого сала.
При пребывании трупа в воде его кожный покров и подкожно-жировая клетчатка в состоянии жировоска имеет серо-белый или серо-желтый цвет. Если сапонификация происходила при нахождении трупов в глинистых почвах — желтовато-коричневатый цвет, а после пребывания тела в черноземе ткани трупа под воздействием гуминовых кислот приобретают серовато-бурый, темно-коричневый либо черный цвет.
Если перед образованием жировоска ткани подвергались частичному гниению, то верхние слои жировоска могут иметь зеленоватый цвет, который в дальнейшем может исчезать.
Следует учитывать, что одежда, находящаяся на теле под действием влаги и омыленных продуктов, может линять, окрашивая поверхность трупа.
Ткани трупа в состоянии жировоска умерено твердые на ощупь, легче воды, с некоторым усилием режутся ножом, оставляют на бумаге жирные отпечатки. При воздействии высокой температуры легко плавятся, а в высохшем состоянии горят ярким пламенем. Кусочки сапонифицированных мягких тканей при погружении в спирт, эфир, или хлороформ, полностью растворяются (за исключением соединительно-тканных волокон, выпадающих в осадок).
Мышечная ткань резко уменьшена в объеме, во многих местах не определяется, на месте мышц часто видны полости различных форм.
Внутренние органы уменьшены в размерах, имеют студневидную плотность, либо обнаруживаются в виде комков воскообразной массы. Нередко паренхима внутренних органов вязкая, слизеобразный консистенции, с резким гнилостным запахом.
При изменении условий захоронения, например при эксгумации, жировоск достаточно быстро высыхает с образованием на поверхности упругой пленки. В дальнейшем жировоск затвердевает, легко крошится, достаточно медленно подвергаясь гнилостным воздействиям.
Высыхание жировоска на воздухе происходит вследствие окислительной полимеризации составляющих его полиненасыщенных жирных кислот и образования оксинов. Выражено ускоряют этот процесс ультрафиолетовые лучи и повышенная температура, преимущественно в интервале 40 — 45ºС.
По степени выраженности на трупе жировоска можно ориентировочно судить о давности погребения.
Отчетливо различаемый жировоск местами образуется на трупе уже в первые месяцы после захоронения. Полное превращение трупов в жировоск происходит в среднем через 10 - 12 месяцев и более.
Скорость образования жировоска зависит от влажности, химического состава почвы, в которой пребывает труп, а также индивидуальных особенностей телосложения и характера одежды умершего. Достаточно быстро подвергаются омылению трупы тучных людей, а также трупы лиц, одетых в хорошо впитывающую влагу толстую одежду.
Высокая температура интенсифицирует процесс сапонификации. Так, в тропических условиях уже спустя несколько дней после смерти некоторые части трупа могут находиться в состоянии жировоска. В теплом и тропическом климате сапонификация трупа может полностью завершиться уже через 3 — 6 месяцев.
Относительно быстро развивается жировоск на трупах новорожденных. Первые признаки сапонификации отмечаются уже через 3 — 4 недели, а через 4 — 5 месяцев труп полностью может перейти в это состояние. Во многом это обусловлено составом подкожной жировой клетчатки новорожденного, которая содержит относительно большее количество пальмитиновой и стеариновой кислот.
В связи с тем, что процессу сапонификации предшествует гниение тканей, то при гистологическом исследовании можно различить только те структурные элементы, которые превратилась в жировоск.
При гистологическом исследовании тканей, находящихся в состоянии жировоска, частично можно различить строение кожи, подкожно-жировой клетчатки, стенки артерий, частичное строение скелетных мышц, а во внутренних органах - только соединительно-тканную строму. Структурные элементы и паренхима внутренних органов в состоянии жировоска при гистологическом исследовании не определяются. Органную принадлежность ткани можно определить по направлению соединительно-тканной стромы и крупных сосудов.
Эритроциты не сохраняются, может обнаруживаться грибковая флора в виде округлых безъядерных клеток, расположенных по одиночке или в виде цепочек, которые окрашиваются эозином в розовый цвет, напоминают эритроциты, однако больше их по размеру.
Эпидермис практически полностью отсутствует, поверхность собственно кожи представлена неровно-волнистой линией, в которой могут наблюдаться малозаметные очертания сосочков…
Клеточные элементы в собственно коже и подкожной клетчатке отсутствуют, ядра соединительно-тканых клеток, эпителиальных, потовых и сальных желез, эндотелия сосудов не определяются.
Могут определятся контуры волосяных сумок и сальных желез, соединительно-тканные стромальные элементы, а также очертания сосудов артериального типа Коллагеновые волокна, набухшие, гомогенизированные, сливаются друг с другом, образуя толстые пучки.
Подкожно-жировая клетчатка спаяна в виде единого конгломерата, местами различимы рыхло распространяющиеся тонкие коллагеновые волокна.
Мышечные клетки лишены поперечной исчерченности, ядра отсутствуют, цитоплазма в виде мелкозернистой массы. Большей частью очертания мышечных волокон не видны, миоциты определяются в виде клеточных теней, отмечается лишь соединительно-тканная строма мышечной ткани.
В отдельных полях зрения видны артерии, интима кровеносных сосудов не определяется, в их просвете видны гомогенные массы красно-бурого цвета. Контуры вен и капилляров определяются неотчетливо.
Судебно-медицинское исследование трупа, находящегося в состоянии жировоска позволяет установить обстоятельства, в которых он находился, ориентировочный срок пребывания трупа в условиях нахождения, а также обнаружить следы ранее причиненных повреждений. Пропитанные кровью ткани обнаруживаются в виде масс красно-бурого цвета сохранивших форму повреждений и внешне напоминающих пигментные пятна, интенсивность окраски которых убывает по направлению от центра к периферии.
В случаях огнестрельных ранений на трупах, находящихся в состоянии жировоска нередко сохраняются контуры раневых отверстий. Дополнительные факторы выстрела вследствие происходящего при сапонификации отслоения эпидермиса обнаруживаются не всегда, однако в начальных отделах раневого канала можно обнаружить копоть и, в некоторых случаях, зерна пороха. Следует учитывать, что пороха при длительном нахождении в воде и влажных условиях разрушаются, что, в зависимости от длительности нахождения трупа в условиях повышенной влажности, затрудняет либо делает невозможным их выявление.
Достаточно хорошо в состоянии жировоска сохраняются те участки кожи, которые до начала сапонификации подвергались действию высокой температуры.
Однако следует учитывать, что возможности макроскопической диагностики во время исследования сапонифицированного трупа в ряде случаев являются весьма ограниченными. Причиной этого служит, с одной стороны, происходящее вследствие хрупкости жировоска разрушение имеющихся на трупе признаков повреждений, а также в результате образования артефактов, имитирующих некоторые признаки повреждений.
Тот факт, что в жировоске долгое время могут сохраняться и выявляться некоторые яды, например алкоголь а также соли тяжелых металлов, делает возможным проведение судебно-химического исследование тканей и органов трупа.
Врач судебно-медицинский эксперт, доцент кафедры судебной медицины Российского национального исследовательского медицинского университета им. Н.И. Пирогова Минздрва России, кандидат мед. наук, доцент Туманов Э.В. Туманов Э.В., Кильдюшов Е.М., Соколова З.Ю. Судебно-медицинская танатология — М.: ЮрИнфоЗдрав, 2011. — 172 с.
Читайте также:
