Тактика при интенсивных болях инфаркта миокарда. Восстановление перфузии ишемизированной зоны миокарда.
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Российский кардиологический научно-производственный комплекс Минздрава РФ, Москва
Сегодня инфаркт миокарда (ИМ) остается таким же серьезным заболеванием, как и несколько десятилетий назад. Вот только один из примеров, доказывающих тяжесть этой болезни: около 50% больных умирают до того, как успевают встретиться с врачом. Вместе с тем совершенно очевидно, что риск ИМ для жизни и здоровья стал значительно ниже. После того, как 35 лет назад были разработаны основные принципы палат интенсивного наблюдения за коронарными больными и эти палаты начали реально работать в практике здравоохранения, существенно повысилась эффективность лечения и профилактики нарушений ритма и проводимости сердца больных ИМ и снизилась госпитальная летальность. В 70-е годы она составляла более 20%, однако в последние 15 лет, после того как была доказана роль тромбоза в патогенезе острого ИМ и показано благоприятное влияние тромболитической терапии, в целом ряде клиник летальность сократилась в 2 раза и более. Надо сказать, что основные принципы и рекомендации по лечению острого ИМ, впрочем, как и для большинства других серьезных патологий, основываются не только на опыте и знаниях отдельных клиник, направлений, школ, но и на результатах крупных многоцентровых исследований, подчас проводящихся одновременно во многих сотнях больниц в разных странах мира. Конечно, это позволяет врачу в стандартных клинических ситуациях быстрее находить правильное решение.
Основными задачами лечения острого ИМ можно назвать следующие: купирование болевого приступа, ограничение размеров первичного очага поражения миокарда и, наконец, профилактика и лечение осложнений. Типичный ангинозный приступ, развивающийся у подавляющего числа больных при ИМ, связан с ишемией миокарда и продолжается до тех пор, пока не происходит некроз тех кардимиоцитов, которые должны погибнуть. Одним из доказательств именно этого происхождения боли служит быстрое ее исчезновение, при восстановлении коронарного кровотока (например, на фоне тромболитической терапии).
Купирование болевого приступа
Сама по себе боль, воздействуя на симпатическую нервную систему, может существенно увеличивать частоту сердечных сокращений, артериальное давление (АД), а также работу сердца. Именно эти факторы обусловливают необходимость как можно быстрее купировать болевой приступ. Целесообразно дать больному нитроглицерин под язык. Это может ослабить боль в том случае, если больной не получал ранее нитроглицерин в связи с этим приступом. Нитроглицерин может быть в форме таблеток или аэрозоля. Не нужно прибегать к его применению при систолическом АД ниже 90 мм рт.ст.
Во всем мире для купирования болевого приступа используются морфин который вводят внутривенно дробно от 2 до 5 мг каждые 5-30 мин по необходимости до полного (по возможности) купирования боли. Максимальная доза составляет 2-3 мг на 1 кг массы тела больного. Внутримышечного введения морфина следует избегать, так как результат в этом случае непредсказуем. Побочные действия крайне редки (в основном, это гипотония, брадикардия) и довольно легко купируются путем придания ногам возвышенного положения, введения атропина, иногда плазмозамещающей жидкости. У пожилых людей нечасто встречается угнетение дыхательного центра, поэтому у них морфин следует вводить в уменьшенной (даже половинной) дозе и с осторожностью. Антагонистом морфина является налоксон, который также вводят внутривенно, он снимает все побочные явления, в том числе угнетение дыхания, вызванное опиатами. Не исключается применение и других наркотических анальгетиков, например промедола и иных препаратов этого ряда. Предположение о том, что нейролептанальгезия (сочетание фентанила и дроперидола) обладает рядом преимуществ, не получило клинического подтверждения. Попытки замены морфина комбинацией ненаркотических анальгетиков и нейролептиков в этой ситуации неоправданны.
Тромболетическая терапия
Основным патогенетическим методом лечения ИМ является восстановление проходимости окклюзированной коронарной артерии. Чаще всего для достижения этого используют либо тромболитическую терапию, либо механическое разрушение тромба при транслюминальной коронарной ангиопластике. Для большинства клиник нашей страны наиболее реалистично сегодня применение первого способа.
Процесс некроза развивается у человека крайне быстро и в основном заканчивается, как правило, уже через 6-12 ч от начала ангинозного приступа, поэтому чем быстрее и полноценнее удается восстановить кровоток по тромбированной артерии, тем более сохранной будет функциональная способность миокарда левого желудочка и в конечном итоге меньше летальность. Оптимальным считается начало введения тромболитических препаратов через 2-4 ч от начала болезни. Успех лечения будет большим, если удастся сократить промежуток времени до начала тромболитической терапии, что может быть осуществлено двумя путями: первый - раннее выявление и госпитализация больных в стационар и быстрое принятие решения о соответствующем лечении, второй - начало терапии на догоспитальном этапе. В наших исследованиях показано, что начало тромболитической терапии на догоспитальном этапе позволяет добиться выигрыша во времени, в среднем около 2,5 ч. Такой способ тромболитической терапии, если он проводится врачами специализированной бригады кардиологической помощи, является относительно безопасным. При отсутствии противопоказаний тромболитическую терапию целесообразно проводить всем больным в первые 12 ч болезни. Эффективность тромболитической терапии выше (снижение летальности на 42-47%), если она начата в течение 1-го часа болезни. При сроках более 12 ч применение тромболитических препаратов проблематично и должно решаться с учетом реальной клинической ситуации. Особенно показана тромболитическая терапия пожилым людям, пациентам с передним ИМ, а также в тех случаях, когда ее начинают достаточно рано. Обязательное условие для начала тромболитической терапии - наличие элеваций сегмента ST на ЭКГ или признаков блокады ножек пучка Гиса. Тромболитическая терапия не показана, если элевации сегмента ST отсутствуют, независимо от того, как выглядит конечная фаза QRS на ЭКГ - депрессии, отрицательные Т или отсутствие каких-либо изменений. Раннее начало терапии тромболитиками позволяет спасти до 30 больных из 1000 леченых.
Сегодня основным путем введения тромболитических препаратов является внутривенный. Все используемые препараты, тромболитики первого поколения, такие как стрептокиназа (1 500 000 ЕД в течение 1 ч) - урокиназа (3 000 000 ЕД в течение 1 ч), второго поколения - тканевой активатор плазминогена (100 мг болюсом плюс инфузия), проурокиназа (80 мг болюсос плюс инфузия 1 ч) - являются высокоэффективными тромболитиками.
Риск терапии тромболитиками общеизвестен - это возникновение кровотечений, из наиболее опасных - кровоизлияние в мозг. Частота геморрагических осложнений невелика, например количество инсультов при применении стрептокиназы не превышает 0,5%, а при использовании тканевого активатора плазминогена - 0,7-0,8%. Как правило, в случае серьезных геморрагий вводят свежезамороженную плазму и, конечно, прекращают введение тромболитика. Стрептокиназа может вызывать аллергические реакции, которые, как правило, удается предотвратить профилактическим введением кортикостероидов - преднизолона или гидрокортизона. Другое осложнение - гипотония, которая чаще наблюдается при использовании препаратов, созданных на основе стрептокиназы, нередко она сопровождается брадикардией. Обычно это осложнение удается купировать после прекращения инфузии тромболитика и введения атропина и адреналина, иногда требуется применение плазмозаменителей и инотропных средств. Сегодня абсолютными противопоказаниями к тромболитической терапии считаются подозрение на расслоение аорты, активное кровотечение и предшествующий геморрагический инсульт.
В среднем тромболитические препараты получает всего лишь одна треть больных ИМ, а в нашей стране эта цифра существенно ниже. Тромболитики не вводят в основном в связи с поздним поступлением больных, наличием противопоказаний или неопределенностью изменений на ЭКГ. Летальность среди больных, не получающих тромболитики, остается по-прежнему высокой и составляет от 15 до 30%.
b-адреноблокаторы
В 1-е сутки после ИМ повышается симпатическая активность, поэтому использование b-адреноблокаторов, которые снижают потребление кислорода миокардом, уменьшают работу сердца и напряжение стенки желудочка, стало обоснованием их применения у этой категории больных. Ряд крупных многоцентровых исследований, в которых изучалась эффективность внутривенного введения b-блокаторов в 1-е сутки ИМ, показал, что они снижают летальность за 1-ю неделю примерно на 13-15%. Эффект несколько выше, если лечение начинается в первые часы болезни, и отсутствует, если использовать эти препараты со 2-3-го дня заболевания. b-блокаторы уменьшают и количество повторных инфарктов в среднем на 15-18%. Механизм влияния b-блокаторов на летальность - это уменьшение случаев фибрилляции желудочков и разрывов сердца.
Лечение b-блокаторами начинают с внутривенного введения (метопролол, атенолол, пропранолол) - 2-3 раза или столько, сколько потребуется, чтобы оптимально снизить частоту сердечных сокращений. В последующем переходят на прием препаратов внутрь: метопролол 50 мг каждые 6 ч в первые 2 сут, атенолол по 50 мг каждые 12 ч в течение суток, а затем подбирают дозу индивидуально для каждого больного. Основные показания к применению b-блокаторов - признаки симпатической гиперактивности, такие как тахикардия при отсутствии признаков сердечной недостаточности, гипертония, болевой синдром, наличие ишемии миокарда. b-Блокаторы, несмотря на наличие противопоказаний к их применению, например брадикардии (число сердечных сокращений меньше 50 в 1 мин), гипотонии (систолическое АД ниже 100 мм рт.ст.), наличие блокад сердца и отека легких, а также бронхоспазма, применяются тем не менее у подавляющего числа больных ИМ. Однако способность препаратов уменьшать летальность не распространяется на группу b-блокаторов с собственной симпатомиметической активностью. Если больной начал лечиться b-блокаторами, прием препарата следует продолжать до тех пор, пока не появятся серьезные противопоказания.
Применение антиагрегантов и антикоагулянтов
Применение при остром ИМ дезагрегантов, в частности ацетилсалициловой кислоты, способствует уменьшению тромбоза, причем максимальный эффект препарата достигается достаточно быстро после приема первоначальной дозы 300 мг и стабильно поддерживается при ежедневном приеме ацетилсалициловой кислоты в небольших дозах - от 100 до 250 мг/сут. При исследованиях, проведенных у многих тысяч больных оказалось, что применение ацетилсалициловой кислоты снижает 35-дневную летальность на 23%. Противопоказана ацетилсалициловая кислота при обострении язвенной болезни, при его непереносимости, а также при бронхиальной астме, провоцируемой этим препаратом. Длительное применение препарата существенно снижает частоту повторныех инфарктов - до 25%, поэтому прием ацетилсалициловой кислоты рекомендуется на неопределенно долгое время.
Еще одна группа препаратов, воздействующих на тромбоциты, это блокаторы гликопротеина IIВ/IIIА тромбоцитов. В настоящее время известна и доказана эффективность применения двух представителей данного класса - это абсиксимаб и тирофебан. По механизму действия эти препараты выгодно отличаются от ацетилсалициловой кислоты, так как блокируют большинство известных путей активации тромбоцитов. Препараты препятствуют образованию первичного тромбоцитарного тромба, причем действие их иногда бывает достаточно продолжительным - до полугода. Мировой опыт пока еще невелик, в нашей стране работа с этими препаратами только начинается. Из антитромботических препаратов по-прежнему широко используется антикоагулянт гепарин, который в основном назначают для профилактики повторных инфарктов, для предупреждения тромбозов и тромбоэмболий. Схемы и дозы введения его хорошо известны. Дозу подбирают так, чтобы частичное тромбопластиновое время увеличилось в 2 раза по сравнению с нормой. Средняя доза - это 1000 ЕД/ч в течение 2-3 дней, подкожное введение гепарина рекомендуется при медленной активизации пациентов.
В настоящее время имеются данные об использовании низкомолекулярных гепаринов, в частности эноксипарина и фрагмина. Основные их преимущества состоят в том, что они фактически не требуют лабораторного контроля за показателями свертываемости крови и специальной аппаратуры, например инфузионных насосов, для их введения, а главное - они существенно эффективнее чем нефракционированные гепарины. Не потеряло своей значимости применение непрямых антикоагулянтов, особенно при венозных тромбозах, выраженной сердечной недостаточности, наличии тромба в левом желудочке.
Антагонисты кальция
В качестве стандартной терапии ИМ антагонисты кальция в настоящее время фактически не используются, так как не оказывают благоприятного влияния на прогноз, а применение их с научной точки зрения малообоснованно.
Внутривенное введение нитратов при ИМ в первые 12 ч заболевания уменьшает размер очага некроза, влияет на основные осложнения ИМ, включая летальные исходы и частоту развития кардиогенного шока. Применение их снижает летальность до 30% в первые 7 дней болезни, это наиболее очевидно при инфарктах передней локализации. Прием нитратов внутрь начиная с 1-х суток заболевания не приводит ни к улучшению, ни к ухудшению прогноза к 30-му дню болезни. Внутривенное введение нитратов должно быть стандартной терапией для всех пациентов, поступивших в первые часы болезни, с передним ИМ и систолическим АД выше 100 мм рт.ст. Начинают введение нитроглицерина с невысокой скоростью, например 5 мкг/мин, постепенно увеличивают ее, достигая уменьшения систолического давления на 15 мм рт.ст. У больных с артериальной гипертонией снижение АД возможно до 130-140 мм рт.ст. Как правило, терапию нитратами проводят в течение 24 ч, если не появляется необходимости продолжения этой терапии, в частности при сохраняющихся болях, связанных с ишемией миокарда, или признаках сердечной недостаточности.
Ингибиторы АПФ
В последнее десятилетие в лечении больных ИМ прочно заняла свое место большая группа ингибиторов ангиотензинпревращающего фермента (иАПФ). Это в первую очередь определяется тем, что данные препараты способны приостанавливать расширение, дилатацию левого желудочка, истончение миокарда, т.е. воздействовать на процессы, приводящие к ремоделированию миокарда левого желудочка и сопровождающиеся серьезным ухудшением сократительной функции миокарда и прогноза. Как правило, лечение иАПФ начинают через 24-48 ч от момента развития ИМ, чтобы снизить вероятность артериальной гипертонии. В зависимости от исходно нарушенной функции левого желудочка терапия может продолжаться от нескольких месяцев до многих лет. Установлено, что лечение каптоприлом в дозе 150 мг/сут у пациентов без клинических признаков недостаточности кровообращения, но при наличии фракции выброса ниже 40% существенно улучшало прогноз. В группе леченых смертность была ниже на 19%, на 22% было меньше случаев сердечной недостаточности, требовавшей лечения в условиях стационара. Таким образом, АПФ (каптоприл 150 мг/сут, рамиприл 10 мг/сут, лизиноприл 10 мг/сут и др.) целесообразно назначать большинству больных ИМ, независимо от его локализации и наличия или отсутствия сердечной недостаточности. Однако эта терапия более эффективна при сочетании клинических признаков сердечной недостаточности и данных инструментальных исследований (низкая фракция выброса). В этом случае риск летального исхода снижается на 27%, т.е. это предотвращает смертельные исходы у каждых 40 из 1000 леченых больных в течение года.
Уже во время пребывания больного в стационаре целесообразно детально исследовать его липидный спектр. Сам по себе острый ИМ несколько уменьшает содержание свободного холестерина в крови. При наличии данных о существенных изменениях этого показателя, например при уровне общего холестерина выше 5,5 ммоль/л, целесообразно рекомендовать больному не только гиполипидемическую диету, но и прием препаратов, в первую очередь статинов.
Таким образом, в настоящее время врач располагает значительным арсеналом средств, позволяющих помочь больному ИМ и свести к минимуму риск возникновения осложнений. Конечно, основной путь достижения этой цели - применение тромболитических препаратов, но вместе с тем использование b-блокаторов, аспирина, АПФ и нитратов может существенным образом повлиять на прогноз и исход заболевания.
Выбор тактики восстановления коронарного кровотока у больных инфарктом миокарда
С точки зрения патоморфологии, инфаркт миокарда (ИМ) — это гибель (некроз) кардиомиоцитов, вызванная длительной ишемией миокарда из-за нарушения коронарного кровотока. В большинстве случаев некроз сердечной мышцы имеет характер очагового поражения в облас
С точки зрения патоморфологии, инфаркт миокарда (ИМ) — это гибель (некроз) кардиомиоцитов, вызванная длительной ишемией миокарда из-за нарушения коронарного кровотока. В большинстве случаев некроз сердечной мышцы имеет характер очагового поражения в области кровоснабжения одной из коронарных артерий. Развитие инфаркта миокарда с подъемом сегмента ST (ИМСПST) чаще всего связано с острым уменьшением (прекращением) коронарного кровоснабжения, причиной которого является окклюзирующий тромбоз атеросклеротически измененной коронарной артерии (КА). У 65-75% больных ИМСПST коронарный тромбоз возникает на месте внезапного разрыва «нестабильной» («уязвимой») атеросклеротической бляшки. Такая «нестабильная» бляшка имеет большое липидное ядро (более 50% ее объема) и истонченную соединительнотканную оболочку, содержащую много макрофагов и Т-лимфоцитов, выделяющих металлопротеиназы (коллагеназа и др.) и цитокиназу, которые способствуют нарушению целостности этой оболочки. Наличие большого количества макрофагов и Т-лимфоцитов указывает на активацию воспалительного процесса и, вероятно, на его ведущую роль в уменьшении механической устойчивости атеросклеротической бляшки к разрыву. Эрозия эндотелиального слоя бляшки существенно реже бывает причиной ИМСПST, чем разрыв ее фиброзной капсулы.
В патогенезе повреждения «нестабильной» бляшки и тромбообразования существенное значение придается ряду физиологических параметров: системному артериальному давлению (АД), частоте сердечных сокращений (ЧСС), тонусу КА, вязкости крови, активности эндогенного тканевого активатора плазминогена (t-PA), уровню кортизола и катехоламинов в плазме крови. Тромб, ответственный за развитие ИМСПST, обычно имеет длину около 1,0 см и состоит из тромбоцитов, фибрина, эритроцитов и лейкоцитов. Его состав может существенно различаться: белые тромбы состоят преимущественно из тромбоцитов и фибрина, а красные тромбы — из эритроцитов, фибрина, тромбоцитов и лейкоцитов. Важно отметить, что приблизительно 3/4 всех случаев окклюзирующего тромбоза выявляется при незначительном или умеренно выраженном стенозе КА. Только у 15-20% больных он определяется в области гемодинамически значимого (70% и более) сужения КА [1].
Ряд патологических процессов, отличающихся от атеросклероза, также могут быть причиной ИМ (табл. 1).
Только у 5% больных с ИМ не выявляются атеросклеротические изменения в коронарных артериях (у больных ИМ моложе 35 лет атеросклероз КА отсутствует в 10-15% случаев).
Острая окклюзия КА в случае отсутствия адекватного коллатерального кровотока или лизиса тромба (фармакологического или спонтанного) приводит к тяжелой трансмуральной ишемии миокарда, а если она сохраняется более 20-30 минут, то и к развитию ИМ с подъемом сегмента ST. Некроз миокарда сопровождается изменением его функционального состояния и, в первую очередь, нарушением сокращения и расслабления сердечной мышцы. Если объем некротизированного участка относительно небольшой и составляет 15-20% массы миокарда левого желудочка (ЛЖ), глобальная функция сердечной мышцы обычно остается сохраненной из-за увеличения сократимости ее неповрежденной части. Однако при поражении значительного сегмента миокарда ЛЖ (более 25%) возможно развитие застойной сердечной недостаточности. Когда ИМ очень большой и включает более 35% массы миокарда ЛЖ, это грозит появлением отека легких или кардиогенного шока [2].
Временная классификация, которая основывается на морфологических изменениях в области сердечной мышцы, выделяет 3 стадии ИМ: острая стадия или острый ИМ (от 6 часов до 7 дней), стадия заживления (healing) или рубцевания (7-28 дней) и стадия зажившего ИМ (healed) или стадия рубца (29 дней и более) [3].
Несмотря на значительные достижения в лечении больных с ИМСПST, общая смертность при нем составляет 15-25%, а около половины из этих фатальных исходов развивается в течение первых 1-2 часов заболевания, в основном от желудочковых тахиаритмий. Существенный прогресс в снижении госпитальной летальности от ИМ в Европе и США связан с внедрением в 60-е годы прошлого столетия специализированных отделений с палатами (блоками) интенсивной помощи больным с острой коронарной патологией. До тромболитической эры, благодаря в основном возможности своевременной диагностики (мониторирование ЭКГ) и экстренной терапии (электрическая кардиоверсия) фатальных желудочковых аритмий сердца, смертность снизилась с 25-30% до 18%. С началом широкого использования фибринолитических препаратов, Аспирина и чрескожных коронарных вмешательств (ЧКВ — баллонирование или стентирование КА) 30-дневная летальность уменьшилась до 6-8%. Так, по данным Euroheart syrvey of acute coronary syndromes [4], 30-дневная смертность у больных острым коронарным синдромом с подъемом сегмента ST составляет 8,4%.
Важнейшее значение в улучшении прогноза больных ИМСПST имеет адекватное и своевременное восстановление кровотока в окклюзированной КА.
Как известно, интенсивно изучаются, а в некоторых странах уже используются две тактики достижения реперфузии в инфаркт-связанной КА: фибринолитическая терапия (ФЛТ) и механическое восстановление коронарного кровотока (ЧКВ или реже коронарное шунтирование (КШ)). Первичная коронарная ангиопластика имеет ряд преимуществ перед ФЛТ: (1) восстановление коронарного кровотока при ее проведении происходит более чем у 85% больных ИМСПST (при ФЛТ — только в 60-70% случаев); (2) в отличие от ФЛТ возможно значительное уменьшение резидуального стеноза и в связи с этим снижение вероятности развития реокклюзии КА и появления постинфарктной стенокардии; (3) сокращение количества геморрагических осложнений, в том числе геморрагических инсультов.
Анализ 10 рандомизированных исследований, выполненный W. D. Weaver et al. в 1997 г. [5], демонстрирует достоверное улучшение клинического течения ИМСПST при проведении механической реперфузии: смертность — 4,4% и 6,5%, нефатальные рецидивы ИМ — 7,2% и 11,9%, геморрагический инсульт — 0,1% и 1,1%. Подобные данные были получены и при более поздней (2003 г.) оценке результатов 23 исследований по сравнению ЧКВ и ФЛТ у больных ИМСПST [6]. Стентирование КА по сравнению с баллонной ангиопластикой уменьшает риск развития ретромбоза, но при этом не приводит к изменению смертности и частоты рецидивов ИМ [7].
Для решения вопроса о выборе способа восстановления коронарного кровотока необходимо рассмотреть следующие факторы:
В исследовании CAPTIM [8] при сопоставлении раннего (догоспитального) фибринолиза и первичного ЧКВ не было обнаружено достоверных различий в исходах заболевания (оценивалась комбинированная конечная точка: смерть, рецидив ИМ и инсульт). Таким образом, если прошло менее трех часов после появления симптомов ИМ и нет технических проблем для выполнения ЧКВ, не отдается предпочтения той или другой стратегии реперфузии. Однако в большинстве клиник при данных обстоятельствах предпочитают ФЛТ (табл. 2).
При госпитализации больного больше чем через 3 часа после развития ИМСПST преимущество имеет коронарная ангиопластика. Тем не менее, первичное ЧКВ должно быть выполнено как можно быстрее (в течение 90 минут после первого контакта с врачом). Определенные требования предъявляются к лаборатории, в которой проводится механическая реперфузия: в ней должно выполняться не менее 200 вмешательств в год, а врач должен делать не менее 75 ангиопластик в год. В тех случаях, когда введение фибринолитика может быть проведено существенно раньше (разница во времени превышает 1 час), предпочтение отдается ФЛТ.
Чрескожное коронарное вмешательство эффективнее ФЛТ при кардиогенном шоке (КРШ). Условиями, определяющими успешность его результатов, являются: развитие КРШ в течение 36 часов от начала ИМ и выполнение ангиопластики не позднее 18 часов от возникновения КРШ. Первичное ЧКВ рекомендуется больным с тяжелой сердечной недостаточностью и отеком легких (класс 3 по Киллипу), жизнеопасными желудочковыми аритмиями, рецидивирующей ишемией миокарда, даже если они развиваются через 12 и более часов (до 24 часов) после ИМ.
Одним из показаний для первичного ЧКВ является наличие противопоказаний к ФЛТ: оно проводится не позднее 12 часов от начала заболевания при отсутствии осложнений ИМ и до 24 часов в случаях появления гемодинамической и электрической нестабильности.
Проведение коронарной ангиопластики целесообразно в случаях, когда по совокупности неинвазивных методов обследования больного (клиника, ЭКГ, ЭхоКГ и др.) предполагается отсутствие эффекта от ФЛТ, выражающееся в сохранении или появлении симптомов ишемии миокарда, сердечной недостаточности и тяжелых желудочковых нарушений ритма сердца.
Перспективным, находящимся в стадии клинического изучения, представляется комбинированный подход к реперфузионной терапии: введение фибринолитика (предпочтительнее фибрин-специфичного) на догоспитальном этапе и механическая реперфузия (стентирование КА) в стационаре.
Перед ЧКВ к Аспирину следует добавить клопидогрель, применение которого продолжается по крайней мере 1 месяц после имплантации непокрытых металлических стентов и в течение нескольких месяцев при использовании стентов с покрытием (3 месяца — сиролимус, 6 месяцев — паклитаксел). У больных с низким риском кровотечений клопидогрель назначается до 12 месяцев [9]. Также для улучшения исходов первичной коронарной ангиопластики (со стентированием или без него) вводится абциксимаб (он предпочтительнее других ИГПРIIb/IIIa тирофибана и эптифибатида).
Коронарное шунтирование выполняется у больных с осложненным течением ИМСПST, которые не являются кандидатами для ЧКВ (стеноз общего ствола левой КА, трехсосудистое поражение). Оно проводится, кроме того, при хирургических вмешательствах по поводу таких осложнений ИМ, как разрыв межжелудочковой перегородки или тяжелая митральная недостаточность.
ЧКВ и КШ не показаны у асимптомных больных без гемодинамической и электрической нестабильности, когда после развития ИМСПST прошло более 12 часов.
По вопросам литературы обращайтесь в редакцию.
Ю. А. Бунин, доктор медицинских наук, профессор
РМАПО, Москва
Инфаркт миокарда: клиника, диагностика, лечение
Острый инфаркт миокарда (ИМ) — клинический синдром, возникающий в результате повреждения сердечной мышцы при несоответствии между потребностью миокарда в кислороде и возможностью его доставки. При этом возникает некроз кардиомиоцитов в зоне поврежде
Острый инфаркт миокарда (ИМ) — клинический синдром, возникающий в результате повреждения сердечной мышцы при несоответствии между потребностью миокарда в кислороде и возможностью его доставки. При этом возникает некроз кардиомиоцитов в зоне повреждения одновременно, что отличает данный процесс от других форм миокардиального повреждения.
Этилогия и патофизиология. Факторами риска являются гиперхолестеринемия, сахарный диабет, артериальная гипертензия, малоподвижный образ жизни, семейный анамнез, табакокурение и другие.
Основным в процессе принято считать атеросклероз коронарных артерий, включающий в себя разрыв или деэндотелизацию атеросклеротической бляшки, тромбоз, вазоконстрикцию, часто на фоне воспаления. Важную роль также играет нарушение свертываемости крови, уменьшение коронарного кровотока и недостаточная его компенсация коллатеральным кровообращением, нарушение обмена простагландинов, функции калликреин-кининовой системы, иммунологические нарушения. Независимо от причины, ИМ характеризуется наступлением необратимой гибели клеток миокарда. Зона инфаркта, которая изначально охватывает субэндокардиальный слой миокарда, начинает распространяться на более глубокие слои, направляясь к эпикарду. Даже при тотальной окклюзии коронарного сосуда, снабжающего зону инфаркта, наблюдается некоторый антеградный кровоток, что может позволить сохраниться в зоне поражения жизнеспособным кардиомиоцитам, поэтому считается, что существует временной период до 6-12 часов, когда возможно повлиять на размер зоны некроза путем увеличения кровотока в поврежденном участке.
У более 50% больных тотальная коронарная окклюзия развивается в области ранее существующей атеросклеротической бляшки. Тотальная окклюзия чаще развивается в проксимальных сегментах крупных артерий, что впоследствии на ЭКГ проявляется патологическими зубцами Q. При отсутствии тотальной тромботической окклюзии коронарного сосуда чаще возникает Q-необразующий ИМ (по ЭКГ).
Развитие ИМ сопровождается нарушением систолической и диастолической функции и ремоделированием левого желудочка (ЛЖ). Нарушение систолической функции обусловлено тем, что некротизированный участок миокарда не участвует в сокращении сердца, тогда как в неповрежденной ближайшей зоне имеется компенсаторная гиперкинезия. Диастолическая дисфункция связана со снижением эластичности и растяжимости миокарда. В результате диастола ЛЖ неполноценна, миокард недостаточно релаксируется, повышается конечное диастолическое давление. Данные нарушения возникают при поражении менее 10% массы миокарда левого желудочка. Ремоделирование ЛЖ обусловлено истончением миокарда и снижением тонуса миокарда в области некроза, компенсаторным расширением полости ЛЖ, развитием состояния гибернации в периинфарктной зоне, активизацией циркулирующей и местной ренин-ангиотензиновой и симпатоадреналовой системы, гиперпродукцией эндотелина. Ремоделирование сердца после ИМ может носить адаптивный и дезадаптивный характер. Адаптивный характер проявляется в уменьшении размеров ЛЖ, поддержании удовлетворительной сократительной способности ЛЖ, стабилизации миокардиального стресса. Сохраняется гемодинамически выгодная форма ЛЖ, поддерживается удовлетворительная сократительная способность ЛЖ и стабилизация миокардиального стресса. Дезадаптивный характер процесса ремоделирования ЛЖ заключается в прогрессированной дилатации ЛЖ с переходом к гемодинамически невыгодной сферической форме сердца, что приводит к развитию рестриктивного типа диастолического наполнения ЛЖ. Этот тип дисфункции является мощным предиктором сердечно-сосудистой смертности.
Клиническая картина. Проявления ИМ имеют множество вариантов. От бессимптомного течения и эпизодического дискомфорта в области сердца до развернутого болевого приступа с различными нарушениями ритма и проводимости. Чаще описываются ощущения «давления», «тяжести» и «жжения» в центральной части грудной клетки с иррадиацией в плечевой пояс, руку, челюсть, эпигастральную область. Больной беспокоен, прикладывает руку к грудине (симптом Левайна). Для пожилого больного с множественной сопутствующей патологией ИМ часто проявляется в признаках сердечной недостаточности (нарастание одышки, отеков, появление сердцебиения, атипичность стенокардитической боли).
Физикальные исследования варьируют от полной нормы до выраженных отклонений (расширение верхушечного толчка, появление 3 и 4 тона, ослабление тонов, появление влажных хрипов в легких и др.). Ни один из этих признаков не подтверждает, но и не исключает наличие ИМ. Диагностика ИМ основана на выявлении маркеров повреждения сердечной мышцы.
Маркеры повреждения кардиомиоцитов. В настоящее время наиболее убедительным маркером является тропонин. Он имеет более высокую чувствительность к ИМ, чем МВ-фракции креатинфосфокиназы (МВ-КФК). Современные методы анализа позволяют наделять тропонин практически абсолютной кардиоспецифичностью, но, учитывая это качество, тропонин может быть повышен и при неишемическом повреждении миокарда. Поэтому только комплексный подход (клинические данные, эхокардиографические и др.) позволяют доказать острую ишемию миокарда и развитие ИМ. Уровень тропонина повышается в первые 4-6 часов и держится повышенным в пределах 8-12 дней. Длительность выявления маркера позволяет диагностировать ИМ в поздние сроки, без исследования лактатдегидрогеназы (ЛДГ). Для более точного ориентирования в сроках ИМ целесообразно исследовать «короткоживущие» маркеры некроза. «Ранним» маркером некроза миокарда является повышение активности МВ-КФК. Активность МВ-КФК повышается в первые часы повреждения миокарда и превышает нормальные показатели между 6-12 часами болезни, достигая пика к 18-24 часу заболевания, а к 48 часу показатели маркера возвращаются к нормальным. Необходимо помнить о других причинах повышения МВ-КФК: повреждение скелетной мускулатуры, хронические миопатии, почечная недостаточность, гипотиреоз за счет снижения клиренса, а также то, что соотношение МВ-КФК и общей КФК не считается критерием диагностики ИМ.
Электрокардиография. Наиболее значимыми признаками ИМ являются изменения сегмента ST (подъем с выпуклостью вверх). При нижней локализации ИМ следует фиксировать ЭКГ на правой половине грудной клетки в отведениях V3R или V4R. Для огибающей окклюзии характерны изменения в так называемых задних отведениях (V7-V9), чаще в виде появления патологического зубца Q. При этом вышеуказанные признаки нельзя считать 100% обязательными. В большинстве случаев типичные изменения ЭКГ отсутствуют, что может быть обусловлено наличием нарушения внутрижелудочковой проводимости или изолированной депрессией сегмента ST.
Эхокардиография (ЭхоКГ). Диагностическая точность ЭхоКГ зависит от качества получаемого изображения. Отсутствие патологии при ЭхоКГ не может служить основанием для исключения ишемической болезни сердца или некроза сердечной мышцы. ЭхоКГ не позволяет отличить свежий очаг асинергии от зоны постинфарктного кардиосклероза. Исследование незаменимо для исключения осложнений ИМ и сопутствующей патологии.
Лечение. Для достижения максимального положительного результата лечение должно начинаться как можно раньше, начиная с первого часа заболевания, что позволит иметь значительно лучший прогноз. Как можно раньше должна быть проведена реперфузионная терапия путем тромболизиса или первичной ангиопластики. Доказано, что рано начатое лечение приводит к существенному снижению смертности при всех формах ИМ. Первичная ангиопластика на инфаркт-ассоциированной артерии в первый час заболевания позволяет восстановить естественную перфузию миокарда в зоне повреждения Чем позже проведена реперфузия, тем выше смертность. В настоящее время доступность ангиопластики остается невысокой.
В 1996 году Европейским обществом кардиологов и Американской коллегией предложены рекомендации по лечению больных острым инфарктом миокарда, состоящие из ряда принципиальных позиций.
1. Болевой синдром имеет важнейшее значение для течения ИМ. Чем выраженнее и продолжительнее болевой синдром, тем больше опасность развития тяжелых осложнений. При отсутствии противопоказаний со стороны гемодинамики для купирования ангинозного приступа можно использовать сублингвальную форму нитроглицерина (НТГ). В отдельных случаях это позволяет получить регресс острых ишемических изменений на ЭКГ. При этом следует с осторожностью использовать НТГ при нижней локализации ИМ, т. к. может развиться тяжелая артериальная гипотония. НТГ также может вызвать сосудистый коллапс и резкое урежение сердечного ритма (вазовагальная реакция). При получении эффекта от сублингвального НТГ можно применить внутривенную инфузию данного препарата в низких дозах (5-10 мкг/мин). Применение НТГ не исключает использования анальгетиков. Не рекомендовано использование мощных вазодилататоров (например, антагонистов кальция) из-за возникновения тяжелой гипотонии и рефлекторной тахикардии. При отсутствии быстрого обезболивающего эффекта от НТГ назначают наркотические анальгетики — морфин гидрохлорид в/в до 10 мг с повторением введения препарата до полного купирования болевого синдрома. Помимо основного эффекта морфин способствует уменьшению пред- и постнагрузки на сердце, уменьшает давление в сосудах малого круга кровообращения. Из побочных эффектов основными являются гипотония и относительная брадикардия, угнетение дыхательного центра, тошнота и рвота. С целью обезболивания используют также Промедол.
Для усиления обезболивающего эффекта используют сочетание морфина и нейролептика, чаще дроперидола, обладающего также мощным противорвотным эффектом. Для больных пожилого возраста данные схемы нужно использовать с осторожностью из-за сопутствующей патологии, т. к. часто возможны нарушения функции дыхания. Для данной возрастной группы больных рекомендуется применение комбинации наркотического анальгетика и транквилизатора, например, Фентанила 0,005% 2 мл и Седуксена 0,5% 2 мл.
Большим достижением в обезболивании некупирующегося ангинозного приступа стала эпидуральная блокада. Широкое применение затруднено из-за развития специфических осложнений и наличия технических трудностей при ее выполнении.
Применение ингаляционных средств наркоза в настоящее время используется редко, только по определенным показаниям (проведение кардиоверсии, искусственная вентиляция легких, выполнение болезненных манипуляций).
2. Восстановление кровотока (реканализация) по инфаркт-ассоциированной артерии существенно уменьшает размеры зоны поражения миокарда. Эффективность тромболитической терапии (ТЛТ) прямо зависит от времени начала лечения. Желательно, чтобы время обращения за помощью и начало ТЛТ не превышало 90 минут. Показанием к ТЛТ считается наличие смещения сегмента ST вверх от изоэлектрической линии более 0,1 мВ не менее чем в двух смежных отведениях ЭКГ или блокады ножки пучка Гиса у больных, поступивших в первые 12 часов после появления симптомов ИМ. Однако при сохранении боли и указанных выше изменений на ЭКГ считается целесообразным проведение ТЛТ и в более поздние сроки (вплоть до 24 часов после начала заболевания). Под блокадой ножки пучка Гиса подразумевается вновь возникшая или предположительно вновь возникшая полная блокада левой ножки пучка Гиса, затрудняющая интерпретацию ЭКГ. Наиболее доступным с доказанной эффективностью считается препарат стрептокиназа. Препарат активизирует плазминоген непрямым способом. Препарат не следует назначать пациентам, которые перенесли ранее тяжелую стрептококковую инфекцию или которым данный препарат вводился в течение последних 5-6 месяцев. Быстрое введение стрептокиназы может вызывать резкое снижение артериального давления. Рекомендуемая доза стрептокиназы составляет 1500000 ЕД в течение часа.
Урокиназа является прямым активатором плазминогена, имеет короткий период полувыведения, вызывает более быстрое восстановление проходимости инфаркт-ассоциированной артерии, чем эквивалентная доза стрептокиназы. Рекомендуемая доза 2000000 ЕД болюсно и 3000000 ЕД в/в капельно в течение 90 минут.
Тканевой активатор плазминогена (ТАП) считается фибрин-специфичным активатором плазминогена. По сравнению со стрептокиназой и урокиназой ТАП способствует более раннему восстановлению проходимости инфаркт-ассоциированной артерии, возможно, именно этот фактор обусловлено снижает смертность при его использовании. Режим назначения ТАП 100 мг в/в в течение 3 часов: 10 мг болюсно, далее 50 мг в течение первого часа и еще 40 мг в течение последующих 2 часов. При массе тела пациента менее 65 кг назначается препарат в дозе 1,25 мг/кг (за 3 часа), при этом 10% от общей дозы должны быть введены в виде первичного болюса. Применение более высоких доз (больше 100 мг) ТАП ассоциировано с риском внутричерепного кровотечения.
С течением времени были синтезированы и другие ТАП с несколько иным молекулярным строением: ретеплаза, тенектеплаза.
Противопоказания к применению ТЛТ определяются риском возникновения серьезных кровотечений, в особенности внутричерепных. Существуют абсолютные противопоказания: активное внутреннее кровотечение, любой сосудистый эпизод в течение последних 2 месяцев, новообразование центральной нервной системы, тяжелая травма, хирургическое вмешательство в течение 3 месяцев, беременность, тяжелая артериальная гипертензия. К относительным противопоказаниям относят подозрение на расслоение аорты, сердечно-сосудистую реанимацию в течение 2 недель, злокачественные новообразования, язвенную болезнь в стадии обострения, нарушения гемостаза, системные заболевания, эндокардит и ряд других заболеваний. Следует индивидуально решать вопрос по проведению ТЛТ у больных старшего возраста, в связи с наличием большого количества сопутствующей патологии.
Сопутствующее лечение
Аспирин необходимо назначать всем больным с подозрением на ИМ, при отсутствии противопоказаний. Его положительное влияние на выживаемость, частоту реинфарктов и ишемических инсультов продемонстрировано как при проведении ТЛТ, так и в ее отсутствие. При сочетании Аспирина с ТЛТ эффективность последней значительно возрастает. Доказано, что Аспирин ингибирует агрегацию тромбоцитов и ускоряет фибринолиз. Поэтому всем больным ИМ следует назначать Аспирин немедленно в дозе 160-325 мг (разжевывать).
Гепарин при внутривенном введении совместно с активаторами плазминогена способствует ускорению проходимости инфаркт-ассоциированной артерии, особенно при использовании ТАП. При использовании стрептокиназы внутривенная инфузия гепарина не является столь необходимой. Стандартная схема гепаринтерапии предлагает первоначальное болюсное введение 5000 ЕД нефракционированного гепарина, а затем инфузию со скоростью 1000 ЕД/час, пока активированное частичное тромбопластиновое время (АЧТВ) не увеличится в 1,5-2 раза по сравнению с исходным. В связи с трудностями точной титрации данной формы гепарина, рекомендуется использовать низкомолекулярные гепарины (НМГ) с расчетом дозы на кг веса пациента.
β-блокаторы снижают риск повторного ИМ у больных, пролеченных тромболитической терапией. β-блокаторы снижают риск смерти, модулируют нейрогуморальные и гормональные системы, замедляют ремоделирование сердечно-сосудистой системы, вызывают нормализацию функционального состояния тромбоцитов. Рекомендуется применять препараты данной группы в первые 12 часов после начала ИМ у всех больных, не имеющих противопоказаний (бронхиальная астма, сахарный диабет, брадикардия, гипотония). Используются суточные доза метопролола, пропранолола.
Ингибиторы ангиотензин-превращающего фермента (иАПФ). Сердечная недостаточность (СН) является частым осложнением и одной из основных причин смертности в острый период ИМ и в отдаленные сроки после его развития. Возникновение и прогрессирование СН у больных, перенесших ИМ, связано с процессом ремоделирования миокарда ЛЖ, патофизиологический процесс которого запускается уже в первые часы заболевания. Повреждение клеточных и структурных компонентов миокарда и расширение зоны инфаркта предрасполагает к дилатации и дисфункции ЛЖ, которая определяет высокую смертность больных ИМ. Изменения в структуре ЛЖ в первые 3 дня, а в последующем пролиферация фибробластов и синтез коллагена приводят к прогрессированию ремоделирования сердца. Активным участником этих процессов являетcя ангиотензин II, вызывающий спазм коронарных артерий, увеличение работы сердца, повышение потребления миокардом кислорода, а в последующем пролиферацию фибробластов. Таким образом, появились теоретические основания для использования иАПФ при ИМ. Ингибиторы АПФ, уменьшая синтез ангиотензина II, вызывающего вазоконстрикцию как артериального, так и венозного сосудистого русла, способствуют нормализации центральной и периферической гемодинамики, тем самым предотвращают развитие кардиогенного шока, снижая нагрузку на сердце существенно, подавляют процесс ремоделирования ЛЖ. Однако применение иАПФ в остром периоде ИМ ограничивается риском снижения системного артериального давления (АД). В связи с этим, несмотря на доказанную эффективность иАПФ, не утратил своей актуальности поиск безопасных препаратов данной группы, пригодных для применения с первых суток ИМ в сочетании с ТЛТ. К препаратам, не вызывающим резкого снижения АД, относится лизиноприл (Диротон). Эффективность Диротона как средства, препятствующего ремоделированию ЛЖ и развитию СН, а также уменьшающего риск смерти после развития ИМ, показана в условиях эксперимента и клиники. В отличие от большинства иАПФ Диротон не нуждается в биотрансформации в печени для образования активных метаболитов, а также не содержит сульфгидрофильной группы, являющейся причиной ряда побочных эффектов. Отсутствие печеночного метаболизма у Диротона позволяет рекомендовать его больным с патологией печени. Диротон уменьшает риск взаимодействия с другими лекарственными препаратами, которые подвергаются биотрансформации в печени. Исследование эффективности Диротона у пациентов с ИМ и в раннем постинфарктном периоде показало снижение смертности, уменьшение СН. Диротон доказал свою эффективность также у больных пожилого возраста.
Антиаритмические препараты. Обычно речь идет о применении Лидокаина, который ранее назначался всем с профилактической целью купирования желудочковых нарушений ритма. Впоследствии оказалось, что реканализация инфаркт-ассоциированной артерии уменьшает вероятность развития таких аритмий, и доказано, что рутинное применение препарата способствует увеличению смертности. Лидокаин следует назначать только при желудочковой тахикардии или фибрилляции желудочков.
Магния сульфат (магнезия сульфат) может применяется при наличии лабораторно доказанной гипомагнемии или других специфических показаний (например, полиморфная желудочковая тахикардия).
Н. В. Журавлева, кандидат медицинских наук
О. А. Поворинская
РНИИ геронтологии, Москва
Инфаркт миокарда
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Инфаркт миокарда: причины появления, симптомы, диагностика и способы лечения.
Определение
Инфаркт миокарда (ИМ) - это омертвление участка сердечной мышцы вследствие недостаточного ее кровоснабжения с развитием характерной клинической картины.
Причины появления инфаркта миокарда
Сердце - полый мышечный орган, имеющий форму конуса. Стенки сердца состоят из трех слоев. Внутренний слой - эндокард - выстилает полости сердца изнутри, и его выросты образуют клапаны сердца. Средний слой - миокард - состоит из сердечной мышечной ткани. Наружный слой - перикард. Сердце человека имеет четыре камеры: два предсердия и два желудочка. В правое предсердие поступает кровь из тканей самого сердца и всех частей тела (по верхней и нижней полым венам). В левое предсердие впадают четыре легочные вены, несущие артериальную кровь из легких. Из правого желудочка выходит легочный ствол, по которому венозная кровь поступает в легкие. Из левого желудочка выходит аорта, несущая артериальную кровь в сосуды большого круга кровообращения. Кислород к миокарду сердца доставляется по коронарным артериям.
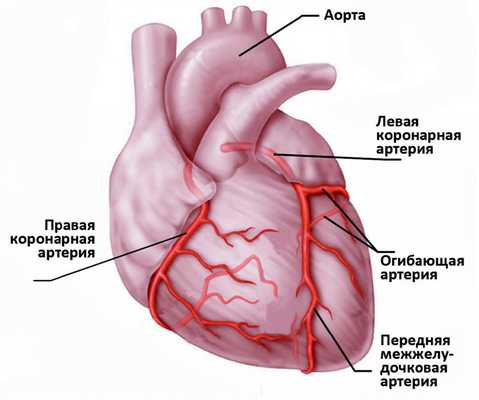
Сердце очень чувствительно к недостатку кровоснабжения (дефициту кислорода). В случае закупорки крупной коронарной артерии и при отсутствии эффективного альтернативного кровообращения по другим сосудам уже через 30 минут в пораженном участке начинается гибель кардиомиоцитов (мышечных клеток сердца).
Нарушение кровообращения вследствие атеросклеротического поражения коронарных артерий в 97-98% случаев имеет основное значение в возникновении инфаркта миокарда.
Атеросклерозом может поражаться как одна коронарная артерия, так и все три. Степень и протяженность сужения артерии могут быть различными. При повышении артериального давления склерозированный внутренний слой сосуда (эндотелий) легко повреждается, кровь проникает внутрь бляшки, активируется процесс свертывания крови и формируется тромб, который может частично или полностью закупорить сосуд.
Где может формироваться тромб:
- на месте разрыва уязвимой (нестабильной) атеросклеротической бляшки;
- на дефекте (эрозии) эндотелия коронарной артерии, не обязательно локализованном на поверхности атеросклеротической бляшки;
- в месте гемодинамически незначимого сужения коронарной артерии.
Развивающийся некроз миокарда может быть различных размеров, а некроз, проходящий через все слои сердца (трансмуральный) может стать причиной разрыва миокарда.
Образование очагов некроза в миокарде сопровождается изменением размера, формы и толщины стенки сердца, а сохранившийся миокард испытывает повышенную нагрузку и подвергается гипертрофии с увеличением объема и массы.
Такие сопутствующие состояния как: анемия, воспаление, инфекция, лихорадка, метаболические или эндокринные расстройства (в частности, гипертиреоз) могут спровоцировать или утяжелить ишемию миокарда.
К факторам риска развития инфаркта миокарда относятся:
- гиперлипидемия (нарушение нормального соотношения липидов крови);
- курение,
- сахарный диабет,
- артериальная гипертензия,
- абдоминальное ожирение,
- психосоциальные причины (стресс, депрессия и т.д.),
- низкая физическая активность,
- несбалансированное питание и потребление алкоголя.
Классификация инфаркта миокарда
I. Острый инфаркт миокарда.
- Острый трансмуральный инфаркт передней стенки миокарда.
- Острый трансмуральный инфаркт нижней стенки миокарда.
- Острый трансмуральный инфаркт миокарда других уточненных локализаций.
- Острый трансмуральный инфаркт миокарда неуточненной локализации.
- Острый инфаркт миокарда неуточненный.
- Повторный инфаркт передней стенки миокарда.
- Повторный инфаркт нижней стенки миокарда.
- Повторный инфаркт миокарда другой уточненной локализации.
- Повторный инфаркт миокарда неуточненной локализации.
- Гемоперикард.
- Дефект межпредсердной перегородки.
- Дефект межжелудочковой перегородки.
- Разрыв сердечной стенки без гемоперикарда.
- Разрыв сухожильной хорды.
- Разрыв сосочковой мышцы.
- Тромбоз предсердия, ушка предсердия и желудочка сердца.
- Другие текущие осложнения острого инфаркта миокарда.
- Коронарный тромбоз, не приводящий к инфаркту миокарда.
- Синдром Дресслера - постинфарктный склероз.
- Другие формы острой ишемической болезни сердца.
- Острая ишемическая болезнь сердца неуточненная.
Симптомы инфаркта миокарда
При инфаркте миокарда в результате нарушения кровообращения в пораженном участке сердца накапливаются продукты обмена, которые раздражают рецепторы миокарда и коронарных сосудов, что проявляется острой болью. Болевой приступ приводит к выбросу адреналина и норадреналина корой надпочечников.
Боль при типичном течении инфаркта миокарда является основным его признаком. Она возникает за грудиной, иногда может отдавать в левую руку, левое плечо, горло, нижнюю челюсть, в подложечную область.
По интенсивности и длительности такая боль в значительной степени превосходит обычный приступ стенокардии. Боль не снимается приемом нитроглицерина. Длительность болевого синдрома может быть различной - от 1 часа до нескольких суток. Иногда инфаркт миокарда сопровождается резкой слабостью, головокружением, головной болью, рвотой, потерей сознания. Больной выглядит бледным, губы синеют, наблюдается потливость.
В первые сутки развития инфаркта миокарда может регистрироваться тахикардия (учащенное сердцебиение), нарушение ритма, повышение температуры до 37-38℃.
Выделяют следующие клинические варианты:
- астматический - протекает как приступ бронхиальной астмы (присутствуют одышка, затрудненное дыхание, чувство нехватки воздуха);
- гастралгический - характеризуется болями в области желудка с распространением в загрудинное пространство, может быть отрыжка, икота, тошнота, многократная рвота, вздутие живота;
- аритмический - возникают нарушения ритма сердца, угрожающие жизни;
- церебральная - характеризуется нарушением мозгового кровообращения (наблюдаются тошнота, головокружение, нарушение сознания с развитием обморока);
- бессимптомный - инфаркт миокарда без типичного болевого приступа. В связи с несоблюдением постельного режима и отсутствием должного лечения протекает неблагоприятно.
Существуют четкие критерии диагностики инфаркта миокарда:
- клиническая картина инфаркта миокарда;
- картина инфаркта миокарда по данным ЭКГ;
- наличие новых участков миокарда со сниженным кровообращением или нарушение сократимости миокарда по данным инструментальных исследований;
- выявление тромбоза коронарных артерий по данным ангиографии.
- определение уровня биохимических маркеров повреждения кардиомиоцитов в крови;
Синонимы: Тн I вч; сердечный Тн I вч; сТн I вч. Tn I hs; cardiac-specific troponin I, high sensitivity; cTn I hs. Краткая характеристика определяемого вещества (Тропонин) Тропонины - небольши�.
Читайте также:
