Техника эндоскопической ассистенции. Методика эндоскопической ассистенции.
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Ключевые слова: транскраниальная эндоскопическая ассистенция, хиазмально-селлярная область, обзор литературы
Применение эндоскопической ассистенции при транскраниальных микрохирургических операциях началось сравнительно недавно и в настоящее время не используется рутинно в нейрохирургии. В отделении хирургии базальных опухолей № 8 на базе ФГАУ «НМИЦ нейрохирургии им. Н. Н Бурденко» накоплен большой опыт удаления опухолей хиазмально-селлярной области разной гистологической природы (более 10 000 наблюдений), из которых на транскраниальные микрохирургические операции приходится около 30 % за последние 15 лет. Данная работа посвящена литературному обзору применения эндоскопической ассистенции в транскраниальной хирургии хиазмально-селлярной области.
1. Matson D. D., Crigler J. F. Management of craniofaringioma in childhood // J Neurosurg. — 1969. — № 30 (4). — P. 377-390.
2. Van Eff enterre R., Boch A. L. Craniopharyngioma in adults and children: a study of 122 surgical cases // J Neurosurg. — 2002. — № 97(1). — P. 3-11.
3. Fahlbusch R., Honegger J., Paulus W., Huk W., Buchfelder M. Surgical treatment of craniopharyngiomas: experience with 168 patients // J Neurosurg. — 1999. — № 90(2). — P. 237-250.
4. Mortini P., Losa M., Pozzobon G., Barzaghi R., Riva M., Acerno S., Angius D., Weber G., Chiumello G., Giovanelli M. Neurosurgical treatment of craniopharyngioma in adults and children: early and long-term results in a large case series // J Neurosurg. — 2011. — № 114 (5). P. 1350-1359.
5. Yaşargil M. G., Curcic M., Kis M., Siegenthaler G., Teddy P. J., Roth P. Total removal of craniopharyngiomas. Approaches and long-term results in 144 Patients // J Neurosurg. 1990. — № 73 (1). — P. 3-11.
6. Семенова Ж. Б. Гистобиология краниофарингиом и особенности течения заболевания. Автореферат докторской диссертации. — М., 2000.
7. Choux M., Lena G. Bases of surgical management of craniopharyngioma in children [proceedings] // Acta Neurochir Suppl (Wien). — 1979. — № 28 (2). — P. 348.
8. Davis J. R., Farrell W. E., Clayton R. N. Pituitary tumors // Reproduction. — 2001. — № 121. — P. 363-371.
9. Gold E. B. Epidemiology of pituitary adenomas // Epidemiol. — 1981. — № 3. — P. 163-183.
10. Daly A. F., Rixhon M., Adam C., Dempegioti A., Tichomirova M. A., Beckers A. High prevalence of pituitary adenomas: a cross-sectional study in the province of Liege, Belgium // J Clin Endocrinol Metab. — 2006. Dec. — № 91 (12):47. — P. 69-75.
11. Kriss T. C., Kriss V. M. History of the operating microscope: from magnifying glass to microneurosurgery // Neurosurgery. — 1998. — № 42 (4). — Р. 899-907, discussion 907-908.
12. Wade N. J. On the late invention of the stereoscope // Perception. — 1987. — № 16(6). — Р. 785-818.
13. Philips C. Evolution of Neurosurgery: A Century of Advances // AANS Bulletin. — 1999. — № 8. — Р. 5-7.
14. Perneczky A. F. G. Endoscope-assisted brain surgery: part 1 — evolution, basic concept, and current technique // Neurosurgery. — 1998. — № 42 (2) — Р. 219-224, discussion 224-225.
15. Ségal A. The role of engineer Gustave Trouvé (1839-1902) in the history of endoscopy // Hist Sci Med. 1995. — № 29 (2). — Р. 123-132.
16. Zada G. L. C., Apuzzo M. L. «Through the looking glass»: optical physics, issues, and the evolution of neuroendoscopy // World Neurosurg. — 2013. — № 79 (2, Suppl). — Р. S3-S13.
17. Hsu W., Li K. W., Bookland M., Jallo GI. Keyhole to the brain: Walter Dandy and neuroendoscopy // J Neurosurg Pediatr. — 2009. — № 3 (5). — Р. 439-442.
18. Cohen A. R. Endoscopic ventricular surgery // Endoscopic ventricular surgery. — 1993. — № 19 (3). — Р. 127-134.
19. Grotenhuis J. A. Manual of Endoscopic Procedures in Neurosurgery. — Nijm egen: Machaon Press, 1995.
20. Kassam A. H. M., Welch W., Sclabassi R., Carrau R., Snyderman C., Hirsch B. The role of endoscopic assisted microneurosurgery (image fusion technology) in the performance of neurosurgical procedures // Minim Invasive Neurosurg. — 2005. — № 48 (4). — Р. 191-196.
21. Kadri H., Mawla A. A. Endoscopy-assisted microsurgical total resection of craniopharyngioma in childhood // Minim Invasive Neurosurg. — 2006. Dec. — № 49 (6). — Р. 369-372.
22. Dedhia R. C., Lord C. A., Pinheiro-Neto C. D., Fernandez-Miranda J. C., Wang E. W., Gardner P. A., Snyderman C. H. Endoscopic endonasal pituitary surgery: impact of surgical education on operation length and patient morbidity // J Neurol Surg B Skull Base. — 2012. Dec. — № 73 (6). — Р. 405-409.
23. Henry W. S. Schroeder & Anne-Katrin Hickmann & Jörg Baldauf. Endoscope-assisted microsurgical resection of skull base meningiomas // Neurosurg Rev. — 2011. — № 34. — Р. 441-455.
24. David A. Wilson H. D., Charles T., Kelly D. F. The Supraorbital Endoscopic Approach for Tumors // World Neurosurg. — 2014. — № 82. — Р. 6S:S72-S80.
25. Inamasu J. T. S., Watabe T., Imizu S., Kaito T., Ito K., Hattori N., Nishiyama Y., Hayashi T., Kato Y., Hirose Y. Early seizures after clipping of unruptured aneurysms of the anterior circulation: analysis on consecutive 1,000 cases // Neurosurg Rev. — 2013, Jul. — № 36 (3). — Р. 447-454.
26. Samii M. A. M., Gerganov V. Endoscope-assisted retrosigmoid intradural suprameatal approach for surgical treatment of trigeminal schwannomas // Neurosurgery. — 2014 Dec. — № 10 Suppl 4. — Р. 565-575; discussion 575.
27. Gazzeri R., Nishiyama Y., Teo C. Endoscopic supraorbital eyebrow approach for the surgical treatment of extraaxialand intraaxial tumors // Neurosurg Focus. — 2014. — № 37 (4). — Р. E20.
28. Пашатаев В. К. Применение эндоскопической ассистенции в хирургическом лечении больных с опухолями мосто-мозжечкового угла: дис. … канд. мед. наук. — М., 2013.
29. Гольбин Д. А. Эндоскопическая ассистенция в хирургии опухолей краниофациального распространения: дис. … канд. мед. наук. — М., 2010.
30. Камбиев Р. Л. Эндоскопическая ассистенция при церебральных нейрохирургических доступах: дис. … канд. мед. наук. — М., 2016.
31. Komatsu F. K. M., Inoue T., Tschabitscher M. Endoscopic supraorbital extradural approach to the cavernous sinus: A cadaver study // J Neurosurg. — 2011. — № 114. — Р. 1331-1337.
32. Van Lindert E. J., Grotenhuis J. A. The combined supraorbital keyhole-endoscopic endonasal transsphenoidal approach to sellar, perisellar and frontal skull base tumors: Surgical technique // Minim Invasive Neurosurg. — 2009. — № 52. — Р. 281-286.
33. Alfi eri A., Jho H. D. Endoscopic endonasal cavernous sinus surgery: An anatomic study // Neurosurgery. — 2001. — № 48. — Р. 827-837.
34. Berhouma M., Jacquesson T., Jouanneau E. The fully endoscopic supraorbital trans-eyebrow keyhole approach to the anterior and middle skull base // Acta Neurochir (Wien). — 2011. — № 153. — Р. 1949-1954.
35. Ciporen J. N., M. K., Ramanathan D., Lopez S., Ledesma E., Rostomily R. et al. Multiportal endoscopic approaches to the central skull base: A cadaveric study // World Neurosurg. — 2010. — № 73. — Р. 705-712.
36. Filipce V., Pillai P., Makiese O., Zarzour H., Pigott M., Ammirati M. Quantitative and qualitative analysis of the working area obtained by endoscope and microscope in various approaches to the anterior communicating artery complex using computed tomography based frameless stereotaxy: A cadaver study // Neurosurgery. — 2009. — № 65. — Р. 1147-1153.
37. Fries G., Perneczky A. Endoscope-assisted brain surgery: Part 2 — analysis of 380 procedures // Neurosurgery. — 1998. — № 42. — Р. 226-232.
38. Kabil M. S., Shahinian H. K. Application of the supraorbital endoscopic approach to tumors of the anterior cranial base // Craniofac Surg. — 2005. — № 16. — Р. 1070-1075.
39. Kabil M. S., Shahinian H. K. The endoscopic supraorbital approach to tumors of the middle cranial base // Surg Neurol. — 2006. — № 66. — Р. 396-401.
40. Kabil M. S., Shahinian H. K. Fully endoscopic supraorbital resection of congenital middle cranial fossa arachnoid cysts: Report of 2 cases // Pediatr Neurosurg. — 2007. — № 43. — Р. 316-322.
41. Komatsu F., Komatsu M., Inoue T., Tschabitscher M. Endoscopic supraorbital extradural approach to the cavernous sinus: A cadaver study // J Neurosurg. — 2011. — № 114. — Р. 1331-1337.
42. Komatsu F., Komatsu M., Inoue T., Tschabitscher M. Endoscopic extradural anterior clinoidectomy via supraorbital keyhole: A cadaveric study // J. Neurosurgery. — 2011. — № 68 (Suppl Operative). — Р. 334-338.
43. Reisch R., Perneczky A. Ten-year experience with the supraorbital subfrontal aprroach through an eyebrow skin incision // Neurosurgery. — 2005. — № 57 (Suppl). — Р. 242-255. .
44. Van Lindert E., Perneczky A., Fries G., Pierangeli E. The supraorbital keyhole approach to supratentorial aneuryms: Concept and technique // Surg Neurol. — 1998. — № 49. — Р. 481-490.
45. Калинин П. Л., Кадашев Б. А., Фомичев Д. В., Кутин М. А., Астафьева Л. И., Шарипов О. И., Шкарубо А. Н., Тропинская О. Ф., Воронина И. А., Фомочкина Л. А. Хирургическое лечение аденом гипофиза // Вопросы нейрохирургии имени Н. Н. Бурденко. — 2017. — Т. 81. — № 1. — С. 95-107.
46. Калинин П. Л., Шарипов О. И., Пронин И. Н., Кутин М. А., Фомичев Д. В., Кадашев Б. А., Шкарубо А. Н., Алексеев С. Н., Астафьева Л. И., Тропинская О. Ф., Добровольский Г. Ф., Шульц Е. И., Андреев Д. Н., Воронина И. А., Курносов А. Б. Эндоскопическое транссфеноидальное удаление аденом гипофиза, врастающих в кавернозный синус // Вопросы нейрохирургии имени Н. Н. Бурденко. — 2016. — Т. 80. — № 4. — С. 63-73.
47. Калинин П. Л., Шарипов О. И., Кутин М. А., Фомичев Д. В., Добровольский Г. Ф., Астафьева Л. И. Анатомия латерального расширенного транссфеноидального эндоскопического эндоназального доступа // Эндоскопическая хирургия. — 2017. — Т. 23. — № 3. — С. 28-31.
48. Калинин П. Л., Ф. Д. В., Кутин М. А., Кадашев Б. А., Астафьева Л. И., Шкарубо А. Н., Алексеев С. Н., Фомочкина Л. А. Эндоскопическая эндоназальная хирургия аденом гипофиза (опыт 1700 операций) // Вопросы нейрохирургии им. Н. Н. Бурденко. — 2012. — Т. 76. — № 3. — С. 26-33.
49. Фомичев Д. В., Кутин М. А., Чернов И. В., Кадашев Б. А., Калинин П. Л. Трансфеноидальная хирургия супраселлярных менингиом — есть ли будушее методики? // Вопросы нейрохирургии им. Н. Н. Бурденко. — 2018. — № 82 (5). — С. 8.
50. Калинин П. Л., Шарипов О. И., Шкарубо А. Н., Фомичев Д. В., Кутин М. А., Алексеев С. Н., Кадашев Б. А., Яковлев С. Б., Дорохов П. С., Бухарин Е. Ю., Курносов А. Б., Попугаев К. А. Повреждение кавернозного отдела внутренней сонной артерии при транссфеноидальном эндоскопическом удалении аденом гипофиза (4 случая из собственной практики) // Вопросы нейрохирургии имени Н. Н. Бурденко. — 2013. — Т. 77. — № 6. — С. 28-38.
51. Fomichev D., K. P., Kutin M., Sharipov O. Extended transsphenoidal endoscopic endonasal surgery of suprasellar craniopharyngiomas // World Neurosurgery. — 2016. — Т. 94. — С. 181-187.
52. Калинин П. Л., Фомичев Д. В., Кадашев Б. А., Кутин М. А., Файзуллаев Р. Б. Пластика дефектов основания черепа после транссфеноидальных эндоскопических операций // Врач. — 2008. — № 12. — С. 60-63.
53. Калинин П. Л., Ф. Д. В., Кутин М. А., Кадашев Б. А., Астафьева Л. И., Курносов А. Б., Попугаев К. А., Фомочкина Л. А., Тропинская О. Ф. Передний расширенный транссфеноидальный эндоскопический эндоназальный доступ в хирургии краниофарингиом // Вопросы нейрохирургии им. Н. Н. Бурденко. — 2013. — Т. 77. — № 3. — С. 13-20.
54. Кутин М. А., К. П. Л., Фомичев Д. В., Кадашев Б. А., Шилин А. Д., Нерсесян М. В., Фомочкина Л. А., Астафьева Л. И. Опыт применения аутотканей с сохраненным кровоснабжением для пластики дефектов основания черепа после эндоскопических транссфеноидальных вмешательств // Вопросы нейрохирургии им. Н. Н. Бурденко. — 2012. — Т. 76. — № 2. — С. 42-49.
55. Wilson D. A., Duong H. Teo C. Kelly D. F. The supraorbital endoscopic approach for tumors // World Neurosurg. — 2014. — № 82 (6 Suppl.). — Р. S72-80.
56. Коновалов А. Н., К. М. А., Кадашев Б. А., Калинин П. Л., Фомичев Д. В., Астафьева Л. И., Голанов А. В., Трунин Ю. Ю. Современные принципы лечения краниофарингиом // Опухоли головы и шеи. — 2012. — № 3. — С. 7-17.
57. Коновалов А. Н., К. П. Л., Кутин М. А., Фомичев Д. В., Кадашев Б. А., Астафьева Л. И., Семенова Ж. Б., Голанов А. В., Трунин Ю. Ю. Транссфеноидальная хирургия краниофарингиом: от паллиативных операций к радикальному удалению // Вопросы нейрохирургии им. Н. Н. Бурденко. — 2013. — Т. 77. — № 3. — С. 3-12.
58. Кутин М. А., К. П. Л., Кадашев Б. А., Фомичев Д. В., Шарипов О. И., Голанов А. В., Трунин Ю. Ю., Астафьева Л. И., Мазеркина Н. А., Клочкова И. С., Сиднева Ю. Г., Семенова Ж. Б., Саватеев А. Н., Струнина Ю. В., Сидорук Е. В. Краниофарингиомы. Общие сведения и основные направления лечения (обзорная лекция) // Вестник неврологии, психиатрии и нейрохирургии. — 2016. — № 5. — С. 42-50.
59. Калинин П. Л., Шарипов О. И., Пронин И. Н., Кутин М. А., Фомичев Д. В., Кадашев Б. А., Шкарубо А. Н., Алексеев С. Н., Астафьева Л. И., Тропинская О. Ф., Добровольский Г. Ф., Шульц Е. И., Андреев Д. Н., Воронина И. А., Курносов А. Б. Эндоскопическое транссфеноидальное удаление аденом гипофиза, врастающих в кавернозный синус // Вопросы нейрохирургии им. Н. Н. Бурденко. — 2016. — Т. 80. — № 4. — С. 63-74.
60. Benjamin V., Russell S. M. The microsurgical nuances of resecting tuberculum sellae meningiomas // Neurosurgery. — 2005. — № 56 (Suppl). — Р. 411-417.
61. Wiedemayer H., Sandalcioglu I. E., Wiedemayer H., Stolke D. The supraorbital keyhole approach via an eyebrow incision for resection of tumors around the sella and the anterior skull base // Minim Invasive Neurosurg. — 2004. — № 47. — Р. 221-225.
62. Akcakaya M. O. Aras Y. Izgi N. Gayretl, O. Sabanci P. A. Aydoseli A. Gurses . A. Sencer A. Ozturk A. Hepgul K. Fully endoscopic supraorbital keyhole approach to the anterior cranial base: A cadaveric study // J Neurosci Rural Pract. — 2015. — № 6—3. — Р. 361-368.
63. Peris-Celda M., D. R. L., Monroy-Sosa A., Morishita T., Rhoton A. Surgical Anatomy of Endoscope-Assisted Approaches to Common Aneurysm Sites. // Operative Neurosurgery. — 2014. — № (10). — Р. 121-144.
64. Zhao J., Wang Y., Zhao Y., Wang S. Neuroendoscope-assisted mini-mally invasive microsurgery for clipping intracranial aneurysms // Minim Invasive Neurosurg. — 2006. — № 49 (6). — Р. 335-341.
65. Hopf N. J., Perneczky A. Endoscopic neurosurgery and endoscope-assisted microneurosurgery for the treatment of intracranial cysts // Neurosurgery. — 1998. — № 43 (6). — Р. 1330-1336, discussion 1336-1337.
66. Galzio R. J., Tschabitscher M. Endoscope-Assisted Microneurosurgery — Principles, Methodology and Applications. — Germany, 2012.
Хирургическое лечение новообразований хиазмально-селлярной области является одним из ведущих направлений в современной нейрохирургии. Исходя из этого, хирургия параселлярной области является зоной повышенного интереса. Наиболее часто встречающимися новообразованиями хиазмально-селлярной области являются аденомы гипофиза, краниофарингиомы, менингиомы, эпидермоидные кисты (холестеатомы), глиомы [1].
До внедрения в практику микрохирургической техники лечение краниофарингиом ограничивалось опорожнением кист или частичным удалением доступной части опухоли. Matson (1969) [1] впервые показал возможность и оправданность тотального удаления опухоли с использованием микрохирургической техники. С этого момента опубликовано множество работ о результатах удаления краниофарингиом 5.
Но во всех случаях не удается полностью удалить опухоль, что создает предпосылки для рецидива. Анализ материала НМИЦН [6] установил высокую степень рецидивирования краниофарингиом, в первую очередь адамантиномоподобных, зависящую от радикальности удаления опухоли и ее биологической активности. В среднем опухоли рецидивировали после тотального и субтотального удаления у 21,5 % больных, а после частичного — у 53,2 %. Частота рецидива папиломатозных краниофарингом — 7,8 %.
Похожие данные приводятся во многих сериях наблюдений и в первую очередь в обобщенном опыте французских нейрохирургов М. Choux и G. Lena [7].
Считается, что распространенность аденом гипофиза в популяции составляет примерно 185-280 случаев на миллион населения [8, 9]. Однако недавно показано, что ох встречаемость может быть выше в 3-5 раз. Так, в исследовании A. Beckers в 2006 г. аденомы гипофиза выявлены у 68 из 71 972 жителей Бельгии, что может соответствовать 940 случаев на миллион населения [10].
Микронейрохирургия с эндоскопической асситенцией возникла в конце 1990-х гг., когда нейрохирурги стали пользоваться эндоскопом во время микроскопических процедур при транскраниальных доступах. Эндоскоп может обеспечить превосходные оптические возможности, которые увеличивают микроскопическую визуализацию, также увеличивается зона доступности ранее недоступных при микроскопической визуализации. До этого происходили устойчивые и прогрессивные научнотехнические усовершенствования в оптике, увеличении и освещении, которые применялись для разработки микроскопов и эндоскопов. Технологические достижения этих оптических инструментов шли параллельно друг другу, но развивались по отдельным направлениям. Пути этих двух уникальных оптических устройств впервые сошлись в нейрохирургических операциях в конце ХХ в. с введением технологии эндоскопической асситенции. Чтобы оценить достоинства каждого оптического устройства и возникающую между ними синергию, необходимо понять их самостоятельную эволюцию и последующее переплетение в нейрохирургической истории.
Абдилатипов Абдишукур Абдилатипович, Шарипов Олег Ильдарович, Андреев Дмитрий Николаевич, Чернов Илья Валерьевич, Эндоскопическая ассистенция в транскраниальной хирургии опухолей хиазмально-селлярной области. Вестник неврологии, психиатрии и нейрохирургии. 2019;12.
Техника эндоскопической ассистенции. Методика эндоскопической ассистенции.
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН, Москва
Применение эндоскопической ассистенции в хирургии опухолей мостомозжечкового угла
Проведен описательно-сравнительный анализ серии из 33 оперативных вмешательств по поводу опухолей мостомозжечкового угла (ММУ), проведенных в НИИ нейрохирургии им. Н.Н. Бурденко с 2010 по 2012 г., в ходе которых была применена методика эндоскопической ассистенции. Все пациенты были оперированы посредством ретросигмовидного субокципитального доступа в положении полусидя. Применение эндоскопической ассистенции в хирургии опухолей ММУ позволило увеличить радикальность проводимых вмешательств, cнизить риск развития послеоперационных осложнений путем сохранения анатомической целостности черепных нервов и важных сосудистых образований и обеспечения сохранности костных структур основания задней черепной ямки. Данные преимущества позволили сохранить и улучшить качество жизни пациентов с опухолями ММУ в послеоперационном периоде.
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Применение эндоскопической техники в хирургии опухолей основания черепа является одной из наиболее актуальных на сегодняшний день. За последние 10 лет значительно возрос интерес к изучению эффективности применения эндоскопической ассистенции (ЭА) в хирургии опухолей задней черепной ямки (ЗЧЯ) и, в частности, опухолей мостомозжечкового угла (ММУ). Несмотря на большое количество публикаций по данной теме 9, не существует единого мнения относительно пользы эндоскопии в хирургии новообразований данной области. При этом лишь в незначительной доле публикаций приводится сравнение результатов применения эндоскопии со схожими по нозологическим характеристикам группами больных, где эндоскопическая ассистенция не применялась.
Цель настоящего исследования - проведение сравнительно-описательного анализа результатов лечения пациентов с опухолями ММУ, подвергшихся оперативному лечению с применением ЭА.
Материал и методы
Исследуемая серия включала 33 пациента (24 женщины, 9 мужчин) в возрасте 15-68 лет (средний возраст 44 года), оперированных по поводу опухолей мостомозжечкового угла с применением эндоскопической ассистенции в НИИ нейрохирургии им. Н.Н. Бурденко с 2010 по 2012 г. В нее вошли 23 (70%) пациента с вестибулярной шванномой, 4 (12%) с менингиомами ЗЧЯ различной локализации, а также 5 (15%) с эпидермоидной кистой и 1 (3%) с липомой ММУ. Включение пациентов в исследуемую группу осуществлялось проспективно, при условии, что удаление опухолей производилось одной бригадой хирургов. Основным критерием исключения из группы служили тяжелые соматические заболевания, наличие которых могло повлиять на исход оперативного вмешательства вне зависимости от особенностей хирургического вмешательства. Данные о пациентах отражены в табл. 1.

Для анализа эффективности применения ЭА при удалении опухолей ММУ была сформирована контрольная группа пациентов, которым также проводилось удаление опухолей ММУ без применения эндоскопии. Данная группа состояла из 25 пациентов с невриномами слухового нерва и 5 - с менингиомами ЗЧЯ (9 мужчин, 21 женщина, возраст 15-70 лет, средний возраст - 47,4 года). Все пациенты контрольной группы были также оперированы в период с 2010 по 2012 г. в НИИ нейрохирургии им. акад. Н.Н. Бурденко (см. табл. 1).
Всем пациентам была выполнена магнитно-резонансная томография (МРТ) головного мозга. У пациентов с вестибулярными шванномами и менингиомами, распространявшимися в область внутреннего слухового прохода, была выполнена компьютерная томография (КТ) в «костном» режиме для оценки внутреннего слухового прохода (ВСП) на стороне опухоли и визуализации положения верхней луковицы внутренней яремной вены.
Для проведения ЭА использовались ригидные эндоскопы 30° и 70° с системой линз Hopkins, диаметром 2,7 мм и длиной 12 см. Для фиксации эндоскопа при выполнении эндоскопически-контролируемых манипуляций в 5 случаях был использован механический фиксатор эндоскопа.
Для статистического анализа использовался пакет Statistica for Windows v.10. Объектом обработки являлись результаты хирургического лечения. Для проведения анализа использовались следующие методы: χ 2 , χ 2 Пирсона, максимального правдоподобия χ 2 и др. для таблиц сопряженности. Критерием статистической достоверности получаемых данных считалась общепринятая величина p
Результаты
Все пациенты в нашей серии были оперированы с применением ретросигмовидного субокципитального доступа, производимого в положении пациента полусидя на операционном столе. При подготовке пациента к оперативному вмешательству в 23 случаях производилась установка стимулятора лицевого нерва (Medtronic NIM 3.0), не требующая применения в операционной специального нейрофизиологического оборудования и присутствия специалиста. Стойка с эндоскопическим оборудованием подготавливалась также до проведения операционного доступа, с учетом длины световода и провода камеры эндоскопа.
После проведения основного этапа вмешательства - удаления большей части опухоли и трепанации задней стенки ВСП производилась эндоскопическая инспекция ложа удаленной опухоли и просвета ВСП с целью контроля тотальности удаления внутриканальной части опухоли. При удалении эпидермоидных кист ММУ инспекция области ВСП не требовалась, однако существовала необходимость проведения контроля арахноидальных цистерн на наличие остатков опухоли. В случае обнаружения остатков новообразования в цистернах ММУ производилось эндоскопически контролируемое их удаление, а также при необходимости осуществлялся контроль положения волокон лицевого нерва под контролем эндоскопа. Необходимо отметить, что проведенная эндоскопическая инспекция устранила необходимость выполнения дополнительной ретракции гемисферы мозжечка и манипуляций с нейроваскулярными структурами для инспекции цистерн ММУ, получения дополнительного угла обзора и усиления освещенности операционной раны.
В основной, исследованной группе применить ЭА удалось у всех пациентов. В 1 случае после удаления парастволовой части капсулы холестеатомы отмечались эпизоды нестабильной гемодинамики, сопровождавшиеся значительным снижением pCO2 крови. Данное обстоятельство потребовало ускорения проведения заключительного этапа операции и не позволило в полной мере осуществить эндоскопическую инспекцию цистерн ММУ.
Необходимо также отметить, что в 23 случаях при проведении ЭА без дополнительной тракции мозжечка был обнаружен остаток опухоли. Удаление резидуальной части опухоли выполнено у 18 пациентов. В 1 случае проведение тотальной резекции опухоли было затруднено ввиду наличия выраженного, распространенного в область ВСП матрикса опухоли у пациентки с менингиомой задней поверхности пирамиды височной кости, в другом - ввиду крайне плотного сращения капсулы опухоли с корешком лицевого нерва у пациентки с вестибулярной шванномой. Во всех случаях дополнительной резекции опухоли использовалась как эндоскопическая эксплорация ложа опухоли, так и эндоскопически контролируемые хирургические манипуляции (удаление опухоли, локация лицевого нерва в месте вхождения его во ВСП и пр.).
В этой группе добиться тотального удаления опухоли удалось в 72% случаев. Факторами, не позволившими произвести тотальное удаление опухоли, были не технические характеристики микрохирургической техники или эндоскопа, а особенности роста опухоли, ее распространение на основание черепа и интимное сращение с нейроваскулярными структурами. Последний факт во всех случаях был выявлен только при помощи ЭА.
Более важным является тот факт, что в 70% случаев только ЭА позволила выявить остаток опухоли. Например, у пациентов с вестибулярными шванномами именно применение методики позволило на интраоперационном этапе обнаружить остаток опухоли во ВСП, убедиться в безопасности планируемого дополнительного рассверливания задней стенки ВСП и удалить остаток опухоли под контролем эндоскопа. У пациентов с холестеатомами ММУ применение методики позволило выявить и удалить недоступные обзору микроскопа фрагменты новообразования (нередко находившиеся на задней поверхности корешков черепных нервов).
Данные манипуляции, несомненно, также имели важное значение для предотвращения развития послеоперационного асептического менингита.
При сравнении групп пациентов по частоте развития пареза лицевого нерва данное осложнение чаще отмечалось у пациентов контрольной группы (p=0,0035). При этом за благоприятный исход принималась оценка от 1 до 2 баллов по шкале Хаус-Бракманна, остальные результаты (3-6 баллов) оценивались как развитие значимого пареза лицевого нерва.
Также в контрольной группе пациентов отмечалась меньшая радикальность удаления опухоли (в 57%), по данным контрольной МРТ, выявлялся остаток опухоли по сравнению с исследуемой (30% вмешательств носили субтотальный характер), при проведении теста χ 2 показатель p=0,0179 (табл. 2).
При анализе исходов по шкале Карновского медиана оценки качества жизни у пациентов контрольной группы равнялась 75,33 (стандартное отклонение ± 8,60), в то время как у пациентов основной группы - 80,6 (рис. 1).
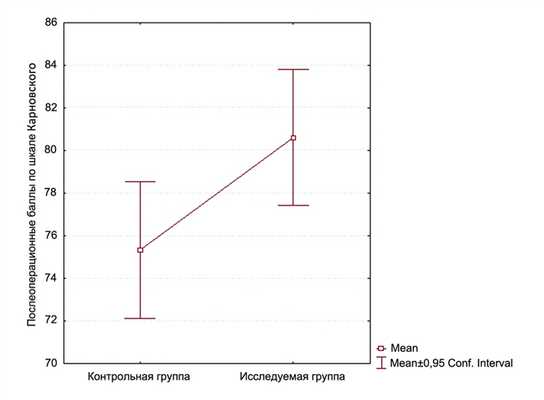
Рисунок 1. Сравнение контрольной и исследуемых групп по исходам по шкале Карновского. Проведенное с помощью теста Манна-Уитни исследование показало статистическую достоверность данного отличия (p=0,01).
В мировой литературе приведено достаточно иллюстративных работ, подтверждающих эффективность применения эндоскопии в хирургии опухолей ММУ [1-3, 5, 8, 9]. Основным преимуществом метода является возможность инспекции «слепых» для микроскопа зон, в частности, ВСП. Ряд авторов [4] также выдвигают гипотезу о необязательности резекции задней стенки ВСП в случае применения ЭА. Следует отметить, что данное предложение справедливо только для опухолей с незначительным распространением во ВСП. Поскольку таких пациентов в нашей серии не было, в 100% случаев трепанация задней стенки ВСП была необходимостью.
Несмотря на большое количество существующих публикаций, сравнение результатов лечения пациентов с применением ЭА и без ее применения проводилось лишь в единичных случаях. Более того, за последние 10 лет не встречается публикаций, описывавших результаты, полученные в смешанных группах больных. Это обстоятельство может отчасти объяснить отсутствие четко сформулированных показаний к применению ЭА в зависимости от типа опухоли. По данным Y. Kumon и соавт. [6], в группе с применением методики отмечалась как бо'льшая радикальность вмешательств, так и меньшее количество рецидивов в послеоперационном периоде. Авторами не получено статистически достоверной разницы в частоте сохранения «полезного» слуха и функции лицевого нерва. В нашей серии такая разница получена (p<0,05), что также отразилось на сравнении исходов операций с точки зрения качества жизни пациентов. Сохранение функции лицевого нерва являлось важным также и потому, что большинство оперированных пациентов - женщины.
На основании полученных результатов нами отработан алгоритм проведения ЭА при удалении опухолей ММУ (рис. 2).
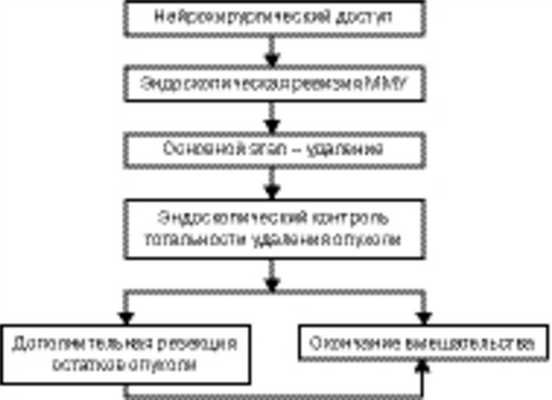
Рисунок 2. Алгоритм проведения ЭА. Следует отметить, что первичная инспекция образований данной локализации возможна только при размерах опухоли не более 20 мм. Также применение эндоскопической техники при удалении опухолей больших и гигантских размеров нередко затруднено ввиду выраженного кровотечения. Поскольку существующий инструментарий не позволяет выполнить эффективный гемостаз при использовании только эндоскопа, хирургу приходится возвращаться к стандартной микрохирургической методике. Более того, изначально подразумеваемый субтотальный характер вмешательств в случае большого размера опухоли делает применение ЭА нецелесообразным.
Наибольшая эффективность ЭА отмечалась нами в хирургии эпидермоидных кист ММУ. Этому способствуют особенности послеоперационного ложа опухоли - деформированный мозг на протяжении всей операции сохраняет свое положение и тем самым создает необходимое для проведения инспекции пространство. Применение эндоскопа позволяло обнаружить фрагменты опухоли в цистернах ММУ, недоступных для инспекции с помощью операционного микроскопа (рис. 3).
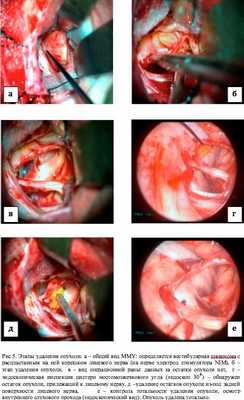
Рисунок 3. Этапы удаления опухоли. а - уменьшение опухоли в размерах; б - общий вид операционной раны после удаления основной части опухоли; в - эндоскопическая инспекция цистерн ММУ (эндоскоп 70°) - обнаружен остаток опухоли на задней поверхности лицевого нерва; г - удаление остатка опухоли; д - эндоскопический контроль: данных, свидетельствуюших об остатках опухоли, нет; е - общий вид операционной раны после удаления опухолевых масс. Применение методики в случае удаления вестибулярных шванном позволяло инспектировать ВСП и в случае обнаружения остатков опухоли производить их удаление, тем самым добиваясь радикального характера вмешательства. Осмотр области трепанации задней стенки ВСП с целью обнаружения костных дефектов побуждал нас применять меры профилактики ликвореи и в некоторых случаях проводить пластику сформировавшихся дефектов (рис. 4). Рисунок 4. Этапы удаления опухоли. а - уменьшение опухоли в размерах, идентификация лицевого нерва; б - трепанация задней стенки внутреннего слухового прохода; в - удаление интраканальной части менингиомы; г - идентификация VII ЧН в канале слухового нерва; д - эндоскопический вид основания черепа (эндоскоп 70°); е - контроль целостности VII ЧН (эндоскопический вид). При удалении менингиом задней поверхности височной кости, в том числе с распространением в область ВСП, применение эндоскопической техники позволяло оценить степень инвазии опухолевой ткани в костные структуры, а также установить источник кровотечения, нередко выпадающий из «поля зрения» микроскопа (рис. 5). Рисунок 5. Этапы удаления опухоли. а - общий вид ММУ: определяется вестибулярная шваннома с распластанным на ней корешком лицевого нерва (на нерве электрод стимулятора NIM); б - этап удаления опухоли; в - вид операционной раны: остатков опухоли нет; г - эндоскопическая инспекция цистерн мостомозжечкового угла (эндоскоп 30°) - обнаружен остаток опухоли, прилежащий к лицевому нерву; д - удаление остатков опухоли из-под задней поверхности лицевого нерва; е - контроль тотальности удаления опухоли, осмотр внутреннего слухового прохода (эндоскопический вид). Опухоль удалена тотально.
Радикальность проводимых операций зависела не только от размеров опухоли, ее связи с мозговыми структурами, но и от степени внедрения образования в область ВСП. Применение ЭА было эффективным способом выявления остатков опухоли, и в ряде случаев именно проведение эндоскопической инспекции позволяло изменять тактику операции ввиду повышения риска травматизации черепных нервов в результате дальнейшего удаления опухоли.
ЭА является эффективной методикой, используемой в хирургии опухолей ММУ. Она позволяет провести безопасную инспекцию ММУ, оценить степень радикальности удаления новообразований и протяженность резекции кости в случае трепанации ВСП. Данные возможности позволяют снизить риск развития послеоперационных осложнений и добиться большей радикальности удаления опухолей, а следовательно, сохранить и, в некоторых случаях, улучшить качество жизни пациентов.
Одновременная работа с микрохирургической техникой и эндоскопом требует навыка, а эндоскопический вид анатомии ММУ - особого восприятия. Поэтому наш первый опыт подтверждает необходимость прохождения специального тренинга.
Комментарий
В данном исследовании впервые в отечественной литературе выделены группы пациентов, в которых использование эндоскопической ассистенции в хирургическом лечении опухолей мостомозжечкового угла показано, целесообразно и малоэффективно. Описана схема развертывания операционной, техника проведения эндоскопической ассистенции на различных этапах удаления опухоли.
Автором представлен алгоритм проведения процедуры; проиллюстрирована эффективность применения методики в хирургии опухолей мостомозжечкового угла, заключающаяся в возможности проведения интраоперационного контроля тотальности удаления опухоли, а также инспекции структур мостомозжечкового угла без дополнительной тракции гемисферы мозжечка.
На основе проведенного исследования продемонстрирована возможность проведения интраоперационного контроля тотальности проведенного удаления опухоли и инспекции недоступных для обзора зон мостомозжечкового угла с целью снижения развития послеоперационных осложнений, доказана эффективность применения эндоскопической ассистенции в хирургии опухолей мостомозжечкового угла.
Статья В.К. Пошатаева и соавт. содержит сведения, актуальные для нейрохирургов, а также специалистов смежных специальностей - онкологов, неврологов, рентгенологов.
Применение эндоскопической ассистенции в хирургическом лечении больных с опухолями мосто-мозжечкового угла
Данная работа посвящена проведению описательно-сравнительного анализа серии из 33 оперативных вмешательств по поводу опухолей мосто-мозжечкового угла, проведенных в НИИ нейрохирургии им. Н.Н. Бурденко с 2010 по 2012 год, в ходе которых была применена методика эндоскопической ассистенции. Все пациенты были оперированы посредством ретросигмовидного субокципитального доступа в положении «полусидя». Применение ЭА в хирургии опухолей ММУ позволило увеличить радикальность проводимых вмешательств, снизить риск развития послеоперационных осложнений путем сохранения анатомической целостности черепных нервов и важных сосудистых образований, и обеспечением сохранности костных структур основания задней черепной ямки. Данные преимущества позволили сохранить и улучшить качество жизни пациентов с опухолями ММУ в послеоперационном периоде.
Введение.
Применение эндоскопической техники в хирургии опухолей основания черепа является одной из наиболее современных технологий на сегодняшний день. За последние 10 лет значительно возрос интерес к изучению эффективности применения эндоскопической ассистенции (ЭА) в хирургии опухолей задней черепной ямки и в частности, опухолей мостомозжечкового угла (ММУ). Несмотря на большое количество публикаций по данной теме 6, не существует единого мнения насчет пользы эндоскопии в хирургии новообразований данной области. При этом, лишь в незначительной доли публикаций приводится сравнение результатов применения эндоскопии со схожими по нозологическим характеристикам группами больных, где ЭА не применялась. Целью настоящего исследования являлось проведение сравнительно-описательного анализа результатов лечения в НИИ нейрохирургии пациентов с опухолями мосто-мозжечкового угла, подвергшихся оперативному лечению с применением ЭА.
Материалы и методы.
Исследуемая серия включала 33 пациентов (24 женщины, 9 мужчин), оперированных по поводу опухолей ММУ с применением ЭА в НИИ нейрохирургии им. Н.Н. Бурденко с 2010 по 2012 гг. В нее вошли 23 пациента с вестибулярной шванномой (70%), 4 пациента с менингиомами задней черепной ямки (ЗЧЯ) различной локализации (12%), а также 5 пациентов с эпидермоидной кистой (15%) и 1 пациент с липомой мостомозжечкового угла (3%). Медиана возраста пациентов составила 44 года (возрастной диапазон 15 - 68 лет). Включение пациентов в исследуемую группу осуществлялось проспективно, при условии, что удаление опухолей производилось одной бригадой хирургов (В.Ш; В.П.). Основным критерием исключения из группы служили тяжелые соматические заболевания, наличие которых могло повлиять на исход оперативного вмешательства, вне зависимости от особенностей хирургического вмешательства. Данные о пациентах отражены в таблице 1.
Для анализа эффективности применения эндоскопической ассистенции при удалении опухолей ММУ, была сформирована контрольная группа пациентов, которым также проводилось удаление опухолей ММУ без применения эндоскопии. Данная группа состояла из 25 пациентов с невриномами слухового нерва и 5 пациентов с менинигиомами ЗЧЯ (9 мужчин, 21 женщина, возраст 15-70 лет, медиана - 47,4 лет). Включение пациентов в обе группы производилось рандомизированно, с применением соответствующего программного обеспечения.
Все пациенты контрольной группы были также оперированы в период с 2010 по 2012 гг. в НИИ нейрохирургии им. акад. Н.Н. Бурденко (Табл.1).
Всем пациентам была выполнена МРТ головного мозга. У пациентов с вестибулярными шванномами и менингиомами, распространявшимися в область внутреннего слухового прохода, была выполнена КТ в «костном» режиме для оценки внутреннего слухового прохода (ВСП) на стороне опухоли и визуализации положения верхней луковицы внутренней яремной вены.
Для проведения эндоскопической ассистенции использовались ригидные эндоскопы 30° и 70° с системой линз Hopkins, диаметром 2.7 мм и длиной 12 см. Для фиксации эндоскопа при проведении эндоскопически-контролируемых манипуляций, в 5 случаях был использован механический фиксатор эндоскопа.
Послеоперационное наблюдение и выполнение контрольной МРТ головного мозга с контрастным усилением выполнялось у пациентов обеих групп через 3, 6, 12 месяцев после операции. Критерием тотальности удаления опухоли являлось отсутствие как интракраниального, так и интраканального компонента (для вестибулярных шванном) опухоли.
Для статистического анализа использовался пакет «STATISTICA for Windows v. 10». Объектом обработки являлись результаты хирургического лечения. Для проведения анализа использовались следующие методы: χ², χ² Пирсона, максимального правдоподобия χ² и др. для таблиц сопряженности. Критерием статистической достоверности получаемых данных нами считалась общепринятая величина p
Результаты.
Все пациенты обеих групп были оперированы с применением ретросигмовидного субокципитального доступа, производимого в положении полусидя на операционном столе. При подготовке пациента к оперативному вмешательству в 23 случаях производилась установка стимулятора лицевого нерва (Medtronic NIM 3.0), не требующая применения в операционной специального нейрофизиологического оборудования и присутствия специалиста. Стойка с эндоскопическим оборудованием подготавливалась также до проведения операционного доступа, с учетом длины световода и провода камеры эндоскопа.
После проведения основного этапа вмешательства - удаления большей части опухоли и трепанации задней стенки внутреннего слухового прохода (ВСП), производилась эндоскопическая инспекция ложа удаленной опухоли и просвета ВСП с целью контроля тотальности удаления внутриканальной части опухоли. При удалении эпидермоидных кист мостомозжечкового угла инспекция области ВСП не требовалась, однако существовала необходимость проведения контроля арахноидальных цистерн на наличие остатков опухоли. В случае обнаружения остатков новообразования в цистернах ММУ, производилось эндоскопически-контролируемое их удаление, а также, при необходимости осуществлялся контроль положения волокон лицевого нерва под контролем эндоскопа. Необходимо отметить, что проведенная эндоскопическая инспекция устранила необходимость проведения дополнительной ретракции гемисферы мозжечка и манипуляций со нейроваскулярными структурами для инспекции цистерн ММУ, получения дополнительного угла обзора и усиления освещенности операционной раны.
В нашей основной, исследованной группе, применить эндоскопическую ассистенцию удалось у всех пациентов. В одном случае, после удаления парастволовой части капсулы холестеатомы, отмечались эпизоды нестабильной гемодинамики, сопровождавшиеся значительным снижением pCO2 крови. Данное обстоятельство потребовало ускорения проведения заключительного этапа операции и не позволило в полной мере провести эндоскопическую инспекцию цистерн мостомозжечкового угла.
Необходимо также отметить, что в 23 случаях при проведении эндоскопической ассистенции без дополнительной тракции мозжечка, был обнаружен остаток опухоли. Удаление резидуальной части опухоли выполнено у 18. В одном случае проведение тотальной резекции опухоли было затруднено ввиду наличия выраженного, распространенного в область внутреннего слухового прохода матрикса опухоли у пациентки с менингиомой задней поверхности пирамиды височной кости, в другом - крайне плотным сращением капсулы опухоли и корешком лицевого нерва у пациентки с вестибулярной шванномой. Во всех случаях дополнительной резекции опухоли нами использовалась как эндоскопическая эксплорация ложа опухоли, так и эндоскопически-контролируемые хирургические манипуляции (удаление опухоли, локация лицевого нерва в месте вхождения его во внутренний слуховой проход и пр.).
В этой группе добиться тотального удаления опухоли удалось в 72% случаев. Факторами, не позволившими произвести тотальное удаление опухоли, были не технические характеристики микрохирургической техники или эндоскопа, а особенности роста опухоли, ее распространение на основание черепа и интимное сращение с нейроваскулярными структурами. Последний факт во всех случаях был выявлен только при помощи эндоскопической ассистенции.
Более важным является тот факт, что в 70 % случаев только эндоскопическая ассистенция позволила выявить остаток опухоли. Например, у пациентов с вестибулярными шванномами, именно применение методики позволило на интраоперационном этапе обнаружить остаток опухоли во внутреннем слуховом проходе, убедиться в безопасности планируемого дополнительного рассверливания задней стенки внутреннего слухового прохода и удалить остаток опухоли под контролем эндоскопа. У пациентов с холестеатомами мосто-мозжечкового угла применение методики позволило выявить и удалить недоступные обзору микроскопа фрагменты новообразования (нередко находившиеся на задней поверхности корешков черепных нервов).
Данные манипуляции, несомненно, также имели важное значение для предотвращения развития послеоперационного асептического менингита.
При сравнении основной и контрольной групп пациентов по частоте развития пареза лицевого нерва, данное осложнение чаще отмечалось у пациентов из контрольной группы (p=0,0035). При этом, за благоприятный исход принималась оценка от 1 до 2 баллов по шк. Хаус-Бракманн, остальные результаты (3-6 баллов) оценивались, как развитие значимого пареза лицевого нерва.
Также в контрольной группе пациентов отмечалась меньшая радикальность удаления опухоли (в 57% по данным контрольной МРТ отмечался остаток опухоли) по сравнению с исследуемой (30% вмешательств носили субтотальный характер), при проведении теста χ2 показатель p=0,0179 (Табл. 2).
При проведении анализа исходов по шкале Карновского, медиана оценки качества жизни у пациентов контрольной группы равнялась 75,33 (ст. отклонение ± 8,60), в то время как у пациентов основной группы - 80,6. (Рис.2). Проведенное с помощью теста Мана-Уитни исследование показало статистическую достоверность данного отличия (p=0,01).
В мировой литературе приведено достаточно иллюстративных работ, подтверждающих эффективность применения эндоскопии в хирургии опухолей мостомозжечкового угла [1,2,3,5,8,9]. Основным преимуществом метода выделяется возможность инспекции «слепых» для микроскопа зон, в частности - внутреннего слухового прохода. Ряд авторов также выдвигает гипотезу о необязательности резекции задней стенки ВСП в случае применения ЭА [4]. Следует отметить, что данное предложение справедливо только для опухолей с незначительным распространением во внутренний слуховой проход. Поскольку таких пациентов в нашей серии не было, в 100% случаев трепанация задней стенки ВСП была необходимостью.
Несмотря на большое количество существующих публикаций, сравнение результатов лечения пациентов с применением ЭА и без нее, проводилось лишь в единичных случаях. Более того, за последние 10 лет не встречается публикаций, описывавших результаты, полученные в смешанных группах больных. Это обстоятельство может отчасти объяснить отсутствие четко сформулированных показаний к применению ЭА в зависимости от типа опухоли. По данным Y. Kumon и соавт., в группе с применением методики отмечалась как большая радикальность вмешательств, так и меньшее количество рецидивов в послеоперационном периоде [6]. Авторами не получено статистически-достоверной разницы в частоте сохранения «полезного» слуха и функции лицевого нерва. В нашей серии такая разница получена (p<0,05), что также отразилось на сравнении исходов операций с точки зрения качеств жизни пациентов. Сохранение функции лицевого являлось важным также с той точки зрения, что большинство оперированных нами пациентами являются женщинами.
На основании полученных результатов, нами отработан алгоритм проведения ЭА при удалении опухолей мосто-мозжечкового угла (Рис. 1). Следует отметить, что первичная инспекция образований данной локализации возможна только при размерах опухоли не более 20 мм. Также, применение эндоскопической техники при удалении опухолей больших и гигантских размеров нередко затруднено ввиду выраженного кровотечения. Поскольку существующий инструментарий не позволяет выполнить эффективный гемостаз при использовании только эндоскопа, хирургу приходится возвращаться к стандартной микрохирургической методике. Более того, изначально подразумеваемый субтотальный характер вмешательств в случае большого размера опухоли, делает применение ЭА нецелесообразным.
Наибольшая эффективность применения ЭА отмечалась нами в хирургии эпидермоидных кист мостомозжечкового угла. Этому способствуют особенности послеоперационного ложа опухоли - деформированный мозг на протяжении всей операции сохраняет свое положение и тем самым, создает необходимо для проведения инспекции протранство. Применение эндоскопа позволяло обнаружить фрагменты опухоли в цистернах мосто-мозжечкового угла, недоступных для инспекции с помощью операционного микроскопа (Рис. 3). Применение методики в случае удаления вестибулярных шванном позволяло инспектировать внутренний слуховой проход и в случае обнаружения остатков опухоли производить их удаление, тем самым, добиваться радикального характера вмешательства. Осмотр области трепанации задней стенки внутреннего слухового прохода с целью обнаружения костных дефектов побуждал нас применять меры профилактики ликвореи и в некоторых случаях, проводить пластику сформировавшихся дефектов (Рис. 5). При удалении менингиом задней поверхности височной кости, в том числе с распространением в область внутреннего слухового прохода, применение эндоскопической техники позволяло оценить степень инвазии опухолевой ткани в костные структуры, а также установить источник кровотечения, нередко выпадающий из «поля зрения» микроскопа (Рис. 4).
Радикальность проводимых операций зависела не только от размеров опухоли, ее связи с мозговыми структурами, но и от степени внедрения образования в область внутреннего слухового прохода. Применение ЭА было эффективным способом выявления остатков опухоли и в ряде случаев, именно проведение эндоскопической инспекции позволяло изменять тактику операции, ввиду повышения риска травматизации черепных нервов в результате дальнейшего удаления опухоли.
Эндоскопическая ассистенция является эффективной методикой, используемой в хирургии опухолей мосто-мозжечкового угла. Она позволяет провести безопасную инспекцию мостомозжечкового угла, оценить степень радикальности удаления новообразований и протяженность резекции кости в случае трепанации внутреннего слухового прохода. Данные возможности позволяют снизить риск развития послеоперационных осложнений и добиться большей радикальности удаления опухолей, а следовательно, сохранить и в некоторых случаях, улучшить качество жизни пациентов.
Одновременная работа с микрохирургической техникой и эндоскопом требует навыка, а эндоскопический вид анатомии ММУ - особого восприятия. Поэтому наш первый опыт подтверждает необходимость прохождения специального тренинга.
Микрохирургическое удаление опухолей основания черепа с применением эндоскопической ассистенции
Категории МКБ: Внутричерепной абсцесс и гранулема (G06.0), Вторичное злокачественное новообразование головного мозга и мозговых оболочек (C79.3), Доброкачественное новообразование гипофиза (D35.2), Доброкачественное новообразование головного мозга над мозговым наметом (D33.0), Доброкачественное новообразование головного мозга неуточненное (D33.2), Доброкачественное новообразование головного мозга под мозговым наметом (D33.1), Доброкачественное новообразование других уточненных частей центральной нервной системы (D33.7), Доброкачественное новообразование костей черепа и лица (D16.4), Доброкачественное новообразование краниофарингеального протока (D35.3), Доброкачественное новообразование оболочек головного мозга (D32.0), Доброкачественное новообразование черепных нервов (D33.3), Другие уточненные врожденные аномалии мозга (Q04.8), Злокачественное новообразование большого мозга, кроме долей и желудочков (C71.0), Злокачественное новообразование височной доли (C71.2), Злокачественное новообразование гипофиза (C75.1), Злокачественное новообразование других и неуточненных черепных нервов (C72.5), Злокачественное новообразование желудочка мозга (C71.5), Злокачественное новообразование зрительного нерва (C72.3), Злокачественное новообразование костей черепа и лица (C41.0), Злокачественное новообразование краниофарингеального протока (C75.2), Злокачественное новообразование лобной доли (C71.1), Злокачественное новообразование оболочек головного мозга (C70.0), Злокачественное новообразование обонятельного нерва (C72.2), Злокачественное новообразование слухового нерва (C72.4), Злокачественное новообразование: поражение спинного мозга и других отделов центральной нервной системы, выходящее за пределы одной и более вышеуказанных локализаций (C72.8), Злокачественное новообразование: поражение, выходящее за пределы одной и более вышеуказанных локализаций головного мозга (C71.8), Новообразования неопределенного или неизвестного характера головного мозга над мозговым наметом (D43.0), Новообразования неопределенного или неизвестного характера головного мозга под мозговым наметом (D43.1), Новообразования неопределенного или неизвестного характера других частей центральной нервной системы (D43.7), Новообразования неопределенного или неизвестного характера оболочек головного мозга (D42.0), Новообразования неопределенного или неизвестного характера черепных нервов (D43.3)
Общая информация
Краткое описание
Микрохирургическое удаление опухолей основания черепа с применением эндоскопической ассистенции - это методика удаления опухолей, включающая использование эндоскопического оборудования для визуализации операционной раны, идентификации сосудистых и нервных структур и проведения интраоперационного контроля эффективности проведенного вмешательства [1,2].
Задача эндоскопической ассистенции - обеспечить полную визуализацию основных анатомических структур основания черепа, которая недоступна при микроскопической визуализации.
Название протокола: Микрохирургическое удаление опухолей основания черепа с применением эндоскопической ассистенции.
С72.8 Поражение головного мозга и других отделов ЦНС, выходящее за пределы одной и более вышеуказанных локализаций
D32.0 Доброкачественное новообразование оболочек головного мозга
D33.0 Доброкачественное новообразование головного мозга над мозговым наметом
D33.1 Доброкачественное новообразование головного мозга под мозговым наметом
D33.2 Доброкачественное новообразование головного мозга неуточненное
D33.3 Доброкачественное новообразование черепных нервов
D33.7 Доброкачественное новообразование других уточненных частей ЦНС
D35.2 Доброкачественное новообразование гипофиза
D35.3 Доброкачественное новообразование краниофарингеального протока
D42.0 Новообразования неопределенного или неизвестного характера оболочек головного мозга
D43.0 Новообразование неопределенного или неизвестного характера над мозговым наметом.
D43.1 Новообразование неопределенного или неизвестного характера под мозговым наметом
D43.3 Новообразование неопределенного или неизвестного характера черепных нервов
D43.7 Новообразование неопределенного или неизвестного характера других частей ЦНС
Q04.8 Другие уточненные врожденные аномалии мозга
G06.0 Внутричерепной абсцесс и гранулема
Сокращения, используемые в протоколе:
АВМ артерио-венозная мальформация
ЗЧЯ Задняя черепная ямка
КТ компьютерная томография
МРТ магнитно-резонансная томография
ОАК общий анализ крови
ОАМ общий анализ мочи
ПЧЯ передняя черепная ямка
ПЭТ позитронно-эмиссионная томография
СЧЯ средняя черепная ямка
ЦНС центральная нервная система
Читайте также:
