Техника, этапы операции при повреждении шейного отдела пищевода
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Алтайский государственный медицинский университет, кафедра общей хирургии, городская больница №12, Барнаул
Государственное бюджетное учреждение высшего профессионального образования «Алтайский государственный медицинский университет» Минздрава РФ, Барнаул, Россия
Отделение общей хирургии
Кафедра общей хирургии ГБОУ ВПО «Алтайский государственный медицинский университет» МЗ РФ, Россия
Эндохирургия доброкачественных заболеваний и повреждений пищевода (с комментарием)
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2016;(10): 21‑26
Обобщен опыт различных типов видеоэндохирургических вмешательств, выполненных 159 больным с различными доброкачественными заболеваниями и перфорацией пищевода. Разработана оригинальная техника видеоторакоскопической экстирпации пищевода с одномоментной видеолапароскопической эзофагогастропластикой, видеолапаротрансхиатального дренирования заднего средостения при перфорации пищевода. Представлены результаты видеолапароскопической эзофагокардиомиотомии при ахалазии кардии, видеоторакоскопической энуклеации лейомиомы пищевода и дивертикулэктомии.
Материал и методы
С использованием видеоэндохирургических технологий нами оперированы 159 пациентов с доброкачественными заболеваниями и перфорацией пищевода (табл. 1).

Таблица 1. Характеристика оперированных больных
В зависимости от характера заболевания были выполнены различные типы видеоэндохирургических вмешательств (табл. 2).
Таблица 2. Типы видеоэндохирургических операций на пищеводе
Показанием к эзофагопластике у больных с послеожоговым рубцовым стенозом пищевода была облитерация его просвета или неэффективность бужирования. При выполнении эзофагопластики всем пациентам производилась трансторакальная экстирпация пищевода с одномоментной (50 человек) или отсроченной (6 человек) эзофагоколо/гастропластикой с проведением трансплантата в заднем средостении и формированием соустья с шейным сегментом пищевода. Отсроченная эзофагопластика производилась на этапе освоения метода из-за трудностей визуализации стенки пищевода при выделении его из периэзофагеальных сращений. Эзофагоколопластика была выполнена 17 больным, у которых невозможно было сформировать трансплантат из желудка (сочетанный послеожоговый стеноз пищевода и желудка, разобщенный кровоток по большой кривизне желудка вследствие ранее сформированной гастростомы).
Предпочтение отдавали выполнению эзофагопластики целым желудком (39 человек). Первоначально формирование трансплантата производилось из лапаротомного доступа (45 больных). В последующем нами была разработана техника трансторакальной экстирпации пищевода из правостороннего доступа с одномоментной видеолапароскопической гастропластикой (11 человек). Учитывая трудности при выделении пищевода из рубцовых сращений и опасность повреждения прилежащих органов, производилось пересечение пищевода над дугой непарной вены с мобилизацией проксимального конца до верхней апертуры грудной клетки, а дистального - до диафрагмы (рис. 1).
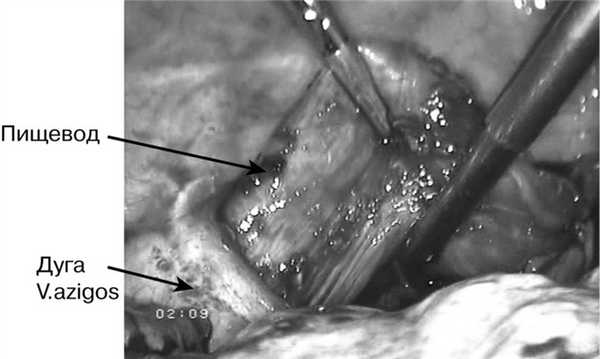
Рис. 1. Выделение пищевода над дугой непарной вены.
При видеолапароскопическом этапе операции производили мобилизацию желудка по большой кривизне с сохранением желудочно-сальниковых артерий. Левую желудочную артерию клипировали и пересекали ниже ее деления на восходящую и нисходящую ветви. Двенадцатиперстную кишку мобилизовали по Кохеру. Через минилапаротомный срединный доступ в эпигастральной области дистальную культю пищевода и кардиальный отдел желудка выводили в операционную рану. При наличии гастростомы это производили через место фиксации желудка к передней брюшной стенке после закрытия желудочного свища. Пищевод резецировали с использованием линейного степлера после предварительной пилородилатации через эзофаготомный разрез. Мобилизованный желудок в заднем средостении проводили на шею, где анастомозировали с проксимальной культей пищевода (рис. 2).
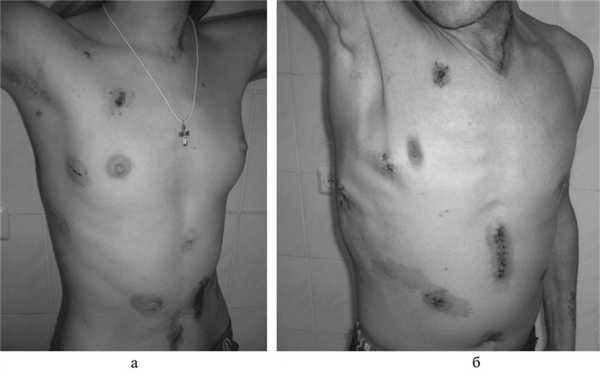
Рис. 2. Фотографии больных после видеоторакоскопической экстирпации пищевода с одномоментной видеолапароскопической эзофагогастропластикой при наличии гастростомы (а) и без нее (б).
Для лечения больных с перфорацией грудного отдела пищевода мы использовали технику видеолапаротрансхиатального дренирования заднего средостения, которая из лапаротомного доступа была предложена P. Lilienthal (1923 г.), Б.С. Розановым (1942 г.) и с успехом применялась М.М. Абакумовым (2004 г.). При лапароскопии производили рассечение диафрагмально-пищеводной связки с выделением пищеводного отверстия диафрагмы. Наконечником отсасывателя и тупфером в заднем средостении по окружности выделяли пищевод до появления бариевой суспензии, которую давали больному для рентгенологической диагностики перфорации пищевода. После аспирации бария и гнойного содержимого с помощью лапароскопа производили медиастиноскопию для оценки адекватности мобилизации пищевода и исключения дополнительных затеков и перемычек. Без зашивания перфоративного отверстия заднее средостение дренировали двухпросветной трубкой, проксимальный конец которой подводили к верхней точке гнойной полости средостения, где и находилось перфоративное отверстие пищевода. Дистальный конец трубки располагали под правой долей печени и выводили через дополнительный прокол в правом подреберье. Средостение герметизировали путем сшивания ножек диафрагмы над пищеводом интракорпоральным швом. В поддиафрагмальном пространстве устанавливали страховочный дренаж с выведением его наружу в левом подреберье. Для функционального выключения пищевода и проведения энтерального питания формировали видеоассистированную гастростому, при перфорации пищевода в средней трети грудного отдела, или еюностому, при перфорации грудного отдела пищевода в нижней трети. В послеоперационном периоде проводили проточно-промывное дренирование заднего средостения. Для контроля динамики сокращения гнойной полости в заднем средостении и рубцевания перфоративного отверстия пищевода на 10-14-е сутки выполняли фистулографию с водорастворимым контрастным веществом. При отсутствии полости и поступления контраста в просвет пищевода дренажную трубку из средостения удаляли.
У пациентов с лейомиомой пищевода производилась ее энуклеация из торако- или лапароскопического доступа в зависимости от локализации новообразования. При лейомиоме грудного отдела пищевода обычно выполняли видеоторакоскопическую энуклеацию опухоли из правостороннего доступа (8 человек). Лишь у одной больной с опухолью больших размеров (8×10 см) по левой боковой поверхности пищевода с пролабированием в левую плевральную полость видеоторакоскопическое вмешательство произведено через левую плевральную полость. При затрудненном интраоперационном позиционировании опухоли, не превышающей в диаметре 1 см, использовали фиброэзофагоскопию с эффектом трансиллюминации (3 больных). После энуклеации лейомиомы целостность слизистой оболочки пищевода визуально контролировали путем интраоперационной фиброэзофагоскопии и пневмопрессии.
Видеоторакоскопическое удаление дивертикулов пищевода производили из правостороннего доступа с использованием эндостеплеров ENDOPATH-60, EndoJA-30, Эшелон-60. Линию аппаратного шва погружали интракорпоральным непрерывным адвентициально-мышечным швом.
У большинства оперированных больных ахалазией кардии (84,8±3,7%) была III и IV стадии заболевания с эндоскопическими признаками эзофагита.
Независимо от стадии заболевания и степени выраженности функциональных нарушений пищевода всем больным произведена видеолапароскопическая эзофагокардиомиотомия по Геллеру с передней гемиэзофагофундопликацией по Дор.
У пациентов с ахалазией кардии IV стадии, при выраженной S-образной деформации пищевода производили ее устранение путем мобилизации пищевода в заднем средостении с низведением в брюшную полость. Рассечение мышечной оболочки пищевода производили на протяжении зоны сужения, на 1,5-2,0 см выше ее и книзу до интимного сращения мышечной оболочки со слизистой оболочкой, что указывало на достижение кардиального отдела желудка. Левый край рассеченной мышечной оболочки пищевода отсепаровывали от слизисто-подслизистого слоя до ½ его окружности. Это приводило к существенному увеличению диаметра пищевода в зоне миотомии и препятствовало смыканию краев рассеченной мышечной оболочки. К краям миотомной раны непрерывным интракорпоральным швом фиксировали переднюю стенку желудка.
В отдаленном послеоперационном периоде у 17 человек, перенесших эзофагопластику, возникли различные осложнения. Из них у 13 пациентов наступило стенозирование анастомоза между трансплантатом и культей шейного отдела пищевода, которое чаще возникало у пациентов, перенесших пластику пищевода толстой кишкой (7 человек), и было устранено бужированием. У 2 человек возникла дискинезия толстокишечного трансплантата, проявляющаяся регургитацией желудочного содержимого. У одного из пациентов это привело к развитию выраженных электролитных нарушений и белково-энергетическому дефициту. Несмотря на обеспечение энтерального питания через сформированную еюностому, прогрессировали катаболические нарушения, приведшие к смерти больного. У второго пациента дискинезия толстокишечного трансплантата корригируется медикаментозно. У двух больных после эзофагогастропластики целым желудком возник пилороспазм, который устранен баллонной дилатацией привратника.
В отдаленные сроки после эзофагопластики у больных послеожоговым рубцовым стенозом пищевода отмечено статистически значимое улучшение качества жизни по всем показателям в 1,5-2 раза (опросник SF-36), которые после эзофагогастропластики и эзофагоколопластики существенно не отличались.
После выполнения видеолапаротрансхиатального дренирования заднего средостения течение раннего послеоперационного периода у 6 человек осложнилось развитием пневмонии. После операции умерли 2 больных от сопутствующих заболеваний (прогрессирующая острая сердечная недостаточность, профузное кровотечение из язвы двенадцатиперстной кишки). У остальных пациентов наступило рубцевание перфоративного отверстия.
При гистологическом и иммуногистохимическом исследовании удаленных новообразований пищевода была подтверждена лейомиома, размеры которой составляли от 0,5 до 8,0×10,0 см в диаметре. Несостоятельность интракорпорального шва наступила у 2 больных, что потребовало видеолапаротрансхиатального дренирования заднего средостения и видеоассистированной еюностомии по Майдлю, после чего наступило выздоровление. Через 7 мес после операции у одной пациентки на месте удаленной опухоли развился рубцовый стеноз нижней 1/3 пищевода. После исключения рецидива заболевания проходимость пищевода восстановлена однократным сеансом ортоградного бужирования по направителю.
После видеоторакоскопического удаления дивертикула несостоятельность швов грудного отдела пищевода возникла у 1 пациента. Осложнение устранено путем видеолапаротрансхиатального дренирования заднего средостения.
При выполнении видеолапароскопической эзофагокардиомиотомии, передней гемиэзофагофундопликации по Дор интраоперационное осложнение в виде точечной перфорации слизистой оболочки пищевода возникло у одного пациента и было ликвидировано путем наложения интракорпорального узлового шва. В отдаленные сроки после операции (от 6 мес до 17 лет) у всех 56 обследованных пациентов отмечено значительное улучшение проходимости пищевода. Рентгенологически регистрировалось достоверное уменьшение диаметра пищевода, увеличение просвета кардии в момент ее раскрытия более чем в 2 раза, снижение продолжительности задержки контрастного вещества над кардией, возрастание скорости опорожнения пищевода. По результатам эзофагоманометрии выявлено снижение уровня базального тонуса пищевода, более выраженное при поздних стадиях заболевания. Восстановление моторики пищевода проявлялось статистически значимым увеличением амплитуды сокращений пищевода у пациентов с ахалазией пищевода III и IV стадии. При изучении показателей качества жизни (опросник SF-36) после оперативного лечения установлено достоверное улучшение физического функционирования, социального функционирования, жизненной активности, снижение интенсивности болевого синдрома.
Заключение
Использование эндовидеохиругических технологий позволяет с успехом выполнять сложные реконструктивные вмешательства при дисфагии у больных с рубцовыми стенозами пищевода и ахалазией кардии даже при ее поздних стадиях, производить удаление доброкачественных опухолей и дивертикулов грудного отдела пищевода, обеспечивает адекватное дренирование заднего средостения при перфорации стенки пищевода.
Комментарий
Снижение травматичности операций на пищеводе является, несомненно, перспективным направлением использования эндовидеохирургических технологий. Отдельной похвалы заслуживает опыт малоинвазивных вмешательств, добросовестно изученный авторами статьи. В то же время нелишне подчеркнуть, что эндоскопический доступ не отменяет положений, ранее выработанных в открытой хирургии. В этой связи считаем необходимым сделать несколько комментариев.
Эндовидеохирургическая экстирпация пищевода с одномоментной пластикой становится все более распространенным методом лечения. Большинство авторов используют узкий желудочный стебель, сформированный из большой кривизны желудка с кровоснабжением за счет правых желудочно-сальниковых сосудов. Узкий желудочный трансплантат избавляет от необходимости дилатации привратника. При раннем прерыве аркады по большой кривизне возможно формирование желудочного стебля с дополнительным кровоснабжением за счет правой желудочной и нисходящей ветви левой желудочной артерий, что избавляет от необходимости пластики толстой кишкой. Выведение желудка на переднюю брюшную стенку через правый параректальный разрез удобнее, чем минилапаротомия по средней линии или в области бывшей гастростомы для формирования желудочного трансплантата с деликатной работой в области его сосудистой ножки.
Лапароскопическое дренирование заднего средостения оказывается малоинвазивной методикой, но следует подчеркнуть, что инсуффляция воздуха должна быть прекращена, иначе за счет турбулентных потоков инфекция распространится по брюшной полости и дополнительно имбибирует ткани заднего средостения. Барий является неудачным контрастным препаратом, при подозрении на несостоятельность по давно известным причинам. Не менее надежным маркером дефекта стенки пищевода будет свежая гематома и мутное отделяемое (слюна). Минилапаротомия под мечевидным отростком может оказаться не худшим доступом для вскрытия и дренирования заднего средостения. Лейомиома менее 1 см в диаметре не требует агрессивной хирургической тактики, тем более что у 2 из 13 больных возникла несостоятельность.
Операция Дора, операция Геллера с неполной фундопликацией по Дору, не лучший способ органосохраняющей операции при кардиоспазме II и III степени и никак не применима при мегаэзофагусе. Пропульсивное сокращение стенки пищевода при ахалазии IV стадии невозможно по определению, так как уже III стадия отличается от II стадии необратимыми дегенеративными изменениями стенки, делающими нецелесообразными органосберегающие операции из-за плохих отдаленных результатов, что косвенно подтверждается и результатами авторов, отметивших продолжительную задержку контрастного вещества над кардией.
Вмешательства на шейном отделе пищевода Шейная эзофаготомия
Шейная эзофаготомия производится для оперативного извлечения застрявших в пищеводе или перфорировавших его инородных тел, если произвести такое извлечение через эндоскоп невозможно. Кроме того, через шейную эзофаготомию подлежат удалению инородные тела, застрявшие в верхней части грудного отдела пищевода, если их верхний конец не заострен и, таким образом, при извлечении нет опасности повредить стенку пищевода. Попытки форсированного извлечения инородных тел из воспаленного, легко кровоточащего пищевода через эндоскоп могут привести к дополнительным тяжелым повреждениям.
Доступ к пищеводу в зависимости от локализации повреждения совершается с левой или с правой стороны(рис. 3-131).Инородное тело, как правило, хорошо пальпируется через стенку пищевода, иногда часть этого предмета видна, когда он уже проникнет через ткани стенки пищевода. Кости, щепки, иглы, гвозди и другие предметы нередко находятся уже за пределами просвета пищевода, впереди позвоночного столба.
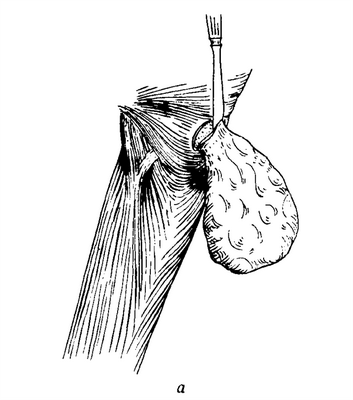
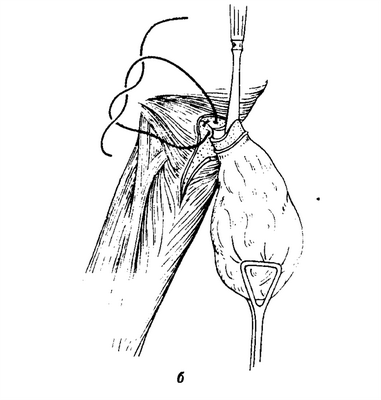
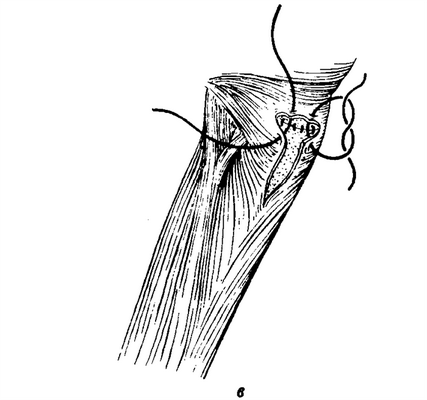
Рис. 3-131. Ценкеровский шейный пограничный дивертикул. а) Выделенный слева ценкеровский дивертикул, б) миотомия шейной части пищевода и резекция дивертикула, в) поперечные швы пищевода и продольная мио-томия
Отверстие в этих случаях, как правило, находится в районе гипофаринкса или в области грушевидного отростка. Отверстие в пищеводе в большинстве случаев спонтанно заживает, поэтому не всегда возникает необходимость в наложении шва.
Если инородное тело прочно застряло в пищеводе и не пропороло его стенку, то в этом месте производят небольшой разрез и удаляют его через созданное отверстие. Разрез на пищеводе зашивают несколькими швами; при этом следует обращать внимание на то, чтобы не сузить просвет. Мягкие ткани шеи закрываются послойно над резиновой дренажной трубкой. Рекомендуется воздержаться от перорального кормления больного на протяжении 3-5дней в тех случаях, если шов пищевода был наложен по всем правилам. Может случиться, что к моменту оперативного вмешательства на шейной части пищевода возникло тяжелое воспаление и в его стенке образовался большой дефект. При этой ситуации следует наложить для питания больного гастро-стому. Способность ран шейного отдела пищевода к заживлению может быть признана весьма хорошей.
Вмешательства при ценкеровском дивертикуле
Дивертикул, возникающий на уровне входа в пищевод, дорзально, на границе между пищеводом и глоткой, обычно расположен на левой половине шеи. Наполненный пищей и мокротой, он может вызвать полное прекращение глотательной способности. Решающее значение в этом имеет ахалазия перстневидно-глоточной мышцы. Поэтому Belsey (1965)предложил миотомию на протяжении нескольких сантиметров верхней части пищевода.
Оперативное вмешательство сравнительно простое. Вскрытие пищевода выполняется обычно слева (см. рис. 3-131).Выделение дивертикула из окружающих тканей не представляет особых трудностей. Так как стенка дивертикула состоит из слизистой, то надо избегать излишнего ее вытяжения из просвета пищевода, чтобы не вызвать при зашивании краев раны стеноза. Слизистую пищевода зашивают тонкими кетгутовыми швами, по возможности в поперечном направлении. Мышечный слой шьют шелковыми или лавсановыми одиночными узловатыми швами. Может быть использован также атравматичный непрерывный шов для закрытия слизистой пищевода.
После экстирпации дивертикула по вышеупомянутой причине (ахалазия) рекомендуется произвести разъединение перстневидно-глоточной мускулатуры. При потягивании вверх баллонный катетер, введенный в пищевод и надутый там, застревает, наталкиваясь на перстневидно-глоточное мышечное кольцо. Провести миотомию над баллонным катетером уже не представляет трудности. После миотомии возникновение
ОСОБЕННОСТИ ЛЕЧЕНИЯ БОЛЬНЫХ С ПОВРЕЖДЕНИЕМ ГЛОТКИ И ПИЩЕВОДА ПРИ ПЕРЕДНЕМ ШЕЙНОМ СПОНДИЛОДЕЗЕ

Цель. Уточнить причины возникновения, выявить особенности повреждения и усовершенствовать тактику лечения больных с проникающим повреждениями пищевода после переднего шейного спондилодеза или в комбинации с ним. Материал и методы: За период с 01.01.2003 по 31.12.2016 годы в НИИ СП им. Н.В. Склифосовского прооперированно 24 пациента с повреждением пищевода после операции на шейном отделе позвоночника передним доступом. Инструментальная диагностика повреждения пищевода включала в себя рентгенологический (обзорная рентгенография шеи и груди, рентгеноконтрастное исследование пищевода с жидкой бариевой взвесью, фистулография, компьютерная томография шеи и средостения) и эндоскопический методы (эзофагоскопия), а также магнитно-резонансную томографию шеи. Все больные были оперированы мультидисциплинарной бригадой в составе нейрохирурга, хирурга и пластического хирурга. Результаты: Всем больным удалось восстановить или сохранить опороспособность позвоночного столба, при этом удалить инфицированные трансплантаты, при необходимости выполнить адекватную декомпрессию сосудисто-нервных образований позвоночного столба и фиксацию позвоночно-двигательного сегмента. Органосохраняющая операция на шейном отделе пищевода путем ушивания дефекта пищевода двухрядным швом в сочетании с миопластикой выполнена 21 больному. Органодеструктивные операции выполнены 2 пациентам. Умер 1 больной.Заключение: Повреждения пищевода после переднего шейного спондилодеза или в комбинации с ним остаются редким осложнением, поэтому получать большой опыт в лечении таких больных в условиях одной клиники не представляется возможным. В связи с этим любые публикации на эту тему представляют большой интерес. Учитывая неудовлетворительные результаты консервативной терапии, золотым стандартом можно считать хирургическое лечение в условиях многопрофильного стационара с участием мультидисциплинарной бригады.
Ключевые слова
Полный текст
Техника, этапы операции при повреждении шейного отдела пищевода
С использованием видеоэндохирургических технологий нами оперированы 159 пациентов с доброкачественными заболеваниями и перфорацией пищевода. С ахалазией кардии было 72 (45,3%) больных, с послеожоговым рубцовым стенозом пищевода - 56 (35,2%), с перфорацией пищевода - 14 (8,8%), с лейомиомой пищевода - 13 (8,2%), с дивертикулом грудного отдела пищевода - 4 (2,5%) больных. Им были выполнены следующие операции: видеолапароскопическая эзофагокардиомиотомия по Геллеру с передней гемиэзофагофундопликацией по Дору (72), видеоторакоскопическая экстирпация пищевода с одномоментной или отсроченной эзофагоколо- или гастропластикой (56), видеолапаротрансхиатальное дренирование заднего средостения (14), видеоторакоскопическое удаление лейомиомы пищевода (9), видеолапароскопическое удаление лейомиомы пищевода (4), видеоторакоскопическая дивертикулэктомия (4).
У большинства оперированных больных с ахалазией кардии была III и IV стадия заболевания с эндоскопическими признаками эзофагита.
Всем больным произведена видеолапароскопическая эзофагокардиомиотомия по Геллеру с передней гемиэзофагофундопликацией по Дору. В случае ахалазии кардии IV стадии с выраженной S-образной деформацией пищевода последнюю устраняли путем мобилизации пищевода в заднем средостении с низведением в брюшную полость. Рассечение мышечной оболочки пищевода выполняли на протяжении зоны сужения, на 1,5-2 см выше ее и книзу до интимного сращения мышечной оболочки со слизистой оболочкой, что указывало на достижение кардиального отдела желудка. Левый край рассеченной мышечной оболочки пищевода отсепаровывали от слизисто-подслизистого слоя до ½ его окружности. Это приводило к существенному увеличению диаметра пищевода в зоне миотомии и препятствовало смыканию краев рассеченной мышечной оболочки. К краям миотомной раны непрерывным интракорпоральным швом фиксировали переднюю стенку желудка.
Показанием к эзофагопластике у больных с послеожоговым рубцовым стенозом пищевода была облитерация его просвета или неэффективность бужирования. При выполнении эзофагопластики всем пациентам производили трансторакальную экстирпацию пищевода с одномоментной (n=50) или отсроченной (n=6) эзофагоколо- или гастропластикой с проведением трансплантата в заднем средостении и формированием соустья с шейным сегментом пищевода. Отсроченную эзофагопластику производили на этапе освоения метода из-за трудностей визуализации стенки пищевода при выделении его из периэзофагеальных сращений. Эзофагоколопластику выполнили в 17 наблюдениях, в которых невозможно было сформировать трансплантат из желудка (сочетанный послеожоговый стеноз пищевода и желудка, разобщенный кровоток по большой кривизне желудка из-за ранее сформированной гастростомы).
Предпочтение отдавали эзофагопластике целым желудком (n=39). Первоначально трансплантат формировали, используя лапаротомный доступ (n=45). В последующем нами была разработана техника трансторакальной экстирпации пищевода из правостороннего доступа с одномоментной видеолапароскопической гастропластикой (n=11). Учитывая трудности при выделении пищевода из рубцовых сращений и опасность повреждения прилежащих органов, его пересекали над дугой непарной вены с мобилизацией проксимального конца до верхней апертуры грудной клетки, а дистального - до диафрагмы (рис. 1).
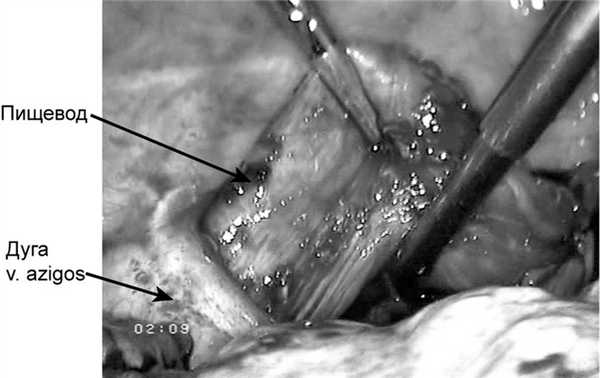
Рис. 1. Интраоперационная фотография. Выделение пищевода над дугой непарной вены.
На видеолапароскопическом этапе операции производили мобилизацию желудка по большой кривизне с сохранением желудочно-сальниковых артерий. Левую желудочную артерию клипировали и пересекали ниже ее деления на восходящую и нисходящую ветви. Двенадцатиперстную кишку мобилизовывали по Кохеру. Через минилапаротомный срединный доступ в эпигастральной области дистальную культю пищевода и кардиальный отдел желудка выводили в операционную рану. При наличии гастростомы это производили через место фиксации желудка к передней брюшной стенке после закрытия желудочного свища. Пищевод резецировали с использованием линейного степлера после предварительной пилородилатации через эзофаготомный разрез. Мобилизованный желудок в заднем средостении проводили на шею, где анастомозировали с проксимальной культей пищевода (рис. 2).
Для лечения больных с перфорацией грудного отдела пищевода мы использовали технику видеолапаротрансхиатального дренирования заднего средостения, которая из лапаротомного доступа была предложена P. Lilienthal (1923 г.), Б.С. Розановым (1942 г.) и с успехом применялась М.М. Абакумовым (2004 г.). При лапароскопии производили рассечение диафрагмально-пищеводной связки с выделением пищеводного отверстия диафрагмы. Наконечником отсасывателя и тупфером в заднем средостении по окружности выделяли пищевод до появления бариевой суспензии, которую давали больному для рентгенологической диагностики перфорации пищевода. После аспирации бария и гнойного содержимого с помощью лапароскопа производили медиастиноскопию для оценки адекватности мобилизации пищевода и исключения дополнительных затеков и перемычек. Без зашивания перфорационного отверстия заднее средостение дренировали двухпросветной трубкой, проксимальный конец которой подводили к верхней точке гнойной полости средостения, где и находилось перфорационное отверстие пищевода. Дистальный конец трубки располагали под правой долей печени и выводили через дополнительный прокол в правом подреберье. Средостение герметизировали путем сшивания ножек диафрагмы над пищеводом интракорпоральным швом. В поддиафрагмальном пространстве устанавливали страховочный дренаж с выведением его наружу в левом подреберье. Для функционального выключения пищевода и осуществления энтерального питания производили видеоассистированное формирование гастростомы при перфорации пищевода в средней трети грудного отдела или еюностомы при перфорации грудного отдела пищевода в нижней трети. В послеоперационном периоде проводили проточно-промывное дренирование заднего средостения. Для контроля динамики сокращения гнойной полости в заднем средостении и рубцевания перфорационного отверстия пищевода на 10-14-е сутки выполняли фистулографию с водорастворимым контрастным веществом. При отсутствии полости и поступления контрастного вещества в просвет пищевода дренажную трубку из средостения удаляли.
При лейомиоме пищевода производили ее энуклеацию из торако- или лапароскопического доступа в зависимости от локализации новообразования. При лейомиоме грудного отдела пищевода обычно выполняли видеоторакоскопическую энуклеацию опухоли из правостороннего доступа (n=8). Лишь у одной больной с опухолью большого размера (8×10 см) по левой боковой поверхности пищевода с пролабированием в левую плевральную полость видеоторакоскопическое вмешательство произвели через левую плевральную полость. При затрудненном интраоперационном позиционировании опухоли, не превышающей в диаметре 1 см, использовали фиброэзофагоскопию с эффектом трансиллюминации (n=3). После энуклеации лейомиомы целостность слизистой оболочки пищевода визуально контролировали путем интраоперационной фиброэзофагоскопии и пневмопрессии.
Видеоторакоскопическое удаление дивертикулов пищевода производили из правостороннего доступа с использованием эндостеплеров. Линию аппаратного шва погружали интракорпоральным непрерывным адвентициально-мышечным швом.
Результаты и обсуждение
При выполнении видеолапароскопической эзофагокардиомиотомии, передней гемиэзофагофундопликации по Дору интраоперационное осложнение в виде точечной перфорации слизистой оболочки пищевода возникло у одного пациента и было ликвидировано путем наложения интракорпорального узлового шва. В отдаленные сроки после операции (от 6 мес до 17 лет) у всех 56 обследованных пациентов отмечено значительное улучшение проходимости пищевода. Рентгенологически регистрировалось достоверное уменьшение диаметра пищевода, увеличение просвета кардии в момент ее раскрытия более чем в 2 раза, снижение продолжительности задержки контрастного вещества над кардией, повышение скорости опорожнения пищевода. По результатам эзофагоманометрии выявлено снижение уровня базального тонуса пищевода, более выраженное в поздних стадиях заболевания. Восстановление моторики пищевода проявлялось статистически значимым увеличением амплитуды сокращений пищевода у пациентов с ахалазией кардии III и IV стадии. При изучении показателей качества жизни (опросник SF-36) после оперативного лечения установлено достоверное улучшение физического и социального функционирования, жизненной активности, уменьшение интенсивности болевого синдрома.
После видеоторакоскопической экстирпации пищевода с эзофагопластикой из лапаротомного доступа на этапе освоения метода в раннем послеоперационном периоде умерли 3 больных. Причиной смерти явилась массивная кровопотеря вследствие кровотечения из точечного ранения дуги аорты (1 больной), некроз трансплантата из восходящей ободочной кишки с терминальным отделом подвздошной кишки (1), прогрессирующая полиорганная дисфункция на фоне белково-энергетического дефицита (1). В группе больных, перенесших видеоторакоскопическую экстирпацию пищевода с одномоментной лапароскопической гастропластикой, летальных исходов не было. После видеоторакоскопической экстирпации пищевода с одномоментной видеолапароскопической эзофагогастропластикой целым желудком длительность послеоперационного периода была достоверно меньше, чем после эзофагогастропластики и эзофагоколопластики из лапаротомного доступа (соответственно на 8 и 6 койко-дней).
В отдаленном послеоперационном периоде у 17 человек, перенесших эзофагопластику, возникли различные осложнения. У 13 из них наступило стенозирование анастомоза между трансплантатом и культей шейного отдела пищевода, которое чаще возникало у пациентов, перенесших пластику пищевода толстой кишкой (n=7), и было устранено бужированием. У 2 человек отмечена дискинезия толстокишечного трансплантата, проявляющаяся регургитацией желудочного содержимого. У одного пациента это привело к развитию выраженных электролитных нарушений и белково-энергетическому дефициту. Несмотря на обеспечение энтерального питания через сформированную еюностому, прогрессировали катаболические нарушения, приведшие к смерти больного. У другого пациента дискинезию толстокишечного трансплантата корригировали медикаментозно. У 2 больных после эзофагогастропластики целым желудком возник пилороспазм, который устранен баллонной дилатацией привратника.
В отдаленные сроки после эзофагопластики у больных с послеожоговым рубцовым стенозом пищевода отмечено статистически значимое улучшение качества жизни по всем показателям в 1,5-2 раза (опросник SF-36), которые после эзофагогастропластики и эзофагоколопластики существенно не различались.
После выполнения видеолапаротрансхиатального дренирования заднего средостения течение раннего послеоперационного периода у 6 больных осложнилось развитием пневмонии. После операции умерли 2 больных от сопутствующих заболеваний (прогрессирующая острая сердечная недостаточность, профузное кровотечение из язвы двенадцатиперстной кишки). У остальных пациентов наступило рубцевание перфорационного отверстия.
При гистологическом и иммуногистохимическом исследованиях удаленных новообразований пищевода была подтверждена лейомиома, размер которой составлял от 0,5 см в диаметре до 8×10 см. Несостоятельность интракорпорального шва отмечена у 2 больных, что потребовало видеолапаротрансхиатального дренирования заднего средостения и видеоассистированной еюностомии по Майдлю, после чего наступило выздоровление. Через 7 мес после операции у одной пациентки на месте удаленной опухоли развился рубцовый стеноз нижней трети пищевода. После исключения рецидива заболевания проходимость пищевода восстановлена однократным сеансом ортоградного бужирования по направителю.
После видеоторакоскопического удаления дивертикула несостоятельность швов грудного отдела пищевода возникла у одного пациента. Осложнение устранено путем видеолапаротрансхиатального дренирования заднего средостения.
Таким образом, использование эндовидеохирургических технологий позволяет с успехом выполнять сложные реконструктивные вмешательства при дисфагии у больных с рубцовым стенозом пищевода и ахалазией кардии даже в ее поздних стадиях, производить удаление доброкачественных опухолей и дивертикулов грудного отдела пищевода, обеспечивать адекватное дренирование заднего средостения при перфорации стенки пищевода.
В настоящее время во всем мире прослеживается тенденция к увеличению числа операций на пищеводе, выполняемых как при злокачественных, так и при доброкачественных его заболеваниях миниинвазивным методом. Такой метод имеет очевидные преимущества - прежде всего снижает травматическое воздействие на переднюю брюшную и особенно грудную стенку при сохранении возможности проводить необходимые по объему хирургические манипуляции внутри каждой из полостей. При этом наиболее часто для замещения пищевода как при частичном, так и при полном его удалении используют желудок. В случае невозможности его использования, особенно при сочетанных химических ожогах пищевода и желудка, тотальное замещение пищевода осуществляют отрезком толстой кишки. Такая тактика является общепринятой в мире при использовании открытого доступа [1, 2], но лишь в одном наблюдении описана техника выполнения малоинвазивной дистальной резекции пищевода по поводу рака нижней трети пищевода с переходом на кардиальный отдел желудка [3].
Мировой опыт пластики пищевода толстой кишкой миниинвазивным методом отсутствует.
Нашей целью явилась демонстрация успешного лечения больного с протяженной ожоговой стриктурой пищевода, которому потребовалось выполнить торакоскопическую экстирпацию пищевода с одномоментной пластикой отрезком толстой кишки с формированием эзофагоколоанастомоза на шее. Все этапы операции выполнены полностью эндовидеохирургическим методом.
Больной Т., 54 лет, обратился в клинику 26.06.13 с жалобами на затруднение прохождения твердой и жидкой пищи по пищеводу в течение 3 мес, снижение массы тела на 15 кг. С его слов, в феврале 2013 г. случайно сделал несколько глотков уксусной кислоты. В течение 10 дней находился под наблюдением в стационаре по месту жительства.
Обследование в МКНЦ
По данным эзофагоскопии, от верхней трети пищевода его слизистая отечна, белесая, с множественными рубцами. На расстоянии 35 см от резцов выявлена циркулярная язва, покрытая фибрином, и стриктура, суживающая просвет пищевода до 0,4 см. Осмотреть дистальные отделы пищевода и желудок стандартным эндоскопом на данном этапе не удалось. Рентгенография: протяженность рубцовой стриктуры до 12 см. Она захватывает нижнюю и среднюю треть пищевода. Супрастенотически пищевод расширен до 4 см (рис. 1). Патологических изменений в желудке не выявлено.

Рис. 1. Рентгенограмма. Протяженность стриктуры (стрелки).
С целью детального осмотра желудка и подготовки больного к оперативному лечению мы выполнили 2 процедуры бужирования стриктуры. Проходимость пищи восстановлена частично. При повторной ЭГДС данных о поражении слизистой оболочки и деформации дистальных отделов пищевода и желудка не получено. После предоперационной подготовки и коррекции алиментарного статуса больной оперирован в плановом порядке 24.07.13.
Техника операции
Эндотрахеальный наркоз с раздельной интубацией бронхов. Правое легкое полностью выключали из акта вентиляции перед введением иглы Вереша. В правой плевральной полости создавали давление до 7 мм рт.ст.
Торакальный этап
Положение больного на левом боку с отведенной вверх правой рукой. После установки 4 троакаров выделили непарную вену, которую пересекли с помощью аппарата Endo GIA-30 (белая кассета) (рис. 2).
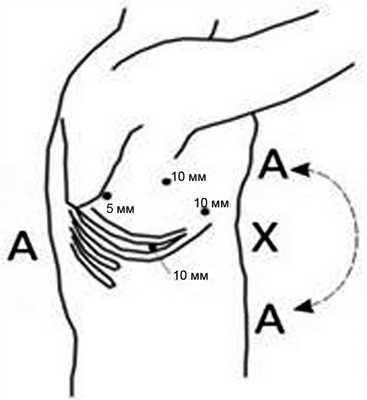
Рис. 2. Схема расположения бригады хирургов и расстановки троакаров при выполнении торакального этапа операции (положение на левом боку). Здесь и на рис. 3: Х - хирург; А - ассистент.
Пищевод циркулярно мобилизовали на уровне средней трети и взяли на держалку, за которую осуществляли тракцию. Ветви бронхиальных артерий и грудной аорты пересекали гармоническим скальпелем либо ножницами после клипирования сосудов.
Пищевод последовательно отделяли от трахеи и перикарда, легочной вены и грудного отдела аорты. Следует подчеркнуть, что в ходе мобилизации пищевода дифференцировать его стенку от окружающих тканей было крайне сложно, в этой зоне отмечалась также повышенная диффузная кровоточивость тканей из-за явлений периэзофагита.
Абдоминальный этап
Положение больного на спине с разведенными нижними конечностями. Первоначально мы планировали заместить пищевод желудком. Для мобилизации желудка и формирования желудочной трубки установили веерообразно в горизонтальной плоскости с расположением лапароскопа около пупка 6 троакаров: 5 по 10 мм, 1 диаметром 12 мм (рис. 3). С помощью печеночного ретрактора Nathanson сместили II и III сегменты печени медиальнее, открыв доступ к пищеводу.
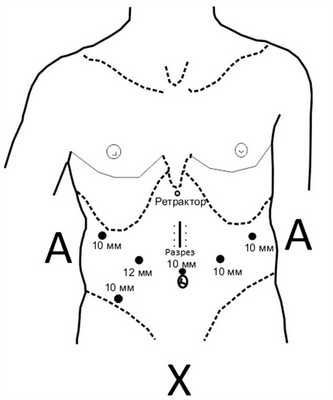
Рис. 3. Схема расположения хирургов и расстановки троакаров при выполнении абдоминального этапа операции.
Этап формирования желудочного трансплантата
От средней трети желудка до его пилорического отдела желудочно-ободочная связка пересечена ультразвуковым скальпелем Harmonic («Ethicon Endo-Surgery», Великобритания). Правые желудочно-сальниковые сосуды сохранены на всем протяжении. Для лучшей подвижности желудочной трубки двенадцатиперстная кишка мобилизована по Кохеру. Мобилизацию начинали с рассечения заднего листка брюшины ультразвуковым скальпелем Гармоник от печеночно-двенадцатиперстной связки по краю нисходящей ветви двенадцатиперстной кишки вплоть до ее нижнего изгиба и далее забрюшинно под корнем мезоколон до связки Трейтца. Далее продолжали мобилизацию желудка по большой кривизне по направлению к селезенке. При этом пересекали у основания левую желудочно-сальниковую артерию, короткие желудочные сосуды и диафрагмально-желудочную связку. В ходе мобилизации желудка по малой кривизне для лучшей подвижности желудочной трубки пересекали правую желудочную артерию. Визуализировали, клипировали и пересекали левые желудочные сосуды.
Изоперистальтическая желудочная трубка выкроена полностью интракорпорально с помощью линейных сшивающих степлеров Endo GIA-45 и 60. Аппаратные швы погружены на всем протяжении серо-серозным непрерывным швом (пролен 3/0).
Шейный этап
Окончив этап формирования желудочной трубки, переходили к шейному доступу. Выделенный пищевод пересекли аппаратом Endo GIA-45 (синяя кассета). Препарат, включающий внутригрудную часть пищевода и малую кривизну желудка, был удален через дополнительный лапаротомный разрез длиной 4 см. При выведении желудочной трубки на шею оказалось, что ее длина недостаточна для формирования анастомоза на шее без натяжения и риск несостоятельности анастомоза очень высок.
В такой ситуации принято решение отказаться от пластики пищевода желудком и использовать для замещения пищевода толстую кишку.
Этап формирования толстокишечного трансплантата
Для формирования трансплантата использовали левую половину толстой кишки как наиболее простой вариант в техническом отношении. Необходимую длину трансплантата определяли с помощью нити. Для этого один ее конец прикладывали к углу нижней челюсти, а другой - к пупку. Как известно, толстокишечный трансплантат такой длины используется для тотальной пластики пищевода с формированием анастомоза с глоткой. Мы сознательно формировали трансплантат несколько большей длины, чем это необходимо, чтобы не столкнуться с таким осложнением, как недостаточная длина трансплантата.
Нить перемещали в брюшную полость. Один ее конец укладывали на корень брыжейки, располагали нить по ходу a. colica media, затем - по передней поверхности поперечной ободочной и сигмовидной кишок. Место расположения дистального конца нити маркировали, намечая дистальный уровень резекции толстой кишки. Кровоснабжение толстокишечного трансплантата сохраняли за счет a. colica media, располагая его в антиперистальтической позиции. Для проверки надежности кровоснабжения трансплантата с помощью сосудистых зажимов пережимали a. colica sinistra и аркаду к этой артерии, отходящей от верхней сигмовидной артерии. Убедившись в надежности кровоснабжения трансплантата, клипировали и пересекли a. colica sinistra и кишку, с помощью сшивающих аппаратов Endo GIA в ранее намеченных местах (рис. 4).
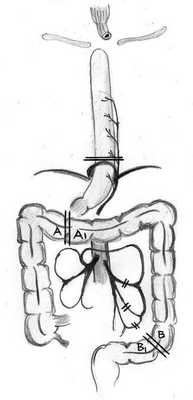
Рис. 4. Места пересечения толстой кишки (схема).
После завершения формирования трансплантата из толстой кишки накладывали межкишечный и желудочно-толстокишечный анастомозы. Через разрез на шее, трансмедиастинально, в брюшную полость проводили зонд, к которому фиксировали апикальный конец трансплантата, его выводили на шею и формировали эзофагоколоанастомоз отдельными узловыми швами конец в бок (рис. 5).

Рис. 5. Сформированный толстокишечный трансплантат (схема).
Рану на шее, плевральную и брюшную полость дренировали.
Результаты
Операция успешно закончена полностью тораколапароскопическим методом. Кровопотеря была минимальной на всех ее этапах и составила 100 мл. Интра- и послеоперационной гемотрансфузии не требовалось. Продолжительность операции составила 660 мин. Через 4 ч от момента окончания операции больной экстубирован в отделении реанимации и интенсивной терапии, где находился в течение 6 сут. После стабилизации состояния был переведен в хирургическое отделение. Рентгенологическое исследование на 7-е сутки с водорастворимым контрастным веществом: каких-либо затеков за пределы анастомозов нет.
Дренажи из брюшной полости удалены на 2-е сутки, а из плевральной - на 3-и сутки.
К 9-м суткам у больного отмечен подъем температуры, в лабораторных показателях выявлено увеличение содержания лейкоцитов до 12,2·10 9 /л. На 11-е сутки после операции рентгенологически у больного диагностирована микронесостоятельность эзофагоколоанастомоза. Рана на шее частично разведена. Выполнена установка зонда в толстокишечный трансплантат с целью проведения питания. Успешная консервативная терапия позволила выписать больного через 13 сут в удовлетворительном состоянии.
Плановое обследование в клинике проведено через 6 мес.
Состояние больного удовлетворительное. Жалоб на дисфагию нет. Пациент прибавил в массе 7 кг. Рентгенография: функция искусственного пищевода удовлетворительная (рис. 6).
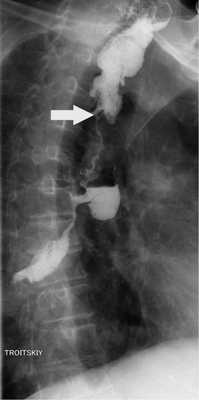
Рис. 6. Рентгенограмма искусственного пищевода (стрелка) через 6 мес.
Замещение пищевода сегментом толстой кишки, особенно у пациентов с протяженной ожоговой стриктурой, является методом выбора при невозможности использовать желудок в качестве пластического материала. При анализе литературы (PubMed, Medline, Embase, Cochrane) по этой теме только в одном источнике мы встретили упоминание о выполнении такого вмешательства полностью тораколапароскопическим методом. В 2007 г. T. Nguyen и соавт. [3] для восстановления непрерывности желудочно-кишечного тракта у больного кардиоэзофагеальным раком использовали правую половину ободочной кишки. Выполнив интерпозицию толстой кишкой, они сформировали внутриплевральный эзофагоколоанастомоз и кологастроанастомоз с дистальной культей желудка.
В нашем наблюдении решение об одномоментной пластике пищевода сегментом из левой половины толстой кишки стало вынужденной мерой после осознания того, что длина желудочного трансплантата недостаточна для формирования соустья на шее. В последующем, анализируя сложившуюся ситуацию и принимая во внимание накопление опыта, мы пришли к выводу, что интракорпорально не всегда удается достичь хорошего растяжения стенок желудка, что является обязательным условием для создания максимальной по длине желудочной трубки. В нашем наблюдении это привело к укорочению трубки и потребовало изменить первоначально намеченный объем вмешательства.
В своей дальнейшей практике мы отказались от интракорпорального выкраивания желудочной трубки и стали формировать ее через дополнительный срединный разрез (4 см) на передней брюшной стенке. С нашей точки зрения, это позволило сократить продолжительность операции и избежать проблем, связанных с недостаточной длиной трансплантата. При этом мы считаем, что такой подход не является более травматичным.
Успешный исход лечения этого пациента демонстрирует возможность выполнять пластику пищевода толстой кишкой миниинвазивным методом.
Таким образом, полностью тораколапароскопическая методика является безопасной при выполнении пластики пищевода толстой кишкой у пациентов с ожоговыми стриктурами пищевода в случае невозможности использовать желудок. Формирование желудочной трубки предпочтительнее выполнять на передней брюшной стенке через минилапаротомный разрез после мобилизации желудка интракорпорально. Подобные хирургические вмешательства следует выполнять в клиниках, располагающих достаточным опытом операций на пищеводе, и имеющих в штате специалистов, освоивших торако- и лапароскопическую технику.
Читайте также:
