Техника, этапы операции при травме двенадцатиперстной кишки
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского, Москва
Хирургические доступы к забрюшинным органам и структурам при травме живота
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2015;(7): 75‑77
Представлено подробное описание с иллюстрациями трех хирургических доступов, которые авторы используют для ревизии забрюшинных органов и структур у пострадавших с закрытой травмой и ранением живота. Приведены клинические наблюдения успешного использования разработанных доступов.
По данным Федеральной службы государственной статистики травмы, отравления и другие последствия воздействия внешних причин устойчиво занимают второе место в структуре заболеваемости населения Российской Федерации (86,2—91,7 на 1000 человек), уступая только болезням органов дыхания. Травма живота имеет место примерно у 8% пострадавших и у 20—40% из них приводит к образованию забрюшинного кровоизлияния. Таким образом, актуальность проблемы диагностики и лечения травматических забрюшинных кровоизлияний не вызывает сомнений.
Причиной образования забрюшинного кровоизлияния может быть повреждение крупных кровеносных сосудов и жизненно важных органов: абдоминального отдела пищевода, двенадцатиперстной кишки (ДПК) и толстой кишки, поджелудочной железы, почек, надпочечников, мочеточников, мочевого пузыря, абдоминального отдела аорты и ее ветвей, нижней полой вены и ее притоков. Почти все исследователи [1, 2, 5, 6, 8, 10, 11, 13, 16, 17, 20] считают ревизию раневого канала в забрюшинном пространстве абсолютно необходимой. Ревизия забрюшинного кровоизлияния при закрытой травме имеет и сторонников [3, 7], и противников [18]. Большинство авторов [9, 12, 14, 15, 19, 21] пропагандируют дифференцированный подход к ревизии.
Методы ревизии органов и структур забрюшинного пространства (за исключением приема Кохера) малоизвестны практическим хирургам. Выполнить ревизию органов и структур, расположенных выше или на уровне корня брыжейки поперечной ободочной кишки, т. е. тела и хвоста поджелудочной железы (особенно по задней поверхности), аорты и ее ветвей, нижней полой вены и ее притоков не просто. Особенно важен адекватный оперативный доступ при ранении, когда ревизию раневого канала необходимо выполнить по всей его длине. Как правило, его рассечение производят в условиях ограниченного пространства, сложных топографоанатомических взаимоотношений и плохой визуализации структур на фоне забрюшинного кровоизлияния.
Мы используем три принципиально разных доступа в зависимости от локализации забрюшинного кровоизлияния.
1. Левосторонний доступ (прием Mattox [4]) применяем при локализации забрюшинного кровоизлияния слева от диафрагмы до корня брыжейки поперечной ободочной кишки. Этот доступ дает возможность выделить и осмотреть аорту от диафрагмы до инфраренального отдела, чревный ствол, верхнюю брыжеечную и левую почечную артерии, селезенку, хвост и тело поджелудочной железы, нисходящую ободочную кишку, селезеночную артерию, левую почку и левый мочеточник. Схема левостороннего доступа представлена на рис. 1 (см. и далее).
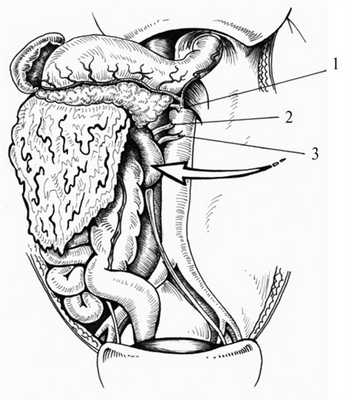
Рис. 1. Схема левостороннего доступа. 1 — чревный ствол, 2 — верхняя брыжеечная артерия, 3 — левая почечная артерия. Стрелка — направление смещения органов.
Производим тотальную срединную лапаротомию. Рассекаем париетальную брюшину на 1—2 см латеральнее и вдоль нисходящей ободочной кишки и пересекаем диафрагмально-ободочную связку (линия рассечения брюшины на рис. 2, а маркирована бриллиантовым зеленым). Тупым путем отделяем нисходящую ободочную кишку с питающими сосудами вместе с левой почкой, селезенкой, хвостом и частично телом поджелудочной железы в медиальном направлении (см. рис. 2, б). Мобилизацию названных выше органов продолжаем таким образом, чтобы вся забрюшинная клетчатка была отсепарована от мышц задней поверхности живота (см. рис. 2, в). После этого постепенным разделением забрюшинной клетчатки в нижней части разреза в медиальном направлении выделяем аорту в инфраренальном отделе. Затем, продолжая диссекцию краниально вдоль левой и передней стенок аорты, выделяем левую почечную и верхнюю брыжеечную артерии, чревный ствол (см. рис. 2, г). После разделения позадипочечной клетчатки полностью доступной осмотру становится левая почка и проксимальная часть левого мочеточника (см. рис. 2, д). Разделение парапанкреатической клетчатки позволяет осмотреть хвост и, частично, тело поджелудочной железы, а также дистальную часть селезеночной артерии (см. рис. 2, е). Осторожная мобилизация заднелевой стенки брюшного отдела аорты позволяет выделить поясничные артерии. При таком доступе также доступны осмотру поясничная часть диафрагмы и мышцы задней брюшной стенки.
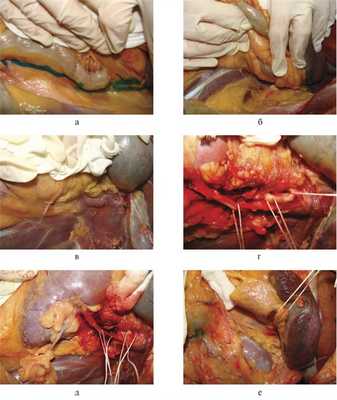
Рис. 2. Аутопсийные фотографии. Этапы выполнения левостороннего доступа (объяснение в тексте).
2. Правосторонний доступ (рис. 3) сочетает одновременное выполнение приема Кохера и мобилизации правой половины ободочной кишки. Применяем его при локализации забрюшинного кровоизлияния справа от диафрагмы до корня брыжейки тонкой кишки. Этот прием делает доступным осмотру нижнюю полую вену от инфрагепатического отдела до подвздошных вен, правую почку и мочеточник, восходящую ободочную кишку, верхнегоризонтальную, нисходящую и частично нижнегоризонтальную часть ДПК, правую почечную и подвздошную артерию.
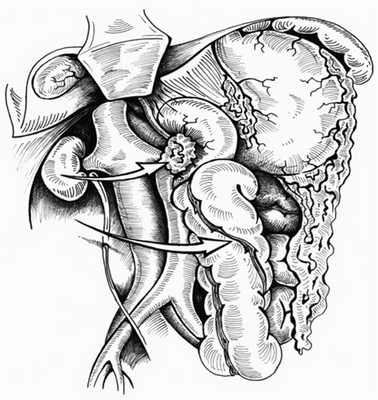
Рис. 3. Схема правостороннего доступа. Стрелки — направление смещения органов.
Производим верхнесредне-срединную лапаротомию. Рассекаем париетальную брюшину на 1—2 см латеральнее и вдоль восходящей ободочной кишки до уровня ее правого изгиба, затем разрез продлеваем краниально вдоль нисходящей части ДПК (прием Кохера). Восходящую ободочную кишку и ДПК с головкой поджелудочной железы в едином блоке отводим медиально так, чтобы диссекция тканей проходила во фронтальной плоскости кпереди от правой почки и почечных сосудов. Таким образом, верхнегоризонтальную, нисходящую и частично нижнегоризонтальную части ДПК, головку поджелудочной железы, восходящую ободочную кишку с питающими сосудами отводим медиально и кпереди. При этом становятся доступными осмотру не только перечисленные выше органы, но и нижняя полая вена от инфрагепатического отдела до подвздошных вен, обе почечные вены, правая почка и мочеточник, правая общая подвздошная артерия (рис. 4).
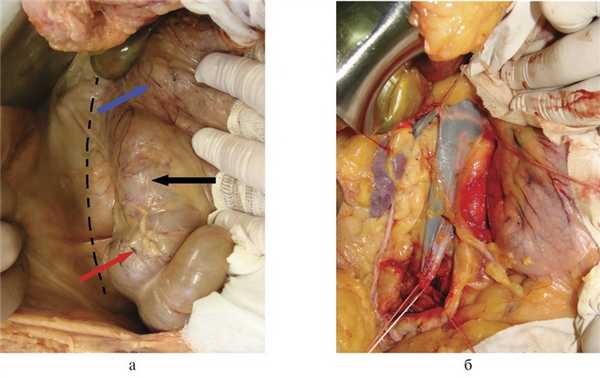
Рис. 4. Аутопсийные фотографии. а — правосторонний доступ. Пунктиром обозначена линия разреза брюшины вдоль восходящей ободочной кишки, красная стрелка — слепая кишка, черная стрелка — восходящая ободочная кишка, синяя стрелка — двенадцатиперстная кишка; б — вид операционного поля после выполнения доступа.
3. Нижний доступ (рис. 5) применяем при локализации забрюшинного кровоизлияния в области тела поджелудочной железы, корня брыжейки поперечной ободочной и тонкой кишки. Этот доступ позволяет визуализировать нисходящую, нижнегоризонтальную, восходящую части ДПК. Также оказываются доступными осмотру и оперативному приему передняя и задняя поверхности головки и тела поджелудочной железы, аорта от устьев почечных артерий и нижняя полая вена.
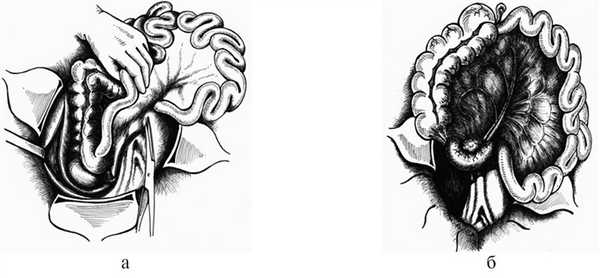
Рис. 5. Схема нижнего доступа. а — начало, б — окончание.
После верхнесредне-срединной лапаротомии рассекаем париетальную брюшину на 1—2 см латеральнее слепой и восходящей ободочной кишок и параллельно им (рис. 6, а). Затем разрезом париетальной брюшины огибаем снизу слепую кишку и продолжаем его краниально и влево вдоль корня брыжейки тонкой кишки (см. рис. 6, б). Начиная со слепой кишки, отслаиваем ее и восходящую ободочную кишку с питающими их сосудами в медиальном и краниальном направлениях, а также брыжейку тонкой кишки (краниально). Последовательно отделяем всю нижнегоризонтальную и восходящую части ДПК, головку и тело поджелудочной железы, нисходящую и верхнегоризонтальную части ДПК от задней стенки живота (см. рис. 6, в). Перечисленные выше органы отводим также краниально. Затем отделяем переднюю стенку нисходящей части ДПК от корня брыжейки поперечной ободочной кишки (см. рис. 6, г).
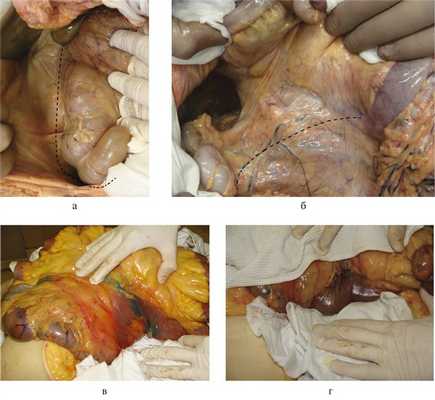
Рис. 6. Аутопсийные фотографии. Этапы выполнения нижнего доступа (объяснение в тексте).
Среди 166 пострадавших с проникающими колото-резаными ранениями живота, поступивших в Институт скорой помощи им. Н.В. Склифосовского, технические трудности отмечены у 3 (5,9%) из 51 пострадавшего с левосторонним латеральным забрюшинным кровоизлиянием, у 3 (7,7%) из 39 с нижнемедиальным, у 1 (8,3%) из 12 с верхнемедиальным, у 4 (10,8%) из 37 с правосторонним латеральным, у 1 (14,3%) из 7 с тазовым, у 4 (23,5%) из 17 с распространенным кровоизлиянием. Применение представленных доступов позволило выполнить полноценную ревизию, обнаружив все повреждения.
Приводим клинические наблюдения.
Больной Т., 28 лет, доставлен через 2 ч после травмы. При поступлении состояние средней тяжести. Вентиляционных и гемодинамических расстройств нет. Живот болезненный в левой половине, перитонеальные симптомы не определяются. Колото-резаная рана размером 30×8 мм в левой боковой области живота. При УЗИ обнаружены признаки большого левостороннего забрюшинного кровоизлияния.
Под эндотрахеальным наркозом выполнена верхнесредне-срединная лапаротомия. В брюшной полости крови нет. Через брюшину в области левого брыжеечного синуса просвечивает кровоизлияние с пропитыванием (рис. 7, а).
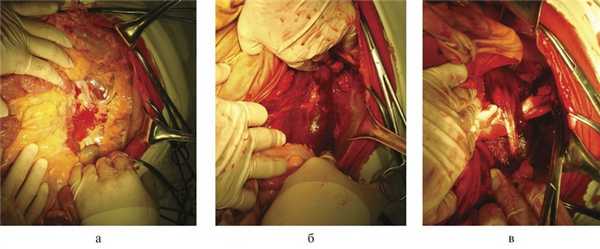
Рис. 7. Операционные фотографии. а — левостороннее латеральное забрюшинное кровоизлияние; б — вид после левостороннего доступа, гематома левой большой поясничной мышцы; в — рана большой поясничной мышцы.
Больная С., 30 лет, доставлена через 1,5 ч после травмы с клинико-инструментальной картиной наружного и внутрибрюшного кровотечения, причиной которого были множественные колото-резаные раны груди, правой поясничной области и конечностей. При катетеризации мочевого пузыря отмечена макрогематурия.
Под эндотрахеальным наркозом выполнена верхнесрединная лапаротомия. В брюшной полости 100 мл крови. Обнаружена рана бокового ската правой половины диафрагмы и рана сегмента VII печени, рана бокового ската левой половины диафрагмы и рана желудочно-ободочной связки, размер всех ран 10×2 мм. Визуализировано правостороннее забрюшинное паранефральное кровоизлияние с образованием свертков и переходом на парадуоденальную, параколическую и парапанкреатическую (кпереди от головки и перешейка поджелудочной железы) клетчатку. Раны печени и обеих половин диафрагмы ушиты. Выполнен правосторонний доступ, обнаружена сквозная рана нижнего полюса правой почки размером 10×3 мм, проходящая через нижнюю чашечку, и рана наружной стенки нисходящей части ДПК размером 3×1 мм с подтеканием желчи. При ревизии парапанкреатического кровоизлияния повреждения органов и сосудов не обнаружено. Выполнена правосторонняя нефрэктомия. Рана ДПК ушита двухрядными отдельными швами нитью PGA 4/0 и лаваном 2/0 на атравматической игле. Операция закончена дренированиием брюшной полости и ушиванием лапаротомной раны.
Несмотря на проведение антиферментной терапии (октреотид 900 мг/сут), течение послеоперационного периода осложнилось развитием травматического панкреатита, парапанкреатического инфильтрата. Больная выписана после проведения курса консервативной терапии, которая привела к резорбции инфильтрата.
Больной К., 18 лет, доставлен через 1 ч после травмы с признаками внутрибрюшного кровотечения. Колото-резаная рана размером 15×5 мм находилась справа в мезогастральной области.
Под эндотрахеальным наркозом выполнена верхнесрединная лапаротомия. В брюшной полости 900 мл крови и сгустков. При ревизии выявлена сквозная рана поперечной ободочной кишки размером 3×2 мм, рана брыжейки поперечной ободочной кишки, две сквозные раны тонкой кишки размером 2×2 мм на расстоянии 2 м от связки Трейтца, дистальнее на 10 см две сквозные раны брыжейки тонкой кишки размером 2×2 мм. При дальнейшей ревизии обнаружено массивное забрюшинное кровоизлияние с образованием свертков, распространяющееся от нижнегоризонтальной ветви ДПК до малого таза. Произведена ревизия структур забрюшинного пространства с использованием нижнего доступа. Выявлены рана передней стенки нижней полой вены размером 2×1 мм, отсечение правой яичковой вены в месте ее впадения в нижнюю полую вену, а также сквозная рана нижнегоризонтальной части ДПК размером 2×2 мм. Раны нижней полой вены ушиты нитью Prolene 4/0. Достигнут гемостаз. Выполнено поэтапное ушивание ран ДПК, тонкой и ободочной кишки, ушивание ран брыжейки ободочной и тонкой кишки. Операция закончена назоинтестинальной интубацией и дренированием брюшной полости. Течение послеоперационного периода без осложнений.
Таким образом, использование разработанных универсальных доступов позволяет выполнить полноценную ревизию забрюшинных органов и структур в сложных топографоанатомических условиях и при наличии забрюшинного кровоизлияния различной локализации и распространения.
Техника, этапы операции при травме двенадцатиперстной кишки
Проведен анализ лечения 15 пострадавших с травмами двенадцатиперстной кишки. Разработана диагностическая программа при разрывах двенадцатиперстной кишки в зависимости от уровня повреждения. Сформулированы современные принципы хирургического лечения при травмах двенадцатиперстной кишки в зависимости от сроков поступления пострадавших в стационар с момента получения травмы, размеров дефекта стенки двенадцатиперстной кишки, уровня повреждения, сочетанных повреждений панкреатодуоденальной зоны.
Management for closed injuries of the duodenum
The analysis of treatment of 15 patients with injuries of the duodenum was conducted. Diagnostic software with rupture of the duodenum, depending on the level of the injury was developed. It was formulated the modern principles of surgical treatment of injuries of the duodenum, depending on the timing of the victims to the hospital from the time of injury, the size of the defect duodenal wall, the level of injury, associated injuries pancreatoduodenal zone.
Задача исследования: улучшение результатов хирургического лечения пострадавших с закрытыми повреждениями 12 п.к. путем усовершенствования существующих и разработки новых методов профилактики и лечения пациентов с закрытыми повреждениями 12 п.к.
Материалы и методы
За период с 2003 по 2012 год в отделении абдоминальной хирургии РКБ МЗ РТ оперированы 15 пострадавших с повреждениями 12 п.к. Изолированные повреждения 12 п.к. наблюдались в 8 случаях, сочетание травмы 12 п.к. с разрывом печени — в 3, с повреждением желудка одном и травмой поджелудочной железы — в 3. Все пациенты были лицами трудоспособного возраста (от 22 до 54 лет), мужчин 12, женщин — 3. Восемь пострадавших были доставлены в первые 6 часов с момента получения травмы, 5 — поступили от 6 до 12 часов, 2 — доставлены в приемное отделение спустя 12 часов с момента получения травмы.
Лучевые методы диагностики повреждений 12 п.к. порой имеют определяющее значение. Обзорная рентгенография органов брюшной полости обеспечивает выявление наличия свободного газа и свободной жидкости в брюшной полости, косвенных признаков воспаления и повреждения, таких как эмфизема в забрюшинном пространстве, усиление четкости правого контура почки, стертость границ правой поясничной мышцы. Если в забрюшинном пространстве воздуха нет, но имеется подозрение на разрыв кишки, необходимо произвести нагнетание воздуха через назогастральный зонд. В этом случае его ретроперитонеальное скопление становится обширнее и заметнее на снимках. Серийная рентгенография верхних отделов живота позволяет обнаружить расширение просвета 12 п.к. с появлением «спиральной пружины» в вертикальной и нижней горизонтальной частях кишки в результате клапанообразного перекрытия ее просвета интрамуральной гематомой. При отсутствии достаточных данных на обзорной рентгенограмме следует произвести рентгенологическое исследование с приемом водорастворимого контраста. В некоторых случаях возможно попадание контраста за просвет кишки в зоне ее повреждения и распространение его вне — или внутрибрюшинно. Обзорная рентгенография органов брюшной полости выполнено всем 15 (100%) пострадавшим, при этом лишь у 5 пациентов выявлены вышеуказанные рентгенологические признаки повреждения 12 п.к. Информативность метода, при данной патологии, составила 33%.
Ультразвуковое исследование (УЗИ) органов брюшной полости и забрюшинного пространства позволяет обнаружить наличие даже небольшого количества жидкости в брюшной полости, при этом регистрируется расхождение на большее или меньшее расстояние листков париетальной и висцеральной брюшины. Картина УЗИ позволяет заподозрить повреждения ретроперитонеальной части 12 п.к. УЗИ брюшной полости нами выполнено всем 15 (100%) пострадавшим. Информативность метода составила 86%.
Компьютерная томография (КТ) является наиболее чувствительным методом для обнаружения в забрюшинном пространстве воздуха и крови. С целью повышения диагностических возможностей КТ вводится водорастворимый контраст в 12 п.к., при этом становится возможным определение выхода контраста за пределы кишки через дефект ее стенки. КТ органов брюшной полости и забрюшинного пространства выполнена 8 (53%) пострадавшим. Информативность метода составила 98%.
Видеолапароскопия применяется при неинформативности неинвазивных методов диагностики. Пациентам в тяжелом состоянии с нестабильными показателями гемодинамики видеолапароскопия противопоказана. У пострадавших со стабильными показателями гемодинамики видеолапароскопия может быть эффективна и позволяет обнаружить в брюшной полости кишечное содержимое, зеленоватое окрашивание по правому боковому каналу при наличии дефекта задней стенки 12 п.к., очаги стеатонекроза, пузырьки газа под париетальной брюшиной, желтовато-зеленое пропитывание тканей на фоне обширной забрюшинной гематомы в зоне 12 п.к. Однако в ряде случаев применение такого высокоинформативного метода исследования не позволяет подтвердить или опровергнуть предположение о повреждении 12 п.к., особенно при повреждениях забрюшинной части 12 п.к. в первые часы с момента получения травмы. Тем не менее диагностическая видеолапароскопия остается важным и необходимым исследованием при травмах живота. Диагностическая видеолапароскопия нами выполнена 7 (47%) пострадавшим, при этом у 2 из них не выявлено забрюшинного повреждения 12 п.к. Таким образом, информативность данного метода составила 72%.
Объем оперативного вмешательства при травмах 12 п.к. зависит от ряда факторов: сроков поступления пострадавших в стационар с момента получения травмы, размеров дефекта стенки 12 п.к., уровня повреждения, сочетанных повреждений панкреатодуоденальной зоны. По мнению А.Б. Молитвословова и соавт. (2004), неблагоприятными факторами, влияющими на исход лечения повреждений 12 п.к. являются размер дефекта более 50% окружности кишки, локализация повреждения в нижнегоризонтальной части, сочетанная панкреатодуоденальная травма, развитие забрюшинной флегмоны [3].
Ряд авторов также выделяют неблагоприятные прогностические факторы при травмах 12 п.к., влияющие на исход. Прежде всего это сочетание повреждения холедоха и/или поджелудочной железы, разрыв или ранение стенки 12 п.к. более 75% окружности, начало операции спустя 24 часа с момента травмы, и повреждения, расположенные в верхне-горизонтальной и нисходящей части 12 п.к. [6, 11-13].
Все 15 пациентов были оперированы в разные сроки с момента поступления в стационар. Операции выполнялись под общим обезболиванием. Для полноценной ревизии 12 п.к. во всех случаях выполняли мобилизацию по Кохеру - Клермону, при подозрении на повреждение забрюшинной части 12 п.к. проводили широкое вскрытие и дренирование забрюшинного пространства. Во время операции у 8 пациентов выявлены изолированные повреждения 12 п.к. В 5 случаях была повреждена верхне-горизонтальная часть, в 3 случаях — нисходящая часть выше БДС. У 3 пострадавших разрывы 12 п.к. сочетались с травмой печени, из них в 2 случаях 12 п.к. повреждена в верхне-горизонтальной части, в одном случае нисходящая часть. У 3 пострадавших выявлено повреждение поджелудочной железы, из них в 2 случаях повреждения нисходящей части 12 п.к. сочетались с травмой головки поджелудочной железы, в 1 случае была повреждена нижне-горизонтальная часть 12 п.к. и тело поджелудочной железы. У одного пострадавшего травма 12 п.к. сочеталась с повреждением стенки желудка (разрыв верхне-горизонтальной части и повреждение передней стенки желудка). 4 пострадавшим разрывы 12 п.к. были ушиты в поперечном направлении двухрядными узловыми швами. Данные пациенты поступили в первые 6 часов с момента получения травмы, дефекты стенки 12 п.к. располагались в верхне-горизонтальной части и не превышали 1/3 (1-1,5 см) ее окружности. Операцию завершали назодуоденальной декомпрессией и проведением питательного зонда в тощую кишку. 7 пациентам с повреждением 12 п.к., поступившим позднее 6 часов с момента получения травмы, после ушивания дефектов стенки кишки нами выполнено выключение 12 п.к. из пассажа пищи с наложением гастроэнтероанастомоза по Вельфлеру - Брауну (рис. 1). Операцию завершали назодуоденальной декомпрессией и установкой зонда в отводящий отдел для энтерального питания.
Рисунок 1. Гастроэнтероанастомоз по Вельфлеру - Брауну с отключением 12 п.к.
У 4 пациентов разрыв был более 1/3 окружности, когда дефекты располагались в нисходящей части 12 п.к. После обработки краев раны, производили ушивание дефектов двухрядными узловыми швами. В последующем на расстоянии 5 см ниже или выше повреждения формировали дуоденоеюноанастомоз «бок в бок» на длинной петле с брауновским соустьем (рис. 2).
Рисунок 2. Дуоденоеюноанастомоз с брауновским соустьем
3 пострадавшим выполнено ушивание разрыва 12 п.к., дуоденоеюностомия на выключенной по Ру петле (рис. 3).
Рисунок 3. Ушивание разрыва 12 п.к., дуоденоеюноанастомоз по Ру
У одного пациента выявлен полный поперечный разрыв нисходящей части 12 п.к. выше БДС. В данном случае нами наложен дуоденоеюнальный анастомоз по типу «конец» в «бок» с брауновским соустьем и отключением дистального отдела 12 п.к. Операция завершена назодуоденальной декомпрессией и проведением питательного зонда в отводящий отдел тощей кишки (рис. 4).
Рисунок 4. Дуоденоеюноанастомоз «конец в бок» с отключением дистальной части 12 п.к.
При сочетании повреждений 12 п.к. и печени производилось ушивание ее разрыва П-образными швами (2 случая). В одном наблюдении при неглубоких повреждениях печени нанесено раневое покрытие «ТахоКомб». При повреждениях поджелудочной железы необходимо широкое вскрытие и дренирование забрюшинного пространства, по типу «ринг-дренирования», а так же дренирование желчевыводящих путей (в 2 случаях сформирована холецистостома, в 1 — холедохостома). Разрыв передней стенки желудка в одном случае ушит двухрядными узловыми швами.
Результаты: из 15 оперированных пациентов умерло 4. Летальность составила 27%. Причинами смерти явились: прогрессирующий панкреонекроз с развитием забрюшинной флегмоны — 1 случай, пациент с сочетанной травмой поджелудочной железы; обширная забрюшинная флегмона с развитием сепсиса и синдрома полиорганной недостаточности — 1 случай, прогрессирование перитонита в результате развития несостоятельности швов ранее ушитых дефектов забрюшинной части 12 п.к. — 2 случая. Все 4 умерших пациента были доставлены в стационар позже 6 часов с момента получения травмы.
1. Диагностика повреждений 12 п.к. должна носить комплексный характер, включая оценку клинико-объективных данных, результатов инструментальных методов исследования. Наиболее информативными методами диагностики являются УЗИ, КТ брюшной полости, забрюшинного пространства с контрастированием.
2. Пострадавшим, поступившим в первые 6 часов с момента получения травмы, при разрывах в супрапапиллярной части 12 п.к. не более 1,5 см, предпочтительнее ограничиваться ушиванием дефекта 12 п.к. двухрядными узловыми швами. При повреждениях кишки более 2 см, после ушивания ее дефекта, с целью декомпрессии и профилактики несостоятельности швов, дополнительно формировать дуоденоеюноанастомоз по типу «бок в бок» с брауновским соустьем или на выключенной по Ру петле.
3. При поступлении пациентов позже 6 часов с момента получения травмы, выполняется выключение 12 п.к. из пассажа в сочетании с гастроэнтероанастомозом по Вельфлеру - Брауну.
4. Обязательным условием при выполнении оперативного вмешательства является широкое дренирование забрюшинного пространства, продленная назодуоденальная — еюнальнальная интубация.
Д.М. Красильников, М.М. Миннуллин, Я.Ю. Николаев
Казанский государственный медицинский университет
Республиканская клиническая больница МЗ РТ, г. Казань
Красильников Дмитрий Михайлович — доктор медицинских наук, профессор, заведующий кафедрой хирургических болезней № 1
Литература:
1. Красильников Д.М., Фатхутдинов И.М., Шайхутдинов P.P. Хирургическая тактика при закрытых повреждениях кишечника // Казанский медицинский журнал. — 2000. — Т. 81, № 5. — С. 405-406.
2. Абакумов М.М., Лебедев Н.В., Малярчук В.И. Диагностика и лечение повреждений живота // Хирургия. — 2001. — № 6. — С. 24-28.
3. Молитвословов А.Б., Ерамишанцев А.К., Марков А.Э. и др. Диагностическая и лечебная тактика при травме двенадцатиперстной кишки // Хирургия. — 2004. — № 8. — С. 46-51.
4. Иванов П.А., Гришин А.В., Корнеев Д.А. и др. Повреждения органов панкреатодуоденальной зоны // Хирургия. — 2003. — № 12. — С. 39-43.
5. Velmahos G.C. Complex repair for the management of duodenal injury // Am.Surg. — 1999. — Vol. 65, № 10. — P. 972-975.
6. Jansen M., Du Toit D.F., Warren B.L. Duodenal injuries surgical management adapted to circumstances // Injury. — 2002. — № 33. — P. 611-615.
7. Aherne N.J., Kavanagh E.G., Condon E.T. et al. Duodenal perforation after a blunt abdominal sporting injuri: the importance of early diagnosis // J. Trauma. — 2003. — Vol. 54, № 4. — P. 791-794.
8. Михайлов А.П., Сигуа Б.В., Данилов А.М. и др. Повреждения двенадцатиперстной кишки (Клиника, диагностика, лечение) // Вестник хирургии им. И.И. Грекова. — 2007. — № 6. — С. 36-40.
9. Сигуа Б.В. Диагностика и лечение повреждений двенадцатиперстной кишки: автореф. дис. … канд. мед. наук. — Санкт-Петербург, 2008. — 16 с.
10. Черкасов М.Ф., Юсков В.Н., Ситников В.Н., и др. Повреждения живота при множественной и сочетанной травме. — М.: Ростов-на-Дону, 2005. — 132 с.
11. Carrillo E.H., Richardson J.D., Miller F.B. Evolution in the management of duodenal injuries // J Trauma. — 1996. — № 40. — Р. 1037-1046.
12. Clendenon J.N., Meyers R.L., Nance M.L. et al. Management of duodenal injuries in children // J Pediatr Surg. — 2004. — № 39. — Р. 964-968.
13. Lopez P.P., Benjamin R., Cockburn M. et al. Recent trends in the management of combined pancreatoduodenal injuries // Am Surg. — 2005. — № 71. — Р. 847-852.
Кафедра госпитальной хирургии с курсом детской хирургии Российского университета дружбы народов, Москва
Хирургическое лечение перфоративных язв двенадцатиперстной кишки
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2010;(11): 76‑79
Балогланов Д.А. Хирургическое лечение перфоративных язв двенадцатиперстной кишки. Хирургия. Журнал им. Н.И. Пирогова. 2010;(11):76‑79.
Baloglanov DA. Surgical treatment of perforative duodenal ulcers. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2010;(11):76‑79. (In Russ.).
При определенных успехах, достигнутых в консервативном лечении язвенной болезни (ЯБ), за последние 10-20 лет не отмечается снижения частоты ее осложненных форм, в частности перфоративных язв двенадцатиперстной кишки (ПЯ ДПК) [1, 4, 5, 9, 13, 19, 21, 24, 30, 43, 49, 52].
По данным Н.А. Майстренко и соавт. [16], перфорация язвы наблюдается у 10% больных, госпитализированных по поводу ЯБ. У 25,9% больных перфорация язвы служит первым проявлением ЯБ [9]. Сочетание ПЯ ДПК с язвенным кровотечением, пилородуоденальным стенозом, пенетрацией отмечается в 12-28% наблюдений [15, 19, 22]. В последние годы растет частота ПЯ ДПК у пациентов пожилого и старческого возраста [5, 27]. Перфорация гигантских язв ДПК бывает редко, но из-за возникающих технических трудностей операции при таком варианте заболевания сопровождаются большим числом осложнений и высокой летальностью [48].
В настоящее время в хирургическом лечении больных с ПЯ ДПК применяется разнообразная хирургическая тактика. Наиболее радикальной остается классическая резекция желудка по обоим способам Бильрота [9, 59]. Ряд хирургов продолжают успешно применять органосохраняющие операции, в основе которых лежат различные виды ваготомии в сочетании с локальным вмешательством на ДПК [17, 29, 30, 36]. В то же время наиболее распространенная операция ушивания ПЯ ДПК не потеряла значения ввиду относительной простоты, малой травматичности и безопасности [10, 14, 21, 31, 44, 49]. В последние годы для ушивания ПЯ ДПК все шире используются эндовидеохирургические технологии, обеспечивающие ряд важных преимуществ в виде снижения частоты осложнений и уровня летальности, а также сокращения периода госпитализации [1, 23, 26, 34].
Показания к различным операциям при ПЯ ДПК, выбор методики и техники вмешательства в настоящее время остаются предметом продолжающихся дискуссий [9, 16, 21, 25].
Длительность задержки экстренной операции, предоперационные уровни мочевины крови и креатинина сыворотки крови, размер перфорации и количество перитонеального выпота, наличие сопутствующих заболеваний и необходимость послеоперационного лечения в отделении реанимации - важные прогностические факторы результата оперативного лечения ПЯ ДПК [33, 42, 47, 58].
Независимыми факторами риска развития послеоперационных осложнений у пациентов с ПЯ ДПК являются уровень сывороточного альбумина менее 25 г/л, гемоглобина менее 100 г/л [47]. Отмечено, что факторы, которые значимо связаны с более длительным послеоперационным лечением пациентов с ПЯ ДПК в стационаре, включают: возраст старше 65 лет, наличие цирроза печени, сахарного диабета, язвенного анамнеза, сопутствующих заболеваний, предоперационного шока, уровень креатинина более 132 мкмоль/л, задержка операции более чем на 12 ч [50].
Задержка экстренной операции при ПЯ ДПК происходит обычно из-за стертости клинической картины заболевания и возникающих вследствие этого трудностей в диагностике, необходимости дополнительных методов исследования - эзофагогастродуоденоскопии с повторной рентгенографией брюшной полости, ультразвукового исследования, диагностической лапаро- или видеолапароскопии, проведения краткосрочной предоперационной подготовки в условиях отделения реанимации [12, 22, 26].
Сторонники экстренных радикальных операций при ПЯ ДПК считают показаниями к резекции желудка сочетание ПЯ ДПК с декомпенсированным пилородуоденальным стенозом или язвенным кровотечением, а также наличие «целующихся» язв ДПК, техническую невозможность ушивания или иссечения язв [9]. По мнению В.В. Рыбачкова и соавт. [22], длительный язвенный анамнез и перфорация хронической каллезной язвы ДПК также являются показаниями к радикальной операции. Кроме того, В.К. Гостищев и соавт. [9] указывают на то, что в последнее время немаловажную роль приобретают социальные показания к первичным радикальным операциям при перфоративных гастродуоденальных язвах; это связано с невозможностью проведения полноценного диспансерного наблюдения, периодического обследования и лечения оперированных больных после их выписки из хирургического стационара.
Преклонный возраст больного, тяжелые сопутствующие заболевания, а также распространенный перитонит считаются противопоказаниями к резекции желудка при ПЯ ДПК [22]. Отмечается также, что неоправданное стремление к выполнению радикальной операции может приводить к развитию тяжелых осложнений у больных с ПЯ ДПК [13].
Ряд авторов методом выбора при ПЯ ДПК считают органосохраняющие операции в виде стволовой или селективной проксимальной ваготомии в сочетании с ушиванием или иссечением язвы и пилоропластикой [14, 17, 29, 30, 40, 54]. Некоторые хирурги пропагандируют также резекцию луковицы ДПК в сочетании с селективной проксимальной ваготомией [36]. Другие авторы полагают, что показанием к подобным операциям является только декомпенсированный пилоробульбарный стеноз при наличии факторов, ограничивающих возможность выполнения резекции желудка [9]. Следует отметить, что в последние годы наблюдается значительное снижение частоты кислотоподавляющих операций при острых осложнениях ЯБ ДПК [38, 56].
По данным В.В. Рыбачкова и соавт. [22], наиболее частой операцией при ПЯ ДПК остается простое ушивание. Хотя все недостатки этого метода хорошо известны, ушивание перфоративных гастродуоденальных язв выполняется в 94,7% наблюдений. Отмечается, что в связи с появлением в последнее время новых весьма эффективных антисекреторных препаратов открылись перспективы улучшения отдаленных результатов ушивания ПЯ ДПК [1, 2, 53].
Выполнение простого ушивания ПЯ ДПК по-прежнему рекомендуется молодым пациентам [31]. Некоторые авторы [6, 7] считают необходимым иссечение ПЯ ДПК, что, по их мнению, улучшает условия заживления линии швов и служит в определенной мере профилактике рецидива язвы. При воспалительно-инфильтративных изменениях стенки ДПК предлагается использование адгезивных свойств препарата ТахоКомб, а также нанесение на линию швов различных других пленок (коллагеновых, фибриногеновых, тромбиновых), способствующих профилактике несостоятельности [32, 39].
При угрозе стенозирования луковицы ДПК в результате обычного ушивания перфоративного отверстия двумя рядами швов применяют тампонаду ПЯ ДПК прядью сальника по Оппелю-Поликарпову [22]. В общей сложности до 25% больных имеют ПЯ ДПК более 1 см в диаметре [42]. При подобных язвах тампонада сальником (по типу операции Оппеля-Поликарпова) обеспечивает снижение частоты осложнений, профилактику несостоятельности швов ДПК и развития пилородуоденального стеноза в отдаленном периоде [45]. Разрабатываются в эксперименте и успешно применяются в клинической практике различные другие методы пластического ушивания ПЯ ДПК [6, 8, 25, 28].
Таким образом, в настоящее время для получения оптимальных результатов многими авторами пропагандируется наиболее простая операция ушивания ПЯ ДПК с последующим проведением противоязвенной терапии, в том числе эрадикации Helicobacter pylori [1, 22, 35, 38, 41, 42, 43, 53].
Наблюдающееся в последние годы совершенствование видеохирургических технологий наряду с широким внедрением мощных противоязвенных препаратов определило лапароскопическое ушивание ПЯ ДПК как один из ведущих методов хирургического лечения данного заболевания [23].
По мнению некоторых авторов, показания к видеохирургическим вмешательствам при ПЯ ДПК не отличаются от показаний к открытым операциям [26, 60]. С этим нельзя согласиться, потому что для видеохирургических операций всегда проводится предварительный отбор заведомо более легких больных и в ряде наблюдений во время самого вмешательства выявляется невозможность его продолжения лапароскопическим методом, т.е. возникает необходимость конверсии лапароскопического доступа в открытый. Известно, что все неблагоприятные условия для выполнения в экстренном порядке резекции желудка и органосохраняющих операций служат показанием к операции меньшего объема в виде ушивания ПЯ ДПК, поэтому и результаты таких операций сравнивать напрямую нельзя. Точно также и при обсуждении показаний к видеохирургическим вмешательствам при ПЯ ДПК всегда выясняется наличие определенного числа противопоказаний и ограничений к их выполнению. В то же время безусловным показанием к лапаротомии являются все без исключения перфоративные язвы желудка и ДПК, а противопоказаний к открытым вмешательствам в экстренной ситуации может быть только два: агональное состояние и категорический отказ больного от операции.
Многие авторы указывают на то, что лапароскопическое ушивание ПЯ ДПК является безопасным вариантом операции, обеспечивающим низкий уровень осложнений и летальности. Это позволяет считать видеохирургическую операцию в большинстве наблюдений методом выбора [1, 3, 11, 12, 20, 23, 34, 37, 46, 49, 57]. В числе важных преимуществ видеохирургических вмешательств отмечается сохранение анатомии пилоробульбарной зоны с незначительной деформацией луковицы ДПК по сравнению с традиционными методами ушивания ПЯ ДПК [20].
I. Malkov и соавт. [51] считают, что лапараскопическое ушивание ПЯ ДПК безопасно и эффективно, если в последующем проводится эрадикация H. pylori.
Существуют и другие мнения. Так, A. Hölscher и соавт. [44] считают, что лапароскопическая операция при ПЯ ДПК не имеет преимуществ по сравнению с открытым вмешательством. По данным N. Vettoretto и соавт. [60], лапароскопическое ушивание ПЯ имеет преимущества только в отношении более низкой частоты развития инфекционных осложнений, по остальным параметрам (длительность вмешательства, послеоперационная боль, время начала перорального питания, длительность послеоперационной госпитализации) не выявлено отличий от традиционной операции. При анализе результатов лапаротомных (n=49) и лапароскопических вмешательств (n=52) при ПЯ ДПК отмечается бóльшая длительность лапароскопических операций по сравнению с открытыми (75 мин против 50 мин) [34].
В настоящее время принципиально важной составляющей лечения больных с перфоративными гастродуоденальными язвами считается эффективное медикаментозное подавление желудочной секреции, поскольку ушивание таких язв направлено только на ликвидацию осложнения и не воздействует на патологический процесс, явившийся причиной перфорации. Наилучшие результаты (быстрое заживление язв) у больных после ушивания ПЯ ДПК получены при использовании сначала внутривенной формы омепразола, а затем таблетированной формы эзомепразола (нексиум) [10]. Проводить курс противоязвенного лечения с целью надежного заживления язвы ДПК необходимо также всем больным, перенесшим органосохраняющие операции [14, 30].
При анализе результатов различных операций у 363 больных показатели послеоперационной летальности после резекции желудка, ваготомии с иссечением или ушиванием язвы и после простого ушивания оказались сопоставимыми (6,9, 8,7 и 5,7% соответственно) [9]. Отмечается, что радикальные операции не связаны со значительным увеличением числа послеоперационных осложнений и летальности по сравнению с таковыми при простом ушивании ПЯ ДПК [55].
В то же время после ушивания перфоративных гастродуоденальных язв частота релапаротомии составляет 8,7%, показаниями к ней служат кровотечение из ушитой язвы или из второй («зеркальной») язвы ДПК, а также развившийся декомпенсированный стеноз пилоробульбарной зоны [9].
У каждого третьего больного после стволовой ваготомии с иссечением язвы ДПК по Джадду в отдаленном периоде развиваются различные постваготомные расстройства, в том числе рецидив язвы [9].
Наибольший разброс в результатах, по данным разных авторов, наблюдается после ушивания ПЯ ДПК [21]. Изучение отдаленных результатов у 363 больных, оперированных по поводу перфоративных гастродуоденальных язв, показало, что после ушивания таких язв рецидив наступил в 78,4%, а необходимость в дальнейших операциях возникла в 21,5% наблюдений. Через 1 год после ушивания с последующей эрадикацией Н. pylori из 65 пациентов рецидив наступил у 51 (78,4%) [9]. В отдаленные сроки после ушивания ПЯ ДПК рецидив перфорации наблюдается у 15% больных, с такой же частотой развивается рубцово-язвенный пилородуоденальный стеноз [15, 16]. В то же время у 17,9% больных, оперированных по поводу рубцово-язвенного пилородуоденального стеноза, в анамнезе отмечено ушивание ПЯ ДПК [18].
Тем не менее имеются указания на то, что ушивание ПЯ ДПК в комплексе с современной противоязвенной терапией дает возможность улучшить результаты хирургического лечения [21]. Значительно снижает частоту рецидивов язвы после простого ушивания ПЯ ДПК эрадикация H. pylori [35, 42, 53].
При анализе отдаленных результатов ушивания ПЯ ДПК у 91 больного отличные и хорошие результаты были отмечены в 70% наблюдений, удовлетворительные - в 12,1%, неудовлетворительные - в 18,6% наблюдений. Плохие результаты были обусловлены отсутствием диспансерного врачебного наблюдения, повторных курсов противоязвенного лечения и несоблюдением пациентами рекомендаций по лечению после выписки из хирургического стационара [21].
Таким образом, в настоящее время наблюдается очевидный приоритет выполнения паллиативных операций больным с перфоративными язвами ДПК. Простое или пластическое ушивание таких язв считается операцией выбора у подобных больных [10, 12]. Назначение всем больным после ушивания ПЯ ДПК современной противоязвенной терапии и осуществление полноценного диспансерного наблюдения позволяют свести к минимуму процент неудовлетворительных результатов [21]. Однако в настоящее время именно последнее положение является одной из самых насущных нерешенных проблем, заставляющей обсуждать в том числе и социальные показания к первичным радикальным операциям при перфоративной язве ДПК.
Повреждение двенадцатиперстной кишки (ДПК) в структуре травм органов желудочно-кишечного тракта встречается редко.
Единой общепринятой хирургической тактики при повреждениях ДПК нет [9], однако существуют основные направления хирургического лечения разрывов ДПК. Ряд авторов предлагают устранять дефект путем наложения двухрядного шва [10], другие применяют метод выключения ДПК из пассажа пищи [3], резекцию кишки [9] или используют серозно-мышечно-подслизистый лоскут с большой кривизны желудка для укрепления места дефекта [5].
Успешность выполнения той или иной операции зависит от состояния пострадавшего, длительности периода с момента травмы, правильности установленного диагноза, практических навыков хирурга [2]. При травме характер повреждения диктует вид и объем оперативного вмешательства. В послеоперационном периоде у 25-60% больных развиваются осложнения: несостоятельность швов ДПК, культи ДПК (при операциях на выключение или резекции), панкреатит, забрюшинная флегмона. Вследствие этого летальность при травме ДПК составляет 11-30%, при развитии забрюшинной флегмоны достигает 100% [4].
Цель работы - улучшение результатов хирургического лечения больных с повреждениями ДПК путем совершенствования диагностики, а также использования оперативных вмешательств, направленных на выключение ДПК из пассажа пищи.
Материал и методы
В основу проведенного исследования положены результаты лечения 32 больных с повреждением ДПК, находившихся в учреждениях органов здравоохранения Хмельницкой области в период с 1996 по 2011 г. Все больные были госпитализированы в ургентном порядке. В структуре причин повреждения ДПК были тупая травма - 27 пострадавших (ДТП - 4, падение с высоты - 15, удар о руль велосипеда - 2, избиение - 6), огнестрельное ранение - 2, ранение холодным оружием - 3. Среди пострадавших было 6 женщин и 26 мужчин. Средний возраст больных составил 30±18,5 года, средняя длительность пребывания в больнице - 12±11 дней.
Большинство пострадавших были госпитализированы в сознании и могли самостоятельно рассказать об обстоятельствах травмы.
Всем больным выполняли обязательный объем клинико-инструментальных исследований: сбор жалоб, выяснение обстоятельств травмы, физикальное обследование, анализы крови и мочи, ЭКГ, обзорную рентгенографию органов брюшной полости и рентгеноскопию желудочно-кишечного тракта (аппарат Siemens Axiom Iconos R-100), гастродуоденоскопию (аппарат Olympus JFType E), фиброгастроскопию (аппарат Pentax FG 29V и Pentax FG 29W), ультрасонографию (аппарат Toshiba Nemioxa) в обычном и допплеровском режимах. Тяжесть течения перитонита оценивали по В.А. Попову [6] и с помощью Маннгеймского индекса [12]. Выраженность эндогенной интоксикации определяли по шкале SAPS [8].
Всех больных разделили на три группы в зависимости от периода с момента травмы до госпитализации: 1-я группа (до 6 ч) - 16 пациентов, 2-я группа (6-12 ч) - 12 пациентов, 3-я группа - (более 12 ч) - 4 пациента. Диагноз устанавливали в соответствии с Международной классификацией травм Abbreviated Injury Scale - 2008 (AIS) [13].
Результаты и обсуждение
При обзорной рентгенографии органов брюшной полости у 11 (34,4%) из 32 больных обнаружено скопление свободного газа под правым куполом диафрагмы. Этим больным установлен диагноз травмы живота, разрыв полого органа, перитонит и в ургентном порядке после предоперационной подготовки произведено оперативное вмешательство.
У остальных больных - 21 (65,6%) - свободный газ в брюшной полости и забрюшинном пространстве не обнаружен. В этих наблюдениях использован предложенный нами метод диагностики разрывов ДПК. Он заключается во введении 3% раствора перекиси водорода через желудочный зонд (9 больных) или 5-10 мл 3% раствора перекиси водорода [1] через эндоскоп (12). При этом выполняли обзорную рентгенографию органов брюшной полости. При появлении свободного газа под куполом диафрагмы нам удалось диагностировать (или заподозрить) повреждение ДПК.
При ФГДС у одного пациента обнаружена небольшая интрамуральная гематома переднебоковой стенки нисходящей части ДПК. Свободного газа в брюшной полости или забрюшинном пространстве у него не выявлено, он выздоровел после консервативного лечения, проводившегося под ежедневным ультразвуковым контролем. У 11 больных при ФГДС обнаружен разрыв луковицы ДПК, в ургентном порядке они оперированы.

Всего был оперирован 31 (96,8%) больной по поводу травмы живота (открытой или закрытой), подозрения на повреждение ДПК, перитонит. Умерли 8 (25%) больных. Объем оперативных вмешательств отображен в таблице.
После операций развились следующие осложнения: дуоденальный свищ (2 больных), деструктивный панкреатит (3), сепсис (1), полиорганная недостаточность (7), абсцессы брюшной полости (2), гематомы и флегмоны забрюшинной клетчатки (3). Эти осложнения, явившиеся последствием посттравматического панкреатита, практически всегда сопровождают повреждения ДПК [7].
По нашему мнению, именно одновременное повреждение поджелудочной железы служит причиной развития таких осложнений, как острый посттравматический панкреатит, парапанкреатит, шок, панкреатогенный перитонит, гнойно-септические осложнения, несостоятельность швов. В наших наблюдениях изолированные повреждения ДПК были у 7, комбинированные - у 25 больных (желудок - 2, тонкая кишка - 4, толстая кишка - 2, поджелудочная железа - 17). Полые органы (желудок, тонкая и толстая кишка) были ушиты двухрядными швами, объем операции на поджелудочной железе зависел от степени ее повреждения. В соответствии с классификацией Американской ассоциации хирургов-травматологов (AAST-2009) y 16 больных имелись повреждения поджелудочной железы I-II степени, у 1 больного - III степени.
Все больные до и после оперативного вмешательства получали препараты для профилактики и лечения панкреатита, перитонита: антибиотики (цефалоспорины третьего-четвертого поколений в дозе 1,0 г 2 раза в сутки, для детей 20-50 мг на 1 кг в сутки, фторхинолоны третьего-четвертого поколений в дозе 0,5-1,0 г в сутки или карбапенемы в дозе 250-500 мг для взрослых и 20-40 мг в сутки для детей), блокаторы протонной помпы (омепразол или пантопразол в дозе 20 мг 2 раза в сутки), производные естественного гормона соматостатина (октрайд или укреотид, или сандостатин в дозе 0,1 мг 3 раза в сутки подкожно).
Нами был усовершенствован один из существующих способов оперативного лечения повреждений ДПК [2] . Суть предложенного нами метода, использованного в 4 наблюдениях, заключается в том, что при обнаружении повреждения 50% и больше окружности в нижней горизонтальной части ДПК (рис. 1) в месте дефекта мы не зашивали кишку, а пересекали, при этом дистальный конец заглушали. Рисунок 1. Дефект горизонтальной части ДПК в размере больше 50% окружности. 1 - забрюшинный разрыв; 2 - связка Трейтца. После освежения краев раны проксимальный конец ДПК подшивали к выкроенной петле тонкой кишки, отступив от связки Трейтца 40-50 см, и накладывали анастомоз конец в бок по Ру. С этой же кишкой формировали низкий гастроэнтероанастомоз, предварительно наложив на слизистую пилорической части желудка кисетный кетгутовый шов. Отсеченную часть тонкой кишки подшивали к отводящей петле по Ру конец в бок (рис. 2). Рисунок 2. Конечный результат операции. 1 - низкий гастроэнтероанастомоз; 2 - дуоденоэнтероанастомоз с отводной петлей по Ру в месте разрыва; 3 - кисетный шов на слизистую желудка.
После использования предложенной методики мы не наблюдали осложнений. Эта оперативная тактика дает возможность предупреждать развитие несостоятельности швов, анастомозов, возникновение дуоденостаза путем ликвидации травмированного участка кишки и полного, временного выключения из пассажа ДПК в раннем послеоперационном периоде. Благодаря способности кетгута рассасываться пассаж по ДПК возобновляется через 7-10 дней.
Больной М., 13 лет, поступил в приемное отделение в сознании с жалобами на головокружение, общую слабость, боль в правой половине живота, позывы на рвоту, гипертермию. Из анамнеза известно, что 3,5-4 ч назад упал с велосипеда и ударился животом о руль. После травмы боль в животе уменьшилась через 30-60 мин, однако в связи с усилением через 3-3,5 ч пострадавший обратился в больницу. При осмотре кожа и видимые слизистые бледные, ЧСС 98 в 1 мин, АД 100/60 мм рт.ст., температура тела 37,6°С, живот болезнен при пальпации, особенно в правых отделах. Перистальтика ослаблена. Признаков раздражения брюшины нет. При УЗИ органов брюшной полости патологических изменений не выявлено. ФГДС не проводилась из-за отказа пациента и родителей. При рентгенографии органов грудной и брюшной полости патологических изменений не обнаружено. Анализ крови: Hb 126 г/л, эр. 3,95'10 12 /л, л. 22,1'10 9 /л. Диагноз: тупая травма живота, ушиб внутренних органов. Принято решение о консервативном лечении. Начата дезинтоксикационная терапия, применяли обезболивающие препараты (дексалгин 2,0 мл внутримышечно), антибиотики (цефтриаксон 1,0 г внутримышечно 2 раза в сутки). На фоне проведенной терапии состояние несколько улучшилось, однако появились симптомы интоксикации и перитонита. При контрольном УЗИ в малом тазу незначительное количество жидкости. Заподозрена травма ДПК. При повторной обзорной рентгенографии патологических изменений не обнаружено. Через назогастральный зонд было введено 50 мл 3% раствора перекиси водорода и через 4 мин выполнена повторная обзорная рентгенография органов брюшной полости. Обнаружено скопление газа под печенью, в правом боковом канале. Диагностирован разрыв забрюшинной части ДПК. Произведена срединная лапаротомия. При ревизии органов брюшной полости обнаружено незначительное количество серозно-геморрагического выпота, возле луковицы ДПК по направлению вниз находилась забрюшинная гематома. При осмотре снизу (от связки Tpeйтца) гематома распространилась ниже горизонтальной части ДПК по направлению к корню брыжейки тонкой кишки. Там же обнаружен участок повреждения брюшины, сквозь него просматривалась желчь. После мобилизации ДПК от связки Трейтца обнаружен разрыв горизонтальной части кишки с передненижней стороны (размер дефекта до 50% окружности кишки с выделением через него желчи). Произведены операция, приведенная выше (см. рис. 2), санация и дренирование забрюшинного пространства и брюшной полости. Состояние больного постепенно улучшалось, в удовлетворительном состоянии он выписан на амбулаторное лечение через 22 дня после госпитализации.
Нами на основании анализа результатов лечения 32 больных с повреждениями ДПК, причин летального исхода (в 25% наблюдений), осложнений (46,8%) установлено несовершенство существующих методов диагностики и хирургического лечения разрывов ДПК как до, так и во время операции.
Так как наиболее часто разрыв забрюшинной части ДПК [1, 3, 7, 10] происходит в горизонтальном отделе [8, 11], эффективность усовершенствованного нами метода оперативного лечения считаем доказанной. По нашему мнению, выбор операции должен зависеть от периода с момента травмы, локализации дефекта, а также наличия повреждений соседних органов.
Таким образом, использование 3% раствора перекиси водорода улучшает и облегчает диагностику повреждений ДПК на дооперационном этапе. Разработанная нами методика устранения дефекта ДПК с полным выключением из пассажа кишки является эффективной. Наша операция обеспечивает адекватное дренирование желудка и дает возможность временно полностью выключить из пассажа ДПК, исключить этап ушивания поврежденной кишки.
Читайте также:
- Порто-кавальная печеночная недостаточность. Интенсивная терапия острой печеночной недостаточности.
- Вестибулярные симптомы при сифилитическом лабиринтите. Признаки врожденного сифилиса внутреннего уха
- Гормоны поджелудочной железы. Островки Лангерганса. Соматостатин. Амилин. Регуляторные функции гормонов поджелудочной железы.
- Выявили уреаплазму парвум: как передается и какие болезни вызывает?
- Инфекционная эритема
