Техника операции при опухоли крестца - резекция крестца, удаление крестца (сакрэктомия)
Добавил пользователь Евгений Кузнецов Обновлено: 08.01.2026
Опухоли определяются как новообразования, которые состоят из бесконтрольно делящихся клеток, и эти опухоли можно обнаружить также в костях. Постоянная боль в костях, считается наиболее важным симптомом определения костных опухолей. Специалист Медицинского Центра Анадолу (Anadolu Medical Center) в области ортопедии и травматологии профессор Каан Эрлер (Kaan Erler), говорит, что «в большинстве случаев опухолей костей, причина не известна, и иногда имеет генетическую природу. Здоровые ткани заменяются аномальными тканями.
Опухоль ослабляет кости и приводит к патологическим переломам. Если вовремя не предпринять необходимые меры, быстро развивающиеся (агрессивные) опухоли начинают двигаться в направлении других тканей и вызывают метастазы».
Профессор, доктор Эрлер, говорит, что большинство опухолей костей являются доброкачественными. И добавляет: «Рак, который начинается в кости (первичный) отличается от рака, который начинается в других частях тела и перемещается в кости (вторичный). Развитие опухолей и наносимый ими ущерб тканям зависит от их биологического поведения. Некоторые из них выявляются случайно, некоторые вызывают серьезные проблемы». Профессор, доктор Эрлер, ответил на наши вопросы по поводу диагностики и лечения опухолей костей.
Каковы наиболее распространенные опухоли кости?
Наиболее распространенные опухоли кости первичного происхождения следующие:
- Множественная миелома: Это наиболее распространенный вид первичной опухоли кости. Это злокачественная опухоль костного мозга. Каждый год ее выявляют у 20 человек на миллион. Наиболее часто встречается в возрасте от 50-70 лет и может поражать любую кость.
- Остеосаркома: Это второй вид наиболее распространенной первичной опухоли костного происхождения. Часто встречающаяся у подростков и расположенная в области колена, она приводит к смертельному исходу в 2-3 случаях на миллион каждый год. Реже эта опухоль локализуется в области бедра и плечевой зоне.
- Саркома Юинга: В основном, встречается в возрасте между 5-20 годами. Она характеризуется обширным новообразованием в мягких тканях и разрушает кость. Чаще всего локализуется в области верхних и нижних конечностей, тазовой кости и груди.
- Хондросаркома: Чаще всего встречается в возрасте между 40-70 годами. Она провоцирует новообразования в области бедра, тазовой кости и плеча.
Какие симптомы бывают при опухолях на костях?
Большинство пациентов с опухолью на костях жалуются на боль. Боль, как правило, имеет характер длительной, вызывающей дискомфорт с низкой интенсивностью, так называемая «тупая» боль. Боль сохраняется даже когда пациент отдыхает, и она усиливается по ночам. Травма не является причиной, но боль усиливается после травмы. В ослабленных костях наблюдается патологический перелом, который увеличивает боль. Некоторые опухоли вызывают лихорадку и ночную потливость. Иногда новообразования бывают безболезненные. Некоторые опухоли обнаруживаются случайно во время рентгена после травм лодыжки.
Что нужно сделать в случае такого рода болезненной ситуации?
Если человек думает, что у него может быть опухоль кости, ему необходимо сразу обратиться к врачу.
Какие меры предпринимаются на этапе постановки диагноза?
Доктор берет подробную историю пациента для того, чтобы узнать анамнез пациента. Анамнез включает в себя все детали — от используемых препаратов до всех предыдущих заболеваний.
Исследуется размер и подвижность опухоли, ее связь с суставами и является ли она проросшей, и проводится обследование других систем, если это необходимо. В первую очередь пациенту делают рентген. Различные опухоли кости дают разные изображения на рентгене. Некоторые показывают избыток кальцификации, некоторые показывают резорбцию кости. Иногда мы видим их сочетание.
Достаточно ли рентгена для определения опухоли, или необходим еще какой-нибудь метод? Некоторые опухоли можно увидеть на рентгене, но для того, чтобы определить тип опухоли, мы используем подробные методы визуализации, такие как томография, МРТ, сцинтиграфия, ПЭТ и томография легких. Мы используем томографию, чтобы увидеть детали кости, и МРТ, чтобы увидеть рост опухоли в кости или чтобы увидеть распространение опухоли в другие удалённые места. Сцинтиграфия кости дает информацию о биологической активации опухоли и о том, есть ли метастазы.
Какие анализы используются для диагностики онкологии костей?
Общий анализ крови или мочи. Биопсия, которая используется для получения образца ткани, еще один вид анализа, и она должна проводиться в центре, где хирургическое вмешательство будет выполняться специалистом в области ортопедической онкологии. Исследование может проводиться в виде биопсии иглой или открытой биопсии. Опыт патолога важен не менее чем выбор метода исследования.
Как проходит лечение рака кости?
Лечение опухолей кости - всегда результат командной работы. Основные члены этой команды — это ортопед-онколог, онколог, радиолог, радиоонколог, патолог. Цель лечения заключается в преодолении рака и защите пораженных конечностей.
Есть ли улучшения в лечении костных опухолей по мере развития медицины? Есть ли изменения в хирургических методах?
Раньше, для того, чтобы удалить опухоль из организма, существовал, в основном, метод ампутации конечностей. Но теперь доступен хирургический подход, который позволяет и удалить опухоль, и защитить конечности. Хирургическое лечение может быть проведено путем удаления центра опухоли или ее удаления вместе с небольшим участком здоровой кожи.
Цель лечения заключается в обеспечении функционирования конечности после онкотерапии. Этому способствует, в частности, развитие реконструктивной хирургии. Также часто применяются протезы, костные трансплантаты, которые являются частью кости, взятой из других частей скелета, используемые для заживления пораженного участка и методы биологической реконструкции.
Каковы другие методы опухолей на кости?
Некоторые опухоли костей чувствительны к лучевой терапии. Лучевая терапия может использоваться как самостоятельно лечение или совместно с другими методами лечения. Химиотерапия может быть использована для лечения в зависимости от биологического поведения заболевания. Она может быть применена до или после операции.
Есть ли разница между полами в отношении риска появления этой болезни?
Мы можем привести информацию по этому вопросу в США. Злокачественные опухоли костей определяются в 2500 случаях в год, доброкачественные — в 200 000-300 000. Метастазы в кости встречаются у 250 000 - 300 000 случаев в год. Разницы между полами с точки зрения риска заболевания опухолями кости не выявлено.
Что бы вы хотели сказать о последующем наблюдении пациентов после лечения?
Последующее наблюдение пациента делается сначала через короткие промежутки времени, и само наблюдение будет проводиться в течение многих лет. С помощью этого метода, рецидив заболевания или его распространение на другие органы обнаруживается на ранней стадии, и составляется план лечения. На этом этапе пациенту нужна психологическая поддержка и возврат к полноценной общественной жизни. Рак легких, молочной железы, щитовидной железы и предстательной железы являются основными причинами метастаз, не считая первичной злокачественной опухоли кости. Кроме того, необходимо тщательно исследовать причины боли в костях, которые возникают в пожилом возрасте.
Что такое ампутация?
Ампутация — это удаление пораженной части тела для того, чтобы спасти жизнь пациента в случае невозможности сохранения органа. Например, если речь идет о развитии заболевания в ноге, нога должна быть ампутирована. Но мы сейчас далеки от такого хирургического подхода благодаря развитию в области диагностики и лечения. Если в 80-х годах 90% пациентов с диагнозом «рак» лечили бы именно методом ампутации, то теперь этот процент составляет менее 10%.
Что вы можете сказать о доброкачественных опухолях костей и их лечении?
Наиболее распространенные доброкачественные опухоли костей — это не остеогенная фиброма, простая киста кости, остеохондрома, опухоль гигантских клеток, хрящевая опухоль и фиброзная дисплазия. Так как лечение доброкачественных опухолей костей зависит от типа опухоли и возраста пациента, в большинстве случаев достаточно наблюдения за пациентом. В некоторых случаях медикаментозное лечение успокаивает боль. В некоторых случаях, особенно у пациентов-детей, опухоли могут со временем спонтанно исчезнуть. Некоторые доброкачественные опухоли могут переродиться в злокачественные опухоли и тогда могут начать развиваться метастазы. Иногда врач рекомендует удаление опухоли. Такой подход предотвращает возможные патологические переломы. Некоторые опухоли могут возникать снова, хотя они были вырезаны. Опухоль гигантских клеток является наиболее встречаемой доброкачественной опухолью, которая может иметь агрессивный ход развития. В некоторых случаях остеохондрома, которая локализуется в нескольких областях, может переродиться в рак.
БУДЬТЕ ВНИМАТЕЛЬНЫ К ДАННЫМ СИМПТОМАМ!
Специалист в области ортопедии и травматологии, профессор Каан Эрлер говорит: «Если вы испытываете боль, несмотря на то, что вы отдохнули или, если у вас есть подозрения на опухоль кости, пожалуйста, немедленно обратитесь к врачу. Ортопеды-онкологи помогут вам в любой ситуации».
Техника операции при опухоли крестца - резекция крестца, удаление крестца (сакрэктомия)
Частота местно-распространенных и рецидивных форм рака прямой кишки колеблется от 30 до 64% [1]. Основную роль в их лечении продолжает играть хирургический метод. При этом удовлетворительные результаты достижимы только при выполнении операции с отрицательными (свободными от опухолевых клеток) краями резекции. Особенно сложно сделать это, когда опухоль квалифицируется хирургом как неподвижная, или «вколоченная». Таких пациентов редко признают операбельными. Одной из причин такого вердикта является непосредственное распространение опухоли прямой кишки на крестец или ее фиксация к нему за счет параканкрозных сращений. Для обеспечения необходимого свободного от опухолевого роста края резекции в такой ситуации требуется выполнение дистальной сакрумэктомии единым блоком с прямой кишкой. В сознании большинства хирургов подобный агрессивный подход чреват развитием серьезных интра- и послеоперационных осложнений и потому редко используется [2, 3].
Цель настоящего исследования — оценка безопасности удаления прямой кишки с резекцией дистальной части крестца.
Материал и методы
Проведено проспективно-ретроспективное исследование результатов лечения двух групп пациентов с гистологически верифицированным раком прямой кишки и анального канала. В исследование вошло 32 клинических наблюдения пациентов с местно-распространенным первичным или рецидивным раком прямой кишки и анального канала, которым было выполнено хирургическое вмешательство с резекцией крестца в период с 2008 по 2016 г. в Клинике колопроктологии и малоинвазивной хирургии Первого МГМУ им. И.М. Сеченова и в отделении колопроктологии с хирургией тазового дна РНЦХ им. Б.В. Петровского РАМН. Характеристика пациентов представлена в табл. 1.

Таблица 1. Характеристики пациентов (n=32)
Сложность оперативного вмешательства при местно-распространенном раке во многом определяется количеством точек фиксации опухоли к соседним структурам. В нашем исследовании была использована разработанная ранее в клинике классификация, учитывающая этот фактор [4]. С ее помощью проведен подгрупповой анализ, основанный на распределении пациентов в зависимости от количества точек фиксации. Для оценки послеоперационных осложнений использована классификация Clavien—Dindo [5].
Статистическую обработку полученных данных проводили с помощью программы Statistica 10 компании «StatSoft, Inc.» (США) и Microsoft Office Excel 2007 (США). Статистически значимой признавали разницу между группами при р
Результаты
Объем оперативного вмешательства определялся на основании данных предоперационного обследования и интраоперационной ревизии. Распределение пациентов с местно-распространенным раком и рецидивом рака прямой кишки по количеству точек фиксации опухоли представлено следующим образом: одна точка (F1) фиксации (крестец) была в 12 наблюдениях, две точки фиксации (F2) — в 10, три точки фиксации (F3) — в 3 и четыре точки фиксации (F4) — в 7 наблюдениях.
В большинстве наблюдений была произведена экстралеваторная брюшно-промежностная экстирпация прямой кишки, однако выполняли и другие виды операций, при этом различали уровень резекции крестца и вид пластики промежностной раны (табл. 2).

Таблица 2. Вид операций
Показаниями к резекции крестца в 17 наблюдениях явились данные, полученные при предоперационном обследовании пациента (МРТ), — прорастание опухоли в крестец либо в пресакральную фасцию. У 15 больных решение о выполнении резекции крестца было принято интраоперационно при обнаружении сращения опухоли с крестцом и в связи с невозможностью, с точки зрения хирурга, отделить опухоль без опасного сближения с ее циркулярной границей.
На основании гистологического исследования аденокарцинома была диагностирована у 23 больных, муцинозная аденокарцинома — у 6, плоскоклеточный рак — у 2 и полный лучевой патоморфоз — у 1 больного. Отрицательный край резекции получен у 29 пациентов, в 3 наблюдениях край резекции был позитивным по передней поверхности препарата (R2 в одном наблюдении, R1 в двух). Истинное прорастание в крестец было выявлено по результатам гистологического исследования у 6 (20%) больных. В остальных наблюдениях место фиксации опухоли к крестцу было обусловлено паратуморозным воспалением или фиброзом после предоперационного лечения.
В качестве непосредственных результатов оценивали интраоперационную кровопотерю, продолжительность операции, послеоперационный койко-день и послеоперационные осложнения (табл. 3).
Таблица 3. Непосредственные результаты операций
У 12 пациентов в послеоперационном периоде были зафиксированы осложнения различной степени тяжести. Имело место 7 осложнений I cтепени по классификации Clavien—Dindo. Осложнения, повлекшие за собой выполнение повторного хирургического вмешательства под местной анестезией, были отмечены только в 3 наблюдениях. Осложнения, приведшие к оперативному вмешательству под общей анестезией, были зафиксированы у 3 пациентов.
Среди осложнений III степени по классификации Clavien—Dindo в исследуемой группе были отмечены жидкостное скопление в брюшной полости, несостоятельность швов промежностной раны, сопровождавшаяся кровотечением из мягких тканей промежности и лонной кости и образованием тонкокишечно-промежностного свища, несостоятельность швов мочевого пузыря у двух пациентов, несостоятельность шва влагалища с абсцессом малого таза.
С учетом расширенного объема операции особого внимания заслуживают осложнения, приводящие к нарушению функции мочевыводящей системы. В исследуемой группе у 23 пациентов были сохранены мочевой пузырь и мочевыводящие пути, из них у 13 пациентов мочеиспускание восстановилось, у 10 (42%) человек в послеоперационном периоде развилась клиническая картина нейрогенного мочевого пузыря, что в 8 наблюдениях потребовало применения самокатетеризации, в 2 — формирования эпицистостомы.
После резекции крестца на уровне SII—SIII у 3 (75%) из 4 пациентов развились стойкие нарушения функции мочеиспускания. В ситуации, когда уровень пересечения крестца соответствовал SIII—SIV, картина нейрогенного мочевого пузыря наблюдалась лишь у 1 (33%) больного из 3. Из 16 пациентов после резекции крестца на уровне SIV—SV и сохранения органов мочевыведения нарушения мочеиспускания наблюдались у 6 (33%). Ни один пациент не умер в течение 90 дней после операции.
Впервые резекцию крестца для доступа к прямой кишке предложил Paul Kraske в 1885 г., в дальнейшем подход к таким хирургическим вмешательствам претерпел ряд изменений и на первый план вышла брюшно-промежностная экстирпация, не теряющая значения более 100 лет [6].
В настоящее время резекция крестца довольно широко применяется при лечении первичных опухолей тазовой локализации (хордома, тератома, саркома) [7]. Однако в современной практике многие хирурги не рискуют оперировать опухоли прямой кишки, фиксированные к пресакральной фасции или крестцу, относя их к разряду неудалимых. Необходимо отметить, что публикаций в русскоязычных источниках на эту тему немного. К примеру, коллективом авторов из НИИ им. Н.Н. Петрова описан всего один случай выполнения резекции крестца при местно-распространенной опухоли прямой кишки [8]. Продолжительность операции, величина кровопотери, возможные осложнения определяют необходимость определения четких показаний к резекции крестца в качестве этапа операции по поводу рака прямой кишки. Таким показанием является фиксация опухоли прямой кишки к крестцу, установленная до или во время операции. При попытках разделить сращение опухоли с крестцом с большой вероятностью могут иметь место положительный край резекции и соответственно неблагоприятный отдаленный результат [9]. Таким образом, при фиксации опухоли к крестцу выполнение дистальной сакрумэктомии оправдано, так как только этот маневр может обеспечить получение R0-циркулярного края резекции по задней полуокружности в случае истинного опухолевого прорастания. Этот тезис подтверждается результатами нашего исследования, так как во всех препаратах исследуемой группы была обеспечена отрицательная граница резекции по задней полуокружности. В трех наблюдениях позитивный край был выявлен по передней поверхности препарата. В одном наблюдении R2-край резекции (макроскопически позитивный) был получен из-за полностенного прорастания задней стенки влагалища, в двух других наблюдениях выявлен рост опухоли на расстоянии 0,1—0,2 см от циркулярной линии резекции.
По данным литературы, продолжительность операции с резекцией крестца составляет в среднем 360—390 мин [10, 11], что сопоставимо с полученными нами результатами. По данным H. Takagi и соавт. [12], при выполнении эвисцерации с резекцией крестца средняя продолжительность операции составляет 520 мин, что сопоставимо с нашими результатами в подгруппе пациентов с четырьмя точками фиксации (эту подгруппу составили пациенты, перенесшие эвисцерацию с резекцией крестца).
Значительное распространение опухолевого процесса требует выполнения комбинированных вмешательств, в то же время, по мнению некоторых исследователей, расширение стандартного объема операции до абдоминосакральной резекции грозит серьезными осложнениями, в том числе массивным неконтролируемым кровотечением. Например, по данным S. Bosman и соавт. [13], средняя интраоперационная кровопотеря при таких операциях составляет 3526 и 6823 мл в группе больных первичным и рецидивным раком соответственно. Максимальная кровопотеря составила 20 000 мл. Группой авторов из Великобритании опубликованы данные о средней кровопотере 1725 мл при абдоминосакральной резекции, максимальная кровопотеря составила 17 000 мл, средняя длительность операции — 9,5 ч [14].
При проведении подгруппового анализа было установлено, что массивная кровопотеря наблюдалась у тех пациентов, у которых опухолевый процесс вовлекал другие органы малого таза и имелось более двух точек фиксации. В подгруппе пациентов, у которых опухоль фиксировалась только к крестцу, кровопотеря была значимо меньше, чем при выполнении комбинированных операций пациентам с двумя, тремя и четырьмя точками фиксации (р=0,05, р=0,001, р=0,008 соответственно). Это означает, что резекция крестца сама по себе не относится к разряду этапов операции, ведущих к плохо контролируемой массивной кровопотере, и не должна рассматриваться как основной фактор при решении вопроса о возможности выполнения хирургической операции у больных с местно-распространенными или рецидивными формами заболевания. Еще одним фактором, свидетельствующим в пользу этого тезиса, является значимо меньшая длительность вмешательств, комбинированных только с резекцией крестца, по сравнению с более расширенными (р=0,001, р=0,002, р=0,001 при сравнении F1 c F2, F3 и F4 соответственно). При анализе протоколов операций пациентов, у которых кровопотеря была выше средней (n=9, 31%), установлено, что в большинстве наблюдений массивное кровотечение возникало при повреждении внутренних подвздошных сосудов, диссекция вдоль которых была продиктована необходимостью экстрафасциального выделения препарата при местно-распространенной опухоли.
Снизить объем кровопотери можно, используя современные методы гемостаза, что демонстрируют японские хирурги [15]. При сравнении непосредственных результатов операций, выполненных в 80-х и 90-х годах прошлого века, авторы отметили уменьшение средней интраоперационной кровопотери с 4229 до 2500 мл (p=0,002). Также нужно отметить, что в большинстве наблюдений основная кровопотеря при подобных операциях происходит в результате кровотечений из системы внутренних подвздошных сосудов в ходе абдоминального этапа, а не при пересечении крестца. Благодаря изменению последовательности оперативных приемов, направленных на деваскуляризацию удаляемых участков тканей, и выполнению пересечения крупных ветвей внутренних подвздошных сосудов в качестве последнего шага к удалению опухоли наряду с использованием современных высокотехнологичных хирургических инструментов (ультразвуковой скальпель, биполярный коагулятор с функцией рассечения тканей) возможно снизить объем кровопотери, выводя его на уровень приемлемого в современной онкохирургической практике. Такой подход был описан нами ранее и рекомендуется для выполнения операций с резекцией крестца [16]. Кроме того, в литературе описаны такие приемы, как коагуляция с использованием жировой ткани и обшивание места кровотечения для его эффективной остановки [17]. Этап пересечения крестца не сопровождается выраженным кровотечением и технически прост при выделении препарата до уровня фиксации к крестцу в ходе абдоминального этапа. И если дистальная сакрумэктомия не приводит к дестабилизации тазового кольца, то оперативное вмешательство может быть выполнено без привлечения вертебрологов.
Особый интерес представляет возможность возникновения стойких тазовых нарушений после операции [18, 19]. Опираясь на данные литературы, можно считать, что сохранение хотя бы с одной стороны корешка нерва SIII может обеспечить нормальные тазовые функции, а сохранение SII ведет к частичному восстановлению тазовых функций и удовлетворительным результатам [20].
В наблюдавшейся нами группе больных развитие нарушений мочеиспускания было, вероятно, связано с расширенным объемом операции и пересечением нервных стволов. Однако принципиальной зависимости частоты развития таких нарушений от уровня резекции крестца выявлено не было. Частота мочеполовых нарушений после резекции крестца на уровне SII—SIII не отличается от таковой после выполнения более дистальной сакрумэктомии (p=0,1). Очевидно, что выбор между сохранением функции тазовых органов и выполнением радикальной операции должен решаться в пользу последней, так как это напрямую связано с отдаленными результатами — 5-летняя общая кумулятивная выживаемость составляет 42% в группе с отрицательным краем резекции и 0 — c позитивным краем [9]. Специфическим для операций с резекцией крестца осложнением может быть ликворея в послеоперационном периоде. Это осложнение описано в литературе [21], но у наблюдавшихся нами больных оно зафиксировано не было в связи с тщательным предоперационным планированием вмешательства, так как ни в одном наблюдении не было отмечено контакта с конечной цистерной спинного мозга.
Отсутствие специфических для таких операций осложнений, контролируемая при должной подготовке хирурга кровопотеря, а также высокий уровень резекции без контакта с опухолью по данным гистологических исследований свидетельствуют об их безопасности и возможной онкологической эффективности. Последнее требует дальнейшей оценки отдаленных результатов. Обследование пациента на предоперационном этапе с использованием КТ и МРТ позволит применять классификацию по точкам фиксации на догоспитальном этапе, прогнозировать и предотвращать интраоперационную кровопотерю. Несомненно, такие вмешательства являются прерогативой специализированных учреждений онкологического и колопроктологического профиля, располагающих опытом комбинированных вмешательств при местно-распространенном и рецидивном раке прямой кишки и анального канала.
Таким образом, выполнение дистальной резекции крестца в случае фиксации к нему первичной или рецидивной опухоли прямой кишки или анального канала сопровождается допустимым увеличением длительности операции и объема кровопотери, однако не приводит к значительному числу серьезных осложнений и летальному исходу. Комбинированные операции с дистальной сакрумэктомией при распространении опухоли на крестец оптимальны для проведения радикального вмешательства с отрицательным краем резекции и выполнимы в условиях специализированного стационара колопроктологом (онкохирургом), специализирующимся на операциях при местно-распространенных опухолях прямой кишки.
ООО Клиника спинальной нейрохирургии «Аксис»;
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН, Москва
Первый МГМУ им. И.М. Сеченова, Москва
ФГБНУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко", РАМН, Москва
ФГАУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
Осложнения хирургического лечения опухолей крестцовой локализации
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2019;83(1): 67‑74
Опухоли крестца — группа новообразований, неоднородных по гистологическому типу, степени злокачественности и характеру роста, которые объединяет только локализация. Хирургическое лечение таких опухолей связано с риском больших и малых осложнений как во время вмешательства, так и после операции. Как правило, любое вмешательство, направленное на удаление опухоли крестца или крестцовой области, сопряжено с необходимостью реконструкции костей и/или мягких тканей для создания условий нормального заживления раны и возможности активизации пациента. Цель исследования — анализ осложнений, возникающих при хирургическом лечении опухолей крестца. Материал и методы. Исследование основано на опыте хирургического лечения 57 пациентов с диагнозом опухоли крестца. Им выполнено 60 хирургических вмешательств, связанных с лечением основной патологии и осложнений хирургического лечения. Большие и малые осложнения наблюдались у 37 (68%) оперированных пациентов. Всего было зафиксировано 47 различных осложнений. У 6 пациентов осложнения раннего послеоперационного периода потребовали дополнительной операции. Выводы. Хирургическое лечение опухолей крестца сопряжено с высоким риском осложнений. Несмотря на потенциальный риск больших осложнений, сакрэктомия при первичной, или потенциально агрессивной, или злокачественной нейрогенной опухоли крестца необходима для улучшения локального контроля и выживаемости пациентов.
Первичные опухоли крестца составляют 2—4% от всех опухолей костей и 1—7% всех первичных опухолей позвоночника. Они представлены врожденными образованиями (хордомой, тератомой), первичными костными опухолями (хондросаркомой, гигантоклеточной опухолью, остеобластомой, аневризмальной костной кистой, остеомой, хондромой), различными саркомами мягких тканей. Отдельно выделяют нейрогенные опухоли: эктопические эпендимомы, невриномы, нейрофибромы, злокачественные опухоли периферических нервов (ЗОПН), периферические нейроэктодермальные опухоли (pPNET) [1, 2]. Клиническая картина при этих новообразованиях различна и зависит от размеров опухоли, направления роста, распространенности и степени инвазии опухолевой ткани, однако первым симптомом чаще всего является локальная боль, усиливающаяся в ночное время [3]. Хирургическое лечение опухолей крестца сопряжено с развитием различных по тяжести осложнений, а прогноз неоднозначен и чаще обусловлен биологией опухоли [4, 5]. Несмотря на 60-летнюю историю изучения проблем, связанных с лечением опухолей крестцовой локализации, и технические преимущества современных диагностических и операционных методов, прогноз исхода заболевания в большинстве случаев по-прежнему остается неясным. До сих пор нет четких рекомендаций относительно необходимости стабилизации после ампутации крестца ниже позвонка S1. Также отсутствуют четкие рекомендации по пластическому закрытию дефекта после удаления крестца.
Цель исследования — проведение анализа осложнений и последствий хирургического лечения опухолей крестцовой локализации.
Проведен ретроспективный анализ результатов хирургического лечения 57 пациентов с различными опухолями крестцовой области в НМИЦ нейрохирургии им. акад. Н.Н. Бурденко Минздрава России в период с 2001 по 2015 г.
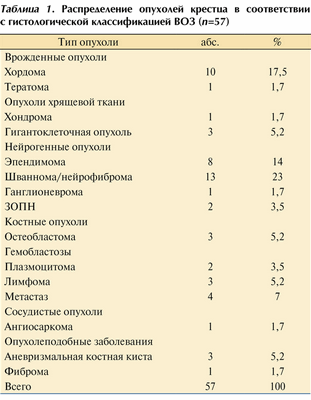
Гистологическая характеристика опухолей представлена в табл. 1. Таблица 1. Распределение опухолей крестца в соответствии с гистологической классификацией ВОЗ (n=57)
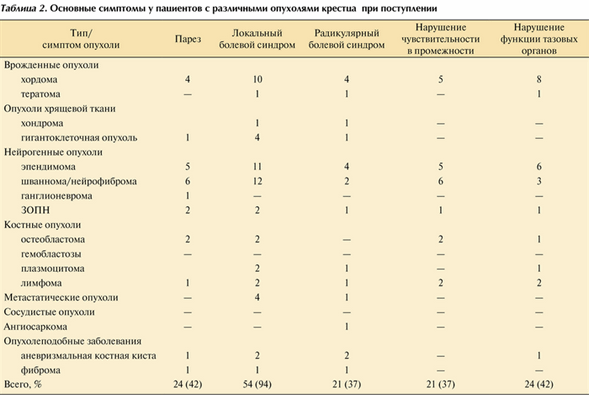
Основные клинические симптомы, выявляемые при поступлении в стационар, приведены в табл. 2. Таблица 2. Основные симптомы у пациентов с различными опухолями крестца при поступлении
Самым частым симптомом была локальная боль. Нарушение функции тазовых органов наблюдалось у 42% пациентов, столько же пациентов имели слабость в нижних конечностях, у 37% пациентов наблюдались нарушения чувствительности и корешковая боль.
Следует отметить, что основной целью лечения пациентов с опухолью крестца являются уменьшение/купирование болевого синдрома, контроль функции тазовых органов, локальный контроль опухоли, а для пациентов с первичными злокачественными опухолями — увеличение продолжительности жизни. По данным разных авторов, наиболее эффективным методом лечения является резекция опухоли единым блоком [6, 7], поэтому большая часть пациентов подвергаются инвалидизирующей операции, что оправдано с точки зрения онкологического прогноза, но сомнительно с точки зрения динамики неврологических симптомов и качества жизни после операции.

Классификация симптомов после N-блок-резекции крестца, предложенная Biagini и соавт. в 1997 г., представлена в табл. 3. Таблица 3. Классификация нарушений после сакрэктомии по Biagini и соавт. (1997)
В серии наших наблюдений N-блок-резекция опухоли крестца была выполнена 10 пациентам (6 пациентов с хордомой, 2 с гигантской шванномой, 1 с ганглионевромой, 1 с солитарным метастазом рака почки). У всех пациентов исходно наблюдался выраженный локальный болевой синдром (в среднем 7 баллов по визуально-аналоговой шкале, ВАШ), у 6 пациентов (с хордомой и шванномами) отмечено нарушение функции тазовых органов в виде запора и нарушения мочеиспускания, у 2 была анестезия аногенитальной области.
Всем 6 пациентам с хордомой была выполнена резекция крестца: 3 пациентам — высокая ампутация крестца, 1 — тотальная сакрэктомия, 2 — средняя сакрэктомия. После операции у всех пациентов отмечено снижение интенсивности боли до 1—2 баллов по ВАШ, однако наблюдалось ухудшение функции тазовых органов. В 3 случаях оно было транзиторным, в 3 других наступило стойкое ухудшение, при этом у 2 пациентов возникло недержание мочи и кала, в 1 случае развилась неполная задержка мочи.
Осложнения сакрэктомии
При анализе результатов сакрэктомии необходимо уточнение понятий последствий и осложнений операции.
Последствиями сакрэктомии принято считать нарушения, связанные с пересечением нервных структур в ходе выделения опухоли, нарушение целостности тазового дна и появление полости в области крестца. Таким образом, к последствиям операции можно отнести нарушение чувствительности в аногенитальной области и в ногах, нарушение движений в ногах, нарушение сексуальной функции, мочеиспускания, дефекации.
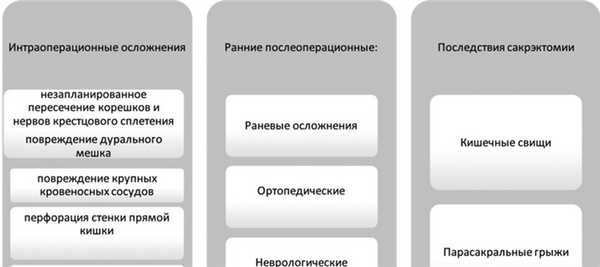
Осложнения сакрэктомии разделяют по времени возникновения на интраоперационные и осложнения раннего и отдаленного послеоперационного периода (рис. 1). Рис. 1. Классификация осложнений сакрэктомии.
Всего в исследуемой группе осложнения были зафиксированы у 37 (68%) пациентов. У 6 пациентов наблюдались интраоперационные осложнения, у всех 37 были осложнения в раннем послеоперационном периоде. Осложнений в отдаленном периоде не наблюдалось. Общее число осложнений составило 47.
Интраоперационные осложнения
К интраоперационным осложнениям принято относить повреждение крупных сосудов, интраоперационную кровопотерю, перфорацию стенки полого органа, незапланированное пересечение спинальных корешков.
Из этих осложнений в исследуемой группе отмечена только кровопотеря. Она не была связана с повреждением крупных сосудов, источником кровотечения служили пресакральные вены, венозное сплетение прямой кишки. В среднем объем кровопотери составил 3,2 л (от 1,6 до 17). Для профилактики последствий кровопотери были использованы аппарат для реинфузии с лейкоцитарной мембраной, гиперволемическая гемодилюция с одномоментным забором собственных эритроцитов, предоперационная заготовка собственной плазмы крови и донорских эритроцитов и плазмы крови. В одном случае на фоне большой кровопотери и переливания донорских эритроцитов развились шоковая почка и макрогематурия. Данное осложнение было купировано в раннем послеоперационном периоде.
Осложнения раннего послеоперационного периода
К осложнениям раннего послеоперационного периода относятся раневые осложнения, которые, по данным литературы, составляют 25—46% от всех осложнений. Среди них преобладают инфекционные осложнения в виде поверхностного и глубокого нагноения. К глубоким нагноениям относят ишиоректальные абсцессы, эмпиему, формирование натечников и эпидуритов с последующим менингитом. Эти осложнения, как правило, сопровождают повреждение прямой кишки с последующим попаданием бактерий в раневую полость и нагноением.
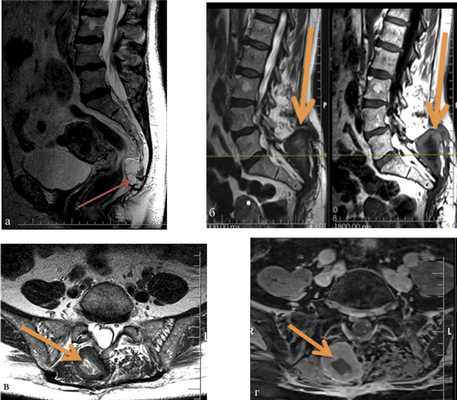
В нашей серии гнойные осложнения наблюдались у 10 (27%) пациентов, из них у 6 было глубокое нагноение раны. В случаях подтвержденного глубокого нагноения проводилась ревизия операционной раны с последующим дренированием и установкой приточно-отточной системы. В 1 случае потребовалось открытое ведение раны с аспирационной повязкой. У 1 пациентки наблюдалось нагноение межмышечной гематомы (рис. 2). Рис. 2. МРТ крестца и таза у пациентки с хордомой крестца. а — до операции, сагиттальная проекция, опухоль указана стрелкой; б—г — после операции, сагиттальная (б) и аксиальная проекции (в, г). Нагноившаяся гематома указана стрелкой.
У 1 пациента в раннем послеоперационном периоде наблюдалась серома в зоне операции. Это частое явление, как правило, встречающееся у пациентов после резекции части креста при удалении костной опухоли, редко приводит к каким-либо последствиям.
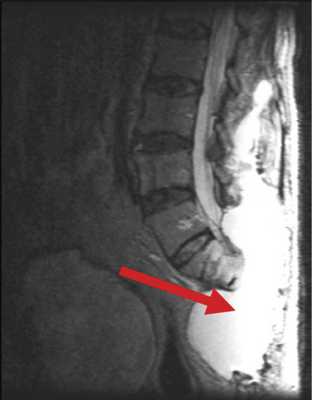
В случае пациента Б., 78 лет, после высокой ампутации крестца, в блок опухоли вошла часть m. erector spinae. Для пластики дефекта были использованы большие ягодичные мышцы, левый лоскут был частично развернут. У пациента наблюдался дефицит массы тела, развившийся на фоне выраженного болевого синдрома, который, в частности, сопровождал акт дефекации. В связи с этим пациент старался меньше есть, за счет чего масса тела снизилась с 86 до 65 кг за 1 мес. Нарушение репаративной функции привело к отсутствию сращения мягких тканей, сформировалась полость, заполненная серозной жидкостью, общим объемом около 5 л (рис. 3). Рис. 3. Гигантская серозная полость как осложнение сакрэктомии (указана стрелкой).
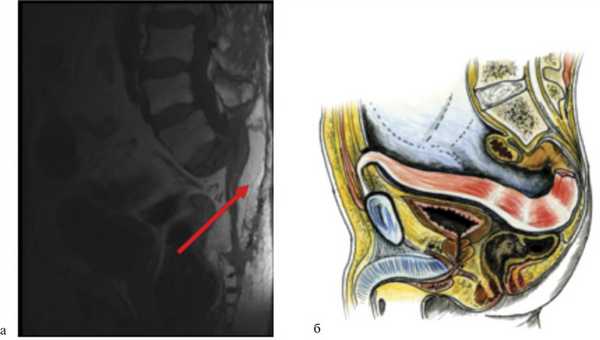
Для лечения подобных осложнений используется метод транспозиции ректоабдоминального лоскута в пресакральную область ректоабдоминальным доступом (рис. 4). Рис. 4. Пример использования метода транспозиции ректоабдоминального лоскута на питательной ножке. а — МРТ больного после операции, сагиттальная проекция. Перемещенный дедерматизированный ректоабдоминальный лоскут указан стрелкой; б — схематическое изображение перемещения лоскута.
Несмотря на продолженный рост и метастазирование опухоли (хондроид-хордома GIII), серозная полость регрессировала, рана зажила первичным натяжением в течение 10 сут.
Нарушение функции мочевого пузыря наблюдалось у 15 пациентов, из них только у 3 оно было следствием резекции крестца, в то время как у остальных нарушение функции тазовых органов было связано с интраоперационным повреждением или иным воздействием на корешки крестцового сплетения. Нарушение функции тазовых органов выражалось полной задержкой мочи у 12 пациентов и требовало периодической катетеризации у 11 пациентов и установки постоянного катетера у 1 пациента, в связи с нарушением подвижности. В 1 случае наблюдался острый пиелонефрит на фоне полной задержки мочи. В 3 случаях развилось недержание мочи: у 2 пациентов была парадоксальная ишурия и у 1 пациента — полное недержание. Двое пациентов также отмечали отсутствие позывов к дефекации, нарушение процесса дефекации и связанные с этим боли в животе. Одному пациенту наложена колостома.
Нарушения мочеиспускания, зафиксированные у 13 пациентов, регрессировали до нормы либо до неполной задержки с минимальной остаточной мочой в мочевом пузыре (до 150 мл). В 1 случае с пересечением дурального мешка на уровне L5—S1 нарушение функции тазовых органов не регрессировало, и пациенту была наложена эпицистостома. У 1 пациентки в связи с недержанием мочи был имплантирован бандаж на шейку мочевого пузыря.
У 6 пациентов в раннем послеоперационном периоде наблюдалась ликворея. Все пациенты имели распространенные нейрогенные опухоли: 5 — миксопапиллярные эпендимомы и 1 — интра-экстрадуральную шванному. Удаление этих опухолей было сопряжено с пластикой твердой мозговой оболочки. Всем пациентам был установлен люмбальный дренаж на время заживления раны. Ни в одном из представленных случаев не было зафиксировано инфекции, ликворея не потребовала ревизии или пластики мягких тканей.
Болевой синдром в связи с пересечением/повреждением корешков крестцового сплетения может осложниться формированием хронического нейропатического болевого синдрома, резистентного к терапии. В нашей группе хронический нейропатический болевой синдром и гиперпатия в зоне иннервации S2—S5 были у 4 пациентов. В 3 случаях в течение 3 мес болевой синдром регрессировал, однако в 1 случае потребовался длительный прием прегабалина.
В 4 случаях был отмечен стресс-перелом крестца в раннем периоде после высокой ампутации крестца. В литературе стресс-перелом крестца после сакрэктомии описывается как редкое осложнение в связи с большой практикой применения металлоостеосинтеза. В нашей серии во всех случаях перелом был обусловлен частичной резекцией крестца и сопутствующим остеопорозом у больных старше 40 лет (3 женщины и 1 мужчина) (рис. 5). Рис. 5. Стресс-перелом крестца после высокой ампутации крестца у пациентки 54 лет на фоне активизации. а, б — 3D-реконструкция СКТ таза после операции, вид спереди (а) и вид сзади (б); в — СКТ на уровне перелома в аксиальной проекции. Стрелками указана линия перелома. В 3 случаях это осложнение наблюдалось после удаления хордомы, в 1 случае — шванномы S1 корешка после частичной резекции покрышки крестца и расширения первого крестцового отверстия (рис. 6). Рис. 6. СКТ костей таза. а — фронтальная и сагиттальная проекции; б, в — 3D-реконструкция, вид спереди и сзади. Линия перелома указана стрелками. Во всех случаях это осложнение сопровождалось локальным болевым синдромом, нарушением походки. В первых 3 случаях проводилась хирургическая коррекция с имплантацией металлоконструкции для пояснично-тазовой стабилизации (рис. 7), Рис. 7. Пояснично-тазовая стабилизация после стресс-перелома крестца на фоне сакрэктомии. а — СКТ до операции; б, в — метод после операции стабилизации. линия перелома указана стрелками. в 1 случае наблюдался регресс болевого синдрома на фоне приема бисфосфонатов.
Техника сакрэктомии является сложной и часто сопряжена с большим количеством осложнений. Выбор стратегии лечения должен основываться на индивидуальных особенностях каждого пациента. Необходимо оценивать функциональный статус и способность пациента перенести лечение, соотносить цели лечения с последствиями и возможными осложнениями, а также учитывать биологические свойства конкретной опухоли.
Оптимальной тактикой лечения раневых и ортопедических осложнений является проведение одномоментной транспозиции ректоабдоминального лоскута и одномоментной пояснично-тазовой стабилизации.
Авторы заявляют об отсутствии конфликта интересов.
Комментарий
Статьявыполнена в классическом стиле. Дан анализ хирургических осложнений лечения 57 случаев новообразований крестца.
Осложнения хирургического лечения опухолей крестца — по-настоящему важная для рассмотрения проблема, широко обсуждаемая в англоязычной периодике. Актуальность проблемы хирургического лечения опухолей крестца безусловна, так как более трети пациентов испытывают нарушение качества жизни и нуждаются в повторной операции после перенесенной парциальной или тотальной сакрэктомии, выполненной для лечения опухолей крестца.
Представленная авторами группа пациентов весьма разнородная, пациентов объединяет лишь локализация новообразований, разумеется, объем хирургического вмешательства зависел от морфологического строения опухоли. В статье подчеркнута зависимость тех или иных осложнений от вида и объема хирургического лечения, в частности от степени резекции нервных структур.
Ввиду редкости описываемой патологии статья представляет интерес для читателей журнала.
Тотальне видалення крижа при пухлинному ураженні
Резюме. У статті узагальнено досвід клініки онкоортопедії РОНЦ при виконанні тотальної сакректомії при пухлинних ураженнях крижа. Детально описані етапи операції, приведено клінічне спостереження тактики лікування пацієнта з рецидивом епендимоми крижа.
Резюме. В статье обобщен опыт клиники онкоортопедии Российского онкологического научного центра (РОНЦ)) по выполнению тотальной сакрэктомии при опухолевых поражениях крестца. Подробно описаны этапы операции, приведено клиническое наблюдение тактики лечения пациента с рецидивом эпендимомы крестца.
Опухолевые поражения крестца — редкие случаи в клинической практике. По данным L. Whittaker, выявляют 1 пациента с опухолью крестца на 40 тыс. госпитализаций [6]. Клиническое течение болезни при данной патологии отличается особой тяжестью. Часто опухоль диагностируют в запущенных стадиях, операции проводят в непрофильных учреждениях, что вызывает частые рецидивы и ухудшает прогноз. Резекции крестца при опухолях относятся к одним из наиболее травматичных оперативных вмешательств в онкоортопедии [2].
Тотальное удаление крестца (сакрэктомия) часто сопровождается большой кровопотерей, высок риск развития инфекционных осложнений, заживления раны вторичным натяжением, неврологического дефицита. Кроме осложнений, особую трудность вызывает проблема выполнения адекватной стабилизации позвоночно-тазового сегмента и эндопротезирования крестца [3]. Эндопротезирование позволяет улучшить функциональные и психологические результаты противоопухолевого лечения и не влияет на прогноз заболевания [1]. Известен способ реконструкции дефекта после тотальной сакрэктомии, предложенный Z. Gokaslan (1997) [4]. Методика заключается в выполнении пояснично-крестцового спондилодеза путем остеосинтеза с применением L-образных стержней Galveston, которые крепятся к транспедикулярным винтам, установленным в тело поясничных позвонков и в подвздошные кости. Такой метод пояснично-крестцовой фиксации впервые предложен в 1982 г. при сколиозах [11]. Остеосинтез подвздошных костей между собой не выполняется, что может приводить к нестабильности конструкции вплоть до ее переломов. В 2003 г. M. Zileli предложил заменить L-образные стержни Galveston продольными стержнями, крепящимися при помощи замков только к поперечному верхнему стержню, соединяющему подвздошные кости, которые фиксированы между собой двумя поперечными стержнями [5].
Методика операции (клиника онкоортопедии РОНЦ)
Операции по тотальному удалению крестца требуют мультидисциплинарного подхода, необходимо участие онкоортопедов, нейрохирургов и пластических хирургов. Хирургическое вмешательство разделяется на несколько основных этапов.
Этап I. Положение пациента — на спине. Передний доступ. Забирают ректоабдоминальный лоскут, мобилизируют передний полюс опухоли. Для этого выполняют разметку кожи на передней брюшной стенке. Разрез кожи подкожно-жировой клетчатки и фасции для забора ректоабдоминального лоскута проходит в проекции прямой мышцы живота (m. rectus abdominis) (рис. 1). Последнюю отсекают у реберной дуги и выделяют на всем протяжении из собственного влагалища. Выделяют кровоснабжающие ее нижнеэпигастральные артерию и вену (a. et v. epigastrales inferiorts), являющиеся ветвями наружных подвздошных сосудов. Мышцу отсекают в области прикрепления к лобковому симфизу (symphis pubis). Внебрюшинно производят доступ к пресакральной области. Мобилизуют бифуркацию общих подвздошных сосудов. Внутренние подвздошные сосуды (a. et v. iliaces interni) перевязывают и пересекают с целью уменьшения кровопотери во время резекции крестца и удаления опухоли. При необходимости мобилизуют передний полюс опухоли от прилежащих органов малого таза. Ректоабдоминальный лоскут помещают в сформированный туннель, при этом необходимо контролировать сосудистую ножку и не допустить ее перекручивания, что может привести к некрозу всего лоскута. Рану передней брюшной стенки послойно ушивают, оставляют дренаж.

Этап II. Положение пациента — на животе (поворот) с подложенными валиками под грудь и таз. Производят разрез кожи вдоль остистых отростков (tubercula spinalis) на уровне LIII-SII, продлевая разрез дугообразно на ягодичные области (рис. 2). Тупым и острым способом сепарируют мышцы спины, на уровне LIII-SII скелетируют позвоночник.

Рис. 2. Кожный разрез вдоль остистых отростков позвонков для установки транспедикулярного фиксатора и дугообразный разрез для выполнения резекции крестца (этап II)
Этап III. Далее выполняют нейрохирургический этап операции, корешки и элементы спинного мозга освобождают от опухолевых тканей, при необходимости перевязывают и пересекают.
Затем визуализируют подвздошные кости. Выделяют копчик, пересекают крестцово-бугорные и крестцово-остистые связки (ligg. sacrotuberous et sacrospinalis). Выполняют ревизию пресакральной области с целью исключения врастания опухоли в прилежащие органы. При распространении опухоли на ягодичные мышцы (mm. glutei) последние широко иссекают. Далее выполняют мобилизацию и тотальную резекцию крестца (рис. 3).

Этап IV. В тела поясничных позвонков, минимум на двух уровнях, устанавливают транспедикулярные винты, к которым крепятся продольные стержни. В подвздошных костях с помощью фрезы выполняют технологические отверстия, через которые проводят и фиксируют шайбами в подвздошных костях поперечные стержни. Продольные стержни фиксируют на поперечных при помощи замков (рис. 4).

С помощью костного цемента с антибиотиком выполняют пластику костного дефекта крестца (рис. 5).

Перемещенный ректоабдоминальный лоскут выводят из пресакральной области в область раны и укладывают на эндопротез крестца с отграничением ампулы (ampula recti) прямой кишки (рис. 6). Паравертебрально в ложе удаленной опухоли с двух сторон выводят дренажи. Рану послойно ушивают.

Клинический пример
Пациент З., 30 лет, находился на стационарном лечении в отделении вертебральной хирургии НИИ КО РОНЦ им. Н.Н. Блохина РАМН с диагнозом «рецидив эпендимомы крестца». Из анамнеза: в течение 11 лет пациенту было выполнено 6 операций различного объема по удалению опухоли крестца, проводилась лучевая терапия (СОД 60 Гр) в неонкологической клинике. При поступлении в РОНЦ пациент предъявлял жалобы на боль в области крестца с иррадиацией в левую ногу, нарушение функции тазовых органов. В течение 6 мес до госпитализации больной не ходил вследствие выраженного болевого синдрома, который возникал при вертикальном положении тела. По данным рентгенологических обследований определяли многоузловую высоковаскуляризированную опухоль c практически полной деструкцией крестца переходом на LV позвонок и крыло подвздошной кости (рис. 7).

Рис. 7. Данные рентгенологического обследования: а — компьютерная томография (КТ), фронтальная проекция; б — КТ, аксиальная проекция; в — ангиография
В предоперационный период пациенту было проведено компьютерное моделирование объема удаляемых тканей и предполагаемой системы стабилизации оперированного сегмента (рис. 8).

Рис. 8. Компьютерное моделирование: а - модель опухоли; б - модель дефекта после удаления опухоли и стабилизирующая система
По описанной методике пациенту была выполнена операция тотального удаления крестца с эндопротезированием и пластикой мягкотканного дефекта ректоабдоминальным лоскутом. Основные этапы операции представлены на рис. 9, 10.

Рис. 9. Остеосинтез металлоконструкцией поясничных позвонков и подвздошных костей: 1 — подвздошные кости; 2 — ампула прямой кишки

Рис. 10. Пластика мягкотканного дефекта: 1 - ректоабдоминальный лоскут (указан стрелкой) выведен в зону операции из малого таза; 2 — ягодичные лоскуты
Продолжительность операции — 14 ч хирургического времени, кровопотеря — 12 000 мл, использовали метод аутоинфузии собственных эритроцитов (Cell-saver). После удаления опухоли пациенту был введен рекомбинантный VII фактор свертываемости крови (NovoSeven), что позволило добиться стабильного гемостаза в области ложа удаленной опухоли, выполнить реконструктивный этап операции в полном объеме, а в послеоперационный период — избежать образования обширных гематом.
В послеоперационный период пациент был активизирован на 4-е сутки, на 7-е сутки он самостоятельно передвигался с ходунками в корсете (рис. 11). Рана зажила первичным натяжением, перемещенный лоскут без признаков ишемии. Неврологический статус после операции — сохранялись парезы стоп с двух сторон; анестезия в области дерматомов LV-SI с двух сторон на стопах; анестезия в аногенитальной зоне справа, слева глубокая гипестезия, до операции — анестезия. Пациент стал частично контролировать функцию мочеиспускания. По данным стандартной рентгенографии, признаков нестабильности металлоконструкции не выявлено (рис. 12).


Радикальные хирургические вмешательства при опухолях крестца наиболее оправданы при низкозлокачественных или агрессивных доброкачественных опухолях, либо в случаях, когда процесс резистентен к химиолучевому лечению. Выполнение радикальных операций на костях таза сопряжено со значительными трудностями, поэтому показания следует рассматривать группе специалистов на мультидисциплинарном консилиуме, включающем хирургов, ортопедов, нейрохирургов, анестезиологов, лучевых диагностов, химио- и лучевых терапевтов.
Эпендимома крестца происходит из клеток эпендимы, распространяется в крестцовом канале и обычно имеет доброкачественную морфологическую форму. Боль в области крестца с иррадиацией или без — наиболее частые первые симптомы болезни, отмечаемые главным образом в возрасте 30-40 лет. Нарушение чувствительности и двигательной активности, а также нарушение функции тазовых органов являются следствием компрессии элементов конского хвоста, и время от начальных проявлений до установления диагноза может составлять обычно 2-3 года [7, 8].
Выбор оперативной тактики требует мультидисциплинарного подхода с использованием современных компьютерных технологий, тщательного предоперационного обследования и планирования хода операции и оперирующих бригад хирургов, высокую квалификацию специалистов на всех этапах оказания медицинской помощи.
Заключение
Данный вид хирургического вмешательства является современным, высокотехнологичным методом лечения опухолевого поражения крестца с использованием последних достижений науки и техники.
Тотальная сакрэктомия требует комплексного подхода с участием специалистов разного профиля, что возможно только в условиях специализированного учреждения. Предлагаемый метод хирургического лечения позволяет улучшить качество жизни больных с опухолевым поражением крестца, активизировать пациентов уже на 3-и сутки после операции, уменьшить время пребывания в стационаре, снизить риск развития нестабильности и инфекционных осложнений.
Читайте также:
