Техника переднелатерального доступа к коленному суставу
Добавил пользователь Евгений Кузнецов Обновлено: 02.02.2026
ФГБОУ «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Санкт-Петербург, Россия
ФГБУ «Центральный научно-исследовательский институт травматологии и ортопедии им. Н.Н. Приорова» Минздрава России, Москва, Россия;
ФГАОУ ВО «Российский университет дружбы народов», Москва, Россия
НИИ скорой помощи им. И.И. Джанелидзе, Санкт-Петербург
Анатомическая антеградная пластика передней крестообразной связки коленного сустава с латеральным экстраартикулярным тенодезом трансплантатом из сухожилия полусухожильной мышцы
Журнал: Вестник травматологии и ортопедии им Н.Н. Приорова. 2018;(4): 12‑18
Во всем мире растет число людей, которые ведут активный образ жизни, занимаясь спортом и физкультурой. Негативной стороной этого является увеличение распространенности спортивных травм, в том числе повреждений передней крестообразной связки (ПКС) коленного сустава. Частота разрывов ПКС в 2016 г. достигла 68,6 случая на 100 тыс. населения [1]. При таких повреждениях возникают патологические переднезадние и передневнутренние ротационные смещения голени, особенно в момент ускоряющих, скручивающих или вальгусных нагрузок на коленный сустав [2]. Эти смещения приводят к вторичному разрушению внутрисуставных структур, являясь причиной развития артроза [3, 4]. Реконструкция ПКС стала повседневной процедурой при лечении передней нестабильности коленного сустава [5].
Однако даже корректно выполненная пластика ПКС не всегда обеспечивает должное восстановление внутренней ротационной стабильности коленного сустава 7. В некоторых случаях это связано с тем, что разрывы ПКС часто сопровождаются дополнительными повреждениями латеральных внесуставных капсульно-связочных структур коленного сустава [9, 10]. Эти структуры обеспечивают внутреннюю ротационную стабильность большеберцовой кости, а вместе с ПКС предотвращают и переднезаднее смещение коленного сустава 11. Изучение роли латеральных капсульно-связочных структур, а также возможностей их хирургического восстановления становится актуальным направлением современной спортивной хирургии коленного сустава 16.
Цель исследования: формулировка научно-обоснованных рекомендаций по клиническому применению латерального экстраартикулярного тенодеза (ЛЭАТ) трансплантатом из сухожилия полусухожильной мышцы (СПСМ) как дополнительного элемента восстановления стабильности коленного сустава при анатомической антеградной пластике ПКС.
Пациенты и методы
Проанализированы результаты хирургического лечения 162 пациентов, которым в период с 2012 по 2017 г. была выполнена артроскопическая реконструкция ПКС. Возраст прооперированных варьировал от 18 до 40 лет, составив в среднем 27,2±2,8 года. Во всех наблюдениях имел место полный разрыв ПКС с явлениями выраженной внутренней ротационной нестабильности коленного сустава, которая при оценке с помощью теста pivot-shift составляла 3+ условных балла, при этом у данных пациентов не было повреждений задней крестообразной или коллатеральных связок коленного сустава, сухожилия подколенной мышцы, клинически значимых разрывов менисков или дефектов внутрисуставного хряща.
Жалобы пациентов, функцию коленного сустава оценивали по шкалам Lysholm Knee Scoring Scale, KOOS, 2000 IKDS, проводили стандартное клиническое обследование и лучевую диагностику (рентгенографию коленного сустава в стандартных переднезадней, боковой и аксиальной проекциях, компьютерную томографию — КТ и магнитно-резонансную томографию — МРТ).
Все пациенты были прооперированы в сроки от 1 до 12 мес после травмы.
В 44 (27,2%) наблюдениях реконструкцию ПКС дополняли ЛЭАТ трансплантатом из СПСМ (1-я группа). У 118 (72,8%) человек проводили изолированную анатомическую антеградную пластику ПКС (2-я группа).
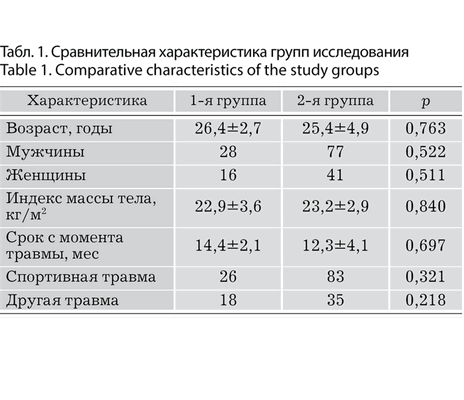
По возрасту и полу пациентов, срокам с момента травмы и ее механизмам группы были сопоставимы (табл. 1). Табл. 1. Сравнительная характеристика групп исследования Возраст, годы Мужчины Женщины Индекс массы тела, кг/м 2 Срок с момента травмы, мес Спортивная травма Другая травма
Реконструкцию ПКС выполняли костно-сухожильно-костным аутотрансплантатом из связки надколенника (ВТВ), который проводили антеградно с учетом анатомического позиционирования костных каналов.
BTB-трансплантат готовили по стандартной методике из средней порции связки надколенника, выпиливая прямоугольные блоки, причем одному из них придавали форму трапеции для заклинивания в бедренном костном канале.
Бедренный костный канал формировали в проекции наружного мыщелка бедренной кости через отдельный разрез мягких тканей, проксимальнее наружной боковой связки, длиной 4,5—6 и 1—1,5 см для пациентов 1-й группы и длиной 1-1,5 см для пациентов 2-й группы. При этом выходное отверстие канала на внутренней поверхности наружного мыщелка бедренной кости размещали в центре прикрепления нативной ПКС — у латерального бифуркационного гребня, ниже латерального межмыщелкового гребня.
Внутрисуставное отверстие большеберцового канала с учетом анатомического прикрепления ПКС формировали напротив задней крестообразной связки и латеральнее основания медиального возвышения большеберцовой кости.
BTB-трансплантат проводили антеградно через бедренный канал с импакцией в нем проксимального костного блока. После проведения дистального костного блока в большеберцовый канал натянутый трансплантат фиксировали в нем одним интерферентным винтом.
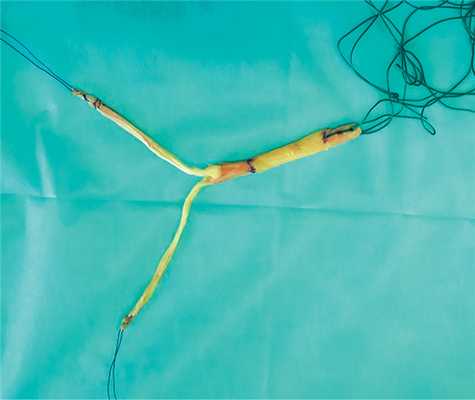
У пациентов 1-й группы BTB-трансплантат дополняли свободным аутотрансплантатом из СПСМ, протянутым через специально сформированное отверстие в трапециевидном костном блоке и предназначенным для ЛЭАТ (рис. 1). Рис. 1. Внешний вид трансплантата для пластики ПКС и ЛЭАТ у пациентов 1-й группы. У них же в наружном мыщелке большеберцовой кости в области бугорка Gerdy формировали дополнительный костный канал диаметром 4 мм, располагая его входное и выходное отверстия на расстоянии не менее 1 см друг от друга.
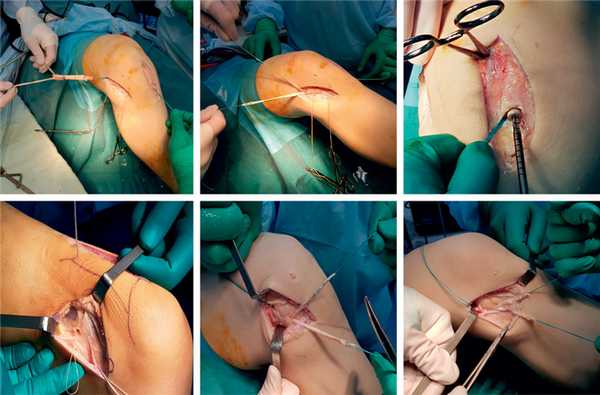
Первым устанавливали и фиксировали ВТВ-трансплантат. После заклинивания трапециевидного костного блока BTB-трансплантата в бедренном канале одновременно фиксировали и трансплантат из СПСМ, свободные концы которого проводили под наружной боковой связкой, а затем через отверстия костного канала наружного мыщелка большеберцовой кости навстречу друг другу. Концы трансплантата натягивали при нейтральной ротации голени и сгибании в коленном суставе около 30° и в этом положении подшивали каждый к противоположной порции в виде дупликатуры так, чтобы получалась замкнутая петля (рис. 2). Рис. 2. Этапы операции у пациентов 1-й группы. а — антеградное проведение комбинированного трансплантата; б — заклинивание проксимального костного блока с СПСМ в бедренном канале; в — фиксация ВТВ-трансплантата в большеберцовом канале; г — формирование костного канала в наружном мыщелке большеберцовой кости; д — проведение свободных концов трансплантата СПСМ под наружной боковой связкой; е — проведение свободных концов трансплантата СПСМ в костном канале наружного мыщелка большеберцовой кости и их натягивание.
Послеоперационный период, реабилитационные мероприятия в обеих группах пациентов проводили по одинаковой методике, используемой после операций на ПКС.
Оценку результатов проводили в течение не менее 2 лет после хирургического вмешательства через каждые 2,5-3,5 мес.
Кроме анализа состояния коленного сустава, изучали продолжительность операции, длительность стационарного лечения, нетрудоспособности, режима возвращения к спортивной активности.
Статистическая обработка полученных данных выполнена в программе Statistical Package for the Social Sciences (SPSS), версия 22 (SPSS Inc., США). Для общей характеристики исследуемых параметров использован метод описательной статистики. Проверку параметров в каждой выборке на нормальность распределения осуществляли по критерию Колмогорова-Смирнова. Для оценки статистической значимости различий средних значений анализируемых параметров у пациентов исследуемых групп использован t-критерий для независимых выборок (в связи с нормальным распределением исследуемых параметров). Различия признавали статистически значимыми при двустороннем p0,05. Результаты представлены в виде М±m, где M — среднее значение, m — стандартное отклонение.
Результаты
Инфекционных осложнений в группах не наблюдали, а по данным лучевых методов исследования констатировали стандартные рентгенологические изменения, которые соответствовали клинической картине.
Изучение функционального состояния коленного сустава по интегральной шкале KOSS показало, что средняя балльная оценка, свидетельствующая о наличии патологических симптомов повреждения коленного сустава, а также средняя балльная оценка, характеризующая спортивную активность, оказались выше у пациентов 1-й группы (см. табл. 2).
При оценке клинических результатов положительный тест Лахмана, соответствующий условному баллу 1+, в 1-й группе наблюдали только у 3 (6,8%) пациентов против 24 (20,3%) пациентов — во 2-й (p<0,05), а оценка теста pivot-shift соответствовала условному баллу 1+ у 2 (4,5%) и 24 (20,3%; p<0,05), 2+ — у 0 и 9 (7,6%; p<0,05) соответственно (табл. 3).
Продолжительность хирургического вмешательства у пациентов 1-й группы оказалась на 26,1±4 мин больше, чем у пациентов 2-й группы.
Длительность пребывания в стационаре, реабилитации, сроки нетрудоспособности и возвращения к спорту в группах не различались.
Одной из основных причин неудовлетворенности пациентов результатами реконструкции ПКС является сохраняющаяся ротационная нестабильность коленного сустава [17]. Эта проблема может быть связана как с вертикальным положением трансплантата, так и с сохраняющейся посттравматической недостаточностью 19.
Иногда повреждения переднелатеральных структур коленного сустава сопровождаются отрывным переломом кортикальной пластинки от переднелатеральной поверхности проксимального метаэпифиза большеберцовой кости, который впервые был описан P. Segond в 1879 г. и, таким образом, визуализируется на рентгенограммах [12].
ЛЭАТ активно использовали в 70-80-х годах XX века для хирургического лечения передней нестабильности коленного сустава, однако высокая частота неудовлетворительных результатов (49-58%) заставила специалистов искать новые пути решения этой проблемы [21, 22]. Вскоре появились технологии внутрисуставной реконструкции ПКС, которые позволили в значительной степени увеличить переднюю стабильность и снизить частоту развития остеоартроза наружного отдела коленного сустава [23, 24]. Вместе с тем ни транстибиальная пластика ПКС, которая активно применялась хирургами до 2000-х годов, ни предложенные позднее технологии «анатомического» позиционирования трансплантата (в том числе двухпучковая реконструкция ПКС) не позволяют у отдельных пациентов достигнуть достаточной передневнутренней ротационной стабильности коленного сустава [19, 25, 26]. ЛЭАТ стали применять вновь уже как дополнительный способ повышения эффективности внутрисуставной пластики ПКС [16, 22, 27].
В настоящем исследовании изучали пациентов с такими разрывами ПКС, которые сопровождались значительной, беспокоящей их внутренней ротационной нестабильностью коленного сустава, соответствующей условным 3+ баллам теста pivot-shift. Проведенный анализ показал в целом высокий клинический и функциональный результат в обеих группах, однако в отдаленном периоде, через 21 мес после операции, во 2-й группе статистически значимо (р<0,05) чаще выявляли слабоположительную гипермобильность коленного сустава по тесту Лахмана, а также внутреннюю ротационную нестабильность в пределах от 1+ до 2+ условных баллов теста pivot-shift. Сходные результаты были получены и в других исследованиях. Авторы также констатировали статистически значимые различия по результатам лечения пациентов с выполнением и без выполнения ЛЭАТ при анатомических реконструкциях ПКС, но в сроки от 12 или 15 мес после операции [16].
Снижение ротационной стабильности у пациентов 2-й группы, вероятно, возникавшее на фоне возвращения к обычным нагрузкам при полной амплитуде движений в коленном суставе, было связано с недостаточностью трансплантата ПКС для противодействия скручиванию, даже несмотря на его анатомическое, по мнению большинства авторов, более устойчивое к ротации, расположение. Установленный в центре сустава короткий трансплантат при несостоятельности переднелатерального капсульно-связочного комплекса не может препятствовать избыточному внутреннему вращению наружного мыщелка большеберцовой кости. Более эффективным в этом плане будет дополнительный трансплантат, расположенный вне сустава, непосредственно на наружных мыщелках бедренной и большеберцовой костей. Удерживая таким образом большеберцовую кость, препятствуя ее внутреннему вращению, ЛЭАТ выполняет вспомогательную протективную функцию по отношению к BTB-трансплантату, что предотвращает его повреждение при повторных травмах и избыточных нагрузках на коленный сустав [14, 16, 28]. L. Engebretsen и соавт. [29] установили, что ЛЭАТ значительно (до 43%) уменьшает ротационную нагрузку на трансплантат ПКС.
Таким образом, снижение частоты и выраженности патологических симптомов в коленном суставе, дискомфорта, синовита, утомляемости конечности, боли в коленном суставе и др. по шкале KOOS у пациентов 1-й группы могли быть обусловлены достигнутой в результате выполнения ЛЭАТ более выраженной ротационной стабильностью. Кроме того, пациенты 1-й группы чаще и более эффективно возвращались к занятиям футболом, баскетболом, волейболом, дзю-до, самбо и другими видами спорта, ассоциированными с высокоэнергетическими нагрузками на коленный сустав (р<0,05).
Увеличение длительности хирургического вмешательства у пациентов 1-й группы было связано с дополнительными этапами по подготовке и установке трансплантата для ЛЭАТ (выделение и обшивание концов СПСМ, проведение его через костный блок ВТВ-трансплантата, проведение трансплантата для ЛЭАТ под наружной боковой связкой, затем в костный канал наружного мыщелка большеберцовой кости, его натяжение и фиксация).
Вместе с тем использованная у пациентов 1-й группы технология ЛЭАТ не увеличивает затрат на имплантаты и имеет перспективы по сокращению общего времени операции за счет оптимизации рабочих процессов, например если подготовку трансплантатов ассистентом проводить одновременно с артроскопической обработкой коленного сустава и формированием костных каналов для ЛЭАТ и установки ВТВ-трансплантата.
Исходя из результатов нашего исследования, можно говорить о двух основных причинах дополнять «анатомическую» пластику ПКС ЛЭАТ: наличие выраженной внутренней ротационной нестабильности и необходимость «защиты» BTB- или ST-трансплантата от повреждений в будущем.
Таким образом, рекомендовать проведение ЛЭАТ можно пациентам:
— с выраженной ротационной нестабильностью коленного сустава (тест pivot-shift 3+);
— занимающимся агрессивными видами спорта;
— моложе 20-21 года в силу вероятности значительных функциональных нагрузок в будущем;
— с разрывами ранее установленного трансплантата ПКС.
Условия успешного выполнения ЛЭАТ:
— достаточная длина трансплантата;
— состоятельность заднелатерального капсульно-связочного комплекса коленного сустава пациента;
— отсутствие признаков артроза латерального отдела коленного сустава или предрасполагающих к этому факторов (в том числе повреждение наружного мениска, «вальгусное колено» и т. д.).
Несоблюдение этих правил может стать причиной быстрого прогрессирования дегенеративных изменений в суставе, обусловить появление болевого синдрома и формирование разгибательной контрактуры коленного сустава [27].
Выводы
1. Латеральный экстраартикулярный тенодез трансплантатом из сухожилия полусухожильной мышцы является эффективным дополнением анатомической антеградной реконструкции передней крестообразной связки у пациентов с нестабильностью коленного сустава (тест pivot-shift 3+), позволяющим не только повысить общую стабильность коленного сустава (р<0,05), но и снизить частоту неблагоприятных симптомов (р<0,05) при сроках наблюдения более 21 мес с момента операции.
2. Объединение трансплантата из сухожилия полусухожильной мышцы и ВТВ-трансплантата позволяет использовать бедренный канал в качестве общей точки фиксации при антеградной анатомической реконструкции передней крестообразной связки, а трансоссальное проведение сухожилия полусухожильной мышцы в наружном мыщелке большеберцовой кости дает возможность эффективно выполнить латеральный экстраартикулярный тенодез без использования дополнительных имплантатов.
3. Дополнение «анатомической» пластики передней крестообразной связки латеральным экстраартикулярным тенодезом с использованием сухожилия полусухожильной мышцы целесообразно у пациентов, имеющих выраженную внутреннюю ротационную нестабильность, и/или при необходимости снизить риск повреждения установленного BTB-трансплантата в будущем.
Виды и терапия повреждений связок коленного сустава
Во время восстановления пациенты находятся в палатах европейского уровня комфортности. Они обеспечены индивидуальными средствами личной гигиены и диетическим питанием.
Подготовка к операции
Особенно внимательными пациентам стоит быть при подготовке к предстоящей артроскопии. Понадобятся консультации с ортопедом, анестезиологом, хирургом. Обязательно понадобится сдача определенных анализов, прохождение обследований:
Техника передненаружного … Техника передненаружного … Техника передненаружного … Техника передненаружного …
Правила подготовки к операции на коленный сустав выглядит таким образом:
- Сдача назначенных анализов.
- Прекращение приема сильнодействующих медпрепаратов за 1 - 2 нед. до процедуры.
- Проведение разъяснительной беседы (обычно за день до операции).
- До назначенной процедуры не стоит пить, есть за 12 часов. Важно быть трезвым. Также нельзя курить.
- В зоне пораженного сочленения не допускается наличие каких-либо ссадин. Волосы удаляют мед. работники на месте.
- При наличии простуды стоит поставить в известность хирурга.
- Приобрести назначенные обезболивающие медпрепараты.
- На процедуру прийти со вспомогательными приспособлениями для ходьбы и сопровождающими лицами.
Оперативные доступы к тазобедренному суставу задний передний
Известно, что при выполнении эндопротезирования тазобедренного сустава применяются различные хирургические доступы, при этом преимущественно используются переднебоковые и заднебоковые доступы. У пациентов с тяжелой патологией тазобедренного сустава (коксартроз тяжелой степени, выраженная оссификация краёв вертлужной впадины и ее губы, протрузия головки бедренной кости) немногие виды доступов к тазобедренному суставу могут быть использованы при эндопротезировании. Поиск оптимального доступа к тазобедренному суставу обусловливает проведение анализа его недостатков. В литературе широко освещены преимущества и недостатки передних и задних доступов к тазобедренному суставу 3. Имея определенный опыт применения боковых доступов, мы поставили следующую цель: провести анализ результатов использования боковых доступов к тазобедренному суставу при выполнении эндопротезирования.
Материалы и методы
Работа основана на анализе собственных результатов применения боковых доступов при эндопротезировании тазобедренного сустава у 44 пациентов с протрузионным коксартрозом 3-й степени, осложнённым выраженной оссификацией краёв вертлужной впадины и её губы. Средний возраст пациентов - 60 ± 1,5 года. Женщины составили 63,6%.
Всем пациентам выполнялись необходимые лабораторные и клинико-инструментальные исследования.
В данной тяжелой клинической ситуации использовались два вида боковых доступов к тазобедренному суставу: доступ по Хардингу и предложенный нами модифицированный боковой доступ. Эндопротезирование тазобедренного сустава всем пациентам выполнялось эндопротезом конструкции ЭСИ.
Прямой боковой доступ, предложенный Р. Бауэром (R. Bauer) и усовершенствованный К. Хардингом (K. Hardinge), включает выполнение кожного разреза длиной 12-16 см над большим вертелом, рассечение широкой фасции бедра на всём протяжении раны, разделение мышечных волокон средней ягодичной мышцы на протяжении 3 см выше верхушки большого вертела, отделение средней ягодичной мышцы и латеральной порции четырёхглавой мышцы бедра субпериостально от передней поверхности большого вертела. Затем производят вывихивание головки бедренной кости и выполняют дальнейшие хирургические манипуляции [3].
Модифицированный боковой доступ к тазобедренному суставу включает следующие этапы: разрез кожи в проекции большого вертела, рассечение широкой фасции бедра, выполнение трёх разрезов. Первый разрез от проксимальной точки по ходу мышечных волокон средней ягодичной мышцы в передне-верхнем направлении длиной 3 см, второй разрез от точки на границе между средней и дистальной третью большого вертела в направлении кпереди, отступив от центральной линии 1 см, длиной 3 см, третий разрез производят, соединяя начальные точки первого и второго разрезов между собой в виде дуги, направленной выпуклой стороной кпереди (рисунок), отсекают среднюю ягодичную мышцу от передней поверхности большого вертела в пределах выполненных разрезов, полученный лоскут средней ягодичной мышцы смещают кпереди и фиксируют при помощи инструментов. Затем вывихивают головку бедренной кости и выполняют эндопротезирование тазобедренного сустава. После основного этапа смещённый кпереди сформированный мышечно-сухожильный лоскут укладывают на своё место и фиксируют при помощи швов [4].
Статистическая обработка полученных результатов проводилась с использованием программы Statistica 8.0. При выполнении сравнительного анализа полученных данных между группами использовали непараметрический критерий Манна-Уитни. Критический уровень значимости при проверке статистических гипотез p
Реабилитация при осложнениях после менискэктомии
После удаления мениска в коленном суставе может скапливаться жидкость и ощущаться боль. Эти симптомы должны уменьшиться через трое суток, а ко второй неделе послеоперационного периода исчезнуть. В ранний восстановительный период для устранения отёчности и болевого синдрома ортопеды проводят дренирование и антисептическую обработку раны. Дополнительно назначают:
- иммобилизацию ноги ортопедическими средствами;
- приподнятое положение нижней конечности в то время, когда пациент лежит в кровати;
- прикладывание холодных сухих компрессов;
- антибактериальные препараты;
- противовоспалительные и обезболивающие средства.
Долго не спадающий отёк является свидетельством прогрессирования воспаления, а, возможно, и развившегося локального инфекционного процесса. Это чревато не только отсутствием эффекта после операции, но и более сложными последствиями: отторжением и повреждением протеза, требующего выполнения повторной операции (снятия имплантата) и продолжительной антибактериальной терапии. Если выраженный отёк связан с чересчур избыточным скоплением синовиальной жидкости и крови, проводится пункция коленного сустава и удаление содержимого суставной полости.
В течение 1-2 недель к суставу прикладывают пузырь со льдом. Гимнастические упражнения на оперированной конечности не выполняются. Пациент, лёжа в постели, под контролем инструктора ЛФК делает гимнастику здоровой ногой, целью которых является предотвращение тугоподвижности в суставах. По мере стихания воспалительного процесса движения постепенно увеличивают, а к концу шестой недели выполняют в полном объёме.
Техника передненаружного … Техника артроскопического доступа к … Техника артроскопического доступа к … Техника переднелатерального доступа к …
Затем пациенты начинают заниматься на современных тренажёрах, которыми оснащена клиника реабилитации Юсуповской больницы. Они позволяют постепенно, с минимальными неприятными ощущениями увеличивать амплитуду движения коленного сустава. Пациент накачивает манжету вокруг колена воздухом, и нога распрямляется за счёт оказываемого давления.
Независимо от типа менискэктомии, после операции существует немалый риск образования в коленном суставе патологических образований - рубцов и спаек. После оперативного вмешательства нижняя конечность двигается мало. Противостоять развитию тяжёлого спаечного процесс реабилитологи начинают со следующего дня после хирургического вмешательства. Инструктор ЛФК составляет и проводит комплекс лечебной физкультуры, который не будет мешать заживлению раны, предотвратит контрактуру и мышечную атрофию.
После хирургического вмешательства в отдалённом восстановительном периоде может не держать боковая связка колена. Это выражается боковой нестабильностью коленного сустава, подкашиванием нижней конечности при ротационном движении. Если во время операции была проведена реконструкция разорванной малоберцовой или большеберцовой коллатеральной связки, не исключено, что вследствие нерациональных нагрузок снова произошло нарушение целостности неокрепшей связочной структуры, которая стабилизирует и укрепляет суставной аппарат. Пациента осматривает ортопед и реабилитолог. После выявления достоверной причины нестабильности меняется тактика ведения пациента.
Навигация дает уверенность.
Анализ соответствия. До резекции в режиме реального времени графически отображается поверхность резецированного переднего кортикала бедра, которая не будет покрыта передним фланцем бедренного компонента. Баланс суставных щелей. Функции Gap Balancing (баланс суставных щелей) и Gap Analysis (анализ баланса) позволяют хирургу оценить суставные щели при сгибании и разгибании — до или после выполнения резекций — и сохранить их в протоколе операции.
Уверенность. Система предупреждает врача о увероятности врезания в передний кортикал до выполнения резекции. Виртуальное уменьшение типоразмера. Система позволяет врачу увидеть картинку, которая получится, если врач выберет феморальный компонент меньшего размера.
Сколько стоит артроскопия коленного сустава в Москве: удаление мениска
Оперативное удаление мениска с помощью артроскопии имеет высокую стоимость. Общая стоимость лечения пациента после артроскопического удаления мениска, включая период реабилитации, меньше, чем стоимость лечения после операции с открытым доступом. После операции с открытым доступом период реабилитации более длительный. Стоимость артроскопии зависит от квалификации, опыта хирурга, ценовой политики клиники, от оснащенности клиники - стоимость процедуры на инновационном оборудовании будет выше. В клиниках Москвы проводится артроскопия мениска коленного сустава, цена на операцию варьируется от 18900 до 65000 рублей в зависимости от клиники.
Техника артроскопического доступа к … Техника заднего доступа к коленному … Техника заднего доступа к коленному … Техника переднелатерального доступа к …
Диагностика
Обследование начинается с опроса, во время которого уточняется механизм травмирования, выясняются жалобы, производится пальпация связок сустава. Учитываются:
- область наибольшей болезненности;
- видоизмененность сустава;
- отечность и покраснение;
- наличие и место кровоизлияния;
- объем движений (ограниченность нагрузки либо нестабильность в суставе);
- возможность опоры на конечность.
Для оценки состояния боковых связок проводится следующий тест. Больной лежит на спине, сгибает колено под углом 20°, полностью расслабляя мышцы. Врач, положив одну руку на сочленение снаружи, другой удерживает пятку, отклоняя голень кнаружи для оценки внутренней коллатеральной связки. При 20° отклонении имеется полный разрыв, сочетающийся с травмой менисков, КС.
Дифференциальную диагностику проводят с переломами и вывихами.

При поврежденных связках сочленение изменяет форму исключительно из-за отечности: движения хоть и ограничены вследствие болезненности, но присутствует, пружинящего сопротивления не наблюдается.
Для уточнения диагноза выполняется:
- УЗИ - позволяет выявить наличие кровоизлияния, утолщение, степень поврежденности.
- МРТ - обладает высокой точностью, наиболее информативный метод исследования.
- Рентгенография колена - полезна при отрыве связки с костным фрагментом в месте ее прикрепления, также при сопутствующих переломах.
- Артроскопия - малоинвазивная хирургическая манипуляция. Проводится при помощи специального эндоскопического оборудования.
Способ хирургического доступа к тазобедренному суставу при эндопротезировании
Предлагаемое изобретение относится к области медицины, а именно к травматологии и ортопедии, и может быть использовано при выполнении операции эндопротезирования тазобедренного сустава для лечения патологии с выраженными дегенеративно-дистрофическими изменениями, заболеваниями, переломами проксимального отдела бедренной кости и их последствиями.
При эндопротезировании в основном используют переднебоковые и заднебоковые доступы к тазобедренному суставу, позволяющие максимально сохранить сосудисто-нервные образования проксимального отдела бедренной кости и таза.
Несмотря на большое многообразие хирургических доступов к тазобедренному суставу, немногие из них могут быть использованы при выполнении эндопротезирования у пациентов с тяжелой патологией тазобедренного сустава (коксартроз тяжелой степени, выраженная оссификация краев вертлужной впадины и ее губы, протрузия головки бедренной кости).
Использование переднего доступа ограничивает свободу хирурга при обработке проксимального отдела бедренной кости, также имеется риск повреждения бокового бедренного нерва и сосудисто-нервного пучка.
При использовании задних доступов предполагается пересечение ягодичных мышц и коротких наружных ротаторов, что грозит нарушением их восстановления и тяжелыми осложнениями со стороны седалищного нерва.
Преимуществом бокового доступа является возможность использования сочетания противоположно направленных положений элементов проксимального отдела бедренной кости. Угол операционного действия при боковом доступе в среднем равен 90° [(1) Прохоренко В.М., Турков П.С.
Влияние положения проксимального отдела бедренной кости на выбор оперативного доступа / В.М. Прохоренко, П.С. Турков // Медицина и образование в Сибири. - 2013. - №3. - 21 с.]. Наиболее целесообразно в указанной тяжелой клинической ситуации является использование бокового доступа, который обеспечивает достаточный обзор операционного поля и угол операционного действия при эндопротезировании.
Аналогом изобретения выбран переднебоковой доступ в модификации Мюллера. Пациента располагают строго на боку и жестко фиксируют таз в вертикальном положении. Разрез кожи центрирован над средней частью большого вертела и направлен дистально вдоль оси бедра.
После разреза кожи и подкожной клетчатки рассекают илеотибиальный тракт продольно. Сумку большого вертела рассекают для доступа через место прикрепления средней ягодичной мышцы к передней части большого вертела. Переднюю порцию средней ягодичной мышцы пересекают, сохраняя сухожильную манжетку для последующего восстановления мышцы.
Производят разделение по ходу мышечных волокон средней ягодичной мышцы на 3 см проксимальнее к верхней губе вертлужной впадины. Отводят среднюю ягодичную мышцу кпереди и краниально обнажают сухожилие малой ягодичной мышцы.
Ягодичные мышцы отводят кпереди и кверху и удерживают острым распатором Хомана, установленным в подвздошную кость выше вертлужной впадины. Рассекают капсулу для обнажения головки бедренной кости и губы вертлужной впадины.
Наиболее близким к предлагаемому является прямой боковой доступ предложенный Н. Bauer и усовершенствованный К. Хардингом. Положение пациента на здоровом боку, таз располагают строго перпендикулярно поверхности операционного стола.
Кожный разрез длиной 12-16 см проходит между передним и задним краями большого вертела на равном удалении от верхушки большого вертела. Широкую фасцию бедра рассекают на всем протяжении раны.
Проводят тупое продольное разделение мышечных волокон средней ягодичной мышцы на протяжении 3 см выше верхушки большого вертела.
Затем при помощи электроножа среднюю ягодичную мышцу и латеральную порцию четырехглавой мышцы бедра субпериостально отделяют от передней поверхности большого вертела и распатором от капсулы сустава.
Отделение средней ягодичной мышцы должно быть выполнено при сохранении сухожильной структуры на большом вертеле. Капсулу сустава иссекают в пределах видимости или сохраняют, после чего производят вывихивание головки бедренной кости и выполняют дальнейшие хирургические манипуляции [(3) Тихилов P.M. Руководство по эндопротезированию тазобедренного сустава / P.M. Тихилов, В.М. Шаповалов. - СПб.: РНИИТО им. P.P. Вредена, 2008. - 301 с. 189-190].
Эндопротезирование тазобедренного сустава - передний доступ
Передний доступ при эндопротезировании тазобедренного сустава
Слева - передний доступ, справа - задний доступ при эндопротезировании тазобедренного сустава
Выполнение эндопротезирования тазобедренного сустава передним доступом - современная тенденция в ортопедии с фокусом на минимально-инвазивные варианты оперативных вмешательств. Суть метода - выполнение той же операции, но с меньшим повреждением мягких тканей и окружающих мышц. Выполнение операции через доступ меньшего размера также позволяет сократить травму, наносимую мягким тканям при их диссекции, что благоприятно влияет на скорость восстановления пациента после вмешательства и снижает болевые ощущения.
Суть методики переднего доступа при эндопротезировании тазобедренного сустава
Использование переднего доступа для выполнения операции такого типа - не новшество.
Многие хирурги десятилетиями выполняли эндопротезирование тазобедренного сустава через передний доступ. Самый цитируемый отчет о проведении такой операции был опубликован в 1980 году. Нововведением в настоящее время является выполнение операции через меньший доступ (разрез) при помощи более специализированного инструмента для того, чтобы сделать операцию менее травматичной для пациента.
Тазобедренный сустав находится в месте соединения костей таза и верхней части бедренной кости. Все эндопротезирования тазобедренного сустава, независимо от вида доступа, требуют замещения верхней части бедренной кости и вертлужной впадины тазовой кости. Это можно сделать несколькими способами, поскольку доступ может быть сформирован сзади сустава (задний доступ), сбоку сустава (боковой или переднебоковой доступ), спереди сустава (передний доступ) или при помощи сочетания различных видов доступа (вмешательство через два разреза).
Важно понимать, что целью операции, независимо от типа доступа, является замещения головки бедренной кости и ацетабулярной впадины тазовой кости.
Особенности переднего доступа при эндопротезировании тазобедренного сустава
Передний доступ - это доступ, при котором мышцы разводятся в стороны и к суставу хирург попадает между двумя соседними мышцами, а не путем сначала отрезания, а затем пришивания мышцы.
Преимуществом такого подхода является более быстрая реабилитация, поскольку не требуется время для заживления вновь пришитой мышцы.
Как и при других минимально-инвазивных доступах разрез выполняется как можно меньше по размеру для снижения послеоперационного дискомфорта. Есть мнение, что эндопротезирование передним доступом снижает риск появления дислокаций, однако с имплантатами нового типа улучшенной конфигурации это преимущество становится менее актуальным.
Наибольшее число осложнений, связанных с эндопротезированием передним доступом, идентично осложнениям, возникающих при стандартных операциях. Одним из специфичных осложнений является повреждение латерального бедренного кожного нерва при выполнении разреза, что может привести к появлению хронических болей, патологических ощущений в области передней и боковой частей бедра.
Является передний доступ предпочтительным типом выполнения операции?
Как и со многими другими нововведениями в области хирургии эндопротезирования суставов, не существует однозначного мнения, является ли передний доступ более предпочтительным по сравнению с другими вариантами. У каждого вида операции эндопротезирования тазобедренного сустава имеются свои преимущества и недостатки.
Несмотря на то, что есть мнение, что реабилитация при применении переднего доступа происходит быстрее, существуют и данные, противоречащие этому утверждению. Некоторые исследования не обнаружили достоверной разницы в скорости реабилитации между постоперационным периодом при применении переднего доступа и других видов хирургических техник.
Желание снизить болевой синдром и ускорить восстановление вполне понятно. Однако, наиболее важным аспектом эндопротезирования тазобедренного сустава является формирование сустава, не вызывающего боли при движении и способного прослужить пациенту в течении многих лет. Эти два важных аспекта нельзя компроментировать при поиске новых вариантов хирургических подходов и техник.
В то время как передний доступ при эндопротезировании тазобедренного сустава может иметь ряд преимуществ перед другими видами операционной техники, до конца неясно, насколько он действительно улучшает результаты этой операции.
Все эти вопросы вы сможете обсудить с вашим лечащим врачом при планировании операции.
Латеральная нестабильность (привычный вывих) надколенника: причины, типы вмешательств и реабилитация
Боль в коленях- один из самых распространенных поводов, с которым пациенты обращаются к травматологу. Чаще всего источником недуга является травмирование коленной чашечки. Но иногда причина дискомфорта может крыться в феморопателлярном отделе - месте скольжения надколенника по межмыщелковой борозде бедренной кости.
В норме движения надколенника при сгибании/разгибании в коленном суставе контролируют несколько анатомических структур:
- Соотношения между межмыщелковой вырезкой и наколенником не позволяют последнему смещаться в наружновнутреннем направлении.
- Поддерживающие связки (ретинакулюмы) надколенника совместно с собственной связкой надколенника и сухожилием четырехглавой мышцы бедра создают его центрацию во всех четырех направлениях.
Если анатомия феморопателлярного отдела не изменена, то коленный сустав работает нормально. Однако если в этом отделе имеется какая-либо врожденная аномалия, то вероятность развития латеральной нестабильности надколенника резко возрастает.
Привычный (рецидивирующий) вывих надколенника - это неестественное состояние, характеризующееся рецедивирующими латеральными (наружными) подвывихами и вывихами надколенника.
Латеральный вывих надколенника характеризуется разрывом медиального ретинакулюма (медиальной пателло-феморальной связки) коленного сустава. Повторный вывих у пациента — главный признак не выполнения медиальной пателло-феморальной связкой своих функций из-за перерастяжения после первичной травмы.
Вывих надколенника, как первичный, так и повторный, ведет к значимому повреждению хрящевого покрова. Как результат — появляется стойкий болевой синдром и снижение физической активности пациента.
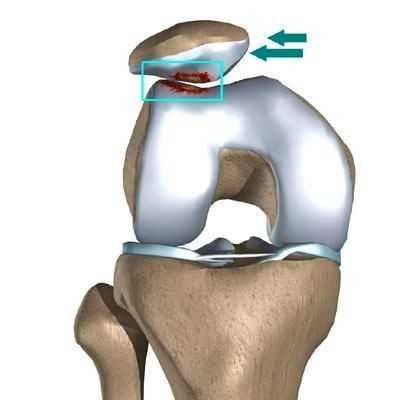
Как образуется латеральная нестабильность надколенника?
Часто предпосылкой к формированию латеральной нестабильности надколенника становится дисплазия феморопателлярного отдела — врожденного состояния, характеризующегося нарушениями соотношений между надколенником и недостаточно выраженной межмыщелковой бороздой бедренной кости (см. рис.).
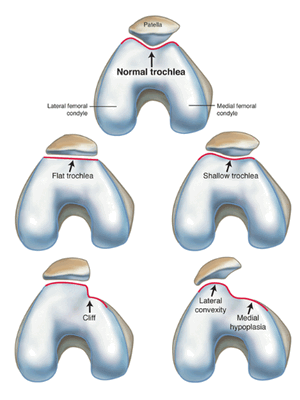
Наличие дисплазии различной степени выраженности ведет к тому, что движения надколенника при сгибании и разгибании в коленном суставе происходят с тенденцией к его латеральному смещению. При дополнительном травматическом воздействии это приводит к возникновению полноценного вывиха.
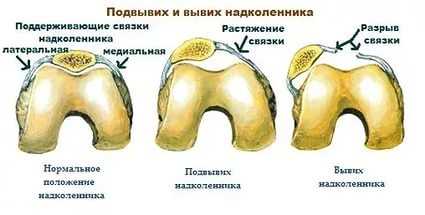
Однако дисплазия не всегда вызывает смещение надколенника (рецидивирующего вывиха надколенника).
Современные подходы к диагностике и лечению рецидивирующего вывиха надколенника
Однократно возникший вывих надколенника не является показанием к операции. Как правило, он успешно устраняется с помощью консервативного лечения, которое проводится в три этапа:
- Иммобилизация и ходьба на костылях 4 недели.
- Лечебная физкультура (ЛФК) с инструктором, физиотерапевтическое лечение (ФТЛ) после устранения иммобилизации.
- Ношение ортеза с латеральной стабилизацией надколенника.
В большинстве случаев врач-травматолог легко диагностирует привычный вывих надколенника. Для этого проводится серия нагрузочных тестов, во время которых пациент демонстрирует страх получения повторного вывиха. Окончательный диагноз ставится после проведения магнитно-резонансной томографии (МРТ) коленного сустава. Как правило, исследование обнаруживает признаки повреждения медиальной пателло-феморальной связки, состояние подвывиха надколенника и признаки травматических повреждений хрящевого покрова.
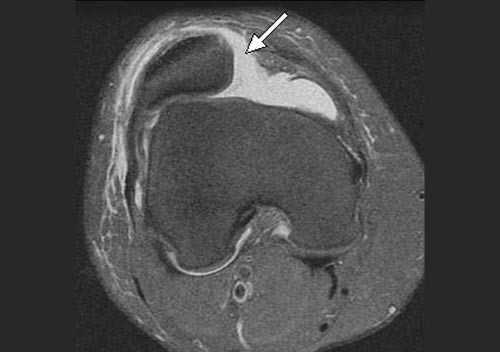
Как уже упоминалось ранее, однократный травматический вывих надколенника не является показанием к операции — достаточно консервативного лечения. При возникновении повторных вывихов/подвывихов надколенника пациенту показано оперативное лечение — хирургическая стабилизация надколенника.
Современная медицина предлагает несколько способов проведения оперативных вмешательств при привычном вывихе надколенника. Оптимальная методика — артроскопическая реконструкция (пластика) медиальной пателлофеморальной связки (МПФС). С помощью данного метода операция при вывихе надколенника позволяет восстановить утраченную анатомическую структуру, стабилизирующую надколенник (МПФС), и одновременно зашлифовать и резецировать участки поврежденного хряща без больших кожных разрезов.
Как проводится артроскопическая реконструкция?
Сначала под контролем эновидеокамеры совершаются два прокола. Они позволяют провести визуальный осмотр всех отделов сустава, при необходимости хирургически обработать поврежденные участки хряща. Затем, через два новых прокола, проводится и фиксируется сухожильный трансплантат, заменяющий утраченную поддерживающую связку надколенника. Натяжение связки регулируется под контролем видеокамеры так, чтобы вывести надколенник из положения подвывиха, но оставить физиологически достаточную свободу его смещения.
Вне зависимости от выбора фиксирующих трансплантат фиксаторов (титановых, пластиковых, биорезорбируемых) в послеоперационном периоде требуется разгрузка сустава для создания условий биологической фиксации и перестройки трансплантата. Эти процессы, по данным МРТ исследований, занимают от 6 до 12 месяцев.
Артроскопическое восстановление передней крестообразной связки методом all-inside как оптимальный способ первичной пластики
В статье «Повреждение передней и задней крестообразной связки: что предлагает современная медицина?» я уже кратко останавливался на основных причинах повреждения передней крестообразной связки (ПКС), методах диагностики и показаниях к консервативному и оперативному лечению пациентов с данной патологией.
Артроскопические операции по восстановлению ПКС проводятся уже более 40 лет. За это время понимание анатомии, функции и механики связочного аппарата коленного сустава постоянно менялось, а с ним менялись и подходы к выполнению операций по его стабилизации.
На сегодняшний день существует несколько десятков различных техник и методик пластики ПКС, отличающихся способом формирования костных тоннелей, забора трансплантата и имплантами, используемыми для его фиксации в процессе операции.
Данные современной отечественной и зарубежной литературы говорят о том, что отдаленные результаты оперативного лечения не имеют существенных отличий, вне зависимости от выбранного метода. В большей степени решающую роль играют опыт хирурга и грамотная послеоперационная реабилитация пациента.
В этой статье я постараюсь объяснить, почему считаю методику all-inside («все внутри») наиболее современным и технически совершенным методом восстановления утраченной ПКС.
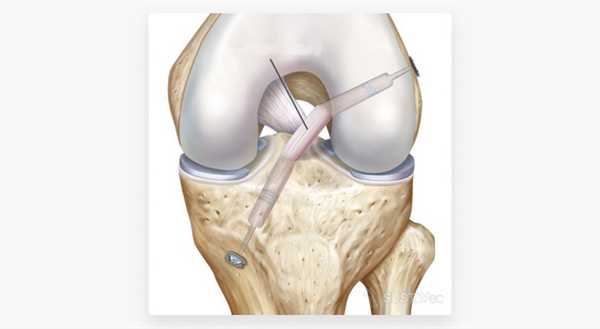
Основные преимущества метода all-inside
Для начала перечислю неоспоримые преимущества именно этого метода артроскопического восстановления передней крестообразной связки (ПКС).
- Достаточно только одного сухожилия для формирования трансплантата — сухожилие полусухожильной мышцы.
- Использование кортикальных пластин на самозатягивающейся петле (Arthrex TightRope, Mitek RIGIDLOOP, Smith and Nephew ULTRABUTTON) обеспечивает надежную накостную фиксацию и максимальное первичное натяжение трансплантата.
- Система направителей — максимальная свобода выбора позиции каналов, максимально приближенное к нормальной анатомии позиционирование трансплантата.
- Формирование костных тоннелей для трансплантата при помощи обратного сверления позволяет максимально сохранить костную массу мыщелков.
- За счет выполнения полноценной пластики ПКС всего через несколько небольших проколов достигается хороший косметический эффект.
- Малая травматичность операции в сочетании с продленной сочетанной анестезией позволяет минимизировать послеоперационный болевой синдром.
Особенности восстановления ПКС методом all-inside
Откуда забирается сухожилие для пластики ПКС?
Существует несколько методик, позволяющих получить пластический материал для замещения утраченной ПКС, при этом избежав значимой потери функции в «донорской зоне».
Основными донорскими местами являются:
- центральная порция сухожилия собственной связки надколенника,
- сухожилие четырехглавой мышцы бедра,
- сухожилие длинной малоберцовой мышцы,
- сухожилия «гусиной лапки» (полусухожильная и нежная мышцы).
Первые два варианта могут сопровождаться выраженным болевым синдромом в послеоперационном периоде и уменьшением силы разгибательного аппарата коленного сустава. Это отрицательно сказывается на сроках реабилитации. Третий — может нарушать функцию стопы. Последний вариант лишен этих недостатков и является приоритетным для выполнения артроскопического восстановления передней крестообразной связки (ПКС) методом all-inside.
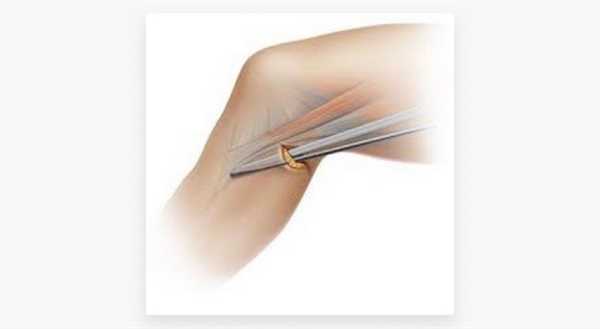
Забор сухожилия полусухожильной мышцы производится через разрез в подколенной области (2 см), что в дальнейшем обеспечивает прекрасный косметический эффект. Рубец в этой области практически незаметен.
Чем фиксируется трансплантат ПКС?
Методика all-inside подразумевает использование накостной фиксации титановыми пластинами. Предварительно подготовленное и сложенное вчетверо сухожилие полусухожильной мышцы будет закреплено на двух прочных лавсановых петлях, которые продеты через эти пластины (их размеры — около 12х3х3 мм).

Импланты не требуют последующего удаления, не «звенят» в рамках металлоискателей, а их наличие не является противопоказанием к выполнению МРТ (титан — инертный металл, не являющийся ферромагнетиком).

Как трансплантат устанавливается на место утраченной ПКС?
Дальнейшие этапы операции выполняются артроскопически, то есть через небольшие разрезы под контролем видеокамеры. Точность внутрисуставных манипуляций контролируется хирургом за счет многократно увеличенной картинки, передающейся с видеокамеры на монитор.

Основным этапом восстановления ПКС является формирование костных тоннелей, в которые затем будет проведен сухожильный трансплантат.
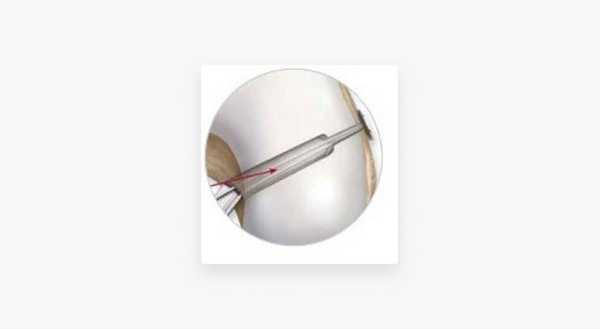
Нативная ПКС имеет крайне сложное двухпучковое строение, поэтому ни одна хирургическая методика не позволяет полностью восстановить структуру ПКС. Правильно спозиционированные тоннели дают возможность установить трансплантат в положение, максимально близкое к анатомической структуре утраченной связки.
Методика all-inside подразумевает формирование тоннелей методикой «свободной руки». Благодаря специально разработанным направителям хирург абсолютно не ограничен в выборе места для формирования тоннеля. Такой вариант позволяет достигнуть правильного положения трансплантата ПКС и, соответственно, получить хорошую стабильность сустава.
Возможен ли разрыв трансплантата ПКС? И что делать, если это случилось?
К сожалению, пластика ПКС не защищает пациентов от повторной травмы, и повторные операции (ревизионная пластика ПКС) встречаются в нашей практике чаще, чем этого хотелось бы.
Повторное артроскопическое восстановление передней крестообразной связки таит в себе много подводных камней и технических трудностей. Не последней из них является дефицит костной ткани в зонах, сформированных при предыдущих вмешательствах тоннелей.
Методика all-inside подразумевает формирование «полутоннелей», а накостная фиксация препятствует формированию костных кист в зоне расположения «рассасывающихся» фиксаторов. Именно формирование костных кист привело к уменьшению популярности использования винтов и пинов из трикальцийфосфата и полимолочной кислоты (биорезорбируемые или «рассасывающиеся» импланты) для фиксации трансплантата ПКС.
При разрыве трансплантата, если первичная пластика выполнялась по методу all-inside, повторная операция представляет собой менее трудную задачу, а ее результаты оказываются лучше.
Какая анестезия будет при операции? Что такое «продленная проводниковая анестезия», и чем она хороша?
Операция по пластике ПКС проводится под сочетанной (проводниковая + внутривенная) анестезией. Это значит, что анестезиологическое пособие сочетает два вида обезболивания: блокаду нервов и сплетений нижней конечности и внутривенное введение препаратов для создания медикаментозного сна.
Такой вариант анестезии отвечает двум важнейшим условиям: минимальная медикаментозная нагрузка на организм при максимальном обезболивающем эффекте и комфортном состоянии пациента во время и после оперативного вмешательства.
Как это выглядит?
- После постановки внутривенного катетера и начала инфузии растворов пациент погружается в контролируемый медикаментозный сон, максимально приближенный к физиологическому сну благодаря современным препаратам.
- Далее под УЗ-навигацией и контролем нейростимулятора Стимуплекс устанавливается катетер в эпиневральное пространство поясничного сплетения и вводится болюс местного анестетика.
- После операции к катетеру подключается эластомерная инфузионная помпа для долгосрочных инфузий (Accufuser®Varicon или Изипамп® II ST/LT (BBRAUN)), заполненная местным анестетиком с дозируемой скоростью введения м\а к нервному сплетению. Помпа остается у пациента в течение первых трех суток после операции. Анестезиолог обучает пациента тому, как вводить анестетик при помощи помпы при возникновении болевых ощущений.
Таким образом, первые трое суток существует полноценная возможность избавить пациента от послеоперационных болей, при этом сохраняя ему двигательную возможность конечности. Это и называется продленной анестезией.
Пациент находится на связи с врачом-анестезиологом как в клинике, так и дома. Это позволяет контролировать работу помпы, эффективность обезболивания, самочувствие пациента.
Если необходимо продолжить обезболивание еще на несколько суток после опустошения помпы, происходит ее замена. Когда потребность в обезболивании исчезает, помпа и катетер удаляются на приеме врача или самостоятельно пациентом.
Какой процесс реабилитации ждет пациента после восстановления ПКС методом all-inside?
Реабилитация — это не менее важная часть лечения, чем сама операция по пластике ПКС. Своевременная, грамотная и эффективная работа с реабилитологом и инструкторами ЛФК позволяет ускорить восстановление функции конечности.
Реабилитация проходит в несколько этапов.
Первый этап
Ранний послеоперационный период.
Сразу после артроскопического восстановления передней крестообразной связки на оперированную конечность надевают компрессионный трикотаж, а оперированный коленный сустав обездвиживают ортопедическим тутором.
Швы снимаются на десятые сутки после операции. Тутор и компрессионный трикотаж (чулки) пациент будет носить в течение двух недель после операции. На такой же срок запрещена осевая нагрузка на оперированную конечность (при ходьбе на костылях на нее нельзя будет наступать).
На третью неделю после операции ортопедический тутор сменяется шарнирным ортезом, пациенту разрешается частичная нагрузка на ногу (можно приступать на ногу, но ходить на костылях). Именно на третьей неделе пациент должен пройти консультацию реабилитолога и запланировать восстановительное лечение.
Второй этап
По прошествии трех недель разрешена полная осевая нагрузка на оперированную конечность. Костыли больше не нужны.
Начинается работа в условиях реабилитационного центра — ЛФК и упражнения, направленные на увеличение амплитуды движений в коленном суставе, упражнения на проприорецепцию и восстановление биомеханики походки. Постепенно добавляются упражнения на восстановление и поддержание мышечного тонуса.
Третий этап
Спустя три месяца после операции, при условии восстановления амплитуды движений в коленном суставе, к программе реабилитации добавляются упражнения, направленные на укрепление мышечного каркаса коленного сустава.
Мышцы и сухожилия являются динамическими стабилизаторами колена, без их слаженной и активной работы невозможны спортивные и тяжелые физические нагрузки.
Четвертый этап
Через шесть месяцев с момента операции, при условии восстановления ПКС, хорошего мышечного каркаса конечности, пациент может приступать к спортивным тренировкам.
В качестве заключения:
С моей точки зрения, методика all-inside является оптимальной для первичной пластики ПКС.
Это абсолютно не означает, что другие методики восстановления передней крестообразной связки плохие. Окончательный выбор всегда остается за оперирующим хирургом.
Для получения консультации по вопросу оперативного лечения методом артроскопии вы можете записаться ко мне на прием:
8 812 380 02 38
Напоминаю, что для постановки диагноза с собой на консультации необходимо иметь МРТ коленного сустава.
Читайте также:
- Аритмии при непостоянных формах блокады. Периоды Венкебаха.
- Программирование похудения. Пять психологических шагов к стройной фигуре
- Синдром Пазини-Пьерини (Pasini-Pierini)
- Головные боли при общих заболеваниях. Гипогликемические головные боли.
- Изменение отношения к болезни при наркомании. Лечение героиновой наркомании
