TNM классификация стадий рака молочной железы
Добавил пользователь Alex Обновлено: 21.01.2026
Сеть клиник пластической хирургии и косметологии профессора Блохина С.Н. и доктора Вульфа И.А.
ООО «Веста-Дент»
Москва, м. Чкаловская или м. Курская, пер. Казарменный, д. 10, стр. 5
Ежедневно с 9:00 до 21:00
Москва, ул. Гиляровского, д. 55
Москва, пер. Подсосенский, д. 20А
Москва, ул. Лефортовский вал, д. 5, стр. 7
Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса Российской Федерации.
Информация о ценах носит уведомительный характер и не является публичной офертой. Стоимость медицинских услуг определяется после очной консультации у специалистов. Действующий прейскурант, заверенный печатью и подписью руководителя, находится на информационном стенде Клиники. Деятельность организации осуществляется на основании действующей лицензии, выданной Департаментом Здравоохранения РФ.
Классификация TNM рака молочной железы
Tis — рак in situ.
Tis (DCIS) — протоковый рак in situ.
Tis (LCIS) — дольковый рак in situ.
Tis (Paget) — рак Педжета (соска) без признаков опухоли (при наличии опухоли, оценку проводят по её размеру).
T1 mic — микроинвазия (до 0,1 см в наибольшем измерении).
Т1а — опухоль до 0,5 см в наибольшем измерении.
T1b — опухоль до 1 см в наибольшем измерении.
T1c — опухоль до 2 см в наибольшем измерении.
Т2 — опухоль до 5 см в наибольшем измерении.
Т3 — опухоль более 5 см в наибольшем измерении.
Т4 — опухоль любого размера с прямым распространением на грудную стенку или кожу:
Т4а — распространение на грудную стенку.
Т4b — отёк (включая симптом «лимонной корочки»), или изъязвление кожи молочной железы, или сателлиты в коже данной железы.
Т4с — признаки, перечисленные в 4а и 4b.
T4d — воспалительная форма рака.
N — регионарные лимфатические узлы
NХ — недостаточно данных для оценки поражения регионарных лимфатических узлов.
N0 — нет метастазов в регионарных лимфатических узлах.
N1 — метастазы в смещаемых подмышечных лимфатических узлах (на стороне поражения).
N2 — метастазы в подмышечных лимфатических узлах на стороне поражения, спаянные между собой или фиксированные, либо клинически определяемые метастазы во внутригрудные лимфатические узлы при отсутствии клинически явного поражения подмышечных лимфатических узлов.
N2a — метастазы в подмышечных лимфатических узлах на стороне поражения, спаянные между собой или фиксированные;
N2b — клинически определяемые метастазы во внутригрудные лимфатические узлы при отсутствии клинически явного поражения подмышечных лимфатических узлов.
N3 — метастазы в подключичные лимфатические узлы на стороне поражения, либо клинически определяемые метастазы во внутригрудные лимфатические узлы при наличии клинически явного поражения подмышечных лимфатических узлов, либо метастазы в надключичные лимфатические узлы на стороне поражения (независимо от состояния подмышечных и внутригрудных лимфатических узлов).
N3a — метастазы в подключичные лимфатические узлы на стороне поражения
N3b — метастазы во внутригрудные лимфатические узлы при наличии клинически явного поражения подмышечных лимфатических узлов.
N3c — метастазы в надключичные лимфатические узлы на стороне поражения.
pNХ — недостаточно данных (не найдено лимфатических узлов, не удалены).
pN0 — нет признаков поражения метастазами регионарных лимфатических узлов при гистологическом исследовании, дополнительные методы определения изолированных опухолевых клеток не проводились.
pN0(I-) — нет признаков поражения метастазами регионарных лимфатических узлов при гистологическом и иммуногистохимическом исследованиях.
pN0(I+) — нет признаков поражения метастазами регионарных лимфатических узлов при гистологическом исследовании, но они определяются иммуногистохимическими методами (кластеры не более 0,2 мм).
pN0(mol-) — нет признаков поражения метастазами регионарных лимфатических узлов при гистологическом и молекулярных исследованиях (RT-PCR).
pN0(mol+) — нет признаков поражения метастазами регионарных лимфатических узлов при гистологическом исследовании, но они определяются молекулярными методами (RT-PCR).
pN1miс — микрометастазы (более 0,2 мм, но менее 2,0 мм).
pN1 — метастазы в 1-3 подмышечных лимфатических узла и/или микроскопическое поражение внутригрудных лимфатических узлов, выявленное по методике исследования (клинически не определяемых) «сторожевых» лимфатических узлов.
pN1a — метастазы в 1-3 подмышечных лимфатических узлах.
pN1b — микроскопическое поражение внутригрудных лимфатических узлов, выявленное по методике исследования (клинически не определяемых) «сторожевых» лимфатических узлов.
pN1c — метастазы в 1-3 подмышечных лимфоузла и микроскопическое поражение внутригрудных лимфатических узлов, выявленное по методике исследования (клинически не определяемых) «сторожевых» лимфатических узлов.
pN2 — метастазы в 4-9 подмышечных лимфатических узлах или клинически определяемое поражение внутригрудных лимфатических узлов при отсутствии поражения подмышечных лимфатических узлов.
pN2a — метастазы в 4-9 подмышечных лимфатических узлах (как минимум одно скопление более 2 мм).
pN2b — клинически определяемое поражение внутригрудных лимфатических узлов при отсутствии поражения подмышечных лимфатических узлов.
pN3 — метастазы в 10 и более подмышечных лимфатических узлов или подключичные лимфатические узлы, или клинически определяемое поражение внутригрудных и подмышечных лимфатических узлов, или поражение более 3 подмышечных лимфатических узлов с микросокпическим поражением клинически интактных внутригрудных лимфатических узлов, либо поражение надключичных лимфатических узлов.
pN3a — метастазы в 10 и более подмышечных лимфатических узлов или подключичные лимфатические узлы.
pN3b — клинически определяемое поражение внутригрудных и подмышечных лимфатических узлов, или поражение более 3 подмышечных лимфатических узлов с микроскопическим поражением клинически интактных внутригрудных лимфатических узлов.
pN3c — метастазы в надключичные лимфатические узлы на стороне поражения.
Материалы конгрессов и конференций
Определение. Под местно-распространенным раком молочной железы (РМЖ) понимается РМЖ при наличии, по крайней мере, одного из следующих признаков: распространение опухоли на кожу молочной железы, распространение опухоли на подлежащую грудную стенку, метастазы в ипсилатеральных надключичных лимфатических узлах, метастазы в ипсилатеральных подключичных лимфатических узлах; ипсилатеральные аксиллярные метастазы, спаянные между собой или фиксированные к другим структурам; большая опухоль в маленькой молочной железе (1). Под такое определение местно-распространенного РМЖ подпадает рак IIIa стадии, IIIb стадии, IIIc стадии и, частично, IIb стадии по последней классификации TNM.
Статистика. По оценке Hortobagyi G.N. и соавт., (1) ежегодно в мире выявляются 300000-350000 новых больных местно-распространенным РМЖ. В России в структуре онкологической заболеваемости женщин РМЖ занимает 1-ое место. Заболеваемость и смертность от этой болезни за 30 лет выросли в 4 раза: в 1970 г. стандартизованные показатели заболеваемости и смертности на 100000 населения составляли 9,6 и 4,2 (2); в 2001 они составили 38,3 и 16,9 соответственно (3). За 13 лет доля РМЖ III стадии среди вновь выявленных заболеваний в относительном выражении сократилась с 30,2 % в 1990 г. до 25,4% в 2003 г., хотя абсолютное число больных раком III стадии выросло за этот период с 9634 до 11760 (4, 5).
Клинико-морфологические факторы прогноза. Фиксация опухоли к грудной стенке, изъязвление опухоли, отёк и краснота кожи молочной железы существенно отягощают прогноз болезни, что позволило Наagensen С. & Stout A.P. (6, 7) отнести эти симптомы к признакам иноперабельности.
По данным ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России самый частый из этих признаков - отек кожи. Наличие отёка кожи у больных без системной терапии сопровождается 5-летней безрецидивной выживаемостью (БРВ), равной 23%, общей выживаемостью (ОВ), равной 30%; 10-летние БРВ и ОВ равны 0%. Судьба больных, не получавших по разным причинам системную адъювантную терапию, свидетельствуют о том, что с появлением отёка и/или гиперемии кожи молочной железы РМЖ становится системной болезнью на 100% и его лечение невозможно без системной терапии (8). Клинические симптомы, относящиеся к критериям T и N по системе TNM, оказываются самыми сильными прогностическими признаками (рис. 1).
Местно-распространённый РМЖ отличается от локализованного не только степенью распространённости опухоли, при этом варианте возрастает частота опухолей с неблагоприятным прогнозом и снижается частота относительно благоприятных прогностических факторов. Так, по данным ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, частота редких морфологических форм рака с относительно доброкачественным течением (слизистый, папиллярный, тубулярный и медуллярный) при раннем РМЖ (T1-2N0M0) составляет 11%, а при местно-распространенном РМЖ - 2%. Анеуплоидные опухоли при раннем РМЖ наблюдались в 62% случаев, а при местно-распространенном РМЖ - в 85%, причём доля анеуплоидных многоклоновых опухолей составила 4% и 17% соответственно (8).
Рис. 1. Весовые коэффициенты (по Шеннону) прогностически значимых признаков у больных, не получавших адъювантной терапии.
Молекулярно-биологические прогностические и предсказательные факторы. Среди огромного количества молекулярно-биологических исследований, относящихся к прогнозированию РМЖ и поиску факторов, предсказывающих чувствительность опухоли к различным способам лечения, необходимо выделить появление молекулярно-генетической классификации РМЖ. К ее достоинствам следует отнести интегральную оценку огромного количества молекулярно-биологических характеристик опухоли как известных ранее, так и новых.
Итак, Perou C.M. и соавт. (9), Sorlie T. и соавт. (10) представили классификацию РМЖ, основанную на вариациях набора экспрессируемых генов и корреляции генетических характеристик опухоли с отдаленными результатами. Исследовались 85 образцов тканей, в том числе 4 образца нормальной ткани молочной железы, 3 фиброаденомы, 2 протоковых рака in situ, 51 образец опухоли от больных местно-распространенным РМЖ. Из 8102 генов выбран набор «существенных» генов (427) - генов с наибольшей вариацией в их экспрессии между различными опухолями. Статистический анализ включал также изучение корреляции между выраженностью экспрессии каждого из генов с длительностью жизни пациента. Такому анализу подверглись 1753 гена.
- 1a. Опухоли подобные базальному эпителию молочной железы. Характеризуются высокой экспрессией кератинов 5 и 17, ламинина, протеина 7, связывающего жирные кислоты;
- 1b. Подгруппа ERBB2+. Опухоли с высокой экспрессией некоторых генов 17q22.24, включая ERBB2 и GRB7;
- 1c. Опухоли, подобные нормальным клеткам молочной железы. Имеют самую выраженную экспрессию многих генов, известных для жировой ткани и клеток других неэпителиальных тканей. Эти опухоли демонстрировали также выраженную экспрессию генов базального эпителия и низкую экспрессию генов люминального эпителия.
- 2a. Люминальный подтип А. Клетки демонстрируют высочайшую экспрессию гена РЭ ? и эстроген-регулируемого LIV-1;
- 2b. Люминальный подтип В. Клетки имеют умеренную или низкую экспрессию генов, специфичных для люминального типа, включая кластер РЭ;
- 2c. Люминальный подтип С. Клетки имеют те же характеристики, что и клетки люминального типа В, отличаются от последних высокой экспрессией генов, координирующая функция которых неизвестна, имеющих сходные черты с генами, экспрессирующимися в опухолях, подобных базальному эпителию, и подтипе ERBB2+.
При анализе корреляции экспрессии генов с выживаемостью оказалось, что из 1753 генов влияние на выживаемость имеют 264 гена. Больные с опухолями, подобными базальному эпителию, и с опухолями подтипа ERBB2+ имеют самую короткую длительность жизни. Люминальный подтип С характеризовался более низкой выживаемостью по сравнению с люминальными типами А и В (9, 10).
При планировании лечения местно-распространенного РМЖ большее значение могут иметь не прогностические факторы, а факторы, предсказывающие эффект того или иного лечения. Примером исследования, оценивающего предсказательные возможности молекулярно-генетической классификации РМЖ, является работа Rouzier R. и соавт. (11). 82 больным РМЖ I-III стадий проводилась предоперационная ХТ паклитакселом, а затем 5-фторурацилом, доксорубицином и циклофосфаном. До начала ХТ производилась биопсия опухоли, определялся профиль экспрессируемых генов и по ним - принадлежность опухоли к молекулярно-генетическому типу. Опухоли базального подтипа и подтипа erbB2+ имели самую высокую частоту полных морфологических регрессий - по 45%; опухоли люминального типа - 6%, опухоли, подобные нормальным клеткам, не имели ни одного случая полных морфологических регрессий. Ни один из 61 гена, ассоциировавшегося с полной морфологической регрессией опухолей базального подтипа, не ассоциировался с таким же эффектом у опухолей подтипа erbB2+, что говорит о разных молекулярных механизмах чувствительности опухолей к ХТ в этих подгруппах.
Вошло в практику суррогатное выделение предложенных подтипов РМЖ, основанное на иммуногистохимическом исследовании РЭ, РП и HER2neu: люминальный тип характеризуется как РЭ+ HER2neu-, HER2neu+ подтип - любые значения РЭ и РП при гиперэкспрессии HER2neu, базальный подтип - РЭ-РП-, HER2neu-. Гиперэкспрессия HER2neu давно рассматривается как фактор неблагоприятного прогноза (12), прогностическое значение базального подтипа РМЖ оценено дополнительно относительно недавно, показано неблагоприятное течение опухолей, имеющих такие характеристики (13).
Ревизия результатов системной терапии в зависимости от принадлежности опухоли к тому или иному подтипу показала предсказательную значимость новой классификации. Люминальный тип РМЖ. Анализ публикаций по неоадъювантной химиотерапии, проведенный Cuffer T. и соавт. (14), показал, что достижение полного морфологического эффекта у больных с РЭ+ опухолями возможно значительно реже (5-8%), чем у больных с РЭ- опухолями (21-23%). Семиглазовым В.Ф. и соавт. представлены результаты неоадъювантной терапии больных гормонально-зависимым местно-распространенным РМЖ: эффективность эндокринной терапии ингибиторами ароматазы не уступала эффективности химиотерапии по схеме АТ (15). В то же время нет оснований утверждать, что химиотерапия не нужна больным с РЭ+ опухолями. При метаанализе рандомизированных исследований было показано, что адъювантная полихимиотерапия примерно в равной степени как при РЭ-, так и при РЭ+ опухолях улучшает безрецидивную и общую выживаемость (16).
HER2neu+ подтип РМЖ. У больных с поражением подмышечных лимфатических узлов адъювантная ХТ, включающая антрациклины (CEF) имела преимущества перед схемой CMF при амплификации HER2neu, причем вероятность рецидива болезни была ниже почти в 2 раза (относительный риск 0.52; р=0.003). У больных с отсутствием амплификации HER2neu результаты лечения были одинаковы (17). Резистентность HER2neu+ подтипа РМЖ к химиотерапии, основанной на применении алкилирующих препаратов, была так же продемонстрирована в публикации Rodenhuis S. с соавт. Это самое крупное рандомизированное исследование по сравнению адъювантной высокодозной химиотерапии с обычной химиотерапией. В исследование были включены 885 больных РМЖ III стадии с поражением 4 и более лимфатических узлов. Контрольная группа больных получала 5 курсов ХТ по схеме FEC, вторая группа больных получала 4 курса по схеме FEC, а затем - курс высокодозной ХТ (циклофосфан 6 г/м², тиофосфамид 480 мг/м² и карбоплатин 1600 мг/м²) и переливание клеток-предшественников гемопоэза. При сравнении групп в целом было отмечено некоторое снижение риска развития рецидива болезни в группе больных, получавших высокодозную ХТ (относительный риск 0,84, р=0,076). Когда была проанализирована экспрессия HER2neu, оказалось, что у больных с гиперэкспрессией имеется тенденция к повышению риска рецидива (относительный риск 1,26, р=0,22) при высокодозной ХТ, а у больных с отсутствием гиперэкспрессии HER2neu высокодозная ХТ имеет выраженные преимущества как по показателю безрецидивной (относительный риск 0,68, р=0,002), так и общей выживаемости (относительный риск 0,72, р=0,02). Причем примерно равное снижение риска болезни наблюдалось как у больных с HER2neu- РЭ-, так и с HER2neu- РЭ+ опухолями (18).
Гиперэкспрессия HER2neu в опухоли обусловливает низкую чувствительность к тамоксифену, но не к ингибиторам ароматазы. В частности, при проведении неоадъювантной эндокринной терапии у больных РМЖ, имевших РЭ+ опухоли и гиперэкспрекспрессию ErbB-1 и/или ErbB-2 эффективность летрозола составила 88% против 21% при применении тамоксифена, р=0,0004 (19).
Особенностью данного подтипа РМЖ является чувствительность к лечению герцептином. Как было показано рядом масштабных рандомизированных исследований, герцептин примерно вдвое снижает вероятность рецидива болезни (20).
Базальный подтип РМЖ, РЭ-РП- HER2neu-. Такая характеристика демонстрирует отсутствие молекулярных «мишеней» в опухолях и, соответственно, - отсутствие возможностей таргетной терапии, необходимость проведения химиотерапии в полном объеме.
Список литературы:
2. Злокачественные новообразования в СССР и союзных республиках «Cтатистический справочник» в 2 частях. Под редакцией Н.Н.Трапезникова, Г.Ф.Церковного, Б.В.Билетова, В.В.Двойрина. Медицина, М, 1989 г.
3. Злокачественные новообразования в России и странах СНГ в 2001 г. Под ред. Давыдова М.И. и Аксель Е.М. ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. М.: Медицинское информационное агентство, 2003.
4. Двойрин В.В.. Статистика рака молочной железы в России. Вестник онкологического научного центра АМН России, 1994, №1, 3-12.
5. Аксель Е.М. Злокачественные образования молочной железы: Состояние онкологической помощи, заболеваемость и смертность. Маммология - 2006, №1, 9-15.
6. Haagensen C., Stout A.P. Carcinoma of the breast. I - Results of treatment. Ann. Surg., 1942, 116, 801 - 815.
7. Haagensen C., Stout A.P. Carcinoma of the breast. II - Criteria of operability. Ann. Surg., 1943, 118, 859-870 & 1032-1051.
8. Портной С.М. Рак молочной железы (факторы прогноза и лечение). Автореф. дис. . д.м.н. М., 1997.
9. Perou C.M., Sorlie T., Eisen M.B., et al. Molecular portraits of human breast tumors. Nature. 2000, 406, 747-752.
10. Sorlie T., Perou C.M., Tibshirani R., et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci U S A. 2001, 98, 10869-10874.
12. Chang J.C., Hilsenbeck S.G. Prognostic and predictive markers. In: Diseases of the breast 3-d edition. Lippincott Williams & Wilkins, 2004. P.675-696.
13. Azambuja E., Castro G.Jr, Durbecq V. et al. The triple negative profile dilemma and its clinical outcome in early breast cancer. 5-th European breast cancer conference. Nice - France 21-25 March 2006. Abstract book. A.293.
14. Cufer T., Pajk B., Borstnar S. Individualized systemic treatment. 5-th European breast cancer conference. Nice - France 21-25 March 2006. Abstract book. Abst. 237.
15. V. Semiglazov, A. Kletsel, V. Semiglazov et al. Primary endocrine therapy vs. chemotherapy in postmenopausal ER-positive breast cancer patients. 5-th European breast cancer conference. Nice - France 21-25 March 2006. Abstract book. Abst. 238.
16. Early Breast Cancer Trialists' Collaborative Group. Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomized trials // Lancet. 2005. Vol. 365. 1987-1717.
17. Pritchard KI, Shepherd LE, O'Malley FP et al. HER2 and responsiveness of breast cancer to adjuvant chemotherapy. N Engl J Med. 2006. 354(20):2103-2111.
20. Baselga J.,Perez E.A., Pienkowski T., Bell R. Adjuvant Trastuzumab: A Milestone in the Treatment of HER-2-Positive Early Breast Cancer. Oncologist. 2006;11(suppl1):4-12.
Copyright © Российское общество клинической онкологии (RUSSCO).
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Как и в предыдущих изданиях есть три компонента, которые описывают анатомическую характеристику опухоли:
- T для оценки первичной опухоли,
- N для поражения лимфатических узлов
- M для метастатазов.
- T-классификация выполняется с использованием КТ,
- N-и M-классификации с использованием КТ и ПЭТ-КТ.
Классификация может быть использована в предоперационной визуализации и клинической классификации iTNM/cTNM, но также применима для окончательной патологической постановки при помощи классификации pTNM, для рестадирования после терапии и рецидивах выбирают классификации yTNM и rTNM.
Ниже представлена классификация TNM.
T - первичная опухоль
Тx - оценка первичной опухоли невозможна, или опухоль верифицирована при обнаружении злокачественных клеток в мокроте или бронхоальвеолярном лаваже, при этом опухоль не определяется на бронхоскопии
Т0 - нет видимости первичной опухоли
Tis - карцинома in situ
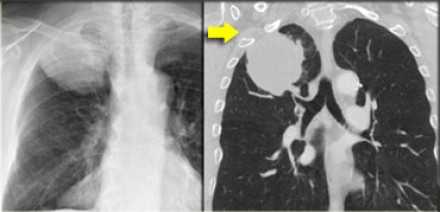
Т1 - опухоль достигает 30 мм в диаметре или меньше в наибольшем измерении, окружена легочной паренхимой или висцеральной плеврой, нет признаков инвазии проксимальнее долевого бронха при бронхоскопии (опухоль не локализуется в главном бронхе)
Т1(mi) минимально инвазивная аденокарцинома
T1а - опухоль 10 мм в диаметре или менее в наибольшем измерении
T1b - опухоль от 10 до 20 мм в диаметре в наибольшем измерении
Т1с - опухоль от 20 до 30 мм в диаметре в наибольшем измерении
Т2 - опухоль от 31 до 50 мм в диаметре в наибольшем измерении, или опухоль в сочетании:
с вовлечением главного бронха, независимо от расстояния до карины, но без её поражения
с поражением висцеральной плевры
с ателектазом или обструктивным пневмонитом, который располагается в прикорневых отделах, вовлекает часть легкого или все легкое
Т2а - опухоль от 31 до 40 мм в диаметре в наибольшем измерении, или размер не может быть определен (например, когда опухоль неотделима от ателектаза)
Т2b - опухоль от 41 до 50 мм в диаметре в наибольшем измерении
Т3 - опухоль от 51 до 70 мм в диаметре в наибольшем измерении, или прямая инвазия в:
грудную стенку (включая париетальную плевру и опухоли верхней борозды)
или определяются метастатические опухолевые узлы или узел в патологически измененной доле
Т4 - опухоль более 70 мм в диаметре в наибольшем измерении, или поражение:
возвратного гортанного нерва
метастатические узелки (узел) в других ипсилатеральных долях
N - вовлечение регионарных лимфатических узлов
Nx - невозможно оценить регионарные лимфатические узлы
N0 - нет метастазов в регионарных лимфатических узлах
N1 - метастазы в ипсилатеральных перибронхиальных и/или ипсилатеральных корневых лимфатических узлах, или метастазы во внутрилегочных лимфатических узлах, включая прямое поражение лимфатических узлов
N1a - поражены лимфатические узлы одного N1 коллектора
N1b - поражены лимфатические узлы нескольких N1 коллекторов
N2 - метастазы в ипсилатеральных медиастинальных и/или субкаринальных лимфатических узлах
N2a1 - поражены лимфатические узлы одного коллектора N2 без вовлечения лимфатических узлов коллектора N1 (скип-метастаз)
N2a2 - поражены лимфатические узлы одного коллектора N2 с вовлечением лимфатических узлов коллектора N1
N2b - множественное вовлечение лимфатических узлов коллектора N2
N3 - метастазы в контрлатеральных медиастинальных, хиларных, любых лестничных или надключичных лимфатических узлов.
M - отдаленные метастазы
М0 - нет отдаленных метастазов
М1 - отдаленные метастазы есть
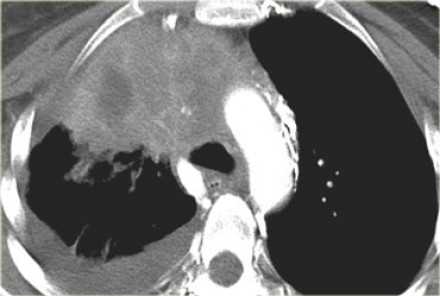
М1а - опухолевые узлы в контрлатеральном легком, опухолевое узелковое поражение плевры, метастатический плевральный или перикардиальный выпот
M1b - одиночный отдаленный опухолевый узел
М1с - множественные внелегочные метастазы в одном или нескольких органах
![]()
Итоговая TNM стадия не-мелкоклеточного рака легкого
Подмножества категорий T, N и M сгруппированы в определенные стадии, так как эти пациенты имеют схожий прогноз [1].
Например, стадия сT1N0 (стадия IA) имеет 5-летнюю выживаемость 77-92%.
С другой стороны рак легкого с любым метастатическим поражением M1c (стадия IVB) имеет 5-летнюю выживаемость равную 0%.
![]()
Лобэктомия нецелесообразна при:
- Трансфиссуральном росте.
- Сосудистой инвазии.
- Инвазии основного бронха.
- Вовлечении верхне-долевого и нижне-долевого бронхов.
Тонко-срезанные изображения с последующими трехплоскостными реконструкциями необходимы, чтобы наилучшим образом продемонстрировать связь опухоли с окружающими структурами.
В случае неопределимой инвазии, в онкологической клинике должен проведен мультидисциплинарный консилиум специалистов для выбора дальнейшей тактики лечения, в зависимости от особенностей данного случая и сопутствующих заболеваний пациента.
T - классификация
- Т0 - нет видимой первичной опухоли на изображении.
- Tis - карцинома in situ.
- Диагностируется ретроспективно после резекции опухоли.
![]()
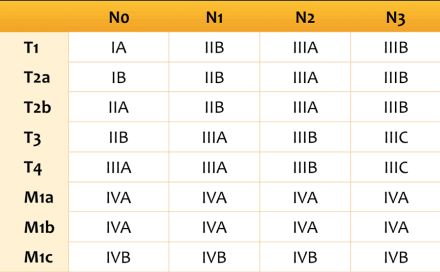
- Т1 - опухоль достигает 30 мм в диаметре или меньше в наибольшем измерении, окружена легочной паренхимой или висцеральной плеврой, нет признаков инвазии проксимальнее долевого бронха при бронхоскопии (опухоль не локализуется в главном бронхе)
- Т1(mi) минимально инвазивная аденокарцинома
- T1а - опухоль 10 мм в диаметре или менее в наибольшем измерении
- T1b - опухоль от 10 до 20 мм в диаметре в наибольшем измерении
- Т1с - опухоль от 20 до 30 мм в диаметре в наибольшем измерении
![]()
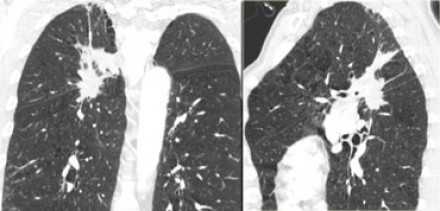
- Т2 - опухоль от 31 до 50 мм в диаметре в наибольшем измерении, или опухоль в сочетании:
- с вовлечением главного бронха, независимо от расстояния до карины, но без её поражения
- с поражением висцеральной плевры
- с ателектазом или обструктивным пневмонитом, который располагается в прикорневых отделах, вовлекает часть легкого или все легкое
- Т2а - опухоль от 31 до 40 мм в диаметре в наибольшем измерении, или размер не может быть определен (например, когда опухоль неотделима от ателектаза)
- Т2b - опухоль от 41 до 50 мм в диаметре в наибольшем измерении
![]()
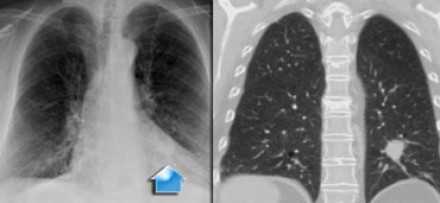
- Т3 - опухоль от 51 до 70 мм в диаметре в наибольшем измерении, или прямая инвазия в:
- грудную стенку (включая париетальную плевру и опухоли верхней борозды)
- диафрагмальный нерв
- париетальный перикард
- или определяются метастатические опухолевые узлы или узел в патологически измененной доле
![]()
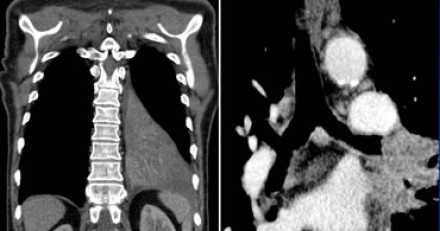
- Т4 - опухоль более 70 мм в диаметре в наибольшем измерении, или поражение:
- диафрагмы
- средостения
- сердца
- крупных сосудов
- трахеи
- возвратного гортанного нерва
- пищевода
- тела позвонка
- бифуркации трахеи
- висцерального перикарда
- метастатические узелки (узел) в других ипсилатеральных долях
![]()
Courtesy of Wouter van Es, MD. St. Antonius Hospital Nieuwegein, The Netherlands
Рак Панкоста
Типичные проявления рака Панкоста следующие:
- боли, обусловленные инвазией в плечеголовное сплетение.
- синдром Горнера
- деструкция костных структур
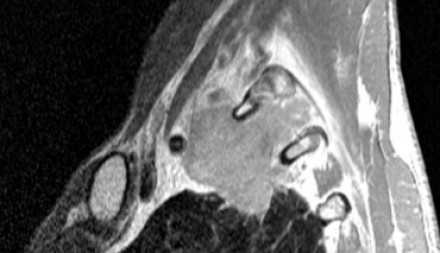
Выполнение МРТ приоритетнее в связи с лучшим мягкотканным контрастом в сравнении с КТ.
На Т1-изображениях представлен пациент с раком Панкоста Т3-стадии в связи с тем, что поражены корешки только Th1, Th2
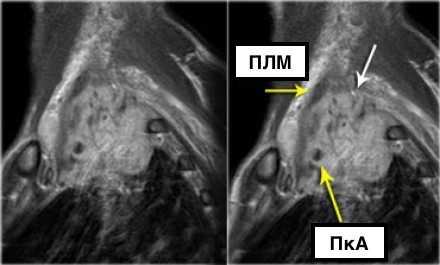
- ПкА = подключичная артерия,
- ПЛМ = передняя лестничная мышца.
(Courtesy of Wouter van Es, MD. St. Antonius Hospital Nieuwegein, The Netherlands)
![]()
На данном постконтрастном Т1-изображении представлена неоперабельная опухоль (T4) Панкоста.
Заметна инвазия в плечевое сплетение (белая стрелка) и инвазия в подключичную артерию (а).
![]()
N-стадирование
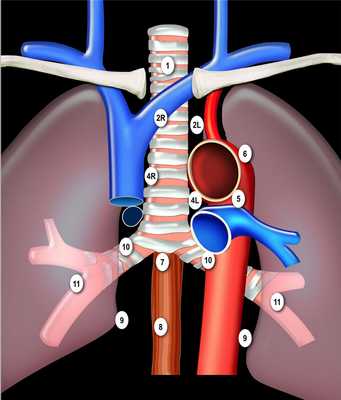
Классификация регионарных лимфатических узлов IASLC 2009 г.
- Надключичные лимфатические узлы 1
- 1 Нижние шейные, надключичные и лимфатические узлы вырезки грудины (левые и правые). Располагаются по обе стороны от срединной линии трахеи в нижней трети шеи и надключичных областях, верхней границей является нижний край перстневидного хряща, нижней - ключицы и яремная вырезка рукоятки грудины.
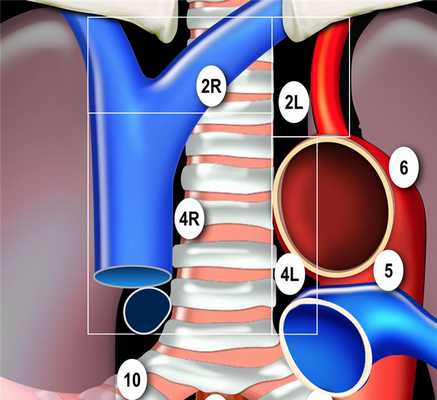
- 2L Левые верхние паратрахеальные располагаются вдоль левой стенки трахеи, от верхнего края рукоятки грудины до верхнего края дуги аорты.
- 2R Правые верхние паратрахеальные располагаются вдоль правой стенки трахеи и спереди от трахеи до ее левой стенки, с уровня верхнего края рукоятки грудины до нижней стенки левой плечеголовной вены в зоне пересечения с трахеей.
- 3А Преваскулярные лимфатические узлы не примыкают к трахее как узлы 2 группы, а располагаются кпереди от сосудов (от задней стенки грудины, до передней стенки верхней полой вены справа и передней стенки левой сонной артерии слева) 3P Превертебральные(Ретротрахеальные) располагаются в заднем средостении, не примыкают к трахее как узлы 2 группы, а локализуются кзади от пищевода.
- 4R Нижние паратрахеальные от пересечения нижнего края плечеголовной вены с трахеей до нижней границы непарной вены, вдоль правой стенки трахеи до ее левой стенки.
- 4L Нижние паратрахеальные от верхнего края дуги аорты до верхнего края левой главной легочной артерии
- Аортальные лимфатические узлы 5-6
- 5. Субаортальные лимфатические узлы располагаются в аортопульмонарном окне, латеральнее артериальной связки, они расположены не между аортой и легочным стволом, а латеральнее них.
- 6. Парааортальные лимфатические узлы лежат спереди и сбоку от восходящей части дуги аорты
- 7. Подкаринальные лимфатические узлы.
- 8. Параэзофагеальные лимфатические узлы. Лимфатические узлы ниже уровня карины.
- 9. Узлы легочной связки. Лежат в пределах легочной связки.
- Все эти группы относятся к N1 лимфатическим узлам. Узлы корня легкого располагаются вдоль главного бронха и сосудов корня легкого. Справа они распространяются от нижнего края непарной вены до области деления на долевые бронхи, слева - от верхнего края легочной артерии.
![]()
Граница между лимфатическими узлами 10 и 4 группы находится на правой нижней границе непарной вены и на левой верхней границе легочной артерии (отличие N1 и N2 стадий).
Достаточно важно разделять лимфатические узлы 1-ой группы и 2/3-ей групп (отличие N3 и N2 стадий).
Нижняя граница лимфатических узлов 1-ой группы с обеих сторон это ключицы, а если оценивать по средней линии, то верхней границей будет рукоятка грудины.Граница между группами лимфатических 4R и 4L является левый латеральный контур трахеи, а не срединная линия.
Паракардиальные, лимфатические узлы молочных желез, диафрагмальные, межреберные и подмышечные лимфатические узлы не входят в карту лимфатических узлов согласно IALSC, несмотря на то, что они редко, но могут вовлекаться в патологический процесс.
При поражении данных нерегиональных узлов предлагается расценивать их поражение, как метастатическое [2].ПЭТ/КТ является методом выбора при определении N-статуса.
Ложноположительные результаты возможно у больных саркоидозом, туберкулезом и другими инфекционными заболеваниями. Из-за высокой отрицательной прогностической ценности ПЭТ-сканирование должно проводиться у всех пациентов до операции.Стадии рака молочной железы - Классификация TNM
Международная классификация TNM рака молочной железы с расшифровкой значений представлена ниже.
Первичная опухоль молочной железы
Обозначение Расшифровка TX Невозможно оценить первичную опухоль T0 Отсутствие признаков первичного злокачественного новообразования Tis Внутриэпителиальный рак (карцинома in situ) Tis (DCIS) Протоковая карцинома in situ Tis (LCIS) Дольковая карцинома in situ Tis (Paget) Болезнь Педжета, НЕ связанная с инвазивной карциномой и/или карциномой in situ (DCIS и/или LCIS) в подлежащей паренхиме молочной железы. Злокачественные новообразования в паренхиме молочной железы, связанные с болезнью Педжета, классифицируются на основе размера и характеристик поражения паренхимы, хотя наличие болезни Педжета, тем не менее, должно отмечаться T1 Наибольший размер опухоли ≤ 20 мм T1mi Наибольший размер опухоли ≤ 1 мм T1a Наибольший размер опухоли > 1 мм, но ≤ 5 мм T1b Наибольший размер опухоли > 5 мм, но ≤ 10 мм T1c Наибольший размер опухоли > 10 мм, но ≤ 20 мм T2 Наибольший размер опухоли > 20 мм, но ≤ 50 мм T3 Наибольший размер опухоли > 50 мм T4 Злокачественное новообразование любого размера с непосредственным распространением на грудную стенку и/или кожу (изъязвление или кожные узелки) T4a Распространение на грудную стенку, за исключением сращения с/поражения только грудной мышцы T4b Изъязвление и/или расположенные на той же стороне тела узелки-спутники и/или отёчность кожи (включая «апельсиновую корку»), не соответствующие критериям воспалительного рака T4c Включает T4a и T4b T4d Воспалительный рак Состояние регионарных лимфатических узлов (N) молочной железы
Обозначение Расшифровка Клиническое исследование NX Состояние регионарных лимфоузлов не поддаётся оценке (например, они были удалены ранее) N0 Метастазы в регионарных лимфоузлах отсутствуют N1 Метастаз(ы) в подвижный подмышечный лимфатический узел (узлы) I, II уровня, расположенный на той же стороне тела N2 Метастазы в расположенных на той же стороне тела подмышечных лимфоузлах I, II уровня, клинически определяющихся как неподвижные или спутанные, или в клинически обнаруживаемых* внутренних маммарных лимфатических узлах, расположенных на той же стороне тела, при отсутствии клинических проявлений метастаза в подмышечном лимфатическом узле N2a Метастазы в расположенных на той же стороне тела подмышечных лимфатических узлах I, II уровня, прикреплённых друг к другу (спутанных) или к другим образованиям N2b Метастазы только в клинически обнаруживаемых* внутренних маммарных лимфатических узлах, расположенных на той же стороне тела, при отсутствии клинических проявлений метастазов в подмышечных лимфатических узлах I, II уровня N3 Метастазы в расположенном на той же стороне тела подключичном лимфатическом узле (узлах) (подмышечных лимфоузлах III уровня), с поражением подмышечных лимфатических узлов I или II уровня или без него, или в клинически обнаруживаемом* внутреннем маммарном лимфатическом узле (узлах), расположенном на той же стороне тела, при наличии клинически обнаруживаемого метастаза в подмышечный лимфатический узел I, II уровня, или метастаз в расположенном на той же стороне тела надключичном лимфатическом узле (узлах), при наличии или отсутствии поражения подмышечного или внутреннего маммарного лимфатического узла N3a Метастаз в расположенном на той же стороне тела подключичном лимфатическом узле (узлах) N3b Метастаз в расположенном на той же стороне тела внутреннем маммарном лимфатическом узле (узлах) и подмышечном лимфатическом узле (узлах) N3c Метастаз в расположенном на той же стороне тела надключичном лимфатическом узле (узлах) *"Клинически обнаруженный" означает выявленный в результате изучения изображений и снимков (за исключением полученных при лимфосцинтиграфии) или в результате клинического исследования, а также имеющий характеристики с высокой подозрительностью на наличие злокачественной опухоли или патологического макрометастаза на основании биопсии тонкой иглой с последующим цитологическим исследованием. Патологическое исследование (pN)* pNX Состояние регионарных лимфоузлов не поддаётся оценке (например, они удалены ранее, или не удалены для проведения патологического исследования) pN0 Метастазы в регионарных лимфатических узлах не определяются гистологически. Примечание: группы изолированных клеток опухоли (ИКО) определяются как мелкие группы клеток ≤ 0,2 мм или отдельные опухолевые клетки, или группы, насчитывающие менее 200 клеток на одном гистологическом срезе; ИКО могут быть обнаружены с использованием стандартных гистологических или иммуногистохимических (ИГХ) методов; лимфоузлы, содержащие только ИКО, исключаются из общего подсчёта поражённых лимфоузлов в целях классификации по критерию N, но должны включаться в общее число оцениваемых лимфоузлов pN0(i-) Метастазы в регионарных лимфатических узлах не определяются гистологически, ИКО отсутствуют pN0(i+) Группы злокачественных клеток в регионарных лимфатических узлах размером ≤0,2 мм (обнаруживаются при помощи окрашивания гематоксилин-эозином [ГЭ] или ИГХ, включая ИКО) pN0(mol-) Метастазы в регионарных лимфатических узлах не определяются гистологически, результаты молекулярных исследований отрицательные (полимеразная цепная реакция с
обратной транскрипцией, [ОТ-ПЦР])pN0(mol+) Положительные результаты молекулярных исследований (ОТ-ПЦР) но метастазы в регионарных лимфатических узлах не обнаруживаются гистологически или при помощи ИГХ pN1 Микрометастазы или метастазы в 1-3 подмышечных лимфатических узлах и/или внутренних маммарных лимфатических узлах; метастазы обнаружены при помощи биопсии «сторожевого» лимфатического узла, но не определяются клинически† pN1mi Микрометастазы (> 0,2 мм и/или > 200 клеток, но не более 2,0 мм) pN1a Метастазы в 1-3 подмышечных лимфатических узлах (как минимум 1 метастаз > 2,0 мм) pN1b Метастазы во внутренних маммарных лимфатических узлах при наличии микрометастазов или макрометастазов, обнаруженных при помощи биопсии «сторожевого» лимфатического узла, но не определяющихся клинически† pN1c Метастазы в 1-3 подмышечных лимфатических узлах и во внутренних маммарных лимфатических узлах при наличии микрометастазов или макрометастазов, обнаруженных при помощи биопсии «сторожевого» лимфатического узла, но не определяющихся клинически† pN2 Метастазы в 4-9 подмышечных лимфатических узлах или в определяющихся клинически‡ внутренних маммарных лимфатических узлах при отсутствии метастазов в подмышечных лимфатических узлах pN2a Метастазы в 4-9 подмышечных лимфатических узлах (как минимум одно скопление опухолевых клеток > 2,0 мм) pN2b Метастазы в определяющихся клинически‡ внутренних маммарных лимфатических узлах при отсутствии метастазов в подмышечных лимфатических узлах pN3 Метастазы в ≥ 10 подмышечных лимфатических узлах или в подключичных лимфатических узлах (подмышечных лимфоузлах III уровня), или в определяющихся клинически‡ внутренних маммарных лимфатических узлах, расположенных на той же стороне тела, при наличии ≥1 положительных подмышечных лимфатических узлов I, II уровня, или в >3 подмышечных лимфатических узлах и во внутренних маммарных лимфатических узлах, при наличии микрометастазов или макрометастазов, обнаруженных при помощи биопсии «сторожевого» лимфатического узла, но не определяющихся клинически†, или в надключичных лимфатических узлах, расположенных на той же стороне тела pN3a Метастазы в ≥ 10 подмышечных лимфатических узлах (как минимум одно скопление опухолевых клеток > 2,0 мм) или метастазы в подключичные лимфатические узлы (подмышечные лимфоузлы III уровня) pN3b Метастазы в определяющихся клинически‡ расположенных на той же стороне тела внутренних маммарных лимфатических узлах при наличии ≥1 положительных подмышечных лимфатических узлов или в > 3 подмышечных лимфатических узлах и во внутренних маммарных лимфатических узлах, при наличии микрометастазов или макрометастазов, обнаруженных при помощи биопсии «сторожевого» лимфатического узла, но не определяющихся клинически† pN3c Метастазы в расположенных с той же стороны тела надключичных лимфатических узлах *Классификация основана на результатах удаления подмышечных лимфоузлов, с или без биопсии сигнальных лимфоузлов. Классификация, основанная исключительно на биопсии сигнального лимфатического узла без последующего удаления подмышечных лимфоузлов обозначается (sn) для «сторожевого узла» - например, pN0(sn). † "Не определяющийся клинически" означает не установлен посредством изучения изображений и снимков (за исключением лимфосцинтиграфии) или посредством клинического обследования.
Отдаленные метастазы (M) при раке молочной железы
Обозначение Расшифровка M0 Клинические или радиографические признаки удалённых метастазов отсутствуют cM0(i+) Клинические или радиографические признаки удалённых метастазов отсутствуют, но имеются скопления опухолевых клеток, обнаруживаемых молекулярными или микроскопическими методами в кровотоке, костном мозге или тканях нерегионарных лимфатических узлов, размером не более 0,2 мм, у пациента без симптомов или признаков метастазов M1 Поддающиеся обнаружению удалённые метастазы, установленные классическими клиническими или радиографическими методами и/или доказанные гистологически, размером > 0,2 мм Гистологическая степень (G) рака молочной железы
Обозначение Расшифровка GX Степень злокачественности не поддаётся оценке G1 Низкая комбинированная гистологическая степень (благоприятная) G2 Средняя комбинированная гистологическая степень (умеренно благоприятная) G3 Высокая комбинированная гистологическая степень (неблагоприятная) Стадии рака молочной железы
Стадия T N M 0 Tis N0 M0 IA T1 N0 M0 IB T0 N1mi M0 T1 N1mi M0 IIA T0 N1 M0 T1 N1 M0 T2 N0 M0 IIB T2 N1 M0 T3 N0 M0 IIIA T0 N2 M0 T1 N2 M0 T2 N2 M0 T3 N1 M0 T3 N2 M0 IIIB T4 N0 M0 T4 N1 M0 T4 N2 M0 IIIC Любое T N3 M0 IV Любое T Любое N M1 Современная диагностика и современные методы лечения рака молочной железы в Израиле позволяют эффективно лечить данное заболевание!
Извините. Эта форма больше не принимает новые данные.
Лечение в клиниках “АССУТА” и “ХАДАССА”
Вас интересует лечение в Израиле?
Крупнейшие профессиональные больницы Израиля - «Ассута» в Тель-Авиве и «Хадасса» в Иерусалиме предлагают реальную возможность получить качественное и специально для вас подобранное лечение у замечательных специалистов по адекватным ценам.
Мы помогаем найти решение ваших проблем со здоровьем, а также предоставляем полную информацию о лучших израильских врачах.
Отделения
Сколько стоит лечение в Израиле?
Цена лечения играет решающую роль в принятии решения о поездке в Израиль.
Каждый медицинский случай уникален, поэтому мы предоставляем нашим пациентам ориентировочные цены на диагностику, реабилитацию и лечение в больницах, а также рассказываем о том, как правильно спланировать поездку и сэкономить деньги во время лечения в Израиле.
Наша главная цель - качественно составленная медицинская программа по доступной цене.
Читайте также:
- МРТ, УЗИ при повреждении лучевой коллатеральной связки
- Производственный травматизм. Несчастный случай на производстве
- Редкие первичные новообразования легких: карциноид, саркома Капоши, гамартома легкого
- Скрининг риска синдрома Дауна. Снижение количества инвазивных диагностических вмешательств
- КТ, МРТ при холестериновой гранулеме среднего уха