Токи через одиночные калиевые (К) - каналы.
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
Ранее было показано, что ионные каналы обладают селективностью или избирательностью, а так же что проводимость мембраны зависит от числа открытых каналов на единицу поверхности.
Многочисленными исследованиями показано, что прохождение тока через отдельный ионный канал не зависит от того, идет ли ток через другие каналы. Например, К + -каналы могут быть открыты или закрыты, а ток через другие типы каналов, например Na + -каналы не меняется. Процесс изменения состояния одних в зависимости от состояния других носит опосредованный характер: изменение проницаемостей каких-либо каналов (например, натриевых) меняет мембранный потенциал, а уже он влияет на проводимости прочих ионных каналов.
Ионные каналы представляют собой представляют собой белковый комплекс, который пронизывающий мембрану. В центре его существует щель, сквозь которую могут проходить ионы. Если использовать радиактивно меченные молекулы избирательного блокатара одного из типов каналов, например блокатора натриевых каналов - тетродотоксина, то можно определить количество канала, приходящихся на 1 мкм 2 площади поверхности мембраны. Так было определено, что на 1 мкм 2 аксона кальмара находится около 500 натриевых каналов.
Измерение трансмембранных токов с помощью микроэлектродной техники в условиях фиксации потенциала на аксоне кальмара длиной 1 см и диаметром 1 мм, то есть площадью 3 • 10 7 мкм 2 , дают возможность оценить суммарный ответ мембраны или иначе говоря проводимости 500 • 3 • 10 7 ~ 10 10 ионных каналов. Измерение суммарных токов и анализ по ним изменения проводимости дает плавное ее изменение во времени (слайд 4) .
Ответ одиночного ионного канала меняется во времени дискретно (слайд 5).
Результаты экспериментов, выполненных на различных ионных каналах, показали, что проводимость ионного канала дискретна и он может находиться в двух состояниях: открытом или закрытом. Переходы между состояниями происходят в случайные моменты времени и подчиняются статистическим закономерностям. Нельзя сказать, что данный ионный канал откроется именно в этот момент времени. Можно лишь сделать утверждение о вероятности открывания канала в определенном интервале времени.
Действительно, если рассмотреть во временном масштабе появление токов через одиночные натриевые каналы, то можно отметить, что деполяризация мембраны на короткий период (каждый раз мембрана деполяризовалась 14 мс), вызывала появление одиночного импульса тока. Амплитуда этого тока была всегда 1,6 пА, а вот время открытия канала и длительность появившихся импульсов варьирует. Отмечено, что максимум вероятности открытия канала достигается через 1,5 мсек, а становится минимальной после 10 мсек, прошедших с момента деполяризации. Необходимо так же отметить, что канал открывается за время деполяризации всего раз.
Время в течение которого канал открыт называют временем открытого состояния канала, а время, в течение которого вероятность открывания отдельного канала велика называют временем жизни каналов.
Так как открытие канала во временном масштабе не является строго определенным, то, по-видимому, деполяризация является причиной повышения вероятности открытия Na канала. Открытие канала в свое время приводит к повышению вероятности его закрытия.
Такой вероятностный механизм функционирования канала аналогичен химическим реакциям и поэтому различают различные состояния канала - «закрытое, но способное к активации», «открытое», «закрытое инактивированное (неспособное к активации)».
«Закрытое, способное к активации» состояние при деполяризации может преобразовываться в «открытое активированное» или «закрытое инактивированное» состояние. Когда канал находится в «открытом активированном» состоянии, стойкая деполяризация способствует переходу в «закрытое инактивированное» состояние. Возвращение канала в «закрытое, способное к активации» состояние может происходить только в результате реполяризации.
Анализируя состояние K + - каналов, нужно отметить, что для них также как для Na + каналов характерно появление токов малой амплитуды до 2 пА. Продолжительность открытого состояния составляет в среднем порядка 5 мсек. Но если Na - каналы остаются открытыми в течение всего времени открытого состояния, то K + - каналы могут за время открытого состояния закрываться на короткое время, то есть они осциллируют. В отличие от натриевых, К + - каналы не инактивируются в течение времени пока мембранный потенциал выше порогового. Большинство K + - каналов во время деполяризации непрерывно открываться и закрываются по несколько раз. Такое поведение одиночных каналов дает при суммации токов идущих через них кривую K + тока, которая нарастает до стационарного уровня. В настоящее время обнаружено по крайней мере пять типов калиевых каналов. Они отличаются соотношением между открыванием и потенциалом, характеристиками инактивации или их открывание может быть опосредованно через вторичные мессенжеры в частности, ионы Са 2+ . Многообразие К + каналов является причиной вариации формы потенциалов действия в клетках различных типов. Кроме того это разнообразие калиевых каналов объясняет различную скорость реполяризации и особенности следовых потенциалов.
2.3.Зависимость параметров канала от мембранного потенциала.
Кроме избирательности или селективности ионные каналы должны обладать способностью менять свою проницаемость при изменении мембранного потенциала. Это явление достаточно хорошо изучено на нервных волокон и их каналах, например натриевый и калиевый каналы аксона кальмара. Это факт проявляется в том, что после начала деполяризации мембраны соответствующие токи начинают изменяться с той или иной кинетикой (слайд 6).
Потенциалозависимость ионного канала означает, что молекула такого канала, по-видимому, несет заряды, которые и смещаются под действием изменившегося мембранного потенциала. То есть можно говорить, что канал имеет в своей конструкции некоторый элемент, чувствительный к действию электрического поля (слайд 7). Так для натриевого канала в качестве такого воспринимающего изменение электрического поля индикатора - сенсора выступают по крайней мере 4 заряда выполняющие роль этого датчика. При изменении мембранного потенциала меняется величина действующей на него силы, в результате эта часть ионного канала перемещается и меняет вероятность открывания или закрывания ворот - своеобразных заслонок, действующих по закону "все или ничего".
Суммарное изменение тока в большой совокупности открытых каналов, каждый из которых переходит в это состояние с определенной вероятностью, а длительность импульса и время его возникновения не детерминированы, в целом носит плавный характер, являющийся проявлением усреднения.
Ионные каналы могут быть чувствительны и к другим физическим воздействиям: механическим деформациям, связыванию химических веществ и т.д. В этом случае они являются структурной основой, соответственно, механорецепторов, хеморецепторов и т.д.
Изучение ионных каналов в мембранах есть одна из важных задач современной биофизики.
Калиевый канал in silico
Новость
изображение одного из бактериальных K+-каналов: Tim Nugent
Автор
Редакторы
Несмотря на то, что за несколько десятилетий существования метода моделирования молекулярной динамики (МД) сущность подхода практически не поменялась, совершенствование алгоритмов и взрывное развитие компьютерных мощностей позволяет достигать все новых рубежей. Американские исследователи провели моделирование МД потенциал-чувствительного калиевого канала, в результате чего удалось в деталях проследить процесс активации / инактивации этого белка, «рассмотрев» подробности, ранее известные лишь гипотетически.
В основе работы возбудимых тканей — а это не только нервы, но и мышцы, и железы, — лежат ионные каналы, встроенные в плазматическую мембрану клетки и способные в ответ на определенные воздействия открываться и, наоборот, закрываться, пропуская определенные ионы или блокируя их проход. Живые клетки всегда имеют трансмембранный (ТМ) электростатический потенциал [1], лежащий в основе массы жизненно-важных процессов — от синтеза АТФ и рецепции до проведения нервного импульса. «За открытия, касающиеся ионных механизмов, участвующих в возбуждении и торможении <. >нервной клетки», британские физиологи Алан Ходжкин и Андре Хаксли получили в 1963 году Нобелевскую премию по физиологии и медицине. Однако молекулярные механизмы открытой ими потенциал-зависимой регуляции проницаемости мембраны для ионов оставались покрытыми мраком до 1980-х, когда появились современные подходы к изучению мембранных белков, а именно — ионных каналов.
Потенциал действия в возбудимой клетке начинается с открывания Na + -каналов, реагирующих на деполяризацию — уменьшение ТМ-потенциала, равного в покоящейся клетке примерно −70 мВ (цитоплазматическая сторона мембраны заряжена отрицательно по отношению к внеклеточной). Возникающий в связи с входящим в клетку «натриевым током» скачок потенциала открывает K + -каналы, и ионы калия устремляются изнутри клетки наружу. Позже нарушенный баланс K + и Na + будет восстановлен за счет действия Na + /K + -насоса, но главное уже произошло — потенциал действия «побежал» по мембране возбудимой клетки.
И Na + -, и K + -каналы здесь — потенциал-чувствительные, то есть они открываются и закрываются, реагируя на электрическое поле, причем в покое (когда потенциал ≈−70 мВ) они закрыты, а открываются они при деполяризации, когда ТМ-напряжение исчезает. Удивительная способность чувствовать такую «не биологическую» характеристику, как разность потенциалов, у всех потенциал-чувствительных каналов (и натриевых, и калиевых, и кальциевых) определяется наличием потенциал-чувствительного домена (ПЧД), четвертый ТМ-сегмент (S4) которого несет большой положительный заряд, а значит, может служить сенсором потенциала. Такие ионные каналы образуются из четырех субъединиц, в каждой из которой есть поровый домен (ПД) и ПЧД, «закрученные» вокруг общей оси, подобно лепесткам диафрагмы .
Подробнее строение потенциал-чувствительного канала мы уже разбирали в статье «О чем не знал Гальвани: пространственная структура натриевого канала» [2]
Структурная биология уже более 15 лет назад расшифровала строение K + -канала: сначала «обычного», потом и потенциал-чувствительного. (На самом деле, у человека более 40 типов разных K + -каналов, так что разнообразие не ограничивается двумя названными типами ;-) Однако особенность приготовления образцов для рентгеноструктурного анализа или спектроскопии ядерного магнитного резонанса (основных методов определения строения биомолекул) такова, что в эксперименте невозможно сохранить ТМ-потенциал, и все структуры каналов из-за этого получаются «открытыми» (то есть, активированными). До сих пор неизвестно строение неактивного (закрытого) канала, а значит и подробности цикла активации / инактивации неизвестны тоже.
Выход из сложившегося положения предлагает группа американских биофизиков во главе с Дэвидом Шоу (David Shaw), заслужившим себе репутацию на мировом финансовом рынке, а потом неожиданно «переквалифицировавшимся» в компьютерную молекулярную биологию и уже потрясшим мир преодолением «миллисекундного барьера» [3] в моделировании молекулярной динамики биомолекул [4].
На этот раз ученые не ставили задачи смоделировать процесс сворачивания белка (фолдинг); вместо этого они решили исследовать работу потенциал-чувствительного K + -канала в ответ на приложение внешней разности потенциалов: как он открывается, закрывается и проводит ионы [5]. Фактически, исследователи используют созданный ими специализированный суперкомпьютер для МД «Anton» в качестве микроскопа: без особенных хитростей запустив МД, наблюдают за тем, что произойдет. Подобную работу ни за что бы не опубликовали в одном из самых известных журналов — Science, — если бы не то обстоятельство, что длительность рассчитанных траекторий (сотни микросекунд) на порядки превосходит то, что можно посчитать на «обычных» суперкомпьютерах для довольно сложной системы, содержащей тетрамерный ионный канал, мембрану, воду и ионы. (Обычно для таких систем больше 1-10 мкс посчитать не удается.) Ну и конечно, рецензентов работы не мог не подкупить тот факт, что полученная в результате моделирования картина в целом согласуется с уже известным механизмом активации / инактивации канала, но показывает его в невиданных ранее подробностях.
В работе было проведено более двух десятков расчетов МД структуры K + -канала («химера Kv2,1/Kv1,2»), помещенной в липидный бислой в ячейке с водой с растворенным в ней KCl (0,5 М). Часть траекторий была получена в «деполяризованном» (V > 0 мВ), а часть — в «гиперполяризованном» (V < 0 мВ) состоянии. В условиях гиперполяризации мембраны канал из первоначально «открытого» состояния переходил в «закрытую» форму, не способную пропускать ионы K + и воду (рис. 1а). Наиболее сильные изменения в структуре канала происходили, как и ожидалось, в области потенциал-чувствительного домена: вольт-сенсорная α-спираль S4, в открытом состоянии «выдвинутая» наружу (во внеклеточную область), при появлении напряжения «ввинчивалась» в ПЧД, что сопровождается переносом заряженных групп (остатков аргинина и лизина) «вниз», с образованием временных солевых мостиков с противоположно заряженными группировками сегментов S1 и S2 ПЧД (рис. 1б). Такой механизм активации / инактивации предполагали и ранее, на основании многочисленных биохимических и биофизических экспериментов. Однако в таких подробностях ранее проследить за процессом не было никакой возможности (видео 1).
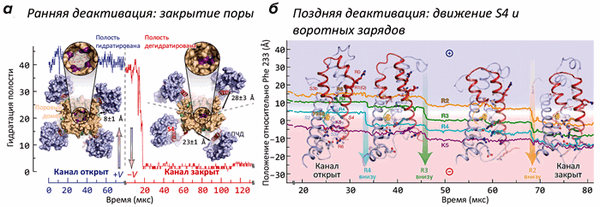
Рисунок 1. Движения потенциал-чувствительного домена (ПЧД) при активации K + -канала. а — Вид модели канала с внутриклеточной стороны в активированном (+V) и покоящемся (−V) состояниях. Канал представляет собой тетрамер: находящийся в центре поровый домен окружен четырьмя ПЧД. Геометрическое закрывание поры (показано на увеличенных врезках) подтверждается кривой гидратации, показывающей количество молекул воды, находящихся в «вестибюле» канала. При «включении» потенциала (через ≈20 мкс) растворитель и ионы K + покидают канал, и пора «захлопывается» под действием гидрофобного коллапса. Интересно, что в открытом канале ПЧД «прижаты» к поре, в то время как в закрытом — расположены более свободно. б — Постепенное «вдвигание» вольт-сенсора S4 и находящихся в нем «воротных зарядов» в ПЧД при «включении» потенциала (т.е., в процессе закрывания канала). В частности, в процессе инактивации заряд R2 переносится на 15 Å «вниз», что в общих чертах описывает основную структурную перестройку, сопровождающую инактивацию канала. Попутно с «нырянием» в ПЧД, сегмент S4 совершает поворот на ≈120°.
Видео 1. Визуализация инактивации K + -канала при реполяризации мембраны. Канал показан «сбоку», мембрана и две субъединицы из четырех для ясности скрыты. В начале траектории можно видеть проникающие через пору ионы K + и показанную синей поверхностью гидратированную полость канала; при закрывании канала эти события пропадают.
В моделировании был показан гипотетический до того переход из состояния канала, когда все вольт-сенсоры S4 уже выдвинуты деполяризацией (снятием напряжения) «вверх», но сама пора пока еще остается закрытой, в «полностью открытое» состояние. Показана и роль «линкера», соединяющего конец S4 с двумя ТМ-спиралями S5 и S6, образующими пору: этот линкер передает механическое движение переноса S4 вверх / вниз, что приводит к открыванию и закрыванию поры. На основе проделанного моделирования исследователи предложили схему функционирования потенциал-чувствительного K + -канала (рис. 2).
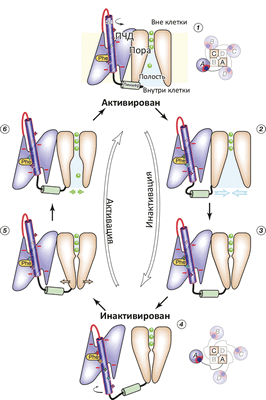
Рисунок 2. Схема работы потенциал-чувствительного K + -канала. (1) Реполяризация (восстановление ТМ-потенциала покоя −70 мВ) приводит к «вдвиганию» вольт-сенсора S4 в ПЧД, что приводит к (2) дегидратации полости канала и «гидрофобному коллапсу» (закрытию поры) (3). При окончании «вдвигания» S4 (4) линкер S4—S5 становится максимально длинным, что позволяет ПЧД «отсоединиться» от поры. При деполяризации (5) (например, при входящем Na + -токе) α-спираль S4 опять выдвигается, ПЧД плотно присоединяется к поре, которая вследствие этого открывается (6). Цикл замкнулся.
Отдельный акцент сделан на практическом применении таких «тяжелых» расчетов: кроме использования компьютера в качестве микроскопа, можно исследовать механизм возникновения так называемых каналопатий — таких заболеваний как аритмия, мигрени, параличи, болевые синдромы, которые связаны с нарушением работы ионных каналов. В частности, мутации в ПЧД (тех самых положительно заряженных остатков аргинина / лизина в S4) приводят к тому, что ПЧД начинает «подтекать» и пропускать через себя так называемые Ω-токи. В ряде дополнительных расчетов исследователи обнаружили и этот феномен, продемонстрировав механизм «протечки».
С одной стороны, Шоу и коллеги не открыли ничего особо нового — схема работы канала, предложенная на рис. 2, в общих чертах была известна и ранее. Однако, пожалуй, самое важное, что следует из их работы, — это то, что увеличение длительности расчетов МД позволяет узнать о биологических системах что-то новое, что само по себе отнюдь не очевидно (такие сложные конформационные явления могли и не произойти вовсе, несмотря на «игру» с потенциалом). Так что истинная причина, по которой чисто «расчетную» работу опубликовали в Science, заключается в том, что возможности методов молекулярного моделирования, часто подвергающиеся (вполне справедливой) критике, все же больше, чем полагали скептики.
Калиевые каналы клеток проводящей системы сердца и рабочего миокарда: структурно-функциональные особенности, патофизиологическое и клиническое значение
Важнейшую роль в процессах реполяризации сердца играют калиевые каналы, генерирующие различные токи. Замедление реполяризации посредством блокирования калиевых каналов приводит к увеличению продолжительности рефрактерных периодов возбудимых тканей сердца и является основным механизмом действия антиаритмических препаратов III класса. При этом излишнее неравномерное замедление реполяризации может способствовать электрической неоднородности тканей и развитию опасных для жизни аритмий (полиморфной желудочковой тахикардии типа torsade de pointes). В обзоре представлены сведения о структуре, функции и свойствах калиевых каналов клеток проводящей системы сердца и сократительного миокарда. Освещены их физиологическая роль и участие в патологических процессах, в том числе при врожденных синдромах, связанных с возникновением опасных для жизни аритмий. Представлены дальнейшие перспективы развития данного направления.
Ритмичную работу сердца обеспечивает взаимосвязь последовательных процессов сокращения и расслабления, которые напрямую сопряжены с генерацией и распространением возбуждения и последующей рефрактерностью возбудимых тканей. Распространение потенциала действия (ПД) по проводящей системе и сократительному миокарду вызывает последовательное сокращение всех отделов сердца [1].
ПД имеет фазы — деполяризации и реполяризации. В фазу деполяризации мембранный потенциал достигает максимального значения, а во время фаз реполяризации происходит его постепенный возврат к уровню потенциала покоя. Именно в это время реализуется электромеханическое сопряжение, необходимое для сокращения миокарда, вот почему совокупная длительность фаз реполяризации должна быть достаточно продолжительной.
Важнейшую роль в процессах реполяризации и поддержании потенциала покоя на постоянном уровне играют токи ионов калия. Удлинение реполяризации увеличивает рефрактерность возбудимой ткани. На этом основано антиаритмическое действие препаратов III класса (блокаторов калиевых каналов). В то же время неравномерное замедление реполяризации может способствовать электрической неоднородности тканей и развитию опасных для жизни аритмий (полиморфной желудочковой тахикардии типа torsade de pointes — TdP) [2, 3].
В зависимости от способа активации и количества трансмембранных доменов, калиевые каналы подразделяют следующим образом:
- потенциалзависимые калиевые каналы (voltage gated — Kv);
- калиевые каналы аномального входящего выпрямления (inward rectifier Kir);
- механочувствительные двупоровые калиевые каналы (2 pore domain — K2P);
- активируемые кальцием калиевые каналы (calcium-activated — KCa; в данном обзоре не рассмотрены, поскольку функционально-активные KCa не представлены на поверхности кардиомиоцитов человека и не участвуют в процессах деполяризации и реполяризации) [4].
Потенциалзависимые калиевые каналы (Kv)
Kv — самое многочисленное семейство калиевых каналов. Все Kv состоят из четырех α-субъединиц. Тетрамеры могут быть образованы четырьмя одинаковыми α-субъединицами (гомотетрамеры) или состоять из четырех разных α-субъединиц (гетеротетрамеры). На работу тетрамеров α-субъединиц существенное влияние могут оказывать вспомогательные β-, γи D-субъединицы, расположенные в цитоплазме клеток и изменяющие кинетику канала. Некоторые белки способны повышать экспрессию калиевых каналов на мембранах и изменять функции их α-субъединиц. Точное определение канала, обеспечивающего тот или иной ионный ток в кардиомиоцитах, всегда крайне затруднено [5].
В зависимости от своих временны'х параметров и вольтажных характеристик Kv могут быть разделены на 2 большие группы.
- Каналы, генерирующие кратковременный выходящий ток (transient outward — Ito), регистрируемый в самом начале реполяризации.
- Каналы, генерирующие токи замедленного выпрямления (IK).
В зависимости от времени нарастания и продолжительности выделяют очень быстрые (ultra rapid — IKur), быстрые (rapid — IKr) и медленные (slow — IKs) токи замедленного выпрямления. Калиевые токи замедленного выпрямления присутствуют в течение всех фаз реполяризации, наибольший их вклад приходится на более поздние ее этапы [6].
Калиевые каналы, генерирующие кратковременный выходящий ток (Ito). Ito регистрируется в самом начале реполяризации (фаза 1 ПД) в течение непродолжительного времени. Он оказывает существенное влияние на ток ионов кальция (ICa,L) и, соответственно, на электромеханическое сопряжение и сократимость миокарда, а также на калиевые токи замедленного выпрямления. В результате сложных взаимодействий между ионными токами изменения Ito могут непредсказуемо влиять на продолжительность ПД и определять предрасположенность к возникновению аритмий [7].
При детальном исследовании биофизических характеристик тока Ito было отмечено, что он состоит из двух компонентов, различающихся по скорости восстановления соответствующих им ионных каналов, — быстрого (fast — Ito,f) и медленного (slow — Ito,s). Эти токи тканеспецифичны. Ito,f в миокарде желудочков обнаруживают преимущественно в субэпикардиальных отделах, он соответствует фазе начальной быстрой реполяризации и определяет характерную форму кривой ПД (спайк и плато — spike and dome). В правом желудочке ток Ito,f выражен сильнее, чем в левом [8].
Каналы, генерирующие ток Ito, являются гомотетрамерами. В сердце человека в образовании каналов Ito,s участвуют α-субъединицы Kv1.4, а каналы Ito,f формируют α-субъединицы Kv4.2 и Kv4.3 [9].
Экспрессию каналов Ito и их активность регулируют добавочные субъединицы, к которым относят β-субъединицы, KChIP (Kv channel interacting proteins — белок, взаимодействующий с потенциалзависимыми калиевыми каналами), фриквенин (frequenin), KChAP (Kv channel associated protein — белок, связанный с потенциалзависимыми калиевыми каналами), а также вспомогательные субъединицы MinK (Minimum K+) и MiRP (MinK related peptides — пептиды, подобные MinK) [10].
Применение никорандила -активатора калиевых каналов -в лечении больных с ишемической болезнью сердца
Ишемическая болезнь сердца (ИБС) продолжает оставаться основной причиной смертности в странах Европы, Северной Америки и в России. Несмотря на достигнутые в последние годы успехи в ее лечении, качество жизни больных с ИБС по-прежнему остается невысоким, главным образом из-за возникновения приступов стенокардии. Медикаментозное лечение ИБС остается основным в терапии больных со стенокардией.
Большой вклад в снижение смертности от ИБС внесли лекарственные препараты с доказанным действием (статины, b-блокаторы, ингибиторы ангиотензинпревращающего фермента), снижение основных факторов риска (холестерин, курение, артериальная гипертония, гиподинамия, сахарный диабет) и процедуры реваскуляризации миокарда.
К антиангинальным препаратам, назначаемым больным с ИБС, относятся: b-адреноблокаторы (БАБ), антагонисты кальция (АК), нитраты и нитратоподобные (молсидомин), селективные ингибиторы If-ионных каналов синоатриального узла (ивабрадин) и активаторы калиевых каналов - никорандил.
Интерес к никорандилу в последнее время увеличился в связи с опубликованием новых клинических исследований его успешного применения при ИБС и с регистрацией в 2009 г. отечественного воспроизведенного (генерика) никорандила - Коронеля (ООО «ПИК-ФАРМА»).
Никорандил состоит из нитратной группы и остатка амида никотиновой кислоты, поэтому обладает свойствами органических нитратов и активаторов калиевых каналов и сбалансированно снижает пред- и постнагрузку на миокард (см. рисунок).
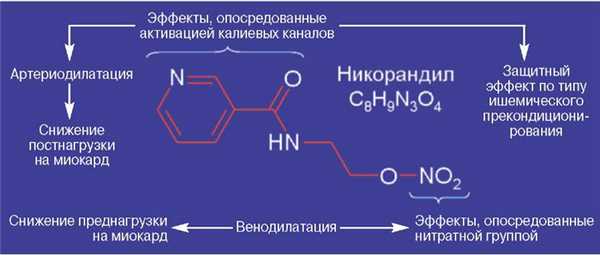
Рисунок. Фармакологический профиль никорандила.
Феномен ишемического прекондиционирования
Представление о прекондиционировании в клиническую кардиологию пришло из экспериментальных лабораторий, изучавших состояние сердца в период после ишемии. После быстрой и кратковременной ишемии у экспериментальных животных последующее ишемическое воздействие и реперфузия вызывали меньшую степень поражения миокарда, чем без начального эпизода ишемии (О.И.Писаренко, 2005; C.Murry и соавт., 1986; R.Kloner и соавт., 2006).
Открывая АТФ-зависимые калиевые каналы, никорандил воспроизводит эффект ишемического прекондиционирования (адаптации к прерывистой ишемии), подготавливает миокард к ишемии: содействует энергообеспечению сердечной мышцы, предотвращает необратимые клеточные изменения в ней. Фармакологическое прекондиционирование подразумевает повышение «выживаемости» миокарда под влиянием фармакологической активации АТФ-зависимых калиевых каналов, вызывающей благоприятное антиишемическое состояние миокарда.
Возможности клинического применения феномена ишемического прекондиционирования суммированы в статье R.Kloner, 2009: у больных со стабильной стенокардией; для снижения повреждения миокарда при чрескожных коронарных вмешательствах (ЧКВ); для защиты миокарда во время аортокоронарного шунтирования (АКШ); для защиты сосудов при хирургических операциях и процедурах; при нестабильной стенокардии; для защиты других органов (мозг, почки) при эпизодах ишемии.
Лечение стабильной стенокардии
В лечении стабильной стенокардии в последнее время используются препараты - активаторы калиевых каналов. Никорандил - открыватель (активатор) АТФ-зависимых калиевых каналов, обладает выраженным антиангинальным и вазодилатационным эффектом (нитратоподобное венодилатирующее действие), что позволяет применять его в клинике для коррекции нарушений ишемизированного миокарда (E.Roland, 1993; Dana А.и соавт., 1999). Препарат оказывает кардиопротективное действие по типу ишемического прекондиционирования. Он снижает тромбообразование в коронарных сосудах, открывает АТФ-зависимые калиевые каналы, полностью воспроизводя защитный эффект ишемического прекондиционирования, подготавливает сердце к ишемии: содействует энергосбережению сердечной мышцы, предотвращает необратимые клеточные изменения в ней.
Препарат может использоваться для купирования приступов стабильной стенокардии (сублингвально по 20 мг). Для профилактики стенокардии никорандил обычно назначают в дозе 20 мг 2 раза в сутки. Перекрестная толерантность с нитратами отсутствует.
Никорандил практически не оказывает действия на частоту сердечных сокращений (ЧСС), систему проводимости и сократительную способность миокарда, не влияет на липидный обмен и метаболизм глюкозы. Полагают, что помимо антиангинальных свойств никорандил обладает кардиопротективной активностью.
Активаторы калиевых каналов включены Европейским обществом кардиологов в алгоритм медикаментозной терапии стабильной стенокардии (2006 г.).
Показания к применению Коронеля:
1) профилактика приступов стабильной стенокардии (в комбинации с другими антиангинальными средствами), а также в качестве монотерапии в случаях противопоказаний или непереносимости БАБ или АК;
2) купирование приступов стенокардии.
Противопоказания:
1) острый инфаркт миокарда - ИМ (и период до 3 мес после ИМ);
2) кардиогенный шок;
3) коллапс;
4) нестабильная стенокардия;
5) хроническая сердечная недостаточность (ХСН) III или IV функционального класса (ФК) по NYHA;
6) левожелудочковая недостаточность с низким давлением наполнения;
7) выраженная брадикардия (ЧСС 8) атриовентрикулярная блокада 2 и 3-й степени;
9) артериальная гипотония (систолическое артериальное давление -АД 10) одновременный прием ингибиторов фосфодиэстеразы (силденафил и др.).
В последнее время показания к применению никорандила расширены, он применяется при нестабильной стенокардии, рефрактерной и ангиоспастической стенокардии, у больных с ИМ, до и после ЧКВ.
В ряде работ были проведены сравнения никорандила с другими антиангинальными препаратами при стабильной стенокардии.
Исследования
Метаанализ базы данных из MEDLINE 20 проспективных контролируемых исследований, в которых средняя продолжительность лечения составляла 5 нед, показал, что:
1) не было значимого различия в снижении эпизодов стенокардии в неделю по сравнению с БАБ, АК, нитратами;
2) не было значимых различий между препаратами и в показателях нагрузочных проб (общая продолжительность нагрузки, время до появления ишемического снижения сегмента ST> 1 мм, время до появления боли);
3) ЧСС и АД больше снижались на АК, но не изменялись на никорандиле;
4) частота побочных эффектов между препаратами достоверно не отличалась.
Таким образом, при коротком периоде лечения никорандил так же эффективен, как и лечение стандартными антиангинальными препаратами; он может использоваться как препарат 1-й линии у больных со стабильной стенокардией при непереносимости БАБ или АК (Y.Hanai и соавт., 2010). Анализ двух пилотных исследований по оценке антиангинального и антиишемического действия никорандила в сравнении с изосорбидом мононитратом и изосорбидом динитратом выявил приблизительно равную эффективность указанных лекарственных препаратов и дозозависимый терапевтический эффект (G.Doring, 1992). В многоцентровом рандомизированном двойном слепом контролируемом исследовании была проведена оценка влияния никорандила на толерантность к физической нагрузке у больных со стабильной стенокардией в сравнении с изосорбида мононитратом (W.Zhu и соавт., 2007). 232 больных китайской национальности со стабильной стенокардией были распределены на 2 группы и получали никорандил по 15 мг/сут и изосорбида мононитрат по 40 мг/сут соответственно. Длительность наблюдения составила 4 нед, включая 2-недельный период «отмывки». Пробы с дозированной физической нагрузкой проводили на тредмиле по протоколу Брюса до начала и через 2 нед приема исследуемых препаратов. Полученные в 2 группах результаты достоверно (р<0,001) показали: увеличение времени до появления депрессии SТ=1 мм, снижение максимальной глубины депрессии SТ-сегмента, увеличение времени до наступления стенокардии и увеличение общего времени нагрузки. Для группы никорандила по отношению к группе изосорбида мононитрата достоверно доказано увеличение на 20,3% доли больных, у которых снизилось количество приступов стенокардии более чем на 50% (0=0,048).
При сравнении антиангинального и антиишемического эффектов никорандила и амлодипина (Swan Study Group, 1999) достоверных различий не получено.
В Первом МГМУ им. И.М.Сеченова изучали клиническую эффективность отечественного препарата Коронель (никорандил) у 50 больных (средний возраст 52 года) со стабильной стенокардией III-IV ФК. На фоне стандартного лечения
1- я группа принимала Коронель в дозе 20 мг 2 раза в день,
2- я принимала амлодипин в дозе 10 мг 1 раз в день. Через 1 мес лечения в 1-й группе на 45% уменьшилась частота и интенсивность приступов стенокардии, на 24% увеличилась толерантность к физическим нагрузкам по данным велоэргометрии и на 47% уменьшилась степень депрессии сегмента ST на сопоставимых нагрузках. Через 3 мес лечения по данным холтеровского мониторирования электрокардиограммы (ЭКГ) на 27% уменьшилась частота эпизодов ишемии миокарда. Результаты свидетельствуют о хорошей антиангинальной и антиишемической активности Коронеля у больных с тяжелой, рефрактерной стенокардией напряжения. Препарат хорошо переносился и не вызывал серьезных побочных явлений. Из нежелательных реакций отмечались головная боль (13,3%), тошнота (2%). Авторы отметили сопоставимую антиангинальную и антиишемическую эффективность Коронеля и амлодипина (Н.В.Юргель и соавт., 2010).
При сочетанном применении никорандила с другими антиангинальными средствами:
1) с БАБ, АК, нитратами, сиднониминами (молсидомин) - отмечается усиление антиангинального и гипотензивного действия, улучшение кровоснабжения миокарда;
2) с ингибитором If-ионных каналов синоатриального узла ивабрадином - отмечается усиление антиангинального действия за счет более выраженного снижения работы сердца и потребности миокарда в кислороде, улучшение кровоснабжения миокарда;
3) с триметазидином МВ - отмечается усиление кардиопротективного действия, так как происходит коррекция большинства адаптивнодезадаптивных изменений метаболизма и сократительного состояния кардиомиоцитов при так называемых «новых ишемических синдромах» (никорандил подготавливает миокард к ишемии по типу эффекта прекондиционирования, триметазидин выводит миокард из состояния гибернации).
В исследовании J.Kim и соавт., 2005, больным с нестабильной стенокардией за 12-48 ч до ЧКВ внутривенно вводили нитросорбида динитрат или никорандил. Сравнивали эффект в 2 группах (54 и 42 человека) до и через 6, 12 и 24 ч после ЧКВ. Измеряли МВ-фракцию креатинфосфокиназы и уровень сердечных тропонинов (отмечено повышение тропонина Т или тропонина I в 1-й группе по сравнению со 2-й, р1 против р2 - 0,01). Оценивали также прогноз больных через 6 мес после ЧКВ: обнаружено повышение фракции выброса по данным эхокардиографии (р1 против р2 - 0,03). Авторы оценивали также появление серьезных нежелательных сердечных событий - МАСЕ (17 и 12%, различие недостоверно). Сделан вывод: никорандил обладает протективным эффектом при ЧКВ у больных с нестабильной стенокардией.
Достоверное улучшение прогноза на фоне терапии никорандилом в различных подгруппах пациентов со стабильной стенокардией было продемонстрировано в исследовании IONA - Impact Of Nikorandil in Angina (Lancet 2002; H Dargie., 2004).
Никорандил в сочетании с любыми антиангинальными средствами улучшает прогноз у больных с ИБС. После исследования IONA никорандил вошел во все международные рекомендации.
Однако по завершении исследования IONA оставались открытыми следующие вопросы:
1) около 50% больных получали терапию БАБ;
2) «неплановая госпитализация из-за болей в грудной клетке» является слабой конечной точкой, несмотря на наличие рандомизации в этом исследовании;
3) неясно, эффективен ли никорандил у коронарных больных высокого риска (например, с острым ИМ или нестабильной стенокардией);
4) наблюдалось ли возможное снижение положительного действия никорандила у пациентов с коронарной болезнью сердца, одновременно принимающих противодиабетические препараты - блокаторы К-АТФ-каналов (глибенкламид);
5) какова оптимальная дозировка никорандила для лечения больных с коронарной болезнью сердца (В.И.Метелица, 2005).
В исследовании IONA было показано, что никорандил не влияет на показатели липидного обмена. Препарат не влияет на метаболизм глюкозы и не ухудшает углеводный обмен.
Блокатор калиевых каналов глибенкламид (производное сульфонилмочевины) - известный гипогликемический препарат для приема внутрь, оказывает коронаросуживающее действие, приводящее к метаболическим и ЭКГ-изменениям, характерным для ишемии миокарда. Никорандил обладает, напротив, вазодилатирующими свойствами благодаря открытию калиевых каналов в мембранах гладкомышечных клеток. В результате такой активации ионы калия выходят из клетки и наступает гиперполяризация, которая препятствует поступлению ионов кальция через потенциалзависимые кальциевые каналы. Гиперполяризация увеличивает период времени, необходимый для достижения порога генерации потенциала действия, что вызывает уменьшение частоты сокращений гладкомышечных клеток и снижение их тонуса (В.ПЛупанов, А.В.Максименко, 2011).
Таким образом, в этом исследовании лечение никорандилом снижало число смертей от всех причин, поэтому оно рекомендуется большинству больных с ИБС.
Наблюдавшееся снижение сердечнососудистой смерти у получавших никорандил пациентов с коронарной болезнью сердца следует расценивать как существенное с учетом относительно короткого периода наблюдения. Эти результаты имеют важное значение для выбора тактики лечения в данной группе больных (рабочая группа исследования JCAD, 2011). Степень снижения частоты смерти любой этиологии на фоне терапии никорандилом не зависела от одновременного приема препаратов сульфонилмочевины.
У больных с ИБС со стабильной стенокардией напряжения ФК Коронель в дозе 20 мг 3 раза в сутки, открывая АТФ-зависимые калиевые каналы, значимо воспроизводит защитный эффект ишемического прекондиционирования. В результате лечения уменьшается количество приступов стенокардии, снижается выраженность ангинозных болей, повышается толерантность к физической нагрузке, улучшается качество жизни пациентов (Ж.М.Сизова, 2009). Антиангинальный и антиишемический эффект Коронеля можно объяснить наличием активной, мобильной нитратной группы и остатка амида никотиновой кислоты, которые определяют два механизма спазмолитического эффекта на основании объединения свойств органических нитратов и модуляторов калиевых каналов. Первый механизм обусловлен активацией гуанилатциклазы, что приводит к внутриклеточному накоплению гуанидилмонофосфата и как следствие - к увеличению продукции эндотелийзависимого фактора релаксации; второй - связан с открытием калиевых каналов, усилением проводимости ионов калия, что приводит к гиперполяризации мембран и, соответственно, к расслаблению гладких мышц сосудов. Следствием этого являются периферическая вазодилатация, коронарорасширяющее действие и снижение АД (Г.И.Сидоренко, 2003, 2010; N.Taira, 1989).
К побочным эффектам никорандила относятся: головная боль, головокружение, сердцебиения, артериальная гипотония, желудочнокишечные расстройства, редко - ульцирация желудочно-кишечного тракта, кожные изменения, аллергические реакции.
Клинические эффекты никорандила:
• положительно влияет на исходы у больных ИБС (улучшает прогноз);
• оказывает антиангинальное и антиишемическое действие;
• прием (под язык) купирует приступ стенокардии;
• может заменять нитраты при развитии толерантности к ним (отсутствует перекрестная толерантность);
• может назначаться больным стенокардией при планировании ЧКВ, АКШ, (подготавливает сердце к ишемии - эффект прекондиционирования);
• положительно влияет на мозговое кровообращение у больных с ишемическим инсультом;
• не вызывает привыкания при длительном применении;
• отсутствует синдром отмены (безопасен пропуск приёма препарата);
• практически не изменяет ЧСС и силу сердечных сокращений;
• снижает АД менее чем на 10 % (в суточной дозе 20-40 мг);
• может назначаться больным с сахарным диабетом (не влияет на показатели углеводного обмена);
• не влияет на показатели липидного обмена;
• длительное применение стабилизирует коронарную бляшку у больных стабильной стенокардией (Y.Izumiya и соавт., 2011).
В настоящее время появилась возможность дальнейшего изучения и оценки первого отечественного генерика никорандила - Коронеля, подтвердившего заявленную клиническую эффективность и производящегося в России в соответствии со стандартом GMP.
Строение и функции мембраны, ионные каналы и их функции, ионные градиенты
Согласно современным представлениям, биологические мембраны образуют наружную оболочку всех животных клеток и формируют многочисленные внутриклеточные органеллы. Наиболее характерным структурным признаком является то, что мембраны всегда образуют замкнутые пространства, и такая микроструктурная организация мембран позволяет им выполнять важнейшие функции.
Строение и функции клеточных мембран.
1. Барьерная функция выражается в том, что мембрана при помощи соответствующих механизмов участвует в создании концентрационных градиентов, препятствуя свободной диффузии. При этом мембрана принимает участие в механизмах электрогенеза. К ним относятся механизмы создания потенциала покоя, генерация потенциала действия, механизмы распространения биоэлектрических импульсов по однородной и неоднородной возбудимым структурам.
2. Регуляторная функция клеточной мембраны заключается в тонкой регуляции внутриклеточного содержимого и внутриклеточных реакций за счет рецепции внеклеточных биологически активных веществ, что приводит к изменению активности ферментных систем мембраны и запуску механизмов вторичных «месенджеров» («посредников»).
3. Преобразование внешних стимулов неэлектрической природы в электрические сигналы (в рецепторах).
4. Высвобождение нейромедиаторов в синаптических окончаниях.
Современными методами электронной микроскопии была определена толщина клеточных мембран (6—12 нм). Химический анализ показал, что мембраны в основном состоят из липидов и белков, количество которых неодинаково у разных типов клеток. Сложность изучения молекулярных механизмов функционирования клеточных мембран обусловлена тем, что при выделении и очистке клеточных мембран нарушается их нормальное функционирование. В настоящее время можно говорить о нескольких видах моделей клеточной мембраны, среди которых наибольшее распространение получила жидкостно-мозаичная модель.
Согласно этой модели, мембрана представлена бислоем фосфолипидных молекул, ориентированных таким образом, что гидрофобные концы молекул находятся внутри бислоя, а гидрофильные направлены в водную фазу. Такая структура идеально подходит для образования раздела двух фаз: вне- и внутриклеточной.
В фосфолипидном бислое интегрированы глобулярные белки, полярные участки которых образуют гидрофильную поверхность в водной фазе. Эти интегрированные белки выполняют различные функции, в том числе рецепторную, ферментативную, образуют ионные каналы, являются мембранными насосами и переносчиками ионов и молекул.
Некоторые белковые молекулы свободно диффундируют в плоскости липидного слоя; в обычном состоянии части белковых молекул, выходящие по разные стороны клеточной мембраны, не изменяют своего положения.
Электрические характеристики мембран:
Емкостные свойства в основном определяются фосфолипидным бислоем, который непроницаем для гидратированных ионов и в то же время достаточно тонок (около 5 нм), чтобы обеспечивать эффективное разделение и накопление зарядов и электростатическое взаимодействие катионов и анионов. Кроме того, емкостные свойства клеточных мембран являются одной из причин, определяющих временные характеристики электрических процессов, протекающихщих на клеточных мембранах.
Проводимость (g) — величина, обратная электрическому сопротивлению и равная отношению величины общего трансмембранного тока для данного иона к величине, обусловившей его трансмембранной разности потенциалов.
Через фосфолипидный бислой могут диффундировать различные вещества, причем степень проницаемости (Р), т. е. способность клеточной мембраны пропускать эти вещества, зависит от разности концентраций диффундирующего вещества по обе стороны мембраны, его растворимости в липидах и свойств клеточной мембраны.
Проводимость мембраны является мерой ее ионной проницаемости. Увеличение проводимости свидетельствует об увеличении количества ионов, проходящих через мембрану.
Строение и функции ионных каналов. Ионы Na+, K+, Са2+, Сl- проникают внутрь клетки и выходят наружу через специальные, заполненные жидкостью каналы. Размер каналов довольно мал.
Все ионные каналы подразделяются на следующие группы:
a) Селективные, т.е. специфические. Эти каналы проницаемы для строго определенных ионов.
b) Малоселективные, неспецифические, не имеющие определенной ионной избирательности. Их в мембране небольшое количество.
a) быстроинактивирующиеся, т.е. быстро переходящие в закрытое состояние. Они обеспечивают быстро нарастающее снижение МП и такое же быстрое восстановление.
b) медленноинактирующиеся. Их открывание вызывает медленное снижение МП и медленное его восстановление.
4. По механизмам открывания:
a) потенциалзависимые, т.е. те которые открываются при определенном уровне потенциала мембраны.
b) хемозависимые, открывающиеся при воздействии на хеморецепторы мембраны клетки физиологически активных веществ (нейромедиаторов, гормонов и т. д).
В настоящее время установлено, что ионные каналы имеют следующее строение:
1.Селективный фильтр, расположенный в устье канала. Он обеспечивает прохождение через канал строго определенных ионов.
2.Активационные ворота, которые открываются при определенном уровне мембранного потенциала или действии соответствующего ФАВ. Активационные ворота потенциалзависимых каналов имеется сенсор, который открывает их на определенном уровне МП.
3.Инактивационные ворота, обеспечивающие закрывание канала и прекращение проведения ионов по каналу на определенном уровне МП.(Рис).
Неспецифические ионные каналы не имеют ворот.
Селективные ионные каналы могут находиться в трех состояниях, которые определяются положением активационных (м) и инактивационных (h) ворот:
1.Закрытом, когда активационные закрыты, а инактивационные открыты.
2.Активированном, и те и другие ворота открыты.
3.Инактивированном, активационные ворота открыты, а инактивационные закрыты
Функции ионных каналов:
1. Калиевый (в покое) - генерация потенциала покоя
2. Натриевый - генерация потенциала действия
3. Кальциевый - генерация медленных действий
4. Калиевый (задержанное выпрямление) - обеспечение реполяризации
5. Калиевый кальций-активируемый - ограничение деполяризации, обусловленной током Са+2
Функцию ионных каналов изучают различными способами. Наиболее распространенным является метод фиксации напряжения, или «voltage-clamp». Сущность метода заключается в том, что с помощью специальных электронных систем в процессе опыта изменяют и фиксируют на определенном уровне мембранный потенциал. При этом измеряют величину ионного тока, протекающего через мембрану. Если разность потенциалов постоянна, то в соответствии с законом Ома величина тока пропорциональна проводимости ионных каналов. В ответ на ступенчатую деполяризацию открываются те или иные каналы, соответствующие ионы входят в клетку по электрохимическому градиенту, т. е. возникает ионный ток, который деполяризует клетку. Это изменение регистрируется с помощью управляющего усилителя и через мембрану пропускается электрический ток, равный по величине, но противоположный по направлению мембранному ионному току. При этом трансмембранная разность потенциалов не изменяется.
Изучение функции отдельных каналов возможно методом локальной фиксации потенциала «path-clamp». Стеклянный микроэлектрод (микропипетка) заполняют солевым раствором, прижимают к поверхности мембраны и создают небольшое разрежение. При этом часть мембраны подсасывается к микроэлектроду. Если в зоне присасывания оказывается ионный канал, то регистрируют активность одиночного канала. Система раздражения и регистрации активности канала мало отличается от системы фиксации напряжения.
Ток через одиночный ионный канал имеет прямоугольную форму и одинаков по амплитуде для каналов различных типов. Длительность пребывания канала в открытом состоянии имеет вероятностный характер, но зависит от величины мембранного потенциала. Суммарный ионный ток определяется вероятностью нахождения в открытом состоянии в каждый конкретный период времени определенного числа каналов.
Наружная часть канала сравнительно доступна для изучения, исследование внутренней части представляет значительные трудности. П. Г. Костюком был разработан метод внутриклеточного диализа, который позволяет изучать функцию входных и выходных структур ионных каналов без применения микроэлектродов. Оказалось, что часть ионного канала, открытая во внеклеточное пространство, по своим функциональным свойствам отличается от части канала, обращенной во внутриклеточную среду.
Именно ионные каналы обеспечивают два важных свойства мембраны: селективность и проводимость.
Селективность, или избирательность, канала обеспечивается его особой белковой структурой. Большинство каналов являются электроуправляемыми, т. е. их способность проводить ионы зависит от величины мембранного потенциала. Канал неоднороден по своим функциональным характеристикам, особенно это касается белковых структур, находящихся у входа в канал и у его выхода (так называемые воротные механизмы).
Рассмотрим принцип работы ионных каналов на примере натриевого канала. Полагают, что в состоянии покоя натриевый канал закрыт. При деполяризации клеточной мембраны до определенного уровня происходит открытие m-активационных ворот (активация) и усиление поступления ионов Na+ внутрь клетки. Через несколько миллисекунд после открытия m-ворот происходит закрытие h-ворот, расположенных у выхода натриевых каналов (инактивация). Инактивация развивается в клеточной мембране очень быстро и степень инактивации зависит от величины и времени действия деполяризующего стимула.
При генерации одиночного потенциала действия в толстом нервном волокне изменение концентрации ионов Na+ во внутренней среде составляет всего 1/100000 от внутреннего содержания ионов Na гигантского аксона кальмара.
Кроме натриевых, в клеточных мембранах установлены другие виды каналов, избирательно проницаемых для отдельных ионов: К+, Са2+, причем существуют разновидности каналов для этих ионов.
Ходжкин и Хаксли сформулировали принцип «независимости» каналов, согласно которому потоки натрия и калия через мембрану независимы друг от друга.
Свойство проводимости различных каналов неодинаково. В частности, для калиевых каналов процесс инактивации, как для натриевых каналов, не существует. Имеются особые калиевые каналы, активирующиеся при повышении внутриклеточной концентрации кальция и деполяризации клеточной мембраны. Активация калий-кальцийзависимых каналов ускоряет реполяризацию, тем самым восстанавливая исходное значение потенциала покоя.
Процесс инактивации кальциевых каналов достаточно сложен. С одной стороны, повышение внутриклеточной концентрации свободного кальция приводит к инактивации кальциевых каналов. С другой стороны, белки цитоплазмы клеток связывают кальций, что позволяет поддерживать длительное время стабильную величину кальциевого тока, хотя и на низком уровне; при этом натриевый ток полностью подавляется. Кальциевые каналы играют существенную роль в клетках сердца. Электрогенез кардиомиоцитов рассматривается в главе 7. Электрофизиологические характеристики клеточных мембран исследуют с помощью специальных методов.
Читайте также:
