Торможение актиновой нити тропонин-тропомиозиновым комплексом. Теория храпового механизма сокращения
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
Существование трупного окоченения (ТО) было известно человечеству с древнейших времен. Началом же судебно-медицинского изучения этого явления можно считать вторую половину XVI века, когда один из родоначальников европейской судебной медицины итальянский врач P. Zacchia предложил использовать выраженность ТО и трупных пятен для установления давности наступления смерти [1, 2].
Несмотря на очевидность существования ТО, механизм его появления, последовательность развития и разрешения оставались неизвестны. Так продолжалось вплоть до начала XIX века, пока в 1811 г. знаменитый французский врач P. Nysten [3] не опубликовал результаты своих исследований, в которых убедительно доказал, что ТО формируется в мышцах, и описал нисходящий порядок его развития, получивший впоследствии название «правило Нистена», которое довольно скоро получило широкую поддержку среди практических экспертов, в том числе и у таких выдающихся судебных медиков того времени, как A. Sommer, M. Larcher, J. Casper [4]. Согласно этому правилу, ТО, начинаясь в мимической мускулатуре лица, далее распространяется на жевательную мускулатуру, мышцы шеи, груди, верхних конечностей, живота и, наконец, на мышцы ног. По времени ТО сохраняется тем дольше, чем позднее после смерти оно наступает, а время его появления, интенсивность и продолжительность находятся в прямой зависимости от степени развития и состояния мускулатуры. В слабых, истощенных мышцах ТО развивается достаточно быстро и бывает кратковременным, а на хорошо развитой, крепкой мускулатуре окоченение появляется позднее и держится дольше.
Как показала дальнейшая судебно-медицинская практика, помимо описанного P. Nysten [5, 6] нисходящего типа развития ТО можно встретить иные варианты, не попадающие под «правило Нистена». Мнения разных исследователей [7—10] по этому поводу значительно различались между собой.
Так, P. Niderkorn (1872) на основании своих личных наблюдений в целом оспаривал порядок ТО, очерченный P. Nysten, а E. von Hofmann (1877), признавая, что «правило Нистена» справедливо для большинства наблюдений, описал восходящий тип трупного окоченения у лиц, умерших в состоянии истощения [7, 8]. А. Lacassagne (1912), выдвигая дегидратационную теорию развития ТО, считал, что последовательность распространения окоченения, зафиксированная P. Nysten, верна лишь для трупов, лежащих на спине, а при изменении положения тела в периоде охлаждения порядок ТО будет иной [9].
Согласно дегидратационной теории, жидкости трупа в силу тяжести стекают сверху вниз, в результате чего вышерасположенные ткани обезвоживаются, что приводит к сворачиванию миозина. В отечных тканях ТО слабое, а в обезвоженных очень сильное (например, при смерти от кровопотери, холеры и пр.). В качестве доказательства предложенного механизма ТО авторы указывали на то, что с помощью бинтования приподнятой конечности человека или животного можно ускорить в ней наступление окоченения, а на трупе с опущенной вниз головой и приподнятыми ногами вначале окоченевают нижние конечности. В экспериментах на животных, делая им инъекции веществ, вызывающих дегидратацию (хлорид кальция, хлороформ, эфир, абсолютный алкоголь), авторы [9, 10] получали немедленное развитие ТО, как они считали, вследствие ускоренного осаждения белковых веществ.
Будучи сторонником достаточно распространенной в то время теории «жизненной силы», P. Nysten [3] предложил свое объяснение механизма развития окоченения, считая, что «с прекращением видимого движения не прекращается еще жизнь мышечных волокон», и рассматривал ТО как «последнее усилие жизни против действия химических сил».
Однако выдвинутая P. Nysten теория механизма развития ТО вскоре обрела оппонентов среди противников теории «жизненной силы». Так, M. Orfila (1821), G. Treviranus (1832), J. Müller (1837), а также ряд видных ученых того времени придерживались так называемой «коагуляционной» теории, согласно которой ТО обусловлено посмертным свертыванием крови и лимфы между мышечными волокнами [11—13].
Однако и коагуляционная теория в свою очередь также подверглась критике. Основанием для нее послужил тот факт, что ТО может развиваться и в трупах обескровленных животных.
Будучи убежденным противником теории «жизненной силы», E. von Brücke в 1842 г. представил коагуляционную теорию в несколько измененном виде, предположив, что ТО происходит вследствие посмертного сворачивания внутрифибриллярного фибрина, который проникает в клетку с током плазмы еще при ее жизни [14]. Против этого возражал R. Virchow [15], обратив внимание на тот факт, что плазма, выделенная из мускула, по своему химическому составу отличается от плазмы, выделенной из крови.
«Второе дыхание» коагуляционная теория ТО получила после выделения W. Kuehne [16] в 1859 г. из мышц лягушки жидкой субстанции, способной при определенных условиях формировать сокращающийся сгусток, названной им миозином.
Теперь у сторонников коагуляционной теории появился неоспоримый аргумент, что в мышцах, как и в крови, есть протеид, способный подвергаться после наступления смерти спонтанной коагуляции. Также было установлено, что в тех случаях, когда миозин в мышцах был разрушен, ТО практически не развивалось, а из мышц, находящихся в состоянии окоченения, миозин выделяли в меньших количествах, чем из мышечной ткани, взятой на исследование прижизненно [17].
В ХХ веке коагуляционная теория ТО получила дальнейшее развитие и была дополнена положением о том, что «свертыванию мышечного фибрина», или, как принято называть сейчас, «полимеризации актин-миозинового комплекса» способствует молочная кислота, уровень которой в миоцитах посмертно нарастает вследствие активации анаэробного гликогенолиза.
Однако коагуляционная теория все же имела и свои слабые стороны, на которые еще в 1858 г. обратил внимание C.-E. Brown-Sequard [18], отметив, что в рамках коагуляционной теории нельзя объяснить имеющуюся последовательность и многочисленные варианты развития ТО, в частности необъяснимым оставался каталептический тип развития ТО.
A.И. Миловзоров [19], проведя гистологическое исследование поперечнополосатых мышц, не обнаружил ни в одном из периодов развития ТО каких-либо морфологических признаков, подтверждающих коагуляционную теорию. В то же время автор обнаружил, что в начале развития ТО можно выявить извитые, «гофреные» волокна с резко сглаженной поперечной исчерченностью (усиление которой происходило по мере нарастания ТО с последующим ее ослаблением в стадии его разрешения) и признаки зернистой и восковидной дегенерации. На основании полученных данных A.И. Миловзоров пришел к выводу, что все существующие теории, раскрывающие причину и механизм ТО, не могут быть признаны подходящими и отвечающими на все неясные вопросы.
По мере развития учения о ТО накапливалось все больше фактов, не укладывающихся в концепцию коагуляционной теории.
Так, в 1908 г. S. Meltzer и J. Auer [17], вводя в кровеносные сосуды экспериментальных животных растворы хлорида кальция и сернокислой магнезии, получили результаты, свидетельствующие о том, что введение незадолго до смерти СаСl2 усиливает развитие ТО, а введение MgSO4 ослабляет выраженность и скорость развития ТО. Аналогичные результаты были получены и в дальнейшем [20].
Позже рядом исследователей [21, 22] было показано влияние нервной системы на развитие ТО. Так, еще в 1910 г. А. Игнатовский [21] отмечал незначительную выраженность ТО при разрушении спинного мозга.
В 1933 г. с критикой коагуляционной теории выступил E. Lundsgaard [23], который в экспериментах ингибировал у лягушек процессы гликолиза. Однако несмотря на то что в мышцах подопытных лягушек в этих случаях происходила щелочная реакция, ТО у всех подопытных животных было выражено достаточно резко.
Все это не только не укладывалось в коагуляционную теорию ТО, но и прямо противоречило ее основным постулатам.
Русским ученым Н.Е. Введенским [24] была предложена парабиотическая теория ТО. Развивая созданное им учение о парабиозе, Н.Е. Введенский считал, что ТО мышц представляет собой пограничное состояние между жизнью и смертью, причем мышца, пребывающая в состоянии парабиоза, может быть возвращена к жизни in vitro при наличии соответствующих условий. Если же такие условия не могут быть созданы, то мышечная ткань умирает. Отмечая значительное физиологическое сходство между мышцей, находящейся в состоянии посмертного окоченения, и парабиозом нерва, называя это сходство «глубоким и основным», Н.Е. Введенский считал, что ТО возникает в результате сильного возбуждения, вызываемого нервом, впадающим в состояние парабиоза.
Парабиотическую теорию ТО поддерживали в более поздних работах многие известные физиологи [25].
Чрезвычайно важным шагом на пути понимания механизма развития ТО стало открытие В.А. Энгельгардтом и М.Н. Любимовой [26] АТФазной активности миозина. Ими было установлено, что гель миозина под влиянием АТФ способен изменять свой объем. На основании полученных результатов было высказано предположение о том, что расщепление АТФ миозином является движущей силой мышечного сокращения [26].
Полученные фундаментальные данные органично дополнили парабиотическую теорию ТО и позволили начать качественно новые исследования физико-химических и биохимических изменений в мышцах, происходящих как во время их прижизненного сокращения, так и в процессе развития ТО.
Т. Erdos (1943), изучая содержание АТФ в мышцах кроликов, степень растворимости актомиозина, динамику ТО, установил, что содержание АТФ и нарастание ТО являются обратно пропорциональными величинами. Поскольку растворимость актомиозина можно снова восстановить добавлением АТФ, Т. Erdos [27] пришел к выводу о том, что ТО и нерастворимость актомиозина являются последствием резкого уменьшения количества АТФ в мышце после смерти.
К аналогичным выводам пришли в своих исследованиях Е. Вate-Smith и J. Bendall [28].
АТФазная теория развития ТО вскоре получила широкое признание и вошла практически во все современные руководства по судебной медицине. Однако сводя суть развития ТО к истощению запасов АТФ изолированно от совокупности всех механизмов мышечного сокращения, авторы, к сожалению, не могут дать адекватную, современную интерпретацию всего многообразия вариантов развития ТО.
Трупное окоченение как посмертная мышечная контрактура
Прекращение после смерти оксигенизации крови в легких и полная остановка гемодинамики приводят к развитию аноксии всех тканей организма, включая и мышечные.
В условиях аноксии в клетках запускается процесс анаэробного дыхания за счет активации процессов гликолиза. Так как в ходе анаэробного окисления синтезируется значительно меньше молекул АТФ, чем при аэробном окислении метаболических субстратов, то в условиях аноксии гликолиз может лишь частично компенсировать возникший энергетический клеточный дефицит. Образующаяся при этом энергия расходуется миоцитами только на поддержание минимального уровня жизнеобеспечения, который в зависимости от ряда условий может быть различным. Так, скелетная мускулатура в течение 6—9 ч, а сердечная — от 1 до 2 ч могут переживать остановку кровообращения [29].
Следствием дефицита макроэргических фосфатов и нарастающего на фоне гликолиза внутриклеточного ацидоза является блокирование АТФ-зависимых механизмов ионного транспорта, в том числе ответственных за удаление из клеток Са 2+ [30].
В условиях ингибирования Са 2+ -транспортных систем сарколемма мышечных клеток более не может лимитировать поступление Са 2+ в саркоплазму. Накапливаясь в околофибриллярном пространстве, Са 2+ насыщает регуляторные центры тропонина С, вызывая изменение структуры тропонинового комплекса, приводя к перемещению тропомиозина.
Локальные изменения структуры тропонина и тропомиозина быстро распространяются вдоль всего актинового филамента, генерируя тянущее усилие с формированием прочных актин-миозиновых комплексов [31].
Выраженный дефицит макроэргов и накопление в саркоплазме Са 2+ способствуют пролонгированному сохранению актин-миозиновых мостиков в положении генерации силы и формированию аноксической контрактуры — фиксированному сокращению мышечной ткани, возникающему в результате нарушения процесса ее расслабления [32].
Активизация анаэробного гликолиза приводит к внутриклеточному накоплению недоокисленных продуктов липолиза, молочной кислоты и развитию метаболического ацидоза. Существенное снижение внутриклеточного рН, происходящее в ходе ТО, приводит к изменениям химического состава, физико-коллоидной структуры и коагуляции белков миоплазмы. Белки теряют свои коллоидные свойства, становятся неспособными связывать (удерживать) воду и лишаются части своей дисперсной среды, которая представлена внутриклеточной жидкостью. Высвободившаяся гидратносвязанная вода, воздействие протеолитических ферментов и кислая среда создают условия для разрыхления сарколеммы мышечных волокон, разрыхления и набухания коллагена.
Набухание коллагена с последующей частичной отдачей влаги с поверхности трупа в окружающую среду в свою очередь ускоряет процесс трупного высыхания и способствует изменению консистенции мышечной ткани.
Рассмотренная концепция ТО позволяет рассматривать его не как особый феномен, а как посмертную контрактуру мышечной ткани, имеющую определенные физиологические закономерности развития.
Это позволяет объяснить не только суть происходящих внутри миоцитов изменений, но и многочисленные модификации ТО, в том числе и очередность его развития.
ТО как посмертная контрактура развивается изначально в тех мышцах, которые наиболее чувствительны к кислородному голоданию. Так, в первую очередь окоченение развивается в относительно бедной резервами макроэргов сердечной мышце.
В скелетных мышцах, которые при жизни имели более интенсивное кровоснабжение, относительно небольшие анаэробные нагрузки и соответственно содержали меньше запасов энергетических субстратов (например, жевательные мышцы), ТО развивается быстрее. Из скелетной мускулатуры, как правило, наиболее устойчивы к действию гипоксии постоянно подвергающиеся физической нагрузке мышцы ног. Поэтому окоченение в нижних конечностях развивается в последнюю очередь. Совокупность указанных факторов и обусловливает нисходящий тип ТО.
В тех случаях, когда основная физическая нагрузка в течение длительного времени приходилась на мышцы плечевого пояса (при длительном постельном режиме, параличе, парезе нижних конечностей и т.д.), наиболее тренированным к гипоксии становится пояс верхних конечностей, что и обусловливает особое развитие ТО (восходящий тип).
ТО развивается несколько позднее и сильнее выражено у трупов физически развитых лиц, так как в их скелетной мускулатуре более высокая плотность миофибрилл на единицу мышечного объема и относительно высокий запас энергетических субстратов.
У пожилых, истощенных, длительно болевших людей вследствие прижизненного снижения уровня пластического обмена происходит уменьшение общего объема мышечной массы, редукция миофибриллярного аппарата и снижение запасов внутриклеточных макроэргических субстратов. В этих случаях ТО развивается более быстро (может отмечаться уже через 30—40 мин), однако выражено значительно слабее и быстро проходит.
Общими физиологическими и биохимическими изменениями, происходящими в агональный период, обусловлено развитие и каталептического ТО на фоне выраженных предсмертных судорог, когда бóльшая часть мышечных групп в последние минуты жизни попадает в условия резко прогрессирующей гипоксии в сочетании с высокоинтенсивной нейрогуморальной нагрузкой. Совокупное действие этих факторов приводит к резкому повышению скорости перекисного окисления липидов и выраженному внутриклеточному метаболическому ацидозу сократительных клеток. Уже во время агонии во многих миоцитах происходит необратимая альтерация мембранных систем с потерей селективной проницаемости. На смену активному транспорту электролитов приходят процессы диффузии, что приводит к резкому падению градиента концентрации электролитов между миоплазмой сократительных клеток и внеклеточной жидкостью, насыщению тропомиозиновых центров Са 2+ и быстрому развитию мышечных контрактур.
Так как ТО тесно связано с явлением парабиоза миоцитов и возможностью различных типов мышечных волокон и групп мышц переживать условия полного прекращения кровообращения, то ряд внешних факторов, а также обстоятельства наступления смерти, влияющие на протекание парабиоза, могут изменять сроки и выраженность протекания ТО.
Низкая температура окружающей среды продлевает сроки парабиоза поперечнополосатой мускулатуры, в результате чего ТО выражено слабее и проявляется в более поздние сроки.
Высокая температура окружающей среды, наоборот, интенсифицирует скорость окислительно-восстановительных процессов, что укорачивает продолжительность парабиоза и способствует более быстрому развитию и выраженности ТО.
Резко выраженное ТО формируется при смерти от действия атмосферного или технического электричества вследствие электрохимической диссоциации и повреждений клеточных мембран, происходящих в миоцитах под действием электрического тока.
Смерть от обильной кровопотери приводит к быстрому развитию аноксии мышечной ткани и соответственно к более выраженному ТО.
Разрешение ТО происходит вследствие разрушения актин-миозиновых комплексов миоцитов лизосомальными ферментами в ходе аутолиза и протекает в том же порядке, как и развивалось: вначале в тех миоцитах, которые раньше погибли на фоне аноксии.
Изложенное выше позволяет сделать вывод о том, что ТО тесно связано с явлением парабиоза миоцитов и возможностью различных типов мышечных волокон и групп мышц переживать аноксию, развивающуюся после наступления биологической смерти. Наиболее быстро ТО начинается в тех мышцах, сократительные клетки которых при жизни содержали наименьшее количество макроэнергетических субстратов.
Развитие ТО обусловлено происходящим в посмертном периоде нелимитируемым ростом концентрации Са 2+ в миоплазме сократительных клеток с приведением актин-миозинового комплекса в положение генерации силы без последующего расслабления, что позволяет рассматривать ТО как посмертную мышечную контрактуру.
Структура миофибрилл и её изменения при сокращении.
Современные представления о структуре миофибриллярного (сократительного) аппарата основываются на исследованиях структуры мышечного волокна при помощи электронной микроскопии, рентгеноструктурного анализа в сочетании с гистохимическими методами.
Установлено: каждая миофибрилла мышечного волокна диаметром 1 мкм состоит в среднем из 2500 протофибрилл, представляющих собой удлиненные полимеризованные молекулы сократительных белков - миозина и актина, которые называются протофибриллами. Миозиновые протофибриллы, или как их ещё называют, нити, вдвое толще актиновых (их диаметр около 10 нм). В состоянии покоя в мышце нити расположены так, что тонкие актиновые нити входят своими концами в промежутки между короткими и толстыми миозиновыми протофибриллами. Благодаря этому І-диски состоят только из актиновых нитей, а А-диски - из миозиновых и небольшого количества актиновых нитей (в местах захода актиновых нитей в промежутки между миозиновыми).
Светлая полоса Н представляет собой узкую зону в диске А, свободную от актиновых нитей. Мембрана Z, проходя через середину диска І, скрепляет между собой эти нити.
Миозиновые нити имеют поперечные выступы длиной около 20 нм, с головками примерно 150 молекул миозина. Они отходят от нити биполярно, во время сокращения каждая головка миозина может связывать миозиновую нить с актиновой. Наклоны этих актиновых центров на миозиноых нитях создают объединенное усилие, происходит «гребок», продвигающий актиновую нить к середине саркомера. В конечной фазе сокращения миозиновые нити достигают линии Z, занимая весь саркомер, а актиновые нити располагаются между ними. При этом наблюдается уменьшение длины диска І, а к концу сокращения - исчезновение дисков І и утолщение линии Z.
Так объясняет феномен укорочения общей длины мышечного волокна в процессе сокращения теория скользящих нитей (теория «зубчатого колеса»), разработанная Хаксли и Хансон (1954), и дополненная этими же авторами в 1981 году.
Основное положение теории скользящих нитей - во время скольжения (сокращения) сами актиновые и миозиновые нити не укорачиваются, так как ширина диска А остается при сокращении постоянной, а І-диски и Н-зоны становятся более узкими или совсем исчезают. Длина протофибрилл не изменяется и при растяжении мышцы. Вместо этого пучки тонких нитей, скользя, выходят из промежутков между толстыми нитями, так что степень их перекрытия уменьшается
Каким же образом осуществляется «разнонаправленное скольжение» актиновых нитей в соседних половинах саркомера?
Во время сокращения каждая головка миозина, или поперечный мостик, связывает миозиновую протофибриллу с актиновой. Наклоны головок создают объединенное усилие, и происходит скольжение (гребок), продвигающий актиновую нить к середине саркомера. Биполярная организация молекул миозина в двух половинах саркомера уже обеспечивает возможность скольжения актиновых нитей в противоположном направлении в левой и правой половине саркомера.
Когда мышца расслабляется, головки миозина отходят от актиновых нитей. Поскольку актиновые и миозиновые нити могут легко скользить относительно друг друга, сопротивление растяжению в расслабленных мышцах оказывается низким, поэтому удлинение мышцы во время расслабления является пассивным.
ЭТАПЫ ГЕНЕРАЦИИ СОКРАЩЕНИЯ.
Стимуляция мышечного волокна: возбуждение мышц обычно происходит при поступлении потенциала действия от иннервирующих мотонейронов через посредство нервно-мышечных синапсов.
В результате на мембране мышечного волокна формируется ПД, который распространяется вглубь мышечного волокна к миофибриллам.
Происходит процесс электромеханического сопряжения: он представляет собой преобразование электрического потенциала действия в механическое «скольжение» протофибрилл по отношению друг к другу. Этот процесс происходит в несколько этапов с обязательным посредством ионов кальция!
Механизм, посредством которого Са 2+ активирует волокно, легче понять при рассмотрении структуры актиновых нитей. Актиновая нить длиной около 1 мкм и толщиной 5-7 нм состоит из двух закрученных один вокруг другого и напоминающих нитки бус мономеров актина толщиной каждой по 5 нм. Через регулярные промежутки примерно 40 нм на цепях актина находятся сферические молекулы тропонина, а в желобках между цепями актина лежат нити тропомиозина. В отсутствии Са 2+ , т.е. при расслаблении миофибрилл, длинные молекулы тропомиозина располагаются так, что блокируют прикрепление поперечных мостиков миозина к актиновым цепям. Под влиянием активирующего начала ионов Са 2+ молекулы тропомиозина глубже опускаются в желобки между мономерами актина, открывая участки прикрепления для поперечных мостиков миозина. В результате мостики миозина прикрепляются к актиновым нитям, АТФ расщепляется и развивается мышечная сила. Эти активационные эффекты обусловлены действием Са 2+ на тропонин, причем последний работает как «кальциевый переключатель», а именно: при связывании с Са 2+ молекула тропонина деформируется так, что она толкает тропомиозин в желобки между нитями актина. При этом концентрация тонов Са 2+ должна достигать пороговой величины 10 -6 - 10 -5 моль/л.
Хранение и высвобождение ионов кальция. В состоянии расслабления мышца содержит более 1 мкмоль Са на 1 г сырого веса. Если бы соли Са не были изолированы в особых внутриклеточных хранилищах, обогащенные кальцием мышечные волокна находились бы в состоянии непрерывного сокращения. Структура внутриклеточных систем хранения кальция следующая: во многих участках мембрана мышечной клетки углубляется внутрь волокна, перпендикулярно его продольной оси, образуя трубки; эта система поперечных трубочек (Т-система) соединяется с внеклеточной средой. Перпендикулярно Т-системе, т.е. параллельно миофибриллам, расположена система продольных трубочек (истинный саркоплазматический ретикулум). Пузырьки на концах этих трубочек, терминальные цистерны, находятся очень близко к мембранам поперечной системы, образуя триады. В этих пузырьках и хранится внутриклеточный Са 2+ . В отличие от поперечной системы продольная система не соединяется с окружающей средой.
Таким образом, электромеханическое сопряжение происходит посредством распространения потенциала действия по мембранам поперечной системы внутрь клетки. При этом возбуждение быстро проникает во внутрь волокна, переходит к продольной системе и, в конечном счете, вызывает высвобождение ионов Са 2+ , которые хранятся в терминальных цистернах, во внутриклеточную жидкость около миофибрилл, что ведет к сокращению.
РОЛЬ АТФ В МЕХАНИЗМЕ МЫШЕЧНОГО СОКРАЩЕНИЯ
В процессе взаимодействия миозиновых и актиновых нитей в присутствии Са 2+ важную роль играет АТФ.
Энергия АТФ используется во время деятельности скелетной мышцы для трех основных процессов:
работы натрий-калиевого насоса, обеспечивающего поддержание постоянства градиента концентрации ионов натрия и калия по обе стороны мембраны;
процесса скольжения актиновых и миозиновых нитей, ведущего к укорочению миофибрилл;
работы кальциевого насоса, необходимого для расслабления волокна.
В соответствии с этим фермент АТФаза локализован в трех различных структурах мышечного волокна: клеточной мембране, миозиновых нитях, мембранах саркоплазматического ретикулума. АТФ гидролитически арсщепляется и, таким образом, энергетически утилизируется с помощью АТФазы - фермента миозина; причем, процесс активируется актином.
Рис.
Потребление АТФ при сокращении. Сейчас известно, что головки миозина, которые взаимодействуют с актином, сами содержат каталитические активные центры для расщепления АТФ. АТФаза миозина активируется актином в присутствии ионов Mg 2+ . Поэтому при физиологическом ионном составе среды, т.е. в присутствии ионов Mg 2+ , АТФ расщепляется с освобеждением АДФ и фостата только в случае прикрепления головки миозина к активирующему белку - актину. В каждом цикле прикрепления-отсоединения поперечного мостика АТФ расщепляется только один раз (вероятно, 1 молекула АТФ на 1 поперечный мостик). Это означает, что чем больше поперечных мостиков находится в активном состоянии, тем выше скорость расщепления АТФ и сила, развиваемая мышцей. Таким образом, скорость расщепления АТФ (или метаболическая скорость) и сила, развиваемая мышцей, бывают обычно пропорциональны друг другу. Мышечное сокращение происходит тем быстрее, чем скорее передвигаются поперечные мостики, т.е. чем больше гребковых движений они делают в единицу времени. В результате быстрые мышцы потребляют больше АТФ (или энергии) в единицу времени, чем медленные мышцы, и сохраняют меньше энергии во время тонического удержания нагрузки. Поэтому для «изометрической работы» организм использует преимущественно медленные (тонические) «красные» мышцы, тогда как бедные миоглобином «белые» мышцы служат для быстрых движений.
Механизм действия АТФ. Молекула АТФ с поперечным мостиком после завершения его «гребкового» движения, и это обеспечивает энергию для разделения компонентов, участвующих в реакции - актина и миозина. После этого головки миозина отсоединяются от актина; затем АТФ расщепляется до АДФ и фосфата с промежуточным образованием комплекса фермент-продукт. Расщепление является обязательным условием для следующего прикрепления поперечного мостика к актину с освобождением АДФ и фосфата и «гребковым» движением мостика. Когда движение мостика завершается, с ним связывается новая молекула АТФ, и начинается новый цикл.
Циклическая активность поперечных мостиков, т.е. ритмическое прикрепление и отсоединение мостиков, которое обеспечивает мышечное сокращение, возможна только до тех пор, пока продолжается гидролиз АТФ, т.е. пока происходит активация АТФазы. Если расщепление АТФ заблокировать, мостики не могут повторно прикрепляться, мышца расслабляется.
После смерти содержание АТФ в мышечных клетках снижается, когда оно переходит критический уровень, поперечные мостики оказываются устойчиво прикрепленными к актиновой нити (пока не произойдет аутолиз). В таком состоянии актиновые и миозиновые нити прочно связаны друг с другом, мышца находится в состоянии трупного окоченения.
Ресинтез АТФ осуществляется двумя основными путями:
ферментативный перенос фосфатной группы от креатинфосфата на АДФ. Ресинтез обеспечивается по этому пути в течение тысячных долей секунды, т.к. запасы КФ значительно больше в клетке, чем АТФ;
гликолитические и окислительные процессы в покоящейся и деятельной мышце - медленный ресинтез АТФ через окисление молочной и пировиноградной кислот.
Нарушение ресинтеза АТФ ядами ведет к полному исчезновению АТФ и креатинфосфата, вследствие чего кальциевый насос перестает работать. Концентрация Са 2+ в области миофибрилл значительно возрастает и мышца приходит в состояние длительного необратимого укорочения. Это состояние называется контрактурой.
Механизм мышечного сокращения. Изменение соотношения протофибрилл. Роль ионов Са и АТФ.
При сокращении мышцы длина актиновых и миозиновых нитей не изменяется. Происходит лишь их смещение относительно друг друга: тонкие нити задвигаются в промежуток между толстыми. Такое скольжение оказывается возможным благодаря существованию поперечных мостиков (миозиновых головок) между толстыми и тонкими нитями. Миозиновая нить имеет на себе множество головок, которыми она может связываться с актином. Актиновая же нить, в свою очередь, имеет участки (активные центры), к которым могут прикрепляться головки миозина. В покоящейся мышечной клетке эти центры связывания прикрыты молекулами тропомиозина, что препятствует образованию связи между тонкими и толстыми нитями.
Для того чтобы актин и миозин могли взаимодействовать, необходимо присутствие ионов кальция. В покое они находятся в саркоплазматическом ретикулуме. Эта органелла представляет собой мембранные полости, содержащие кальциевый насос, который за счет энергии АТФ транспортирует ионы кальция внутрь саркоплазматического ретикулума. Распространяющийся по клеточной мембране потенциал действия активирует близко расположенную к поверхности клетки мембрану ретикулума и вызывает выход Ca 2+ в цитоплазму.
Молекула тропонина открывает активный центр, ранее прикрытый тропомиозионом и к нему присоединяется поперечный мостик, что позволяет актину и миозину взаимодействовать друг с другом. Для дальнейшего скольжения нитей необходима энергия АТФ. При гидролизе АТФ выделяется энергия, которая разрывает связь между актином и миозином, и миозиновая головка способна взаимодействовать с новым участком молекулы актина. АТФ обуславливает такое свойство мышц, как растяжимость.
Познавательно:
КЛАССИФИКАЦИЯ СОГЛАСНЫХ ЗВУКОВ РУССКОГО ЯЗЫКА Согласные звуки - это звуки речи, состоящие или из одного шума, или из голоса и шума, который образуется в органах.
Федеральные государственные образовательные стандарты и федеральные государственные требования, образовательные стандарты и образовательные программы Понятие "государственный образовательный стандарт" впервые было введено Законом РФ "Об образовании".
Классификация аминокислот I. Физико-химическая - основана на различиях в физико-химических свойствах аминокислот. 1) Гидрофобные аминокислоты.
Виды мотивов учения Мотив учения — это направленность ученика на различные стороны учебной деятельности.
Как исследовать функцию на непрерывность? Исследование функции на непрерывность в точке проводится по уже накатанной рутинной схеме.
Теория скольжения филаментов

Взаимодействие мышечных белков лежит в основе нашего нынешнего понимания сокращения саркомера. Как оно происходит? Это как-то связано со скользящим взаимодействием между актином и миозином.
Основные понятия
Перед тем, как углубиться в физиологию, ознакомимся с основной терминологией.
На электронной микрофотографии тонкого среза мышечных волокон изображена группа нитей.
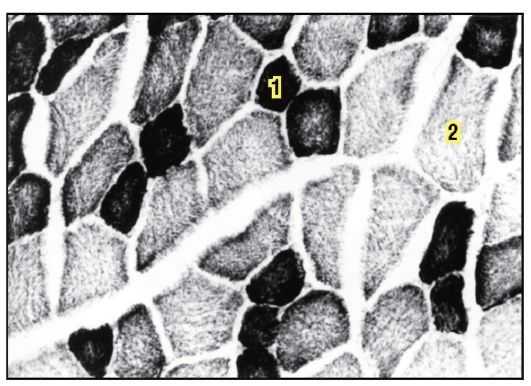
Рисунок 1. 1 — тонкие нити (I тип, красные нити) — не интенсивная, длительная работа.
2 — толстые нити (II тип, белые нити) — интенсивная и кратковременная работа.
Каждый массив нитей — миофибрилла — имеет форму цилиндра, внутри которого чередуются пучки тонких и толстых нитей. Внутри волокна нити находятся в строгом порядке, так что области с одинаковой плотностью находятся рядом друг с другом, за счет чего волокно имеет характерную полосатую окраску в поляризованном световом микроскопе. Единица между двумя темными полосами — саркомер.
В продольном разрезе группы миофибрилл имеется полоса низкой плотности, называемая I-полосой. В центре I-полосы имеется заметная плотная линия, называемая Z-диском. Область между двумя линиями Z — саркомером — может считаться основной структурной и функциональной единицей, непосредственно ответственной за сокращение мышц. Таким образом, миофибриллу можно рассматривать как группу саркомеров.
Группа миофибрилл образует симпласт. На поверхности мышечной клетки плазматическая мембрана (сарколемма) образует впячивания, где формируется система Т-трубочек, обеспечивающая сокращение миоцитов. Представляет собой сеть взаимосвязанных колец, каждое из которых окружает миофибриллу и обеспечивает важный путь коммуникации между наружной частью волокна и миофибриллами, которые расположены глубоко внутри волокна.
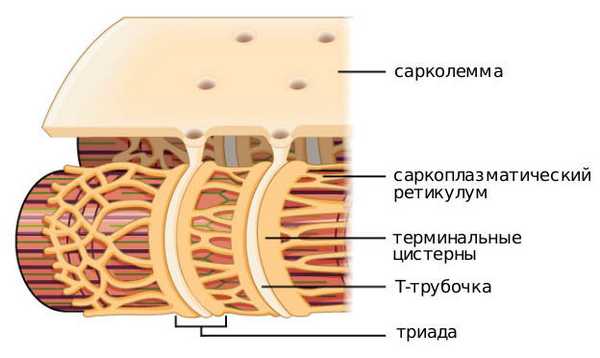
Другая мембранная система, которая окружает каждую миофибриллу — саркоплазматический ретикулум, образующий ряд закрытых мешковидных мембран. Участок, контактирующий с Т-трубочкой, образует увеличенный мешок, называемый терминальной цистерной. У большинства позвоночных каждая Т-трубочка имеет две цистерны, тесно связанные с ней, образуя трехэлементный комплекс, называемый триадой. Количество триад на саркомер зависит от вида. Например, в мышце лягушки есть одна на триаду, а в мышцах млекопитающих — две. У рыб и ракообразных только одна цистерна связана с каждой поперечной трубочкой, образуя диаду.
Мышечные белки
Основной составляющей толстых нитей является миозин. Каждая толстая нить состоит из около 250 молекул миозина. Миозин играет две важные роли: структурную как строительный блок для толстых нитей и функциональную как катализатор распада АТФ во время сокращения и взаимодействия с актином в составе силового генератора мышц. Хвост длиной около 120 нм состоит из двух цепей белка, каждая из которых намотана на так называемую α-спираль, вместе образуя структуру спиральных катушек. На другом конце молекулы две белковые цепи образуют две глобулярные головные области, которые обладают способностью сочетаться с белковым актином и несут ферментативные сайты для гидролиза АТФ.
В средней части толстой нити молекулы собраны в хвост-хвост. Вдоль остальной части нити наматываются с головы до хвоста. Хвостовые части молекул образуют сердцевину нити; головные части выступают из нити.
Тонкие нити содержат три разных белка: актин, тропомиозин и тропонин. Актин, составляющий около 25 % белка миофиламентов, является основным компонентом тонких нитей в мышцах. Актиновые молекулы повторяются каждые 2,75 нм вдоль тонкой нити. Они создают спиральную структуру, которая может рассматриваться как двойная или одинарная спираль.
Тропомиозин представляет собой стержнеобразную молекулу длиной около 40 нм. Имеет структуру, аналогичную структуре хвоста миозина, являющейся спиральным звеном двух белковых цепей. Каждая молекула тропомиозина находится в контакте с семью актиновыми единицами.
Тропонин представляет собой комплекс из трех различных субъединиц белка: I, T и C. Тропонин С может связывается с кальциевыми ионами. Тропонин T присоединяется к тропомиозину, образуя с ним тропонин-тропомиозиновый комплекс. Тропонин I соединяется с актином в тонких филаментах. Один тропониновый комплекс связан с каждой молекулой тропомиозина. Молекула тропонина расположена примерно каждые 40 нм вдоль нити.
Тропонин и тропомиозин участвуют в регуляции сокращения и расслабления мышц. Одной из субъединиц является рецептор для Ca 2+ , высвобождаемый из саркоплазматического ретикулума при активации мышцы. Считается, что связывание кальция затем приводит к дальнейшим структурным изменениям взаимодействия актина, тропомиозина и другой субъединицы тропонина, которые приводят к сокращению путем активации взаимодействия актин-миозин.
Историческая справка
В 1954 году ученые опубликовали две новаторские статьи, описывающие молекулярную основу сокращения мышц. В этих работах описывалось положение миозиновых и актиновых филаментов на разных стадиях сокращения мышечных волокон и предлагалось, как это взаимодействие вызывает сократительную силу. Используя микроскопию высокого разрешения, А. Ф. Хаксли и Р. Нидерберг (1954) и Х. Э. Хаксли и Дж. Хансон (1954) наблюдали изменения в саркомерах по мере сокращения мышечной ткани. Они заметили, что одна зона повторного саркомера, «полоса А», оставалась относительно постоянной по длине во время сокращения. Полоса А содержит толстые нити миозина. Предполагалось, что миозиновые нити остаются центральными и постоянными по длине, в то время как другие области саркомера сокращаются.

Эти наблюдения побудили их предложить теорию скользящих нитей, в которой говорится, что скольжение актина относительно миозина вызывает напряжение мышц. Поскольку актин привязан к структурам, расположенным на боковых концах каждого саркомера, называемых z-дисками или «z-полосами», любое сокращение длины нити актина приведет к сокращению саркомера и, следовательно, мышцы.
Механизм сжатия
Когда нервный импульс от головного и спинного мозга переносится по двигательному нейрону в мышечное волокно, Ca 2+ ионы высвобождаются в терминальном аксоне.
Увеличение концентрации ионов кальция стимулирует высвобождение нейротрансмиттера ацетилхолина в синаптической щели.
Нейротрансмиттер связывается с рецептором на сарколемме, происходит деполяризация, и генерируется потенциал действия через мышечное волокно для сокращения мышц. Потенциал действия распространяется по всему мышечному волокну и перемещается в соседние волокна вдоль Т-трубочек.
Инициируется выделение ионов кальция из саркоплазматического ретикулума, которые стимулируют сокращение мышц. Последовательность сокращения мышц, объясняемая моделью скользящих нитей, выглядит следующим образом:
1. Блокировка головной части миозина:
Актин и миозин перекрывают друг друга, образуя поперечный мостик. Поперечный мостик активен только тогда, когда головка миозина прикреплена, как крючок, к нити актина. Когда мышца находится в состоянии покоя, перекрытие актиновой нити к головке миозина блокируется тропомиозином. Миофиламент актина находится в положении покоя.
2. Выделение иона кальция:
Нервный импульс, вызывающий деполяризацию и потенциал действия в сарколемме, вызывает выброс ионов кальция. Ион кальция связывается с тропониновым комплексом на нити актина, сдвигая тропомиозин из его места блокировки. Миофиламент актина находится в активном положении.
3. Поперечный мостик:
Поперечный мостик между актином и миозином действует как фермент (миозин АТФ-аза), который гидролизует АТФ, хранящийся в головке миозина, в АДФ, вследствие чего высвобождается энергия. Эта освобожденная энергия используется для перемещения головки миозина в направлении актиновой нити. Головка миозина наклоняется и тянет актиновую нить так, что миозин и актиновая нить скользят друг к другу. Противоположные концы нитей актина в саркомере движутся в направлении друг к другу, что приводит к сокращению мышцы. После сближения поперечный мостик отсоединяется, а актин и миозиновая нить возвращаются в исходное положение.

Аналогия, наглядно иллюстрирующая теорию
Представьте, что вы стоите между двумя большими шкафами с книгами. Они находятся на расстоянии нескольких метров друг от друга и расположены на рельсах, так что их можно легко перемещать. Вам дается задача объединить два книжных шкафа, но вы ограничены использованием только ваших рук и двух веревок. Стоя в центре между книжными шкафами, вы тянете за две веревки (по одной на руку), которые надежно привязаны к каждому книжному шкафу. Повторяющимися движениями вы подтягиваете каждую веревку к себе, перехватываете ее, а затем снова тянете. В конце концов книжные шкафы движутся вместе и приближаются к вам. В этом примере ваши руки похожи на молекулы миозина, веревки — это актиновые нити, а книжные шкафы — это z-диски, на которых закреплен актин и которые составляют боковые концы саркомера. Подобно тому, как вы остаетесь в центре между книжными шкафами, миозиновые нити остаются центрированными во время нормального сокращения мышц.
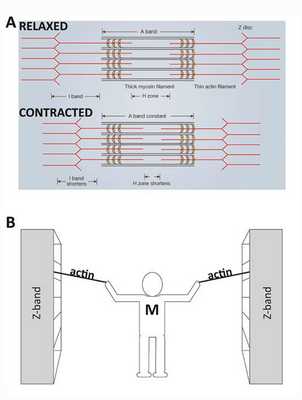
Регуляция
АТФ поставляет энергию, как и было описано выше, но что делает кальций? Кальций требуется двум белкам (тропонину и тропомиозину), которые регулируют сокращение мышц. В покоящемся саркомере тропомиозин блокирует связывание миозина с актином. В вышеупомянутой аналогии вытягивания шкафов тропомиозин будет мешать вашей руке, поскольку он будет удерживать актин-веревку.
В 1994 году Уильям Леман и его коллеги продемонстрировали, как тропомиозин вращается, изучая форму актина и миозина в богатых кальцием растворах и растворах, содержащих низкий уровень кальция (Lehman, Craig, & Vibertt, 1994). Сравнивая действие тропонина и тропомиозина в этих двух условиях, они обнаружили, что присутствие кальция является существенным для механизма сжатия. В отсутствие свободного кальция связывание актина и миозина не происходит, поэтому наличие свободного кальция является важным регулятором мышечного сокращения.
Нерешённые вопросы
Ученым предстоит выяснить о нескольких белках, которые явно влияют на сокращение мышц. Например, молекулы, такие как титин, необычно длинный и «упругий» белок, охватывающий саркомеры у позвоночных, предположительно связывается с актином. Кроме того, ученые исследовали мышечные клетки, которые сокращаются по иному принципу. Например, некоторые мышцы у моллюсков и членистоногих выдерживают силовую нагрузку в течение долгого времени — явление, иногда называемое «уловкой» или силовым гистерезисом (Hoyle, 1969). Изучение этих и других примеров пластичности мышц — захватывающие возможности для новых открытий в биологии.
БИОЛОГИЯ Том 2 - руководство по общей биологии - 2004
Когда была выявлена ультраструктура миофибрилл, две независимые группы исследователей (X. Хаксли/Дж. Хансон и А. Хаксли/Р. Нидергерке) предложили гипотезу мышечного сокращения, основанную на скольжении относительно друг друга актиновых и миозиновых нитей (рис. 18.20). Ее легко понять, вдвигая пальцы одной руки между пальцами другой: если считать обе ладони эквивалентом одного саркомера, то эта система будет укорачиваться, т. е. сокращаться. В пользу такого механизма говорит, в частности, тот факт, что при мышечном сокращении ширина зоны I и зоны Н уменьшается, тогда как ширина зоны А не меняется. Сейчас эта гипотеза окончательно подтверждена, повсеместно признана и называется теорией скользящих нитей.
Для того чтобы понять, какие силы обеспечивают скольжение, необходимо ознакомиться со строением тонких (актиновых) и толстых (миозиновых) миофиламентов.
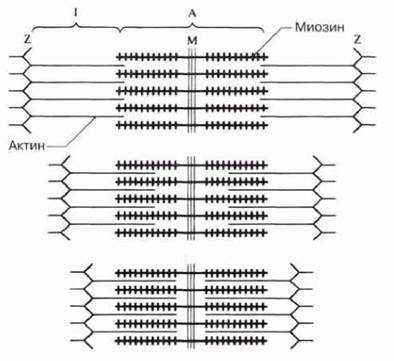
Рис. 18.20. Схема сокращения саркомера. Актиновые нити скользят вдоль нитей миозина. На толстых миофиламентах показаны миозиновые головки. (Объяснения см. в тексте.)
Миозиновые (толстые) миофиламенты
Молекула миозина состоит из двух частей: длинного палочкообразного участка («хвоста») и присоединенного к одному из его концов глобулярного участка, который представлен двумя одинаковыми «головками» (рис. 18.21, А). Молекулы миозина расположены в миозиновой нити таким образом, что головки регулярно распределяются по всей ее длине. В тех местах, где нити актина и миозина перекрываются, миозиновые головки могут прикрепляться к соседним актиновым нитям. Насколько важно такое взаимодействие, мы оценим при рассмотрении собственно механизма сокращения capкомера.

Рис. 18.21. А. Структура миозина: видны его линейная часть (хвост) и две головки. Б. Структура актина.
Актиновые (тонкие) миофиламенты
Каждый актиновый миофиламент образован двумя цепочками из глобулярных молекул актина (G-актина), закрученными одна вокруг другой наподобие спирали (рис. 18.21, Б). Весь комплекс актиновых молекул называется F-актином (фибриллярным актином). Полагают, что с каждой молекулой G-актина связана одна молекула АТФ.
Схема механизма сокращения следующая. Там, где актиновые и миозиновые миофиламенты перекрываются, миозиновые головки как крючки «зацепляются» за соседние F-актиновые нити, образуя с ними поперечные мостики. Эти мостики загибаются, как пальцы, в одном направлении, протаскивая актиновые миофиламенты вдоль миозиновых. Затем головки отделяются от актина, распрямляются, соединяются с новыми его участками, и цикл повторяется. При сокращении в каждый данный момент времени примерно половина головок «тянет», а остальные возвращаются в исходное положение, что обеспечивает плавность процесса. Энергию для него дает АТФ. Молекулы АТФ гидролизуются до АДФ и фосфата под действием АТФазы, содержащейся в миозиновых головках. Происходящие события иллюстрируются рис. 18.22. Между двумя последовательными образованиями мостиков одной головкой проходит 1/50—1/100 с. Очевидно, для этого необходимо очень интенсивное расходование АТФ. Этим объясняется наличие в мышечном волокне огромного числа митохондрий, которые восполняют запас АТФ в процессе аэробного дыхания. Саркомер способен укоротиться на 30—60% исходной длины.
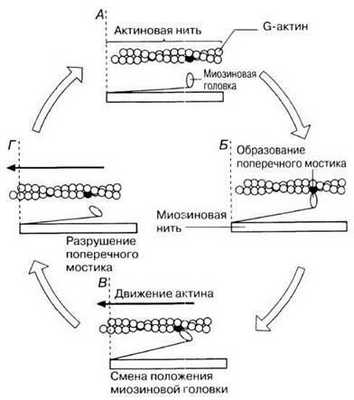
Рис. 18.22. Движение актиновой нити под действием миозиновой при мышечном сокращении. Пунктирная вертикаль в левой части каждой стадии помогает заметить происходящий сдвиг.
18.2. Как изменяется ширина зоны А при сокращении саркомера?
Как запускается и прекращается процесс сокращения? Его активируют ионы кальция (см. ниже «Роль тропомиозина и тропонина»). Они накапливаются в саркоплазматическом ретикулуме (специализированном эндоплазматическом ретикулуме мышечного волокна), который образует расширенные цистерны вокруг линий Z (рис. 18.23). Эти цистерны контактируют с поперечными трубочками (Т-трубочками, или Т-системой), образованными впячиванием сарколеммы и пронизывающими саркоплазму (цитоплазму мышечного волокна) (рис. 18.23 и 18.18). Когда нервный импульс по мотонейрону достигает нервно-мышечного соединения на поверхности мышечного волокна, потенциал действия из области концевой пластинки волной распространяется по Т-системе, передается от нее саркоплазматическому ретикулуму и приводит к высвобождению ионов кальция в саркоплазму.
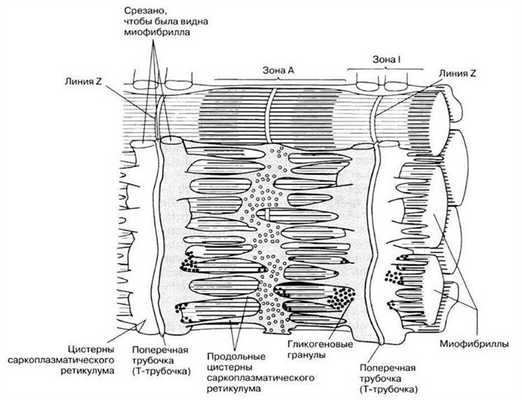
Рис. 18.23. Саркоплазматический ретикулум и Т-система.
Роль тропомиозина и тропонина
Актиновые филаменты состоят из F-актина и двух вспомогательных белков — тропомиозина и тропонина. Молекулы тропомиозина образуют две довольно растянутые спиральные цепочки, которые обвивают F-актин, как показано на рис. 18.24. Тропомиозин служит для включения и выключения механизма сокращения. С тропоми- озином связан глобулярный белок тропонин, способный обратимо присоединять ионы кальция.
Когда мышца в покое (расслаблена), тропомиозин блокирует на тонком миофиламенте участки для прикрепления миозиновых головок (рис. 18.24, А), «отключая» актин. Ионы кальция, высвобождаясь из саркоплазматического ретикулума, соединяются с тропонином, заставляя его и одновременно тропомиозин, с которым он связан, смещаться. Это приводит к разблокированию участков прикрепления миозиновых головок (рис. 18.24, Б) — актин «включается», и начинается скольжение нитей по описанному выше механизму (рис. 18.22). Когда раздражение мышечного волокна стимулирующими импульсами прекращается, ионы кальция закачиваются из саркоплазмы в саркоплазматический ретикулум кальциевым насосом вес мембране, т. е. путем активного транспорта, также требующим энергии АТФ. Тропонин и тропомиозин приобретают исходную конфигурацию, тонкий миофиламент «отключается», и мышечное волокно расслабляется.
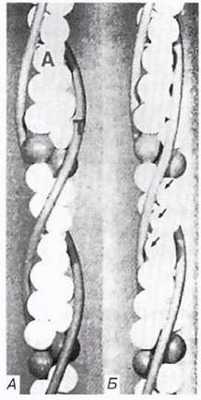
Рис. 18.24. Модем, иллюстрирующая изменение структуры актиновых нитей. А. «Выключенное» состояние при низком уровне Са 2+ : тропомиозин блокирует участки связывания миозина с актином. Б. «Включенное» состояние при высоком уровне Са 2+ : тропамиозин смещается, обнажая участки связывания с миозином (указаны стрелками). А — актин; Т — тропамиозин. Тропонин не показан, он расположен ближе к субъединицам актина.
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Читайте также:
