Третий и четвертый этап иммобилизационного стресса. Социальное покрывание макак
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Анализ крови, вытекающей из щитовидной железы крысы, показал, что острый иммобилизационный стресс усиливает секрецию тиреоидных гормонов с увеличением индекса Т3/Т4-100. Наиболее выраженная реакция на стресс наблюдалась после повторной 2-минутной иммобилизации с интервалом в 3 мин: такое повышение секреции было купировано введением прасозина, α-адреноблокатора. Пропилтиоурацил, введенный за час до эксперимента, снижал индекс конверсии Т4 в щитовидной железе. Эти результаты позволяют сделать вывод, что кратковременная повторная иммобилизация усиливает секрецию тиреоидных гормонов через стимуляцию α-адренергической системы, что сопровождается увеличением выработки гормонально более активного Т3.
Ключевые слова
Для цитирования:
For citation:
В процессе жизнедеятельности организму человека и животного постоянно приходится сталкиваться с различными стресс-факторами. Имеются многочисленные данные, показывающие, что стресс может служить патологической основой развития различных заболеваний, количество которых в последнее время непрерывно возрастает [1, 3, 6]. Считается, что основой развития болезней при длительном стрессировании организма является продолжительное влияние гормонов, участвующих в формировании стрессовой реакции и вызывающих серьезные нарушения в обмене липидов, углеводов и электролитов [3]. Есть сведения о том, что психическая травма является причиной примерно 80 % всех случаев заболеваний базедовой болезнью [4]. Однако именно функция тиреоидной оси меньше всего изучена при воздействии стресса на организм [7]. Недостаточно изучено влияние стрессовых факторов на процесс секреции и метаболизма тиреоидных гормонов, а также на изменения, вызываемые этими факторами в органах- мишенях. В связи с этим целью настоящей работы явилось изучение влияния иммобилизационного стресса на процесс секреции тиреоидных гормонов. Материалы и методы В экспериментах использовали 60 крыс-самцов линии Вистар массой тела 180-200 г. Крыс содержали в виварии в стандартных условиях на нормальной диете. Иммобилизацию осуществляли фиксированием крыс на спине в течение 2 мин с последующим повторением процедуры через 2 мин. Данный интервал был выбран в связи с указанием [2], что это время является минимальным между воздействиями, в течение которого биоэлектрические и вегетативные реакции успевают возвратиться к исходному уровню. После иммсЯ5илизации крыс анестезировали препаратом калнпсол (Са1урзо1. Будапешт, Венгрия) - 25 мг/кг, фиксировали на спине, разрезом по центральной линии вдоль трахеи открывали щитовидную железу и препарировали отходящие от ее долей вены. Для предотвращения тром- бообразования операционную область обрабатывали раствором гепарина (0,025 ЕД/мл). Сосуды, отходящие от краниального полюса и медиальной поверхности, пережигали, кровь собирали с каудального полюса обеих долей при помощи системы микроотсоса. Все исследуемые препараты животным вводили внутрибрюшинно. В плазме крови определяли концентрации тиреоидных гормонов при помощи наборов РИО-Тч-ПГ, РИО-Тз-ПГ ИБОХ, Минск, Белоруссия. Экспериментальные животные были разделены на следующие группы: И-1 -интактные животные; И-2 - иммобилизация в течение 2 мин; И-3 - двукратная иммобилизация по 2 мин с интервалом между воздействием 3 мин; И-4 - троекратная иммобилизация; И-5 - четырехкратная иммобилизация; И-6 - интактные животные; И-7 - двукратная иммобилизация с забоем на следующий день; И-8 - контроль (введение 0,9% раствора NaCl); И-9 - введение 0,9% раствора NaCl за 1 ч до иммобилизации; И-10 - введение 6-п-пропил-2-тиоурацила (1 мкг на 100 г массы тела; «Sigma», США); И-11 - введение пропранолола (1 мкг/100 г; «Sigma», США); И-12 - введение празозина (1 мкг/100 г; «Sigma», США). Результаты и их обсуждение В табл. 1 видно, что кратковременная иммобилизация вызывает значительное увеличение секреции как тироксина (Т4), так и трийодтиро- нина (Т3), причем максимальное увеличение концентрации гормонов в тиреоидной крови наблюдалось при двукратной иммобилизации. Последующее повторение стрессового воздействия сохраняло повышенный уровень секреции, но не столь ярко выраженный, как в эксперименте И-3. Следует отметить, что секреция Т3 увеличивалась значительнее, чем секреция Т4. Отношение Т3/Т4-100, принятое нами в качестве показателя тиреоидной конверсии Т4 [5], имело тенденцию к увеличению при кратковременной иммобилизации с пиком активности при двукратном стрессовом воздействии, что говорит об увеличении активности 5'-монодейодирования Т4. При повторных кратковременных иммобилизациях повышенный уровень секреции сохранялся, но недолговременно. На следующий день после стрессирования не наблюдалось разницы в уровне секреции тиреоидных гормонов (табл. 2). В работе [6] указывается на то, что щитовидная- железа вовлекается в реакцию факти- Таблица I Секреция тиреоидных гормонов при иммобилизации крыс (М±т, я=5) Показатель Группа животных И-1 И-2 | И-3 И-4 И-5 Т4, нмсо1ь/л 41,31 ± 159 68,72±0,68* 86,16±0,91* 64,52±0,47* 54,92±0,74* Тз, нмоль/л 0,7.3^0,05 3,(Ю±0,17* 5,18±0,72* 2,12±0,12* 1,85+0,07* ТЗ/Т4-100 1,76 4,37 6,01 3,34 3,39 Примечание. Здесь и в табл. 3 звездочка - достоверность изменений по сравнению с контрольными животными (р<0,001). Таблица 2 Секреция тиреоидных гормонов в различные сроки после двукратной иммобилизации (М±т, л=5) Показатель Группа животных И-6 И-7 Т4, нмоль/л 57,61 ±3,86 56.83+6,58 Т3, нмоль/л 1,33±0,38 1,32±033 Т3/Т4Л00 2,31 2,32 Таблица 3 Секреция тиреоидных гормонов при остром стрессе на фоне введения различных препаратов (М±т, Показатель Группа животных И-8 И-9 И-10 И-11 И-12 T4 нмоль/л 44,29 + 1,32 66,94±4,73* 87,П^^^Д^1 * 79,17±3,79* 46,60±2,79 Тз, нмоль/л 0,98±0,03 3,46±0,13* 1,76-±0.39* 3,38±0,64* 1,23±0,23 T3/T4-100 2,22 5,17 2,02 4,26 2,64 чески сразу после начала влияния стресс-фак- тора на организм. Увеличение секреции тиреоидных гормонов при кратковременной иммобилизации наблюдали Р. Langer и соавт. [8], однако более длительное стрессирование крыс не влияло на содержание тиреоидных гормонов в плазме крови. Увеличение образования гормонально более активного Т3 в этот период, возможно, способствует быстрой активации метаболических процессов и повышению реактивности организма, что позволяет эффективнее справляться с изменениями, вызываемыми стрессовым воздействием. Снижение до контрольных значений концентрации тиреоидных гормонов при увеличении количества повторных воздействий, видимо, связано с быстрой адаптацией организма крыс к данному виду стресса. По мнению М. Вигаш [3], у крыс психосоциальные и соматические стрессоры вызывают комплексную, но однообразную нейроэндокринную активацию, характеризующуюся мощной адренокортикальной секрецией и прекращением секреции соматотропного гормона. Р. Langer и соавт. [8] считают, что увеличение секреции тиреоидных гормонов при таком виде воздействия на организм крыс может быть опосредовано биогенными аминами, действие которых может быть блокировано а-адренергиче- скими блокирующими агентами. И действительно, мы наблюдали подавление увеличения секреции тиреоидных гормонов при введении а-блокатора празозина. Введение же Р-адреноблокатора пропранолола не вызывало значительных изменений (табл. 3). То, что при кратковременной иммобилизации увеличивается активность тиреоидной конверсии Т4, было подтверждено в экспериментах по введению специфического блокатора 5'-дейодирова- ния - 6-п-пропил-2-тиоурацила, при действии которого снижался показатель Т3/Т4-100 (см. табл. 3). Таким образом, нами было показано зависимое от катехоламинов увеличение секреции тиреоидных гормонов и активности конверсии Т4 при остром стрессе у крыс. Выводы 1. Иммобилизация крыс в течение 2 мин с повторением через 3 мин вызывает значительное увеличение секреции тиреоидных гормонов. 2. Данное увеличение секреции отменяется введением за 1 ч до воздействия а-блокатора празозина. 3. Острый стресс, вызываемый повторной иммобилизацией, увеличивает активность тиреоидной конверсии Т4.
Три стадии стресса
Стресс— одно из нормальных состояний организма, поскольку связан с повышением адаптационных механизмов. Стресс является неотъемлемым проявлением жизни. Стрессовые реакции филогенетически помогали человеку справляться с трудностями, поэтому в этом аспекте стрессовые реакции полезны. Однако, когда стресс имеет яркое выражение и длительное проявление, в таком случае он причиняет вред здоровью человека.
Наблюдения Селье
Ганс Селье считается родоначальником теории биологического стресса. В своих исследованиях Селье заметил, что организм приспосабливается к внешним стрессорам с точки зрения биологической модели, которая пытается восстановить и сохранить внутренний баланс. В своей попытке сохранить гомеостаз организм использует гормональную ответную реакцию, которая непосредственно осуществляет борьбу со стрессором.
Три фазы стрессовой реакции
1. Стадия тревоги
На стадии реакции тревоги, сигнал бедствия посылается в часть мозга, которая называется гипоталамус. Гипоталамус обеспечивает высвобождение гормонов, называемых глюкокортикоидами.
Глюкокортикоиды запускают выброс адреналина и кортизола. Адреналин дает человеку заряд энергии: сердечный ритм увеличивается, кровяное давление повышается, уровень сахара крови также повышается. Эти физиологические изменения регулируются частью вегетативной нервной системы человека, называемой симпатической ветвью.
Надпочечники начинают активно вырабатывать повышенное количество кортизола и находятся в состоянии гиперфункции. Это состояние можно подтвердить, используя паттерн изменений в гормональном профиле слюны, при котором будут следующие показатели: повышенный уровень кортизола/нормальный уровень DHEA.
2. Стадия сопротивления
Во время стадии сопротивления организм пытается противодействовать физиологическим изменениям, которые произошли во время стадии реакции тревоги. Стадия сопротивления регулируется частью вегетативной нервной системой, которая называется парасимпатической.
Парасимпатическая нервная система пытается вернуть тело в норму: уменьшается количество вырабатываемого кортизола, частота сердечных сокращений и артериальное давление начинают возвращаться к норме. Уровень сопротивляемости организма значительно выше обычного. На этой стадии осуществляется сбалансированное расходование адаптационных ресурсов.
Если стрессовая ситуация заканчивается, на этапе сопротивления тело возвращается в нормальное состояние. Однако, если стрессогенный фактор остаётся, организм остаётся настороже, чтобы бороться с его проявлениями.
Надпочечники адаптируются к этой стадии, уже используя механизм, называемый «захват прегненолона». Прегненолон является метаболитом холестерина и представляет собой исходное химическое вещество для производства как кортизола, так и половых гормонов, включая тестостерон. При изменении метаболизма прегненолона, уровень тестостерона, вырабатываемого в организме, снижается. При этой стадии, паттерн гормонального профиля в слюне будет представлен следующими показателями: повышенный уровень кортизола/низкий уровень DHEA.
3. Стадия истощения
На этом этапе стресс сохраняется в течение длительного периода. Организм начинает терять способность бороться со стрессором и уменьшать его вредное воздействие, поскольку истощается вся адаптивная способность. Стадия истощения может приводить к стрессовым перегрузкам и к проблемам со здоровьем, если они не будут решены немедленно.
В этой стадии надпочечники больше не способны адаптироваться к стрессу и исчерпали свои функциональные возможности. Сначала при исследовании гормонального профиля в слюне будут выявляться нормальный уровень кортизола/низкий уровень DHEA или уровень кортизола, характерный для гиперфункции и сниженной функции будет сочетаться с нормальным уровнем DHEA). Когда надпочечники исчерпают свои возможности, будут определяться: низкий уровень кортизола/низкий уровень DHEA.
Если стресс продолжает воздействовать и далее, истощаются запасы кофакторов, которые необходимы для производства кортизола, вследствие чего организм разрывает механизм шунтирования прегненолона и вновь переключается на выработку DHEA. Такой паттерн будет представлен низким уровнем кортизола/нормальным уровнем DHEA.
Гормоны стресса.
Адреналин: регулирует частоту сердечных сокращений;
регулирует поступление воздуха в легкие;
влияет на диаметр кровеносных сосудов и бронхов.
Кортизол: повышает уровень сахара в крови;
подавляет иммунную систему;
Самые важные гормоны формирующие стрессовую реакцию - это адреналин и норадреналин. Их синтезирует симпатическая нервная система. Другой важный класс гормонов реакции на стресс называют глюкокортикоидами, из них наиболее известен гормон кортизол. Кортизол помогает организму выстоять в стрессовой ситуации. Повышенный уровень кортизола может быть связан не только с явной опасностью для человека, но и с некоторыми изменениями в условиях жизни, которые организм воспринимает как опасность. Иногда самые благие намерения, например, занятие спортом, «здоровое» питание могут привести к нервному срыву. Но перед этим, был хронический стресс, который игнорировался. Избыточные физические нагрузки, недостаток качественного питания (диеты, недоедания), недостаток сна, злоупотребление алкоголем, эндокринные нарушения могут привести к дистрессу («плохому стрессу».
Группа глюкокортикоидных гормонов вырабатывается надпочечниками, и их действие часто похоже на действие адреналина. Адреналин начинает действовать в течение нескольких секунд, а глюкокортикоиды поддерживают его действие от нескольких минут до нескольких часов. Управление гормонами находится в зоне ответственности головного мозга.
Во время стресса поджелудочная железа начинает вырабатывать гормон глюкагон. Коктейль из глюкокортикоидов, глюкагона и секреции симпатической нервной системы повышает уровень глюкозы в крови. Глюкоза обеспечивает необходимую для реакции на стресс энергией. Активируются также и другие гормоны. Гипофиз вырабатывает пролактин, который кроме других эффектов способствует угнетению во время стресса репродуктивной функции. Гипофиз и мозг также вырабатывают особый класс эндогенных морфиноподобных веществ эндорфинов и энкефалинов, которые, среди всего прочего, притупляют ощущение боли. Наконец, гипофиз вырабатывает вазопрессин, гормон регулирующий уровень жидкости в организме, играющий важную роль в реакции сердечно-сосудистой системы на стресс. Вазопрессин поддерживает водный гомеостаз внутри организма, который необходим для жизни.
В ответ на стресс активируются некоторые железы, а различные гормональные системы во время стресса угнетаются. Снижается секреция различных гормонов репродуктивной системы, таких как эстроген, прогестерон и тестостерон. Выработка гормонов, связанных с функцией роста (например, гормона соматотропин), также угнетается, как и выработка инсулина, гормона поджелудочной железы, который в нормальных условиях помогает телу накапливать энергию, чтобы использовать ее позже.
Эти научные факты говорят о прямой связи между эмоциональным состоянием и такими заболеваниями как сахарный диабет, нарушения функционирования репродуктивной системы, сердечно-сосудистых заболеваний, различных зависимостей.
В современном мире люди ежедневно сталкиваются с огромным количеством стрессовых ситуаций. Любая из них может стать последней каплей и спровоцировать депрессию. Знать о том, как лечится стресс, необходимо: психотерапия, физическая активность, релаксация, здоровый сон и правильно питание. Взращивайте дух, чтобы не бояться душевной, физической и материальной боли, учитесь хорошо зарабатывать, занимайтесь спортом, будьте здоровы!
Ведущий лаборант кафедры
функциональной диагностики Малаховская С.Н.
Третий и четвертый этап иммобилизационного стресса. Социальное покрывание макак
ФГБУ "Российский научный центр медицинской реабилитации и курортологии" Минздравсоцразвития России, Москва
ФГБУ "Российский научный центр медицинской реабилитации и курортологии" Минздрава РФ, Москва
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Применение низкоинтенсивного электромагнитного излучения в условиях иммобилизационного стресса (экспериментальное исследование)
Журнал: Вопросы курортологии, физиотерапии и лечебной физической культуры. 2014;91(4): 47‑52
Королев Ю.Н., Бобровницкий И.П., Никулина Л.А., Михайлик Л.В., Гениатулина М.С., Бобкова А.С. Применение низкоинтенсивного электромагнитного излучения в условиях иммобилизационного стресса (экспериментальное исследование). Вопросы курортологии, физиотерапии и лечебной физической культуры. 2014;91(4):47‑52.
Korolev IuN, Bobrovnitskiĭ IP, Nikulina LA, Mikhaĭlik LV, Geniatulina MS, Bobkova AS. The application of low-intensity electromagnetic radiation under immobilization stress conditions (an experimental study). Voprosy kurortologii, fizioterapii, i lechebnoi fizicheskoi kultury. 2014;91(4):47‑52. (In Russ.).
В экспериментах на нелинейных белых крысах самцах с помощью светооптических, электронно-микроскопических, биохимических и радиоиммунологических методов исследования было установлено, что применение низкоинтенсивного электромагнитного излучения (НИ ЭМИ; плотность потока мощности меньше 1 мкВт/см2, частота около 1000 МГц) в режиме как первичной профилактики, так и лечебно-профилактического воздействия ограничивало развитие постстрессорных нарушений в семенниках, печени и тимусе и способствовало активации адаптационно-защитных и компенсаторных процессов. Полученные данные обосновывают возможность использовать НИ ЭМИ для защиты организма и его репродуктивной системы от негативного действия стрессогенных факторов.
Проблема защиты организма от действия стресса является одной из наиболее актуальных проблем современной медицины. В качестве средств, способных повысить адаптационные возможности и защитить организм от действия стресса, целесообразно использовать различные виды электромагнитных излучений (ЭМИ) как в виде монофактора, так и при сочетанных воздействиях [1, 2]. Особый интерес представляют низкоинтенсивные ЭМИ (НИ ЭМИ) сверхвысоких частот, эффекты которых еще мало изучены. Предполагается, что механизм биологического действия НИ ЭМИ, в отличие от микроволн высоких интенсивностей, связан с поглощением определенных (резонансных) частот водной средой организма, в том числе молекулами воды биомембран, с последующим модулирующим влиянием этого взаимодействия на развитие метаболических процессов, в том числе адаптационного характера [3, 4]. В частности, было показано, что НИ ЭМИ влияет на внутриклеточные механизмы регуляции гомеостаза и межклеточные контакты, активирует органы иммунной системы, повышает противоопухолевую резистентность организма, снижает уровень перекисного окисления липидов (ПОЛ) за счет конформационных изменений в структуре мембран 6. Поэтому при использовании НИ ЭМИ можно ожидать усиления процессов адаптации на клеточном и ультраструктурном уровнях и повышения общей резистентности организма к действию стресса.
Цель настоящей работы - определить влияние НИ ЭМИ на снижение уровня постстрессорных нарушений при остром иммобилизационном стрессе у крыс.
Исследования были проведены на 27 белых беспородных крысах-самцах массой 180-220 г. Работу с животными проводили в соответствии с правилами, принятыми Европейской конвенцией по защите животных, используемых для экспериментальных целей (Страсбург, 1986). Крысы были разделены на 5 групп: 1-я группа (опытная) - предварительное применение НИ ЭМИ (первичная профилактика) с последующим воздействием иммобилизационного стресса; 2-я группа (контроль к 1-й группе) - воздействие иммобилизационного стресса и ложных процедур НИ ЭМИ (без включения аппарата); 3-я группа (опытная) - воздействие иммобилизационного стресса с последующим применением НИ ЭМИ (лечебно-профилактическое применение); 4-я группа (контроль к 3-й группе) - воздействие иммобилизационного стресса и ложных процедур НИ ЭМИ (без включения аппарата); 5-я группа (интактная) - животные никаким воздействиям не подвергались.
Иммобилизационный стресс осуществляли по методике Г. Селье однократным привязыванием крыс в течение 6 ч в положении на спине. Процедуры НИ ЭМИ проводили от аппарата Акватон-2 (ООО «Телемак», Саратов), плотность потока мощности меньше 1 мкВт/см 2 , частота около 1000 МГц. Всего на курс 8 процедур, время воздействия 2 мин. Животные облучались с расстояния 2-3 см от поверхности кожи поясничной области. Забой животных проводили через 1 день после действия стресса при первичной профилактике и через 9 дней - при лечебно-профилактическом применении НИ ЭМИ. Объектом исследования являлись органы репродуктивной системы (семенники), а также печень, тимус, кровь.
Для светооптических исследований семенники фиксировали в жидкости Буэна, оценка состояния сперматогенеза проводилась по общепринятой методике [7]. Подсчитывали количество извитых семенных канальцев (ИСК) с различным числом генераций половых клеток (от 4 до 0), определяли индекс сперматогенеза. Для электронно-микроскопических исследований семенники фиксировали в 4% параформальдегиде, приготовленном на фосфатном буфере (рН 7,4), постфиксировали в 1% ОsО 4 . После обезвоживания образцы заключали в смесь эпон-аралдит. Исследование ультратонких срезов проводили на электронном микроскопе Libra 120 (Германия). Для исследования антиокислительной активности (АОА) в семенниках и печени использовали модельную систему в виде суспензии липопротеинов желтка куриного яйца [8]. Уровень ПОЛ определяли по конечному продукту перекисного окисления липидов - малоновому диальдегиду [9]. Содержание белка определяли биуретовым методом [10], содержание нуклеиновых кислот (РНК и ДНК) - двухволновым спектрофотометрическим методом в модификации [11]. В плазме крови радиоиммунологическим методом определяли кортизол и тестостерон (фирма «ИБОХ», Беларусь). Статистическую значимость различий оценивали с помощью парного критерия Стьюдента и непараметрического U-критерия Манна-Уитни. Различия считали достоверными при р≤0,05.
После действия иммобилизационного стресса у животных контрольной группы через 1 сут определялось отчетливое снижение АОА в семенниках и печени, наличие выраженных признаков дистрофии и дегенерации со стороны сперматогенных клеток, снижение индекса сперматогенеза, активация процессов ПОЛ и снижение АОА, нарушение белоксинтезирующих процессов, уменьшение массы тимуса. В дальнейшем, к 9-м суткам последействия стресса, отмечалось как усиление ряда негативных явлений, особенно в семенниках (развитие процессов деструкции в сперматогенном эпителии, повышение уровня ПОЛ, снижение содержания общего белка), так и тенденция к активации некоторых ответных адаптационных реакций (АОА в печени, функциональной активности тимоцитов). Электронно-микроскопически обнаруживались нарушения во всех слоях собственной оболочки ИСК, являющейся частью гематотестикулярного барьера. Это проявлялось, в частности, в неравномерном утолщении оболочки в 1,5-2 раза, разрыхлении и местами истончении базальной мембраны, набухании ее неклеточных слоев. Нарушения барьерных структур ИСК вызывали усиление процессов вакуолизации с образованием как мелких, так и крупных локальных отеков, которые нарушали контакты между собственной оболочкой и сперматогенными клетками. Все это свидетельствовало о существенных нарушениях процессов микроциркуляции, что приводило к расстройствам трофики и метаболизма в эпителии семенных канальцев.
Предварительное применение НИ ЭМИ повышало устойчивость организма крыс к последующему действию острого иммобилизационного стресса. При этом через сутки после стресса защитный эффект в семенниках проявлялся в лучшей сохранности клеток сперматогенного эпителия, что выражалось, в частности, в более сбалансированном количестве ИСК с 4 и 3 генерациями половых клеток по сравнению с контролем (см. таблицу). На ультраструктурном уровне явно слабее, чем в контроле, проявлялись признаки отечности собственной оболочки ИСК, реже встречались и были менее выражены локальные отеки и межклеточные расширения в сперматогенном эпителии. На этом фоне происходило усиление АОА на 22,2% (р<0,05) и повышение содержания РНК и ДНК [соответственно на 17,3% (р=0,05) и 20,6% (р<0,05) по сравнению с контролем (рис. 1, a)]. Рисунок 1. Метаболические процессы в семенниках крыс при иммобилизационном стрессе и действии НИ ЭМИ. Здесь и на рис. 2 и 3: а - первичная профилактика; б - лечебно-профилактическое воздействие; светлые столбики - контроль; темные - опыт; * - ррр<0,01) (рис. 2, a) и снижение интенсивности процессов ПОЛ на 92,6% (р<0,01), что приводило к выраженному уменьшению (более чем в 2 раза; р <0,01) окислительного потенциала в ткани печени (ПОЛ/АОА). Рисунок 2. Метаболические процессы в печени крыс при иммобилизационном стрессе и действии НИ ЭМИ. Вместе с тем на фоне повышения АОА отмечалось снижение содержания общего белка на 22,1% (р<0,01). В тимусе наблюдалась тенденция к уменьшению абсолютной и относительной массы, но при этом удельная активность генома тимоцитов возрастала на 39,6% (р<0,01) по сравнению с контролем и на 79,2% (р<0,01) по сравнению с интактными животными (рис. 3, a), что указывает на усиление функции этих клеток и иммунокорригирующее действие НИ ЭМИ. Рисунок 3. Функциональная активность тимуса крыс при иммобилизационном стрессе и действии НИ ЭМИ. 1 - масса тимуса; 2 - число ядер тимоцитов (ТМ); 3 - связывание АО в ядре ТМ; 4 - удельная активность генома ТМ. Параллельно с выявленными адаптационными сдвигами во внутренних органах в сыворотке крови обнаруживались в виде тенденции изменения стрессорного характера - содержание кортизола превышало контрольный уровень (на 11,4%), а содержание тестостерона снижалось (на 22,3%).
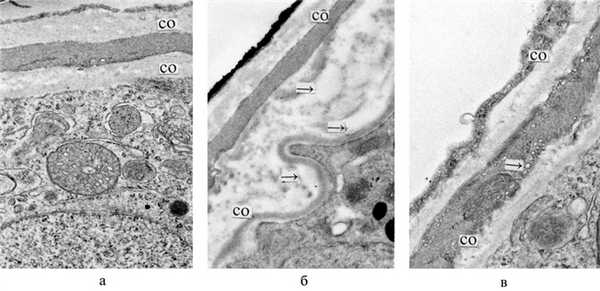
Лечебно-профилактическое применение НИ ЭМИ после действия стресса также вызывало ослабление ряда постстрессорных нарушений и усиление адаптационно-компенсаторных реакций. В семенниках это проявлялось в улучшении процессов сперматогенеза к 9-м суткам после стресса: число ИСК с 4 генерациями клеток возрастало на 48,0% (р<0,05), а число ИСК с 3 генерациями уменьшалось на 18,6% (р<0,05), что приближало эти показатели к уровню интактных животных (см. таблицу). Следует также отметить, что в отличие от контроля у животных опытной группы отсутствовали ИСК с 1 и 2 генерациями, что указывало на снижение уровня деструктивных процессов в сперматогенных клетках. Положительные изменения отмечались со стороны гематотестикулярного барьера, при этом уменьшалась толщина собственной оболочки ИСК и ее отдельных слоев, отчетливо ослаблялись локальные отеки, которые не были столь выражены, как у животных контрольной группы (рис. 4). Рисунок 4. Ультраструктурные изменения собственной оболочки ИСК при иммобилизационном стрессе и действии НИ ЭМИ. а - интактная крыса. Собственная оболочка ИСК; б - иммобилизационный стресс. Контроль. Утолщение собственной оболочки ИСК, в основном за счет выраженного отека ее внутреннего неклеточного слоя, видны мелкие локальные скопления отечной жидкости (стрелки); в - иммобилизационный стресс. Влияние НИ ЭМИ после действия стресса. Улучшение ультраструктуры собственной оболочки ИСК-ослабление явлений отека, уменьшение общей ее толщины. На данном участке собственной оболочки сохраняются процессы повышенного везикулообразования (стрелка). ×18 000. СО - собственная оболочка. Местами выявлялась активация процессов регенерации в миоидных клетках собственной оболочки в виде увеличения белоксинтезирующих органелл. Все эти благоприятные сдвиги свидетельствовали о снижении проницаемости барьерных структур и об улучшении процессов микроциркуляции. На этом фоне АОА повышалась на 24,2% (р<0,01), а содержание общего белка на 44,1% (р<0,01) (см. рис. 1, б). В печени усиление АОА на 45,4% (р<0,05) (рис. 2, б) сочеталось с повышенным уровнем ПОЛ на 61,1% (р<0,01), при этом окислительный потенциал (ПОЛ/АОА; р=0,05) становился ниже уровня контроля.
Результаты проведенного исследования свидетельствуют о том, что применение НИ ЭМИ в режиме как профилактики, так и лечебно-профилактического воздействия ограничивало развитие постстрессорных нарушений и способствовало активизации ряда адаптационно-защитных и компенсаторных процессов. Эти эффекты были обусловлены в основном антиоксидантным, а также иммуномодулирующим влиянием НИ ЭМИ на местные и общие механизмы регуляции. Среди выявленных сдвигов в первую очередь следует отметить усиление АОА, которая проявлялась как в семенниках, так и в печени в условиях профилактики и лечебно-профилактического воздействия. Активация антиокислительной системы, усиление ее мощности под влиянием НИ ЭМИ являлась важным регуляторным механизмом в защите организма от стресса, в повышении устойчивости мембранных структур сперматогенных клеток и снижении уровня деструктивных процессов. Этот антиоксидантный и цитопротекторный эффект сопровождался усилением ряда пластических процессов, которые более отчетливо проявлялись в семенниках, а также повышением функциональной активности тимуса, особенно в условиях первичной профилактики. Полученные данные показывают, что применение НИ ЭМИ может быть весьма перспективным в свете разработки новых подходов к способам усиления адаптационно-защитных и компенсаторных реакций организма при действии стресса. С целью оптимизации этих процессов, особенно с учетом недостаточного их развития в печени, следует использовать более адекватные режимы воздействия НИ ЭМИ, в том числе в комплексе с другими лечебными физическими факторами.
ИСПОЛЬЗОВАНИЕ РАЗЛИЧНЫХ МОДЕЛЕЙ ОСТРОГО ИММОБИЛИЗАЦИОННОГО СТРЕССА В ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЯХ
Стресс является выработанной в процессе эволюции совокупностью защитных и повреждающих реакций организма, которые возникают в результате нейро-эндокринных и метаболических сдвигов в ответ на действие чрезвычайных или патологических факторов. Таким образом стресс - важное звено адаптационного механизма, которое при неблагоприятном течении может стать составляющей патогенеза многих заболеваний. Проблема стресса, несмотря на достаточно длительное изучение, продолжает оставаться актуальной темой для научных исследований. Целью работы было сравнить различные модели острого иммобилизационного стресса на основании данных литературных источников и результатов собственных исследований. Использованная исследователями из Украинской медицинской стоматологи-ческой академии модель позволяет сократить время эксперимента, не требует сложного оборудования и использования дополнительных факторов стрессорного воздействия. Этот способ прост в проведении и может быть использован для изучения влияния иммобилизационного стресса на организм.
Ключевые слова:
стресс, иммобилизация, крысы
Список цитируемой литературы:
- Haydey O.S. Etiolohiya stressu / O.S. Haydey // Nauk.-tekhn. byul. in-tu biolohiyi tvaryn ta Derzh. n.-d. kontrol. in-tu vetpreparativ ta korm. dobavok. - 2012. - Vyp. 13, № 3/4. - S. 416-419.
- Koptev M.M. Otsinka morfo-funktsionalnykh zmin peryferychnykh viddiliv leheni pislya vplyvu hostroho immobilizatsiynoho stresu / M.M. Koptev // Aktualmi problemy suchasnoyi medytsyny: Visnyk Ukrayinskoyi medychnoyi stomatolohichnoyi akademiyi. - 2013. - T 13, № 4 (44). - S. 121-124.
- Kuz’mina V.Ye. Funktsional’noye sostoyaniye muzhskikh gonad i razvitiye stress-reaktsii / V.Ye. Kuz’mina // Vestnik SamGU - Yestestvennonauchnaya seriya. - 2007. - T 58, № 8. - S. 129-137.
- Netyukhaylo L.H. Mekhanizmy rozvytku i rol zmin metabolichnykh protsesiv v lehenyakh pry hostromu stresi: avtoref. dys. na zdobuttya nauk. stupenya kand. med. nauk: spets. 14.03.04 „Patolohichna fiziolohiya” / L.H. Netyukhaylo. - Odesa, 2000. - 17 s.
- Oshchepkova O.M. Zakonomernosti razvitiya stressornykh povrezhdeniy vnutrennikh organov i ikh preduprezhdeniye proizvodnymi glitsina (eksperim. issled.): avtoref. dis. na soiskaniye uchen. stepeni kand. med. nauk: spets. 14.00.16 „Patologicheskaya fiziologiya” / O.M. Oshchepkova. - Irkutsk, 1995. - 20 s.
- Pavlov S.Ye. Adaptatsiya / S.Ye. Pavlov. - M.: Parusa, 2000. - 282 s.
- Podhayetska O.YE. Zahalni ta mistsevi osoblyvosti kysnevoho metabolizmu pry tyazhkomu immobilizatsiynomu stresi ta yikh rol v patohenezi parodontytu / O.YE. Podhayetska, V.I. Portnichenko, V.I. Nosar [ta in.] // Med. reabylytatsyya, kurortolohyya, fyzyoterapyya. - 2008. - № 1. - S. 31-34.
- Podhayetska O.YE. Mekhanizmy poshkodzhennya tkanyn parodonta pry hostromu stresi ta yikh korektsiya za dopomohoyu interval'nykh hipoksychnykh trenuvan: avtoref. dys. na zdobuttya nauk. stupenya kand. med. nauk: spets. 14.03.04 „Patolohichna fiziolohiya” / O.YE. Podhayets'ka. - Odesa, 2010. - 19 s.
- Potemina TYe. Izmeneniye parametrov semennoy zhidkosti samtsov belykh krys pri razlichnykh vidakh eksperimental’nogo stressa / TYe. Potemina, S.V. Kuznetsova, V.A. Lyalyayev // Sovremennyye tekhnologii v meditsine. - 2009. - № 2. - S. 23-26.
- Ukrainskaya L.A. Stress-indutsirovannaya al’teratsiya legkikh i yeye korrektsiya mediatorami i metabolitami stress-limitiruyushchikh sistem: avtoref. dis. na soiskaniye uchen. stepeni kand. biol. nauk: spets. 14.00.16 „Patologicheskaya fiziologiya”, 03.00.25 „Gistologiya, tsitologiya, kletochnaya biologiya” / L.A. Ukrainskaya. - Irkutsk, 2002. - 17 s.
- Fomochkina I.I. Metabolichni mekhanizmy rozvytku immobilizatsiynoho stresu ta yikh korektsiya: avtoref. dys. na zdobuttya nauk. stupenya kand. med. nauk: spets. 14.03.04 „Patolohichna fiziolohiya” / I.I. Fomochkina. - Donetsk, 2007. - 20 s.
- Oishi K. Different effects of immobilization stress on the mRNA expression of antioxidant enzymes in rat peripheral organs / К. Oishi, К. Machida // Scand. J. Clin. Lab. Invest. - 2002. - Vol. 62, № 2. - P. 115-121.
Публикация статьи:
«Вестник проблем биологии и медицины» Выпуск 3 Том 2 (138), 2017 год, 13-16 страницы, код УДК 613.86
Выпусков - 47
Статей - 3183
Скачиваний - 327890
При публикации статей на сторонних ресурсах ссылка на сайт обязательна.
Здравствуйте! Про отправке сопроводительных документов к статье есть ли необходимость их перевода на английский язык (или перевод осуществляется редакцией)?
Добрый день!
Перевод осуществляется редакцией
Об издании
Профессиональное научное издание Украины (Постановление МОН Украины № 1081 от 29.09.2014).
Медицинские и биологические науки.
Свидетельство о государственной регистрации КВ №10680 от З0.11.2005 года.
ISSN 2523-4110 (Для электронной версии), ISSN 2077-4214 (Для печатной версии)
© Вестник проблем биологии и медицины 1997-2019 г.
Все права защищены.
При иммунизации животных гетерологичным антигеном было выявлено, что исходная чувствительность к гипоксии существенно влияет на выраженность клеточного и гуморального иммунитета. Полученные результаты позволяют сделать выводы о том, что низкоустойчивые иммунизированные, но нестрессированные крысы имеют более высокий уровень гуморального и клеточного иммунного ответа. Данный факт подтверждает повышенное содержание антителобразующих клеток и увеличение интенсивности гиперчувствительности замедленного типа. Можно предположить, что у нестрессированных высокоустойчивых животных более низкий уровень иммунного ответа связан с количественным перераспределением клеток в гемопоэзе и сдвинут в сторону эритропоэза. При воздействии стрессорного фактора у крыс с высокой устойчивостью к гипоксии наблюдается повышенный уровень Th-2 иммунного ответа и одновременно сниженный уровень эритропоэза. У низкоустойчивых стрессированных животных после иммунизации наблюдалась тенденция к снижению количества антителобразующих клеток. Это может быть связано как с низким уровнем цитокинов, так и со снижением к ним чувствительности.
1. Волчегорский, И.А. Роль иммунной системы в выборе адаптационной стратегии организма / И.А. Волчегорский, И.И. Долгушин, О.Л. Колесников, В.Э. Цейликман. - Челябинск, 1998. - 70 с.
2. Волчегорский, И.А. Экспериментальное моделирование и лабораторная оценка адаптационных реакций организма / И.А. Волчегорский, И.И. Долгушин, О.Л. Колесников, В.Э. Цейликман. - Челябинск, 2000. - 167 с.
3. Волчегорский, И.А. Влияние триамцинолонаацетонида на распределение лейкоцитов в системе крови, мононуклеарную инфильтрацию печени и иммунорективность при стрессорной сенсибилизации к гипоксии у крыс / И.А. Волчегорский, В.Э. Цейликман, О.Б. Цейликман, Н.В. Бубнов // Экспериментальная и клиническая фармакология. - 2005. - № 1. - С.61-66.
4. Гусев Е.Ю. Взаимоотношения клеточноопосредованного и гуморального иммунного ответа на уровне целостного организма: автореф. дис. … д-ра мед. наук. - М., 1996.
5. Лукьянова, Л.Д. Биоэнергетическая гипоксия: понятие, механизмы, коррекция. / Л.Д. Лукьянова // Бюл. экспер. биол. мед. - 1997. - Т. 124, № 9. - С. 244-254.
Введение
Одной из глобальных проблем современной биологии и медицины является проблема гипоксии. Гипоксическая гипоксия оказывает комплексное воздействие на организм и может вызывать существенные изменения в работе органов и систем организма [5]. В настоящий момент известно, что определенную роль в реакции организма в ответ на действие гипоксии выполняет иммунная система [4]. А резистентность к гипоксическому воздействию является одним из признаков адаптации организма к влиянию неблагоприятных факторов окружающей среды.
На сегодняшний день имеется большое количество исследований, посвященных влиянию различных видов гипоксии на иммунную систему. Однако не было изучено, как влияет исходная чувствительность к гипоксии на выраженность клеточного и гуморального иммунитета при различных вариантах «иммунного» и иммобилизационного стресса.
Исходя из этого, была поставлена цель исследования: определить влияние иммунизации на выраженность Th-1- и Th-2-иммунного ответа в зависимости от исходной устойчивости к гипоксии у крыс до и после иммобилизационного воздействия.
Исходя из цели исследования, были поставлены следующие задачи:
Определить влияние иммунизации на выраженность Th1- и Th2- зависимого иммунного ответа у нестрессированных животных в зависимости от исходной устойчивости к гипоксии.
Определить влияние иммунизации на выраженность Th1- и Th2- зависимого иммунного ответа у стрессированных животных в зависимости от исходной устойчивости к гипоксии.
Материалы и методы
Моделирование изучаемых состояний проводилось на лабораторных крысах массой 180-300 г обоего пола. Использовались беспородные крысы. Всего использовано 40 животных.
Гипоксическая гипоксия моделировалась при помощи барокамеры. Создаваемое в барокамере разряжение воздуха соответствовало «подъему на высоту» 10500 м над уровнем моря. На этом этапе животные были разделены на группы - высокоустойчивые (ВУ) и низкоустойчивые (НУ).
На втором этапе, животных с разной устойчивостью к гипоксии подвергали трехратному иммобилизационному стрессу. Длительность одной иммобилизации составляла 3 часа, стрессовые воздействия повторяли с интервалом в 24 часа. Иммунологический стресс моделировали путем внутрибрюшинного введения эритроцитов барана.
Через 4 дня проводили повторную иммунизацию ЭБ под апоневроз стопы. Под апоневроз контрольной стопы вводили такой же объём физиологического раствора. В качестве сенсибилизирующей дозы использовали 1×108 ЭБ, а в качестве разрешающей - 5×107 ЭБ. Выраженность реакции ГЗТ оценивали волюмометрически через 24 часа после разрешающей иммунизации антигена [2].
Определение количества АОК проводили по методу A.J. Cunningham (1965) [2].
Результаты
Выполненные исследования показали, что исходная чувствительность к гипоксии существенно влияет на выраженность клеточного и гуморального иммунного ответа.
У НУ животных отмечается более высокий уровень Th-1 и Th-2-зависимого иммунного ответа. Об этом свидетельствует повышенное содержание АОК и увеличение интенсивности ГЗТ (таблица № 1). Данный факт может свидетельствовать о повышении устойчивости к гипоксической гипоксии и при переходе от резистентной стратегии адаптации к толерантной [1,3].
Выраженность Th-1- и Th-2-зависимого иммунного ответа у иммунизированных животных с различной устойчивостью к гипоксии
Контроль НУ имм.
Контроль ВУ имм.
Относительное количество АОК, %
Примечание: U - критерий Манна - Уитни; различия считали статистически значимыми при р < 0,05.
Р - статистическая значимость различий между группами Контроль НУ имм. и Контроль ВУ имм.
Предварительный иммобилизационный стресс модифицировал выраженность иммунного ответа у животных с различной устойчивостью к гипоксии.
У стрессированных ВУ животных иммунизация вызывает более высокий уровень Th-2-зависимого иммунного ответа по сравнению с контрольной ВУ группой. Об этом свидетельствует повышенное содержание АОК (таблица № 2).
Выраженность Th-2-зависимого иммунного ответа у высокоустойчивых иммунизированных животных до и после стрессорного воздействия
ВУ Контроль имм.
Абсолютное количество АОК, 10*6
Р - статистическая значимость различий между группами ВУ контроль имм. и ВУ стресс имм.
У стрессированных НУ животных после иммунизации отмечается повышение интенсивности Th-1-зависимого иммунного ответа по сравнению с нестрессированными животными (таблица № 3).
Выраженность Th-1-зависимого иммунного ответа у высокоустойчивых иммунизированных животных до и после стрессорного воздействия
Р - статистическая значимость различий между группами Контроль НУ имм. и Стресс НУ имм.
Более низкий уровень иммунного ответа у нестрессированных ВУ крыс может быть связан с определенными перестройками в гемопоэзе. Возможно, что повышенная устойчивость к гипоксии у этой группы животных связана с активацией эритропоэза. Между тем известны данные о реципрокных отношениях между лимфопоэзом и эритропоэзом, связанных с перераспределением стволовых клеток между различными ростками гемопоэза [3].
При сравнении НУ и ВУ животных между собой установлено, что ВУ крысы имеют более высокий процент эритроидных клеток в костном мозге, чем НУ.
У ВУ крыс после завершения стресса по сравнению с контрольной группой наблюдалось снижение общего количества эритроидных клеток.
При воздействии постстрессорной иммунизации наблюдалось повышение количества эритроидных клеток у НУ животных, при этом у ВУ животных статистически значимого отклонения от контрольной иммунизированной группы не было. При сравнении стрессированных иммунизированных животных между собой было выявлено, что количество эритроидных клеток у ВУ крыс ниже, чем у НУ. Важно отметить, что одновременно со снижением уровня эритроидных клеток в этой группе наблюдалось повышение уровня АОК (таблица № 2, рисунок № 1).
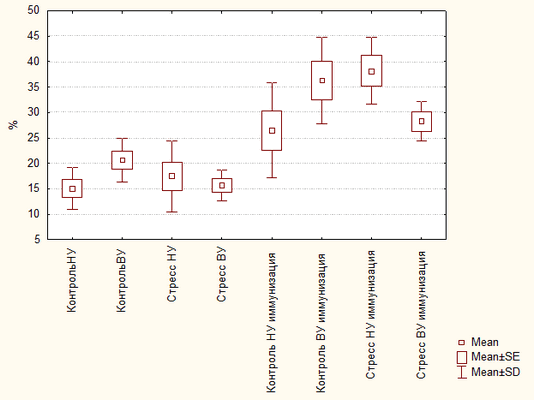
Количество эритроидных клеток в костном мозге у высокоустойчивых и низкоустойчивых крыс
Статистически значимые отличия между группами Контроль НУ и Контроль ВУ, Контроль ВУ и Стресс ВУ; Контроль НУ имм и Стресс НУ имм; Стресс НУ имм и Стресс ВУ имм, P
Вполне возможно, что повышенный уровень иммунного ответа у ВУ животных имеет цитокин-зависимый характер.
У НУ стрессированных животных после иммунизации наблюдалась тенденция к снижению количества АОК. Это может быть связано как с низким уровнем цитокинов, так и со снижением к ним чувствительности. Скорее всего, у стрессированных НУ животных развилась десенситизация к провоспалительным цитокинам, что привело к снижению иммунного ответа относительно ВУ животных. Вполне возможно, что у ВУ животных, напротив, наблюдается повышенная чувствительность к провоспалительным цитокинам, что проявляется в более высоком уровне иммунного ответа.
Таким образом, в результате полученных данных можно сформулировать следующие выводы:
У НУ нестрессированных животных отмечается более высокий уровень Th-1 и Th-2-зависимого иммунного ответа. Об этом свидетельствуют повышенное содержание АОК и увеличение интенсивности ГЗТ.
У крыс с повышенной устойчивостью к гипоксии при дополнительной иммунизации гетерологичным антигеном наблюдается более высокий уровень Th-2 имунного ответа, а также более низкий уровень эритропоэза по сравнению с крысами со сниженной устойчивостью к гипоксии. Следовательно, у иммунизированных на фоне предварительного стресса животных с повышенной устойчивостью к гипоксии повышение Th-2 имунного ответа ассоциируется с угнетением эритропоэза в костном мозге.
Резензенты:
Львовская Е.И., д.м.н., профессор, заведующий кафедрой биохимии, ФГБОУ ВПО «Уральский государственный университет физической культуры» Минспорта России, г. Челябинск.
Осиков М.В., д.м.н., профессор кафедры патофизиологии ГБОУ ВПО ЮУГМУ Минздрава России, г. Челябинск.
Читайте также:
