Тучные клетки. Функции и значение тучных клеток
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Тучные клетки (лаброциты, тканевые базофилы, мастоциты) характеризуются способностью вырабатывать, хранить и выделять биологически активные вещества - гепарин (возможно и другие гликозаминогликаны), гистамин (или комплекс «гистамин-серотонин»), активные протеолитические ферменты и др.
Одним из способов выделения тучными клетками биологически активных веществ является дегрануляция - явление выброса из клетки единичных гранул или их полное рассыпание - морфологическое выражение активной секреторной деятельности клеток. Это процесс активный, происходящий с потреблением энергии АТФ. Усиленная дегрануляция является показателем повышенной функциональной активности тучных клеток и наблюдается при действии многих факторов физической, химической, биологической природы, при антигенных воздействиях. При этом увеличивается и количество тучных клеток. В естественных условиях дегрануляция не ведет к гибели клеток, а сопровождается процессом восстановления гранул. В результате дегрануляции окружающая среда обогащается гепарином и гистамином, стимулируется внутриклеточная регенерация. Количество, структура, функциональная активность тучных клеток определяется возрастом и состоянием нейрогормональной регуляции.
Механизм дегрануляции заключается в повышении проницаемости мембраны, отделяющей гранулы от матрикса цитоплазмы, в результате чего происходит усиленное поступление в перигранулярное пространство (в силу высокой осмотической активности гепарина и аминов) воды и ионов, что ведет к набуханию гранул и отделению от них гистамина. При массивном действии повреждающих факторов происходит тотальная дегрануляция с гибелью тучных клеток. К таким дегранулирующим факторам относятся: ионизирующее излучение, гипоксия, ультрафиолетовое излучение, охлаждение, растворы солей; некоторые лекарственные препараты (рентгеноконтракстные, опиаты, кураре) органические соединения (красители тиазинового ряда, белки, полипептиды, амины), анафилотоксин (брадикинин, дистиллированная вода, гипотонический раствор). В последнем случае в основе разрушения тучной клетки лежит осмотический механизм. Выброшенные гранулы могут растворяться во внеклеточном матриксе, уноситься из зоны дегрануляции током лимфы, фагоцитироваться другими клетками СТ - макрофагами, фибробластами, эозинофилами, нейтрофилами. Однако, основным механизмом, приводящим к дегрануляции тучных клеток, является иммунный механизм, связанный с образованием циркулирующих антител. Эти антитела фиксируются на поверхности тучных клеток, которые имеют к ним специальные рецепторы. При последующем поступлении в -организм соответствующего антигена последний реагирует с антителами, изменяя микроконфигурацию поверхности тучных клеток, что служит стимулом к их дегрануляции и поступлению медиаторов во внеклеточное пространство. Этот процесс лежит в основе анафилактического типа иммунных повреждений тканей.
Дегрануляция может осуществляться двумя основными механизмами, из которых ранее был известен лишь один, известный под названием анафилактической дегрануляции тучных клеток. Он лежит в основе патогенеза различных аллергических заболеваний и изучен наиболее подробно. Второй механизм, первоначально открытый в базафильных гранулоцитах морской свинки и человека связан с постепенным выделением небольших порций содержимого гранул в межклеточное пространство. Он реализуется путем переноса медиаторов тучных клеток из гранул к внешней клеточной мембране микровизикулами. Такой механизм получил название постепенной дегрануляции или микровизикулярного транспорта. Постепенная дегрануляция является основным механизмом выделений медиаторов для осуществления регуляции различных физиологических процессов, а также при различных заболеваниях. Анафилактическая дегрануляция развивается очень быстро - первые изменения отмечаются уже спустя 5 сек. после начала активации тучных клеток и резко нарастают в течение нескольких минут. В отличие от анафилактической дегрануляции постепенная дегрануляция длится сутками.
Поскольку тучные клетки содержатся в синовиальных тканях суставов в сравнительно большом количестве (3% от числа всех нормальных синовиальных клеток) полагают, что их персистирующая дегрануляция играет определенную роль в поддержании хронического течения артритов.
Множественность продуктов секреции и многонаправленность действия их создают полифункциональность тучных клеток; различают их локальные эффекты, ограниченные местом синтеза биоактивных веществ, их диффузии от клетки к клетке и отдаленные. Кроме основных их функций (депо гистамина и гепарина) им свойственны и ряд других:
участие в регуляции гидрофильности тканей, обусловленное выделением гранул во всех случаях, когда содержание «свободной» воды в окружающей ткани оказывается повышенной;
синтез и секреция гликозаминогликанов (от гепарина до гиалуроновой кислоты), непосредственно предназначенных для построения внеклеточных структур СТ;
участие в процессах регенерации, в формировании основного вещества и коллагеновых волокон;
ингибирующая роль в процессе коллагеногенеза - торможение развития грубой компактной коллагеновой ткани;
влияние на процессы минерализации СТ;
регуляция количества свободного сульфата в ткани (и, следовательно, и процессов синтеза гликозаминогликанов);
продукция протеаз, которые могут секретироваться во внеклеточный матрикс и оказывать действие на его белковые компоненты: мукопротеиды, комплексы коллагеновых белков;
образование основного вещества, влияние на его проницаемость;
влияние на размножение, миграцию и функции фибробластов, эндотелиоцитов;
участие в регуляции процесса свертывания крови;
участие в регуляции жирового обмена;
влияние на микроциркуляторное русло;
участие в иммунных реакциях.
Тучные клетки - основные клетки-мишени аллергических реакций; принимают участие в реакциях гиперчувствительности немедленного и замедленного типа. Они вовлекаются в аллергическую реакцию посредством соединения фиксированных на клеточной мембране аллергических антител (реагентов) с аллергеном, что приводит к освобождению из тучных клеток биологически активных веществ, действующих на другие клетки и ткани и вызывающих проявление реакции гиперчувствительности немедленного типа (анафилаксии, бронхиальной астмы, крапивницы, отека Квинке, конъюнктивитов, ринитов и др.). Участие в реакциях гиперчувствительности замедленного типа осуществляется благодаря активации тучных клеток лимфокинами, выделяющимися при взаимодействии антигенспецифических Т-лимфоцитов с антигеном.
Тучные клетки

Цель исследования: В жизнедеятельности всех систем организма, в том числе гомеостаза, защитно-приспособительных реакций, процессов обмена веществ, кровообращения, дыхания и других, важную роль играют соединительная ткань и кровь. Среди различных клеток соединительной ткани особый интерес представляют тучные клетки (ТК), которые выполняют чрезвычайно важные функции: 1) участвуют в формировании и развитии воспалительного процесса; 2) регулируют процесс свертывания крови и обмен жиров; 3) обеспечивают постоянство состава соединительной ткани; 4) передают синтезированные ими вещества другим клеткам (трофоцитоз); 5) регулируют размножение и функцию фибробластов, лейкоцитов; 6) активно участвуют в образовании основного вещества, синтезе меланина, регуляции гомеостаза, иммунных и аллергических реакциях; 7) выделяют биологически активные вещества (гепарин, гистамин, серотонин, дофамин и др.). ТК свои сложные функции выполняют в тесной взаимосвязи с эозинофилами, базофилами, нейтрофилами и другими клетками соединительной ткани. В связи с этим, в последние годы возникло и успешно развивается новое научное направление, связанное с изучением возрастных изменений иммунных и аллергических реакций на клеточном уровне. Долгое время в медицинской науке господствовало мнение, что клетки всегда повреждаются в результате образования иммунного комплекса на поверхности их мембран. Сейчас точно установлено, что образование иммунных комплексов на поверхности клеток-мишеней не всегда сопровождается разрушением клеток. В большинстве случаев отмечается не разрушение, а возбуждение, то есть повышение их функциональной активности [8,43]. Эти сведения открывают новое перспективное направление, позволяющее разрабатывать фармакологические методы управления аллергическими реакциями. Возникает возможность, например, использовать лекарственные препараты, снижающие, то есть тормозящие возбудительные процессы в клетках.
Несмотря на то, что ТК посвящена большая литература многие аспекты их физиологии и патологии остаются нераскрытыми. Так, например, представляет большой научный интерес вопрос о возрастных особенностях реактивности ТК в норме и при аллергических реакциях. Дело в том, что ТК относятся к наиболее реактивным клеткам организма. Они быстро реагируют на различные экзогенные и эндогенные воздействия. Степень реагирования прямо зависит от силы действующего раздражителя. Изучение реактивности ТК в динамике аллергии позволяет определить патологический процесс на ранних стадиях их развития. Выяснение реактивности ТК позволяет косвенно судить об общем состоянии организма в целом. Кроме того, по показателям реактивности ТК можно объективно оценить эффективность применяемой терапии [12,221].
Выявление возрастных особенностей реактивности тучных клеток при аллергических реакциях, на наш взгляд, будет способствовать успешному решению отдельных фундаментальных аспектов Национальной программы М3 РУз по диагностике, лечению и профилактике аллергии [18,191].
Ключевые слова: тучные клетки, соединительная ткань, кровь, диагностика, лечение.
Введение: ТК и их гранулы впервые были описаны Ehrlich в 1877 году [40]. В литературе тучные клетки имеют свои синонимы: гепариоциты, лаброциты, мастоциты, тканевые базофилы. ТК встречаются везде, где имеется рыхлая волокнистая соединительная ткань, часто около мелких сосудов, под эпителием вблизи желез кожи, слизистых и серозных оболочек, в капсуле и трабекулах паренхиматозных органов, в лимфоидных органах и в перитонеальной жидкости. ТК найдены у всех видов млекопитающих и позвоночных. Однако имеются видовые, индивидуальные и возрастные особенности.
Представляет большой интерес обсуждение возрастных изменений ТК. У плода человека ТК появляются уже на 12-14-й неделе в стенке желудка, гортани, трахее и бронхах. До рождения ребенка число ТК в разных органах увеличено до максимального уровня. После рождения (в первые часы) до 70 % ТК находятся в состоянии дегрануляции и общее количество их уменьшается. Это явление связывают с механическим воздействием при родах. Затем с возрастом отмечается увеличение числа ТК. В целом полагают, что после рождения число ТК в соединительной ткани возрастает, а к пожилому возрасту снижается [33]. По мнению некоторых ученых, уменьшение числа ТК с возрастом объясняется блокадой белково-полисахаридного взаимодействия. Что касается показателя заполнения ТК гранулами. то здесь отмечается противоположное явление, то есть с возрастом процесс заполнения ТК гранулами повышается почти вдвое [34,36,42].
Существует тесная двусторонняя связь между ТК и эозинофилами. Эозинофилы фагоцитируют иммунные комплексы «аллерген-антитело», что приводит к разрушению эозинофильных гранул. При этом высвобождающаяся пероксидаза действует на ТК, вызывая их дегрануляцию и выхождение гистамина, который, в свою очередь, вызывает эмиграцию эозинофилов в ткани и повышение их продукции в костном мозге [2,7,39].
ТК принимают активное участие в аллергических реакциях, развивающихся по патогенезу аллергии немедленного (гуморального, химергического) типа. Это объясняется тем, что они относятся к клеткам-мишеням, на цитоппазматической мембране которых фиксируются специфические аллергические антитела (реагены). Избирательная фиксация аллергических антител на клеточной мембране ТК объясняется тем, что там имеются специальные рецепторы, предназначенные для специфических IgЕ — антител. Общее число рецепторов на клеточной мембране достигает 300.000. Рецептор представляет собой гликопротеид с молекулярной массой порядка 50000. Участок, где происходит фиксация антител является С4 домена молекулы IgЕ [13,14,28,44,51].
Аллерген, участвующий в иммунной реакции, должен быть мультивалентным, то есть содержать минимум две молекулы. Моновалентные аллергены не вызывают повышения функциональной активности ТК. Когда происходит фиксация аллергических антител на поверхности клеточной мембраны, ТК автоматически возбуждаются, что приводит к повышению их функциональной активности. Морфологически это проявляется в увеличении размера клетки, которая начинает терять свои очертания и гранулы (дегрануляция). Некоторые ученые ошибочно утверждают, что дегрануляция связана с повреждением клетки. Однако на самом деле, в большинстве случаев, при дегрануляции целостность клетки сохраняется. Об этом свидетельствует наличие следующих трёх способов секреции, то есть выделения биологически активных веществ из ТК [31,46]:
- Экзоцитозная секреция (дегрануляция без разрушения клеток); является переходной формой к апокринному типу секреции.
- Мерокринная секреция (без повреждения клетки), то есть выделение биологически активных веществ без дегрануляции ТК.
- Голокринная секреция, то есть выделение биологически активных веществ при разрушении тучных клеток.
Усиленная дегрануляция является существенным доказательством повышения функциональной активности ТК. Обычно дегрануляция сопровождается процессом восстановления гранул.
Об отсутствии разрушения ТК при аллергических реакциях свидетельствуют также следующие факты:
- Придегрануляции из тучных клеток не выходят АТФ и лактат дегидрогеназа, а также предварительно введенные в клетки радиоактивные вещества ( 4 2 К и 52 Сr).
- Противоаллергические препараты, стабилизирующие мембрану клетки, тормозят высвобождение медиаторов.
Процесс дегрануляции ТК состоит из последовательно развивающихся следующих сложных биохимических и биофизических процессов:
активация фосфолипазы при участии ионов Са 2+ —> аутокаталитическая активация эстеразы —> активация сократительных белков —> сближение и слияние перигранулярных и цитоплазматических мембран —> перемещение гранул к выходу из клетки —> увеличение пространства между гранулами и перигранулярными мембранами —> слияние перигранулярных мембран друг с другом и с общей цитоплазматической мембраной, то есть образование вакуоли —> истончение зон слияния мембраны и основание участков с повышенной проницаемостью, то есть образование пор —> выход гранул через поры во внеклеточную среду —> усиленное поступление ионов Nа + из внеклеточной среды в клетку и вытеснение биологически активных веществ из клетки во внеклеточную среду [9,47,50].
ТК клетки принимают активное участие в механизмах развития многих аллергических заболеваний: анафилактического шока, бронхиальной астмы, аллергического риносинусита, конъюнктивита, атопического дерматита, крапивницы, отека Квинке, пищевой и лекарственной аллергии, инсектной аллергии.
Анафилактический шок (АШ) известен медицине с давних времен. Первые упоминания об АШ относятся к 2641 г. до нашей эры. В исторических документах упоминается, что египетский фараон Мензес погиб от ужаления осы или шершня при острых клинических явлениях удушья и судорог, напоминающих симптомы АШ. Термин «анафилаксия» впервые в медицину ввели Портье и Рише еще в 1902 году. Впервые в региональных условиях Узбекистана экспериментальное исследование, направленное на выяснение реактивности ТК на экспериментальной модели АШ было проведено нами еще в 1968 [25]. В последние годы отмечается увеличение случаев АШ. Только в США АШ встречается у 1 из 3000 пациентов. Ежегодно от этого заболевания в США умирает 500 человек. В России заболеваемость АШ составляет 1 на 700000 населения в год [15,32].Одной из самых распространенных причин АШ являются антибиотики. Частота анафилактических реакций при применении антибиотиков составляет 0,7-10 %. Частота летальности от АШ, вызываемого антибиотиками составляет 0,002 %, то есть 1 летальный исход на 7,5 млн. инъекций препарата. Следует отметить, что нередки случаи перекрестных анафилактических реакций при использовании других представителей пенициллинового ряда из-за наличия общих антигенных детерминант. Частота перекрестных анафилактических реакций составляет 30 % [24]. Системные аллергические реакции вплоть до АШ встречаются на ужаление и укусы насекомых (ос, пчел, комаров, муравьев и т. д.). Частота анафилактических реакций на насекомых достигает 3,3 %. Частота повторных анафилактических реакций находится в пределах 60-70 %. В США ежегодно умирает от АШ, вызванного насекомыми 40-50 человек. В целом частота риска развития АШ составляет: для пенициллина — 10-20 %, для рентгенконтрастых веществ 20-40 %, для ужаления насекомыми 40-60 % Самой частой причиной АШ являются йодсодержащие рентгенконтрастные вещества. Системные реакции, угрожающие жизни встречаются в 0,1 % случаев, причём летальные исходы наблюдаются 1:10000-1:50000 внутривенных инъекций. От АШ, вызванного рентгенконтрастными веществами ежегодно погибает 500 человек. Описаны случаи АШ, вызванного пищевыми добавками (папаин, сульфиты и др.). Сульфиты присутствуют в пиве, вине, салате, свежих фруктах, овощах. Частота АШ, вызванного латексом составляет 1,5 %. Частота анафилаксии при общей анестезии составляет 1:5000-1:15000 из них летального исхода достигают 4-6 %. Основные причины (аллергены) — это альфатезин, тиопентал натрия, метогекситал и др. Бывают случаи АШ, вызванного компонентами крови и аналогичными биопрепаратами. У некоторых больных после неоднократных трансфузий донорской крови развивается АШ с летальным исходом. Описаны случаи пассивной сенсибилизации, после переливания донорской крови, содержащей высокие титры IgЕ. Анафилактические реакции могут вызывать также и плазмозаменяющие растворы. Анафилактический шок с летальным исходом встречается при осложнениях специфической терапии [15].
Клинические проявления анафилактического шока зависят от вида млекопитающих: у морских свинок преобладает острая обструкция воздухоносных путей; у кроликов острая легочная гипертензия; у собак сосудистый коллапс. К основным клиническим проявлениям АШ у человека относятся гипотония, вызванная острым периферическим сосудистым коллапсом, дыхательная недостаточность, асфиксия, вызванная ангионевротическим отеком гортани или острым бронхоспазмом. Симптомы АШ обычно проявляются через несколько секунд или минут после повторного контакта предварительно сенсибилизированного организма со специфическим аллергеном. Различие во времени проявления реакции зависит от путей проникновения в организм аллергена: при внутривенном — быстро, подкожном — позже. Основная непосредственная причина гибели организма — дыхательная недостаточность (70 %), сердечно-сосудистая недостаточность (24 %).
Патоморфологические исследования погибших от АШ выявляют — острое вздутие и отек легких: отек гортани, застойные явления во внутренних органах; повышение проницаемости сосудов и кровоизлияния в альвеолах: уртикарные высыпания; ангионевротические отеки. При микроскопическом исследовании выявляют невоспалительный отек, повышенное количество секрета в воздухоносных путях, эозинофильные инфильтраты в стенке бронхов. При летальных исходах от АШ повреждение миокарда отмечается в 80 % случаев.
Количество выделяемого гистамина при АШ прямо пропорционально числу разрушившихся ТК: чем больше разрушается ТК, тем больше количество гистамина в крови. Неслучайно ТК называют «эффекторами анафилактической реакции», ибо при АШ отмечается системная и массовая дегрануляция ТК и высвобождение большого количества гистамина. Чувствительность ТК разных видов животных неодинаковая: самая высокая у морской свинки, собаки и кролика, а у белых крыс и мышей — низкая.
Бронхиальная астма (БА) типичное аллергическое заболевание, характеризующееся полностью или частично обратимой обструкцией воздухоносных путей, воспалением и гиперреактивностыо бронхов [10,21,231]. В патогенезе бронхиальной астмы большое значение имеют ТК. В результате возбуждения их из-за взаимодействия аллергена со специфическими аллергическими антителами (IgЕ -антитела), отмечается дегрануляция и высвобождающиеся биологически активные вещества вызывают острый бронхоспазм, в результате чего развивается приступ удушья [11.20,38,48].
Патогенез аллергических ринитов определяют ТК, расположенные в больших количествах в слизистой и подслизистой оболочках носа и его придаточных пазух. При повторных воздействиях аллергена отмечается массивная дегрануляция ТК. Высвобождение гистамина и других биологически активных веществ, которые и определяют клиническое течение болезни. Выяснено, что нередко аллергические риносинуситы в последующие годы трансформируются в БА [16.17,29].
ТК играют важную роль в патогенезе аллергического конъюнктивита, крапивницы, отека Квинке, пищевой, лекарственной и инсектной аллергии [35,45]. Они принимают активное участие и в механизме псевдоаллергических реакций [11,37.49,50].
Вывод: Таким образом, анализ современной литературы свидетельствует, что проблема реактивности ТК при аллергии является актуальной. Разрабатываются различные аспекты этой проблемы. Однако мало сведений, посвященных изучению особенностей реактивности ТК при аллергии в онтогенезе. Между тем выяснение возрастных особенностей реактивности этих клеток при аллергических реакциях имеет определенное теоретическое и практическое значение.
Нами установлены возрастные особенности реактивности, количественного содержания, заполнения клеток гранулами, функциональной активности тканевых (брыжейка тонкой кишки) и перитонеальных ТК у интактных морских свинок. Выявлено, что организм морских свинок в раннем постнатальном онтогенезе (новорожденные, двухнедельные) реактивен на экзогенное аллергенное воздействие. Определено, что реактивность ТК морских свинок с возрастом повышается и у одномесячных достигает уровня реактивности половозрелых. ТК морских свинок раннего возраста принимают активное участие в механизмах развития аллергических реакций немедленного (анафилактического) типа [3,4]. Таким образом, очень велика роль ТК в возникновении аллергического раздражении организма с появлением основных признаков.
- Абба и Терр. Псевдоаллергия //В кн.: Р. Паттерсон, Л. К. Грэммер, П.АТринбергер «Аллергические болезни. Диагностика и лечение» Изд-во КЭОТАР.- М.:Медицина.- 2000.- С.618-637.
- Азизова Ф.Х., Ахмедова Х. Ю., Князева Л. С. Тучные и эозинофильные клетки слизистой толстой кишки при некоторых воздействиях // Профессор А. Т. Окилов таваллуди- нинг 70 йиллигига багишланган «Тиббий — биологик фанлар ва тиббиёт генетиканинг долзарб масалалари» илмий-амалий анжумани мацолалари туплами.- Тошкент, 2000.- Б.32-35.
- Бегманов С.А.-Сенсибилизация ва анафилактик шокда турли ёшли денгиз чучцачалари семиз хужайраларининг реактивлиги / / Педиатрия-1999.-№ 2.-Б.98-100.
- Бегманов С.А. Анафилактик типдаги аллергик реакция- ментальной модели специфической гипосенсибилизирующей иммунотерапии у морских свинок разного возраста.
- Бегманов С.А., Хакбердиев М. М. Турли ёшли денгиз чучцачаларида анафилактик гипли аллергияларни специфик иммундаволаш самарадорлигининг мезонлари//Патология, Тошкент, 2000.-№ 2.-Б.10-13.
- Бегмапов С.А., Турсунов Э. А., Хакбердыев. Роль тучных клеток в норме, при аллергии анафилактического типа и специфической терапии у морских свинок разного возраста//Бюллетень ассоциации врачей Узбекистана.-2000.-№ 1.-С.104-106.
- Беклемишев Н. Д. Аллергия, иммунитет и иммунокоррекция.- Алма-Аты: Ылым.- 1995- 168 с.
Основные термины (генерируются автоматически): АША, реакция, активное участие, анафилактический шок, летальный исход, соединительная ткань, бронхиальная астма, вещество, возрастная особенность реактивности, функциональная активность.
Возрастные особенности количества тканевых тучных клеток морских свинок при аллергических реакциях анафилактического и гистаминового типа
Цель исследования: изучение особенностей, присущих тканевым тучным клеткам брыжейки тонкой кишки в норме, при общем анафилактическом и гистамином шоках морских свинок различного возраста.
Тучные клетки функционально взаимосвязаны с базофилами и нейтрофилами крови и клетками соединительной ткани. Тучные клетки защищают организм от влияния внешней среды. Участие тучных клеток в аллергических реакциях имеет важное значение. При аллергических реакциях они выполняют роль клеток мишеней. [1,3]
Несмотря на большое количество литературы посвященной изучению тучных клеток, до сих пор до конца не найдено решение проблем, связанных с патологическим, физиологическим, морфологическим особенностями тучных клеток в процессе онтогенеза
Цель работы: изучение особенностей присущих количеству тканевых тучных клеток брыжейки тонкой кишки в норме, при общем аллергическом и гистамином шоке у морских свинок различной возрастной категории.
Материалы и методы
В качестве объекта исследования была взята брыжейка тонкой кишки морских свинок различного возраста. Во время исследования были использованы аллергологический, иммунологический, патофизиологический методы
В начале исследования были изучены тучные клетки 40 интактных морских свинок. Затем были рассмотрены и подробно изучены случаи анафилактического шока у 105 особей морских свинок, из них у 81 морской свинки были проведены опыты, 24 контроль, а также у 69 морских свинок была изучена реакция на гистаминовый шок, из них на 45 особях морских свинок были проведены опыты, 24 были контрольной группой. При этом изучены особенности дегрануляции тучных клеток брыжейки тонкой кишки.
Активная сенсибилизация и общий анафилактический шок были вызваны широко распространенным способом. В качестве аллергена была использована лошадиная сыворотка. Под кожу подопытных особей по два раза в течение дня вводилось 0,02 мл лошадиной сыворотки с целью сенсибилизации.
Решающая доза специфического аллергена была введена внутривенно или в брюшную полость дозой равной 1-2 мл. Гистаминовый шок был вызван введенным под кожу (4-6 мл/кг) или внутривенным введением (0.1 мл/кг) гистамина. Тучные клетки брыжейки тонкого кишечника для изучения были фиксированы чистым спиртом и окрашены 1 % толуидин синим в 60 % спирте. Цифровые данные для подтверждения точности были обработаны методом вариации системы статистики ti2 и Р
Похожие статьи
Особенности дифференцировки клеток эпителиального слоя.
Основные термины (генерируются автоматически): клетка, тонкая кишка, основание ворсинок, клеточная дифференцировка, поджелудочная железа
Филогенетические особенности развития половых клеток у хряков разных генотипов и процесс оплодотворения у свиней.
Лимфоидная ткань кишечника как основа иммунной системы.
Гранулы интраэпителиальных лимфоцитов и тучных клеток сходны по своему строению и химическому составу, поэтому
Пейеровы бляшки это структурно организованные и оформленные скопления лимфоидных клеток в подслизистом слое тонкой кишки.
Филогенетические особенности развития половых клеток.
Морфофункциональные особенности строения печени новорожденных норчат различных окрасочных генотипов. Особенности дифференцировки клеток эпителиального слоя слизистой оболочки тонкой кишки.
Морфофункциональные особенности строения печени.
Для изучения морфологических особенностей печени проводили эвтаназию животных (по 3 гол каждого генотипа).
Качественные показатели мяса быков различных генотипов. Филогенетические особенности развития половых клеток у хряков разных генотипов и.
Исмоилов Бекзод Бахтиер угли — Информация об авторе
Возрастные особенности количества тканевых тучных клеток морских свинок при аллергических реакциях анафилактического и гистаминового типа. №10 (114) май-2 2016 г.
Гаппаров Камолиддин Сайфутдинович — Информация об авторе
Влияние генов МС4R, POU1F1, PRLR, ESR на продуктивные.
Для проведения ДНК-генотипирования у свиней были отобраны образцы ткани площадью 1 см² (ушные выщипы).
Влияние генотипов по генам МС4R и POU1F1 на откормочную продуктивность определяли по результатам контрольного выращивания ремонтных свинок (n.
Метаболические изменения и уровень гистамина в ткани тимуса.
Ключевые слова: ожирение, тимус, тучные клетки, гистамин.
Материалы иметоды: исследование проводилось на крысах-самцах массой в среднем 179±13 г, которые были разделены на 2 группы по 10 животных в каждой: 1 группа контрольная (интактные животные).
Тучные клетки, также называемые мастоцитами и лаброцитами - это малочисленная разновидность клеток иммунитета, которые находятся в соединительной ткани и имеют большое значение в развитии аллергии. По своему строению и значению они похожи на базофилы крови.
Как выглядят тучные клетки:
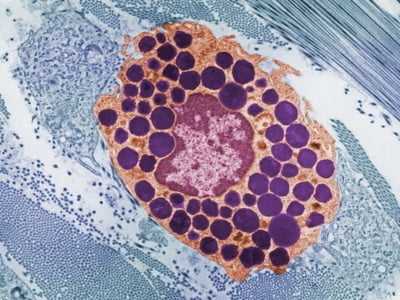
Строение тучной клетки типично: ядро, цитоплазма с заключенными в ней органеллами, мембрана. На поверхности мембраны расположены особые рецепторы - участки, к которым «приклеиваются» иммуноглобулины Е. Сами клетки очень маленькие, но, невзирая на это, на каждой из них располагается 50-300 000 рецепторов.
В цитоплазме находятся гранулы, содержащие биологически активные вещества: гистамин, гепарин, протеазы, интерлейкины.
Функции тучных клеток:
Как уже говорилось, местом «обитания» этих клеток служит соединительная ткань, в которую они мигрируют из места своего образования - костного мозга. Притом располагаются они не по всему телу, а выборочно: преимущественно возле мест возможного входа чужеродных объектов в организм (кожа, слизистая носа, гайморовых пазух, бронхов). Следовательно, их функция заключается в том, чтобы не допустить проникновения вредоносных частиц внутрь организма. Свою роль они реализуют так.
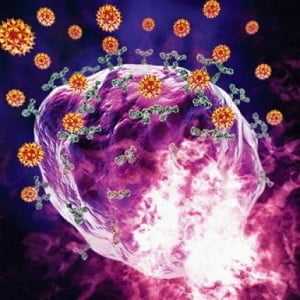
Когда в организм проникает аллерген, тучные клетки активируются. Иммуноглобулины Е, выделяющиеся лимфоцитами, прикрепляются к соответствующим рецепторам на мембранах лаброцитов и вызывают в них изменения. Их гранулы подходят к наружной мембране и сливаются с ней, выбрасывая наружу, за пределы клетки, свое биологически активное содержимое. Этот процесс называется дегрануляция тучных клеток.
Поступление в ткани выделяемого тучными клетками гистамина, гепарина и других веществ вызывает определенные биологические эффекты. Гепарин разжижает кровь и не дает ей свертываться, гистамин повышает проницаемость сосудов. В месте высвобождения этих соединений происходит отек тканей, сюда же из других частей организма привлекаются клетки, «отвечающие» за воспалительную реакцию.
Дегрануляция тучных клеток
А как это все проявляется на уровне организма? У человека возникают симптомы аллергической реакции: сыпь, зуд, отек кожи и слизистых. Участвуя в явлении аллергии, тучные клетки создают условия, при которых чужеродные частицы задерживаются в месте проникновения и не распространяются далее. Следовательно, аллергены не успевают причинить человеку такого вреда, как могли бы.
Что такое стабилизаторы тучных клеток?
Дегрануляция тучных клеток - защитное явление, однако, к сожалению, оно не всегда действует во благо. К примеру, при бронхиальной астме это скорее негативный механизм. В основе этого заболевания лежит аллергия; тучные клетки при нем реагируют на поступление аллергенов в дыхательные пути. Под влиянием веществ, которые выделяются этими клетками, возникает отек, усиление выделения слизи мелкими бронхами, а также их спазм, ведущий к приступу удушья.
Таким образом, возникает необходимость в использовании средств, которые нарушали бы этот механизм и помогали бы избежать астматических приступов. Для этого и были созданы стабилизаторы тучных клеток. Это препараты, которые подавляют высвобождение из тучных клеток гистамина, гепарина и других активных соединений, и препятствуют спазму дыхательных путей у больных.
Возникает вопрос: а если блокировать защитную реакцию организма, не приведет ли это к тому, что аллерген проникнет в тело и нанесет ущерб здоровью? Это маловероятно, потому что на тучных клетках больных людей гораздо больше рецепторов к иммуноглобулинам Е, чем у здоровых. Стало быть, эти клетки бурно реагируют на минимальное раздражение, на которое клетки здорового человека «не обратили бы внимания». Последнее означает, что никакого урона здоровью описанные лекарства не нанесут - от их применения будет только польза.
Тучные клетки. Функции и значение тучных клеток
Функциональные особенности гетерогенной популяции клеток врожденного иммунитета — тучных клеток (ТК) — обусловливают их участие в развитии многих воспалительных, аутоиммунных и опухолевых заболеваний. Разнообразие рецепторного аппарата ТК, секретируемых биологически активных медиаторов, широкая распространенность в барьерных тканях и тесная взаимосвязь с кровеносными и лимфатическими сосудами — все это позволяет ТК реализовывать множество защитных функций, в том числе в качестве эффективных участников аллергических реакций и первичных эффекторов иммунного ответа на инфекционные патогены. Ключевая роль ТК в иммуновоспалительных реакциях обусловлена синтезом и секрецией многочисленных биологически активных веществ при активации ТК рЦ 0зличными факторами (аллергенами, цитокинами, анафилатоксинами, нейропептидами, иммунными комплексами, антигенами и токсинами микроорганизмов, некоторыми лекарственными препаратами). Нарушение регуляции функций ТК может привести к негативным последствиям для организма, чем определяются особенности их участия в патогенезе ряда хронич e5ских аллергических, воспалительных, аутоиммунных и опухолевых заболеваний. Несмотря на существенное углубление представлений о патогенетической роли ТК в течении иммуновоспалительных заболеваний, сохраняют актуальность исследования механизмов их активации и регуляции, особенностей и значимости взаимодействия их медиаторов с иммунокомпетентными клетками, механизмов реализации провоспалительных эффектов ТК, что может способствовать оптимизации терапии различным заболеваний.
Ключевые слова: тучные клетки, иммунопатогенез, медиаторы, аллергическое воспаление, инфекционное воспаление, атопический дерматит.
N.V. Kolesnikova
Kuban State Medical University, Krasnodar, Russian Federation
Functional characteristics of a heterogeneous population of innate immune cells, mast cells, account for their involvement in many inflammatory and autoimmune diseases and tumors. A diversity of mast cell receptors and secreted biologically active mediators, broad presence in barrier tissues, and close relation with blood and lymphatic vessels allow mast cells to realize many protective functions (including as effective participants of allergic reactions and primary effectors of the immune response to infections). The primary role of mast cells in immune-mediated inflammation is accounted for by the synthesis and secretion of numerous biologically active substances under their activation with various factors (e.g., allergens, cytokines, anaphylotoxins, neuropeptides, immune complexes, microbial antigens and toxins, some medications). Impaired regulation of mast cell functions may have a negative effect which determines a pattern of their involvement in the pathogenesis of chro nic allergic, inflammatory, and autoimmune diseases and tumors. Despite a better understanding of the pathogenic role of mast cells in immune-mediated inflammatory disorders, studies on the mechanisms of their activation and regulation, pattern and im-portance of the interaction of their mediators with immune cells, and mechanisms of the implementation of mast cell pro-inflammatory effects are still relevant. The results of these studies are likely to optmise the treatment of a variety of diseases.
Keywords: mast cells, immune pathogenesis, mediators, allergic inflammation, infectious inflammation, atopic dermatitis.
For citation: Kolesnikova N.V. Mast cells in allergic and infectious inflammation. Russian Medical Inquiry. 2022;6(2):79-84 (in Russ.). DOI: 10.32364/2587-6821-2022-6-2-79-84.
Для цитирования: Тучные клетки при аллергическом и инфекционном воспалении. РМЖ. Медицинское обозрение. 2022;6(2):79-84. DOI: 10.32364/2587-6821-2022-6-2-79-84.
Введение
Тучные клетки (ТК) представляют собой многофункциональные эффекторные клетки врожденного иммунитета, происходящие из полипотентных ТК-коммитированных CD34 + -стволовых клеток костного мозга, которые далее транслоцируются в периферическую кровь и периферические ткани большинства экстрамедуллярных органов [1]. Между тем на ранних стадиях внутриутробного развития ТК могут развиваться непосредственно в тканях и поддерживаться там на протяжении всей жизни [2]. Физи eeлогические функции ТК, а также широкое их распространение в тканях организма определяют их привилегированное положение, позволяющее участвовать не только в иммунной защите, но и во многих физиологических процессах в рамках поддержания гомеостаза [3].
Тучные клетки — резидентные эффекторные клетки врожденного иммунитета
Ключевая роль ТК в иммуновоспалительных реакциях обусловлена продукцией и высвобождением многочисленных биологически активных веществ при активации ТК различными факторами (аллергенами, цитокинами, анафилотоксинами, нейропептидами, иммунными комплексами «IgG — комплемент», микробными продуктами (антигенами, токсинами)) и некоторыми лекарственными препаратами [4]. Секретируемые ТК медиаторы представляют три основных класса: медиаторы, предварительно сформированные и хранящиеся в цитоплазматических гранулах; липидные медиаторы, образованные из мембранных липидов; неосинтезируемые медиаторы, образующиеся при активации рецепторов ТК различными стимулами (см. таблицу) [5].
![Таблица. Медиаторы ТК [5] Table. Mast cell mediators [5]](/pimg3/tuchnie-kletki-funktsii-A43A.png)
Специфичными для ТК медиаторами являются α- и β-триптаза и химотрипсиноподобная сериновая протеаза (химаза), в соответствии с чем выделяют два типа ТК человека — триптазоположительные (локализуются в слизистой оболочке желудка, тонкой и толстой кишки) и триптазо- и химазоположительные (имеют сродство к подслизистой оболочке тонкой кишки и мышечной оболочке) [6].
Композиция молекулярных маркеров на поверхности ТК формирует их основной фенотип (FcεRI + CD13 + CD29 + CD45 + CD117 + СD123 + ), при этом FcεRI является высокоаффинным рецептором для IgE, CD117 представляет собой рецептор для фактора стволовых клеток (SCF), а CD123 — рецептор для фактора роста ТК (IL-3). Экспрессия функционально значимых поверхностных рецепторов — к C3b- и C3d-компонентам комплемента (СR), к иммуноглобулину G (FcγR), β2-интегрину, серотонину, цитокинам, а также MHC-рецепторов обоих классов и Toll-подобных рецепторов (TLR) позволяет им реагировать на различные патогенные стимулы [7].
В дополнение к участию в физиологических репаративных процессах (восстановление тканей, заживление ран, ангиогенез) ТК играют решающую роль во врожденном и адаптивном иммунитете, включая индукцию иммунологической толерантности. Однако способность ТК взаимодействовать с микроокружением с высвобождением ряда биологически активных медиаторов представляет собой довольно хрупкий баланс, при котором неадекватная регуляция функций ТК может привести к негативным последствиям для организма, чем определяются особенности их участия в патогенезе ряда хронических аллергических/воспалительных, аутоиммунных и опухолевых заболеваний [8].
Роль ТК в аллергическом воспалении
Открытие феномена IgE-опосредованного высвобождения гистамина из ТК сенсибилизированной ткани [9] положило начало исследованию роли ТК в IgE-опосредованных аллергических реакциях, запускаемых перекрестным взаимодействием поливалентных антигенов со спе-цифическими IgE, связанными с высокоаффинными FcεRI на поверхности ТК. Активация FсεRI запускает множество специфических механизмов сигнального каскада, вызывающих приток внутриклеточного кальция, приводит к активации определенных факторов транскрипции, дегрануляции ТК и продукции цитокинов [10]. Высвобождающийся при дегрануляции гистамин является ключевым фактором вазодилатации и повышения проницаемости сосудов, что в конечном итоге приводит к быстрому формированию локального отека, тогда как выброс из гранул цитокинов Ц 8 хемокинов (TNF, IL-6, CXCL1, эотаксин) способствует рекрутированию эффекторных воспалительных клеток (нейтрофилов, эозинофилов и моноцитов) [11] и сопровождается усилением синтеза de novo липидных медиаторов и дополнительных цитокинов и хемокинов.
Сложность и многофазность аллергических реакций при астме, аллергическом рините и атопическом дерматите (АтД) подтверждаются наличием не только острой, но и поздней фазы, при которой провоспалительные цитокины, высвобождаемые ТК, индуцируют лейкоцитарную инфильтрацию в очаге воспаления и запуск реакций адаптивного иммунитета, что способствует развитию хронической фазы, характеризующейся постоянным воспалением, ремоделированием тканей и фиброзом [12]. Так, в острой фазе AтД секреция IL-4 активированными ТК приводит к рекрутированию Тh2 и эозинофилов, а в хронической фазе АтД данный цитокин усиливает экспрессию FcεRI на ТК кожи и высвобождение гистамина, что способствует активации кератиноцитов с выбросом тимусного стромального лимфопоэтина (TSLP) и IL-33, дополнительно активирующих ТК через соответствующие рецепторы [13]. Кроме того, триптаза и гистамин активируют нейроны, усиливая зуд за счет дополнительной активации ТК нейропептидами (субстанция P), а макрофагальный воспалительный белок 1 (MIP-1) ТК рекрутирует моноциты/макрофаги, которые совместно с ТК способствуют усилению воспаления и развитию лихенизации кожи (рис. 1).
![Рис. 1. Роль ТК в порочном круге АтД [14] Fig. 1. The role of mast cells in a vicious cycle of atopic dermatitis [14]](/pimg3/tuchnie-kletki-funktsii-679A136.png)
Таким образом, если острое начало кожного воспаления связано с преобладанием Th2-ответа и IL-4, то при хроническом АтД доминирует активация моноцитов/макрофагов, рекрутированию которых способствует взаимодействие цитокинов и хемокинов ТК с эндотелием сосудов [14], а продолжающаяся экспрессия цитокинов, локальная экспансия Th2 и повреждение кератиноцитов, вызванное расчесыванием и возможным микробным инфицированием, усиливают воспаление за счет высвобождения IL-1β, IL-25, IL-33, TSLP [15].
Значимая репаративная роль ТК при аллерген-индуцированном воспалении, обусловленная способностью секретируемых ими протеаз инактивировать IgE, аллергены, цитокины, хемокины и вазоактивные пептиды, расщепляя их до неактивных фрагментов, свидетельствует о важных механизмах биологической обратной связи во время аллергических реакций, в которых ТК и их продукты могут участвовать в ограничении местных и системных реакций на аллергены.
Роль ТК в инфекционном воспалении
Являясь клетками врожденного иммунитета, ТК одними из первых реагируют на проникновение генетически чужеродных микробов, распознавая их патоген-ассоциированные молекулярные паттерны/образы (PAMP) посредством поверхностных и внутриклеточных патогенраспознающих рецепторов — PRR (TLR, NLR, RIG-I, MDA5) [16, 17]. При этом активация ТК агонистами PRR (TLR) сопровождается не столь быстрой дегрануляцией, как при активации FcεRI при аллергическом воспалении [18]. При защите от инфекционных патогенов ТК способны осуществлять их внутриклеточный киллинг (фагоцитоз), а также уничтожать патогены посредством выбрасываемых сетей-ловушек из внеклеточной ДНК (NET) [19] и секреции антимикробных пептидов [20].
Первичный контакт ТК с микробными патогенами часто приводит к индукции NF-κB-зависимого цитокинового каскада, включающего синтез TNF-α, IL-1β и IL-6 и других цитокинов и регуляторных факторов, баланс которых зависит от вида ткани и характера стимулирующих факторов [21]. При этом спектр провоспалительных цитокинов обусловливает привлечение в очаг воспаления воспалительных клеток: нейтрофилов, рекрутируемых TNF-α и протеазами ТК для защиты от бактерий, и естественных клеток-киллеров (NK), рекрутируемых IL-8 для борьбы с вирусами, тогда как TNF-α привлекает нейтрофилы и макрофаги для формирования гранулем вокруг клеток, инфицированных внутриклеточными паразитами [22], а интерфероны I типа и хемокины участвуют в привлечении NK- и NKT-клеток для развития ответа на вирусы [23].
Тучные клетки способствуют активации и миграции дендритных клеток в дренирующие лимфоузлы [24], а при взаимодействии с популяциями В-лимфоцитов — усилению антителогенеза, однако образующиеся антитела и некоторые цитокины (IL-10) могут негативно повлиять на функции ТК, вызывая их чрезмерную активацию в условиях присоединения вторичной инфекции [25].
Важная роль ТК не только в бактериальном клиренсе, но и в поствоспалительном репарационном процессе подтверждается экспериментальными данными о существенном замедлении репарации инфицированных ран в отсутствие ТК [26].
С точки зрения роли ТК в инфекционном воспалении кожи следует учесть их существенный вклад в патогенез инфекционных осложнений АтД (рис. 2). В частности, ТК могут защищать организм хозяина от бактерий как путем их фагоцитоза, так и посредством рекрутирования профессиональных фагоцитов (нейтрофилов). При вирусных инфекциях ТК осуществляют локальный контроль репликации вирусов и способствуют рекрутированию NK-клеток, CD4 + - и CD8 + -лимфоцитов, тогда как антипаразитарная защита ТК связана с высвобождением оксида азота (NO) и формированием внеклеточных ловушек (NET), а также рекрутированием и активацией дендритных клеток [14].
![Рис. 2. Роль ТК при инфекционном осложнении АтД [14] Fig. 2. The role of mast cells in infectious complications of atopic dermatitis [14]](/pimg3/tuchnie-kletki-funktsii-780E.png)
Подобно трансмиссивным вирусам некоторые паразиты (Leishmania spp., Plasmodium spp. и Trypanosoma spp.) проникают в организм через укусы насекомых, что сопровождается выраженной дегрануляцией ТК в месте инвазии, являющейся значимым индикатором паразитемии и тяжести заболевания [31]. Дегрануляция ТК также способствует рекрутированию и активации дендритных клеток с последующей индукцией цитотоксических реакций по Th1-типу иммунного ответа, наряду с тем, что ТК способны непосредственно убивать паразитов за счет образования активных форм кислорода и NET [32].
Тучные клетки вносят определенный вклад в защиту от микотической инфекции, распознавая антигены грибов посредством TLR или лектинового рецептора С-типа. Так, защитная роль ТК против Candida связана с их способностью к фагоцитозу и образованию NET, а также с рекрутированием в очаг инфекции воспалительных клеток — нейтрофильных гранулоцитов [33]. Однако роль ТК при микотических инфекциях не всегда позитивна: при IgE-опосредованном аллергическом бронхолегочном аспергиллезе, вызванном Aspergillus fumigatus, дегранулируемые протеазы ТК способствуют высвобождению факторов роста из клеток эпителия с развитием поражений легочной ткани и фиброза [34], а активация ТК при инфицировании Malassezia sporodialis способствует развитию АтД за счет высвобождения из ТК лейкотриена C4 , IL-6 и CCL2 [35]. Наряду с этим фагоцитоз грибов Candida albicans ТК слизистой оболочки может быть незавершенным, когда поглощенные, но не убитые микроорганизмы, разрушая ТК слизистой, нарушают ее барьерную функцию, в то время как стромальные ТК способны убивать поглощенные дрожжи и повышать иммунную толерантность слизистой за счет высокой продукции TGF-β и IL-10 [36].
Анализ приведенных сведений позволяет заключить, что ТК могут играть как позитивную, так и негативную роль при бактериальных, вирусных и грибковых инфекциях, что обосновывает определенную закономерность в эффектах локального и системного ответа ТК на исход инфекции: если локальная активация ТК в месте инфекции способствует элиминации патогена, то их системная активация способствует утрате барьерной функции, воспалению и диссеминации патогенов.
Заключение
Несмотря на накопленные сведения о гомеостатической и патологической роли ТК, многие вопросы требуют уточнения. Являясь ключевыми резидентными сигнальными клетками кожи и слизистых оболочек, способными выявлять патогены, ТК часто одними из первых активируются при инваз ии патогенов, повреждении тканей или инфекции. Успехи в понимании процесса активации ТК и влияния их медиаторов на иммунную систему выявили сложность и многофазность аллергических реакций (поздняя и хроническая фазы аллергии), что требует дальнейшего изучения роли ТК в различных фазах аллергического процесса. НеобходЦ 8мы исследования гетерогенности ТК в инфицированных тканях, ее связи с иммунным ответом и исходом заболевания, что подтверждается различным профилем медиаторов ТК различных фенотипов. Вместе с тем до сих пор ведутся споры о возможной роли ТК в здоровых тканях, о том, может ли активация ТК быть полезной при патологических процессах (у силивает процессы репарации) или она приносит вред (повреждает ткани). Остается надеяться, что будущие исследования ТК позволят получить ответы на эти вопросы, что приведет к лучшему пониманию их биологии и роли в норме и при патологии.
Сведения об авторе:
Колесникова Наталья Владиславовна — д.б.н., профессор кафедры клинической иммунологии, аллергологии и лабораторной диагностики ФПК и ППС ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. Митрофана Седина, д. 4; ORCID iD 0000-0002-9773-3408.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 07.02.2022.
Поступила после рецензирования 03.03.2022.
Принята в печать 30.03.2022.
About the author:
Natalya V. Kolesnikova — Dr. Sc. (Biol.), professor of the Department of Clinical Immunology, Allergy, and Lab Diagnostics of the Faculty of Advanced Training and Vocational Retraining of Specialists, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0002-9773-3408.
There is no conflict of interests.
Received 07.02.2022.
Revised 03.03.2022.
Accepted 30.03.2022.
Список литературы Свернуть Развернуть
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:
- Волосатая лейкоплакия языка. Географический язык. Географический стоматит. Язык при анемии.
- Анатомия: Проводящий путь слухового анализатора. Проводящий путь cлуха.
- Эпилепсия детей подростков с фокальными (парциальными) припадками
- Варианты экстрагенитальных объемных образований таза
- Назначение диагностических тестов. Скринирующие тесты
