Тучные клетки и базофилы при воспалении легких.
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Функциональные особенности гетерогенной популяции клеток врожденного иммунитета — тучных клеток (ТК) — обусловливают их участие в развитии многих воспалительных, аутоиммунных и опухолевых заболеваний. Разнообразие рецепторного аппарата ТК, секретируемых биологически активных медиаторов, широкая распространенность в барьерных тканях и тесная взаимосвязь с кровеносными и лимфатическими сосудами — все это позволяет ТК реализовывать множество защитных функций, в том числе в качестве эффективных участников аллергических реакций и первичных эффекторов иммунного ответа на инфекционные патогены. Ключевая роль ТК в иммуновоспалительных реакциях обусловлена синтезом и секрецией многочисленных биологически активных веществ при активации ТК рЦ 0зличными факторами (аллергенами, цитокинами, анафилатоксинами, нейропептидами, иммунными комплексами, антигенами и токсинами микроорганизмов, некоторыми лекарственными препаратами). Нарушение регуляции функций ТК может привести к негативным последствиям для организма, чем определяются особенности их участия в патогенезе ряда хронич e5ских аллергических, воспалительных, аутоиммунных и опухолевых заболеваний. Несмотря на существенное углубление представлений о патогенетической роли ТК в течении иммуновоспалительных заболеваний, сохраняют актуальность исследования механизмов их активации и регуляции, особенностей и значимости взаимодействия их медиаторов с иммунокомпетентными клетками, механизмов реализации провоспалительных эффектов ТК, что может способствовать оптимизации терапии различным заболеваний.
Ключевые слова: тучные клетки, иммунопатогенез, медиаторы, аллергическое воспаление, инфекционное воспаление, атопический дерматит.
N.V. Kolesnikova
Kuban State Medical University, Krasnodar, Russian Federation
Functional characteristics of a heterogeneous population of innate immune cells, mast cells, account for their involvement in many inflammatory and autoimmune diseases and tumors. A diversity of mast cell receptors and secreted biologically active mediators, broad presence in barrier tissues, and close relation with blood and lymphatic vessels allow mast cells to realize many protective functions (including as effective participants of allergic reactions and primary effectors of the immune response to infections). The primary role of mast cells in immune-mediated inflammation is accounted for by the synthesis and secretion of numerous biologically active substances under their activation with various factors (e.g., allergens, cytokines, anaphylotoxins, neuropeptides, immune complexes, microbial antigens and toxins, some medications). Impaired regulation of mast cell functions may have a negative effect which determines a pattern of their involvement in the pathogenesis of chro nic allergic, inflammatory, and autoimmune diseases and tumors. Despite a better understanding of the pathogenic role of mast cells in immune-mediated inflammatory disorders, studies on the mechanisms of their activation and regulation, pattern and im-portance of the interaction of their mediators with immune cells, and mechanisms of the implementation of mast cell pro-inflammatory effects are still relevant. The results of these studies are likely to optmise the treatment of a variety of diseases.
Keywords: mast cells, immune pathogenesis, mediators, allergic inflammation, infectious inflammation, atopic dermatitis.
For citation: Kolesnikova N.V. Mast cells in allergic and infectious inflammation. Russian Medical Inquiry. 2022;6(2):79-84 (in Russ.). DOI: 10.32364/2587-6821-2022-6-2-79-84.
Для цитирования: Тучные клетки при аллергическом и инфекционном воспалении. РМЖ. Медицинское обозрение. 2022;6(2):79-84. DOI: 10.32364/2587-6821-2022-6-2-79-84.
Введение
Тучные клетки (ТК) представляют собой многофункциональные эффекторные клетки врожденного иммунитета, происходящие из полипотентных ТК-коммитированных CD34 + -стволовых клеток костного мозга, которые далее транслоцируются в периферическую кровь и периферические ткани большинства экстрамедуллярных органов [1]. Между тем на ранних стадиях внутриутробного развития ТК могут развиваться непосредственно в тканях и поддерживаться там на протяжении всей жизни [2]. Физи eeлогические функции ТК, а также широкое их распространение в тканях организма определяют их привилегированное положение, позволяющее участвовать не только в иммунной защите, но и во многих физиологических процессах в рамках поддержания гомеостаза [3].
Тучные клетки — резидентные эффекторные клетки врожденного иммунитета
Ключевая роль ТК в иммуновоспалительных реакциях обусловлена продукцией и высвобождением многочисленных биологически активных веществ при активации ТК различными факторами (аллергенами, цитокинами, анафилотоксинами, нейропептидами, иммунными комплексами «IgG — комплемент», микробными продуктами (антигенами, токсинами)) и некоторыми лекарственными препаратами [4]. Секретируемые ТК медиаторы представляют три основных класса: медиаторы, предварительно сформированные и хранящиеся в цитоплазматических гранулах; липидные медиаторы, образованные из мембранных липидов; неосинтезируемые медиаторы, образующиеся при активации рецепторов ТК различными стимулами (см. таблицу) [5].
![Таблица. Медиаторы ТК [5] Table. Mast cell mediators [5]](/pimg3/tuchnie-kletki-bazofili-1186.png)
Специфичными для ТК медиаторами являются α- и β-триптаза и химотрипсиноподобная сериновая протеаза (химаза), в соответствии с чем выделяют два типа ТК человека — триптазоположительные (локализуются в слизистой оболочке желудка, тонкой и толстой кишки) и триптазо- и химазоположительные (имеют сродство к подслизистой оболочке тонкой кишки и мышечной оболочке) [6].
Композиция молекулярных маркеров на поверхности ТК формирует их основной фенотип (FcεRI + CD13 + CD29 + CD45 + CD117 + СD123 + ), при этом FcεRI является высокоаффинным рецептором для IgE, CD117 представляет собой рецептор для фактора стволовых клеток (SCF), а CD123 — рецептор для фактора роста ТК (IL-3). Экспрессия функционально значимых поверхностных рецепторов — к C3b- и C3d-компонентам комплемента (СR), к иммуноглобулину G (FcγR), β2-интегрину, серотонину, цитокинам, а также MHC-рецепторов обоих классов и Toll-подобных рецепторов (TLR) позволяет им реагировать на различные патогенные стимулы [7].
В дополнение к участию в физиологических репаративных процессах (восстановление тканей, заживление ран, ангиогенез) ТК играют решающую роль во врожденном и адаптивном иммунитете, включая индукцию иммунологической толерантности. Однако способность ТК взаимодействовать с микроокружением с высвобождением ряда биологически активных медиаторов представляет собой довольно хрупкий баланс, при котором неадекватная регуляция функций ТК может привести к негативным последствиям для организма, чем определяются особенности их участия в патогенезе ряда хронических аллергических/воспалительных, аутоиммунных и опухолевых заболеваний [8].
Роль ТК в аллергическом воспалении
Открытие феномена IgE-опосредованного высвобождения гистамина из ТК сенсибилизированной ткани [9] положило начало исследованию роли ТК в IgE-опосредованных аллергических реакциях, запускаемых перекрестным взаимодействием поливалентных антигенов со спе-цифическими IgE, связанными с высокоаффинными FcεRI на поверхности ТК. Активация FсεRI запускает множество специфических механизмов сигнального каскада, вызывающих приток внутриклеточного кальция, приводит к активации определенных факторов транскрипции, дегрануляции ТК и продукции цитокинов [10]. Высвобождающийся при дегрануляции гистамин является ключевым фактором вазодилатации и повышения проницаемости сосудов, что в конечном итоге приводит к быстрому формированию локального отека, тогда как выброс из гранул цитокинов Ц 8 хемокинов (TNF, IL-6, CXCL1, эотаксин) способствует рекрутированию эффекторных воспалительных клеток (нейтрофилов, эозинофилов и моноцитов) [11] и сопровождается усилением синтеза de novo липидных медиаторов и дополнительных цитокинов и хемокинов.
Сложность и многофазность аллергических реакций при астме, аллергическом рините и атопическом дерматите (АтД) подтверждаются наличием не только острой, но и поздней фазы, при которой провоспалительные цитокины, высвобождаемые ТК, индуцируют лейкоцитарную инфильтрацию в очаге воспаления и запуск реакций адаптивного иммунитета, что способствует развитию хронической фазы, характеризующейся постоянным воспалением, ремоделированием тканей и фиброзом [12]. Так, в острой фазе AтД секреция IL-4 активированными ТК приводит к рекрутированию Тh2 и эозинофилов, а в хронической фазе АтД данный цитокин усиливает экспрессию FcεRI на ТК кожи и высвобождение гистамина, что способствует активации кератиноцитов с выбросом тимусного стромального лимфопоэтина (TSLP) и IL-33, дополнительно активирующих ТК через соответствующие рецепторы [13]. Кроме того, триптаза и гистамин активируют нейроны, усиливая зуд за счет дополнительной активации ТК нейропептидами (субстанция P), а макрофагальный воспалительный белок 1 (MIP-1) ТК рекрутирует моноциты/макрофаги, которые совместно с ТК способствуют усилению воспаления и развитию лихенизации кожи (рис. 1).
![Рис. 1. Роль ТК в порочном круге АтД [14] Fig. 1. The role of mast cells in a vicious cycle of atopic dermatitis [14]](/pimg3/tuchnie-kletki-bazofili-6CD3.png)
Таким образом, если острое начало кожного воспаления связано с преобладанием Th2-ответа и IL-4, то при хроническом АтД доминирует активация моноцитов/макрофагов, рекрутированию которых способствует взаимодействие цитокинов и хемокинов ТК с эндотелием сосудов [14], а продолжающаяся экспрессия цитокинов, локальная экспансия Th2 и повреждение кератиноцитов, вызванное расчесыванием и возможным микробным инфицированием, усиливают воспаление за счет высвобождения IL-1β, IL-25, IL-33, TSLP [15].
Значимая репаративная роль ТК при аллерген-индуцированном воспалении, обусловленная способностью секретируемых ими протеаз инактивировать IgE, аллергены, цитокины, хемокины и вазоактивные пептиды, расщепляя их до неактивных фрагментов, свидетельствует о важных механизмах биологической обратной связи во время аллергических реакций, в которых ТК и их продукты могут участвовать в ограничении местных и системных реакций на аллергены.
Роль ТК в инфекционном воспалении
Являясь клетками врожденного иммунитета, ТК одними из первых реагируют на проникновение генетически чужеродных микробов, распознавая их патоген-ассоциированные молекулярные паттерны/образы (PAMP) посредством поверхностных и внутриклеточных патогенраспознающих рецепторов — PRR (TLR, NLR, RIG-I, MDA5) [16, 17]. При этом активация ТК агонистами PRR (TLR) сопровождается не столь быстрой дегрануляцией, как при активации FcεRI при аллергическом воспалении [18]. При защите от инфекционных патогенов ТК способны осуществлять их внутриклеточный киллинг (фагоцитоз), а также уничтожать патогены посредством выбрасываемых сетей-ловушек из внеклеточной ДНК (NET) [19] и секреции антимикробных пептидов [20].
Первичный контакт ТК с микробными патогенами часто приводит к индукции NF-κB-зависимого цитокинового каскада, включающего синтез TNF-α, IL-1β и IL-6 и других цитокинов и регуляторных факторов, баланс которых зависит от вида ткани и характера стимулирующих факторов [21]. При этом спектр провоспалительных цитокинов обусловливает привлечение в очаг воспаления воспалительных клеток: нейтрофилов, рекрутируемых TNF-α и протеазами ТК для защиты от бактерий, и естественных клеток-киллеров (NK), рекрутируемых IL-8 для борьбы с вирусами, тогда как TNF-α привлекает нейтрофилы и макрофаги для формирования гранулем вокруг клеток, инфицированных внутриклеточными паразитами [22], а интерфероны I типа и хемокины участвуют в привлечении NK- и NKT-клеток для развития ответа на вирусы [23].
Тучные клетки способствуют активации и миграции дендритных клеток в дренирующие лимфоузлы [24], а при взаимодействии с популяциями В-лимфоцитов — усилению антителогенеза, однако образующиеся антитела и некоторые цитокины (IL-10) могут негативно повлиять на функции ТК, вызывая их чрезмерную активацию в условиях присоединения вторичной инфекции [25].
Важная роль ТК не только в бактериальном клиренсе, но и в поствоспалительном репарационном процессе подтверждается экспериментальными данными о существенном замедлении репарации инфицированных ран в отсутствие ТК [26].
С точки зрения роли ТК в инфекционном воспалении кожи следует учесть их существенный вклад в патогенез инфекционных осложнений АтД (рис. 2). В частности, ТК могут защищать организм хозяина от бактерий как путем их фагоцитоза, так и посредством рекрутирования профессиональных фагоцитов (нейтрофилов). При вирусных инфекциях ТК осуществляют локальный контроль репликации вирусов и способствуют рекрутированию NK-клеток, CD4 + - и CD8 + -лимфоцитов, тогда как антипаразитарная защита ТК связана с высвобождением оксида азота (NO) и формированием внеклеточных ловушек (NET), а также рекрутированием и активацией дендритных клеток [14].
![Рис. 2. Роль ТК при инфекционном осложнении АтД [14] Fig. 2. The role of mast cells in infectious complications of atopic dermatitis [14]](/pimg3/tuchnie-kletki-bazofili-0CD0B.png)
Подобно трансмиссивным вирусам некоторые паразиты (Leishmania spp., Plasmodium spp. и Trypanosoma spp.) проникают в организм через укусы насекомых, что сопровождается выраженной дегрануляцией ТК в месте инвазии, являющейся значимым индикатором паразитемии и тяжести заболевания [31]. Дегрануляция ТК также способствует рекрутированию и активации дендритных клеток с последующей индукцией цитотоксических реакций по Th1-типу иммунного ответа, наряду с тем, что ТК способны непосредственно убивать паразитов за счет образования активных форм кислорода и NET [32].
Тучные клетки вносят определенный вклад в защиту от микотической инфекции, распознавая антигены грибов посредством TLR или лектинового рецептора С-типа. Так, защитная роль ТК против Candida связана с их способностью к фагоцитозу и образованию NET, а также с рекрутированием в очаг инфекции воспалительных клеток — нейтрофильных гранулоцитов [33]. Однако роль ТК при микотических инфекциях не всегда позитивна: при IgE-опосредованном аллергическом бронхолегочном аспергиллезе, вызванном Aspergillus fumigatus, дегранулируемые протеазы ТК способствуют высвобождению факторов роста из клеток эпителия с развитием поражений легочной ткани и фиброза [34], а активация ТК при инфицировании Malassezia sporodialis способствует развитию АтД за счет высвобождения из ТК лейкотриена C4 , IL-6 и CCL2 [35]. Наряду с этим фагоцитоз грибов Candida albicans ТК слизистой оболочки может быть незавершенным, когда поглощенные, но не убитые микроорганизмы, разрушая ТК слизистой, нарушают ее барьерную функцию, в то время как стромальные ТК способны убивать поглощенные дрожжи и повышать иммунную толерантность слизистой за счет высокой продукции TGF-β и IL-10 [36].
Анализ приведенных сведений позволяет заключить, что ТК могут играть как позитивную, так и негативную роль при бактериальных, вирусных и грибковых инфекциях, что обосновывает определенную закономерность в эффектах локального и системного ответа ТК на исход инфекции: если локальная активация ТК в месте инфекции способствует элиминации патогена, то их системная активация способствует утрате барьерной функции, воспалению и диссеминации патогенов.
Заключение
Несмотря на накопленные сведения о гомеостатической и патологической роли ТК, многие вопросы требуют уточнения. Являясь ключевыми резидентными сигнальными клетками кожи и слизистых оболочек, способными выявлять патогены, ТК часто одними из первых активируются при инваз ии патогенов, повреждении тканей или инфекции. Успехи в понимании процесса активации ТК и влияния их медиаторов на иммунную систему выявили сложность и многофазность аллергических реакций (поздняя и хроническая фазы аллергии), что требует дальнейшего изучения роли ТК в различных фазах аллергического процесса. НеобходЦ 8мы исследования гетерогенности ТК в инфицированных тканях, ее связи с иммунным ответом и исходом заболевания, что подтверждается различным профилем медиаторов ТК различных фенотипов. Вместе с тем до сих пор ведутся споры о возможной роли ТК в здоровых тканях, о том, может ли активация ТК быть полезной при патологических процессах (у силивает процессы репарации) или она приносит вред (повреждает ткани). Остается надеяться, что будущие исследования ТК позволят получить ответы на эти вопросы, что приведет к лучшему пониманию их биологии и роли в норме и при патологии.
Сведения об авторе:
Колесникова Наталья Владиславовна — д.б.н., профессор кафедры клинической иммунологии, аллергологии и лабораторной диагностики ФПК и ППС ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. Митрофана Седина, д. 4; ORCID iD 0000-0002-9773-3408.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 07.02.2022.
Поступила после рецензирования 03.03.2022.
Принята в печать 30.03.2022.
About the author:
Natalya V. Kolesnikova — Dr. Sc. (Biol.), professor of the Department of Clinical Immunology, Allergy, and Lab Diagnostics of the Faculty of Advanced Training and Vocational Retraining of Specialists, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0002-9773-3408.
There is no conflict of interests.
Received 07.02.2022.
Revised 03.03.2022.
Accepted 30.03.2022.
Список литературы Свернуть Развернуть
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Базофилия
Базофилия (базофильный лейкоцитоз) - это увеличение содержания базофилов более 150 в 1 мкл крови или более 1% от общего количества лейкоцитов. Очень часто сопутствует эозинофилии, так как базофилы и эозинофилы принимают совместное участие во многих патологических реакциях. Причины базофилии ‒ аллергические, воспалительные, онкогематологические заболевания. Каких-либо специфических проявлений нет, клиническая картина определяется основной патологией. Измерение уровня базофилов проводится в общем анализе крови. Для устранения базофилии необходимо лечение болезни, на фоне которой она возникла.
Классификация
Увеличение процентного содержания базофилов при нормальном уровне лейкоцитов называется относительной базофилией. Повышение количества базофилов наряду с общим лейкоцитозом - это абсолютная базофилия. По патогенетическому механизму развития выделяют следующие виды базофилии:
- Реактивная. Самая распространенная разновидность. Причиной являются аллергические и воспалительные заболевания.
- Неопластическая (злокачественная). Связана с онкогематологическими болезнями. Характерен высокий базофильный лейкоцитоз.
Причины базофилии
Физиологические состояния
Существует так называемая физиологическая базофилия, которая не связана ни с какими патологическими процессами. Чаще всего встречается у женщин (во время беременности, в период овуляции и середине лютеиновой фазы менструального цикла), так как высокая концентрация эстрогенов вызывает базофильный лейкоцитоз. У маленьких детей причиной одновременной базофилии и моноцитоза является прорезывание молочных зубов. Иногда базофилия возникает в период выздоровления от инфекций (ветряной оспы, гриппа, туберкулеза).
Аллергии
Наиболее частой причиной базофилии выступают IgE-опосредованные реакции гиперчувствительного типа. Такие реакции лежат в основе крапивницы, атопического дерматита, бронхиальной астмы и т.д. При взаимодействии аллергена с IgE-рецепторами на мембране базофилов происходит их дегрануляция и высвобождение большого количества гистамина, лейкотриенов и интерлейкинов (медиаторов аллергического воспаления). Также базофилы секретируют особый белок - эозинофильный хемотаксический фактор, стимулирующий приток эозинофилов к очагу воспаления. Степень базофилии незначительная, она быстро разрешается после устранения клинических симптомов.
Глистные инвазии
Еще одна распространенная причина базофилии, особенно среди детей, - гельминтозы: анкилостомидоз, аскаридоз, токсокароз. Это объясняется тем, что базофилы способны вызывать хемотаксис (целенаправленное движение) эозинофилов, которые являются главным противопаразитарным орудием иммунной системы. Несмотря на это, базофилия считается менее чувствительным маркером глистных инвазий, чем эозинофилия. Концентрация базофилов повышается незначительно и только в острый период (стадия миграции личинки), затем возвращается к нормальным показателям.
Воспалительные заболевания
Причиной базофилии нередко становятся болезни, сопровождающиеся воспалением. В основном это касается аутоиммунного воспаления соединительной ткани, которое наиболее характерно для ревматологических патологий. Точный патогенетический механизм базофилии при этих заболеваниях не установлен. У детей базофильный лейкоцитоз в основном наблюдается во время активной фазы острой ревматической лихорадки, у взрослых - при неспецифическом язвенном колите и диффузных болезнях соединительной ткани (системной красной волчанке). Базофильный лейкоцитоз свидетельствует об очень интенсивном воспалительном процессе в тканях, во время ремиссии базофилы остаются в пределах нормы.
Злокачественные болезни крови
Главной причиной высокой базофилии (до 4-5%) признаны онкогематологические патологии, а именно, хронический миелолейкоз, тучноклеточный лейкоз (злокачественная форма системного мастоцитоза), истинная полицитемия (болезнь Вакеза). Механизм базофильного лейкоцитоза заключается в опухолевом (клональном) перерождении клетки-предшественницы в костном мозге и гиперпродукции базофилов. Одновременное повышение базофилов с эозинофилами (базофильно-эозинофильная ассоциация) - один из лабораторных признаков бластной трансформации хронического миелолейкоза (финальной стадии заболевания, характеризующейся очень высоким риском летальности).
Редкие причины
- Эндокринные расстройства: тяжелая степень гипотиреоза (микседема).
- Болезни крови: гемолитические анемии, гемофилии.
- Прием лекарственных препаратов: эстрогенсодержащих средств (оральных контрацептивов).
- Воздействие ионизирующего излучения.

Диагностика
Чтобы выяснить причину базофильного лейкоцитоза, необходимо обратиться к медицинскому специалисту. Врач расспрашивает пациента, не перенес ли он недавно инфекционное заболевание, не страдает ли он аллергической патологией. Если имеются какие-то симптомы (боли в суставах, похудание, спонтанные кровотечения), о них обязательно нужно упомянуть. Также назначается дополнительное обследование, включающее:
- Анализы крови. Выполняется подсчет общего числа лейкоцитов и лейкоцитарной формулы. Определяется концентрация маркеров воспаления - СОЭ, СРБ. Методом ИФА выявляются специфические антитела (IgM, IgG) к антигенам гельминтов. Проводится анализ на наличие аутоантител - антистрептолизина, Ат к двуспиральной ДНК. Для диагностики хронического миелолейкоза информативно обнаружение филадельфийской хромосомы с помощью цитогенетического исследования. Посредством иммунофенотипирования клеток крови находят опухолевые CD-маркеры.
- Аллергодиагностика. Аллергическая природа заболевания подтверждается высоким содержанием иммуноглобулина Е (IgE) в крови. Для выявления причинного («виновного») аллергена проводятся специальные кожные и провокационные пробы - нанесение на кожу, внутрикожное введение, вдыхание различных аллергенов. Также выполняются тесты дегрануляции тучных клеток (прямой или непрямой).
- Инструментальные исследования. Для диагностики бронхиальной астмы важную роль имеет спирометрия с лекарственной пробой. При ревматизме на эхокардиографии отмечается поражение клапанов, иногда ‒ выпот в полость перикарда. При онкогематологических заболеваниях на УЗИ органов брюшной полости обнаруживается гепатоспленомегалия. При язвенном колите на фиброколоноскопии видны гиперемия и язвенные дефекты слизистой оболочки.
- Гистологические исследования. При подозрении на злокачественную болезнь крови обязательно выполняется стернальная пункция либо трепанобиопсия для получения образца костного мозга. При его микроскопическом изучении отмечается диффузная гиперплазия гранулоцитарного ростка, большое количество бластных клеток.

Коррекция
Кратковременное повышение базофилов во время выздоровления от острой вирусной инфекции или в период беременности - абсолютно нормальное и безвредное явление, не требующее никакого вмешательства. Стойкий, а тем более высокий (до 5%) базофильный лейкоцитоз, требует коррекции путем лечения болезни, послужившей причиной для его развития.
- Противоаллергическое лечение. Для устранения симптомов аллергии в первую очередь рекомендуется максимальное ограничение контакта с аллергеном, также применяются антигистаминные препараты (лоратадин, цетиризин) и глюкокортикостероиды (преднизолон). Метод, позволяющий полностью избавиться от аллергии - аллергенспецифическая иммунотерапия (АСИТ).
- Дегельментизация. При глистных инвазиях используются противогельминтные лекарственные препараты (мебендазол, альбендазол). Очень часто дополнительно назначаются противоаллергические средства.
- Противовоспалительное лечение. При аутоиммунных заболеваниях применяются медикаменты, подавляющие воспалительный процесс - глюкокортикоиды, иммуносупрессанты (метотрексат, циклофосфамид), производные 5-аминосалициловой кислоты (сульфасалазин), производные аминохинолина (гидроксихлорохин).
- Лечение онкогематологических болезней. При злокачественных заболеваниях крови назначаются курсы химиотерапии из комбинации цитостатических препаратов (иматиниб, винбластин, винкристин). При истинной полицитемии для подавления патологического гемопоэза эффективны гидроксимочевина и альфа-интерферон.
Прогноз
Базофилия сама по себе не приносит никакого вреда здоровью. В некоторых случаях она может быть индикатором неблагоприятного прогноза (например, внезапное возникновение базофилии свидетельствует развитии бластного криза при хроническом миелолейкозе). Тем не менее, прогноз главным образом определяется основным заболеванием. Поэтому при обнаружении базофильного лейкоцитоза нужно обращаться к врачу для выяснения его причины.
1. Дифференциальный диагноз внутренних болезней: Алгоритмический подход/ Хили П.М., Джекобсон Э.Дж. - 2014.
3. Патофизиологиясистемы крови. Часть II. Нарушения в системе лейкоцитов/ Николаева О.В., Кучерявченко М.А., Шутова Н.А. и др. - 2016.
Эозинофильная пневмония ( Легочная эозинофилия , Пневмония Лёффлера , Синдром Лера-Киндберга , Эозинофильный летучий инфильтрат легкого )
Эозинофильная пневмония - это аллерго-воспалительное поражение легочной ткани, сопровождающееся образованием неустойчивых мигрирующих инфильтратов эозинофильной природы и развитием гиперэозинофилии. Заболевание обычно протекает с недомоганием, субфебрилитетом, небольшим сухим кашлем, иногда со скудной мокротой; при острой форме - с болью в груди, миалгией, развитием острой дыхательной недостаточности. Установить эозинофильную пневмонию позволяют данные рентгенографии и КТ легких, общего анализа крови, бронхоальвеолярного лаважа, аллергопроб, серодиагностики. Основу лечения составляют специфическая гипосенсибилизация и гормональная терапия.
МКБ-10
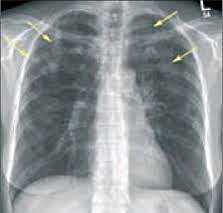
Общие сведения
Эозинофильная пневмония (эозинофильный «летучий» инфильтрат легкого) - респираторное заболевание, связанное с патологическим накоплением эозинофилов в альвеолах и повышением их уровня в крови и мокроте. Эозинофильная пневмония чаще диагностируется у населения и туристов в странах с тропическим климатом (Индонезии, Индии, Малайзии, тропической Африке, Ю. Америке).
Эозинофильная пневмония протекает по типу долевой пневмонии или бронхопневмонии, затрагивает обычно верхние отделы легких. Отмечается очаговое или диффузное воспаление альвеол, интерстициальной ткани, сосудов, бронхиол с их обильной инфильтрацией эозинофилами. Типичен преходящий характер инфильтратов с полным регрессом без вторичных рубцовых и склеротических изменений тканей.
Выделяют 3 формы легочной эозинофилии - простую (пневмония Лёффлера), острую и хроническую (синдром Лера-Киндберга). На хронизацию процесса указывают длительное (>4 недель) сохранение и рецидивирование эозинофильных инфильтратов. Эозинофильной пневмонией одинаково часто болеют лица обоего пола, преимущественно в 16-40-летнем возрасте; хроническая форма чаще развивается у женщин, страдающих бронхиальной астмой.
Причины
Эозинофильное поражение легочной ткани инициируют патогены инфекционно-аллергической и аллергической природы, вызывающие сенсибилизацию организма пациента. В качестве них могут выступать:
- Паразитарная (глистная) инвазия. В 1932 г Лёффлер впервые определил роль гельминтов в этиологии эозинофильной пневмонии, возникающей при транзиторном повреждении легочной ткани в процессе миграции личинок паразитов через легкие. К появлению пневмонии Лёффлера может привести практически любой гельминтоз - аскаридоз, стронгилоидоз, шистосомоз, анкилостоматоз, парагонимоз, токсокароз, трихинеллез и др. Довольно часто при легочной эозинофилии выявляются нематоды Toxocara cati и T. canis, аскариды собак и кошек. Личинки и яйца глистов могут попадать в ткань легких с током крови, взрослые паразиты (Paragonimus westermani) - через кишечную стенку, диафрагму и плевру, вызывая эозинофильное воспаление с образованием инфильтратов.
- Ингаляционные и лекарственные аллергены. Эозинофильная пневмония может быть результатом аллергической реакции на прием медикаментов (пенициллина, ацетилсалициловой кислоты, сульфаниламидов, нитрофуранов, изониазида, гормональных и рентгенконтрастных препаратов, соединений золота), на контакт с химическими агентами на производстве (солями никеля), цветочной пыльцой (ландыша, лилии, липы). Пневмония Леффлера может быть проявлением сывороточной болезни, иметь связь с аллергией на туберкулин.
- Грибковая инфекция. Атопическая сенсибилизация дыхательного тракта к спорам грибов (особенно, рода Aspergillus) также способствует развитию эозинофильных легочных инфильтратов.
Патогенез
Развитие эозинофильной пневмонии опосредовано реакциями гиперчувствительности немедленного типа. Помимо гиперэозинофилии в крови пациентов часто выявляется повышенный уровень IgE (гипериммуноглобулинемия). За образование аллерго-воспалительных очагов в легочной ткани ответственны тучные клетки, активированные иммунными (IgE) и неиммунными (гистамином, системой комплемента) механизмами и продуцирующие медиаторы аллергии (главным образом, эозинофильный хемотаксический фактор анафилаксии). В ряде случаев эозинофильная пневмония развивается за счет выработки преципитирующих антител к антигенам (реакции по типу феномена Артюса).
Симптомы эозинофильной пневмонии
Клиническая картина бывает весьма вариабельной. Аллергическое воспаление легких может иметь бессимптомное течение с отсутствием или очень скудной выраженностью жалоб и определяться только рентгенологическим и клинико-лабораторным методом. Часто пневмония Лёффлера протекает с минимальными проявлениями, манифестируя симптомами катарального ринофарингита. Больные ощущают легкое недомогание, слабость, повышение температуры до субфебрильной, небольшой кашель, чаще сухой, иногда с незначительной вязкой или кровянистой мокротой, болезненность в области трахеи.
При массивном гематогенном распространении яиц и личинок глистов в организме присоединяется сыпь на коже, зуд, одышка с астматическим компонентом. Эозинофильная инфильтрация других органов сопровождается легкими, быстро исчезающими признаками их поражения - гепатомегалией, симптомами гастрита, панкреатита, энцефалита, моно- и полиневропатией.
Острая эозинофильная пневмония протекает тяжело, с интоксикацией, фебрилитетом, болью в груди, миалгией, быстрым (в течение 1-5 суток) развитием острой дыхательной недостаточности, респираторного дистресc-синдрома. Для хронической формы типично подострое течение с потливостью, потерей массы тела, нарастанием одышки, развитием плеврального выпота.
Эозинофильная пневмония обычно длится от нескольких дней до 2-4 недель. Выздоровление может наступать спонтанно. При хронической форме продолжительное существование инфильтратов и рецидивы способствуют постепенному прогрессированию заболевания, развитию легочного фиброза и дыхательной недостаточности.
Диагностика эозинофильной пневмонии включает проведение рентгенографии и КТ легких, общего анализа крови, анализа кала на яйца глист, бронхоальвеолярного лаважа, аллергопроб, серологических (РП, РСК, ИФА) и клеточных тестов (реакции дегрануляции базофилов и тучных клеток). Пациенты с эозинофильной пневмонией, как правило, имеют предшествующий аллергологический анамнез. Аускультация определяет небольшое количество влажных мелкопузырчатых хрипов или крепитацию. При обширных инфильтратах заметно укорочение легочного звука при перкуссии. Инструментально-лабораторный комплекс:
- Рентгенография легких. На снимках видны субплеврально расположенные одиночные (реже множественные, двусторонние) нечеткие затемнения средней интенсивности неправильной формы размером до 3-4 см. В окружении инфильтрата легочный рисунок усилен, тень корня легкого слегка расширена. Характерна быстрая динамика инфильтратов с миграцией по легочным полям и исчезновением не позднее 1-2 недель после обнаружения (чаще через 1-3 дня) без остаточной рубцовой деформации. При длительно поддерживающемся инфильтративном воспалении в ткани легких могут образоваться фиброзные очаги и кистозные полости.
- Лабораторные данные. В периферической крови на начальной стадии заболевания регистрируется лейкоцитоз, гиперэозинофилия (10-25%), при хронизации процесса уровень эозинофилов близок к норме. Часто выявляется высокое содержание в крови IgE (до 1000 МЕ/мл). В анализе лаважной жидкости также появляются эозинофилы (при острой форме - до 40% и более) и кристаллы Шарко-Лейдена. Анализ кала, проводимый с учетом цикла развития паразитов, при некоторых гельминтозах позволяет обнаружить яйца глист. По данным биопсии в альвеолах и интерстиции определяются эозинофилы, лимфоциты и макрофаги, гранулемы, поражение мелких сосудов.
- Аллергопробы. Этиологическая диагностика эозинофильной пневмонии включает провокационные назальные и ингаляционные тесты, кожные пробы с аллергенами пыльцы, гельминтов, спор грибов, серологические анализы. «Никелевая» эозинофильная пневмония обычно сочетается с аллергическим контактным дерматитом и подтверждается положительным компрессным (аппликационным) тестом с никелем.
- ФВД. Бронхиальную проходимость оценивают при проведении спирометрии, бронхомоторных тестов.
Дифференцировать эозинофильную пневмонию необходимо с пневмониями бактериального и вирусного генеза, туберкулезом, синдромом Вайнгартена, альвеолитом, десквамативным интерстициальным фиброзом. При атопической отягощенности показана консультация аллерголога, при респираторном рините - отоларинголога.
Лечение эозинофильной пневмонии
Основным в лечении является устранение действия этиологически значимого фактора: контакта с аллергенами (аэроаллергенами, лекарствами), проведение дегельминтизации. Назначаются антигистаминные препараты, противопаразитарные средства. Имеются случаи спонтанного выздоровления без фармакотерапии. В случае тяжелой глистной инвазии с обезвоживанием организма или невозможности полного изъятия аллергена из окружающей среды лечение проводится стационарно, в отделении пульмонологии.
При острой форме эозинофильной пневмонии применяются глюкокортикоиды, на фоне которых происходит быстрая (в течение 48 часов) регрессия воспаления. Дозу ГК подбирают индивидуально и снижают постепенно во избежание обострения. В тяжелых случаях требуются ИВЛ, длительная гормональная терапия. При бронхообструкции показаны ингаляционные ГК, бета-адреномиметики. Для лучшего отхождения мокроты используются отхаркивающие средства, дыхательная гимнастика. Проводится лечение сопутствующей бронхиальной астмы.
Прогноз и профилактика
Прогноз эозинофильной пневмонии в целом благоприятный, возможно самопроизвольное разрешение инфильтратов. Правильное лечение и наблюдение пульмонолога позволяет избежать хронизации процесса и рецидивов. Профилактика эозинофильной пневмонии сводится к мерам гигиены, предотвращающим заражение организма гельминтами, контролю за приемом медикаментов, ограничению контакта с аэроаллергенами, проведению специфической гипосенсибилизации. При необходимости рекомендуется смена места работы.
2. Легочные эозинофилии: диагностика, подходы к терапии/ Э.Х.Анаев, А.Г.Чучалин// Пульмонология. - 2012 -№ 4.
3. Эозинофильная пневмония в практике врача-терапевта: трудности диагностики/ Болдырева Л.Н., Пантелеева Е.Н.//Справочник поликлинического врача. - 2011 - №9.
4. Трудности этиологической диагностики легочной эозинофилии/ Николаева С.С., Растомпахова Т.А.// Сибирский медицинский журнал. - 2011.
Лейкоцитоз
Лейкоцитоз - это увеличение содержания в периферической крови лейкоцитов выше 9000 в 1 мкл (9х109/л). Наблюдается при широком спектре нозологий, особенно бактериальных и вирусных инфекциях, системных воспалительных патологиях ревматического характера. Какие-либо специфические клинические проявления отсутствуют. Симптоматика определяется причиной, т.е. болезнью, на фоне которой развился лейкоцитоз. Уровень лейкоцитов измеряется при заборе венозной или капиллярной крови утром через 12 часов после последнего приема пищи. Подсчет лейкоцитов является частью общего анализа крови. Для коррекции лейкоцитоза проводится лечение основного заболевания.
Лейкоцитозы разделяются по различным критериям. По биологическому значению выделяют физиологическое и патологическое повышение лейкоцитов в крови. Физиологический лейкоцитоз не несет никакого вреда и наблюдается у каждого здорового человека при определенных обстоятельствах - во время интенсивной мышечной работы (миогенный), через 2-3 часа после приема пищи (алиментарный), во втором триместре беременности (гестационный). Причиной патологического лейкоцитоза выступают заболевания. По степени увеличения уровня лейкоцитов выделяют:
- Умеренный лейкоцитоз. Количество лейкоцитов от 9000 до 15000.
- Высокий лейкоцитоз. Содержание лейкоцитов от 15000 до 50000.
- Гиперлейкоцитоз (лейкемоидная реакция). Концентрация лейкоцитов свыше 50000. Часто присутствует большое количество незрелых форм белых клеток крови.
Помимо уровня лейкоцитоза важное значение имеет то, какой именно тип лейкоцитов вышел за пределы нормальных показателей. В зависимости от вида лейкоцитов различают следующие виды лейкоцитоза:
- Нейтрофильный (нейтрофилез). Увеличение нейтрофилов выше 75%. Причиной являются бактериальные инфекции, нагноительные процессы.
- Лимфоцитарный (лимфоцитоз). Содержание лимфоцитов больше 38% (у детей до 7 лет - выше 55%). Частые причины - вирусные инфекции, лимфопролиферативные заболевания.
- Моноцитарный (моноцитоз). Увеличение моноцитов выше 10%. Причинами служат гранулематозные процессы, протозойные инфекции, септический эндокардит.
- Эозинофильный (эозинофилия). Содержание эозинофилов больше 5%. Основными причинами являются глистные инвазии, аллергические реакции, некоторые болезни легких.
- Базофильный (базофилия). Увеличение базофилов выше 1%. Очень редкое состояние. Причиной выступают аллергии, истинная полицитемия, неспецифический язвенный колит.
Причины лейкоцитоза
Инфекции
Наиболее частой причиной лейкоцитоза считаются различные инфекции (бактериальные, вирусные, паразитарные). Так как главная функция всех лейкоцитов - поддержание противоинфекционного иммунитета, присутствие в организме чужеродного патогена сопровождается реактивным увеличением в крови белых кровяных телец. Причем определенный вид микроорганизма вызывает различные виды лейкоцитоза.
- Бактериальные инфекции. При бактериальных инфекциях повышается содержание в крови нейтрофилов и моноцитов, которые путем фагоцитоза и «кислородного взрыва» уничтожают патогены. При локализованных инфекциях (ангина, пиелонефрит, бронхит) лейкоцитоз обычно незначительный. Выраженные гнойные процессы (абсцесс, флегмона, остеомиелит) и генерализованные инфекции (сепсис, эндокардит) характеризуются высоким лейкоцитозом, иногда встречается лейкемоидная реакция. Отличительная особенность лейкоцитоза, причиной которого стала бактериальная инфекция - сдвиг лейкоцитарной формулы влево, т.е. появление в крови «молодых», незрелых форм нейтрофилов (метамиелоцитов, промиелоцитов). При острых процессах лейкоцитоз резко нарастает и достигает максимума на 1-2 день заболевания, затем постепенно уменьшается и приходит в норму. При хронических бактериальных инфекциях уровень лейкоцитов может быть на верхней границе нормы или слегка превышать ее.
- Вирусные инфекции (грипп, корь, мононуклеоз). Становятся причиной повышения в крови лимфоцитов, которые обладают способностью запускать в вирусных клетках механизм апоптоза и вырабатывать против них специфичные антитела (иммуноглобулины). Лимфоцитоз чаще всего умеренный, может сохраняться длительное время (недели, месяцы, годы), особенно при персистирующих вирусных инфекциях (цитомегаловирус, вирус Эпштейн-Барра).
- Глистные инвазии. Инфицирование гельминтами (аскаридами, острицами, анкилостомами) считается одной из самых частых причин эозинофильного лейкоцитоза. Эозинофилы содержат в своих гранулах эозинофильный катионный белок, который нарушает обменные процессы в теле гельминтов. Эозинофилия возникает примерно на 5-й день болезни, стремительно растет и достигает очень высоких значений к 35-40 дню, а затем начинает медленно (на протяжении нескольких недель) снижаться до нормальных цифр.

Системные заболевания
Причиной лейкоцитоза часто становятся хронические системные воспалительные процессы. Точные патогенетические механизмы повышения лейкоцитов при этих патологиях еще неизвестны. Предполагается, что медиаторы и цитокины, образующиеся при ревматическом воспалении, стимулируют в костном мозге выработку лейкоцитов. В основном это касается следующих ревматических заболеваний:
- Болезни суставов: ревматоидный артрит, анкилозирующий спондилоартрит.
- Диффузные болезни соединительной ткани: системная красная волчанка, дерматомиозит, склеродермия.
- Системные васкулиты: неспецифический аортоартериит, гранулематоз с полиангиитом, гигантоклеточный артериит.
При артритах и диффузных заболеваниях соединительной ткани лейкоцитоз обычно умеренный. При системных васкулитах с некротизирующим воспалением в сосудистой стенке лейкоцитоз может достигать высоких цифр.
Аллергия
Это основная причина эозинофильного лейкоцитоза. Попадание в организм аллергена вызывает IgE-опосредованную дегрануляцию тучных клеток с высвобождением медиаторов аллергического воспаления - лейкотриенов, гистамина и пр. Одной из главных функций эозинофилов является подавление выработки медиаторов воспаления, поэтому любая аллергическая реакция сопровождается повышением уровня эозинофилов.
Максимальный уровень эозинофилии достигается в момент обострения аллергической реакции, затем он постепенно снижается по мере регресса симптомов и возвращается к нормальным показателям в стадию ремиссии. При большинстве аллергических заболеваний (бронхиальная астма, риноконъюнктивит) наблюдается умеренный лейкоцитоз. Лишь при развитии системных реакций (синдром Стивенса-Джонса, DRESS-синдром) может встречаться высокий лейкоцитоз.
Болезни крови
Злокачественные миелопролиферативные (лейкозы, полицитемия) и лимфопролиферативные (лимфомы) патологии считаются основной причиной гиперлейкоцитоза. Он обусловлен онкологической трансформацией стволовых клеток костного мозга и лимфатической ткани с последующей гиперпродукцией лейкоцитов. При лейкозах наблюдается нейтрофильный, моноцитарный или эозинофильный лейкоцитоз, при лимфомах - лимфоцитоз.
При острых лейкозах, помимо лейкоцитоза, отмечаются такие признаки, как лейкемический провал, который подразумевает наличие только зрелых лейкоцитов и бластных клеток и отсутствие промежуточных форм (метамиелоцитов), базофильно-эозинофильную ассоциацию (одновременное резкое увеличение базофилов и эозинофилов). Лейкоцитоз нарастает медленно, в течение нескольких лет. Достигает высоких цифр (до 100 000) и постепенно снижается под действием химиотерапии.
Другие причины
- Массивный распад тканей: инфаркт миокарда, ишемический инсульт, панкреонекроз, обширные ожоги.
- Токсическое воздействие на костный мозг: отравления свинцом, органическими углеводородными соединениями, ионизирующее излучение.
- Эндокринные расстройства: хроническая надпочечниковая недостаточность, аутоиммунные полигландулярные синдромы, врожденная дисфункция коры надпочечников.
- Первичные иммунодефициты: синдром Вискотта-Олдрича, синдром Джоба (гипер-IgE-синдром).
- Злокачественные новообразования: мелкоклеточный рак легких, рак молочной железы, аденокарцинома толстой кишки.
- Болезни легких: легочные эозинофилии (эозинофильные пневмонии), гистиоцитоз из клеток Лангерганса, аллергический бронхолегочный аспергиллез.
- Дерматологические заболевания: экзема, герпетиформный дерматит Дюринга, чесотка.
- Состояние после удаления селезенки (спленэктомии): как компонент постспленэктомического синдрома.
Лейкоцитоз выявляется во время исследования клинического анализа крови. Так как причин повышения уровня лейкоцитов довольно много, сначала следует обратиться к врачу-терапевту. Врач собирает подробный анамнез, проводит физикальное обследование больного, включающее измерение температуры тела, осмотр кожных покровов и слизистых оболочек и пр. На основании полученных данных с целью подтверждения заболевания, вызвавшего лейкоцитоз, назначаются следующие исследования:
- Анализы крови. В крови определяются маркеры воспаления - высокая СОЭ и СРБ, аутоантитела (ревматоидный фактор, АЦЦП, антитела к цитоплазме нейтрофилов). Обязательно проводится подсчет лейкоцитарной формулы (процентное соотношение форм лейкоцитов). Изучается мазок крови на предмет наличия токсической зернистости нейтрофилов, атипичных мононуклеаров, теней Боткина-Гумпрехта. В случае подозрения на септическое состояние измеряется пресепсин.
- Выявление патогена. Для идентификации инфекционного возбудителя как причины лейкоцитоза проводится бактериальный посев крови, мокроты, мочи. Методом иммуноферментного анализа определяются антитела (иммуноглобулины класса G и M) к бактериям, вирусам, гельминтам, а при помощи полимеразной цепной реакции обнаруживаются их ДНК.
- Аллергодиагностика. С целью подтверждения аллергической природы заболевания измеряется уровень иммуноглобулина Е (IgE) методом ИФА. Для выявления причинного аллергена выполняются базофильные тесты, различные аллергологические пробы - кожные (скарификационные, аппликационные, прик-тесты), провокационные (назальные, ингаляционные, конъюнктивальные).
- Рентгенография. При пневмониях на рентгенографии органов грудной клетки отмечаются инфильтраты в легких, очаги затемнения, на рентгене суставов у больных артритами - сужение суставной щели, остеопороз, эрозии костной ткани. При остеомиелите на рентгенографии костей обнаруживаются утолщение надкостницы, секвестрационные очаги (участки некроза кости).
- УЗИ. При пиелонефрите на ультразвуковом исследовании ОБП выявляется увеличение размера почек, расширение и уплотнение чашечно-лоханочной системы. Для инфекционного мононуклеоза характерна гепатоспленомегалия. На эхокардиографии могут быть видны вегетации на клапанах, выпот в полость перикарда.
- Гистологические исследования. При подозрении на лейкоз выполняется трепанобиопсия или стернальная пункция, в материале которых обнаруживается гиперплазия гранулоцитарного ростка, большое количество бластных клеток. Для диагностики лимфом проводится аспирационная биопсия увеличенного лимфатического узла, в биоптате выявляется лимфоцитарная гиперклеточность, разрастание коллагена, гигантские клетки Березовского-Штернберга.

Лечение при лейкоцитозе
Симптоматического лечения лейкоцитоза не существует. Для нормализации уровня белых кровяных клеток необходимо бороться с основной патологией, которая послужила причиной лейкоцитоза. При незначительном лейкоцитозе в период выздоровления от инфекционного заболевания не нужно никакого медицинского вмешательства. Однако даже умеренное повышение в крови лейкоцитов, сохраняющееся длительное время, требует консультации специалиста для выяснения причины.
Для терапии болезней, сопровождающихся лейкоцитозом, применяются антибактериальные, противовирусные, противогельминтные лекарственные препараты. Если высокое содержание лейкоцитов обусловлено ревматологической патологией, используются средства, подавляющие воспалительный процесс (глюкокортикостероиды, иммуносупрессанты). Аллергические реакции эффективно купируются антигистаминными медикаментами и ГКС.
Если причиной лейкоцитоза явились злокачественные гематологические заболевания, необходим длительный курс химиотерапии, а в некоторых случаях - аллогенная трансплантация костного мозга. Нагноительные процессы (флегмоны, абсцессы) подлежат хирургическому вмешательству, которое подразумевает рассечение мягких тканей, промывание и дренирование очага. При эндокардите может потребоваться пластика или протезирование клапанов.
Лейкоцитоз сам по себе не может быть предиктором последствий или осложнений. По нему невозможно предсказать прогноз и риск летального исхода. Исход напрямую зависит от причины, т.е. болезни, вызвавшей лейкоцитоз, а также от степени ее тяжести. Например, острая респираторная вирусная инфекция практически всегда протекает доброкачественно, заканчивается полным выздоровлением и никак не влияет на продолжительность жизни. Такие патологии, как системные васкулиты, гемобластозы, характеризуются высоким процентом смертности. Поэтому при любом уровне повышения лейкоцитов в крови показано тщательное обследование, направленное на выяснение причины и своевременное начало лечения.
1. Патофизиология системы крови. Часть II. Нарушения в системе лейкоцитов/ Николаева О.В., Кучерявченко М.А., Шутова Н.А. и др. - 2016.
4. Синдромная диагностика и базисная фармакология заболеваний внутренних органов, в 2 томах. Том 2/ под рел. Г.Б. Федосеева, Ю.Д. Игнатова. - 2004.
Анализ крови при пневмонии
Воспалительный процесс в легких (пневмония) - это часто встречаемое заболевание, которое нередко протекает скрыто, проявляясь невыраженными симптомами, приводит к осложнениям, в тяжелых случаях к смерти больного. Воспалительный процесс в легких вызывают различные возбудители - микоплазма, вирусы, бактерии.
Если врач Юсуповской больницы подозревает воспаление легких у пациента, больного направляют на исследования - клинические исследования крови (общий и биохимический анализ) и мочи. Диагноз ставится на основании осмотра пациента, симптомов, клинических исследований крови, мокроты, мочи, рентгенологического исследования, а также ряда дополнительных исследований в случае необходимости - МРТ или КТ, биопсии и других исследований.
Клинический анализ крови при пневмонии
Определенные показатели анализа крови говорят о наличии воспалительного процесса в легких:
- лейкоциты - это белые кровяные тельца, которые отвечают за иммунитет. Лейкоциты имеют много разновидностей клеток, исполняющих определенные функции. К лейкоцитам принадлежат эозинофилы, нейтрофилы, базофилы, плазматические клетки, лимфоциты, моноциты. Пневмония в легкой форме проявляется умеренным лейкоцитозом крови, сдвигом лейкоцитарной формулы влево. Средняя тяжесть заболевания характеризуется выраженным лейкоцитозом со сдвигом влево. Тяжелая стадия пневмонии характеризуется очень высоким лейкоцитозом, сдвигом лейкоцитарной формулы влево до миелоцитов. Отсутствие лейкоцитоза указывает на сниженный иммунитет больного, часто встречается у пожилых и ослабленных, при неблагоприятном прогнозе заболевания;
- эритроциты. Исследование учитывает скорость оседания эритроцитов. Резкое увеличение скорости оседания эритроцитов (при отсутствии сопутствующих патологий) указывает на развитие пневмонии;
- нейтрофилы. Токсическая зернистость клеток отмечается при тяжелой стадии заболевания;
- эозинофилы. При тяжелой стадии пневмонии происходит снижение количества эозинофилов. Рост эозинофилов наблюдается у больного перед кризом заболевания - это указывает на благоприятный прогноз пневмонии;
- моноциты. Количество моноцитов увеличивается при благоприятном прогнозе пневмонии перед кризом заболевания;
- лимфоциты. Тяжелая стадия заболевания характеризуется снижением количества лимфоцитов;
- СОЭ. При легкой и средней тяжести воспаления легких отмечается повышение СОЭ. Тяжелая стадия заболевания характеризуется очень высоким СОЭ. Нормы СОЭ для мужчин и женщин варьируются: у мужчин 1-10, у женщин 2-15. У пожилых людей норма СОЭ повышается от 20 до 30, также повышение СОЭ происходит во время беременности от 30 до 40.
Биохимический анализ крови помогает определить состояние и работу внутренних органов, анализ дает информацию о состоянии метаболизма, потребности организма пациента в микроэлементах.
Показатели крови при пневмонии у детей
Исследования крови у взрослого пациента при развитии пневмонии отличаются от исследований крови у ребенка - иммунитет ребенка работает иначе, чем у взрослых. Анализ крови у маленького пациента должен рассматриваться в зависимости от возраста малыша. Очень часто явные признаки вирусной пневмонии в анализе крови у взрослого будут являться нормой у малыша.
Пневмония у детей встречается как основное или сопутствующее заболевание. Нередко пневмония развивается после коклюша или гриппа, может развиться после ожога или как аспирационная пневмония. Изменение лейкоцитарной формулы (лейкопения или лейкоцитоз) у детей говорит об инфекции или нарушении кроветворной функции. При пневмонии происходит повышение СОЭ, изменяется скорость оседания эритроцитов.
Тяжелая стадия воспаления легких у детей характеризуется обезвоживанием, анемией. Повышается уровень эритроцитов при тяжелой форме бактериальной пневмонии, также значительно повышается количество лейкоцитов, при других видах пневмонии уровень эритроцитов может находится в норме или снижен. При бактериальной пневмонии происходит снижение уровня лимфоцитов, определяется большое количество палочкоядерных нейтрофилов различных форм.
Лечение пневмонии в Юсуповской больнице
Детям и взрослым назначают при воспалении легких анализ крови. Симптомы, жалобы пациента, результаты обследования, осмотра пациента помогают врачу в постановке диагноза. В Юсуповской больнице работает современная клиническая лаборатория, на базе больницы создана инновационная диагностическая база. Пациенты с пневмонией проходят лечение в терапевтическом отделении, в стационаре Юсуповской больницы. В больнице оказывается услуга транспортировки больного. Записаться на прием к врачу можно по телефону Юсуповской больницы.
Читайте также:
- Иннервация органов таза у женщин.
- Гормоны щитовидной железы в норме и их функции
- Особенности транслокации по флоэме растения. Строение ситовидных трубок растения.
- История лечения поясничных радикулитов. Лапароскопическая дискэктомия.
- Гипертрофия отделов сердца. Гипертрофия левого и правого предсердия на ЭКГ
