Удаление мертвых клеток из организма. Хромосомный пол
Добавил пользователь Владимир З. Обновлено: 21.01.2026

Обзор
рисунок автора статьи
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Сегодня проблемы репродукции являются одними из самых обсуждаемых в мире. Но что мы знаем о молекулярной кухне процессов оо- и эмбриогенеза? Ученые из лаборатории морфологии клетки Института цитологии РАН попытались разобраться в закономерностях перестроек хроматина, протекающих в ядрах ооцитов и ранних эмбрионов млекопитающих, и предложили возможные эпигенетические механизмы регуляции данных процессов. Мне, в свою очередь, удалось заглянуть в закулисье и лично пообщаться с авторами статьи. Здесь я не просто хочу поделиться опытом коллег, предупреждающих о возможных трудностях в изучении данной темы. Я хочу объяснить, почему это настолько заинтересовало даже меня, молекулярного онколога, совершенно незнакомого с данной областью исследования.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Такие разные конфигурации
Ирина и Дмитрий Боголюбовы из Института цитологии РАН исследовали закономерности перестроек хроматина в ядрах ооцитов и ранних эмбрионов млекопитающих) и предложили возможные эпигенетические механизмы регуляции этих перестроек (рис. 1) [1], [2]. Но давайте обо всем поговорим по порядку, а вместе с тем послушаем мнение и самих авторов исследования.
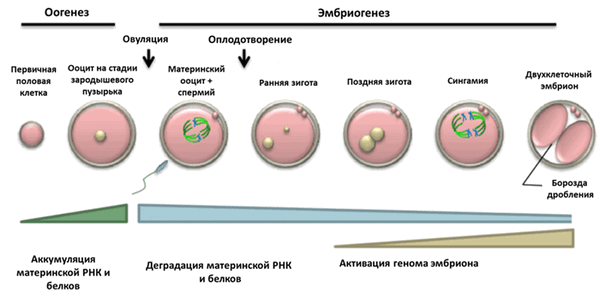
Рисунок 1. Основные стадии раннего развития.
Оогенез и эмбриогенез — это непрерывные, сменяющие друг друга процессы; происходящие в это время преобразования хроматина ооцита предопределяют дальнейшее развитие зиготы после оплодотворения. У некоторых млекопитающих, включая человека, на завершающей стадии развития ооцита перераспределение хроматина в ядре совпадает с преобразованием ядрышка в так называемые атипичные ядрышки или ядрышкоподобные тела (ЯПТ) . Образовавшиеся ЯПТ начинают созывать к себе повсеместно конденсирующийся хроматин, который постепенно окружает ЯПТ по типу «кольца», или, по-научному, хроматин переходит из NSN-состояния (non-surrounded nucleolus) в SN-состояние (surrounded nucleolus) (рис. 2). Почему атипичные ядрышки являются центрообразующей единицей для хроматина, вам не ответит даже самый опытный цитолог. Но давайте поговорим обо всем этом подробно.
ЯПТ (nucleolus-like body, NLB) — особенная ядерная структура, представляющая собой хромосомы, собранные вокруг центрального тела, состоящего преимущественно из фибриллярных белков (ламинов типа А и В). Точный состав центрального тела ЯПТ остается неизвестен [3].
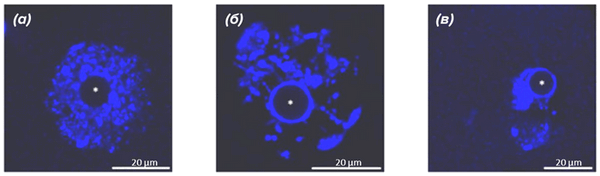
Рисунок 2. Различная конфигурация хроматина в мышиных ооцитах.
(а) — NSN-состояние;
(б) — раннее SN-состояние;
(в) — SN-состояние.
Первым, кто решил разобраться в хроматиновом безобразии, был Молсби Уиллетт Блэкман. Еще в 1901 г. Блэкман работал с хилоподами, правда, не с ооцитами, а со спермацитами (в которых происходят схожие с ооцитами процессы), и наблюдал конденсацию хроматина в ограниченном пространстве ядра на стадии диплотены профазы мейоза [4]. Данному явлению Блэкман дал название «кариосфера», и спорить с ним никто не стал. «Раз никто не спорит, — подумал Блэкман, — можно ввести в историю еще один термин — „кариосома“». Так кариосомой начали обозначать частный подтип кариосферы, когда гетерохроматиновые агрегаты не связаны с какими-либо экстрахроматиновыми включениями. Другой подтип кариосферы — те же самые гетерохроматиновые агрегаты, но уже окруженные внешней капсулой. Данному варианту был гордо присвоен термин «типичная кариосфера». Однако у млекопитающих, которые интересуют биологов больше всего, все совершенно иначе. Поэтому далее мы будем рассматривать процессы оогенеза и эмбриогенеза в контексте именно млекопитающих модельных объектов.
У человека, как и у мыши, хромосомный материал располагается вне экстрахромосомного элемента (тех самых ЯПТ). В таком случае принято говорить «инвертированная кариосфера» (рис. 3) [5].
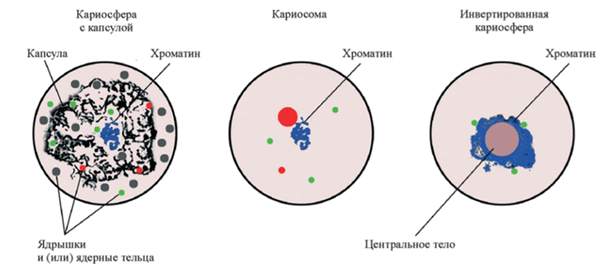
Рисунок 3. Основные типы кариосфер.
С терминологией немного разобрались. Вернемся к морфодинамике. В оогенезе, по мере перехода хроматина из NSN- в SN-состояние происходит инактивация транскрипционной активности ядра, и это очень важный параметр для дальнейшего завершения деления, созревания и осуществления правильного мейоза. Забегая вперед, можно сказать, что на начальных стадиях эмбриогенеза организация хроматина в зиготе морфологически поразительно похожа на таковую в ооцитах на поздних стадиях развития. За исключением того, что случается «рекапитуляция» транскрипционной активности, и она начинает волнообразно нарастать. Но редкая птица долетит до середины Днепра! Проблема заключается в том, что, если мы возьмем фолликулы одинакового размера в яичнике человека или мыши, то в них будут встречаться как SN-, так и NSN-ооциты, с постепенным увеличением процента SN-ооцитов в поздних антральных (готовых к овуляции) фолликулах. Тем не менее, какой-то процент NSN-ооцитов останется. Такие ооциты даже способны к оплодотворению, но развитие получившихся из них эмбрионов останавливается на двухклеточной стадии. Значимость перехода NSN—SN была подтверждена сравнением транскриптомных профилей: уровни мРНК большого набора генов, кодирующих материнские факторы, необходимые для расщепления и развития эмбриона, повышаются именно в SN-ооцитах. В связи с этим встает важный вопрос об отборе качественных ооцитов (например, для ЭКО), поскольку довольно трудно провести сегрегацию между SN- и NSN-ооцитами, полученными из антральных фолликулов одного размера. А размер для специалистов ЭКО имеет значение (как критерий оценки качества, разумеется).
Хорошо, с ооцитами стало понятнее. А у эмбрионов как обстоят дела?
Как уже говорилось ранее, морфологические картины, отражающие изменения конфигурации гетерохроматина в раннем эмбриогенезе, на первый взгляд, напоминают таковые в оогенезе. После оплодотворения ядро ооцита «разбирается», и в зиготе происходит формирование материнского и отцовского пронуклеусов de novo. В этом ведущую роль играют регуляторные белки материнского происхождения. На ранних стадиях эмбриогенеза тельца-предшественники ядрышек или ТПЯ (аналоги ЯПТ) служат платформой для формирования общего хроматинового ландшафта зиготы. Вокруг ТПЯ и ЯПТ конденсируется хроматин, образуя своеобразное гетерохроматиновое кольцо, содержащее области центромер и перицентромер. Именно пространственное расположение определенных гетерохроматиновых участков определяет дальнейшие стадии дробления зиготы (рис. 4).
Рисунок 4. Организация хроматина в ранних эмбрионах мышей, развивающихся in vivo.
(а) — зигота: mPN — материнский пронуклеус; pPN — отцовский пронуклеус; вокруг ТПЯ видны гетерохроматиновые кольца;
(б) — двухклеточная стадия: PB — полярное тело; на этом этапе начинают формироваться хромоцентры;
(в) — четырехклеточная стадия: видны многочисленные хромоцентры; гетерохроматиновые кольца вокруг некоторых ТПЯ начинают исчезать;
(г) — морула.
Мощным инструментом в изучении структуры гетерохроматина в ооцитах и зиготах млекопитающих является так называемая «энуклеоляция» — микрохирургическое удаление ЯПТ из ооцитов мыши и ТПЯ из пронуклеусов зигот. Так, было установлено, что ТПЯ/ЯПТ незаменимы для регуляции MaSat и MiSat вскоре после оплодотворения и служат основной структурой, организующей гетерохроматин в ооцитах и зиготах мышей.
MaSat (major satellite DNA, перицентромерный мажорный сателлит) и MiSat (minor satellite DNA, центромерный минорный сателлит) — повторяющиеся участки некодирующей ДНК, образующие тандемные повторы. Различия, главным образом, заключаются в количестве повторяющихся нуклеотидных мономеров и их локализации [6].
Состав самих ЯПТ (как и ТПЯ) пока остается малоизученным. Все дело в том, что на морфологическом уровне компактизация фибриллярных волокон атипичных ядрышек настолько плотная, что не все антитела, использующиеся в традиционных методах выявления белков-мишеней (например, вестерн-блот и иммуноцитохимический анализ), физически могут «достать» свою мишень [7]. Однако доподлинно известно, что ЯПТ и ТПЯ формируются схожим, весьма необычным, образом [8]. «Сейчас в биологии происходит настоящая LLPS-революция (LLPS: liquid-liquid phase separation) [9], т.е. изучается процесс формирования биомакромолекулярных конденсатов, возникающих в результате разделения жидких фаз. Сборка, разборка атипичных ядрышек и телец-предшественников ядрышек, как и протекание дальнейших процессов реорганизации хроматина также определяется законами фазового перехода», — комментирует доктор биологических наук, один из авторов обозреваемой статьи, Дмитрий Сергеевич Боголюбов.
Если все так сложно реализуется уже на уровне макромолекулярных комплексов — что уж говорить про геномный уровень?
Тут правильнее сказать — эпигеномный. В оогенезе и раннем развитии млекопитающих функциональная активность хроматина в значительной степени регулируется уникальным эпигенетическим ландшафтом. В его создании принимают участие следующие процессы [10]:
- пострепликационные модификации ДНК;
- посттрансляционные модификации ДНК-связывающих белков;
- АТФ-зависимое ремоделирование нуклеосом.
Казалось бы, ключевые эпигенетические игроки проанализированы и хорошо изучены. Однако полногеномных исследований с разрешением до одной клетки (single-cell sequencing), позволяющих установить корреляцию между SN- и NSN-состояниями хроматина, на данный момент не так уж много [11], [12]. Еще бы, ведь энуклеоляция с последующим анализом ядра каждой отдельной клетки — задачи не из легких.
Поскольку на поздних стадиях оогенеза происходит инактивация транскрипционной активности ядра, логично предположить, что в районах активно транскрибирующихся генов появляется определенный стоп-сигнал для транскрипционных или хроматин-ремодулирующих факторов, который всем своим видом провозглашает, что сейчас не время для транскрипции. Метилирование ДНК, которое изменяет сайты связывания ряда факторов транскрипции, является таким стоп-сигналом. Метильные группы обнаруживаются в динуклеотидах CpG, которые часто присутствуют в богатых CpG областях генома, называемых CpG-островками. В ооцитах, взятых из примордиальных (зародышевых) фолликулов, ДНК практически не метилирована по сравнению с ооцитами, присутствующими в антральных фолликулах, которые демонстрируют примерно 40% глобального метилирования ДНК. Кроме того, метилирование ДНК «конкурирует» с метилированием гистонов. Например, гистон H3 должен быть триметилирован по лизину 36 (H3K36me3), но не должен быть ди- или триметилирован по лизину 4 (H3K4me2/me3) и лизину 9 (H3K9me2) в областях, предназначенных для метилирования ДНК. Но стоит только часам пробить полночь, а оплодотворению случиться, как несущаяся карета метилирования генома превращается в тыкву деметилирование. Деметилироваться отцовскому и материнскому геномам помогают ДНК-метилтрансферазы DNMT3a и DNMT, опосредующие присутствие и отсутствие метильных групп на 5-метилцитозинах (5mC) и 5-гидроксиметилцитозинах (5hmC). После такого глобального сброса настроек ДНК в зиготе уже метилируется de novo; запускается процесс дробления.
В то время как с самой ДНК все просто (либо метилирована, либо нет), от разнообразия ковалентных гистоновых модификаций, определяющих гистоновый код, голова идет кругом. Здесь нужно пояснить, что гистоновый код — это посттрансляционные модификации определенных аминокислотных остатков гистонов на N-терминальном конце, например, ацетилирование, метилирование, фосфорилирование, убиквитинирование или рибозилирование. Гистоновые модификации необходимы для привлечения хроматин-ремодулирующих белков и, как следствие, для поддержания определенного состояния хроматина. Следует учитывать, что гистоновые модификации довольно видоспецифичны. Тем не менее, общей тенденцией для репрограммирования хроматина как в ооцитах, так и в зиготах млекопитающих, является метилирование гистона Н3 (H3K4me2, H3K4me3, H3K9me2 и H3K9me3) и ацетилирование гистонов Н3 и Н4 (H3K9ac, H3K18ac, H4K5ac и H4K12ac). К примеру, репрезентативными метками «активного» состояния хроматина является наличие паттернов распределения Н3К4me3 и H4K5ac, в то время как за «спящее» состояние хроматина отвечают Н3K27me3 и H3K9me3.
Посттрансляционные модификации гистонов — это, конечно, хорошо. Но только если есть, что модифицировать. Некоторые постоянные или коровые гистоны имеют своих дублеров — вариантные гистоны, замещающие коровые в составе нуклеосом. К примеру, отсутствие материнского гистонового варианта Н3—Н3.3 в зиготе приводит к нарушению репрограммирования и подавлению ключевых генов плюрипотентности [13]. Кроме того, присутствие Н3.3 и гистонового варианта Н1—Н1foo необходимо для замещения протаминов и сборки отцовского пронуклеуса. Вот такие вот они нужные и важные. Не важнее только, пожалуй, варианты гистона Н2A. Например, H2A.Z участвует в активации транскрипции и эпигенетической памяти, H2A.X играет центральную роль в ответе на повреждение ДНК, а MacroH2.A предположительно участвует в инактивации Х-хромосомы.
Помимо всего вышеперечисленного, ни один NSN-SN переход не обходится без участия дополнительных негистоновых белков, а присутствие некоторых даже является критически необходимым. Например, PCBP1 (poly(rC)-binding protein 1) играет ключевую роль в установлении транскрипционно-неактивного состояния хроматина во время формирования кариосферы. Мутации в гене одного из хроматин-ремоделирующих белков, ATRX (α-thalassemia/mental retardation X-linked protein), приводят к нестабильности перицентромерного хроматина и резкому возрастанию числа анеуплоидных ооцитов и эмбрионов. Белок DPPA3 (developmental pluripotency-associated protein 3), как и PCBP1, способствует репрессии транскрипции. Не дремлют и активируемые MAPK (mitogen-activated proteinkinase) сигнальные каскады, регулирующие NSN-SN переход при участии гормонов.
Несмотря на значительный прогресс в понимании молекулярных механизмов перестроек хроматина на поздних стадиях оогенеза и ранних стадиях эмбриогенеза, цельное видение регуляции таких сложных процессов еще не сформировано. Однако актуальность исследования не оставляет сомнений в том, что игра стоит свеч. «С фундаментальной точки зрения, изучение таких уникальных объектов поможет лучше понять законы организации клеточного ядра в целом, — говорит другой автор статьи, доктор биологических наук, Боголюбова Ирина Олеговна. — С прикладной — любые данные о преобразовании ядра в оогенезе позволяют увидеть слабые места уже в эмбриогенезе».
Роль Y-хромосомы в «делах сердечных»
Новость
Сердечная мышца. TEM фибрилл здоровой сердечной мышцы. Митохондрии (оранжевые) снабжают мышечные клетки энергией; миофибриллы пересекают поперечные канальца (темно-синие линии), которые разделяют миофибриллы на сократительные единицы (саркомеры).
Увеличение: 3900x
Статья на конкурс «Био/Мол/Текст»: Как связана потеря Y-хромосомы с заболеваниями сердечно-сосудистой системы? Ученые из Национальных институтов здравоохранения провели исследование, в ходе которого удалили Y-хромосому из клеток красного костного мозга у мышей и выявили изменения в тканях сердца. А при изучении данного явления у человека было обнаружено, что мужчины, в большом количестве клеток которых отсутствовала Y-хромосома, имели повышенный риск сердечно-сосудистых заболеваний.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023.
Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Часто при упоминании Y-хромосомы на первый план выходят пол и половое развитие. Однако не все так просто. Как выяснилось недавно, маленькая по размеру хромосома, на которой расположены более 70 белок-кодирующих генов, может с возрастом исчезать из клеток [1]. Кроме того, ее отсутствие, возможно, приводит не только к бесплодию и дефектам полового развития у мужчин, но и к заболеваниям сердца [2].
Гены, расположенные на Y-хромосоме, преимущественно связаны с проявлением и развитием мужских половых признаков. При этом соматические клетки способны делиться и функционировать и при утрате этой хромосомы [3]. Таким образом, у мужчин в разных органах и тканях в течение жизни увеличивается количество клеток, имеющих кариотип 45,X. При описании хромосомного набора используют следующую структуру: сначала записывают общее количество хромосом, а через запятую указывают половые, в соответствии с этим мужской кариотип в норме обозначают как 46,XY. Явление, при котором в тканях присутствуют клетки с разным набором хромосом, называется «мозаицизм» («Биомолекула» уже писала о мозаицизме в статье «Геномная головоломка: открой в себе мозаика» [4]).
Как происходит потеря Y-хромосомы?
Исследования данного процесса еще продолжаются. Предполагается, что потеря Y-хромосомы происходит в процессе митоза соматических клеток. В этом случае отдельные клетки будут иметь кариотип 45,X. Укорочение теломерных участков и другие явления, влияющие на микроархитектуру хромосом, могут приводить к неправильному расхождению Y-хромосомы при делении клеток [1].
Кроме того, Y-хромосома человека обогащена палиндромными последовательностями [5]. Палиндромные последовательности — это участки ДНК, в которых последовательность нуклеотидов при чтении от 5’-конца к 3’-концу совпадает с последовательностью в комплементарной цепи. Высокая частота данных последовательностей является причиной образования изодицентрических хромосом — хромосом, состоящих из идентичных плеч и содержащих два близко расположенных центромерных региона, что приводит к нарушениям сегрегации хромосом во время митоза (рис. 1) [6].
Рисунок 1. Структура Y-хромосомы.
(а) — нормальная структура Y хромосомы.
(б) — перицентрическая инверсия, затрагивающая перицентромерную область p-плеча и проксимальный район q-плеча. В результате произошла перестройка проксимальной области q-плеча в p-плечо.
(в) — сестринские хроматиды, формирующиеся во время гаметогенеза.
(г) — структура изодицентрической Y-хромосомы.
Последующая клональная экспансия одной или нескольких стволовых клеток с кариотипом 45,X приводит к клиническим проявлениям мозаичной потери Y хромосомы (mosaic loss of Y, mLOY) в различных органах и тканях [1].
Это явление преимущественно характерно для людей пожилого возраста. Исследования показывают, что мозаичная потеря Y-хромосомы (mLOY) ассоциирована с болезнями сердца, онкопатологией, синдромом Альцгеймера и другими «возрастными» заболеваниями. Более того, mLOY может являться одной из возможных причин более короткой продолжительности жизни у мужчин по сравнению с женщинами. У мужчин молодого возраста случаи mLOY встречаются реже и проявляются нарушениями сперматогенеза, а также дефектами развития половой системы (рис. 2) 9.
Рисунок 2. Последствия мозаичной потери Y-хромосомы. В зависимости от этапа развития человека, последствия mLOY будут иметь разные фенотипические эффекты.
При чем тут сердце?
На 38 мышах было проведено исследование, в ходе которого с помощью технологии CRISPR-Cas9 из клеток красного костного мозга была удалена Y-хромосома [2]. Как известно, в процессе митоза к центромерным районам хромосом прикрепляются нити веретена деления, благодаря чему происходит сегрегация хромосом к полюсам клетки. После воздействия CRISPR-Cas9 на центромерные области происходит их фрагментация, а впоследствии нарушается расхождение хромосом во время деления, из-за чего возможна частичная утрата хромосом [10]. Для таргетного воздействия CRISPR-Cas9 на нужные участки генома необходимо участие направляющих РНК (gRNA). В рамках проведенного эксперимента были использованы gRNA, которые нацелены на повторяющиеся последовательности в центромерных районах Y-хромосомы. Доставку комплекса gRNA и Cas9 осуществляли с помощью лентивирусных векторов (подробнее можно прочитать в статье «Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo» [11]). После этого клетки, модифицированные подобным образом, подсадили молодым самцам мышей, у которых был удален костный мозг. В результате данной процедуры было обнаружено, что в крови реципиентов 49-81% лейкоцитов не имеют хромосому Y. В контрольной группе 37 мышей также подвергли трансплантации костного мозга, но потеря Y-хромосомы у них отмечена не была [2].
Период наблюдения за грызунами составил 2 года. Выяснилось, что 40% мышей с удаленной Y-хромосомой выжили в течение 600 дней после трансплантации. В то время как в контрольной группе этот показатель составил 60% [2].
Также были отмечены заболевания сердца у мышей с отсутствующей Y-хромосомой. Примерно через 15 месяцев после начала исследования у мышей в экспериментальной группе сила сокращения сердца снижалась на 20%. Кроме этого, начинался фиброз сердечной мышцы [2].
Помимо опытов с мышами, исследователи провели анализ образцов от более 15 000 мужчин, полученных в UK Biobank. Было выявлено, что мужчины, как минимум 40% лейкоцитов которых были лишены Y-хромосомы, на 30% чаще умирали от заболеваний системы кровообращения, чем те, у которых количество клеток с нормальным кариотипом было больше [2].
Заключение
Анализируя полученные данные, пока рано делать однозначные выводы относительно связи сердечных патологий и mLOY. Однако данное явление необходимо учитывать в клинической практике и продолжать исследования не только механизмов потери Y-хромосомы клетками, но и влияния mLOY на другие органы и системы организма.
Удаление мертвых клеток из организма. Хромосомный пол
Вирус папилломы человека (ВПЧ) - собирательное название для группы ДНК-вирусов, передающихся от человека к человеку и провоцирующих развитие доброкачественных новообразований - папиллом. Некоторые разновидности являются онкогенными (то есть повышают риск возникновения злокачественных опухолей). Наиболее часто ВПЧ связывают с раком шейки матки, ежегодно уносящим тысячи женских жизней по всему миру. Однако эти вирусы влияют на развитие и других онкологических заболеваний: не только у женщин, но и у мужчин.
ВПЧ длительное время не проявляет себя симптомами: пациенты часто о нем узнают уже лишь тогда, когда развиваются предраковые состояния или рак. ВПЧ представляет угрозу для пациентов любого пола и возраста, включая маленьких детей. Но все же его главной «целевой аудиторией» являются люди 15-30 лет: они ведут активную половую жизнь, не всегда задумываясь о мерах предосторожности, а в большинстве случаев ВПЧ передается именно половым путем.
Чтобы воздействие вируса на организм не зашло так далеко, рекомендуется регулярно проверять состояние своего здоровья: для исключения патологий, которые он способен вызвать. Также существуют анализы на ВПЧ, позволяющие выявить наличие онкогенных штаммов. Позаботьтесь о своем здоровье прямо сейчас: запишитесь на прием в Поликлинике Отрадное и посетите консультацию врача без необходимости ждать в очередях или подстраиваться под неудобное для вас время
Что такое ВПЧ
Папилломавирусы человека, попадая в организм через микротравмы кожи, внедряются в клетки базального слоя эпителия. ВПЧ может существовать в любых слоях эпидермиса. Однако его размножение происходит исключительно в базальном слое.
Развитие вируса происходит в 2 стадии:
- Репродуктивная - вирус проникает в клетку, не затрагивая ее хромосомы, и размножается.
- Интегративная - ВПЧ внедряется в геном инфицированной клетки.
Именно во время второй стадии вирус трансформирует клетки. Они начинают активно делиться, и возникают опухолевидные образования - папилломы. Это сосочковые разрастания, выступающие над поверхностью кожного покрова (поэтому они так и называются: papilloma - от латинского papilla - сосок и греческого oma - опухоль). Вторая стадия наступает не всегда. Вирус, находясь в первой стадии развития, способен регрессировать (покинуть организм). Однако даже если у пациента не наблюдается патологических изменений, он является носителем ВПЧ и способен заражать других людей.
Инкубационный период может длиться от 3 недель до года. В среднем он составляет 3 месяца. В некоторых случаях сначала появляются негенитальные формы папиллом, а затем новообразования возникают на половых органах.
В большинстве случаев в течение 2-х лет организм справляется с вирусом. Однако может произойти повторное заражение - этим же или другим штаммом. Также папилломы или другие кожные проявления, способны регрессировать через 6-8 месяцев (постепенно уменьшаться и впоследствии исчезнуть). Это происходит, когда иммунитет подавляет вирус и «выживает» его из клеток.
Чаще всего вирус ВПЧ поражает кожу и слизистые оболочки:
- Аногенитальной области.
- Верхних дыхательных путей.
- Ротовой полости.
- Бронхов.
- Конъюктивы.
- Прямой кишки.
- Пищевода.
Типы ВПЧ
Первый вирус папилломы человека (Human papilloma virus, HPV) был выделен в 1971 году. А ученому Харальду цур Хаузену удалось выявить и доказать связь между ВПЧ и раком шейки матки. Впоследствии за свои открытия он получил Нобелевскую премию.
На сегодняшний день известно около 600 различных штаммов ВПЧ. Одни провоцируют возникновение бородавок, другие - кондилом, третьи - папиллом. Также есть среди ВПЧ типы, влияющие на развитие раковых опухолей. Их называют онкогенными. К счастью, их не так много. Они могут обладать низким, средним или высоким онкогенным потенциалом:
- Низкой онкогенностью отличаются штаммы 6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81.
- Средняя онкогенность у типов 26, 31, 33, 35, 51, 52, 53, 58, 66.
- Высокий онкогенный потенциал у штаммов 16, 18, 39, 45, 56, 59, 68, 73, 82.
Рак шейки матки в большинстве случаев вызывается типами 16 и 18.
Справка! Наличие онкогенного типа ВПЧ в организме не означает, что человек «приговорен» к раку. Наличие вируса повышает риск развития онкологических заболеваний, но не является единственной причиной их возникновения. Если у пациента выявлен онкогенный штамм ВПЧ, ему просто необходимо внимательнее следить за состоянием своего здоровья, регулярно проходить профилактические исследования. При необходимости врач назначит ему соответствующую терапию.
Половую систему женщин и мужчин способны поражать около 40 типов папилломавирусов. Результатом их активности являются не только онкологические заболевания, но также генитальные бородавки или кондиломы.
Справка! Раковые опухоли развиваются медленно: в течение 5-30 лет после заражения папилломавирусом. Им предшествуют предраковые состояния (доброкачественные новообразования, способные перерождаться в злокачественные). Именно поэтому так важно регулярно проходить профилактические осмотры. И предраковые состояния, и даже рак на начальных стадиях прекрасно поддаются лечению, и можно избежать опасных последствий.
Пути передачи ВПЧ
Главным «условием» заражения является наличие микроповреждений (ранок, трещинок, царапин) кожи или слизистых оболочек. Именно они служат «вратами» для ВПЧ.
Чаще всего передача вируса происходит при соприкосновении кожи или слизистых оболочек двух людей. Поэтому основным путем папилломавирусов является половой контакт. Причем использование презервативов не исключает возможность заражения. Вирус может быть передан при оральном сексе, во время которого далеко не всегда пользуются контрацепцией. К тому же презерватив покрывает не всю поверхность полового члена, и нередко его надевают уже в середине полового акта. ВПЧ можно заразиться и при поцелуе.
Также ВПЧ может передаваться:
- От матери к ребенку при прохождении малыша через родовые пути.
- В быту: при использовании чужих средств гигиены (полотенец, зубных щеток, бритвенных принадлежностей).
- В общественных местах: банях, спортзалах, бассейнах.
Справка! Срок выживания папилломавирусов во внешней среде недолог. Поэтому риск бытового заражения хоть и существует, но он значительно ниже, чем при половом контакте.
Также возможно самозаражение: перенос вируса с одного участка тела на другой во время депиляции, расчесывании кожи, обкусывании ногтей.
Заражение при контакте с вирусом происходит не во всех случаях. Риск повышают следующие факторы:
- Снижение иммунитета.
- Вредные привычки: курение, злоупотребление спиртным.
- Стрессы.
- Наличие инфекций, передаваемых половым путем.
- Заболевания мочевыделительной системы.
- Травмы кожи и слизистых оболочек.
- Иммунодефицитные состояния.
- Длительный прием гормональных контрацептивов.
Справка! Для женщин онкогенные штаммы ВПЧ опаснее, чем для мужчин, так как они заражаются ими чаще.
ВПЧ: симптомы
Папилломавирусы способны на протяжении длительного времени абсолютно не проявлять себя симптомами. Обычно о наличии ВПЧ пациент узнает уже при развитии его последствий: появления бородавок, папиллом, кондилом. В некоторых случаях о наличии вируса могут говорить следующие признаки:
- Покраснения, кожные новообразования (чаще всего в области половых органов);
- Кожный зуд.
- Боли и прочий дискомфорт во время или после полового акта.
Какие заболевания может вызвать ВПЧ
Папилломавирусы, прежде всего, провоцируют рост папиллом, бородавок и кондилом у пациентов обоих полов. Все вышеперечисленные новообразования способны возникнуть на любом участке тела. Однако чаще всего они поражают половые органы и анальную область. У женщин они возникают в области вульвы, шейки матки, влагалища. У мужчин - мошонку, головку члена, крайнюю плоть. У пациентов обоих полов новообразования часто появляются в области заднего прохода.
Также бородавки нередко возникают на подошвах, гортани, голосовых связках. У папиллом (сосочковидных образований телесного цвета) нет «излюбленного места» - они способны появиться на туловище, шее, лице, руках и ногах. У детей и подростков чаще всего встречаются плоские бородавки (их еще называют юношескими или ювенильными). Это небольшие (3-5 мм) темные новообразования, немного выступающие над поверхностью кожи. Чаще всего они возникают на тыльной стороне кистей, лице, ногах.
Что касается онкологических заболеваний, то с ВПЧ у большинства пациентов ассоциируется, в первую очередь, рак шейки матки. Действительно, эта патология является очень распространенной в наше время. Однако у женщин ВПЧ также нередко провоцирует развитие рака влагалища и вульвы (65-70% случаев), у мужчин - рака полового члена (50% случаев). Также и у женщин, и у мужчин папилломавирусы могут способствовать возникновению злокачественных опухолей:
- прямой кишки;
- полости рта;
- гортани.
У детей ВПЧ, как правило, проявляется ростом папиллом на фоне снижения иммунитета вследствие перенесенных заболеваний, обычно это вирусные или бактериальные инфекции. Также папилломавирусы поражают маленьких пациентов, страдающих аллергическими реакциями или частыми простудными заболеваниями.
ВПЧ и беременность
Папилломавирусы негативно влияют на женскую фертильность. При их наличии вероятность наступления беременности снижается вдвое, так как ВПЧ способен препятствовать имплантации оплодотворенной яйцеклетки. Если вирусом заражен и партнер (что бывает в 65-70% случаев), то возможность зачатия уменьшается еще больше. ВПЧ оказывает негативное влияние на подвижность сперматозоидов.
При наступлении беременности папилломавирус повышает риск развития:
- Мало- или многоводия.
- Хронической плацентарной недостаточности.
- Также ВПЧ может спровоцировать невынашивание беременности.
Поэтому беременным назначается щадящая медикаментозная терапия, позволяющая значительно снизить все вышеперечисленные риски.
При прохождении ребенка по родовым путям есть риск его заражения. Поэтому женщинам с ВПЧ предпочтительнее рожать путем кесарева сечения - риск передачи вируса снижается в 5 раз.
Изменения гормонального фона провоцируют быстрый рост остроконечных кондилом на половых органах. Они могут срастаться, что способно вызвать затруднения актов мочеиспускания и дефекации, доставлять неприятные ощущения при ходьбе, кровотечения. При родах новообразования легко травмируются. Также они могут затруднить прохождение ребенка по родовым путям. Чтобы избежать всего этого, остроконечные генитальные кондиломы лечат на ранних сроках беременности. Применяются такие методы, как криодеструкция, лазерная хирургия и т.д.
Диагностика
Для диагностики ВПЧ сначала обращаются к терапевту. В зависимости от проявлений вируса, он направит пациента на диагностические исследования и к узкому специалисту (гинекологу, урологу, дерматологу, онкологу, проктологу и т.д.).
И женщинам, и мужчинам могут быть назначены такие исследования, как:
- Иммуноферментный анализ крови - по его результатам нельзя определить концентрацию и онкогенность вируса, но можно выявить антитела к нему, метод идеально подходит для ранней диагностики, когда еще не появились симптомы.
- ПЦР-диагностика - позволяет выявить ДНК ВПЧ, то есть позволяет точно узнать, есть ли в организме вирус или нет; для анализа берут кровь, слюну, выделения из половых органов и т.д.
- Digene-тест - позволяет оценить степень онкогенности штамма, установить количество вируса в организме; биоматериалом служит кусочек ткани, соскоб из цервикального канала, влагалища или уретры.
Женщинам назначают следующие виды обследования:
- Цитологическое исследование (ПАП-тест) - изучение мазка из влагалища под микроскопом с целью выявления измененных вирусом клеток.
- Кольпоскопию - осмотр шейки матки с помощью прибора кольпоскопа, эта процедура назначается пациентке, если по результатам цитологического исследования были обнаружены измененные клетки.
Лечение
Специфического лечения ВПЧ (то есть направленного на его уничтожение) не существует. Однако можно принять меры, подавляющие активность вируса и повышающие вероятность самоизлечения. Пациенту назначают:
- Витамины.
- Иммуномодуляторы.
- Противовирусные препараты.
Также проводится симптоматическое лечение - удаление новообразований. Пытаться лечить кондиломы, папилломы и бородавки народными средствами ни в коем случае нельзя. Есть риск спровоцировать развитие вторичной инфекции или перерождение доброкачественной опухоли в злокачественную.
Для устранения новообразований применяются следующие методы:
- Удаление с помощью скальпеля.
- Криодеструкция (замораживание с помощью жидкого азота).
- Удаление радионожом.
- Лазерное удаление.
- Электрокоагуляция.
Метод выбирается врачом в зависимости от характера и расположения новообразования, а также состояния организма пациента.
Профилактика
К профилактическим методам относятся ведение здорового образа жизни и регулярное укрепление иммунитета с помощью полноценного и разнообразного питания, умеренной физической активности, качественного отдыха. Важно соблюдать правила личной гигиены, не пользоваться чужими принадлежностями. Во избежание риска заражения следует отказаться от случайных половых связей и использовать барьерные средства контрацепции.
Также в наше время есть возможность вакцинации от некоторых высокоонкогенных штаммов ВПЧ. Прививки рекомендуют делать в возрасте от 9 до 26 лет (оптимальный возраст - 11-12 лет). Женщины могут пройти вакцинацию и после 26 лет, но только лишь если гинеколог считает, что есть показания. Следует иметь в виду, что прививка не излечивает от уже имеющегося в организма вируса, а предотвращает заражение некоторыми особо опасными его типами.
Замершая беременность
Замершая (неразвивающаяся) беременность — патологическое состояние, при котором происходит остановка развития, а затем гибель плода. Это одна из разновидностей невынашивания беременности. Самопроизвольного аборта (выкидыша) непосредственно после гибели не происходит — плод остается в матке. От погибшего эмбриона организм пытается избавиться уже позднее.
Может пройти около 2 недель и более, прежде чем осуществится самопроизвольный аборт. В течение этого времени плод начинает разлагаться, из-за чего может произойти интоксикация организма. Поэтому без врачебной помощи в случае замершей беременности не обойтись.
Беременность может перестать развиваться на любом сроке, до 28 недели. Наиболее часто это состояние выявляют на:
Самым «опасным» сроком считается 8 неделя, когда у ребенка начинают закладываться основные органы и системы. Именно в этот момент риск развития нарушений максимален.
Замершая беременность включает в себя несколько факторов:
- нежизнеспособность плода;
- отсутствие активности миометрия (мышечного слоя матки);
- патологию гемостаза у беременной (нарушения в свертывающей системе крови).
Виды замершей беременности
Различают два вида неразвивающейся беременности:
- Анэмбриония — когда в плодном яйце (округлом образовании, окружающем плод при нормальном течении беременности) отсутствует эмбрион. Существуют две причины возникновения такой патологии. В первом случае эмбрион не формируется с самого начала, во втором — его развитие замирает на раннем этапе (до 5 недели беременности). Клетки плодного яйца при этом продолжают размножаться, а ХГЧ (хорионический гонадотропин человека, «гормон беременности») вырабатывается, как при нормальной беременности. Поэтому результаты тестов на беременность и анализа на ХГЧ будут положительными.
- Гибель эмбриона — изначально беременность развивается нормально, но затем вследствие наличия тех или иных негативных факторов плод погибает.
Причины неразвивающейся беременности
Основные причины, по которым беременность может замереть, можно условно разделить на несколько больших групп:
- Врожденные и приобретенные аномалии матки.
- Патологии эндометрия (внутренней слизистой оболочки матки).
- Острые инфекции.
- Генетические/хромосомные нарушения.
- Гормональные нарушения.
- Патологии свертывающей системы крови.
- Иные причины.
К врожденным патологиям внутренних половых органов относятся:
- двурогая матка (аномалия, при которой полость матки полностью или частично разделена перегородкой на две части — рога);
- полное удвоение матки (у женщины две матки и два влагалища, у каждой матки всего по одной маточной трубе);
- однорогая матка (развита только одна половина матки и имеется одна маточная труба);
- седловидная матка (матка имеет почти нормальное строение, но в центре ее дна имеется углубление).
Врожденные патологии матки выявляются примерно у 10-25% женщин с замершей беременностью. Приобретенные аномалии часто диагностируются у пациенток, перенесших кюретаж (гинекологическое выскабливание матки, в ходе которого удаляется верхний слой слизистой оболочки). Также они могут быть следствием предыдущей замершей беременности. К приобретенным аномалиям внутренних половых органов относят:
- истмико-цервикальную недостаточность (преждевременное раскрытие шейки матки при беременности);
- субмукозную миому (доброкачественное новообразование, развившееся из мышечного слоя матки);
- возникновение внутриматочных спаек.
Патологические состояния эндометрия способны стать причиной неудачной имплантации эмбриона или недостаточного питания плода. Это приводит к замиранию беременности. Наиболее частыми нарушениями, из-за которых гибнет плод, являются хронический эндометрит и синдром регенераторно-пластической недостаточности эндометрия (состояние, в результате которого слизистая оболочка матки атрофируется).
Острые инфекционные заболевания далеко не всегда вызывают гибель плода, чаще они становятся причиной развития врожденных аномалий у ребенка (глухоты, пороков сердца, задержки умственного развития и т.д.). И все же в ряде случаев даже ОРВИ может спровоцировать замирание беременности. А к наиболее опасным для плода инфекциям относят краснуху, цитомегаловирус, герпес, токсоплазмоз, хламидиоз, гонорею.
Генетические и хромосомные нарушения часто становятся причиной замирания беременности на ранних сроках (до 8 недели). В некоторых случаях плод гибнет позднее — на 13-20 неделе, но такое происходит гораздо реже. В результате генетических и хромосомных нарушений у плода может сформироваться кариотип (хромосомный набор), несовместимый с жизнью. В этом случае в дальнейшем развитии эмбриона нет смысла, и он погибает. Патологические гены способны передаваться как от отца, так и от матери (а иногда аномалии обусловлены несовместимостью генов женщины и мужчины), а хромосомные нарушения возникают непосредственно в процессе деления клеток после оплодотворения. Они могут быть качественными (наблюдаются дефекты в строении хромосом) или количественными (хромосом больше или меньше, чем нужно).
Гормональные нарушения могут появиться из-за наличия у будущей мамы заболеваний эндокринной или репродуктивной систем или аутоиммунных нарушений. Беременность способна замереть в двух случаях:
- при недостатке прогестерона (гормона, отвечающего за подготовку матки к имплантации эмбриона);
- при избытке мужских половых гормонов в организме женщины.
Патологии свертывающей системы крови у матери могут стать причиной сбоя процесса имплантации плодного яйца, повреждения маточно-плацентарных сосудов или нарушения функций плаценты. Все это способно привести к замиранию беременности.
Иногда причины неразвивающейся беременности так и остаются неизвестными. К возможным факторам, повлиявшим на гибель плода, в таких случаях относят генетическую несовместимость родителей ребенка или наличие в организме матери аллоиммунных антител, способных вызвать резус-конфликт.
Факторы риска

Существуют факторы риска, при наличии которых вероятность замирания беременности возрастает. Они могут быть неконтролируемыми (то есть их нельзя ликвидировать) и контролируемыми (их можно устранить или компенсировать). К неконтролируемым факторам относятся:
- Возраст. Чем старше женщина, тем выше риск неразвивающейся беременности.
- Сильные стрессы.
Среди контролируемых факторов:
- Предшествующие аборты, выкидыши, замершие беременности. Чем их больше, тем выше вероятность гибели плода;
- Неправильный образ жизни. Вредные привычки (курение, употребление спиртного, злоупотребление кофеином) и несбалансированное питание во время беременности могут негативно сказаться на состоянии плода;
- Хронические заболевания женщины, как гинекологические, так и патологии внутренних органов и систем (тяжелые заболевания сердечно-сосудистой системы, печени и почек, сахарный диабет, синдром поликистозных яичников, системная красная волчанка);
- ЭКО. По пока не выявленным причинам среди замерших беременностей больше тех, которые наступили в результате экстракорпорального оплодотворения. В этом случае плод обычно гибнет до 12 недели;
- Заболевания органов репродуктивной системы у мужчины;
- Многоплодная беременность;
- Значительные отклонения индекса массы тела от нормы у женщины (слишком маленький вес или сильное ожирение);
- Воздействие на организм будущей мамы токсичных веществ (например, вдыхание паров на вредном производстве);
- Прием некоторых противовоспалительных препаратов на ранних сроках беременности. Будущая мама обязательно должна консультироваться с врачом по поводу любого лекарства, которое собирается принять.
Часто замирание беременности провоцируется сразу несколькими факторами.
Симптомы
Порой неразвивающаяся беременность не дает о себе знать никакими проявлениями, и о патологии женщина узнает уже после проведения планового УЗИ. В других случаях могут наблюдаться такие симптомы, как:
- Боли тянущего или ноющего характера внизу живота, в области спины;
- Мажущие кровянистые выделения из влагалища — от розоватых до коричневых;
- На ранних сроках — резкое исчезновение признаков токсикоза, если он был;
- Внезапное снижение базальной температуры (наиболее низкой температуры тела, устанавливающейся в состоянии покоя, измеряется в прямой кишке);
- Общее недомогание: слабость, головные боли, тошнота, озноб и т.д.;
- Изменения в области груди. На ранних сроках беременности останавливается нагрубание молочных желез, пропадают боли. Грудь становится мягкой. На поздних сроках (после 22 недель), напротив, молочные железы при замершей беременности способны набухать. Иногда из груди выделяется молоко (не молозиво).
- Отсутствие шевелений плода. При первой беременности шевеления обычно начинаются после 22 недели (могут немного раньше), при второй — после 18 недели. Если толчков в положенный срок нет, необходимо обратиться к врачу.
При наличии в организме очага воспаления также может наблюдаться незначительное повышение температуры тела.
Вышеперечисленные признаки необязательно говорят о замершей беременности. Вполне возможно, что плод развивается нормально, и проявившиеся симптомы свидетельствуют о наличии совсем других, не таких страшных, нарушений. Но при наличии этих признаков обратиться к врачу необходимо как можно скорее.
Диагностика замершей беременности
Сначала осуществляются общий и гинекологический осмотры пациентки. О неразвивающейся беременности врачу сообщат следующие признаки:
- низкий тонус матки;
- низкая температура в прямой кишке;
- несоответствие размеров матки срокам беременности.
Затем проводятся УЗИ, анализ крови на гормоны. По результатам УЗИ при замершей беременности могут быть выявлены:
- отсутствие в плодном яйце эмбриона;
- признаки отслойки хориона (зародышевой части плаценты);
- отсутствие у плода сердцебиения;
- нечеткая визуализация плода.
При наличии у пациентки тех или иных заболеваний (инфекций передающихся половым путем, сердечно-сосудистой или эндокринной системы, почек, печени и т.д.) потребуется консультация специалиста, в компетенцию которого входит имеющаяся патология.
Лечение может быть как медикаментозным, так и хирургическим. Главная цель всех медицинских мероприятий — освобождение матки от погибшего плода и предотвращение осложнений (возникновения воспалительных процессов, интоксикации организма и т.д.). Врачи выбирают метод лечения, основываясь на сроке беременности, состоянии организма пациентки, наличии сопутствующих патологий и т.д.
На ранних сроках могут осуществляться:
- . Его проводят до 6-7 недели беременности. Пациентке назначают препараты, под воздействием которых происходит сокращение матки и изгнание плода.
- Вакуумная аспирация. Осуществляется до 12 недели беременности. Полость матки опорожняют с помощью специального вакуумного отсоса, вводя наконечник прибора в шейку матки без установки расширителей. Процедура проводится под местной анестезией или общим наркозом.
- Кюретаж (выскабливание полости матки с помощью хирургического инструмента, который называется кюретка). Операция проводится под общей анестезией. Это достаточно травматичная процедура, в результате которой повреждается эндометрий. В канал шейки матки пациентки вводят расширитель, а затем производят выскабливание с удалением верхнего слоя слизистой оболочки матки. После операции женщина в течение нескольких дней во избежание развития осложнений находится в стационаре. Биологический материал, полученный в результате выскабливания, отправляется на гистологическое исследование — с его помощью врачи быстрее и точнее определят причину замершей беременности.
После извлечения плода из матки обычно проводят антибактериальную медикаментозную терапию.
На поздних сроках принимают такие меры:
- искусственная стимуляция родовой деятельности;
- кесарево сечение.
После лечения пациентке рекомендуется пройти следующие обследования (для предотвращения повторной замершей беременности):
- Осмотр у терапевта для диагностики хронических заболеваний; и мочи; ; ;
- Генетическое обследование обоих партнеров (обязательным оно является, если замершая беременность была уже третьей по счету, в остальных случаях — если врач видит в этом необходимость);
- Иммунологическое исследование (проводится, если у доктора есть подозрения, что неразвивающаяся беременность была обусловлена аутоиммунными нарушениями); ; ;
- Анализы, позволяющие выявить инфекции, передающиеся половым путем.

Главной профилактической мерой является планирование беременности, включающее в себя:
- Общий медицинский осмотр, в ходе которого можно выявить заболевания, способные повлиять на течение беременности;
- Гинекологическое обследование — для своевременной диагностики патологий;
- Выявление и своевременное лечение гормональных нарушений;
- Профилактика инфекций (при необходимости перед беременностью можно сделать прививки от наиболее опасных для плода заболеваний).
При наступлении беременности необходимо следить за правильностью питания, носить одежду, не стягивающую низ живота, стараться избегать стрессовых ситуаций и тяжелых физических нагрузок, сократить время работы за компьютером. Бывать на свежем воздухе нужно ежедневно. Отказаться от вредных привычек (если они есть) рекомендуется еще на этапе планирования.
После замершей беременности предпринимать новые попытки зачатия стоит не ранее чем через 3-6 месяцев. Однако этот срок весьма условен, и в каждом конкретном случае может быть разным. По поводу сроков планирования новой беременности рекомендуется проконсультироваться с врачом.
Хромосомные болезни: теория и практика

Вся генетическая информация, которая передается из поколения в поколения, закодирована в специальной молекуле — дезоксирибонуклеиновой кислоте, более известной в сокращении как ДНК. В комплекте с белками ДНК формирует хромосомы. Различные аномалии, которые их затрагивают, приводят к так называемым хромосомным болезням.
MedAboutMe разбирался, что это за болезни и откуда берутся хромосомные аномалии.
ДНК ядерная и митохондриальная
В молекуле ДНК располагаются все гены, в которых запрограммирована информация о структуре белков и других молекул, из которых состоит организм человека и всех живых существ. Всего генов насчитывается около 30 тысяч.
Молекула ДНК состоит из двух цепей, которые скручены в спираль. Молекулы ДНК уложены очень компактно в ядре клеток. Вместе с белками они образуют специфические образования — хромосомы. В прямом переводе этот термин означает «окрашенное тело», поскольку они хорошо окрашиваются специальными красителями.
Открытие хромосом, как неких образований в ядре клетки, согласно истории биологии, может принадлежать нескольким ученым второй половины девятнадцатого века. Только в начале двадцатого века было высказано предположение об их участии в наследовании информации (Т. Морган и соавт.).
Помимо ядерной ДНК существует митохондриальная ДНК, которая находится в специальных образования клетки — митохондриях, расположенных в цитоплазме клеток. Открытие этой формы ДНК состоялось в 1963 году. Митохондриальная ДНК существенно меньше по размерам ядерной, но, так же как и ядерная ДНК, несет на себе важную генетическую информацию, а ее нарушение приводит к развитию так называемых митохондриальных болезней. В отличие от ядерной ДНК, в которой располагаются тысячи генов, в митохондриальной ДНК сосредоточено несколько десятков генов, но все они кодируют крайне важные белки/ферменты для человека.
Тело человека и хромосомы
Все ядерные хромосомы в клетках человека, кроме половых клеток, представлены парами. Таких пар 23, то есть всего в ядре клеток содержится 46 хромосом (диплоидный набор), в том числе 22 пары аутосом (не половые хромосомы) и одна пара половых (ХХ или ХY). Хромосомы в каждой из 22 пар сходны по строению и по размерам.
В половых клетках, представленных яйцеклеткой и сперматозоидом, содержится по 23 хромосомы (гаплоидный набор), одна из них — Х, а другая — Y хромосома, достающаяся от отца, будет определять пол человека. Поскольку женские половые клетки содержат набор из 22 хромосом и одной X половой, в сперматозоидах возможно два варианта — сперматозоид содержит 22 хромосомы плюс Х- или 22 плюс Y-половая хромосома.
После соединения яйцеклетки и сперматозоида образующийся набор ХХ будет определять развитие по женскому типу, а набор ХY — по мужскому. В целом, можно сказать, что каждый человек имеет два варианта одного и того же гена, хранящегося в хромосомах — один вариант от матери, другой от отца, при этом пол определяется отцом.
Гены и число хромосом
Число хромосом сильно варьирует в зависимости от вида животных и растений. Таким образом, количество хромосом является признаком, характеризующим различные виды животного мира. Например, число хромосом у лошади равно 64, у гориллы — 48, у собак — 78, у рака — 200, у кошки — 38, у свиньи — тоже 38, у лягушки — 26, у картофеля — 48, у кукурузы — 20, а у некоторых видов муравьев — всего 2 хромосомы, геном холерного вибриона также представлен 2 хромосомами.
Однако число хромосом и количество генов находится не всегда в пропорциональной зависимости. Например, число хромосом у обычной домовой мыши 40, а у человека — 46, при этом число генов приблизительно совпадает. Число хромосом лошади превышает число хромосом человека, однако у лошадей пока идентифицировано около 20 тысяч генов.
Многие из генов животных имеют сходное строение с генами человека. Гомология (схожесть) некоторых геномов животных с геномом человека достигает более 90%. Схожесть генома у людей достигает 99,9% и лишь 0,01% генома формирует все многообразие среди людей. Понимание путей эволюции в формировании геномов человека и животных крайне важно для выявления мутаций, которые являются специфичными для человека. Эти знания необходимы для лечения болезней с применением методов генной инженерии в будущем.
Кариотип и кариотипирование
Выше было сказано, что ядерный геном человека в норме величина постоянная. Он состоит из 46 хромосом, которые формируют 23 пары. 22 пары хромосом представляют собой аутосомы (парные хромосомы в клетках кроме половых), тогда как 23-я пара представляет собой половые хромосомы — XX у женщин и XY у мужчин.
Для обозначения совокупности набора хромосом было введено понятие «кариотип». Впервые это термин был введен уже в 1922 российским ученым Л.Н. Делоне при изучении набора хромосом у различных представителей растительного мира.
Набор хромосом человека, состоящий их 46 хромосом в норме, называют кариотипом. Помимо количества, главными признаками, формирующими кариотип, являются также размеры, строение и форма хромосом. Метод, позволяющий проводить оценку кариотипа, называется кариотипированием. Данный метод относится к цитогенетическим методам исследования генома и широко используется в диагностике хромосомных аномалий.
Поскольку в течение клеточного цикла вид хромосом в ядре подвержен значительным изменениям, то принято проводить изучение кариотипа в определенной стадии деления клетки, которая называется «метафаза митоза». Для повышения точности определения применяются специфические методы окрашивания хромосом с применением красителей, что значительно повышает чувствительность метода.
При обследовании женщин нормальный кариотип записывают как 46, XX и 46, XY для мужчины.
Хромосомные болезни
Изменение кариотипа человека и животных может происходить на различных этапах развития. Если изменение числа хромосом происходит на стадии, когда образуются родительские половые клетки (гаметы), то и все клетки будущего эмбриона будут иметь измененный кариотип.
Например, увеличение 21-й пары хромосом на одну добавочную хромосому (трисомия по 21-й хромосоме) приводит к возникновению синдрома Дауна. Лишняя X-хромосома в паре половых хромосом XY у мужчин образует изменение кариотипа на формулу 47, XXY (вместо 46, XY). Такой кариотип приводит к возникновению синдрома Клайнфельтера. Одним из основных признаков такой патологии является нарушение половых желез.
Понятие мозаицизма (мозаичный кариотип) появилось, когда было обнаружено, что при дроблении зародышевых клеток в самом начале формирования эмбриона появляются клетки с различными кариотипами, т.е. один организм может содержать одновременно клоны клеток как с нормальным набор хромосом, так и с аномальным. Иными словами, организм состоит из клеток с различным генетическим материалом. Примерами такого развития могут быть синдромы Дауна, Клайнфельтера, Шерешевского-Тернера. При мозаицизме клиническая выраженность симптомов чаще имеет стертые формы, поскольку часть клеток все же имеет нормальный кариотип.
Причины хромосомных аномалий и их диагностика

Ранее мы говорили, что причиной хромосомных аномалий могут быть ионизирующая радиация, влияние различных химических агентов, включая лекарства, экстремальная температура. Во многих случаях выявить точную причину изменений не представляется возможным. Многолетними наблюдениями доказано, что частота хромосомных аномалий резко увеличивается с возрастом матери.
Кариотипирование обычно проводят в пренатальный период (в период беременности до родов). Кариотипирование проводят как инвазивным способом, так и неинвазивным.
- Инвазивный способ заключается в заборе клеток для исследования из матки женщины (плацента, хорион), крови из пуповины плода или околоплодных вод (амниоцентез) под контролем ультразвука. Отбираются клетки плода и в них проводят исследование хромосом. Следует учитывать, что такой способ забора материала может закончиться выкидышем (около 1% в первом триместре).
- Неинвазивный метод заключается в выделении генетического материала плода из крови матери. Этот метод не опасен для ребёнка и плода, однако менее чувствителен по сравнению с инвазивным методом. Показанием для неивазивного способа забора материала могут быть возраст матери (старше 35 лет), наличие хромосомных аномалий у предыдущих детей.
В настоящее время наиболее точным методом диагностики ряда хромосомных аномалий является метод количественной флуоресцентной полимеразной цепной реакции.
При выявлении патологии решается вопрос о продолжении или прерывании беременности. Метод кариотипирования применяется для обследования детей при наличии пороков развития, а также супругов, у которых происходило рождение мертворожденных детей, и при планировании ЭКО.

этот тест и узнайте, во сколько баллов - по десятибалльной шкале - можно оценить состояние вашего здоровья.
Читайте также:
