Уменьшение венозного возврата. Увеличение венозного возврата крови к сердцу. Спланхническое сосудистое русло.
Добавил пользователь Alex Обновлено: 01.02.2026
Это объем венозной крови, притекающий к сердцу по нижней и верхней полым венам. В покое венозный возврат 4-6 л/мин,причем на верхнюю полую вену приходится треть, а на нижнюю полую - две трети этого объема.
Факторы, участвующие в формировании венозного возврата.
Две группы факторов:
1 группапредставлена факторами, которые объединяет общий термин «vis a tegro»- действующие сзади:
13% энергии, сообщенной потоку крови сердцем;
• сокращение скелетной мускулатуры («мышечное сердце», «мышечная венозная помпа»);
• переход жидкости из ткани в кровь в венозной части капилляров;
• наличие клапанов в крупных венах (препятствует обратному току крови);
• констрикторные (сократительные) реакции венозных сосудов на нервные и гуморальные воздействия.
2 группапредставлена факторами, которые объединяет общий термин «vis a fronte» - действующие спереди:
• присасывающая функция грудной клетки. При вдохе отрицательное давление в
плевральной полости увеличивается и это приводит к снижению центрального венозного давления (ЦВД), ускорению кровотока в венах;
• присасывающая функция сердца. Осуществляется за счет понижения давления в
правом предсердии (ЦВД) до нуля в диастолу.
Снижение ЦВД до 4 мм рт. ст. ведет усилению венозного возврата (далее не влияет), при ЦВД более 12 мм рт. ст. венозный возврат крови к сердцу тормозится.
Изменение венозного давления на несколько миллиметров ртутного столба ведет к увеличению притока крови в 2-3 раза.
От венозного возврата крови к сердцу зависит наполнение кровью сердца в диастолу (конечнодиастолическийобъем), а значит, это опосредованно влияет (особенно при нагрузках) на величину ударного объема(через изменение резервного объема) и как следствие - на величину МОК.Эти изменения приводят к соответствующим изменениям АД.
Объем циркулирующей крови (ОЦК).
У мужчин он составляет в среднем 5,5 л (75-80 мл/кг), у женщин - 4,5 л (около 70 мл/кг). ОЦК делится в соотношении 1:1 на:
1) непосредственно циркулирующую по сосудам,
2) депонированную (селезенка, печень, легкие, подкожные сосудистые сплетения - депо крови).
Некоторая часть депонированной крови постоянно обновляется. Под действием нервных и гуморальных факторов большая часть депонированной крови легко мобилизуется в кровоток.
При этом увеличивается венозный возврат, возрастает МОК, а также повышается АД, в большей степени диастолическое.
2.2. Механизмы венозного возврата по системе нижней полой вены.
Переход человека в вертикальное положение сопровождается падением ударного объема падает на 40-50 %, сердечного выброса - на 30 %, частота сердечных сокращений увеличивается на 10-20 ударов в минуту. Причиной этих изменений является перераспределение объема крови из интраторакального сосудистого ложа в нижние конечности. При этом количество крови в сердце и легочном круге падает примерно до 25 % (Heyman F., Strid K., 1994).
Perko G. et al. (1995) c помощью электрического импеданса определяли изменения объемов жидкостей тела человека в различных его положениях. Увеличение электрического импеданса на уровне груди и уменьшение на уровне нижних конечностей при вставании соответствует перемещению около 80 % крови из внутригрудного вместилища в нижние конечности. Точка индифферентности сосудистого объема располагалась между пупком и гребнем подвздошной кости и была независима от активации мышечно-венозной помпы.
Исследования Vanhoutte P.M. (1991) позволили определить, что при вставании появляется большой гидростатический градиент. В брюшной полости увеличение венозного гидростатического давления выравнивается увеличенным тканевым давлением, создаваемым висцеральной оболочкой брюшины. Висцеральные вены располагаются в идеальной позиции для модуляции сосудистой емкости. В конечностях артериальное и венозное давления увеличиваются одинаково при гидростатической нагрузке, так как в движущей силе кровотока изменений не происходит.
Повышение давления в венах нижних конечностей имеет два следствия. Одним из них является увеличение капиллярного давления, вызывающее повышенную фильтрацию, другим - скопление крови в венозном русле. Аккумуляция крови в венах нижних конечностей ограничивается механическими свойствами венозной стенки и при помощи клапанов, которые, по мнению автора, «подразбивают» столб крови на сегменты. Давление внутри таких сегментов меньше, чем, если бы не было клапанов. В результате повышения венозного давления в нижних конечностях аккумулируется дополнительно несколько сот мл крови.
Механизмы компенсации венозного возврата в условиях ортостаза были изучены при пассивном наклоне с переходом в вертикальное положение. Венозное кровообращение регистрировалось с помощью эходопплерокардиографии у 30 здоровых добровольцев в 4 положениях: в лежачем на спине, и при 20, 40, 60 градусах вертикального наклона (Guazzi M. et al. 1995). В указанных уровнях наклона часть исследуемых (20 человек) находилась по 10 минут, другая (10 человек) - по 45 минут. При 20 градусах наклона частота сердечных сокращений, артериальное давление, конечно-диастолический и ударный объемы были устойчивы. Однако диастолическая площадь правого желудочка была уменьшена на 18 %, пиковые трансмитральные и транстрикуспидальные Е скорости правого и левого желудочков были снижены на 14% и 17%, соответственно, и Е/А скоростное пиковое отношение желудочков уменьшилось на 6% и 13%, соответственно. Различие в предсердно-желудочковом давлении было снижено с обеих сторон, апредсердный вклад в желудочковое заполнение сохранялся. Полученные результаты при 20 градусах вертикального наклона могут быть объяснены с позиции диастолической желудочковой взаимозависимости: правопредсердное давление и правожелудочковый объем уменьшаются в ответ на уменьшенный венозный возврат; уменьшение объема правого желудочка будет увеличивать левожелудочковую диастолическую растяжимость и уменьшать левопредсердное давление, облегчая в действительности заполнение желудочка. Сразу после наклона, легочный бассейн крови поддерживает левожелудочковое заполнение и выброс, что компенсирует немедленное уменьшение в правожелудочковом ударном объеме, благодаря чему сохраняется нормальный ударный объем правого желудочка, несмотря на сниженную преднагрузку. Таким образом, нормальное сердце способно к компенсации небольшого или умеренного уменьшения венозного возврата, главным образом, за счет гемодинамического урегулирования в сердце и легких. При более значительных уровнях ограничения венозного возврата (при 40% и 60% вертикального наклона) это урегулирование было недостаточно, и уменьшение ударного объема частично компенсировалось увеличением частоты сердечных сокращений без инотропного эффекта. Адаптивные ответы при тех же уровнях наклона при продолжительности 45 минут не становились истощенными у нормальных людей, и были сопоставимы с таковыми для 10 минутной продолжительности.
ВЕНОЗНЫЙ ВОЗВРАТ ПРИ ДВИЖЕНИИ
При движении во время езды на велосипеде объем крови в нижних конечностях уменьшается приблизительно на 30 %, в то время как конечно-диастолический объем сердца увеличивается на 10 %, легочный объем крови - на 20 %. При повышении нагрузки объем крови в нижних конечностях уменьшается еще больше (до 23 %), снижается объем крови в брюшной полости, особенно в селезенке (около 50 %), почках (около 25 %), печени (около 20 %), а легочный объем крови продолжал увеличиваться (до 50 %) (Flamm S.D., Taki J., Moore R. et al., 1990) Эти исследования показали, что нагрузка в вертикальном положении приводит к перераспределению крови от нижних конечностей и брюшных органов к сердцу и легким отчетливо коррелируя в динамическом процессе с потреблением кислорода. На основании полученных данных можно утверждать, что в этих условиях легкие могут действовать как гемодинамический буфер в течение периодов остро увеличенного венозного возврата.
При нагрузке сердце получает повышенный приток крови в результате действия, главным образом, мышечных насосов нижних конечностей и других групп мышц верхних конечностей, груди и живота (Linden R.J., 1995). Показатели гемодинамики при физической нагрузке изменяются следующим образом: частота сердечных сокращений увеличивается в 2,5 раза по сравнению с покоем, сердечный выброс увеличивается 5-6 раз, но ударный объем максимально повышается только вдвое. Прирост ударного объема возникает как из-за увеличения конечно-диастолического объема, который, в свою очередь может повышаться не более чем на 50 %, так и за счет снижения конечно-систолического объема также не более чем на 50 %. Ограничение увеличения размеров сердца и объемов его полостей является функционально выгодным и поддерживается 3-мя механизмами: закон Франка-Старлинга, повышенная активность симпатических нервов, увеличение частоты сердечных сокращений. В соответствии с законом Франка-Старлинга, повышенный приток крови к сердцу увеличивает конечно-диастолическое давление и объем желудочка, что растягивает мышечные волокна и приводит к повышенной силе сокращения и увеличению ударного объема. Увеличение активности влияния симпатических нервов на сердечную мышцу приводит к уменьшению конечно-систолического объема и увеличению ударного объема сердца. Наиболее важным механизмом, контролирующим размеры сердца при увеличении венозного возврата, является изменение частоты сердечных сокращений. Этот механизм связан с возникновением сердечного рефлекса с участием предсердных рецепторов. Предсердные рецепторы располагаются в субэндокардиальном слое на уровне соединений верхней и нижней полых вен и правого предсердия, легочных вен и левого предсердия. Они оказываются чувствительны к изменениям размеров и давления в полости предсердий. Афферентным путем рефлекса являются блуждающие нервы, эфферентным - симпатические нервы сердца. Повышенный приток крови повышает давление в предсердиях, что увеличивает импульсацию предсердных рецепторов и заканчивается увеличением частоты сердечных сокращений. Увеличение частоты сердечных сокращений уменьшает время заполнения и поддерживает конечно-диастолический объем на относительно постоянном уровне, несмотря на повышение венозного возврата.
При движении в вертикальном положении начинает работать мышечно-венозная помпа голени. Этот насос работает следующим образом: во время мышечной систолы опорожняются мышечные вены, кровь из синусов выбрасывается в глубокие венозные магистрали, резко повышая в них объемную скорость кровотока. Дистальные клапаны в глубоких и коммуникантных венах вследствие возникающего гидростатического градиента закрываются, препятствуя возникновению ретроградного кровотока. В поверхностных венах происходит кратковременный стаз с повышением давления. Во время расслабления мышц венозная кровь поступает в синусы из мышечных вен, и, через арочные вены, из магистральных вен.
Нормально функционирующая мышечно-венозная помпа способна поддерживать венозный отток от нижних конечностей соответственно артериальному притоку при нагрузке, без дополнительного расширения вен нижних конечностей, довольно значимо снижая венозное давление стопы. Помимо снижения венозного давления важными механизмами работы помпы является снижение капиллярного давления, освобождение объемов крови, дополнительно скопившейся при переходе в вертикальное положение.
В исследованиях Alimi Y.S., Barthelemy P., Juhan C. (1994) представлены данные о нормальных взаимоотношениях давления в трех вместилищах мышечно-венозной помпы (поверхностном и глубоком; задних и переднем большеберцовом) и венозного давления в большой подкожной (БПВ) и подколенной (ПВ) венах в различных положениях тела при работе насоса. В покое в положении сидя и, особенно, стоя происходит повышение венозного давления только в БПВ и ПВ в результате гидростатической силы венозного столба крови без повышения давления в мышечных вместилищах, клапаны которых способны противодействовать этому воздействию. В положении на корточках давление в мышечных вместилищах значительно повышается и вызывает дополнительное повышение венозного давления в ПВ, хотя давление в БПВ незначительно падает. Во время приема Valsalva клапанная протекция мышечных вместилищ оказывается несостоятельной, что приводит к повышению давлений в заднем глубоком и переднем большеберцовом вместилищах. При этом важно отметить, что венозное давление в БПВ и ПВ во время приема Valsalva растет только тогда, когда тело полностью выпрямлено как в положении лежа или стоя. В положении на корточках такого дополнительного повышения за счет приема Valsalva не происходит вследствие, по всей вероятности, компрессии бедренной вены паховой связкой. В течение сгибания стопы действие мышечно-венозной помпы происходит, главным образом, благодаря сокращению переднего большеберцового вместилища, а разгибание - глубокого заднего вместилища. Большого значения действие поверхностного заднего вместилища не имеет. В течение каждого движения значительное повышение давления происходило в одном из вместилищ и вызывало повышение венозных давлений БПВ и ПВ. При этом давление в ПВ изменялось незначительно, демонстрируя хороший венозный отток в случае действия нормально функционирующей мышечно-венозной помпы. Давление в БПВ в течение сгибания стопы повышалось значительнее, чем при разгибании. Поэтому, создается впечатление, что мышечная активность имеет влияния главным образом на вариации давления в поверхностной венозной системе.
Таким образом, можно говорить о центральных и периферических механизмах венозного возврата. К центральным механизмам можно отнести деятельность сердца, легких и диафрагмы, функционирующих в тесном взаимодействии. К периферическим механизмам - реактивность и состояние венозных сосудов, тонус окружающих тканей и деятельность мышечно-венозной помпы.
1.3. Физиология венозного оттока из нижних конечностей
Венозная система находится под постоянным влиянием гравитационного поля Земли. В горизонтальном положении тела человека вектор силы тяжести направлен практически перпендикулярно оси конечности и ее магистральных вен, что нивелирует его действие на флебогемодинамику. При вертикальном положении вектор силы тяжести становится направленным против тока крови. Давление крови, возникающее при сокращении левого желудочка сердца, в большей мере расходуется на прохождение артериального и капиллярного русла, и лишь небольшая его часть передается венозной крови.
Следует условно говорить о центральных и периферических механизмах венозного возврата. К центральным механизмам можно отнести деятельность сердца, легких и диафрагмы, функционирующих в тесном взаимодействии. К периферическим механизмам — реактивность и состояние венозных сосудов, тонус окружающих тканей, деятельность мышечного насоса и мышечно-венозной помпы.
На уровне венозного конца капиллярного русла давление крови составляет 15—20 мм рт. ст., а в венулах — 10—15 мм рт. ст., что соответствует давлению в венозной системе в горизонтальном положении. Давление крови в венах на уровне лодыжки, в ортостазе, напрямую зависит от роста человека [Швальб П. Г., 2009].
Возросшее венозное давление в неподвижном ортостазе создает препятствия для оттока крови. Устранить это препятствие возможно только путем воздействия, приложенного к венозной системе извне. На уровне капилляров для этого существует так называемый мышечный насос, описанный в трудах В. Т. Назарова (1986) и Н. И. Аринчина (1988). Суть его работы можно наглядно представить следующим образом: неподвижно закрепим отдельно взятую мышцу за сухожилия на противоположных ее концах. Затем следует растянуть ее за сухожилия в разные стороны. Поскольку сухожильные волокна вплетаются в мышечные, нагрузка будет почти равномерно распределена на всю мышцу. При сокращении мышечные волокна сдавят находящиеся в ней капилляры и другие мелкие сосуды. При этом кровь выдавится из мышцы по направлению к отводящей вене. Теперь отпустим сухожилия, и мышца, благодаря своей эластичности, приобретет первоначальную форму. Внутри ее сосудов образуется вакуум, вследствие чего они моментально заполнятся кровью, причем обратный ток крови из вен будет затруднен за счет наличия в них клапанов. Поэтому мышца будет заполняться кровью из артериального конца. Если начать ритмично производить растягивание-расслабление данной мышцы, то она будет работать как насос, перекачивая кровь от артериального конца к венозному. В экспериментах показано, что скелетная мышца представляет собой весьма мощный насос и способна создавать «на выходе» давление в 200 мм. рт. ст. и более. При этом насосная функция мышц возникает не только при ритмических сокращениях, но и при статическом напряжении. Поскольку мышечный аппарат неподвижно стоящего человека находится в постоянном тоническом напряжении, а для удержания равновесия человек производит непроизвольные малозаметные движения, можно считать, что этот механизм ответственен за длительную по времени компенсацию оттока крови в неподвижном ортостазе. Однако обеспечить полную компенсацию венозного оттока в длительном неподвижном ортостазе он не в состоянии. Для обеспечения нормальной перфузии тканей необходимо, чтобы давление в венозном конце русла стало ниже существующего на артериальном конце — т. е. ниже 35 мм рт. ст. Для этого необходимо включение в работу так называемой мышечной венозной помпы. При переходе к ходьбе эти механизмы совместно обеспечивают быстрое снижение давления венозной крови у лодыжки с 85 до 25 мм рт. ст. и перекачивает порядка 75% крови от нижних конечностей. Действие мышечной венозной помпы похоже на работу описанного мышечного насоса. Различие заключается в размерах сосудов, сдавливаемых мышечными волокнами. Если в первом случае речь идет преимущественно о мелких сосудах, то во втором случае мышечный массив икроножной, камбаловидной и длинной малоберцовой мышц сдавливают венозные синусы. Последние представляют собой своего рода «мешки» веретенообразной формы, заполняемые венозной кровью. Средний объем всех венозных синусов голени составляет около 45 см3. При мышечном сокращении объемы крови, содержащиеся в них, получают ускорение и выбрасываются в бассейн подколенной вены. При мышечном расслаблении венозные клапаны не дают синусам заполняться кровью из вышележащих отделов. Кроме мышечной венозной помпы голени выделяют венозную помпу стопы, которая вносит определенный вклад в обеспечение оттока крови по венам нижних конечностей.
Учитывая, что непременная составная часть мышечной венозной помпы — фасциальный футляр, мы решили установить, является ли фасциальный футляр подкожных вен, в частности БПВ, составной частью механизма оттока по этим венам. Исследовав методом ультразвукового ангиосканирования нижних конечностей 28 человек (54 конечности), в положении стоя и при имитации ходьбы, мы выявили зависимость между диаметром БПВ и степенью натяжения поверхностной фасции. При попеременном натяжении и расслаблении фасциального футляра, окружающего БПВ, кровь из сегмента вены вытесняется по направлению к сафенофеморальному соустью. Так была выявлена активная гемодинамическая функция фасциального футляра БПВ. Обнаруженный механизм был назван «поверхностной венозной помпой» [Стойко Ю. М., Мазайшвили К. В., 2009].
В работе описанных механизмов существенную роль играют венозные клапаны. Изучить биомеханику их работы удалось лишь совсем недавно, с появлением ультразвукового оборудования с возможностью прямой визуализации движения крови без использования эффекта Допплера (режим B-flow). Исследования американского ученого F. Lurie (2003) показали, что в работе венозных клапанов существует цикл из четырех фаз. На продольном срезе венозные клапаны похожи на воронку, обращенную суженной частью по направлению к сердцу. Эта суженная часть представляет собой створки с тончайшими вуалеобразными выростами, которые колеблются внутри сосуда подобно полотнищу на ветру. Они крайне чувствительны к давлению, создаваемому вокруг. При придании потоку крови ускорения (за счет любых механизмов) створки клапанов расходятся в стороны и между ними (за счет меньшей площади просвета) возникает струя крови, движущейся с высокой скоростью (фаза открытия). Створки клапанов расходятся до определенного расстояния, пока за ними не возникнет вихреобразный поток, который начинает «кружить» в клапанном синусе. Этот вихревой поток создает давление на створки, заставляя их двигаться навстречу друг другу (т. е. закрываться). Пока давление на створки со стороны просвета сосуда и со стороны клапанного синуса динамически друг друга уравновешивают, створки клапана остаются открытыми (равновесная фаза). Но постепенно ускорение исчезает, а с ним падает и скорость движения крови. Давление на створки со стороны клапанных синусов становится больше (фаза закрытия). Клапан закрывается, пока кровь не получит следующий импульс (фаза закрытого клапана).
Существует мнение [Швальб П. Г., 2009], что наиболее важным для обеспечения адекватного венозного оттока в ортостазе является величина так называемого венозного сопротивления. Введение понятия венозного сопротивления позволяет с иных позиций рассмотреть некоторые вопросы патогенеза ХВН. В частности, это понятие позволяет интегрально соединить два таких, казалось бы, противоположных явления, как увеличение площади венозного русла при варикозной болезни и уменьшение его при посттромботической болезни, и создать единую гемодинамическую концепцию развития ХВН.
Тем не менее ни у кого не вызывает сомнения, что обеспечить адекватный отток крови от нижних конечностей в вертикальном положении возможно только за счет механизмов, действующих во время движения конечностями, придающих ускорение потоку крови. Как изменяются эти механизмы при нарушениях венозного кровотока в различных отделах венозной системы — остается пока недостаточно изученным.
Физиология
Переход в вертикальное положение сопровождается падением ударного объема падает на 40-50 %, сердечного выброса - на 30 %, частота сердечных сокращений увеличивается на 10-20 ударов в минуту.
Причиной этих изменений является перераспределение объема крови из интраторакального сосудистого ложа в нижние конечности. При этом количество крови в сердце и легочном круге падает примерно до 25 % (Heyman F., Strid K., 1994). Perko G. et al. (1995) c помощью электрического импеданса определяли изменения объемов жидкостей тела в различных его положениях. Увеличение электрического импеданса на уровне груди и уменьшение на уровне нижних конечностей при вставании соответствует перемещению около 80 % крови из внутригрудного вместилища в нижние конечности. Точка индифферентности сосудистого объема располагалась между пупком и подвздошным гребнем и была независима от активации мышечно-венозной помпы.
Исследования Vanhoutte P.M. (1991) позволили определить, что при вставании появляется большой гидростатический градиент. В брюшной полости увеличение венозного гидростатического давления выравнивается увеличенным тканевым давлением, создаваемым висцеральной оболочкой брюшины. Висцеральные вены располагаются в идеальной позиции для модуляции сосудистой емкости. В конечностях артериальное и венозное давления увеличиваются одинаково при гидростатической нагрузке, так как в движущей силе кровотока изменений не происходит. Повышение давления в венах нижних конечностей имеет два следствия. Одним из них является увеличение капиллярного давления, вызывающее повышенную фильтрацию, другим - скопление крови в венозном русле. Аккумуляция крови в венах нижних конечностей ограничивается коллагеновыми волокнами венозной стенки и при помощи клапанов, которые, по мнению автора, «подразбивают» столб крови на сегменты. Давление внутри таких сегментов меньше, чем, если бы не было клапанов. В результате повышения венозного давления в нижних конечностях аккумулируется дополнительно несколько сот мл крови.
Механизмы компенсации венозного возврата в условиях ортостаза были изучены при пассивном наклоне с переходом в вертикальное положение. Венозное кровообращение регистрировалось с помощью эходопплерокардиографии у 30 здоровых добровольцев в 4 положениях: в лежачем на спине, и при 20, 40, 60 градусах вертикального наклона (Guazzi M. et al. 1995). В указанных уровнях наклона часть исследуемых (20 человек) находилась по 10 минут, другая (10 человек) - по 45 минут. При 20 градусах наклона частота сердечных сокращений, артериальное давление, конечно-диастолический и ударный объемы были устойчивы. Однако диастолическая площадь правого желудочка была уменьшена на 18 %, пиковые трансмитральные и трикуспидальные Е скорости правого и левого желудочков были снижены на 14% и 17%, соответственно, и Е/А скоростное пиковое отношение желудочков уменьшилось на 6% и 13%, соответственно. Различие в предсердно-желудочковом давлении было снижено с обеих сторон, и предсердный вклад в желудочковое заполнение сохранялся.
Полученные результаты при 20 градусах вертикального наклона могут быть объяснены с позиции диастолической желудочковой взаимозависимости: правопредсердное давление и правожелудочковый объем уменьшаются в ответ на уменьшенный венозный возврат; уменьшение объема правого желудочка будет увеличивать левожелудочковую диастолическую растяжимость и уменьшать левопредсердное давление, облегчая в действительности заполнение желудочка. Сразу после наклона, легочный бассейн крови поддерживает левожелудочковое заполнение и выброс, что компенсирует немедленное уменьшение в правожелудочковом ударном объеме, благодаря чему сохраняется нормальный ударный объем правого желудочка, несмотря на сниженную преднагрузку.
Таким образом, нормальное сердце способно к компенсации небольшого или умеренного уменьшения венозного возврата, главным образом, за счет гемодинамического урегулирования в сердце и легких. При более значительных уровнях ограничения в енозного возврата (при 40% и 60% вертикального наклона) это урегулирование было недостаточно, и уменьшение ударного объема частично компенсировалось увеличением частоты сердечных сокращений без инотропного эффекта. Адаптивные ответы при тех же уровнях наклона при продолжительности 45 минут не становились истощенными у нормальных людей, и были сопоставимы с таковыми для 10 минутной продолжительности.
ВЕНОЗНЫЙ ВОЗВРАТ ПРИ ДВИЖЕНИИ
При движении во время езды на велосипеде объем крови в нижних конечностях уменьшается приблизительно на 30 %, в то время как конечно-диастолический объем сердца увеличивается на 10 %, легочный объем крови - на 20 %. При повышении нагрузки объем крови в нижних конечностях уменьшается еще больше (до 23 %), снижается объем крови в брюшной полости, особенно в селезенке (около 50 %), почках (около 25 %), печени (около 20 %), а легочный объем крови продолжал увеличиваться (до 50 %) (Flamm S.D., Taki J., Moore R. et al., 1990) Эти исследования показали, что нагрузка в вертикальном положении приводит к перераспределению крови от нижних конечностей и брюшных органов к сердцу и легким тесно коррелируя в динамическом процессе с потреблением кислорода. На основании полученных данных можно утверждать, что в этих условиях легкие могут действовать как гемодинамический буфер в течение периодов остро увеличенного венозного возврата.
При нагрузке сердце получает повышенный приток крови в результате действия, главным образом, мышечных насосов нижних конечностей и других групп мышц верхних конечностей, груди и живота (Linden R.J., 1995). Показатели гемодинамики при физической нагрузке изменяются следующим образом: частота сердечных сокращений увеличивается в 2,5 раза по сравнению с покоем, сердечный выброс увеличивается 5-6 раз, но ударный объем максимально повышается только вдвое. Прирост ударного объема возникает как из-за увеличения конечно-диастолического объема, который, в свою очередь может повышаться не более чем на 50 %, так и за счет снижения конечно-систолического объема также не более чем на 50 %. Ограничение увеличения размеров сердца и объемов его полостей является функционально выгодным и поддерживается 3-мя механизмами: закон Франка-Старлинга, повышенная активность симпатических нервов, увеличение частоты сердечных сокращений. В соответствии с законом Франка-Старлинга, повышенный приток крови к сердцу увеличивает конечно-диастолическое давление и объем желудочка, что растягивает мышечные волокна и приводит к повышенной силе сокращения и увеличению ударного объема. Увеличение активности симпатических нервов к сердечной мышце приводит к уменьшению конечно-систолического объема и увеличению ударного объема.
Наиболее важным механизмом, контролирующим размеры сердца при увеличении венозного возврата, является изменение частоты сердечных сокращений. Этот механизм связан с возникновением сердечного рефлекса с участием предсердных рецепторов. Предсердные рецепторы располагаются в субэндокардиальном слое на уровне соединений верхней и нижней полых вен и правого предсердия, легочных вен и левого предсердия. Они оказываются чувствительны к изменениям размеров и давления в полости предсердий. Афферентным путем рефлекса являются блуждающие нервы, эфферентным - симпатические нервы сердца. Повышенный приток крови повышает давление в предсердиях, что увеличивает импульсацию предсердных рецепторов и заканчивается увеличением частоты сердечных сокращений. Увеличение частоты сердечных сокращений уменьшает время заполнения и поддерживает конечно-диастолический объем на относительно постоянном уровне, несмотря на повышение венозного возврата.
При движении в вертикальном положении начинает работать мышечно-венозная помпа голени. Этот насос работает следующим образом: во время мышечной систолы опорожняются мышечные вены, кровь из синусов выбрасывается в глубокие венозные магистрали, резко повышая в них объемную скорость кровотока. Дистальные клапаны в глубоких и коммуникантных венах вследствие возникающего гидростатического градиента закрываются, препятствуя возникновению ретроградного кровотока. В поверхностных венах происходит кратковременный стаз с повышением давления. Во время расслабления мышц венозная кровь набирается в синусы из мышечных вен, и, через арочные вены, из магистральных вен. Нормально функционирующая мышечно-венозная помпа способна поддерживать венозный отток от нижних конечностей соответственно артериальному притоку при нагрузке, без дополнительного расширения вен нижних конечностей, довольно значимо снижая венозное давление стопы. Помимо снижения венозного давления важными механизмами работы помпы является снижение капиллярного давления, освобождение объемов крови, дополнительно скопившейся при переходе в вертикальное положение.
Исследования Alimi Y.S., Barthelemy P., Juhan C. (1994) представили данные о нормальных взаимоотношениях давления в трех вместилищах мышечно-венозной помпы (поверхностном и глубоком задних и переднем большеберцовом) и венозного давления в большой подкожной (БПВ) и подколенной (ПВ) венах в различных положениях тела при работе насоса. В покое в положении сидя и, особенно, стоя происходит повышение венозного давления только в БПВ и ПВ в результате гидростатической силы венозного столба крови без повышения давления в мышечных вместилищах, клапаны которых способны противодействовать этому воздействию. В положении на корточках давление в мышечных вместилищах значительно повышается и вызывает дополнительное повышение венозного давления в ПВ, хотя давление в БПВ незначительно падает. Во время приема Valsalva клапанная протекция мышечных вместилищ оказывается несостоятельной, что приводит к повышению давлений в заднем глубоком и переднем большеберцовом вместилищах.
При этом важно отметить, что венозное давление в БПВ и ПВ во время приема Valsalva растет только тогда, когда тело полностью выпрямлено как в положении лежа или стоя.
В положении на корточках такого дополнительного повышения за счет приема Valsalva не происходит вследствие, по всей вероятности, компрессии бедренной вены паховой связкой. В течение сгибания стопы действие мышечно-венозной помпы происходит, главным образом, благодаря сокращению переднего большеберцового вместилища, а разгибание - глубокого заднего вместилища. Большого значения действие поверхностного заднего вместилища не имеет. В течение каждого движения значительное повышение давления происходило в одном из вместилищ и вызывало повышение венозных давлений БПВ и ПВ. При этом давление в ПВ изменялось незначительно, демонстрируя хороший венозный отток в случае действия нормально функционирующей мышечно-венозной помпы. Давление в БПВ в течение сгибания стопы повышалось значительнее, чем при разгибании. Поэтому, создается впечатление, что мышечная активность имеет влияния главным образом на вариации давления в поверхностной венозной системе.
Таким образом, можно говорить о центральных и периферических механизмах венозного возврата. К центральным механизмам можно отнести деятельность сердца, легких и диафрагмы, функционирующих в тесном взаимодействии. К периферическим механизмам - реактивность и состояние венозных сосудов, тонус окружающих тканей и деятельность мышечно-венозной помпы.
Чурсин В.В. Клиническая физиология кровообращения (методические материалы к лекциям и практическим занятиям)
Чурсин В.В. Клиническая физиология кровобращения. Методические материалы к практическим и семинарским занятиям, - 2011. - 44 с.
Содержит информацию о физиологии кровообращения, нарушениях кровообращения и их вариантах. Также представлена информация о методах клинической и инструментальной диагностики нарушений кровообращения.
Данные материалы являются переработанным вариантом предыдущих изданий (1999г., 2003г.), первым автором которых являлся В.Ф.Туркин - доцент кафедры анестезиологии и реаниматологии АГИУВ.
Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Введение
Академик В.В.Парин (1965г.) дает такое пояснение: «Клиническая физиология исходит из положения, что в организме при болезни многие возникающие реакции являются приспособительными. Под влиянием чрезвычайных раздражителей приспособительные реакции резко изменяются и, приобретая опасное для организма значение, становятся реакциями патологическими. Переход приспособительных реакций в патологические является узловым звеном в патогенезе заболеваний. А его детальное изучение является одной из главных задач клинической физиологии кровообращения».
Исходя из этого пояснения, можно отметить, что значение клинической физиологии любой системы предполагает:
Более образно это можно представить в следующем виде (рисунок 1).
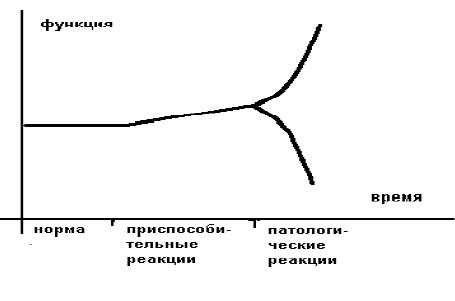
Приспособительные реакции обеспечивают компенсацию, а патологические реакции обуславливают декомпенсацию страдающего органа или страдающей системы. В общем виде отличием (границей) между нормой и приспособлением является изменение свойств приспосабливающего органа или приспосабливающейся системы.
Границей между приспособлением и патологией является резкое изменение ("излом") приспособительной реакции по направлению и величине.
Различают срочные приспособительные реакции и долговременные. Врачам интенсивной терапии чаще приходится иметь дело с острыми расстройствами, поэтому необходимы знания срочных приспособительных реакций и их переход в патологические.
Кровообращение - определение, классификация
Кровообращение - это непрерывное движение (обращение) крови по замкнутой системе, именуемой сердечно-сосудистой.
- 2 - аорта и крупные артерии, имеют много эластических волокон, представляются как буферные сосуды, благодаря им резко пульсирующий кровопоток превращается в более плавный;
- 3 - прекапиллярные сосуды, это мелкие артерии, артериолы, метартериолы, прекапиллярные жомы (сфинктеры), имеют много мышечных волокон, которые могут существенно изменить свой диаметр (просвет), они определяют не только величину сосудистого сопротивления в малом и большом кругах кровообращения (поэтому и называются резистивными сосудами), но и распределение кровопотока;
- 4 - капилляры, это обменные сосуды, при обычном состоянии открыто 20-35% капилляров, они образуют обменную поверхность в 250-350 кв.м., при физической нагрузке максимальное количество открытых капилляров может достигать 50-60%;
- 5 - сосуды - шунты или артериоло-венулярные анастомозы, обеспечивают сброс крови из артериального резервуара в венозный, минуя капилляры, имеют значение в сохранении тепла в организме;
- 7 - вены, крупные вены, они обладают большой растяжимостью и малой эластичностью, в них содержится большая часть крови (поэтому и называются емкостными сосудами), они определяют "венозный возврат" крови к желудочкам сердца, их заполнение и (в определенной мере) ударный объём (УО).
Объем циркулирующей крови (ОЦК)
Вопрос объема имеет важное значение. Прежде всего потому, что определяет наполнение камер сердца и таким образом влияет на величину УО.
По классическому представлению ОЦК составляет у мужчин 77 и у женщин 65 мл/кг массы тела 10%. В среднем берётся 70 мл/кг.
Необходимо чётко представлять, что ОЦК является «жидким слепком сосудистой системы» - сосуды не бывают полупустыми. Ёмкость сосудистой системы может изменяться в достаточно больших пределах, в зависимости от тонуса артериол, количества функционирующих капилляров, степени сдавления вен окружающими тканями («наполненность» интерстиция и тонус мышц) и степенью растянутости свободно расположенных вен брюшной полости и грудной клетки. Разница в ОЦК, определяемая изменением состояния вен, предположительно составляет примерно 500-700 мл у взрослого человека (А.Д.Ташенов, В.В.Чурсин, 2009г.). Мнение, что венозная система может вместить, кроме ОЦК, еще 7-10 литров жидкости, можно считать ошибочным, так как излишняя жидкость достаточно быстро перемещается в интерстиций. Депо ОЦК в организме является интерстициальное пространство, резервная-мобильная емкость которого составляет примерно ещё 1 литр. При патологии интерстиций способен принять около 5-7 литров жидкости без формирования внешне видимых отеков (А.Д.Ташенов, В.В.Чурсин, 2009г.).
Особенностью интерстициальных отеков при некорректной инфузионной терапии является то, что жидкость при быстром поступлении в организм прежде всего уходит в наиболее «мягкие» ткани - мозг, легкие и кишечник.
Последствием этого является наиболее наблюдаемые недостаточности - церебральная, дыхательная и кишечная.
Физиологи на сегодняшний день считают, что практически у среднего человека номинальной величиной ОЦК принимается 5 литров или 5000 см 3 . В ОЦК различают две составных части: объем заполнения (U) и объем растяжения (V) сосудистой системы. U составляет 3300 см., V составляет 1700 см 3 . Последний, объем растяжения имеет непосредственное отношение к давлению крови и скорости объемного потока крови в сосудах.
Избыточная, особенно быстрая, инфузия растворов ведет к увеличению объема, прежде всего в сосудах легких, чем в других органах. При быстрой инфузии, особенно крупномолекулярных растворов (декстраны, ГЭК, СЗП, альбумин) жидкость не успевает переместиться в интерстиций, и при этом жидкость депонируется в первую очередь в легочных венах. Имеются сведения о том, что легочные вены могут дополнительно вместить еще примерно 53% общего легочного объема крови. При дальнейшей избыточной инфузии в действие вступает рефлекс Китаева. При этом рефлексе импульсы с рецепторов перерастянутых легочных вен, возбуждающе действуя на мускулатуру легочных артериол, суживают их, предотвращая таким образом переполнение легочных венозных сосудов.
Из-за спазма легочных артериол при дальнейшей избыточной инфузии наступает объемная перегрузка правых отделов сердца, в первую очередь правого желудочка. При его чрезмерной перегрузке в действие вступает рефлекс Ярошевича. Импульсы с рецепторов легочных артерий, возбуждающе действуя на мускулатуру в устьях полых вен, суживают их, предотвращая таким образом переполнение правых отделов сердца.
Здесь граница, за которой далее приспособление может перейти в патологию. В случае продолжения избыточной инфузии - вследствие избыточного давления в правом предсердии и его перерастяжения возникают следующие условия.
Во-первых ухудшается отток в правое предсердие значительной части крови из коронарных вен. Затруднение оттока по коронарным венам приводит к затруднению притока крови по коронарным артериям и доставки кислорода к миокарду (боль в области сердца).
Во-вторых, может возникнуть рефлекс Бейнбриджа (подробнее - раздел регуляции кровообращения), он вызывает тахикардию, которая всегда увеличивает потребность миокарда в кислороде.
У лиц со скрытой коронарной недостаточностью (что почти никогда не выявляется у больных перед операцией из-за недостаточного обследования) и у лиц с явной ишемической болезнью сердца (ИБС) все это может обусловить возникновение острой коронарной недостаточности вплоть до возникновения острого инфаркта миокарда (ОИМ) с дальнейшим развитием острой сердечной лево-желудочковой недостаточности (ОСЛН).
Если компенсаторные возможности коронарного кровообращения не скомпрометированы и не реализуется рефлекс Бейнбриджа, то дальнейшая объемная перегрузка приводит к растяжению полых вен. При этом с рецепторов, расположенных в устьях полых вен, импульсация поступает к центрам осморегуляции в гипоталамусе (супраоптическое ядро). Уменьшается секреция вазопрессина, приводящая к полиурии (выделению мочи более 2000 мл/сут), что отмечается утром дежурным врачом (и, как правило, безотчётливо) - больной спасает себя. Хорошо, если у больного регуляция водного баланса не нарушена и почки функционируют, в противном случае больной будет «утоплен» с благими намерениями.
Не затрагивая вопросов о «хроническом» уменьшении ОЦК, когда это обусловлено хроническим уменьшением потребления жидкости, коснемся вопроса уменьшения ОЦК, обусловленного именно острой кровопотерей, с чем чаще всего имеют дело врачи анестезиологи-реаниматологи.
По современным представлениям отмечаются следующие приспособительные изменения функции сердечно-сосудистой системы.
Когда ОЦК снижается на 10-20%, то такая кровопотеря представляется компенсируемой. При этом первой приспособительной реакцией является уменьшение емкости венозных сосудов за счёт сдавления их окружающими тканями. Вены из округлых становятся сплющенными или почти полностью спадаются, и таким образом емкость сосудов приспосабливается к изменившемуся объему циркулирующей крови. Венозный приток крови к сердцу и его УО поддерживаются на прежнем уровне. Компенсаторную реакцию организма можно сравнить с ситуацией, когда содержимое неполной 3-х литровой банки переливают в 2-х литровую и она оказывается полной.
Компенсаторным механизмом является и перемещение жидкости из интерстиция за счёт уменьшения венозного давления и увеличения скорости кровотока (укорочения времени изгнания даже без развития тахикардии) - жидкость как бы засасывается из интерстиция. Этот компенсаторный механизм можно наблюдать у доноров при донации, когда экстракция 500 мл крови не приводит к каким-либо изменениям кровообращения.
С уменьшением ОЦК до 25-30% (а это уже потеря растягивающей части ОЦК - V) кровопотеря представляется не компенсируемой за счёт критического уменьшения ёмкости венозной системы. Начинает уменьшаться венозный приток к сердцу и страдает УО. При этом развивается приспособительная (компенсаторная) тахикардия. Благодаря ей поддерживается достаточный уровень сердечного выброса (СВ за минуту = МСВ) за счёт уменьшенного УО и более частых сердечных сокращений. Одновременно с тахикардией развивается сужение периферических артериальных сосудов - централизация кровообращения. При этом ёмкость сосудистой системы значительно уменьшается, подстраиваясь под уменьшенный ОЦК. При сниженном УО и суженных периферических артериальных сосудах поддерживается достаточный уровень среднего артериального давления (АДср) в сосудах, направляющих кровь к жизненно важным органам (мозг, сердце и лёгкие). Именно от величины АДср зависит степень перфузии того или иного органа. Таким образом, развивается приспособительная централизация кровообращения за счет уменьшения кровоснабжения периферических тканей (кожа, скелетные мышцы и т.д.). Эти ткани могут переживать ишемию (I фазу нарушения микроциркуляции) и кислородную недостаточность в течение более продолжительного времени.
Эта реакция аналогична процессу воспаления, при котором организм, образуя грануляционный вал и отторгая омертвевшее, жертвует частью во имя сохранения целого.
Когда ОЦК снижается более чем на 30-40% и восполнение кровопотери задерживается, то такая кровопотеря переходит в разряд некомпенсированной и может стать необратимой. При этом несмотря на тахикардию, СВ уменьшается и снижается АДср. Из-за недостаточного транспорта кислорода в организме усиливается метаболический ацидоз. Недоокисленные продукты метаболизма парализуют прекапиллярные сфинктеры, но периферический кровоток не восстанавливается из-за сохраняющегося спазма посткапиллярных сфинктеров.
Развивается II фаза нарушений микроциркуляции - застойной гипоксии. При этом за счёт ацидоза повышается проницаемость капилляров - плазматическая жидкость уходит в интерстиций, а форменные элементы начинают сладжироваться, образуя микротромбы - развивается ДВС-синдром. К моменту, когда на фоне нарастающего ацидоза парализуются и посткапиллярные сфинктеры (III фаза нарушений микроциркуляции) капиллярное русло уже необратимо блокировано микротромбами.
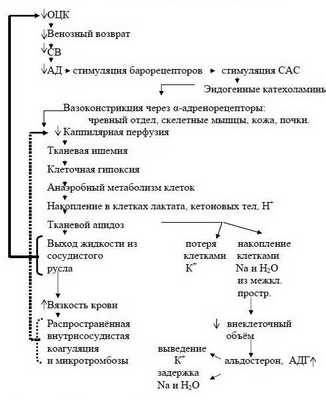
Наступает несостоятельность тканевой перфузии. Во всех случаях затянувшегося синдрома малого СВ присоединяется преренальная анурия. Всё это клиническая форма шока с классической триадой: синдром сниженного СВ, метаболический ацидоз, преренальная анурия. При этом во многих органах, как отмечает профессор Г.А.Рябов, "наступают необратимые изменения и даже последующее восполнение кровопотери и восстановление ОЦК не всегда предотвращает смертельный исход из-за осложнений, связанных с необратимыми изменениями в некоторых органах" - развивается полиорганная недостаточность (ПОН) или мультиорганная дисфункция (МОД).
Последовательность в нарушениях гомеостаза при кровопотере схематически представлена на рисунке 2 (Р.Н.Лебедева и сотр., 1979 г.).
Таким образом, при абсолютном снижении ОЦК практически любого происхождения границей перехода приспособления в декомпенсацию является увеличение частоты сердечных сокращений (ЧСС) с одновременным снижением СВ и АДср.
Данное положение не применимо к случаям, когда имеется относительное уменьшение ОЦК за счет патологической вазодилятации.
Следует учитывать и то, что очень часто острая кровопотеря сопровождается болью и это вносит разлад в последовательность компенсаторных механизмов - раньше чем нужно и в большем количестве выбрасываются эндогенные катехоламины. Централизация развивается быстрее и времени на спасение больного остается меньше.
Читайте также:
