УЗИ, ЭхоКГ при аортальном стенозе у плода
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Московский областной НИИ акушерства и гинекологии (МОНИИАГ), Россия.
Гомельский областной медико-генетический центр с консультацией "Брак и семья", Гомель, Беларусь.
УЗИ аппарат HS40
Лидер продаж в высоком классе. Монитор 21,5" высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
- Семьи, имеющие ребенка с ВПС.
- Семьи с ВПС у одного или обоих супругов.
- Женщин, страдающих сахарным диабетом, системными заболеваниями соединительной ткани, гипотиреозом.
- Беременных с тератогенной экспозицией в ранние сроки беременности (герпес ранее 6-7-й недели) [2].
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): "Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга".
Главная цель пренатальной диагностики сформулирована специалистами пренатальной диагностики всего мира - это обеспечение женщины максимально возможной информацией о пороке как можно раньше. Мы должны дать право женщине и семье в целом решать вопрос о пролонгировании беременности с грубыми пороками развития у плода [4].
С каждым годом все большее количество публикаций посвящается диагностике ВПС в ранние сроки - в I триместре беременности 6. Практически ни один из выпусков журнала ISUOG (Ultrasound In Obstetrics and Gynecology, или "белого" журнала, как его называют специалисты) не обходит своим вниманием тему ранней диагностики врожденных пороков развития.
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат "перу" специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
При эхокардиографии изучались четырехкамерный срез сердца плода (рис. 1) и срез через три сосуда (рис. 2). УЗИ проводилось трансабдоминальным датчиком, лишь при необходимости (затрудненная визуализация) использовался внутриполостной датчик. Четырехкамерный срез сердца плода при ультразвуковом сканировании трансабдоминальным датчиком визуализировался в 85% случаев, срез через сосуды - в 73%, при использовании трансвагинального датчика эти цифры существенно возрастали до 100 и 91% соответственно. Оптимизация пренатальной диагностики ВПС может быть достигнута путем строгого соблюдения основных методических правил. При оценке четырехкамерного среза плода необходимо оценить нормальное расположение сердца плода, исключив его эктопию (рис. 3), положение оси сердца плода, что не представляет никаких трудностей, нормальные пропорции и размеры камер сердца, движение створок атриовентрикулярных клапанов должно быть свободным, септальная створка трикуспидального клапана должна располагаться ближе к верхушке сердца (рис. 4). При оценке среза через три сосуда необходимо оценить взаиморасположение сосудов и их диаметр.
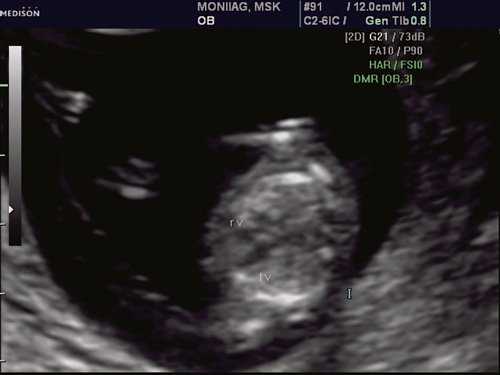
Рис. 1. Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.
Патологии сердца плода, которые можно определить на скрининговом УЗИ
Основные пороки сердца у плода формируются в 1 триместре беременности на сроке 12-14 недель. Это может быть реакция на внешние факторы либо генетические проблемы. К этому сроку происходит формирование сердечной мышцы плода, поэтому будущей матери необходимо пройти УЗИ обследование на выявление патологий органа.

Во внутриутробном развитии пороки сердца возникают как реакция организма на нарушение плацентарного кровообращения либо воздействие канцерогенных веществ (формальдегиды, никотин, токсические вещества).
Аномалии положения сердца плода
Среди аномалий расположения сердца выделяют эктопию сердца (размещение вне грудной клетки). К таким патологиям относят декстрокардию (смещение сердца в правую сторону относительно нормального положения) и мезокардию (расположение сердца не с левой стороны грудины, а по срединной линии тела).
Эктопия сердца у плода возникает на сроке 14-18 дней с момента зачатия мезадерма начинает развиваться неправильно, что вызывает неправильное срастание брюшной стенки. У плода либо отсутствует диафрагма вообще, либо нет диафрагмального сегмента перикарда.
Из-за отверстия в стенке между правым и левым желудочком слышны интракардиальные шумы. Также у плода эктопия сердца нередко сопровождается другими аномалиями — гидроцефалией, энцефалоцеле и пр.
Надо сказать, что существует высокая вероятность ошибочного диагноза по установки положения сердца. При тазовом предлежании плода на УЗИ сердца визуализируется справа, хотя на самом деле оно располагается в положенном месте.
В 71% случаев эктопия сердца вызывается плевральным выпотом, кистозным аденоматозным пороком развития лёгкого, диафрагмальной грыжей.
Различают четыре вида эктопии:
- абдоминальная (сердце находится в брюшине);
- грудная (сердце выходит наружу через дефекты грудины);
- торакоабдоминальная (пентада Кантрелла — сложнейшая патология, имеющая комплекс отклонений от нормы);
- шейная (сердце смещается в область сердца).
Грудная эктопия встречается в 55-60% случаев, торакоабдоминальная — в 38%, шейная — почти в 3%. Выживаемость составляет около 10%. В большинстве случаев при эктопии младенец либо рождается мёртвым, либо умирает сразу после рождения.
Патология сопровождается смещением других внутренних органов, которые не защищены от механических повреждений и подвержены инфекциям и вирусам больше обычного.
Врождённые дефекты сердца
Пять наиболее встречаемых дефектов — это тетрада Фалло, дефект межжелудочковой перегородки, транспозиция магистральных сосудов, коарктация аорты, гипоплазия левых камер.
Оптимальным сроком для проведения ультразвуковой диагностики сердца плода считается период 24-26 недель беременности. Именно в это время анатомические структуры сердца максимально визуализируются, а на более ранних сроках можно увидеть только явные и глобальные пороки сердца.
Наиболее информативен ультразвуковой осмотр 4-камерного среза сердца. После которого при любом отклонении от нормы женщина отправляется на более детальное обследование плода с использованием допплеровской эхокардиографии. Также проводится кариотипирование, потому что в 30% случаев аномалии являются результатом хромосомных нарушений.
Что выявляет УЗИ
В нашей клинике используется современное 4D оборудование, имеющее допплеровский режим. С его помощью можно получить изображение 3-х главных сосудов — верхней полой вены, лёгочного ствола и восходящей аорты. Во время обследования выявляется не только расположение сосудов, но и их диаметр и другие параметры.
На экране монитора будут видны следующие патологии плода:
- Уменьшение диаметра аорты при расширении лёгочного ствола можно говорить об гипоплазии (недоразвитости) левых отделов сердца малыша, отвечающих за начало кровообращения;
- Уменьшение ствола лёгочной артерии в размерах при сохранении в норме диаметров аорты и верхней полой вены указывает на стеноз (сужение) лёгочной артерии. У плода выявляются только выраженные формы;
- Маленький диаметр аорты при нормальном 4-камерном строении сердца является следствием коарктации аорты (сужение аорты сердца в определённом сегменте);
- Визуализация 2 сосудов вместо 3 может быть следствием соединения сосудов в общий артериальный ствол;
- Смещение аорты вперёд или правее лёгочной артерии наблюдается при транспозиции магистральных сосудов;
- Диаметр аорты расширен, но при этом сужен диаметр лёгочной артерии, а аорта смещена вперёд. Это может является тетрадой Фалло (очень тяжёлая сочетанная аномалия сердца). Проблема включает в себя стеноз или гипертрофию выходного отдела правого желудочка, дефект межжелудочковой перегородки, декстропозицию аорты (отхождение в правую сторону). Диагностика плода крайне затруднительна, поэтому на помощь приходит допплеровский режим, помогающий визуализировать поток крови в аорту из обоих желудочков;
- Гипоплазия (недоразвитость) правых камер сердца определяется по уменьшению их размеров относительно левых камер. Эта патология сопровождается обычно дисплазией (провисанием или выбуханием) митрального клапана;
- Общий предсердно-желудочковый канал виден как дефект перегородки сердца с расщеплением атриовентрикулярного клапана;
- Гипопластический синдром левых отделов сердца проявляется в виде недоразвития желудочка и митрального и аортального клапанов;
- Единственный желудочек также не является нормой, потому что их должно быть два и они хорошо просматриваются в четырёхкамерном срезе;
- При недоразвитости трёхстворчатого клапана кровь из правого предсердия не попадает в левое, что хорошо видно при допплеровском исследовании;
- Со 2 триместра фиброэластоз эндокарда визуализируется как утолщение миокарда и ухудшении его сокращения;
- Недоразвитие миокарда одного из желудочков (аномалия Уля) заметна на 2 триместре.
Какие патологии сердца у плода сложно выявить на скрининговом УЗИ
Трудности в диагностике заболеваний сердца на УЗИ вызывают следующие патологии органа:
- дефект межпредсердной перегородки;
- дефект межжелудочковой перегородки;
- транспозиция главных артерий.
При подозрении на их наличие, пациентка должна регулярно наблюдаться и соблюдать все рекомендации гинеколога.
Коарктация аорты у плода. Точность и ошибки диагностики
ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова" Минсоцразвития РФ, Москва.

Журнал "SonoAce Ultrasound"
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Распределение диагностики ВПС в зависимости от нозологической формы значительно варьирует. Определенные ВПС пренатальная диагностика позволяет выявить в 90% случаев. Цифры статистики неумолимо показывают низкий процент выявления ВПС (30%) по результатам скринингового исследования. В специализированных учреждениях частота выявления ВПС выше и достигает 54% [1, 2].
Точность ультразвуковой диагностики патологии плода за последние годы многократно подвергается критике со стороны акушеров-гинекологов и в большей степени педиатров. Порой клинические признаки интересуют специалистов значительно меньше, чем данные ультразвукового антенатального исследования плода.
В этой работе представлен анализ возможностей ультразвукового пренатального исследования при коарктации аорты. В работе учтены данные, имеющиеся в публикациях отечественных и зарубежных авторов, а также материал отделения функциональной диагностики Центра.
Латинский термин "сoarctatius" означает "суженный, стиснутый". Впервые его описал J.F. Meckel в 1750 году. Коарктация аорты - это патологическое сужение ее просвета, которое может возникнуть в любом месте по всей ее длине. Частота порока составляет 6,3%, по данным клинических наблюдений из выборки в 2000 случаев [3], и 8,4% по результатам патологоанатомического материала [4].
У детей первого года жизни коарктация аорты занимает четвертое место cреди ВПС. Как правило, она развивается дистальнее места ответвления левой подключичной артерии вблизи артериального протока (ductus arteriosus). В зависимости от локализации сужения аорты относительно артериального протока различают два классических типа коарктации: предуктальную и постдуктальную [5].
При наличии сужения аорты клиническая картина может нарастать как шквал после закрытия артериального протока. В течение первого года погибают 56% пациентов. В основном смертельный исход бывает вызван сочетанием коарктации с другими аномалиями сердца. Изолированная форма в первые недели и дни жизни также характеризуется высоким процентом смертности (34%). Если этот период дети переживают, то продолжительность жизни в среднем составляет 30-50 лет. Причиной смерти у новорожденных является сердечно-легочная недостаточность. При артериальной высокой гипертензии, как исключение, может быть кровоизлияние в мозг.
В ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова " Минсоцразвития РФ за двухлетний период (2010-2011) родились 27 детей с аномалиями аорты, от незначительного сужения до полного перерыва. В 15 наблюдениях в отделении функциональной диагностики диагноз был поставлен антенатально. Это были беременные, обратившиеся в поздние сроки от 35 до 39 нед гестации. Во всех наблюдениях патология аорты сочеталась с гипоплазией левого желудочка. Диагноз был подтвержден во всех случаях. В изолированном виде коарктация аорты за этот период была диагностирована в 6 наблюдениях. В 3 из них диагноз был поставлен антенатально, в 2 - сужение было выявлено у новорожденных на 3-5-е сутки после закрытия артериального протока. В одном случае после рождения был поставлен диагноз кинкинг аорты. Таким образом, наши данные свидетельствуют о сложности и невысоком проценте выявления изолированной коарктации аорты. Лишь в тех наблюдениях, когда имеются выраженные гемодинамические нарушения, приводящие к значительным анатомическим изменениям в виде гипоплазии левого желудочка, диспропорции желудочков сердца, увеличения диаметра легочной артерии диагноз с большой достоверностью может быть поставлен антенатально.
Первые работы по диагностике коарктации аорты у плода относятся к 1984 г. [6, 7]. По данным литературы, трансвагинальный доступ в 12-15 нед гестации позволяет диагностировать коарктацию аорты в 21,4% случаев [1]. При трансабдоминальном доступе частота выявления коарктации аорты увеличивается: в 16-30 нед она составляет 43%, после 30 нед, по мере прогрессирования гемодинамических нарушений, не превышает 54% [8].
Согласно результатам скринингового ультразвукового обследования 20 248 плодов при сроках 19-22 нед беременности в крупном регионе Германии (1990-1994) пренатальный диагноз коарктации аорты не был установлен ни в одном из 7 случаев. Аналогичные данные были получены в Норвегии, даже в специализированном центре пренатальной диагностики. Согласно данным мультицентрового анализа, проведенного в 12 европейских странах, точный пренатальный диагноз изолированной коарктации аорты в конце 90-х гг. был установлен только в 9 (15,8%) из 57 случаев [9]. Средний срок обнаружения изолированной коарктации составил 22 нед, при этом 7 из 9 случаев было выявлено до 24 нед. При сочетании коарктации аорты с экстракардиальными пороками и хромосомными аномалиями точность ее пренатальной диагностики была существенно выше за счет выраженности гемодинамических нарушений и расширенного эхокардиографического исследования плода и составила 52%.
По данным института сердечно-сосудистой хирургии им. А.Н. Бакулева, точность диагностики не превышает 27%. Как правило, патология наиболее часто отмечается при сочетании коарктации аорты с другими кардиальными аномалиями [10].
Таким образом, обобщая статистические данные материала Центра, публикации ведущих специалистов России и зарубежных коллег, можно отметить очень низкий процент диагностики коарктации аорты у плода.
В чем же причина столь низкого процента выявления коарктации аорты антенатально?
Существует несколько факторов, затрудняющих диагностику коарктации аорты антенатально.
Первая причина не диагностированной коарктации аорты это морфогенез патологии и теория первичного нарушения развития дуги аорты. Теория была предложена в 1828 г. [11]. Автор считает, что данная патология связана с недостаточным соединением 4 и 6 дуги аорты с нисходящим ее отделом. Поэтому перешеек - это место, где наиболее часто локализуется участок сужения [12], так как оба отдела образуются из разных эмбриональных зачатков. В норме область перешейка аорты равна 2/3 диаметра восходящего отдела аорты (рис. 1).
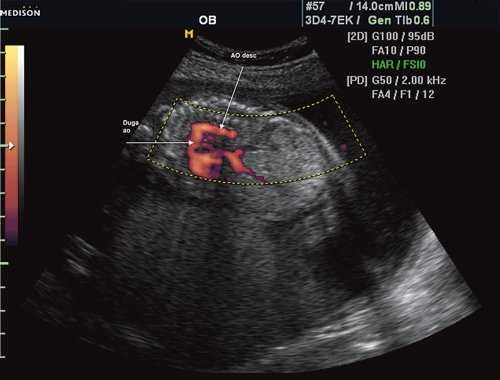
Рис. 1. Восходящий отдел, дуга и нисходящий отдел аорты плода в режиме энергетического допплера в норме.
Согласно "теории дуктальной ткани" коарктация аорты возникает в результате миграции гладких мышечных клеток протока в предуктальную аорту, с последующей констрикцией и сужением просвета аорты [4]. При формировании коарктации аорты в области перешейка сохраняется сужение различной протяженности и формы (рис. 2, 3). Наиболее часто это проявляется в виде локальной перетяжки, выше или ниже которой диаметр аорты сохраняется в норме.
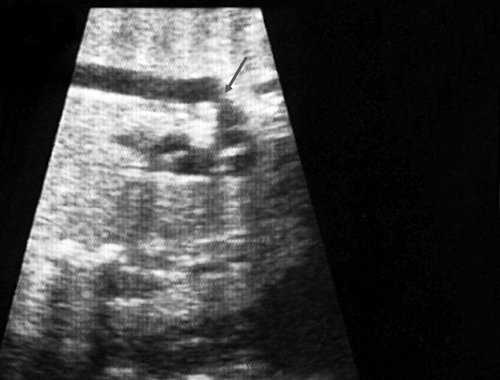
Рис. 2. Ультразвуковое исследование восходящего отдела, дуги и нисходящего отдела аорты. Стрелкой указано место сужения.
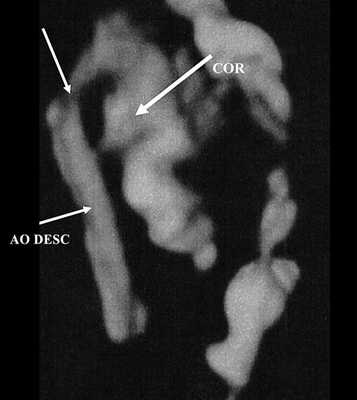
Рис. 3. Трехмерное изображение сердца и аорты плода в 16 нед беременности. Стрелкой указано место сужения аорты. AO DESC - нисходящий отдел аорты, COR - сердце.
Следовательно, оценка сужения аорты в типичном месте как признак развивающейся патологии не всегда представляется возможной в ранние сроки беременности. Поскольку речь идет о предуктальной коарктации аорты (сужение аорты локализовано проксимальнее протока), то, очевидно, что в период внутриутробной жизни в более поздние сроки отмечается снижение кровотока через левые отделы сердца и перешеек аорты и развивается гипоплазия левого желудочка и аорты. Это и способствует более позднему проявлению патологии и возможности ее ультразвуковой диагностики.
Вторая причина, затрудняющая диагностику коарктации аорты - это теория постнатального развития. У плода перешеек аорты узкий и после рождения и закрытия артериального протока он должен в норме расшириться для обеспечения адекватного кровотока в нисходящий отдел аорты. Таким образом, имеющееся физиологическое сужение перешейка аорты не позволяет предположить формирование коарктации аорты после рождения.
Постдуктальная коарктация развивается уже после рождения и практически всегда представляет собой изолированный дефект. Эта аномалия, вероятнее всего, является результатом разрастания мышечной ткани артериального протока в аорту плода. Когда же проток после рождения сужается, эктопическая ткань внутри аорты также сжимается, перекрывая, как тампоном, просвет сосуда по всей его окружности. В отличие от предуктальной коарктации в данном случае гипоплазия аорты не развивается. Закрытие артериального протока у некоторых детей приводит к наличию сужения аорты и развитию коарктации через 2-3 нед после рождения [13].
Третья причина не диагностированной коарктации аорты состоит в особенностях внутрисердечной гемодинамики у плода. Кровообращение плода, так же, как и взрослого, подчиняется ряду основных закономерностей физического и биологического воздействия. Поток крови движется из зоны высокого давления в область низкого давления. При выраженном потоке размеры увеличиваются, при уменьшении объема потока уменьшаются. Так, гипоплазия левого желудочка и коарктация аорты часто сопутствуют порокам со сниженным выбросом крови в аорту (стеноз аорты, дефект межжелудочковой перегородки) и практически не встречаются при пороках с большим объемом потока через аорту (при тетраде Фалло).
Исходя из особенностей внутрисердечной гемодинамики плода, для диагностики коарктации аорты были предложены косвенные признаки патологии в антенатальном периоде: дилатация правого желудочка и его гипертрофия (см. рис. 3), дилатация легочной артерии [6, 7, 14]. Авторы считают, что это достоверные признаки и встречаются они достаточно часто (в 18 из 24 случаев верифицированных диагнозов коарктации аорты). Поэтому была предложена оценка индексов отношения полости правого желудочка к левому (в норме - 1,1) и легочной артерии к аорте (у здоровых - 1,2). Исходя из увеличения этих параметров, можно предположить наличие затрудненного выброса в аорту или гипоплазию дуги аорты. Тем не менее, по данным предложивших эти косвенные признаки авторов, такие изменения выявляются только в 30% наблюдений (рис. 4).
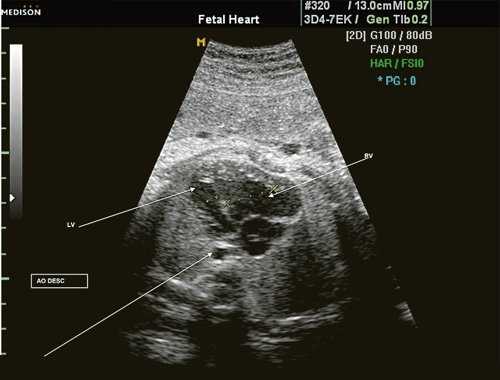
Рис. 4. Диспропорция размеров желудочков сердца при коарктации аорты. RV - правый желудочек; LV - левый желудочек; AO DESC - поперечное сечение нисходящего отдела аорты.
Во второй половине 90-х гг. было опубликовано несколько работ, посвященных изучению диагностической ценности увеличения правого желудочка и уменьшения левого желудочка при коарктации аорты. Авторы, опубликовавшие эти результаты [2], считают, что чем раньше проводится исследование (от 14-16 до 25 нед гестации), тем оно информативнее для диагностики коарктации аорты. Доказательством могут служить данные, полученные D. Brown и соавт. [15]. В представленных исследованиях коарктация аорты отмечена у 8 (62%) из 13 плодов с диспропорцией размеров желудочков до 34 нед и только у 6 (21%) из 29 плодов после 34 нед беременности. Несмотря на то, что более половины случаев коарктации аорты сопровождается диспропорцией размеров желудочков, что достаточно легко выявляется при изучении четырехкамерного среза сердца плода, во многих исследованиях в Норвегии она не была диагностирована, даже при обязательном скрининговом изучении размеров сердца до 18 нед беременности [9].
Такие прoтиворечивые результаты можно объяснить гемодинамической теорией [16, 17]. Внутриутробно в восходящий отдел аорты поступает 50% суммарного выброса крови, в нисходящую - 65%, а через перешеек аорты всего лишь 25%. Исходя из уменьшенного объема кровотока возникает его физиологическое сужение, которое усугубляется лишь после рождения.
Допплеркардиография, позволяющая оценить кровоток, информативна лишь при выраженном сужении аорты [18]. При этом возникает обратная зависимость максимальной скорости кровотока в восходящем и нисходящем отделах аорты. В норме скорость в восходящем отделе немного преобладает над скоростью нисходящего отдела.
При перерыве дуги аорты отмечается ретроградный кровоток заполнения участка дуги аорты после перерыва через открытый артериальный проток и отсутствие прямого кровотока на уровне перерыва.
И, наконец, последняя причина не диагностированной коарктации аорты заключается в частоте сочетания с другими аномалиями сердца. Изолированная коарктация аорты составляет всего лишь 15-18%. По данным M. Campell и P. Polani [19], процент сочетания коарктации аорты с кардиальными аномалиями колеблется от 13 до 18%. Наиболее часто (85%) коарктация аорты сочетается с двустворчатым аортальным клапаном [20], нередко сочетается с фиброэластозом эндомиокарда, распространяющимся на выходной тракт левого желудочка и на межжелудочковую перегородку. Возможно, при коарктации аорты аномальное отхождение правой подключичной артерии или обеих подключичных артерий от нисходящей аорты, дистальней коарктации (5%).
Наличие сопутствующей кардиальной патологии может нивелировать типичные для коарктации гемодинамические изменения со стороны сердца плода, на которые обязательно обращает внимание специалист при ультразвуковом исследовании.
Существует еще и понятие как псевдокоарктация, или "кинкинг" аорты - деформация аорты, аналогичная классической коарктации, но препятствие кровотоку незначительное, так как имеется простое удлинение и извилистость аорты (рис. 5).
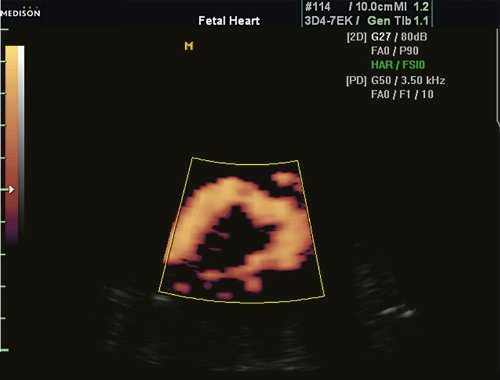
Рис. 5. Кинкинг аорты у плода в 34 нед беременности. Исследование в энергетическом режиме.
Итак, становится очевидным, что практически ни один из ультразвуковых признаков в антенатальном периоде не имеет высокой степени диагностической точности.
Известно, что диагноз данного порока сердца опирается на прямой признак - визуализацию места сужения аорты, и, возможно, расширение проксимального отдела аорты. Однако четко визуализировать участок сужения аорты у плода достаточно трудно и удается только в единичных наблюдениях. Порок можно увидеть лишь тогда, когда имеется уменьшение диаметра перешейка аорты более чем на 1/3 по сравнению с нормой для каждого срока беременности (см. рис. 2, 3).
Ключом к пренатальной диагностике коарктации аорты является комплексный учет данных, получаемых как при изучении четырехкамерного среза сердца (дилатация правого желудочка, гипоплазия левого желудочка), так и при оценке самих главных артерий. При наличии коарктации диаметр аорты в среднем в 2 раза меньше диаметра дилатированной легочной артерии. Поэтому для диагностики коарктации аорты следует использовать визуализацию самой аорты, что наиболее целесообразно при скрининговой оценке среза через три сосуда. Помощь в диагностике может оказать измерение диаметра артериального протока, который при коарктации аорты широкий.
Окончательный диагноз коарктации аорты устанавливается при использовании среза через дугу аорты, так как чаще всего сужение аорты отмечается в области ее перешейка - на уровне впадения артериального протока. Следует отметить, что сужение может охватывать большой участок аорты вплоть до тубулярной гипоплазии. Нормальный переход дуги аорты в артериальный проток в норме гладкий и плавный. Кроме того, при исследовании аорты по длинной оси наиболее надежным признаком следует считать гипоплазию поперечной части дуги аорты. Как один из косвенных признаков коарктации аорты можно использовать извилистость дуги аорты при изучении ее по длинной оси [2].
Важное дополнительное значение имеет допплерэхокардиографическое исследование, которое при коарктации орты позволяет выявить ускорение и турбулентный характер кровотока в аорте. Однако в антенатальном периоде этот признак может не проявиться [2]. Более надежно выявление левоправого шунта через овальное окно. Предполагается, что этот шунт является компенсаторным механизмом, обеспечивающим уменьшение потока крови в левый желудочек и аорту. G. Sharland и соавт. [18] отметили левоправый шунт через овальное окно у 7 из 12 плодов с коарктацией аорты. У оставшихся 5 плодов обнаруживалось как левоправое, так и праволевое направления потоков крови через овальное окно.
В случаях резко выраженных анатомических изменений аорты и функции левого желудочка с увеличением постнагрузки может наблюдаться сердечная недостаточность [21]. Нарушения гемодинамики и сердечная недостаточность характеризуются антенатально наличием выпота в перикарде, уменьшением сердечного выброса с уменьшением размеров левого желудочка [22].
После рождения и закрытия артериального протока весь поток крови поступает в восходящий отдел аорты и перешеек расширяется до нормального уровня. После рождения, когда проток перекрывается, коарктация аорты приводит к серьезными клиническим проявлениям.
Итак, анализ возможностей и ошибок ультразвуковой диагностики коарктации аорты в пренатальном периоде показывает насколько проблематично поставить диагноз во всех случаях данного порока сердца у плода. К сожалению, все эхокардиографические антенатальные признаки патологии не обеспечивают высокий процент диагностики.
Хочется надеяться, что развитие новых технологий и накопление позитивного и анализ негативного опыта позволят в будущем повысить процент диагностики такого сложного порока сердца с высокой неонатальной смертностью.
Литература
Закономерности изменений показателей ультразвукового исследования при врожденных пороках сердца у плода в зависимости от особенностей внутрисердечной гемодинамики антенатального периода
ФГУ Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова Минздравсоцразвития России,
Москва.
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Врожденные пороки сердца редко влияют на развитие плода. Впервые это было отмечено в исследованиях B. Mac Mahon и соавт. [1]. Однако есть пороки, не совместимые с жизнью, и после рождения ребенок тотчас погибает. Некоторые врожденные пороки сердца, даже несложные формы, в раннем неонатальном периоде протекают злокачественно, обусловливая развитие декомпенсации кровообращения и дыхательную недостаточность. Главной причиной этого является несовершенство компенсаторных механизмов.
Диагностика врожденных пороков сердца у плода - одна из труднейших задач перинатологии. Многие врожденные пороки сердца, даже сложные, практически не совместимые с жизнью, антенатально не проявляются в силу особенностей внутрисердечной гемодинамики и после рождения становятся катастрофой для жизни ребенка.
Антенатальный период характеризуется особенностями кровообращения, такими как высокое давление в правом желудочке, незначительный объем кровотока в легочной артерии, параллельность работы желудочков сердца, функционирующие артериальный проток и овальное окно, нагнетающие кровь как обходные анастомозы в большой круг кровообращения за счет усиленной работы правого желудочка. Эти особенности внутрисердечной гемодинамики плода, безусловно, должны корректировать характер гемодинамических изменений ультразвуковых показателей сердца в норме и при пороках сердца у плода.
Известно, что у пациентов с врожденными пороками сердца нарушения гемодинамики в результате анатомических изменений в значительной степени влияют на данные ультразвукового сканирования сердца, такие как размеры полостей сердца, степень гипертрофии миокарда, функция клапанного аппарата, сократительная способность миокарда, направленность движения межжелудочковой перегородки.
Метод оценки внутрисердечной гемодинамики базируется на широко известных понятиях о систолической, объемной и смешанной перегрузках сердца, предложенных в 1952 г. E. Cabrera и J. Monroy [2].
В основе разделения использован следующий принцип.
Нагрузка сопротивлением возникает при ситуации, когда выброс крови из желудочков сердца в магистральные сосуды затруднен на уровне полулунных клапанов (стеноз аорты и легочной артерии), подклапанного пространства (идиопатический гипертрофический субаортальный стеноз, подклапанный стеноз аорты или легочной артерии), на протяжении сосудистого русла (коарктация аорты) либо при значительном увеличении выходного сопротивления (синдром Эйзенменгера). В результате затруднения выброса крови резко возрастает напряжение миокарда соответствующего желудочка при относительно стабильном объеме крови, что служит проявлением систолической перегрузки сердца. При систолической перегрузке желудочков сердца независимо от нозологической формы порока полость желудочка, несущего основную нагрузку сопротивлением, умеренно увеличивается в размерах. В ответ на нагрузку сопротивлением на эхокардиограмме выявляется гипертрофия миокарда соответствующего желудочка, и чем больше сопротивление выбросу, тем резче выражена степень гипертрофии миокарда соответствующего желудочка и межжелудочковой перегородки (рис. 1) [3].
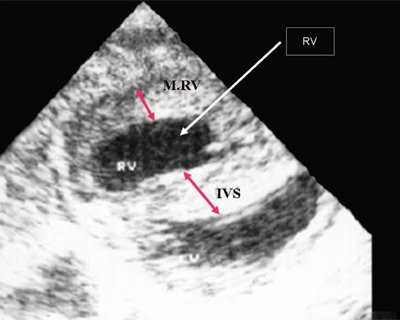
Рис. 1. Систолическая перегрузка правого желудочка. Поперечное сечение желудочков сердца при стенозе легочной артерии. Градиент давления правый желудочек - легочная артерия равен 200 мм рт.ст. Выраженная гипертрофия межжелудочковой перегородки и миокарда передней стенки правого желудочка.
Нагрузка объемом возникает при дополнительном притоке крови в желудочки и в результате шунтирования крови через септальные перегородки или артериальный проток (дефекты межпредсердной и межжелудочковой перегородок, открытый артериальный проток), а также в результате обратного тока крови через атриовентрикулярные клапаны (клапанная недостаточность).
Характерными особенностями выраженной объемной перегрузки правого желудочка являются дилатация желудочка, при которой толщина миокарда не превышает верхней границы нормы, увеличение правого предсердия, парадоксальный характер движения межжелудочковой перегородки и увеличение амплитуды движения трикуспидального клапана (рис. 2, 3).
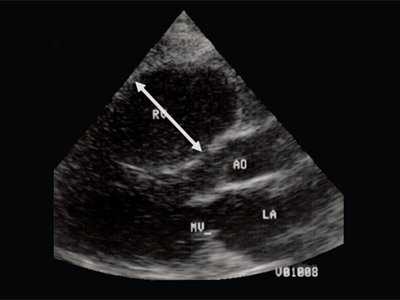
Рис. 2. Длинная ось сердца. Объемная перегрузка правого желудочка при дефекте межпредсердной перегородки. Объем сброса крови превышает 200% МОС. Отмечается выраженная дилатация правого желудочка.
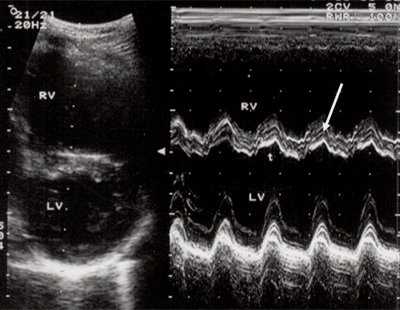
Рис. 3. Объемная перегрузка правого желудочка при дефекте межпредсердной перегородки. В- и М-сканирование. Стрелкой показан парадоксальный характер движения межжелудочковой перегородки.
Для левого желудочка признаком объемной перегрузки являются увеличение полости левого предсердия и желудочка, а также экскурсии межжелудочковой перегородки и миокарда задней стенки левого желудочка (рис. 4).
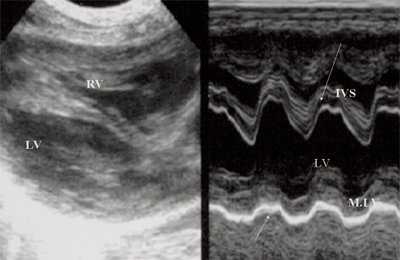
Рис. 4. Объемная перегрузка левых отделов сердца. В- и М-сканирование. Отмечается усиление экскурсии межжелудочковой перегородки и миокарда задней стенки левого желудочка.
IVS - межжелудочковая перегородка, MLV - миокард левого желудочка, LV и RV - левый и правый желудочек.
При сочетании нагрузки сопротивлением и объемом возникает смешанная перегрузка (например, при дефекте межжелудочковой перегородки и повышении давления в легочной артерии для правого желудочка систолическая перегрузка сочетается с нагрузкой объемом, для левого желудочка в результате артериальновенозного сброса крови через дефект).
За многолетний период (с 1980 г. по настоящее время) наблюдений в ФГУ Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова Минздравсоцразвития России было замечено, что в антенатальном периоде не всегда работают принципы гемодинамических эхокардиографических проявлений врожденного порока сердца, которые ранее были разработаны и представлены в современной литературе 6.
Анализ более 2000 наблюдений врожденных пороков сердца у плода показал, что в ряде наблюдений имеются лишь анатомические изменения, характерные для определенной нозологической формы порока. При других врожденных пороках сердца изменения на эхокардиограмме связаны с характером гемодинамической нагрузки на сердце и аналогичны тому, что наблюдается после рождения. Наконец, в ряде наблюдений врожденных пороков сердца у плода вторичные изменения на эхокардиограмме, вызванные гемодинамическими нарушениями, отличаются от гемодинамических проявлений ультразвуковых показателей у детей и взрослых. Это позволило разделить все врожденные пороки сердца плода на три группы в зависимости от изменений на эхокардиограмме, обусловленных особенностями антенатальной внутрисердечной гемодинамики.
В первую группу вошли пороки сердца, которые, имея отчетливые анатомические проявления патологии, при ультразвуковом исследовании не имеют гемодинамических проявлений врожденного порока сердца. К ним относятся: дефект межпредсердной перегородки, дефект межжелудочковой перегородки, общий желудочек, простая форма транспозиции магистральных сосудов и также при наличии дефекта межжелудочковой перегородки общий артериальный ствол, двойное отхождение сосудов от желудочков сердца.
- дилатации правого желудочка (см. рис. 2, 3);
- увеличению правого предсердия;
- парадоксальному характеру движения межжелудочковой перегородки (см. рис. 2, 3).
Антенатально при равных величинах давления в желудочках сердца и в предсердиях объемной перегрузки не возникает. В связи с этим ни один из эхокардиографических гемодинамических признаков, используемых у детей и взрослых, не выявляется у плода. К эхокардиографическим проявлениям порока антенатально относится только прямой признак - перерыв ультразвукового луча в области дефекта. Размеры сердца, соотношение размеров желудочков сердца не отличаются от нормы (рис. 5).
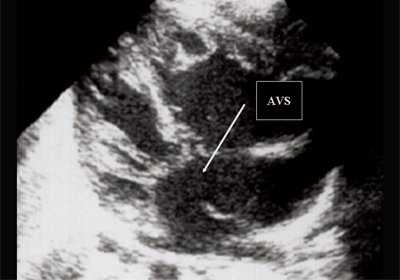
Рис. 5. Четырехкамерное сечение сердца плода. Стрелкой указан первичный дефект межпредсердной перегородки (АVS).
В равной степени это относится к дефекту межжелудочковой перегородки (рис. 6), простой форме транспозиции магистральных сосудов (рис. 7, 8), транспозиции магистральных сосудов с дефектом межжелудочковой перегородки (синдром Тауссиг - Бинга) (рис. 9), общему желудочку (рис. 10), общему артериальному стволу (рис. 10), двойному отхождению сосудов от одного из желудочков сердца (рис. 11).
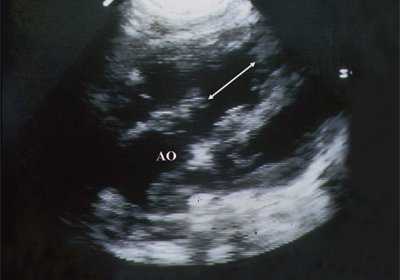
Рис. 6. Дефект межжелудочковой перегородки. Длинная ось сердца. Стрелками показан дефект межжелудочковой перегородки.
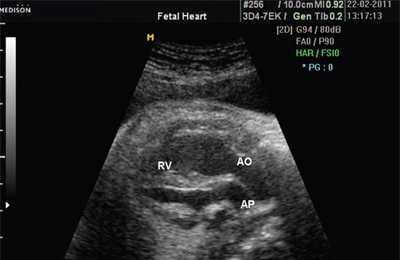
Рис. 7. Транспозиция магистральных сосудов.
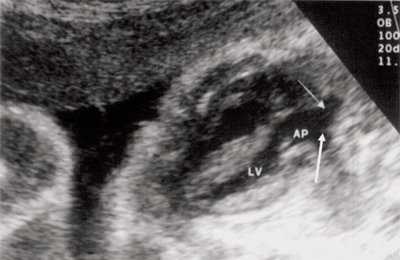
Рис. 8. Транспозиция магистральных сосудов, стрелками показаны ветви легочной артерии.
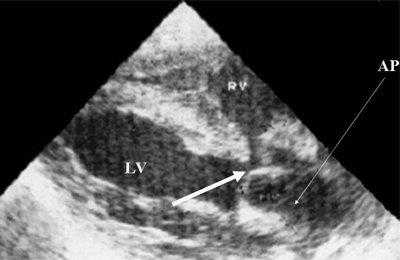
Рис. 9. Синдром Тауссиг - Бинга. Легочная артерия (отмечена стрелкой) расположена над дефектом межжелудочковой перегородки.
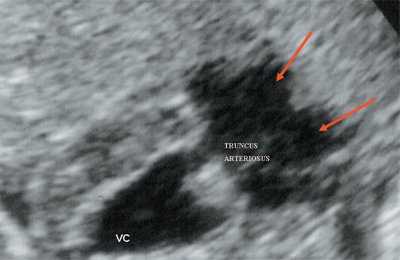
Рис. 10. Общий желудочек с отхождением TRUNCUS ARTERIOSUS. Стрелками показано разделение TRUNCUS ARTERIOSUS на аорту и ствол легочной артерии.
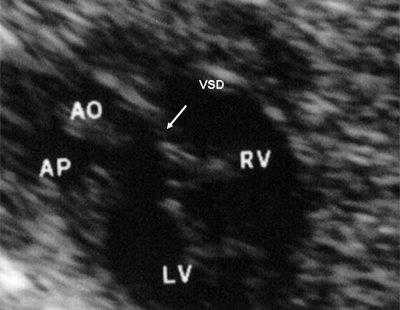
Рис. 11. Двойное отхождение магистральных сосудов от левого желудочка. Длинная ось сердца. Магистральные сосуды инвертированы и отходят от левого желудочка. Аорта расположена "верхом" над дефектом межжелудочковой перегородки (стрелка).
LV и RV - левый и правый желудочек, АР - легочная артерия, АО - аорта, VSD - дефект межжелудочковой перегородки.
Таким образом, диагностика перечисленных выше врожденных пороков сердца основывается на знании анатомических изменений, характерных для определенной нозологической формы патологии.
Вторая группа врожденных пороков сердца. При ультразвуковом исследовании регистрируются анатомические и гемодинамические изменения, характерные для определенной нозологической формы порока. В эту группу были отнесены: стеноз аорты, стеноз легочной артерии, врожденный митральный стеноз, транспозиция магистральных сосудов с сужением легочной артерии, обструкция опухолью выходного тракта одного из желудочков, аномалия Эбштейна, синдром гипоплазии правого и левого желудочков сердца, фиброэластоз, преждевременное закрытие овального окна.
Как пример можно разобрать изменения эхокардиографических показателей при клапанном стенозе легочной артерии. Нарушение гемодинамики при изолированном стенозе легочной артерии обусловлено препятствием на пути выброса крови в легочную артерию. Тяжесть стеноза определяется разницей систолического давления в правом желудочке и легочной артерии, т.е. градиентом давления.
При двухмерной эхокардиографии выявляется утолщение створок клапана легочной артерии, экскурсия их уменьшена, а в систолу они образуют купол. Это анатомические проявления порока. К ним добавляются гемодинамические проявления: выраженная гипертрофия миокарда передней стенки правого желудочка и межжелудочковой перегородки, значительно превышающие нормативы. Степень выраженности гипертрофии миокарда правого желудочка зависит от степени стенозирования легочной артерии и соответственно от величины градиента давления. Эти данные получены при сопоставлении результатов ультразвукового сканирования и данных катетеризации полостей сердца у детей [6]. Следует особо отметить, что при выраженной гипертрофии миокарда полость правого желудочка увеличивается незначительно. Отмечается также увеличение размера правого предсердия.
У плода получены аналогичные изменения, зависящие также от степени стенозирования легочной артерии. Полость правого желудочка, как видно на рис. 12, не увеличена. В то же время имеется значительная гипертрофия стенок правого желудочка. Как и в постнатальном периоде отмечено увеличение полости правого предсердия (рис. 13). После рождения при катетеризации полостей сердца в данном наблюдении был выявлен градиент давления на выходе из правого желудочка, равный 200 мм рт.ст.
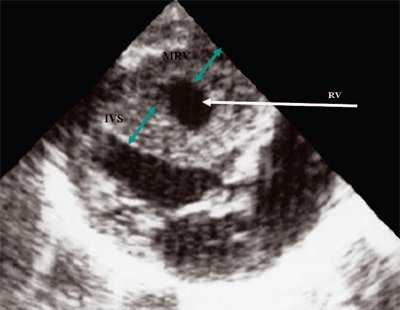
Рис. 12. Стеноз легочной артерии. Гипертрофия миокарда правого желудочка.
Аортальный (клапанный) стеноз (I35.0)

По происхождению:
- врожденный (порок развития);
- приобретенный.
По локализации:
- подклапанный;
- клапанный;
- надклапанный.
По степени нарушения кровообращения:
- компенсированный;
- декомпенсированный (критический).
По степени выраженности (определяется по площади проходного отверстия клапана и по градиенту систолического давления (ГСД) между левым желудочком и аортой):
- умеренный стеноз - при ГСД <50 мм рт.ст., площадь >1 см 2 (норма 2,5-3,5 см 2 );
- выраженный стеноз - при ГСД 50-80 мм рт.ст. (площадь 1-0,7 см 2 );
- резкий стеноз - при ГСД >80 мм рт.ст.;
- критический стеноз - при ГСД до 150 мм рт.ст. (площадь 0,7-0,5 см 2 ).
Аортальный стеноз - критерии АСС/АНА (Американский кардиологический колледж/ Американская ассоциация сердца)
Скорость потока (м/с)
Средний градиент (мм рт. ст.)
Площадь отверстия клапана (см 2 )
Индекс площади отверстия клапана (см 2 /м 2 )
Этиология и патогенез
Клапанный аортальный стеноз может быть вызван несколькими причинами:
- врожденный аортальный стеноз;
- ревматизм;
- двустворчатый аортальный клапан;
- изолированное обызвествление Кальциноз (син. кальцификация, обызвествление) - отложение солей кальция в тканях организма
аортального клапана (старческий аортальный стеноз).
Ревматический аортальный стеноз обычно сочетается с аортальной недостаточностью и пороками митрального клапана. Ревматизм является редкой причиной тяжелого изолированного аортального стеноза в развитых странах.
Подклапанный аортальный стеноз (субаортальный стеноз) представляет собой врожденный порок (может не проявляться при рождении). Под аортальным клапаном в выносящем тракте левого желудочка, как правило, имеется мембрана с отверстием. Данная мембрана часто вступает в контакт с передней створкой митрального клапана. Реже обструкцию вызывает не мембрана, а мышечный валик в выносящем тракте левого желудочка.
Патогенез подклапанного аортального стеноза не ясен. Принято считать, что он является приспособительной реакцией, обусловленной нарушением гемодинамики в выносящем тракте левого желудочка.
Подклапанный аортальный стеноз может сочетаться с другими обструктивными пороками левых отделов сердца (кoарктация аорты, при синдроме Шона и пр.).
Надклапанный аортальный стеноз - встречается редко. Обструкция расположена над клапаном в восходящей аорте. Может развиваться в результате отложения липопротеидов при тяжелых формах наследственных гиперлипопротеидемий, а также может входить в состав наследственных синдромов. Например, синдрома Вильямса, для которого характерны идиопатическая гиперкальциемия, задержка развития, низкорослость, гротескные черты лица, множественные стенозы аорты и ветвей легочной артерии).
Патогенез
В нарушении гемодинамики первична обструкция оттоку крови из левого желудочка. Это приводит к возникновению градиента систолического давления между левым желудочком и аортой. В результате обструкции развивается дилатация и уменьшение ударного объема левого желудочка. Однако сердечный выброс еще в течение долгого времени остается нормальным за счет компенсаторно развивающейся гипертрофии левого желудочка.
По мере прогрессирования степени стеноза устья аорты систолическое давление в левом желудочке продолжает повышаться, однако редко превышает 300 мм рт. ст.
Функционирование левого предсердия в качестве вспомогательного насоса препятствует повышению давления в легочных венах и легочных капиллярах до уровня, который может вызвать застойные явления в легких и поддерживает в то же время конечно-диастолическое давление в левом желудочке на повышенном уровне, необходимом для его эффективного сокращения. В случае прекращения регулярных и сильных сокращений левого предсердия при мерцании предсердий или атриовентрикулярной диссоциации, симптомы болезни могут резко усилиться.
У основной массы больных со стенозом устья аорты сердечный выброс в покое поддерживается на нормальном уровне, но не может адекватно возрастать в ответ на физическую нагрузку.
В поздних стадиях болезни уменьшаются сердечный выброс и градиент давления между левым желудочком и аортой; повышаются среднее давление в левом предсердии, давление заклинивания легочного ствола, давление в легочном стволе и давление в правом желудочке.
В результате гипертрофии мышечной массы левого желудочка увеличивается потребность миокарда в кислороде. Постепенно, по мере декомпенсации порока, полость левого желудочка расширяется, возникает вначале тоногенная, а затем миогенная дилатация.
Декомпенсация функции левого желудочка свидетельствует о начале развития бивентрикулярной сердечной недостаточности. Среди поздних признаков порока - появление застоя и гипертензии в малом круге кровообращения. При "митрализации" порока и развитии легочной гипертензии в патологический процесс вовлекаются правые отделы сердца.
Эпидемиология
Частота выявления аортального стеноза среди лиц в возрасте до 65 лет - 4-5%, после 65 лет - около 25%, после 75 лет - 48%.
Аортальный стеноз в последнее время стал наиболее частым показанием к хирургическому вмешательству на клапанах, что объясняет интерес к его лечению. Данный порок выявляется у 25 % больных с хроническими заболеваниями клапанов сердца. Среди взрослых больных с клинически выраженным стенозом устья аорты 80% составляют мужчины.
Доля врожденного аортального стеноза среди прочих врожденных пороков сердца составляет 3-5,5% и в около 13% случаев он сочетается с другими врожденными пороками сердца.
Клапанный стеноз встречается у 58% больных, подклапанный - у 24%, а надклапанный - у 6%.
Клиническая картина
Cимптомы, течение
При стенозе устья аорты редко наблюдаются гемодинамические или клинические проявления до тех пор, пока клапанное кольцо не сужается до величины, составляющей около 30% от нормы. Какие-либо клинические проявления могут отсутствовать в течение многих лет. Больные сохраняют достаточно высокую трудоспособность, хорошо переносят большие физические нагрузки, могут заниматься спортом.
Основные симптомы:
1. Одышка при физической нагрузке. Одышка и утомляемость нарастают в течение болезни и постепенно ограничивают работоспособность больных.
2. Стенокардия. Более выраженное препятствие кровотоку из левого желудочка увеличивает силу сердечных сокращений, в результате больные начинают ощущать сердцебиение. Приступы стенокардии провоцируются нагрузкой и исчезают в покое (наблюдается схожая со стенокардией в рамках ишемической болезни сердца картина). Стенокардия отмечается приблизительно у 2/3 больных с тяжелым (критическим) аортальным стенозом (у половины из них есть ишемическая болезнь сердца).
3. Систолический шум при аортальном стенозе - характерный шум изгнания, который возникает вскоре после I тона, увеличивается по интенсивности и достигает пика к середине периода изгнания, после чего постепенно уменьшается и исчезает как раз перед закрытием аортального клапана.
Лучше всего шум выслушивается в основании сердца, часто он хорошо проводится вдоль сонных артерий и на верхушку сердца. При развитии недостаточности левого желудочка и уменьшении сердечного выброса, шум становится мягче или исчезает совсем. В этом случае могут возникнуть трудности при распознавании заболевания: формируется клиническая картина тяжелой левожелудочковой недостаточности с низким сердечным выбросом.
Диагностика
Электрокардиография. Выявляемые изменения находятся в зависимости от степени изменений в мышце левого желудочка. На ранних стадиях развития порока изменения на ЭКГ могут отсутствовать.
По мере прогрессирования стеноза определяются признаки гипертрофии левого желудочка в виде увеличенной амплитуды зубцов комплекса QRS в соответствующих отведениях, чаще в сочетании с измененной конечной частью желудочкового комплекса.
В поздних стадиях аортального стеноза на ЭКГ могут отмечаться изменения, свидетельствующие о перегрузке миокарда левого предсердия: высокие расщепленные зубцы Р. Нередко отмечаются нарушения предсердно-желудочковой проводимости различной степени: от удлинения интервала P-Q до полной AV-блокады.
Фонокардиография. Систолический шум имеет характерную ромбовидную или веретенообразную форму.
Рентгенологическое исследование. Имеет важное значение. На ранних этапах выявляется умеренное расширение сердца влево и удлинение дуги левого желудочка с закруглением верхушки. При выраженном сужении отверстия аорты и длительном течении порока сердце имеет типичную аортальную конфигурацию. При "митрализации" порока (развитии относительной недостаточности митрального клапана) наблюдается увеличение размеров левого предсердия и появление рентгенологических признаков застоя в малом круге кровообращения.
Показания к проведению эхокардиографии при аортальном стенозе (Американский кардиологический колледж, 1998):
- диагностика и оценка степени тяжести аортального стеноза;
- оценка размеров левого желудочка, функции и/или степени нарушения гемодинамики;
- повторное обследование пациентов, у которых имеется аортальный стеноз с изменяющимися симптомами;
- оценка изменений нарушения гемодинамики и компенсации желудочков в динамике у больных с диагнозом аортального стеноза в период беременности;
- повторное обследование пациентов с компенсированным аортальным стенозом и признаками дисфункции левого желудочка или его гипертрофией.
Катетеризация правых отделов применяется для получения представления о степени компенсации порока: позволяет определить давление в левом предсердии, правом желудочке и в легочной артерии.
Катетеризация левых отделов используется для определения степени стенозирования аортального отверстия по систолическому градиенту между левым желудочком и аортой.
Дифференциальный диагноз
Необходима дифференциальная диагностика с пороками и другими заболеваниями сердца, при которых определяются систолический шум и гипертрофия левого желудочка сердца.
В случае неясной этиологии порока (особенно у детей) в первую очередь исключают врожденный аортальный стеноз. Его характерные проявления: выявление признаков порока в раннем детском возрасте, нередко - сочетание с другими врожденными аномалиями развития сердечно-сосудистой системы (незаращение артериального протока, коарктация аорты). Подобные проявления отмечаются и при дефекте межжелудочковой перегородки. Для его дифференциации с аортальным стенозом в некоторых случаях возникает необходимость в зондировании сердца и вентрикулографии , которые требуются также для определения показаний к оперативному вмешательству.
У взрослых дифференциальный диагноз более часто проводят с идиопатическим гипертрофическим субаортальным стенозом, стенозом устья легочного ствола, реже - с митральной недостаточностью. Для постановки правильного диагноза существенное значение имеет эхокардиографическое исследование.
Читайте также:
- Х-сцепленная ранняя нейросенсорная глухота: признаки, диагностика
- Лишний вес. Проблемы эстетики или здоровья?
- Сочетание ПЦР и культивирования. Ценность методов культивирования в стоматологии
- Диагностика кисты кармана Ратке по КТ, МРТ
- Современная последовательность помощи при переломах костей таза. Тактика
