УЗИ, МРТ при артрогрипозе, фетальной акинезии у плода
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Сотрудники Курского государственного медицинского университета и Курской областной детской больницы № 2 представили описание клинического случая: ребенок с диагнозом Артрогрипоз, тяжелого врожденного заболевания опорно-двигательного аппарата с контрактурами двух и более суставов нижних и/или верхних конечностей.
Раннее консервативное лечение младенцев с артрогрипозом позволяет скорректировать имеющиеся деформации опорно-двигательного аппарата. Ожидается, что раннее начало лечения увеличит амплитуду и пассивных, и активных движений в суставах кисти, что улучшит функцию схвата кисти и возможность самообслуживания пациентов.
Артрогрипоз это тяжелое врожденное заболевание опорно-двигательного аппарата, характеризующееся врожденными контрактурами двух и более суставов несмежных областей в сочетании с мышечной гипотрофией или атрофией. Типичными клиническими признаками дистального артрогрипоза являются выраженные деформации верхних и нижних конечностей, а также аномалии лицевого скелета. По наличию и степени выраженности указанных признаков выделяют пациентов с высокой и низкой вероятностью артрогрипоза.
Распространенность артрогрипоза варьирует от 1:3000 до 1:12 000 живорожденных детей, подтипа 2А (один из наиболее распространенных вариантов дистального артрогрипоза) — до 1:30 000 детей, но в разных странах уровень заболеваемости может сильно варьировать. Так, в Финляндии заболеваемость артрогрипозом составляет 1:3300, в Австралии — 1:12 000, в Шотландии — 1:56 000 новорожденных.
Считается, что причинами развития врожденного артрогрипоза являются задержка и нарушение эмбриогенеза на 6-10-й нед гестации. В настоящее время предложено пять основных теорий возникновения артрогрипоза, описывающих патогенез нарушений эмбриогенеза:
- механическая (возникновение патологических состояний во время беременности, обусловливающих компрессию плода — много- и маловодие, пороки развития и опухоли матки, многоплодная беременность и пр.);
- инфекционная (тератогенное влияние вирусов, бактерий);
- наследственная (преобладает при дистальных формах заболевания);
- миогенная (первичное поражение мышечной ткани);
- нейрогенная (связывает развитие заболевания с поражением двигательных нейронов, локализующихся в передних рогах спинного мозга).
Различают следующие клинические формы артрогрипоза: генерализованный (с поражением крупных суставов, таких как плечевые, локтевые, лучезапястные, тазобедренные, коленные, деформацией кистей и стоп, лицевого скелета) и дистальный артрогрипоз (возможно наличие поражения только верхних или нижних конечностей). Оценку клинических форм заболевания проводят с участием приглашенных врачей-специалистов (ортопед, невролог, генетик, челюстно-лицевой хирург) с учетом локализации контрактур, состояния скелетных мышц, а также наличия или отсутствия челюстно-лицевых аномалий.
Дистальный артрогрипоз — это группа заболеваний, характеризующихся поражением кистей и стоп в сочетании или без аномалий лицевого скелета, в основе этиологии которых лежат изменения в структуре гена MYH3, кодирующего белки медленно сокращающихся миофибрилл. Однако эту патологию нельзя отнести к общепринятому понятию «миопатия». Для дистального артрогрипоза типичным считается наличие следующих признаков: низкий рост, сколиоз, поражение дистальных суставов, лицевые контрактуры. Однако, как было отмечено выше, возможны различные комбинации указанных признаков или их отсутствие. В отечественной и зарубежной литературе большое внимание уделяют описанию случаев артрогрипоза. Однако особенно важна популяризация этих случаев — широкое распространение опыта диагностики артрогрипоза и лечения (этапность, методики) младенцев с данной патологией для повышения квалификации и подготовки специалистов. Ниже описаны особенности клинических проявлений и диагностики дистального артрогрипоза у новорожденного с отягощенным генеалогическим анамнезом.
Ребенок Ф. (мальчик), 6 сут жизни. При поступлении в отделение патологии новорожденных и недоношенных детей состояние ребенка тяжелое. Спонтанная двигательная активность снижена. На осмотр реагирует некоторым усилением двигательной активности, слабым болезненным криком. Температура тела в пределах нормы. Лицо симметричное, имеется удлиненный губной желобок, глаза открывает, веки пастозные. Фотореакция сохранена, симметрична. Большой родничок размерами 2,0 2,0 см, не напряжен, на уровне костей черепа. Щелевидное расхождение стреловидного шва. Малый родничок открыт, точечный. Небольшая отечность мягких тканей головы. Мышечный тонус дистоничен: диффузно снижен в проксимальных отделах верхних и нижних конечностей, в дистальных отделах верхних конечностей выраженно повышен, имеются сгибательные контрактуры II-V пальцев, сгибательно-приводящая контрактура I пальца обеих кистей. Выведение пальцев затруднено. При попытке выведения пальцев в физиологическое положение отмечается выраженная болезненность: ребенок реагирует плачем. При осмотре нижних конечностей патологии со стороны суставов, костной системы не выявлено.
Анамнез жизни
Ребенок от 1-й беременности, протекавшей без особенностей в I триместре, на фоне амнионита во II триместре, фетоплацентарной недостаточности. По данным ультразвукового сканирования плода — гидронефроз обеих почек. Ребенок от первых срочных оперативных родов, показания к кесареву сечению: крупный плод, клинически узкий таз 2-й ст., возрастная первородящая женщина. Безводный период 11 ч 36 мин. Околоплодные воды: передние — светлые, задние — густо-зеленые. Масса тела при рождении 4400 г, длина — 56 см. Окружность головы 38 см, окружность груди — 37 см.
Мать ребенка (34 года) страдает мочекаменной болезнью, хроническим пиелонефритом (в период беременности обострений не отмечалось). Отец ребенка (36 лет) не обследован, имеется врожденная деформация пальцев обеих кистей. Со слов родителей, у прадедушки и двоюродного дяди ребенка по отцовской линии также имеется сгибательная деформация пальцев обеих верхних конечностей.
Анамнез болезни
Состояние ребенка при рождении расценено как крайне тяжелое (оценка по шкале APGAR 4/6 баллов) за счет дыхательной недостаточности, перенесенной интранатальной асфиксии тяжелой степени. Реанимационные мероприятия в родильном зале: лучистое тепло, санация верхних дыхательных путей (при санации — грязно-зеленое отделяемое), режим искусственной вентиляции легких постоянным положительным давлением (Constant Positive Airway Pressure, СРАР) при помощи маски, интубация на 4-й мин, дыхание через интубационную трубку. Для дальнейшего лечения переведен в отделение интенсивной терапии. На искусственной вентиляции легких находился 3 сут, затем была продолжена респираторная поддержка через высокопоточные назальные канюли. Кислородная зависимость сохранялась на протяжении 6 сут.
В условиях отделения патологии новорожденных при обследовании физиологические рефлексы периода новорожденности следующие: поисковый рефлекс Куссмауля-Генцлера положительный; сосательный рефлекс вызывается слабо; ладонно-ротовой рефлекс Бабкина проверить не удалось за счет выраженной контрактуры пальцев; рефлекс Моро — 1-я фаза положительная, 2-я фаза не вызывается; хватательный рефлекс — проверка затруднена; рефлексы опоры и автоматической ходьбы угнетены; защитный рефлекс вызывается после тренировки, замедленно; рефлексы Бауэра, Галанта и Переса отрицательные.
Кожный покров бледно-розовый, имеется умеренный периоральный акроцианоз, выражена мраморность, неяркая подкожная венозная сеть на передней брюшной стенке. На коже туловища имеется большое количество элементов токсической эритемы. Тургор тканей достаточный, ткани пастозные. Подкожно-жировой слой развит достаточно. Пупочная ранка — геморрагическая корочка. Носовое дыхание свободное. Грудная клетка подвздута. Дыхание с участием вспомогательной мускулатуры, умеренное втяжение межреберий и ретракция грудины на вдохе. По шкале Даунса 2 балла, что соответствует легкому расстройству дыхания. SpO2 — 98%, кислородная зависимость не выражена. Дыхание проводится по всем легочным полям, регулярное, ритмичное, аускультативно — ослабленное. Выслушиваются проводные и крепитирующие хрипы с двух сторон, частота дыхательных движений — до 52/мин. Тоны сердца ритмичные, приглушены, шумов не слышно, частота сердечных сокращений — 150 уд/мин. Язык чистый, влажный. Живот мягкий, не вздут, доступен пальпации. Печень +1 см. Селезенка не пальпируется. Половые органы сформированы правильно, по мужскому типу, без особенностей. Стул регулярный, желтый, кашицеобразный, без патологических примесей. Мочится свободно, моча светлая, темп диуреза достаточный.
Лабораторная и инструментальная диагностика
В 1-е сут жизни (после стабилизации состояния в условиях отделения интенсивной терапии) выполнены бактериальный посев с кожи, из зева и трахеи (выделена Klebsiella oxytoca), рентгенологическое исследование органов грудной клетки (признаки двусторонней пневмонии), на 2-е сут — эхокардиография (открытое овальное окно, открытый артериальный проток), ультразвуковое исследование внутренних органов (пиелоэктазия с обеих сторон, расширение кармана левой ветви портальной вены, гепатомегалия).
С целью уточнения диагноза при поступлении в отделение патологии новорожденных и недоношенных детей (на 6-е сут жизни) проведено дообследование (инструментальные тесты и консультации специалистов). В частности, выполнены: нейросонография — обнаружены постгипоксические изменения паренхимы головного мозга, перивентрикулярный отек, маркеры внутриутробной инфекции, кровоизлияние в сосудистые сплетения; ультразвуковое исследование органов брюшной полости и почек — обнаружены пиелэктазия с двух сторон (слева 8,5 мм, справа 7,0 мм), диффузные изменения почек (данные изменения обнаружены на 13-е сут жизни, исследование проводилось 1 раз в 7 дней с момента поступления); эхокардиография — визуализированы открытое овальное окно, аномальная хорда левого желудочка; рентгенологическое исследование органов грудной клетки — определена двусторонняя полисегментарная пневмония, гиперплазия тимуса 2-й ст.
Учитывая клинические данные, ребенку выполнено рентгенологическое исследование обеих кистей в прямой проекции. На рентгенограмме обеих кистей определяется вынужденное положение пальцев кисти — ладонная сгибательная контрактура I пальца обеих кистей, выражена ульнарная девиация межфаланговых суставов II-V пальцев, соотношение межпястно-фаланговых и лучезапястных суставных поверхностей не нарушено. Костно-травматических и деструктивных изменений не выявлено.
Ребенок проконсультирован ортопедом, врачом-генетиком, неврологом. Установлен клинический диагноз: «Основной: Внутриутробная инфекция неуточненной этиологии. Врожденная двусторонняя полисегментарная пневмония. Сопутствующий. Церебральная ишемия 2-3-й ст. Q74.3. Дистальный артрогриппоз, тип 2А, аутосомно-доминантный тип наследования с неполной пенетрантностью. Открытое овальное окно. Аномальная хорда левого желудочка. Гиперплазия тимуса 2-й ст. Осложнения: Дыхательная недостаточность 0-1-й ст.».
За время нахождения ребенка в отделении патологии новорожденных и недоношенных детей в течение 21 сут проводилась лечебная гимнастика с наложением этапных ладонных гипсовых лонгет от кончиков пальцев до верхней трети предплечий в положении максимально возможного разгибания II-V пальцев и отведения и разгибания I пальца. На фоне гипсования отмечена небольшая положительная динамика с увеличением амплитуды разгибания пальцев кисти.
После купирования врожденной инфекции и ноотропной терапии ребенок выписан на амбулаторный этап под наблюдение участкового педиатра и ортопеда с рекомендациями провести молекулярно-генетическое исследование гена МYН3 (поиск частых патологических вариантов), продолжить этапное гипсование кистей. Решение вопроса о сроках оперативного лечения оставлено на усмотрение врача-ортопеда по месту жительства с учетом местного статуса в возрасте 10-12 мес жизни.
При соблюдении рекомендаций ортопеда, плана амбулаторных осмотров и консультаций, продолжительной консервативной терапии (гипсовые иммобилизации, пассивные движения в пальцах кистей) в течение 10-12 мес жизни и последующем оперативном лечении, направленном на устранение контрактур, сохраняется вероятность благоприятного исхода заболевания (в перспективе — обретение навыков самообслуживания и возможности дальнейшей социализации ребенка).
Дистальный артрогрипоз типа 2А — редкий вариант врожденного дистального артрогрипоза с аутосомно-доминантным типом наследования. Представленное клиническое наблюдение подтверждает, что раннее консервативное лечение детей с этой патологией устраняет имеющиеся деформации или значительно уменьшает степень их выраженности и позволяет улучшить возможности пациентов при самообслуживании.
Артрогрипоз у детей и подростков: эффективные методы лечения в РФ
Ежегодно в ФГБУ «НМИЦ детской травматологии и ортопедии им. Г. И. Турнера» Минздрава России поступает около 200 детей с диагнозом «артрогрипоз» (*В ведущих клиниках мира за 10-20 лет проходят лечение не более 100 больных с этим диагнозом).

Ольга Евгеньевна АграновичРуководитель отделения артрогрипоза (10 отделение) НМИЦ детской травматологии и ортопедии имени Г.И. Агранович Ольга Евгеньевна, доктор медицинских наук, врач травматолог-ортопед: «Специализированное отделение по лечению детей с артрогрипозом было открыто в 2010 г. и является единственным в России. В 2012 г. сотрудники отделения за создание метода лечения артрогрипоза были награждены премией «Призвание», присуждаемой лучшим врачам России. Благодаря развитию международных связей со специалистами ведущих клиник мира, занимающихся лечением больных с данной патологией, в 2014 г. на базе ФГБУ «НМИЦ детской травматологии и ортопедии им. Г. И. Турнера» Минздрава России был проведён II Всемирный симпозиум по артрогрипозу. Большинство методик, используемых при лечении пациентов, разработаны врачами отделения и защищены патентами РФ. В настоящее время в Центре накоплен самый большой в мире опыт по лечению детей с артрогрипозом, что позволяет в большинстве случаев улучшить возможность самообслуживания и передвижения больных. Применяемые методики включают в себя гипсовую коррекцию контрактур, лечебную физкультуру, массаж, физиопроцедуры, стимуляцию спинного мозга, а также оперативное лечение (устранение контрактур путём выполнения вмешательств на костях, суставах, мягких тканях; восстановление активных движений в суставах путём микрохирургической пересадки различных групп мышц; устранение вывихов в суставах и т.п.)».
Содержание записи:
Что такое артрогрипоз?
Артрогрипоз - это врождённое заболевание опорно-двигательной системы, которое проявляется контрактурами суставов, недоразвитием мышц и поражением спинного мозга. Контрактура - это ограничение пассивных движений в суставе, что приводит в зависимости от локализации к нарушению самообслуживания или передвижения пациента. Артрогрипоз - это непрогрессирующее заболевание, в связи с чем раннее начало лечения позволяет в большинстве случаев помочь ребёнку и восстановить возможность передвижения и самообслуживания. Данная патология встречается у 1 ребёнка из 3000 новорождённых.
Наиболее часто встречается врождённый множественный артрогрипоз (ненаследственное заболевание) в нескольких формах: генерализованная, с поражением верхних или нижних конечностей. Значительно реже наблюдается дистальная форма (около 20 типов), характеризующаяся преимущественным поражением кистей и стоп, аномалиями челюстно-лицевой области. Данное заболевание является наследственным, в связи с чем пациент и его родители должны пройти медико-генетическое консультирование для определения прогноза для больного, а также риска повторного рождения в семье ребёнка с идентичной патологией.
Причины и механизм развития
Существует около 400 причин появления артрогрипоза, но основополагающий фактор неизвестен. Его появлению могут способствовать такие факторы:
- бактериальные и вирусные инфекции;
- вредное производство;
- ионизирующее излучение;
- лекарственные препараты;
- патологии беременности (сильный токсикоз, многоводие, маловодие, плацентарная недостаточность);
- аномалии формы матки, из-за чего плоду недостаточно места;
- выкидыши, аборты в анамнезе беременной;
- тяжёлые заболевания женщины (сахарный диабет, системная красная волчанка);
- вредные привычки (курение, алкоголизм, наркомания).
Воздействие патогенных факторов приводят к нарушению движений плода в ходе внутриутробного развития, что и приводит к формированию контрактур суставов.
Клиническая картина зависит от вида артрогрипоза.
Симптомы болезни
Патология проявляется множественными врождёнными контрактурами суставов конечностей, сколиозом, гипотрофией или атрофией мышц.
Как правило, все контрактуры чаще всего симметричные. Умственное развитие детей с артрогрипозом, как правило, сохранено. При своевременном начале лечения дети могут посещать детские сады, учиться в обычных школах и в дальнейшем получать среднее специальное или высшее образование.

Пренатальная диагностика
Рекомендуется с 12 недели беременности делать УЗИ. Ранняя УЗИ-диагностика артрогрипоза затруднена. До 24 недели беременности данное заболевание диагностируется только в 25% случаев. Основные диагностические признаки артрогрипоза на 12 неделе беременности:
- ограничение двигательной активности плода,
- деформации конечностей и скелета.
При подозрении на пороки развития после 17-18 недели беременности выполняется МРТ плода. Наиболее часто ВМА диагностируется в конце второго - в третьем триместре беременности.
Лечение артрогрипоза в России — передовые методы
Рекомендуется проводить лечение, направленное не только на устранение имеющихся деформаций конечностей, но и на улучшение общей двигательной активности ребёнка. Крайне важно в течение первого года жизни ребёнка развивать его основные двигательные навыки (например, переворачивание, ползание и т.п).
Ведение детей с диагнозом ВМА должно быть междисциплинарным, с участием ортопеда-травматолога, невролога, реабилитолога, генетика, медицинского психолога, социального педагога, техника-протезиста. Лечебные программы должны быть достаточно агрессивными, что позволяет больным реализовать их полный реабилитационный потенциал. При стабильном соматическом состоянии ребёнка консервативное лечение может быть уже начато на первой неделе жизни ребёнка в условиях стационара или дома.
Целью лечения является улучшение пассивных и активных движений в суставах и устранение деформации конечностей. Консервативное лечение у детей первого года жизни включает в себя гипсовую коррекцию деформаций конечностей, ЛФК, массаж, тепловые процедуры, электростимуляцию мышц, стимуляцию спинного мозга. Оперативное лечение показано в возрасте 5-6 месяцев при отсутствии эффекта от консервативного лечения (устранение контрактур путём выполнения вмешательств на костях, суставах, мягких тканях; восстановление активных движений в суставах путём микрохирургической пересадки различных групп мышц; устранение вывихов в суставах и т.п.).
Больным с артрогрипозом показано назначение технических средств реабилитации (ТСР) (костыли, кресла-коляски, поручни, приспособления для одевания, раздевания, захватывания предметов и т.п.), что обеспечивает больному возможность самообслуживания и передвижения, а также протезно-ортопедических изделий (тутора, аппараты для ходьбы, ортопедическая обувь), что позволяет предотвратить рецидив деформации в процессе роста пациента.
Прогноз
Прогноз для пациента с артрогрипозом зависит от формы заболевания, характера деформаций и степени их тяжести, а также от наличия сопутствующей патологии, и может варьироваться от неблагоприятного для жизни до минимальных ортопедических нарушений.
- 10% детей рождаются мертворождёнными, 27% - умирают в течение первых месяцев жизни.
- У 7% больных наблюдается очень тяжёлая форма заболевания, малоперспективная для лечения.
- Большинство больных с данной патологией имеют значительный потенциал для ходьбы во взрослом возрасте.
Способность к самостоятельной ходьбе или передвижению с использованием вспомогательных средств у взрослых пациентов составляет 49-88%, однако некоторые из них со временем теряют способность к ходьбе, что в ряде случаев связано с набором избыточного веса с возрастом.
15-50% больных имеют хорошую функцию верхних конечностей, полностью себя обслуживают и независимы в быту.
Нейробластома плода. Возможности пренатальной диагностики и прогноз

Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Введение
Обычно поражение изолированное, с вовлечением одного надпочечника, двустороннее поражение встречается редко [5]. Иногда антенатально появляются метастазы в печень, кожу, костный мозг и редко в ворсинки плаценты [6]. В этом случае плацента выглядит объемной, но метастатические очаги могут не определяться макроскопически, а диагностируются лишь при гистологическом исследовании. Сосуды ворсинок плаценты содержат скопления клеток нейробластомы, но инвазия стромы наблюдается исключительно редко [7]. Описаны случаи метастазирования в пуповину с последующей гибелью плода [8]. Нейробластомы преимущественно состоят из нейробластов. Макроскопически очаги опухоли хорошо очерчены, но могут инфильтрировать окружающие ткани, капсула отсутствует.
Известно сочетание нейробластом с различными состояниями, в частности с болезнью Гиршпрунга, фетальным алкогольным синдромом, синдромом ДиДжорджа, болезнью Вон Реклинхаузена, синдромом Беквита - Видеманна.
В литературе описан ранний случай диагностики нейробластомы в 19 нед беременности, однако обычно пренатальный диагноз устанавливается при ультразвуковом исследовании в промежутке от 26 до 39 нед гестации [8].
Смещение нижней полой вены визуализирующимся образованием кпереди следует расценивать как признак забрюшинного происхождения этого образования [13]. Кроме того, при больших размерах опухоль надпочечника может смещать окружающие органы.
Цветовое допплеровское картирование помогает идентифицировать питающий опухоль сосуд, отходящий непосредственно от аорты, однако такой единственный сосуд может и не визуализироваться [13].
Как правило, антенатальная диагностика метастазов возможна исключительно редко, так как специфических поражений плаценты при ультразвуковом исследовании не отмечается, описано лишь неспецифическое ее утолщение [14]. В диагностике метастазов может быть информативной МРТ плода.
Геморрагические опухоли надпочечников могут осложняться анемией плода, неиммунной водянкой плода или массивной инвазией печени [10]. Предложены различные объяснения этиологии развития водянки плода: избыточная продукция катехоламинов, приводящая к гипертензии и сердечной недостаточности у плода; вовлечение в патологический процесс печени, вызывающее нарушение венозного возврата и развитие гипопротеинемии [14]; инвазия эритропоэтической ткани клетками опухоли, приводящая к развитию тяжелой анемии или даже гиперсекреции альдостерона корой надпочечников. Кроме того, описано возникновение водянки плода вторично к появлению метастазов в плаценту. Отек плаценты вследствие механического эффекта большого образования может развиваться в некоторых случаях нейробластомы без метастазирования в плаценту [6].
Кроме того, опухоли надпочечников больших размеров могут приводить к дистоции во время родов [8].
Следует помнить и о материнских осложнениях. Очень редко гиперпродукция катехоламинов опухолью надпочечников плода может вызывать избыточное потоотделение, развитие гипертензии и преэклампсии у матери, материнского миррор-синдрома при поражении плаценты [12, 14, 15]. Кроме того, развитие таких материнских осложнений, как правило, связано с высоким уровнем неонатальной смертности, достигающим 70% [1].
Прогноз при нейробластоме зависит от времени диагностики, локализации первичного очага и стадии заболевания. Прогноз лучше у детей до 1 года жизни при низких стадиях опухоли (выживает около 90%) [16]. При нейробластоме, диагностированной пренатально, прогноз, как правило, благоприятный, выживает 90-96% детей [1]. Однако при поражении плаценты прогноз неблагоприятный, часто происходит антенатальная гибель плода или смерть ребенка вскоре после рождения [12, 14].
Обнаружение кальцификатов в опухоли при ультразвуковом исследовании сочетается с лучшим прогнозом, вероятно, вследствие того, что кальцификаты являются свидетельством произошедшего некроза опухоли [12].
Нейробластома in situ может не проявлять себя клинически и даже подвергаться спонтанной регрессии [17, 18].
Течение заболевания у пациентов с нейробластомой, диагностированной пренатально, обычно благоприятное, особенно при изолированном поражении надпочечников [8]. Методом лечения (с хорошими результатами) является хирургическое удаление опухоли непосредственно после рождения [19], химиотерапия показана только в случаях существенного прогрессирования заболевания [20]. Пациенты с "благоприятными" признаками заболевания (небольшие размеры опухоли, ее кистозная структура, отсутствие прогрессирования) должны тщательно наблюдаться и подвергаться хирургическому лечению только при отсутствии регресса образования [11].
Материалы и методы
В качестве иллюстрации приводим одно из наших клинических наблюдений.
Клиническое наблюдение
Пациентка Т., 40 лет, обратилась для проведения планового скринингового ультразвукового исследования в 32 нед. В ходе предыдущих исследований в 13 и 19 нед патологии не было выявлено.
Супруги здоровы, профессиональных вредностей не имеют. Наследственность не отягощена. Настоящая беременность пятая. В анамнезе двое нормальных родов, два медаборта. На учете в женской консультации пациентка состояла с 6 нед. Беременность протекала без существенных осложнений. Лишь в срок 6-7 нед была диагностирована угроза невынашивания.
Ультразвуковое обследование проводилось на УЗ-сканере SonoAce-X8 (Medison).
Результаты
При ультразвуковом исследовании обнаружен один живой плод мужского пола. Гестационный срок составил 31 нед 4 дня. Фетометрические показатели соответствовали данному сроку, за исключением окружности живота, превышающей 95-й процентиль за счет гепатомегалии. Нарушений фето-плацентарного кровотока не было выявлено. Патологических изменений плаценты и околоплодных вод не отмечено.
Под диафрагмой справа визуализировалось гиперэхогенное опухолевидное образование несколько неоднородной солидной структуры, с четкими ровными контурами, размером 50x38x35 мм. К нижнему полюсу данного образования прилежала правая почка, имеющая нормальные размеры, форму и структуру. Нижняя полая вена была смещена кпереди и влево. Обращала на себя внимание выраженная гепатомегалия, причем структура печени не была однородной. Она содержала множественные гиперэхогенные включения размерами до 17 мм, окруженные тонким гипоэхогенным периферическим ободком. Цветовое допплеровское картирование(ЦДК) демонстрировало интенсивную периферическую васкуляризацию опухоли (рис. 1-3).
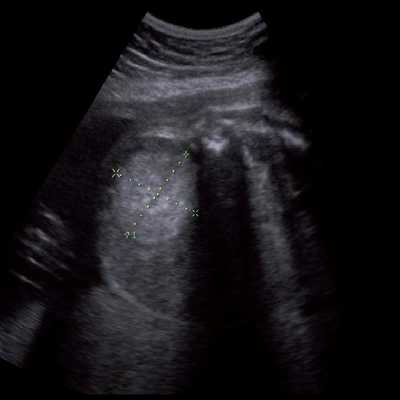
Рис. 1. Нейробластома правого надпочечника плода. Беременность 31 нед 4 дня.
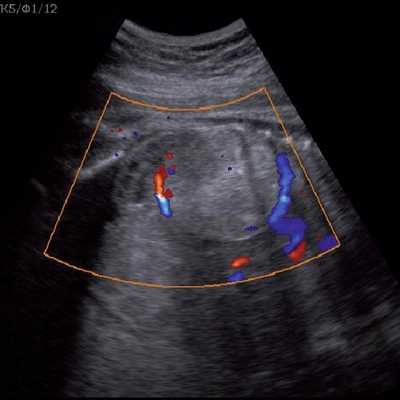
Рис. 2. Кровоток в нейробластоме плода. Цветовое допплеровское картирование. Отчетливо виден питающий сосуд, огибающий образование по его периферии. К нижнему полюсу образования прилежит интактная почка плода.
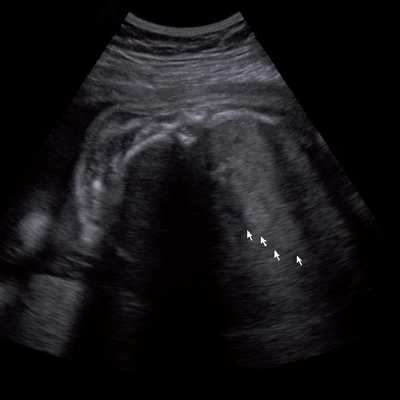
Рис. 3. Метастазы в печени плода. Поперечное сечение брюшной полости плода. Гепатомегалия. В структуре печени плода определяются округлые включения несколько повышенной эхогенности (стрелки), с гипоэхогенным ободком - метастазы.
Был поставлен диагноз: беременность 31 нед 4 дня. Опухоль правого надпочечника плода с метастазами в печень. Рекомендовано динамическое ультразвуковое наблюдение за темпами роста новообразования и возникновением возможных осложнений.
В срок 32 нед 4 дня была диагностирована антенатальная гибель плода. Родился мертвый ребенок, мужского пола весом 2480 г, длиной 45 см.
В представленном наблюдении картина нейробластомы надпочечника была не совсем классической. То, что это супраренальное образование - очевидно, так как оно прилежало к почке, имеющей нормальную форму, размеры и структуру. Опухоль имела капсулу, однородную гиперэхогенную структуру, что не характерно для нейробластомы надпочечника. Поэтому дифференциальную диагностику проводили с кровоизлиянием в надпочечники, опухолью Вильмса, экстралобарным легочным секвестром, ретроперитонеальной тератомой.
Кровоизлияние в надпочечники, как правило, выглядит эхогенным или неоднородной структуры образованием, иногда может быть полностью анэхогенным и характеризуется изменением ультразвуковой картины при динамическом исследовании, постепенно превращаясь в анэхогенное кистозное образование, в котором с течением времени отмечается утолщение его стенки [13] и образуются кальцификаты. Энергетический допплер демонстрирует полную аваскулярность такого образования. В нашем случае образование имело повышенную эхогенность, несколько неоднородную структуру. При ЦДК в опухоли регистрировался преимущественно периферический кровоток.
Опухоль Вильмса поражает почку (чаще правую), которая в представленном случае была интактна.
Экстралобарная легочная секвестрация является преимущественно левосторонним супраренальным образованием с четким наружным контуром, как правило, гиперэхогенной однородной структурой неправильной формы. Выявляется эта патология уже во II триместре беременности, при ЦДК определяется питающий сосуд.
Тератомы (в том числе и забрюшинной локализации) всегда представлены образованиями неоднородной солиднокистозной структуры вследствие их гистологического строения.
Таким образом, обнаруженное нами образование было отнесено к опухоли надпочечника даже при отсутствии классической картины нейробластомы. Обращали на себя внимание большой размер опухоли и отсутствие выраженных осложнений в виде многоводия, застойной сердечной недостаточности, нарушения фето-плацентарного кровотока. При этом относительно ранняя манифестация (выявление данного комплекса изменений уже в 31 нед), не совсем типичная ультразвуковая морфология опухоли, наличие выраженной гепатомегалии и множественных метастазов позволяли сделать вывод о злокачественном течении заболевания, что, видимо, и обусловило антенатальную гибель плода. В итоге диагноз был подтвержден патоморфологическим исследованием. У недоношенного плода мужского пола живот увеличен в объеме. Справа в забрюшинном пространстве определяется округлое образование (опухоль) размером 50?35?30 мм, эластичной консистенции. Спереди и снизу к опухоли прилежит почка, плотно с ней спаянная. Опухоль исходит из правого надпочечника, который находится на ее верхнем полюсе в виде "шапочки". На разрезе опухоль однородная, желтовато-серая. Левые надпочечники и почка обычного вида. Печень значительно увеличена, занимает около 1/2 объема брюшной полости, доли четко не дифференцируются. Поверхность печени коричневато-красная. На разрезах определяются множественные плотные эластичные узлы диаметром до 15 мм бледно-желтого цвета (рис. 4, 5).
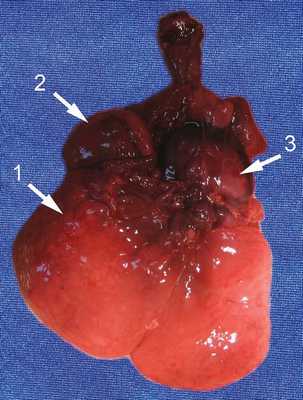
Рис. 4. Органокомплекс, вид спереди.
1 - печень;
2 - опухоль с правым надпочечником;
3 - сердце.
Пренатальная диагностика опухолей у плода

Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
В настоящей публикации представлены два случая пренатальной ультразвуковой диагностики опухолей у плодов. Эти опухоли относятся к разным морфологическим группам, однако объединяющим моментом в данных представлениях является большой объем образований.
Клиническое наблюдение 1
Лимфангиомы относятся к зрелым, доброкачественным опухолям, исходящим из лимфатических сосудов. Микроскопическая структура лимфангиомы представлена тонкостенными кистами различных размеров. Лимфангиомы встречаются достаточно редко и составляют примерно 10-12 % всех доброкачественных образований у детей. Лимфангиомы могут быть наружными (шейными, шейно- подмышечно-грудными) и внутренними (средостенными, внутренних органов, забрюшинными, тазовыми). Наиболее частыми являются лимфангиомы шейной локализации - от 74 до 82 %, шейно- подмышечно-грудные лимфангиомы встречаются у 6 % больных, средостенной локализации - у 10-16 % больных, в органах брюшной полости - 1-2 %, забрюшинного расположения - у 1-2 % пациентов, тазовой локализации - у 1-2 % пациентов.
Различают простые, кавернозные и кистозные лимфангиомы.
Простая лимфангиома, состоящая из расширенных лимфатических сосудов и соединительнотканных щелей, заполненных лимфой, встречается чаще на языке, реже на губах. Клинически это проявляется диффузным увеличением указанных органов, их тестообразной консистенцией.
Кавернозная лимфангиома, состоящая из беспорядочно расположенных соединительнотканных полостей, разделенных перемычками, выстланных эндотелием и заполненных лимфой, имеет вид нечетко ограниченного образования, возвышающегося над окружающими тканями, покрытого нормальной кожей или слизистой оболочкой. Является наиболее частой формой, наблюдаемой у детей.
Кистозная лимфангиома, представляющая собой одну или несколько крупных полостей, заполненных лимфой, возвышается над окружающими тканями. При пальпации лимфангиомы этого вида определяется флюктуация, чего не отмечается при кавернозной лимфангиоме [1, 2, 3].
Беременная М., 24 лет, обратилась в клинику в сроке 21 нед. Данная беременность первая.
Исследование проводилось на аппарате SonoAce R7 (компании Sumsung Medison), конвексным датчиком 2-8 МГц. Фетометрические показатели плода соответствовали сроку беременности. Пол плода мужской.
В процессе ультразвукового исследования впервые выявлен распространенный опухолевый процесс, занимающий всю правую подмышечную область плода, правое плечо (поперечный размер в средней трети плеча составил 26 мм, соответственно аналогичный размер левого плеча - 17 мм), включая локтевую область, правую боковую поверхность грудной клетки с переходом на ее переднюю поверхность и правую боковую поверхность шеи. Опухоль была представлена мелкокистозными структурами ячеистого характера, с анэхогенным содержимым, аваскулярная.
С учетом ультразвуковой картины, патогномоничной для кавернозной лимфангиомы, выдано соответствующее заключение.
Учитывая тяжесть обнаруженной аномалии у плода, семья обратилась в израильскую клинику Ultrasound Unit of the Department of Obstetrics and Gynecology Hadassah-Hebrew University Hospital, где было проведено повторное исследование в 25 недель беременности, и диагноз "лимфангиома" был подтвержден. С разрешения Dr. Dan Valsky, проводившего исследование, публикуем сонограммы для иллюстрации динамики процесса.
Учитывая тяжесть и распространенность опухолевого процесса, по желанию семьи было принято решение о прерывании беременности. Диагноз "кавернозная лимфангиома" был подтвержден при патологоанатомическом исследовании
Современные подходы к изучению плодового фенотипа в эру генетического ультразвука
Медико-генетическое отделение Московского областного НИИ акушерства и гинекологии, Москва.
Курс пренатальной диагностики, ФГБОУ ДПО РМАПО Минздрава России, Москва.

УЗИ аппарат RS85
Революционные изменения в экспертной диагностике. Безупречное качество изображения, молниеносная скорость работы, новое поколение технологий визуализации и количественного анализа данных УЗ-сканирования.
Настоящая работа посвящена изучению плодового фенотипа при ультразвуковом исследовании в различные сроки беременности при помощи новейших технологий Samsung, оптимизирующих диагностику многих врожденных пороков развития, аномалий, нарушений строения, особенностей развития с оценкой значимости отдельных ультразвуковых патологических маркеров в качестве потенциальных признаков генетических синдромов и ассоциаций.
Одной из ведущих причин детской и младенческой смертности являются врожденные пороки развития (ВПР), среди которых в 20% случаев встречаются множественные ВПР (МВПР) с установленной частотой 1:250 новорожденных [1]. Особое значение в профилактике МВПР имеет пренатальная диагностика - современный и высокоэффективный метод диспансеризации плода, направленный на своевременное выявление патологии, впоследствии определяющий выбор адекватной акушерской тактики при данной беременности и специфических мер профилактики болезни в данной семье в дальнейшем [2]. Современные ее возможности позволяют из комплекса патологических нарушений у плода выделить достоверно значимые ультразвуковые маркеры для постановки диагноза генетических синдромов различной этиологии. Сегодня пренатальная синдромология активно развивается, как в плане расширения спектра возможных лабораторных исследований, так и описания значимых, ключевых, таргетных ультразвуковых признаков многих наследственных синдромов различного происхождения.
Группа МВПР включает сотни нозологических форм, различных по этиологии, фенотипическим проявлениям и прогнозу. В силу огромной гетерогенности МВПР представляют собой сложную проблему для постановки окончательного диагноза. Основными этиологическими факторами, приводящими к возникновению синдромов с множественными пороками развития, являются генные, хромосомные мутации и действие на плод неблагоприятных факторов внешней среды [3, 4].
Любые наследственные или врожденные генетические болезни являются результатом повреждения генетической информации на геномном, хромосомном или генном уровне. В 60% всех случаев МВПР встречаются хромосомные синдромы, достаточно широко изученные и хорошо диагностируемые. Для лабораторной диагностики этих повреждений разработаны разнообразные и хорошо известные методы: цитогенетический, молекулярно-цитогенетический и молекулярно-генетический. МВПР нехромосомного генеза встречаются в 40% случаев. Среди них выделяют синдромы, ассоциации и неклассифицированные комплексы. Применительно к нехромосомным синдромам цитогенетическое исследование позволяет лишь отвергнуть хромосомную природу данного комплекса пороков развития, но не установить диагноз.
Сегодня имеется определенное количество публикаций о выявлении некоторых синдромов и ассоциаций при пренатальной эхографии [6, 7]. Однако дородовая идентификация нозологических форм нехромосомных синдромов пока не вошла в рутинную практику врачей в области пренатальной диагностики и носит случайный характер. В литературе отсутствуют четкие рекомендации о системном подходе к диагностике наследственных синдромов различной этиологии, нет диагностических алгоритмов и определенных схем взаимодействия врачей ультразвуковой пренатальной диагностики, генетиков, акушеров-гинекологов.
Использование эхографии делает возможным пренатальное выявление не менее 80% врожденных дефектов во II, III триместрах беременности и свыше 50% значимых нарушений анатомии плода уже в I триместре начиная со сроков 11-12 нед. Весь комплекс диагностированных пороков развития и различных микроаномалий в совокупности составляет фенотипический спектр синдрома, который состоит из «ядерных» (главных, ключевых) признаков и дополнительных аномалий, наличие которых не является обязательным для диагностики клинической нозологии синдрома.
Революцией в пренатальной ультразвуковой диагностике явилось появление объемной эхографии, которая, обладая такими качествами, как неинвазивность, безопасность и возможность многократного применения у одной пациентки, имеет высокую информативность в исследовании анатомии плода и изучении его фенотипа. При применении различных режимов объемной эхографии абсолютно очевидно их преимущество по сравнению с обычным сканированием. Детально можно изучить лицо плода (рис. 1-4) в различные сроки беременности, начиная со сроков первого пренатального скрининга в 11-14 нед, конечности плода, причем не только их наличие и положение (рис. 5, 6), но и состояние и количество пальцев (рис. 7-9) как на руках, так и на ногах. Также можно изучить позвонки плода (рис. 10), состояние твердого нёба (рис. 11, 12), строение наружного уха (ушной раковины) (рис. 13), состояние основных швов черепа и родничков, исключая их преждевременное закрытие при кранисиностозах (рис. 14, 15).
Читайте также:
