УЗИ, МРТ при бронхолегочной секвестрации у плода
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
Эмбриология. Пороки легких и бронхов могут быть результатом отклонений в развитии на всех стадиях формирования органа: между 3-й и 6-й неделями эмбрионального развития, когда на первичной кишке появляется дивертикул трахей, между 6-й и 16-й неделями, когда происходит быстрое деление бронхов, после 16-й недели, когда начинается активное формирование альвеолярного аппарата.
Врожденная гипоплазия и дисплазия лёгкого (синонимы: Врожденная кистозно-аденоматозная мальформация легкого, КАМЛ). Порок, при котором происходит разрастание терминальных бронхиол с образованием кист разного размера, не затрагивающих альвеолы. Вовлеченная в патологический процесс ткань легкого снабжается воздухом из магистральных дыхательных путей через узкие поры Кона, а кровью из легочной артерии. Практический во всех случаях заболевание поражает одно легкое (80-95%).
Врожденная секвестрация легкого (СЛ) представляет собой порок развития, характеризующийся тем, что часть легочной ткани, обычно ано-мально развитой и представляющей собой кисту или группу кист, оказывается отделенной от нормальных анатомо-физиологических связей (бронхи, легочные артерии) и васкуляризуется артериями большого круга кровообращения отходящими от аорты. Масса нефункционирующей эмбриональной или кистозной ткани, не имеющей связи с функционирующими дыхательными путями и снабжаемой кровью из большого круга кровообращения, носит название секвестра. Частота возникновения этого порока варьирует 0,15 до 6,4% среди всех пороков развития легкого. Почти во всех случаях поражение одностороннее и располагается в нижней доле легкого; около 2/3-слева.
Врожденная киста легкого (ВКЛ) (синонимы: бронхогенная, бронхолегочная, бронхиальная, воздушная бронхогенная и др.) киста легкого является пороком развития одного из мелких бронхов и представляет собой округлое полостное тонкостенное образование, выстланное изнутри эпителием и содержащее слизистую жидкость или воздух.
Врожденная лобарная эмфизема (ВЭЛ) - Врожденная лобарная эмфизема (синонимы - врожденная локализованная эмфизема, гигантская эмфизема, эмфизема напряжения) - порок развития, характеризующийся растяжением паренхимы доли легкого или сегмента и выявляющийся преимущественно в раннем детском возрасте. Врожденная лобарная эмфизема может быть обусловлена следующими тремя пороками развития: 1) аплазией гладких мышц терминальных и респираторных бронхов, в которых отсутствуют пучки гладких мышц и имеются лишь единичные мышечные клетки; 2) отсутствием промежуточных генераций бронхов; 3) агенезией всего респира-торного отдела доли. Изменения заключаются в отсутствии внутридольковых бронхов, терминальных респираторных бронхиол и альвеол.
Забрюшинная секвестрации легкого у новорожденного
Представлено описание секвестрации легкого с явлениями кистозной аденоматоидной трансформации 2-го типа, расположенной в забрюшинном пространстве у новорожденного мальчика, а также приведены данные литературы о клинико-морфологических особенностях подобных мальформаций. Подчеркнуты трудности клинико-инструментальной дооперационной диагностики.
Секвестрация легкого (легочная секвестрация, бронхолегочная секвестрация, секвестрированная доля легкого) расценивается как порок развития, при котором аномальный участок легочной ткани не связан с бронхиальным деревом и кровоснабжается аномальной артерией, являющейся чаще всего добавочной веточкой нисходящей аорты [18]. Данная аномалия составляет порядка 1-6% от всех пороков развития легких [3, 5]. Первое ее описание принадлежит Карлу Рокитанскому, которую он назвал дополнительной легочной долей [13]. Термин «легочная секвестрация» был предложен D.M. Pryce в 1946 г. [12].
Выявляется секвестрация легкого обычно при ультразвуковом или компьютерно-томографическом исследовании, в том числе у плода.
Приводим собственное наблюдение. Новорожденный мальчик от первой беременности, первых своевременных самопроизвольных родов. Масса тела при рождении 2470 г, рост 48 см. Из анамнеза известно, что на 24-25-й неделе беременности при ультразвуковом исследовании (УЗИ) плода выявлены признаки секвестрации левого легкого в виде образования кистозно-солидной структуры, расположенного в нижних отделах грудной полости слева.
При рождении состояние ребенка средней степени тяжести. Сердечная деятельность удовлетворительная. Дыхание пуэрильное, проводится во все отделы легкого, хрипов нет. Признаков
дыхательной недостаточности нет. Ребенок поступил в отделение хирургии новорожденных для
дополнительного обследования.
Данные лабораторных методов исследования в пределах возрастной нормы. При рентгенографии органов грудной клетки и брюшной полости легочные поля прозрачные, без очаговых и инфильтративных теней. Купола диафрагмы четкие, сердце, крупные сосуды без видимой патологии. На электрокардиограмме (ЭКГ) ритм синусовый, ЭКГ в пределах возрастной нормы. При эхокардиографии полости сердца не расширены, пороков сердца не выявлено. При УЗИ органов брюшной полости вертикальный размер правой доли печени 52 мм, селезенка и надпочечники без патологии. Правая почка 42×21×20 мм, паренхима 10 мм. Левая почка 44×22×20 мм, паренхима 10 мм.
При магнитно-резонансной томографии (МРТ) органов грудной клетки на серии томограмм (рис. 1 а-г, см. на вклейке) паравертебрально и паракостально сзади в заднем костно-диафрагмальном синусе на уровне VIII-XI грудных позвонков определяется объемное образование размером 3,2×2,7×1,5 см с четкими ровными контурами, неоднородной структуры, дольчатого строения, не имеющее связи с корнем легкого. Образование прилежит к заднему скату левого купола диафрагмы, позвоночнику и аорте. Нельзя исключить, что образование частично расположено под диафрагмой. Определяется
дополнительный артериальный сосуд, отходящий от аорты на уровне диафрагмы и питающий
данное образование. Жидкости в плевральных полостях нет. Печень и селезенка расположены типично, структура их не изменена. Почки обычной формы и размеров, структура их без особенностей, дифференциация на корковое и мозговое вещество не снижена. Надпочечники расположены обычно, структура их однородная.
Заключение: объемное образование в заднем костно-диафрагмальном синусе левой плевральной полости, вероятно следует расценивать как секвестрацию легкого.
На 10-е сутки жизни ребенку была выполнена операция. При торакоскопической ревизии левой плевральной полости легкое воздушно, целостность диафрагмы не нарушена. В заднем медиастинальном отделе определяется выпячивание диаметром до 3 см. Выполнено рассечение мышечного слоя диафрагмы над образованием забрюшинного пространства, начата мобилизация последнего. При манипуляциях вскрыта одна из кистозных полостей образования и выделено небольшое количество прозрачной слизистой жидкости. Учитыва.
Кистозный аденоматоз и секвестр легких плода - современный взгляд на проблему. Диагностика и исходы развития
Проведен анализ 30 публикаций ведущих отечественных и зарубежных исследователей с целью оценки возможности использования эхографии в диагностике и прогнозировании постнатального исхода при кистозно-аденоматозном пороке развития легких (КАПРЛ) и легочной секвестрации (ЛС) у плода. Частота диагностики пороков развития легких значительно возросла за последнее десятилетие и составляет 1:2500-3000 новорожденных. В 30-50% наблюдений отмечается сочетание КАПРЛ и ЛС, что приводит к образованию «гибридных форм». Пренатальная диагностика патологии возможна с 20-21 недели беременности, после 32 недель в большинстве наблюдений отмечается уменьшение размеров или полное исчезновение патологических признаков. Однако проведение в постнатальном периоде КТ с внутривенным контрастированием практически в 100% наблюдений позволяет обнаружить диагностируемую ранее патологию. В 95% наблюдений при наличии указанной патологии легких исход для новорожденного благоприятный. Неблагоприятный исход отмечен в 5-9%, при возникновении водянки плода. Тактика ведения новорожденных с бессимптомным течением заболевания неоднозначна, в подавляющем большинстве случаев проводится резекция пораженного участка легкого или секвестрэктомия.
Кистозно-аденоматозный порок развития легких (КАПРЛ) и легочная секвестрация (ЛС) являются наиболее частыми патологиями легких плода.
ЛС - порок развития, при котором часть аномально развитой легочной паренхимы отделяется от неизмененного легкого. При этом образовавшийся секвестр не связан с воздухоносными путями, не имеет функционального кровотока, а его кровоснабжение осуществляется изолированным сосудом, отходящим непосредственно от аорты [3, 4, 8]. Впервые данная патология была описана Rokitansky в 1861 г. [9] и в дальнейшем детализирована Pryce в 1946 г. [10].
За последние 20 лет отношение к данным порокам развития претерпело существенные изменения. Ранее эта внутриутробная патология легких обычно рассматривалась как крайне неблагоприятный для жизни порок развития, в связи с чем рекомендовалось прерывание беременности [6,11-14]. Однако в настоящее время большинство авторов сообщают о высокой выживаемости новорожденных с данной патологией [6, 12, 14-17]. Хорошо известен также феномен самопроизвольного исчезновения ее патологических признаков в конце беременности, что, по мнению ряда авторов, может достигать 50% [1, 12, 15, 16]. Также ранее высказывалось мнение, что смещение средостения большими размерами патологического участка легкого относится к прогностически неблагоприятному признаку. Однако в настоящее время установлено, что смещение средостения наблюдается довольно часто - в 50-60% наблюдений [1, 6, 14, 18] и не оказывает заметного влияния на выживаемость новорожденных. Последнее, как было установлено, связано с тем, что в процессе прогрессирования беременности в 60% случаев происходит уменьшение объема патологической ткани [5, 15, 19].
В настоящее время к единственно прогностически неблагоприятному признаку относят развитие водянки плода, что встречается в 5-10% наблюдений [6, 14-16, 20]. Ряд авторов [6, 15, 16, 21] считают, что проведение внутриутробного лечения при водянке плода позволяет повысить выживаемость новорожденных, тогда как другие придерживаются выжидательной тактики ведения беременности при этом осложнении.
Частота и диагностика
По данным исследований, опубликованных в начале 2000 гг., частота КАПРЛ варьирует в пределах 1 на 11 000-35 000 новорожденных [18]. Stocker L. и соавт. [18], в результате ретроспективного анализа выявления данной патологии за 19-летний период наблюдений в одном из регионов Англии отметили значительное увеличение ее диагностики в пренатальном периоде в последнее десятилетие. Так, по их данным, за период 1994-1998 гг. частота встречаемости составила 1,27 на 10 000 новорожденных, в то время как за период с 2008 по 2012 гг. - 4,15 на 10 000. Это, по их мнению, связано с увеличением разрешающей способности ультразвуковых приборов и повышением опыта оператора [7, 18], что подтверждают также и исследования Walker L. [15]. Так, проведенный им анализ пренатально диагностированных случаев легочной патологии в двух регионах Северной Англии (население более 8 млн человек), показал, что частота встречаемости этой патологии составляет 1:3000. По данным некоторых авторов, частота данной аномалии достигает 1:2000-2500 новорожденных [12, 13, 20].
Частота встречаемости ЛС точно не известна [8]. По данным Walker L. [15], диагноз ЛС был поставлен в 11% случаев (из 228 плодов с патологий легких) на основании выявления отдельного питающего сосуда.
Не отмечено зависимости патологии легких от пола плода. Она встречалась с одинаковой частотой у плодов как мужского, так и женского пола [4, 18, 20].
Сопутствующая патология при КАПРЛ выявляется в 3-18% случаев и наиболее часто сочетается с аномалиями сердечно-сосудистой и мочевыделительной систем [1, 6, 15, 16]. Хромосомная патология встречается редко, она отмечена только у 1% плодов с наличием сочетанных пороков развития [15].
При ЛС сочетанные пороки развития выявляются в 10-22%, из них наиболее часто встречаются врожденная диафрагмальная грыжа, патология сердечно-сосудистой системы, легочная гипоплазия [1].
Классификация кистозного аденоматоза
В настоящее время предложено несколько классификаций КАПРЛ. Согласно классификации Stocker J. [22], которая основана на размере кист и выстилающего их эпителия, выделяют следующие типы этой патологии:
Секвестрация легкого
Секвестрация легкого - порок формирования легких, заключающийся в обособлении от основного органа рудиментарного участка легочной ткани с автономным кровотоком, не участвующего в процессе газообмена. Клиника при секвестрации легкого может быть скудной; при обострении инфекционного воспаления включает лихорадку, слабость, одышку, кашель со слизисто-гнойной мокротой, кровохарканье; при сдавлении пищевода и желудка - нарушение прохождения пищи. Диагноз основан на данных рентгенографии и КТ легких, бронхографии, бронхоскопии, ангиопульмонографии. При секвестрации легкого лечение только оперативное - секвестрэктомия, сегментэктомия или лобэктомия.
МКБ-10
Общие сведения
Секвестр легочной ткани не участвует в дыхательной функции, имеет небольшую величину и обычно представлен кистовидным образованием (единичной бронхогенной кистой или скоплением мелких кист). Участок секвестрации не связан с сосудами малого круга кровообращения (легочной артерией), а имеет аномальное кровоснабжение через дополнительные сосуды, идущие от нисходящей дуги грудной или брюшной аорты или ее ветвей (подключичной и селезеночной артерий). Основной венозный отток от порочного участка реализуется через систему верхней полой вены, реже - через легочные вены. Иногда секвестрированная ткань может сообщаться с бронхами пораженного легкого.
Причины секвестрации легкого
Секвестрация легкого является сложным пороком, вызванным комбинированным нарушением формирования различных бронхолегочных структур. Аномалия развивается в результате тератогенных влияний в раннюю внутриутробную фазу. Источником развития легочного секвестра являются добавочные выпячивания первичной кишки, рудименты дивертикула пищевода, отделившиеся от организующихся легких и затем теряющие связь с первичной кишкой и бронхиальным деревом. Иногда может оставаться связь рудимента легкого с пищеводом или желудком с помощью соустья-тяжа (бронхолегочно-кишечная мальформация).
Согласно теории тракции, развитию секвестрации легкого способствует нарушение редукции ветвей первичной аорты с трансформацией их в аномальные сосуды. Через эти сосудистые ветви зачаточные фрагменты легкого отграничиваются от нормальной легочной закладки.
Секвестрация легкого часто комбинируется с другими пороками развития: ЭЛС - с неиммунной водянкой плода, анасаркой, гидротораксом новорожденного; ИЛС - с врожденной аденоматоидной мальформацией легкого 2-го типа, рабдомиоматозной дисплазией, трахео- и бронхопищеводными свищами, воронкообразной деформацией грудной клетки, открытым средостением, диафрагмальной грыжей, гипоплазией почки, дефектами позвоночника и тазобедренных суставов.
Классификация
Различают 2 формы секвестрации легкого: внутридолевую (интралобарную - ИЛС) и внедолевую (экстралобарную - ЭЛС). При интралобарной легочной секвестрации кистозный участок располагается среди функционирующей паренхимы легкого в границах висцерального листка плевры (чаще всего в области медиально-базальных сегментов нижней доли левого легкого) и васкуляризуется одним или несколькими аберрантными сосудами. ИЛС можно рассматривать как врожденную кисту с аномальным кровообращением. Секвестрированные легочные кисты имеют эпителиальную выстилку и жидкое или слизистое содержимое, часто первично не связаны с бронхиальным деревом. В кистозно-измененном участке секвестрации легкого рано или поздно возникает нагноение.
При экстралобарной форме легочный секвестр имеет отдельный плевральный листок и изолирован от основного органа, являясь полностью эктопированной тканью (добавочной легочной долей). ЭЛС чаще наблюдается в левой половине грудной клетки (в 48% случаев), в правой (20%), в переднем (8%) или заднем (6%) средостении, поддиафрагмально (18%), в брюшной полости (10%), интраперикардиально (единичные случаи). ЭЛС обеспечивается кровью исключительно через артерии большого круга кровообращения (грудную или брюшную аорту). Микроскопически ткань ЭЛС включает множество неразвитых одинаковых бронхиол, ацинусов, состоящих из альвеолярных ходов неправильной формы и обычных или расширенных альвеол. В четверти случаев ЭЛС диагностируется пренатально, в 2/3 случаев - в первые 3 месяца жизни ребенка.
Встречаемость внутридолевой секвестрации легкого примерно в 3 раза выше, чем внедолевой, иногда возможно их одновременное присутствие у одного больного. ЭЛС в 3-4 раза чаще выявляется у мальчиков, чем у девочек.
По клиническим критериям выделяют 3 формы секвестрации легкого:
Симптомы секвестрации легкого
Клиническая картина секвестрации легкого определяется локализацией секвестра, наличием или отсутствием его связи с дыхательными путями, степенью развития гипоплазии легочной ткани и воспалительных изменений. Симптомы интралобарной секвестрации легкого редко проявляются на этапе новорожденности и раннего детства, развиваясь обычно в более старшем возрасте при инфицировании, воспалении, нагноении и прорыве кистозного секвестра.
При нагноении кисты и абсцессе порочной доли легкого заболевание начинается остро с лихорадки, слабости, потливости, умеренного болевого синдрома, одышки при нагрузке, непродуктивного кашля, а при прорыве гнойника - с выделения значительного объема гнойной мокроты. Иногда возможно кровохарканье и легочные кровотечения, часты плевральные осложнения. Течение секвестрации легкого обычно приобретает хронический характер с повторяющимися вялыми обострениями и ремиссиям. При ИЛС может иметь место клиника рецидивирующей пневмонии.
Экстралобарная секвестрация легкого часто протекает асимптомно и начинает беспокоить больного только в подростковом и более позднем возрасте. Внедолевые секвестры могут провоцировать сдавление пищевода, желудка и других органов, что может проявляться одышкой, цианозом, нарушением эвакуации пищи. Риск инфекционного процесса крайне низок.
Секвестрация легкого может осложниться пневмомикозом, туберкулезом, профузным легочным кровотечением и массивным гемотораксом, формированием опухоли, развитием острой сердечной недостаточности по причине объемной перегрузки сердца за счет артериовенозного шунтирования в секвестрированной кисте.
Диагностика
Ранняя диагностика секвестрации легкого затруднена из-за схожести ее клинико-рентгенологических симптомов с таковыми при другой легочной патологии. Диагноз устанавливают по совокупности данных обзорной рентгенографии и КТ легких, бронхографии, бронхоскопии, УЗИ брюшной полости, аортографии, ангиопульмонографии.
Рентгенологически интралобарная секвестрация легких (в отсутствии связи с бронхом и воспаления) определяется как затенение неправильной формы разной степени интенсивности с просветлением в толще или как полостное образование с горизонтальным уровнем жидкости или без него. При обострении вокруг секвестра в нижней доле легкого отмечается выраженная деформация сосудисто-бронхиального рисунка, умеренная перифокальная инфильтрация легочной ткани. При бронхографии наблюдается деформация и смещение бронхов, соседних с пораженным сегментом легкого. Бронхоскопическая картина секвестрации легкого, сообщающейся с дыхательными путями, соответствует катарально-гнойному эндобронхиту на стороне пораженного легкого.
Брюшнополостная ЭЛС выявляется на УЗИ как четко отграниченное образование однородной эхогенности с кровоснабжением через ветви крупных артерий. Диагноз окончательно подтверждается МСКТ легких и ангиопульмонографией с установлением наличия, количества и топографии аномальных сосудов, питающих область секвестрации. Радиоизотопное сканирование печени и перитонеография помогают отграничить правостороннюю секвестрацию легких от патологии органов ЖКТ. Секвестрация легкого нередко выявляется в ходе хирургического вмешательства по поводу хронического гнойного процесса в легком. Дифференциальный диагноз при секвестрации легкого проводится с деструктивной пневмонией, туберкулезным процессом, кистой или абсцессом легкого, бронхоэктазами, опухолью грудной полости.
Лечение секвестрации легкого
При секвестрации легких требуется проведение оперативного вмешательства - удаление аномального участка легочной ткани. При выявлении бессимптомной внутридолевой секвестрации легких возможно выполнение сегментэктомии, однако чаще всего требуется удаление всей пораженной легочной доли (обычно нижней) - лобэктомия. Тактика хирургического лечения внедолевой формы заключается в удалении секвестрированного участка (секвестрэктомии). Наличие при секвестрации легких аномальных крупных артериальных сосудов нетипичной локализации делает важным тщательную предварительную диагностику во избежание их интраоперационного повреждения и развития тяжелого угрожающего жизни кровотечения.
Прогноз при интралобарной форме в отсутствие гнойно-септических процессов - удовлетворительный, при экстралобарной секвестрации легкого брюшнополостной локализации, как правило, лучше, чем при ее внутригрудном расположении.
1. Секвестрация легкого как интраоперационная находка/ Зеленский И.В., Оспанов М.А., Кали Д.Е., Аманжолов Е.У., Баширов М.Ш.// Вестник Казахстана - 2014 - №4.
2. Внутридолевая секвестрация легкого. Клиническое наблюдение/ Ворончихин В. В., Волкова Н. В., Санников О. Р.// Актуальные вопросы эндоскопии. - 2015.
3. Внелегочная секвестрация легкого/ Дубова Е.А., Павлов К.А., Кучеров Ю.И., Жиркова Ю.В., Кулабухова Е.А., Щёголев А.И.// Российский вестник детской хирургии, анестезиологии и реаниматологии. - 2011.
4. Случай диагностики и лечения внутрилегочной секвестрации у женщины 34 лет/ Шулутко А.М. , Ясногородский О.О. , Талдыкин М.В., Качикин А.С. , Гандыбина Е.Г. , Винарская В.А., Мороз Н.Г., Катанэ Ю.А.К.// Русский медицинский журнал. - 2014.
Пренатальная ультразвуковая диагностика и исходы кистозно-аденоматозного порока развития легких и легочной секвестрацией у плода. Опыт Центра за 10-летний период: 363 наблюдения
Цель. Анализ возможности пренатальной ультразвуковой диагностики и оценка исходов новорожденных с кистозно-аденоматозным пороком развития легких и легочной секвестрацией.
Материалы и методы. С 2010 по 2019 гг. на консилиум в Центр обратились 363 беременные с пренатально выявленными пороками легких у плода.
Результаты. Наиболее часто пороки легких диагностированы в сроках 20-22 недели гестации (96,7%). При эхографии основными признаками заболевания являлись повышение эхогенности легочной ткани (100%), увеличение в рамерах патологического легкого, наличие кист (71,9%), смещение средостения в контрлатеральную сторону. При динамическом наблюдении положительная динамика течения заболевания установлена в 77,7% наблюдений, из них в 12,3% отмечено полное исчезновение ранее выявляемых признаков, отсутсвие изменений отмечено в 18,2%. Водянка плода выявлена у 4,4% плодов. Родоразрешение в Центре проведено у 271 беременной, родился живым 271 ребенок. Точность ультразвуковой диагностики пороков легких составила 92,6%. Хирургическое лечение проведено 84,9% новорожденным, послеоперационная летальность составила 0,5% (1 недоношенный новорожденный).
Заключение. Применение эхографии позволяет с высокой точность диагностировать внутриутробно пороки развития легких. Общая смертность плодов и детей с данной патологией с учетом внутриутробной и постнатальной летальности составила 4,7%, из них 4,4% - дооперационная и 0,3% - послеоперационная.
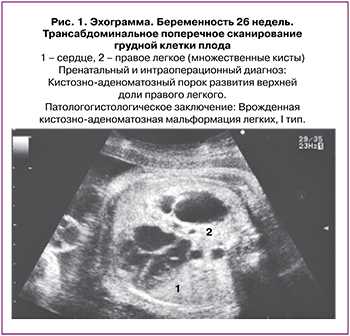
Кистозно-аденоматозная мальформация легких (КАМЛ) и легочная секвестрация (ЛС) являются наиболее частыми врожденными пороками развития легких плода и новорожденного. КАМЛ возникает в результате нарушения формирования терминальных бронхиол с образованием в ткани легкого различного диаметра кист 4. ЛС - это участок аномально развитой легочной паренхимы, не связанный напрямую с воздухоносными путями, его кровоснабжение осуществляется по аномальным сосудам из системного кровотока - аорты и ее ветвей 3.
Частота встречаемости КАМЛ широко варьирует от 1:2000-3000 до 1:35000 и общему числу новорожденных 6. Частота встречаемости ЛС точно не известна, что связано с относительной редкостью данного заболевания [5].
Морфологическая классификация КАМЛ предложенная J. Stocker, основана на размере кист и характере выстилающего их эпителия. Она одинаково удобна для описания как поражения собственно легочной ткани, так и секвестров легкого: I тип - большие кисты 2-10 см в диаметре, выстланные многослойным эпителием, II тип - кисты 0,5-2 см, выстланные цилиндрическим эпителием, III тип - микрокисты, менее 0,5 см в диаметре, выстланные кубическим эпителием. В последствии к этой оригинальной классификации было добавлено еще два типа 0 тип - солидная ткань и IV тип - одна большая киста. Эти два типа составляют всего 5% от всех кистозно-аденоматозных пороков развития легкого КАПРЛ [11]. В настоящее время существует мнение, что КАМЛ и ЛС нельзя всегда рассматривать как самостоятельные нозологические единицы. Морфологические исследования свидетельствуют о том, что около 50% КАМЛ и ЛС являются «гибридными формами», имеющими как признаки аномального строения ткани собственно легкого, так и характерные для секвестрации особенности кровоснабжения патологического участка [3, 11-14]. В целом происхождение, морфологические особенности и клинические данные этих заболеваний очень схожи, что позволяет объединить их в группу КАПРЛ (рис. 1-4).
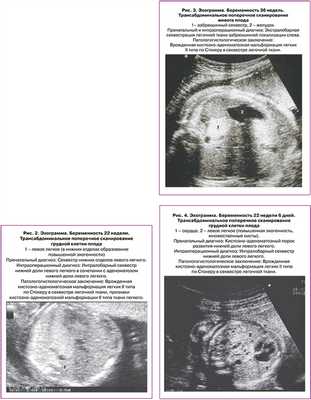
Сопутствующая патология при КАПРЛ выявляется в 3-22% случаев. Наиболее часто это аномалии сердечно-сосудистой и мочевыделительной системы, врожденная диафрагмальная грыжа (ВДГ) [1, 8, 11, 12]. Хромосомная патология встречается крайне редко [8].
Классификация ЛС основана на его локализации и связи с долей легкого. Интралобарный секвестр располагается в пределах доли легкого, они покрыты единым листком плевры, часто отсутствует четкая граница между тканью секвестра и нормальной легочной паренхимой. Экстралобарный секвестр полностью отделен от легкого и имеет собственную плевру. Забрюшинный (абдоминальный) секвестр расположен в поддиафрагмальном пространстве [5].
Пренатальная диагностика аномалий легочной ткани в основном возможна с 20-21 недели беременности [1, 3, 8, 11]. При эхографии в грудной клетке плода определяется увеличение размеров и повышение эхогенности всего легкого или его части с наличием или отсутствием в нем кистозных включений. В подавляющем числе наблюдений изменениям подвергается одна из долей легкого и процесс имеет одностороннюю локализацию (более чем в 95% случаев) [1, 3, 8, 11]. В 26-28 недель беременности наблюдается пик роста легочной патологии [1, 8]. В дальнейшем, обычно после 32 недель, может происходить уменьшение размера или полное исчезновение внутриутробных эхографических признаков данной патологии [4, 6, 9, 12, 15-18].
Исходы для новорожденного расцениваются как благоприятные в случае неосложненного внутриутробного течения заболевания. Выживаемость новорожденных составляет 88-97% [8, 11, 12]. Неблагоприятным вариантом течения беременности при легочной мальформации является развитие водянки плода [1, 2, 11]. Во внутриутробном периоде появление данного осложнения при пороках легкого отмечено в 5-9% наблюдений [8, 12], что значительно ниже, чем в популяции. По данным литературы частота встречаемости неиммунной водянки плода составляет 1 на 3000-4000 новорожденных 20. При консервативной тактике ведения беременности при водянке плода частота летального исхода варьирует в пределах 50-100% [11, 12]. В настоящее время при развитии данного осложнения внутриутробно у плода с пороком легкого возможно проведение хирургического лечения: при наличии крупных кистозных полостей - торакоамниотическое шунтирование [8, 12], склеротерапия [21], при ЛС - внутриутробная лазерная коагуляция питающего сосуда [12].
Как уже отмечалось ранее, в процессе прогрессирования беременности к окончанию III триместра в 15-50% случаев происходит исчезновение патологических признаков рассматриваемой патологии [1, 8, 11, 12]. Однако, после обследования новорожденных (МСКТ или МРТ с контрастированием сосудов) «исчезнувшая» патология вновь обнаруживается в 60-100% случаев [6, 11, 12]. При этом авторы отмечают, низкую диагностическую точность рентгенографии (около 60%) по сравнению с МСКТ.
Тактика ведения беременности при патологии легких зависит от размеров образования. Большие размеры образования и смещение средостения требуют родоразрешения в условиях специализиро.
Машинец Н.В. , Демидов В.Н. , Дорофеева Е.И. , Подуровская Ю.Л. , Буров А.А. , Филиппова Е.А. , Козлова А.В. , Кулабухова Е.А. , Гус А.И.
Читайте также:
- Атрезия наружного слухового прохода с проводящей глухотой. Отсутстиве ножки стремени и уродство наковальни
- Принципы операции при неполнослойном разрыве вращательной манжеты плечевого сустава
- Синдром Курца (Kurz)
- Аномалии глазной щели
- Сесамовидные(добавочные), сверхкомплектные(дополнительные) кости стопы. Старение стопы
