УЗИ, МРТ при гетеротаксическом и кардиоспленическом синдроме у плода
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
1 Кыргызский государственный медицинский институт переподготовки и повышения квалификации им. С.Б. Даниярова
Проблема врожденных пороков развития остается актуальной на сегодняшний день, в частности врожденные пороки сердца являются одной из основных причин детской смертности. Важной задачей акушерской службы является своевременная постановка диагноза, что включает в себя качественное скрининговое УЗИ, при необходимости детальный осмотр сердца плода. Необходимо отметить, что до настоящего времени нет конкретной связи с какими-либо факторами развития сердечной патологии, поэтому своевременная и грамотная внутриутробная диагностика пороков сердца играет важную роль. В данной статье проведен анализ 48 случаев различных врожденных пороков сердца, среди которых встречались как изолированные сердечные аномалии, так и сочетание с дефектами других систем. Сложные пороки сердца в большинстве случаев закончились летально. Изолированные дефекты межжелудочковой перегородки, которые в большинстве случаев имеют хороший прогноз, у плодов наших пациенток сочетались с хромосомными и генетическими заболеваниями. Наиболее ранний срок описания структуры пороков сердца пришелся на 18 недель беременности. Обучение врачей пренатальной диагностики правильному обследованию при врожденных пороках сердца, оснащение диагностических кабинетов ультразвуковыми аппаратами экспертного класса позволят значительно повысить качество выявления внутриутробной кардиальной патологии, а также сочетанных пороков развития плода.
1. Бокерия Е.Л. Перинатальная кардиология: настоящее и будущее. Часть 1: врожденные пороки сердца // Российский вестник перинатологии и педиатрии. 2019. № 3. С. 5-10.
2. Pavliceka J., Gruszkaa T., Kapralovab S., Prochazkac M., Silhanovad E., Kaniovad R., Polanskaa S., Cernickovac R., Klaskova E. Associations between congenital heart defects and genetic and morphological anomalies. The importance of prenatal screening. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2019. Vol. 163. No. 1. P. 67-74.
3. Тюменева А.И. Пренатальная диагностика сложных врожденных пороков сердца: автореф. дис. … канд. мед. наук. Москва, 2008. 24 с.
4. Чепурных Е.Е., Григорьев Е.Г. Врожденные пороки сердца // Сибирский медицинский журнал (Иркутск). 2014. № 3. С. 121-127.
5. Hernandez-Andrade E., Patwardhan M., Cruz-Lemini M., Luewan S. Early evaluation of the fetal heart. Fetal Diagnosis and Theraphy. 2017. Vol. 42. P. 161-173.
6. Charafeddine F., Hachem А., Kibbi N., Abutaqa M., Bitar F., Bulbul Z., El-Rassi I., Arabi M. The first fetal echocardiography experience for prenatal diagnosis of congenital heart disease in Lebanon: successes and challenges. J Saudi Heart Associations. 2019. Vol. 31. P. 125-129.
7. Bravo-Valenzuela N., Peixoto A. B., Júnior E. A. Prenatal diagnosis of congenital heart disease: a review of current knowledge. Indian heart journal. 2018. Vol. 70. P. 150-164.
8. Jortveit J., Wik G., Degaard J. S., Sitras V., Perminov K.V., Holmstrom H. Diagnosis of severe congenital heart defects in Norway 2016. Tidsskrift for Den norske legeforening. 2019. P. 1-8.
9. Медведев М.В., Кубрина М.В., Галкина О.Л., Копытова Е.И., Полотова Е.В., Марченко Н.П. Атрезия легочной артерии с дефектом межжелудочковой перегородки: мультицентровой анализ случаев пренатальной диагностики // Пренатальная диагностика. 2017. Т. 16. № 2. С. 108-116.
Сердечная патология является одной из основных причин детской смертности и находится на втором месте среди причин младенческой смертности. Частота составляет 8 случаев на 1000 новорожденных [1, 2].
Неблагоприятный прогноз для жизни представляют сложные врожденные пороки сердца (ВПС). Под термином «сложный» понимают такие сердечные аномалии, как гипоплазированные камеры сердца, атрезии клапанов, аномальное отхождение магистральных сосудов, единственный желудочек, то есть изменения в сердце, при которых невозможно выполнить полную хирургическую коррекцию [3].
Критические пороки сердца, требующие хирургического вмешательства в ранний неонатальный период, составляют 25 % от всех врожденных сердечных аномалий. В первую неделю умирает 29 % новорожденных, к концу первого года жизни - 87 % [4].
Первое ультразвуковое скрининговое обследование (11-13 недель) является важным осмотром. В случае обнаружения увеличения толщины воротникового пространства, отклонения сердечной оси, рекомендуется расширенное обследование сердца (фетальная эхокардиография). При рутинном ультразвуковом исследовании лишь в 40 % выявляются пороки сердца у плодов, при том что детальный осмотр позволяет выявлять до 90 % сердечных пороков внутриутробно. Для своевременного выявления врожденных пороков сердца необходимо детально обследовать сердце плода ультразвуковым методом при втором скрининговом обследовании (18-22 недели) [5, 6].
Применяя фетальную эхокардиографию, возможно определить структуру порока и спрогнозировать исход для плода [7]. Особенно это касается сложных пороков сердца, так как имеет место позднее выявление патологии, при осмотре неонатологом в родильном доме или после выписки домой [8].
Данная тема является актуальной. Врачи пренатальной диагностики встречаются с трудностями точного определения структуры сердечных пороков, что связано с большой вариабельностью кардиальной аномалии у плодов.
Задачей врачей-гинекологов является правильная тактика ведения беременной после установки диагноза, так как своевременная хирургическая помощь спасает жизни детей и влияет на качество дальнейшей жизни.
Цель исследования: проанализировать течение беременности при выявлении кардиальной патологии у плодов, определить точность внутриутробной диагностики, описать случаи сочетания сердечных пороков с патологией развития других органов плода.
Материалы и методы исследования
В центре диагностики матери и плода «Family» г. Бишкек с января 2019 г. по ноябрь 2020 г. было осмотрено 48 беременных женщин с пороками сердца плода, требующими хирургической коррекции после рождения. Всем новорожденным было проведено эхокардиографическое обследование после родов врачами-кардиологами для уточнения структуры пороков. В случаях прерывания беременности, для подтверждения диагноза проводилось патологоанатомическое вскрытие.
Осмотр беременных выполнялся на ультразвуковых аппаратах General Electric (GE) Voluson E8 и E10, c использованием программы fetal heart. Также использовалась программа STIC (постобработка снимков, полученных в режиме объемного сканирования), основным являлся двумерный режим с цветовым и импульсным доплеровским картированием. У всех пациентов было получено информированное согласие на участие в нашем исследовании. Результаты были обработаны путем вычисления относительных величин (в %).
Результаты исследования и их обсуждение
Среди 48 плодов с ВПС сложные пороки сердца были в 40 случаях (83,3 %). Из общего количества умерли после родов 23 ребенка (47,9 %). Прервали беременность 3 женщины (6,2 %), в двух случаях проводилось патологоанатомическое вскрытие плодов. Третья беременная после заключения медицинской комиссии прервала беременность в сроке 31 неделя, в связи с плохим прогнозом для жизни ребенка. Диагноз был подтвержден методом эхокардиографии.
Из факторов риска, по анализам обменных карт, острые респираторные вирусные инфекции (ОРВИ) до 12 недели перенесли 14 женщин (29,1 %), ОРВИ во втором триместре перенесли 4 женщины (8,3 %). Анемия легкой степени имела место в 12 случаях (25,0 %), хроническая ревматическая болезнь сердца у матери - один случай (2,0 %). Многоплодные беременности как фактор риска в нашем случае встречались в двух случаях (4,1 %), обе дихориальные, диамниотические двойни.
Количество плодов мужского пола составило - 31 (64,5 %), женского 17 (35,4 %). Маловесными (вес менее 2600 г.) родились 9 детей (18,7 %), из них 8 имели сочетание порока сердца с ненормальным развитием других органов, в одном случае порок сердца был изолированным.
При ультразвуковом исследовании фетоплацентарное нарушение кровотока 1 степени выявлено у одной беременной (2,0 %), задержка внутриутробного развития у 4 (8,3 %), маловодие у 2 (4,1 %), многоводие у 5 (10,4 %), причем избыточное количество вод во всех случаях сочеталось с множественными пороками развития.
Сложности при ультразвуковом осмотре вызывали неправильное положение плода, большой срок гестации (после 35 недель), многоводие, маловодие. Необходимо отметить, что технология STIC информативна при осмотрах четырехкамерной проекции сердца (пороки атривентрикулярных клапанов, гипоплазии желудочков, дефекты межжелудочковой перегородки). Для осмотра выходных трактов желудочков, особенно при повороте оси сердца, осмотр в двумерном режиме является предпочтительным. Также для осмотра органов других систем маловодие и неудобное положение плода являются помехами для трехмерного ультразвука.
Структура выявленных пороков оказалась многообразна. Нами были диагностированы: у 5 плодов (10,4 %) двойное отхождение сосудов от правого желудочка, аномалия Эбштейна - 1 (2,0 %), транспозиция магистральных сосудов - 3 (6,2 %), стеноз легочной артерии - 7 (14,5 %), изолированный перимембранозный дефект межжелудочковой перегородки - 3 (6,2 %), декстрапозиция аорты с дефектом межжелудочковой перегородки - 5 (10,4 %), атрезия легочной артерии - 4 (8,3 %), атриовентрикулярный канал -5 (10,4 %), тетрада Фалло - 6 (12,5 %), перерыв дуги аорты - 1 (2,0 %), атрезия трикуспидального клапана - 1 (2,0 %), атрезия митрального клапана - 4 (8,3 %), из них в двух случаях аортальный клапан был атрезирован, также в двух случаях имелось двойное отхождение сосудов от правого желудочка. Коарктация аорты составила один случай (2,0 %), единственный желудочек - 2 (4,1 %).
После рождения вскрытие проводилось в одном случае - ребенку с аномалией Эбштейна, который умер в родильном доме на вторые сутки. Согласно заключению патологоанатома, причиной смерти стала острая сердечная недостаточность, дилатация полостей сердца, острый венозный застой внутренних органов.
В двух случаях единственного желудочка диагностика оказалась затруднительной как внутриутробно, так и после родов. В первом случае трикуспидальный клапан был атрезирован и полость правого желудочка практически отсутствовала, также имелся единый сосуд, исходящий из функционально единого желудочка. После родов рекомендовалась компьютерная томография для уточнения диагноза. При телефонном разговоре с матерью мы узнали, что в возрасте 10 месяцев ребенок еще не прошел полного обследования, но в развитии значительно отставал, не мог переворачиваться и самостоятельно не сидел.
Во втором случае мы диагностировали правосформированное, праворасположенное сердце в сочетании с единым атриовентрикулярным клапаном, двойным отхождением сосудов от правого желудочка, ребенок умер в первый месяц жизни.
Среди плодов с кардиальной патологией в 6 случаях (12,5 %) было сочетание с хромосомными аберрациями и генетическим заболеванием: синдромом Дауна - 4 случая, синдромом Ди Джорджи - один случай; также наблюдался один случай редкой генетической патологии (синдром Холта - Орама, наследственное заболевание, сочетание порока сердца с отсутствием первого пальца на кистях обеих рук до аплазии лучевой кости).
После родов успешно прооперированы были двое детей с тетрадой Фалло, также двое детей со стенозом клапана легочной артерии. Один ребенок с диагнозом двойного отхождения сосудов от правого желудочка благополучно оперирован в Турции. К сожалению, в случаях транспозиции магистральных сосудов и единственного желудочка детям было отказано в проведении оперативного лечения как местными, так и зарубежными хирургами в связи с высоким риском смерти сразу после операции.
Приводим наблюдение о несовпадении нашего диагноза с эхокардиографическим заключением после родов. В нашем центре при плановом обследовании на 30 неделе беременности был установлен диагноз коарктации аорты с дефектом межжелудочковой перегородки. В родильном доме при проведении эхокардиографии был выявлен только дефект мышечной перегородки, коарктация была исключена. Ребенок умер через 2 недели после родов, от вскрытия родители отказались. Мы пришли к выводу, что портативные ультразвуковые аппараты, на которых обследуют детей в родильных домах, могут вызывать сложности визуализации и неполную диагностику, что связано с менее четким изображением, чем на стационарном оборудовании.
По данным литературы, внутриутробная диагностика пороков сердца возможна с 13 недели беременности, в частности таких сложных для выявления ВПС, как атрезия легочной артерии [9]. В нашем центре плод с атрезией легочной артерии и дефектом межжелудочковой перегородки был выявлен в 18 недель беременности. Данная беременность была прервана в связи с неблагоприятным прогнозом для жизни. Патологоанатомическое вскрытие подтвердило диагноз. По нашему мнению, 18 неделя беременности (второе скрининговое обследование) является наиболее ранним сроком для точного определения структуры порока. Связано это с тем, что магистральные сосуды сердца плода плохо видны в сроки первого скринингового обследования, что может приводить к неточной диагностике.
Из 48 случаев с ВПС 16 плодов (33,3 %) имели множественные пороки развития, причем такие изменения, как гидроцефалия, укорочение трубчатых костей, выявлялись на сроках после 30 недель. А случаи атрезии ануса были обнаружены только при рождении детей. Таким образом, выявление любых изменений в сердце является поводом для обязательного повторного ультразвукового обследования в сроки 25-30 недель (таблица).
Возможности эхокардиографии плода в I триместре беременности (11-14 недель)
Московский областной НИИ акушерства и гинекологии (МОНИИАГ), Россия.
Гомельский областной медико-генетический центр с консультацией "Брак и семья", Гомель, Беларусь.

УЗИ аппарат HM70A
Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
- Семьи, имеющие ребенка с ВПС.
- Семьи с ВПС у одного или обоих супругов.
- Женщин, страдающих сахарным диабетом, системными заболеваниями соединительной ткани, гипотиреозом.
- Беременных с тератогенной экспозицией в ранние сроки беременности (герпес ранее 6-7-й недели) [2].
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): "Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга".
Главная цель пренатальной диагностики сформулирована специалистами пренатальной диагностики всего мира - это обеспечение женщины максимально возможной информацией о пороке как можно раньше. Мы должны дать право женщине и семье в целом решать вопрос о пролонгировании беременности с грубыми пороками развития у плода [4].
С каждым годом все большее количество публикаций посвящается диагностике ВПС в ранние сроки - в I триместре беременности 7. Практически ни один из выпусков журнала ISUOG (Ultrasound In Obstetrics and Gynecology, или "белого" журнала, как его называют специалисты) не обходит своим вниманием тему ранней диагностики врожденных пороков развития.
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат "перу" специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
При эхокардиографии изучались четырехкамерный срез сердца плода (рис. 1) и срез через три сосуда (рис. 2). УЗИ проводилось трансабдоминальным датчиком, лишь при необходимости (затрудненная визуализация) использовался внутриполостной датчик. Четырехкамерный срез сердца плода при ультразвуковом сканировании трансабдоминальным датчиком визуализировался в 85% случаев, срез через сосуды - в 73%, при использовании трансвагинального датчика эти цифры существенно возрастали до 100 и 91% соответственно. Оптимизация пренатальной диагностики ВПС может быть достигнута путем строгого соблюдения основных методических правил. При оценке четырехкамерного среза плода необходимо оценить нормальное расположение сердца плода, исключив его эктопию (рис. 3), положение оси сердца плода, что не представляет никаких трудностей, нормальные пропорции и размеры камер сердца, движение створок атриовентрикулярных клапанов должно быть свободным, септальная створка трикуспидального клапана должна располагаться ближе к верхушке сердца (рис. 4). При оценке среза через три сосуда необходимо оценить взаиморасположение сосудов и их диаметр.
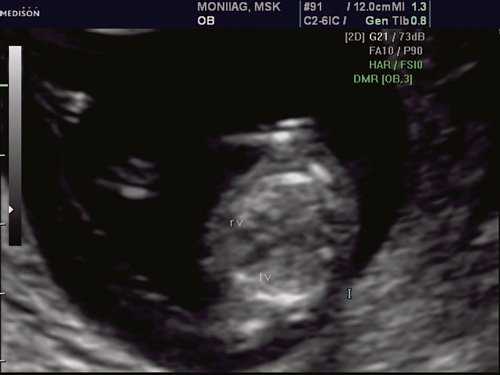
Рис. 1. Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.
Патологии сердца плода, которые можно определить на скрининговом УЗИ
Основные пороки сердца у плода формируются в 1 триместре беременности на сроке 12-14 недель. Это может быть реакция на внешние факторы либо генетические проблемы. К этому сроку происходит формирование сердечной мышцы плода, поэтому будущей матери необходимо пройти УЗИ обследование на выявление патологий органа.

Во внутриутробном развитии пороки сердца возникают как реакция организма на нарушение плацентарного кровообращения либо воздействие канцерогенных веществ (формальдегиды, никотин, токсические вещества).
Аномалии положения сердца плода
Среди аномалий расположения сердца выделяют эктопию сердца (размещение вне грудной клетки). К таким патологиям относят декстрокардию (смещение сердца в правую сторону относительно нормального положения) и мезокардию (расположение сердца не с левой стороны грудины, а по срединной линии тела).
Эктопия сердца у плода возникает на сроке 14-18 дней с момента зачатия мезадерма начинает развиваться неправильно, что вызывает неправильное срастание брюшной стенки. У плода либо отсутствует диафрагма вообще, либо нет диафрагмального сегмента перикарда.
Из-за отверстия в стенке между правым и левым желудочком слышны интракардиальные шумы. Также у плода эктопия сердца нередко сопровождается другими аномалиями — гидроцефалией, энцефалоцеле и пр.
Надо сказать, что существует высокая вероятность ошибочного диагноза по установки положения сердца. При тазовом предлежании плода на УЗИ сердца визуализируется справа, хотя на самом деле оно располагается в положенном месте.
В 71% случаев эктопия сердца вызывается плевральным выпотом, кистозным аденоматозным пороком развития лёгкого, диафрагмальной грыжей.
Различают четыре вида эктопии:
- абдоминальная (сердце находится в брюшине);
- грудная (сердце выходит наружу через дефекты грудины);
- торакоабдоминальная (пентада Кантрелла — сложнейшая патология, имеющая комплекс отклонений от нормы);
- шейная (сердце смещается в область сердца).
Грудная эктопия встречается в 55-60% случаев, торакоабдоминальная — в 38%, шейная — почти в 3%. Выживаемость составляет около 10%. В большинстве случаев при эктопии младенец либо рождается мёртвым, либо умирает сразу после рождения.
Патология сопровождается смещением других внутренних органов, которые не защищены от механических повреждений и подвержены инфекциям и вирусам больше обычного.
Врождённые дефекты сердца
Пять наиболее встречаемых дефектов — это тетрада Фалло, дефект межжелудочковой перегородки, транспозиция магистральных сосудов, коарктация аорты, гипоплазия левых камер.
Оптимальным сроком для проведения ультразвуковой диагностики сердца плода считается период 24-26 недель беременности. Именно в это время анатомические структуры сердца максимально визуализируются, а на более ранних сроках можно увидеть только явные и глобальные пороки сердца.
Наиболее информативен ультразвуковой осмотр 4-камерного среза сердца. После которого при любом отклонении от нормы женщина отправляется на более детальное обследование плода с использованием допплеровской эхокардиографии. Также проводится кариотипирование, потому что в 30% случаев аномалии являются результатом хромосомных нарушений.
Что выявляет УЗИ
В нашей клинике используется современное 4D оборудование, имеющее допплеровский режим. С его помощью можно получить изображение 3-х главных сосудов — верхней полой вены, лёгочного ствола и восходящей аорты. Во время обследования выявляется не только расположение сосудов, но и их диаметр и другие параметры.
На экране монитора будут видны следующие патологии плода:
- Уменьшение диаметра аорты при расширении лёгочного ствола можно говорить об гипоплазии (недоразвитости) левых отделов сердца малыша, отвечающих за начало кровообращения;
- Уменьшение ствола лёгочной артерии в размерах при сохранении в норме диаметров аорты и верхней полой вены указывает на стеноз (сужение) лёгочной артерии. У плода выявляются только выраженные формы;
- Маленький диаметр аорты при нормальном 4-камерном строении сердца является следствием коарктации аорты (сужение аорты сердца в определённом сегменте);
- Визуализация 2 сосудов вместо 3 может быть следствием соединения сосудов в общий артериальный ствол;
- Смещение аорты вперёд или правее лёгочной артерии наблюдается при транспозиции магистральных сосудов;
- Диаметр аорты расширен, но при этом сужен диаметр лёгочной артерии, а аорта смещена вперёд. Это может является тетрадой Фалло (очень тяжёлая сочетанная аномалия сердца). Проблема включает в себя стеноз или гипертрофию выходного отдела правого желудочка, дефект межжелудочковой перегородки, декстропозицию аорты (отхождение в правую сторону). Диагностика плода крайне затруднительна, поэтому на помощь приходит допплеровский режим, помогающий визуализировать поток крови в аорту из обоих желудочков;
- Гипоплазия (недоразвитость) правых камер сердца определяется по уменьшению их размеров относительно левых камер. Эта патология сопровождается обычно дисплазией (провисанием или выбуханием) митрального клапана;
- Общий предсердно-желудочковый канал виден как дефект перегородки сердца с расщеплением атриовентрикулярного клапана;
- Гипопластический синдром левых отделов сердца проявляется в виде недоразвития желудочка и митрального и аортального клапанов;
- Единственный желудочек также не является нормой, потому что их должно быть два и они хорошо просматриваются в четырёхкамерном срезе;
- При недоразвитости трёхстворчатого клапана кровь из правого предсердия не попадает в левое, что хорошо видно при допплеровском исследовании;
- Со 2 триместра фиброэластоз эндокарда визуализируется как утолщение миокарда и ухудшении его сокращения;
- Недоразвитие миокарда одного из желудочков (аномалия Уля) заметна на 2 триместре.
Какие патологии сердца у плода сложно выявить на скрининговом УЗИ
Трудности в диагностике заболеваний сердца на УЗИ вызывают следующие патологии органа:
- дефект межпредсердной перегородки;
- дефект межжелудочковой перегородки;
- транспозиция главных артерий.
При подозрении на их наличие, пациентка должна регулярно наблюдаться и соблюдать все рекомендации гинеколога.
Закономерности изменений показателей ультразвукового исследования при врожденных пороках сердца у плода в зависимости от особенностей внутрисердечной гемодинамики антенатального периода
ФГУ Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова Минздравсоцразвития России,
Москва.
УЗИ сканер HS70
Точная и уверенная диагностика. Многофункциональная ультразвуковая система для проведения исследований с экспертной диагностической точностью.
Врожденные пороки сердца редко влияют на развитие плода. Впервые это было отмечено в исследованиях B. Mac Mahon и соавт. [1]. Однако есть пороки, не совместимые с жизнью, и после рождения ребенок тотчас погибает. Некоторые врожденные пороки сердца, даже несложные формы, в раннем неонатальном периоде протекают злокачественно, обусловливая развитие декомпенсации кровообращения и дыхательную недостаточность. Главной причиной этого является несовершенство компенсаторных механизмов.
Диагностика врожденных пороков сердца у плода - одна из труднейших задач перинатологии. Многие врожденные пороки сердца, даже сложные, практически не совместимые с жизнью, антенатально не проявляются в силу особенностей внутрисердечной гемодинамики и после рождения становятся катастрофой для жизни ребенка.
Антенатальный период характеризуется особенностями кровообращения, такими как высокое давление в правом желудочке, незначительный объем кровотока в легочной артерии, параллельность работы желудочков сердца, функционирующие артериальный проток и овальное окно, нагнетающие кровь как обходные анастомозы в большой круг кровообращения за счет усиленной работы правого желудочка. Эти особенности внутрисердечной гемодинамики плода, безусловно, должны корректировать характер гемодинамических изменений ультразвуковых показателей сердца в норме и при пороках сердца у плода.
Известно, что у пациентов с врожденными пороками сердца нарушения гемодинамики в результате анатомических изменений в значительной степени влияют на данные ультразвукового сканирования сердца, такие как размеры полостей сердца, степень гипертрофии миокарда, функция клапанного аппарата, сократительная способность миокарда, направленность движения межжелудочковой перегородки.
Метод оценки внутрисердечной гемодинамики базируется на широко известных понятиях о систолической, объемной и смешанной перегрузках сердца, предложенных в 1952 г. E. Cabrera и J. Monroy [2].
В основе разделения использован следующий принцип.
Нагрузка сопротивлением возникает при ситуации, когда выброс крови из желудочков сердца в магистральные сосуды затруднен на уровне полулунных клапанов (стеноз аорты и легочной артерии), подклапанного пространства (идиопатический гипертрофический субаортальный стеноз, подклапанный стеноз аорты или легочной артерии), на протяжении сосудистого русла (коарктация аорты) либо при значительном увеличении выходного сопротивления (синдром Эйзенменгера). В результате затруднения выброса крови резко возрастает напряжение миокарда соответствующего желудочка при относительно стабильном объеме крови, что служит проявлением систолической перегрузки сердца. При систолической перегрузке желудочков сердца независимо от нозологической формы порока полость желудочка, несущего основную нагрузку сопротивлением, умеренно увеличивается в размерах. В ответ на нагрузку сопротивлением на эхокардиограмме выявляется гипертрофия миокарда соответствующего желудочка, и чем больше сопротивление выбросу, тем резче выражена степень гипертрофии миокарда соответствующего желудочка и межжелудочковой перегородки (рис. 1) [3].
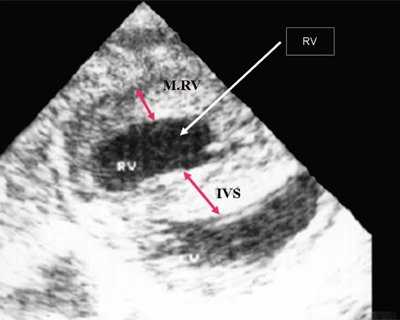
Рис. 1. Систолическая перегрузка правого желудочка. Поперечное сечение желудочков сердца при стенозе легочной артерии. Градиент давления правый желудочек - легочная артерия равен 200 мм рт.ст. Выраженная гипертрофия межжелудочковой перегородки и миокарда передней стенки правого желудочка.
Нагрузка объемом возникает при дополнительном притоке крови в желудочки и в результате шунтирования крови через септальные перегородки или артериальный проток (дефекты межпредсердной и межжелудочковой перегородок, открытый артериальный проток), а также в результате обратного тока крови через атриовентрикулярные клапаны (клапанная недостаточность).
Характерными особенностями выраженной объемной перегрузки правого желудочка являются дилатация желудочка, при которой толщина миокарда не превышает верхней границы нормы, увеличение правого предсердия, парадоксальный характер движения межжелудочковой перегородки и увеличение амплитуды движения трикуспидального клапана (рис. 2, 3).
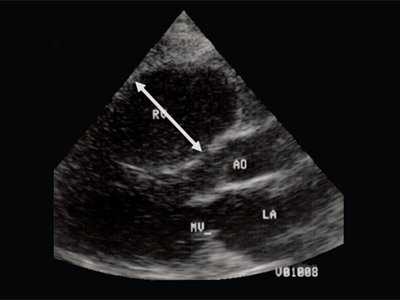
Рис. 2. Длинная ось сердца. Объемная перегрузка правого желудочка при дефекте межпредсердной перегородки. Объем сброса крови превышает 200% МОС. Отмечается выраженная дилатация правого желудочка.
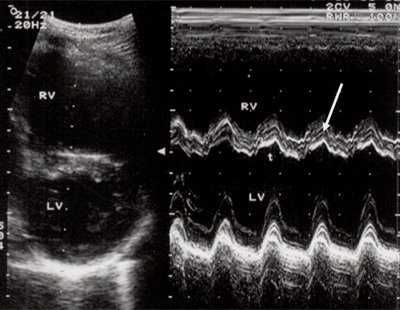
Рис. 3. Объемная перегрузка правого желудочка при дефекте межпредсердной перегородки. В- и М-сканирование. Стрелкой показан парадоксальный характер движения межжелудочковой перегородки.
Для левого желудочка признаком объемной перегрузки являются увеличение полости левого предсердия и желудочка, а также экскурсии межжелудочковой перегородки и миокарда задней стенки левого желудочка (рис. 4).
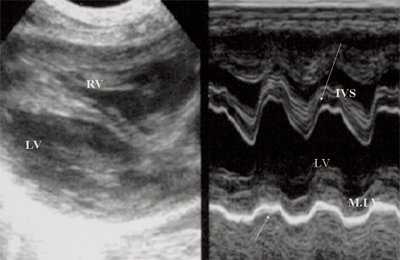
Рис. 4. Объемная перегрузка левых отделов сердца. В- и М-сканирование. Отмечается усиление экскурсии межжелудочковой перегородки и миокарда задней стенки левого желудочка.
IVS - межжелудочковая перегородка, MLV - миокард левого желудочка, LV и RV - левый и правый желудочек.
При сочетании нагрузки сопротивлением и объемом возникает смешанная перегрузка (например, при дефекте межжелудочковой перегородки и повышении давления в легочной артерии для правого желудочка систолическая перегрузка сочетается с нагрузкой объемом, для левого желудочка в результате артериальновенозного сброса крови через дефект).
За многолетний период (с 1980 г. по настоящее время) наблюдений в ФГУ Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова Минздравсоцразвития России было замечено, что в антенатальном периоде не всегда работают принципы гемодинамических эхокардиографических проявлений врожденного порока сердца, которые ранее были разработаны и представлены в современной литературе 5.
Анализ более 2000 наблюдений врожденных пороков сердца у плода показал, что в ряде наблюдений имеются лишь анатомические изменения, характерные для определенной нозологической формы порока. При других врожденных пороках сердца изменения на эхокардиограмме связаны с характером гемодинамической нагрузки на сердце и аналогичны тому, что наблюдается после рождения. Наконец, в ряде наблюдений врожденных пороков сердца у плода вторичные изменения на эхокардиограмме, вызванные гемодинамическими нарушениями, отличаются от гемодинамических проявлений ультразвуковых показателей у детей и взрослых. Это позволило разделить все врожденные пороки сердца плода на три группы в зависимости от изменений на эхокардиограмме, обусловленных особенностями антенатальной внутрисердечной гемодинамики.
В первую группу вошли пороки сердца, которые, имея отчетливые анатомические проявления патологии, при ультразвуковом исследовании не имеют гемодинамических проявлений врожденного порока сердца. К ним относятся: дефект межпредсердной перегородки, дефект межжелудочковой перегородки, общий желудочек, простая форма транспозиции магистральных сосудов и также при наличии дефекта межжелудочковой перегородки общий артериальный ствол, двойное отхождение сосудов от желудочков сердца.
- дилатации правого желудочка (см. рис. 2, 3);
- увеличению правого предсердия;
- парадоксальному характеру движения межжелудочковой перегородки (см. рис. 2, 3).
Антенатально при равных величинах давления в желудочках сердца и в предсердиях объемной перегрузки не возникает. В связи с этим ни один из эхокардиографических гемодинамических признаков, используемых у детей и взрослых, не выявляется у плода. К эхокардиографическим проявлениям порока антенатально относится только прямой признак - перерыв ультразвукового луча в области дефекта. Размеры сердца, соотношение размеров желудочков сердца не отличаются от нормы (рис. 5).
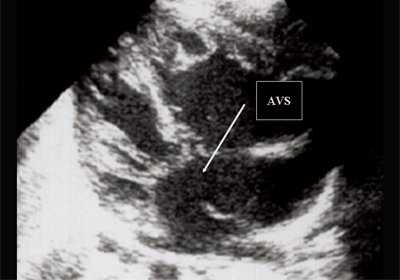
Рис. 5. Четырехкамерное сечение сердца плода. Стрелкой указан первичный дефект межпредсердной перегородки (АVS).
В равной степени это относится к дефекту межжелудочковой перегородки (рис. 6), простой форме транспозиции магистральных сосудов (рис. 7, 8), транспозиции магистральных сосудов с дефектом межжелудочковой перегородки (синдром Тауссиг - Бинга) (рис. 9), общему желудочку (рис. 10), общему артериальному стволу (рис. 10), двойному отхождению сосудов от одного из желудочков сердца (рис. 11).
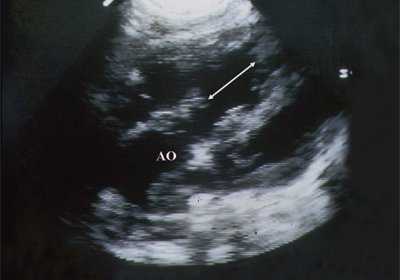
Рис. 6. Дефект межжелудочковой перегородки. Длинная ось сердца. Стрелками показан дефект межжелудочковой перегородки.
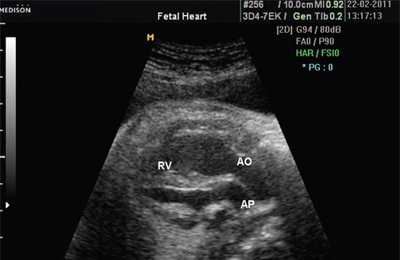
Рис. 7. Транспозиция магистральных сосудов.
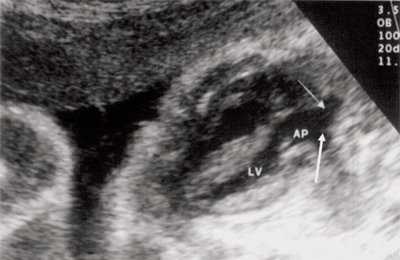
Рис. 8. Транспозиция магистральных сосудов, стрелками показаны ветви легочной артерии.
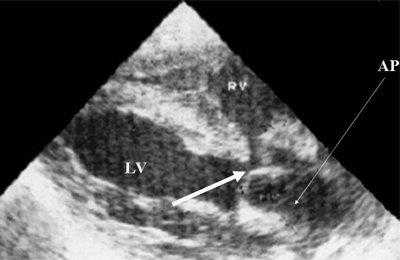
Рис. 9. Синдром Тауссиг - Бинга. Легочная артерия (отмечена стрелкой) расположена над дефектом межжелудочковой перегородки.
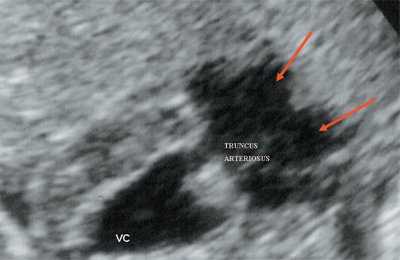
Рис. 10. Общий желудочек с отхождением TRUNCUS ARTERIOSUS. Стрелками показано разделение TRUNCUS ARTERIOSUS на аорту и ствол легочной артерии.
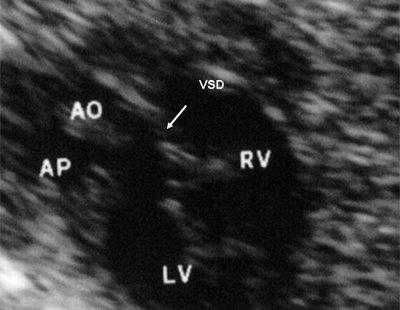
Рис. 11. Двойное отхождение магистральных сосудов от левого желудочка. Длинная ось сердца. Магистральные сосуды инвертированы и отходят от левого желудочка. Аорта расположена "верхом" над дефектом межжелудочковой перегородки (стрелка).
LV и RV - левый и правый желудочек, АР - легочная артерия, АО - аорта, VSD - дефект межжелудочковой перегородки.
Таким образом, диагностика перечисленных выше врожденных пороков сердца основывается на знании анатомических изменений, характерных для определенной нозологической формы патологии.
Вторая группа врожденных пороков сердца. При ультразвуковом исследовании регистрируются анатомические и гемодинамические изменения, характерные для определенной нозологической формы порока. В эту группу были отнесены: стеноз аорты, стеноз легочной артерии, врожденный митральный стеноз, транспозиция магистральных сосудов с сужением легочной артерии, обструкция опухолью выходного тракта одного из желудочков, аномалия Эбштейна, синдром гипоплазии правого и левого желудочков сердца, фиброэластоз, преждевременное закрытие овального окна.
Как пример можно разобрать изменения эхокардиографических показателей при клапанном стенозе легочной артерии. Нарушение гемодинамики при изолированном стенозе легочной артерии обусловлено препятствием на пути выброса крови в легочную артерию. Тяжесть стеноза определяется разницей систолического давления в правом желудочке и легочной артерии, т.е. градиентом давления.
При двухмерной эхокардиографии выявляется утолщение створок клапана легочной артерии, экскурсия их уменьшена, а в систолу они образуют купол. Это анатомические проявления порока. К ним добавляются гемодинамические проявления: выраженная гипертрофия миокарда передней стенки правого желудочка и межжелудочковой перегородки, значительно превышающие нормативы. Степень выраженности гипертрофии миокарда правого желудочка зависит от степени стенозирования легочной артерии и соответственно от величины градиента давления. Эти данные получены при сопоставлении результатов ультразвукового сканирования и данных катетеризации полостей сердца у детей [6]. Следует особо отметить, что при выраженной гипертрофии миокарда полость правого желудочка увеличивается незначительно. Отмечается также увеличение размера правого предсердия.
У плода получены аналогичные изменения, зависящие также от степени стенозирования легочной артерии. Полость правого желудочка, как видно на рис. 12, не увеличена. В то же время имеется значительная гипертрофия стенок правого желудочка. Как и в постнатальном периоде отмечено увеличение полости правого предсердия (рис. 13). После рождения при катетеризации полостей сердца в данном наблюдении был выявлен градиент давления на выходе из правого желудочка, равный 200 мм рт.ст.
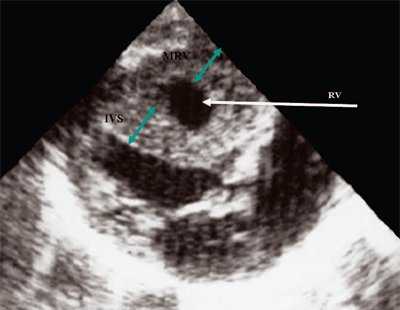
Рис. 12. Стеноз легочной артерии. Гипертрофия миокарда правого желудочка.
Возможности эхографии для диагностики дефектов позвоночника плода
Spina bifida - дефект развития нервной трубки, представляющий собой расщепление спинномозгового канала (спинальный дизрафизм), часто с формированием грыж спинного мозга.
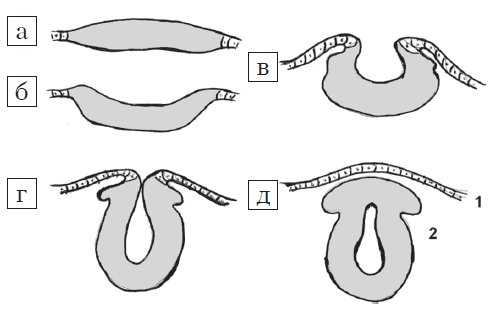
Рис. 1. Стадии эмбриогенеза нервной трубки: поперечный схематических разрез.
а) Медуллярная пластинка.
б, в) Медуллярная бороздк.
г, д) Нервная трубка: 1 - роговой листок (эпидермис); 2 - нейральные гребни.
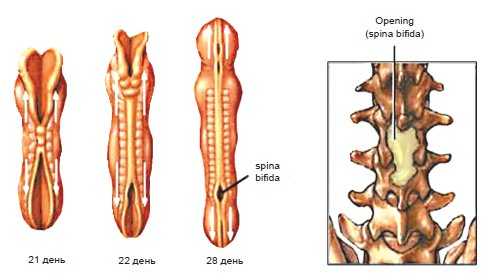
Рис. 2. Формирование дефекта нервной трубки.
Типичным для всех видов и форм спинальных дизрафий является их заднее расположение с дефектом заднего полукольца позвоночного канала. Крайне редко (менее 1% случаев) незаращение формируется на переднебоковой поверхности канала, и возникают передние спинномозговые грыжи.
Передняя и задняя расщелины позвонка могут проходить по срединной линии, а также располагаться асимметрично. В ряде случаев щель располагается косо. Если расщепление позвонков происходит по срединной линии, то деформация позвоночника может быть незначительной или вовсе не выражена. Однако при асимметричном и косом расположении щели в сочетании с другими аномалиями развития позвонков (например, односторонней микроспондилией половины позвонка, аномалией суставных отростков) развивается выраженная деформация позвоночника.
Наиболее часто (до 70% случаев) spina bifida локализуется в пояснично-крестцовой области, в 21% - в грудном отделе и в 9% - прочей локализации [1].
- Spina bifida occulta. Этот вариант еще называют "скрытым", так как видимого наружного дефекта нет. Скрытые незаращения позвоночника обычно локализуются в пояснично-крестцовой области и, как правило, клинически ничем не проявляются. Часто они являются случайной "находкой" при рентгенологическом исследовании позвоночника или МРТ. Анатомическая сущность скрытой расщелины позвоночника состоит в неполном заращении дужки позвонка. Это наиболее благоприятный вариант spina bifida. Иногда в области дефекта имеются "маркеры" или кожные стигмы в виде липом, кистозных и/или солидных масс, участков аномального оволосения, гиперпигментации. При закрытых дефектах также встречаются аномалии позвонков, деформации стоп и аномально низкорасположенный конус. Закрытый вариант spina bifida не сопровождается синдромом Арнольда Киари II, вентрикуломегалией и другими интракраниальными изменениями [2].
- Meningocele. Менингоцеле представляет собой расщепление позвоночника с выпячиванием в дефект твердой мозговой оболочки, но без вовлечения в процесс нервных структур (рис. 3). Содержимое грыжевого мешка - мозговые оболочки и ликвор, форма его - обычно стебельчатая с суженной ножкой. Костный дефект захватывает обычно два-три позвонка. Клинические проявления заболевания вариабельны и колеблются от бессимптомного течения до нарушения функции тазовых органов, двигательных и чувствительных расстройств. Данный вариант spina bifida встречается редко.
- Myelomeningocele. Это наиболее тяжелая форма spina bifida, с вовлечением в грыжевой мешок оболочек, спинного мозга и его корешков. Костный дефект обычно широкий и протяженный, захватывает от 3 до 6-8 позвонков. Степень неврологического дефекта всегда тяжелая параплегия нижних конечностей, чувствительные расстройства, нейрогенный мочевой пузырь и парез кишечника. Именно эта форма спинномозговых грыж встречается наиболее часто - около 75% всех форм 5. Почти во всех случаях миеломенингоцеле сочетается с синдромом Арнольда - Киари II. Таким образом, обнаружение признаков аномалии Арнольда - Киари II у плода является маркером наличия spina bifida. Кроме того, в 70-80% случаев у плода развивается гидроцефалия [5, 6].
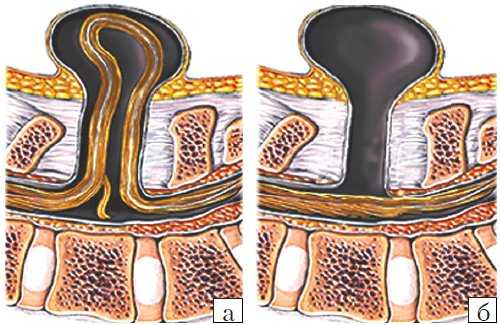
Рис. 3. Схема дефектов позвоночника плода.
а) Meningomyelocele.
б) Meningocele.
Представляем клинические наблюдения, демонстрирующие возможности эхографии в диагностике дефектов позвоночника плода.
Клиническое наблюдение 1
Пациентка К., 26 лет, обратилась в клинику в 23 нед беременности. Беременность первая. Исследование проводилось на аппарате Accuvix-XQ (Samsung Medison) с использованием режима поверхностной объемной реконструкции 3D/4D. Показатели фетометрии полностью соответствовали сроку беременности. В процессе сканирования позвоночника во фронтальной и сагиттальной плоскостях выявлена угловая деформация позвоночника в грудном отделе, протяженностью около трех позвонков. В поперечной плоскости сканирования нарушения структур и целостности тканей не было обнаружено. В режиме 3D/4D реконструкции было выявлено асимметричное расхождение ребер правой и левой стороны грудной клетки (рис. 4).
Рис. 4. Эхографическая картина асимметрии ребер в режиме 3D реконструкции.
Ребра левой стороны были сближены, межреберные промежутки уменьшены по сравнению с противоположной стороной (рис. 5, 6). Другой патологии у плода не было выявлено. Заподозрен врожденный сколиоз, основой которого является наличие боковых полупозвонков (hemivertebrae) или боковых клиновидных позвонков. В 26 нед ультразвуковая картина сохранялась. При проведении трехмерной эхографии получено отчетливое изображение асимметрии реберных дуг и сколиотическая деформация позвоночника.
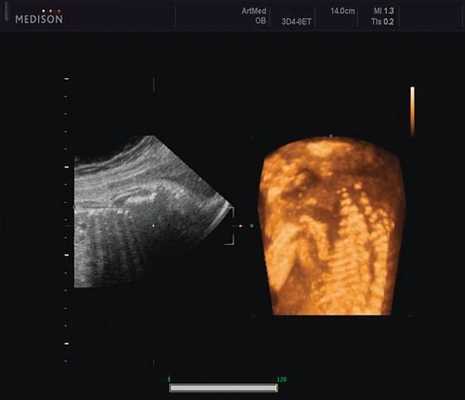
Рис. 5. Асимметрия межреберных промежутков в режиме 3D реконструкции.
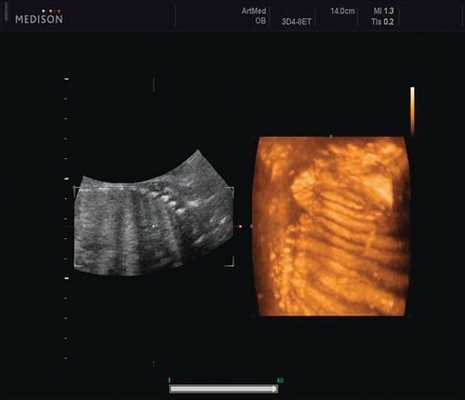
Рис. 6. Асимметрия межреберных промежутков в режиме 3D реконструкции.
В 30 нед фетометрические показатели плода соответствовали сроку беременности. Сколиотическая деформация позвоночника сохранялась. Дополнительно выявлена оболочечная грыжа, исходящая из грудного отдела позвоночника, в области деформированных позвонков. Грыжа представляла собой стебельчатой формы образование с суженной ножкой (рис. 7, 8). Концевая часть ее была расширена в виде петли и заполнена анэхогенным содержимым (ликвором), которое отчетливо дифференцировалось на фоне "мутных" околоплодных вод (рис. 9). Таким образом, диагноз был уточнен: spina bifida - менингоцеле.
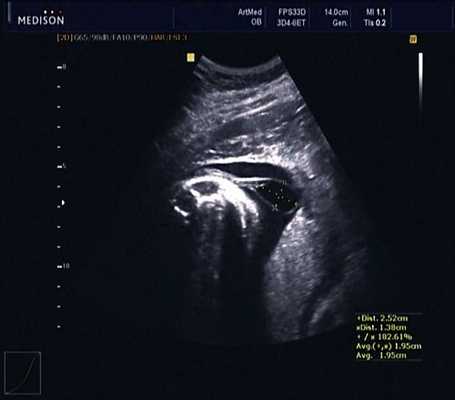
Рис. 7. Беременность 30 нед. Стебельчатая форма менингоцеле.
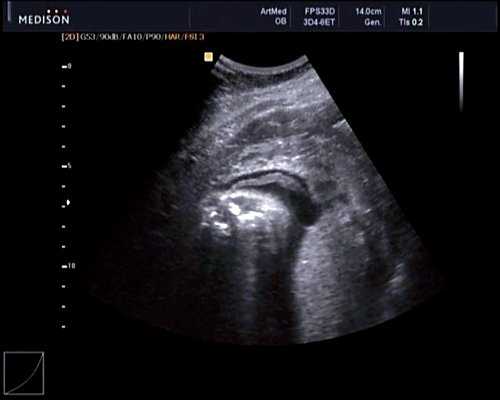
Рис. 8. Место выхода мозговой оболочки.
Рис. 9. Беременность 30 нед. Эхогенность ликвора ниже эхогенности околоплодных вод.
Дальнейшее наблюдение не выявило значительной динамики обнаруженных изменений.
После рождения диагноз spina bifida - менингоцеле подтвержден. Ребенок успешно оперирован, у него отсутствуют какие-либо неврологические расстройства.
В данном случае, локальная угловая деформация позвоночника в грудном отделе и асимметрия ребер явились начальными ультразвуковыми признаками открытой формы spina bifida - менингоцеле во II триместре беременности. Манифестация грыжи возникла только в III триместре.
Клиническое наблюдение 2
Беременная М., 21 года. Впервые обратилась в клинику в срок 20 нед беременности. Исследование проводилось на аппарате SonoAce-R7 (Samsung Medison) с использованием режима поверхностной объемной реконструкции 3D/4D. При изучении позвоночника плода в трех плоскостях костных деформаций не выявлено. В грудном отделе позвоночника обнаружено тонкостенное кистозное образование с анэхогенным содержимым, стебельчатой формы (рис. 10-12). Степень "прозрачности" содержимого была выше околоплодных вод, что позволяло идентифицировать его как ликвор. В проекции грыжевого выпячивания располагалась петля пуповины, дифференциальную диагностику которой без труда удалось провести с помощью ЦДК (рис. 13).
Рис. 10. Беременность 20 нед. Менингоцеле: типичное кистозное образование стебельчатой формы.
Рис. 11. Беременность 20 нед. Менингоцеле.
Рис. 12. Менингоцеле. В сагиттальном срезе видна неровность кожи в проекции расщелины.
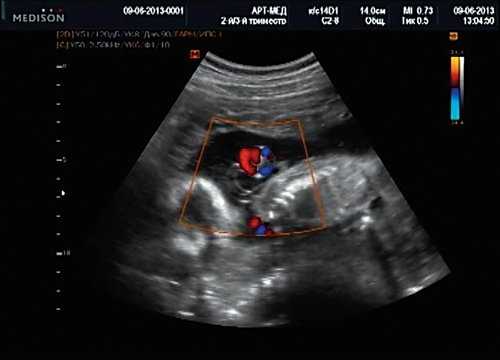
Рис. 13. Петля пуповины в режиме ЦДК.
У плода наблюдалась выраженная гидроцефалия, обусловленная синдромом Аронольда - Киари II (рис. 14, 15).
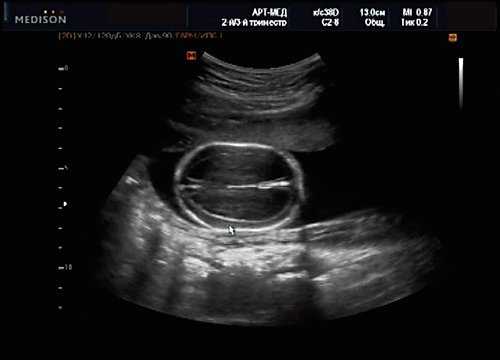
Рис. 14. Беременность 20 нед. Гидроцефалия.
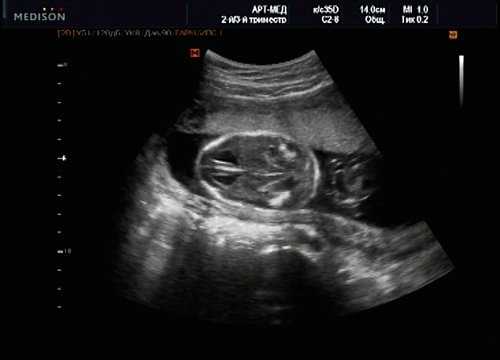
Рис. 15. Беременность 20 нед. Удлинение ножек мозга и вклинение мозжечка в затылочное отверстие при синдроме Арнольда - Киари II.
Учитывая типичную форму грыжевого выпячивания и отсутствие элементов нервной ткани, было высказано предположение о наличии у плода менингоцеле (рис. 16). Женщина приняла решение о прерывании беременности.
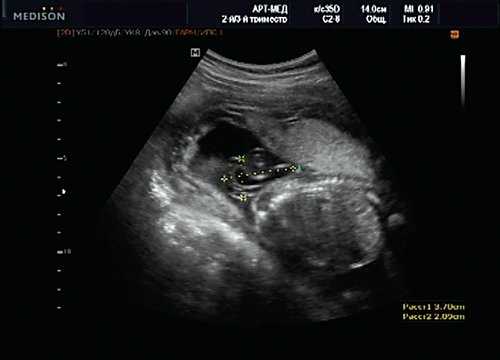
Рис. 16. Беременность 20 нед. Менингоцеле размером 37х21 мм.
Клиническое наблюдение 3
Беременная 27 лет, обратилась в клинику в 18 нед. При эхографии обнаружен синдром Арнольда - Киари II, умеренно выраженная гидроцефалия (рис. 17).
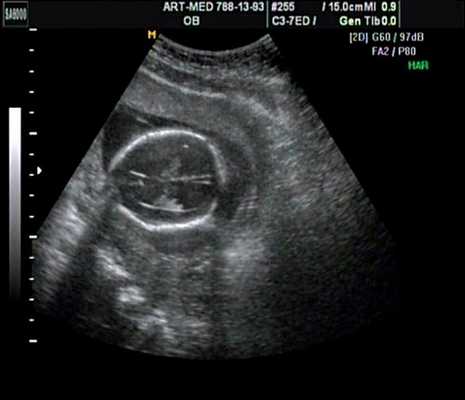
Рис. 17. Беременность 18 нед. Гидроцефалия.
В крестцовом отделе позвоночника выявлена spina bifida cysticа (рис. 18).
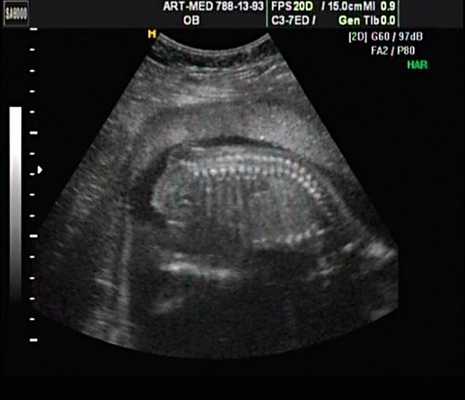
Рис. 18. Беременность 18 нед. Spina bifida в крестцовом отделе.
Женщиной принято решение о прерывании беременности.
Клиническое наблюдение 4
Беременная 25 лет, обратилась в клинику в срок 18 нед. При эхографии выявлена грубая кифотическая деформация позвоночника в поясничном отделе (рис. 19).
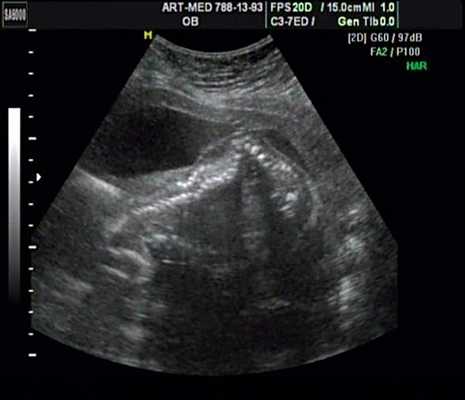
Рис. 19. Деформация позвоночника.
В проекции деформации определяется миеломенингоцеле (рис. 20).
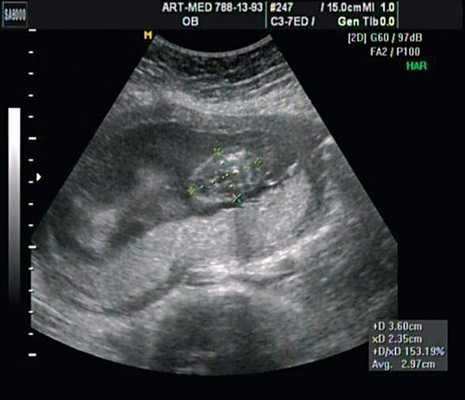
Рис. 20. Миеломенингоцеле.
Обнаружение типичных эхографических признаков позволило установить диагноз миеломенингоцеле.
Заключение
Диагностика открытых форм spina bifida не является трудной задачей во II триместре беременности. Обнаружение таких изменений, как синдром Арнольда - Киари II и дефект позвоночника с формированием грыжевого выпячивания не оставляют сомнений в диагнозе. Исключение составляют лишь те случаи, когда ультразвуковая манифестация порока представлена только деформацией позвоночника. В настоящее время наибольший интерес представляет выявление данного порока в I триместре беременности. Изучаются такие ультразвуковые критерии, как отсутствие интракраниальной "прозрачности" (intracranial translucency), сглаженность угла ствола мозга, уменьшение бипариетального размера ниже 5-го процентиля и т.д. Таким образом, диагностика spina bifida остается важной задачей пренатальной диагностики.
Литература
- Amari F., Junkers W., Djalali S., Hartge D.R. et al. Fetal spina bifida - prenatal course and outcome in 103 cases // J. Ultrasound in Obstetrics & Gynecology. 2009. N 34. P. 82.
- Pugash D., Irwin B., Lim K., Thiessen P., Poskitt K., Cochrane D. Prenatal diagnosis of closed spinal dysraphism // J Ultrasound in Obstetrics & Gynecology. 2006. N 28. P. 547.
- Tortori-Donati P., Rossi A., Cama A. Spinal dys-raphism: a review of neuroradiological features with embryological correlations and proposal for a new classification // Neuroradiology. 2000. N 42. P. 471-491.
- Van den Hof M.C., Nicolaides K.H., Campbell J., Campbell S. Evaluation of the lemon and banana signs in one hundred thirty fetuses with open spina bifida // Am J Obstet Gynecol. 1990. N 162. P. 322-327.
- Ghi T., Pilu G., Falco P., Segata M., Carletti A., Cocchi G., Santini D., Bonasoni P., Tani G., Rizzo N. Prenatal diagnosis of open and closed spina bifida.Ultrasound Obstet Gynecol. 2006. N. 28. P. 899-903.
- D'Addario V., Rossi A.C., Pinto V., Pintucci A., Di Cagno L. Comparison of six sonographic signs in the prenatal diagnosis of spina bifida // J Perinat Med. 2008. N 36. P. 330-334.
УЗИ сканер WS80
Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Читайте также:
- Объемная перегрузка левого желудочка. Фазы течения ДМЖП
- Аллергический гранулематоз Черджа-Стросс, симулирующий опухоль конъюнктивы: признаки, гистология, лечение, прогноз
- Эхокардиографическая характеристика тканей при ишемической болезни сердца
- Паралич при ботулизме у детей. Клещевой паралич
- Судорожные припадки у детей
