УЗИ при синдроме Карпентера у плода
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Ультразвуковое исследование в настоящее время является незаменимым методом исследования в диагностике неразвивающейся беременности, полного и неполного выкидыша, угрозы прерывания беременности, пузырного заноса, многоплодной беременности. Обнаружение ультразвуковых маркеров внутриутробного инфицирования имеет большое значение для дальнейшего прогноза состояния плода и последующей тактики ведения беременности. Ультразвуковой скрининг на протяжении всей беременности является обязательным методом обследования, который необходимо проводить всем беременным для диагностики и уточнения соответствия размеров плода сроку гестации, неразвивающейся беременности, угрозы прерывания беременности, выяснения локализации плаценты, наличия участков ее отслойки, предлежания, выраженности деструктивных изменений в плаценте, наличия компенсаторно-приспособительных процессов, для ранней диагностики отклонений внутриутробного развития плода, в том числе задержки или аномалий его развития, мало- или многоводия.
1. Воронцова Н.А., Гажонова В.Е., Чернышенко Т.А. Клиническая значимость соноэластографии в ранней диагностике внематочной беременности // Кремлевксая медицина. Клинический вестник. - 2013. - № 1. - С. 106-111.
2. Серов В.Н., Дубницкая Л.В., Тютюнник В.Л. Воспалительные заболевания органов малого таза: диагностические критерии и принципы лечения // РМЖ. - 2011. - Т. 19, № 1. - С. 46-50.
3. Макухина Т.Б. Отдаленные исходы осложненных форм воспалительных заболеваний органов малого таза у женщин, пролеченных малоинвазивными технологиями под ультразвуковым контролем // Проблемы репродукции. - 2008. - Спец. вып- С. 296-297.
4. Мартынова Н.В., Нуднов Н.В., Головина И.А. Определение диагностической эффективности современных методов визуализации // Медицинская визуализация. - 2005. - № 1. - С. 140-144.
5. Eckert, L. O. Infections of the Lower and Upper Genital Tracts (Vulva, Vagina,Cervix, Toxic Shock Syndrome, Endometritis, and Salpingitis) // Comprehensive Gynecology, 6th ed. Elsevier Inc. - 2013. - P. 519-553.
6. Taylor B.D., Darville T., Haggerty C.L. Does bacterial vaginosis cause pelvic inflammatory disease? // Sex. Transm. Dis. - 2013. - Vol. 40, № 2. - P. 117-122.
В последние годы плацентарная недостаточность (ПН) занимает одно из ведущих мест в общей структуре перинатальной смертности и заболеваемости и остается важнейшей проблемой современного акушерства [1, 2]. В структуре акушерских осложнений частота встречаемости плацентарной недостаточности составляет 52,0 %. Внутриутробная инфекция (ВУИ) относится к тяжелым осложнениям беременности и зачастую обнаруживается вместе с плацентарной недостаточностью, существенно влияя на перинатальные исходы. Инфицирование плаценты и плода происходит в различные сроки беременности. В первом триместре беременности основными показателями УЗ обследования являются размеры плодного яйца и эмбриона, а также состояние и размеры желточного мешка и хориона. Большинство исследователей отмечают высокую диагностическую ценность данного метода обследования [3, 4, 5, 6].
Безусловно, определяя характерные признаки ВУИ, необходимо провести дифференциальную диагностику с пороками развития сердца, хромосомными заболеваниями, синдромами мальформаций, чтобы выявить группу инфекций, относящихся к TORCH (Т - токсоплазмоз, О - другие инфекционные агенты (корь, парвовирус В19, сифилис, ветряная оспа, вирус Коксаки, вирусы гепатита С, В, Е, Д, папилломавирус, листериоз, гонорея, боррелиоз, ВИЧ-инфекция, эпидемический паротит, микоплазма, грипп, малярия, инфекционный мононуклеоз, хламидии, стрептококки группы В), R - краснуха, C - цитомегаловирус, H - простой герпес). В связи с тем, что ультразвуковые маркеры в полной мере не могут исключить или подтвердить пренатальную инфекцию с точной достоверностью, обнаружение ультразвуковых критериев, типичных для ВУИ плода, имеет важное значение для выработки дальнейшей тактики ведения беременности.
Целью исследования явилось выявление ультразвуковых маркеров внутриутробного инфицирования плода у женщин с плацентарной недостаточностью.
Материалы и методы исследования
Для получения достоверной картины внутриутробного инфицирования у беременных мы провели исследования среди 169 женщин репродуктивного возраста, которые были разделены на 2 группы. Первую группу составили 123 женщины, обратившиеся за гинекологической помощью, т.е. имевшие на период проведения работу ту или иную гинекологическую заболеваемость. Вторую группу составили 46 женщин, которые в отмеченном периоде не имели текущей гинекологической заболеваемости. Возраст женщин колебался от 18 до 39 лет.
Критериями включения беременных в основную группу были следующие эхографические признаки ВУИ: изменение количества околоплодных вод, гиперэхогенный кишечник, синдром задержки развития плода, изменения кровотока у плода, инфекционная кардиопатия, гепатоспленомегалия, амниотические тяжи, кальцификаты или гиперэхогенные включения в паренхиматозных органах. Наличие этих маркеров, как единственных, так и в различных сочетаниях, явилось показанием проведения в дальнейшем динамической допплерометрии.
Состояние фетоплацентарного комплекса (ФПК) изучали с помощью инструментальных методов исследования, включающих комплексное ультразвуковое исследование (плацентографию, фетометрию, развитие внутренних органов плода и оценку количества околоплодных вод), допплерометрическое исследование кровотока в артериях пуповины (АП), маточных артериях (МА), венозном протоке плода (ВП) и средней мозговой артерии (СМА).
Диагноз плацентарной недостаточности устанавливали при выявлении двух и более из перечисленных ниже признаков:
- выявление по данным эхографии задержки внутриутробного роста плода;
- выявление по данным КТГ хронической внутриутробной гипоксии плода;
- выявление внутриутробной гибели плода на любом сроке беременности;
- выявление нарушения плодово-плацентарного кровотока по данным допплерографии;
- выявление маловодия по данным эхографии;
- выявление характерных изменений в структуре плаценты по данным УЗИ: обнаружение тромбозов, инфарктов и изменения в эхогенности базальной мембраны.
В ходе исследования использовались различные функции УЗИ: 2D-сканирование, 3D/4D сканирование плаценты, плода, пуповины, для оценки кровотоков в ФПК применялась спектральная допплерометрия. Статистический анализ данных осуществлялся с помощью программы электронного пакета Microsoft Excel 2007, которые были сформированы в соответствии с запросами настоящего исследования.
Результаты исследования и их обсуждение
В ходе проведенных исследований произведен анализ эхографических особенностей ФПК. Выявленные эхографические признаки, характеризующие внутриутробное инфицирование плода, представлены в табл. 1.
При проведении эхографического исследования у плодов основной группы определялись различные сочетания ультразвуковых признаков, характерных для ВУИ. При помощи УЗИ в I триместре беременности было установлено, что наиболее часто у беременных встречалось многоводие, которое в 1 группе беременных составило соответственно - 55,2 ± 4,5 % и во 2 группе беременных - 45,6 ± 7,3 %, значительно реже наблюдалось маловодие (соответственно - 17,0 ± 3,4 % и 10,9 ± 4,6 в группах; χ2 = 21,43, р < 0,01).
Эхографические признаки, характеризующие состояние ФПК в I триместре беременности
Синдром Карпентера ( Акроцефалополисиндактилия 2 типа )
Синдром Карпентера (акроцефалополисиндактилия 2-го типа) — это чрезвычайно редкое наследственное заболевание, обусловленное мутацией гена RAB23. Патология передается по аутосомно-рецессивному типу. Болезнь имеет характерную триаду симптомов: раннее заращение черепных швов (краниосиностоз) с врожденными дизморфиями лицевого скелета, множественные пороки развития конечностей, ожирение. Диагностика синдрома Карпентера включает рентгенографию или КТ скелета, эхокардиографию, молекулярно-генетическую диагностику для выявления специфической мутации. Основу лечения составляет хирургическая коррекция краниосиностоза, создающая условия для развития головного мозга.
МКБ-10
Общие сведения
Заболевание впервые описано английским педиатром Джорджем Альфредом Карпентером, в 1909 году заметившим характерный набор симптомов у 3-х детей из одной семьи. Генетические предпосылки появления патологии были установлены в 2000 г. Болезнь встречается крайне редко, в литературе описано всего 40 случаев, ввиду чего статистические показатели заболеваемости отсутствуют. Несмотря на редкость синдрома, он не теряет своей актуальности в современной генетике, поскольку требует раннего выявления, проведения комплекса хирургических мероприятий в младенческом возрасте.
Причины
Синдром возникает вследствие генного дефекта RAB23, кодирующего одноименный белок. Ген расположен на коротком плече 6 хромосомы, состоит из 237 аминокислотных остатков. Для развития заболевания необходимо, чтобы ребенок получил по одной копии мутантного гена от каждого родителя. При этом вероятность синдрома Карпентера составляет 25%, независимо от пола новорожденного.
Патогенез
По биохимической структуре RAB23 представляет собой гуанозинтрифосфатазу суперсемейства Ras. Основная функция протеина — участие во внутриклеточном транспорте белков, что необходимо в процессе закладки и дифференцировки тканей. Он располагается в клеточных мембранах, цитоплазме клеток, везикулах и эндосомах. Кроме того, RAB23 контролирует активность гена SHH, отвечающего за развитие клеток в периоде онтогенеза.
При дефиците протеина вследствие синдрома Карпентера в первую очередь страдают процессы дифференцировки костной ткани. В результате этого происходит раннее срастание черепных швов, что формирует замкнутое пространство головы без возможности его увеличения соответственно росту головного мозга. Также патология RAB23 вызывает нарушения сигнальных каскадов при формировании центральной нервной системы.
С учетом особенностей зарастания швов формируется 2 типа краниосиностоза — сагиттальный (длинный узкий череп с выступающим лбом и большим затылком) и бикорональный (широкий короткий череп с деформированными лбом и глазницами). Тип краниосиностоза оказывает наибольшее влияние на особенности формирования неврологических расстройств.
Симптомы
Костные аномалии при болезни Карпентера формируются во внутриутробном периоде, поэтому они определяются сразу после рождения. Родители обращают внимание на вытянутую башнеобразную форму головы (акроцефалию). Со временем череп деформируется из-за раннего закрытия швов (краниосиностоза), которые ограничивают рост костей и не позволяют голове увеличиваться в объеме. Также наблюдаются множественные врожденные аномалии лицевого скелета.
Краниосиностоз проявляется разнообразными симптомами. При бикорональной деформации черепа отмечаются патологии зрительного аппарата: косоглазие, слезотечение, экзофтальм (выпячивание глазных яблок). Характерна задержка психомоторного развития: ребенок поздно начинает держать голову, плохо сидит и стоит, с трудом учится ходить. Также большое значение имеет косметический дефект, вызывающий у пациента при отсутствии коррекции психологическую травму.
Еще один типичный признак синдрома Карпентера — аномалии развития пальцев рук и ног. Зачастую возникает кожная синдактилия — сращение мягких тканей соседних пальцев, также возможно отсутствие средних фаланг, деформация большого пальца. Некоторые больные имеют шестипалость, причем на руках чаще есть добавочный мизинец, а на ногах — любой палец с I по IV. По мере взросления пациента становится заметна короткопалость, отставание в росте.
Дизэмбриогенез внутренних органов, как правило, проявляется врожденными сердечными аномалиями, которые выявляются у трети больных. Постепенно у детей развивается ожирение, сначала легкой, а затем средней степени, с преимущественным распределением жира по лицу, телу, проксимальным частям конечностей. У мальчиков возможен крипторхизм. Интеллектуальный уровень примерно у 75% пациентов соответствует легкой умственной отсталости.
Осложнения
Наиболее серьезная проблема при краниосиностозе — внутричерепная гипертензия, которая проявляется срыгиваниями, повторной рвотой, беспокойством вследствие сильной головной боли. Возможно развитие судорог, менингеального синдрома, в тяжелых случаях наступает кома. Опасность представляют пороки сердца, чреватые критическими нарушениями кровообращения.
Диагностика
Обследованием пациента занимается неонатолог /педиатр, по показаниям к диагностике подключают челюстно-лицевого хирурга и нейрохирурга, генетика, детского кардиолога. Заподозрить синдром Карпентера удается по характерным фенотипическим особенностям, однако для подтверждения диагноза проводятся лабораторные и инструментальные исследования:
- КТ черепа. Для уточнения степени костных деформаций, состояния черепных швов применяется спиральная компьютерная томография, которая дает максимально детальное изображение всех структур, помогает в выборе тактики хирургического лечения.
- УЗИ сердца. Учитывая высокую вероятность кардиологических пороков, всем пациентам с подозрением на болезнь Карпентера показана эхокардиография. При выявлении аномалий дополнительно делают ЭКГ, МРТ сердца, катетеризацию сердца.
- Генетическое тестирование. Секвенирование генома с целью диагностики мутантного гена RAB23 — единственно возможный способ 100% подтвердить диагноз. После установления заболевания целесообразно провести генетическое исследование родителям, ближайшим кровным родственникам.
- Пренатальная диагностика. При отягощенной наследственности или обнаружении подозрительных признаков при УЗИ-скрининге выполняется биопсия хориона во 2-м триместре беременности. Полученный материал используется для молекулярно-генетического тестирования.
Лечение синдрома Карпентера
Консервативная терапия
Этиопатогенетическое лечение заболевания не разработано. Чтобы корректировать избыточный вес тела, больным рекомендуется соблюдение пожизненной диеты со сниженным калоражем. Для уменьшения выраженности возможных сопутствующих расстройств показаны:
- Специальные методы обучения. Детям с умственной отсталостью необходимо обучаться по специальным программам, составленным олигофренопедагогами. Также важную роль играет выработка навыков бытового самообслуживания.
- Коррекция эмоциональных расстройств. При наличии признаков невротических или депрессивных нарушений используются методы психотерапии, подбираются успокоительные фитопрепараты, мягкие антидепрессанты.
- Офтальмологическая помощь. При снижении остроты зрения, косоглазии, слезотечении и других нарушениях зрения, типичных для бикоронального кранисиностоза, больному может потребоваться соответствующая коррекция.
Хирургическое лечение
При синдроме Карпентера основной задачей становится коррекция краниосиностоза, выполняемая только хирургически. Оптимальный возраст для проведения операции — 3-9 месяцев. Раннее устранение деформации черепа создает благоприятные условия для физического и интеллектуального развития пациента. Нейрохирурги делают эндоскопическую или открытую краниопластику, используют биодеградируемые и артифицированные титановые имплантаты.
Больным с синдактилией рекомендована операция по разделению пальцев. При терминальном типе сращения хирургическое вмешательство показано во втором полугодии жизни младенца, в остальных случаях операция проводится в возрасте 4-5 лет. При шестипалости применяется метод ампутации добавочного пальца. В случае врожденных сердечных пороков требуется консультация кардиохирургов для индивидуального подбора способа устранения дефектов.
Прогноз и профилактика
При своевременном выявлении синдрома Карпентера и проведении хирургической коррекции краниосиностоза удается полностью нивелировать признаки заболевания. Прогноз благоприятный при условии отсутствия умственной отсталости и тяжелых пороков сердца. Профилактика патологии предполагает медико-генетическое консультирование родителей, у которых уже есть больной ребенок или отягощен семейный анамнез.
1. Краниосиностоз. Опыт лечения на базе одной клиники/ А.А. Жайлганов// Нейрохирургия и неврология Казахстана. — 2020. — №1.
2. Сочетание синдрома Карпентера с эпилепсией. Клинический случай/ С.С. Стецура// VI Балтийский конгресс по детской неврологии. — 2016.
3. Carpenter syndrome/ Hidestrand, Pip, Henry Vasconez, and Carol Cottrill// Journal of Craniofacial Surgery. — 2009. — №1.
Аномалии и патологии органов пищеварительной системы плода, выявляемые на УЗИ
Патологии органов пищеварительной системы встречаются у плода нередко как самостоятельно, так и в комплексе с другими аномалиями внутренних органов. На них приходится до 21% пороков у новорождённых и 34% случаев младенческой смертности.

Причины нарушений формирования органов ЖКТ у плода, статистика
Аномалии строения органов ЖКТ связаны с нарушением эмбриогенеза на стадии 4-8 недель беременности, когда идёт образование отверстия пищеварительной трубки. Изначально она заканчивается с обоих концов, однако к концу 8 недели происходит образование каналов, а слизистый эпителий закрывает просвет кишечной трубки.
Среди наиболее часто встречающихся патологий можно выделить стенозы (сужения или растяжки стенок) или атрезии (сращивания).
Больше всего страдает 12-перстная кишка, что связано с особенностями её эмбриогенеза. 1/2 случаев сопровождается пороками других внутренних органов — сердца, сосудов, прямой кишки, печени, желудка. Некоторые случаи настолько тяжёлые, что малышу при жизни придётся сделать множество операций, и они не будут являться гарантом его нормального существования.
Аномалии органов ЖКТ на УЗИ видны на сроке 11 недель. Ультразвуковая диагностика не является 100% гарантией того, что у малыша будут серьёзные отклонения, поэтому её результаты являются основанием для более детального обследования женщины.
Беременной делают кариотипирование на выявление хромосомных нарушений. Также она проходит анализ амниотической жидкости, и по результатам обследования (если они плохие и диагноз подтвердится) ей рекомендуют прервать беременность
Патологии кишечника
К аномалиям 12-перстной кишки относятся:
Атрезия. Встречается в 1 случае из 10 000. Заключается в полной непроходимости кишечника вследствие патологического сращения стенок органа. В 37% случаев сопровождается другими аномалиями — конской стопой, слиянием шейных позвонков, несимметричным положением рёбер и пр.
Ещё в 2% случаев атрезия кишечника сопровождается атрезией пищевода, гигромой заднего прохода, незавершённом поворотом желудка и т.п. В основном это типично для плода с хромосомными нарушениями, в частности с трисомией по 21 хромосоме.
90% беременностей заканчиваются выкидышем или замиранием развития в течение первых 2-х триместров. Остальные 10% беременностей с патологией 12-перстной кишки завершаются рождением детей, страдающих различными пороками: у 31% имеется обструкция дыхательных путей (закупорка инородным телом вроде кисты, опухоли), 24% — парез лицевого нерва (нарушением функциональности мимических мышц).
Только 1% малышей ведёт относительно нормальный образ жизни после проведения сложнейшей операции при условии отсутствия хромосомных нарушений.
Внутрикишечная мембрана . Это плёнка, перекрывающая просвет кишечника, появившаяся в результате нарушения разрастания внутреннего слоя 12-перстной кишки. Встречается в 1 случае из 40 000. На УЗИ визуализируется как слабоэхогенное образование. Просвет кишечника при этом сужен на несколько миллиметров, контуры слизистой оболочки чёткие.
Патология не является показанием для прерывания беременности. В зависимости от расположения мембраны она удаляется после рождения малыша методом дуоденотомии (вскрытием просвета кишечника с последующим удалением мембраны).
Мальротация. Заключается в нарушении нормального вращения и фиксации 12-перстной кишки. Если средняя кишка совершила полный оборот на кровоснобжающей ножке, это может привести к прекращению кровоснабжения и отмиранию средней кишки.
Пренатальный диагноз можно поставить с 24 недели, причём в 61,5% беременностей наблюдалось многоводие. На УЗИ выявляется анэхогенный double-buble 3 следствие расширение кишки и желудка.
Хотя даже незначительное расширение на сроке 16-22 недели должно вызывать тревогу. В норме 12-перстная кишка видна на УЗИ только с 24 недели. Дополнительно в 62% случаев выявляются у плода пороки развития сердца, мочеполовой системы, других органов ЖКТ. После исследования на кариотип в 67% случаев выявляются хромосомные отклонения, из которых на 1 месте стоит синдром Дауна.
Стеноз. Выявляется у 30% новорождённых, в основном у мальчиков. Это частичная непроходимость 12-перстного кишечника, локализованная в одном месте. В основном наблюдается в верхних отделах и сопровождается аномалиями поджелудочной железы. На УЗИ отчётливо виден на сроке от 24 недель при использовании допплеровского метода в изучении кровотока кишечника.
Стеноз успешно устраняется и имеет более благоприятные перспективы, чем атрезия. Не требует прерывания беременности.
Megaduodenum . Это увеличение размеров 12-перстной кишки до размеров, иногда превышающих размеры желудка. Встречается в 1 случае из 7500. Может являться следствием кольцевидной поджелудочной железы, когда головка органа кольцом окручивает кишечник, либо атрезии или стеноза 12-перстной кишки. На УЗИ диагностируется на 24 неделе. Верхняя часть брюшной полости вздута очень сильно, в то время как нижняя часть впалая.
Гиперэхогенность кишечника. Чем выше плотность исследуемой ткани, тем больше будет эхогенность. На УЗИ эхогенность кишечника плода должна быть ниже эхогенности костей, но выше, чем у таких пористых органов, как печень, лёгкие или почки. Когда эхогенность кишечника равна по плотности эхогенности костной ткани, говорят о гиперэхогенности.
Патология выявляется не ранее чем на 16 неделе. Она свидетельствует об отклонении в развитии плода. Повышенная эхогенность случается при преждевременном старении плаценты, внутренних инфекциях, несоответствии размеров плода сроку беременности, эндокринном заболевании муковисцидозе, кишечной непроходимости (стенозе).
УЗИ следует пройти в нескольких разных клиниках во избежание ошибки специалиста. Только при окончательном подтверждении диагноза женщину отправляют на более детальное обследование — биохимический скрининг, анализ на ТОРЧ-инфекции, кордоцентез и анализ амниотической жидкости. Окончательный диагноз ставится на основе комплексного анализа, а не только УЗИ обследования.
Дивертикулы (кисты). Они имеют разные названия — дупликационные кисты, удвоенная кишка, энтерогенная дивертикула. Заключается в отпочковании от стенок кишки образования в эмбриональный период. Образуются не только в кишечнике, но и по всему ЖКТ от гортани до ануса.
Считается, что причиной раздвоения стенок служит нарушение кровоснабжения пищеварительной трубки плода. Кисты на УЗИ гипоэхогенны, бывают как однокамерными, так и многокамерными. Стенки кист двухслойны и имеют повышенную перистальтику, имеют гиперэхогенность, если содержат кровь.
Визуализируются кисты кишечника на 2 триместре и часто сочетаются с другими патологиями. Точность визуализации кист кишечника у плода составляет 66,6%. Данная патология не является показанием к прерыванию беременности, потому что в неосложнённых случаях оперируется и устраняется.
Аномалия формы, размера, положения и подвижности кишечника. Ко 2 триместру беременности должен обратиться вокруг брыжеечной артерии против часовой стрелки на 2700. При нарушении эмбриогенеза можно выделить следующие патологии: отсутствие поворота, несостоявшийся поворот и неполный поворот.
На УЗИ при аномалиях поворота кишечника у плода отмечается многоводие и расширение петель кишечника без перистальтики. В случае перфорации кишечника возникает микониевый перитонит — заражение вследствие выхода наружу содержимого кишечника. Обнаруживается патология поздно, только на 3 триместре, что требует немедленной подготовки женщины к родоразрешению.
Патологии печени у плода
Печень визуализируется на ультразвуковом обследовании уже на 1-м скрининге. На сроке 11-14 недель можно увидеть в верхней части брюшной полости гипоэхогенное образование в виде месяца. К 25 неделе эхогенность повышается и становится такой же, как у кишечника, а перед родами превышает по плотности кишечник.
Очень важна оценка состояния кровотока печени. Вена пуповины плода входит в печень, во 2 триместре визуализируется воротная вена. Её диаметр в норме равен 2-3 мм, а к родам увеличивается до 10-11 мм. Желчные протоки в норме визуализироваться у плода не должны.
Одна из часто встречающихся патологий плода — гепатомегалия печени — увеличение размеров органа. Для выявления аномалии применяется 3D датчик, способный визуализировать срез в продольном, поперечном и вертикальном срезах. Также можно увидеть увеличение размеров печени и на обычном УЗИ аппарате по выступающему животику, охват которого значительно превышает норму.
Одновременно с этим на экране видны различные гиперэхогенные включения. Как правило, аномалия дополняется увеличением селезёнки.
Среди причин, приводящих к увеличению размеров органов пищеварения, выделяют скрытые инфекции (токсоплазмоз, сифилис, ветрянка), а также хромосомные мутации (синдромы Дауна, Зельвегера, Беквета-Видемана).
- При синдроме Зельвегера видны аномалии конечностей, искажение грудной клетки, кисты почек. Анализ амниотических вод выявляет нехватку дигидрокси-ацетон-фосфат-ацил-трансферазы.
- Ветряная оспа, герпес, цитомегаловирус вызывают кальцинирование тромбов печёночной вены, что отражается на экране УЗИ монитора гиперэхогенными кальцинатами круглой формы. Также они образуются при мекониевом перитоните — отравлении содержимым кишечника плода, которое попадает в результате повреждения стенок.
В 87,5% случаев причиной увеличения печени и образования кальцификатов являются внутриутробные инфекции. Также у большинства беременных диагностируется гиперэхогенный кишечник, изменение структуры плаценты, а также большие размеры селезёнки. Патология на 3 триместре возникает в случае резус-конфликта между матерью и ребёнком.
Также не исключены и метаболические нарушения. Увеличение печени встречается при галактоземии (генетическое нарушением углеводного обмена, из-за которого галактоза не преобразуется в глюкозу), трипсинемии (отсутствия выработки пищеварительного гормона трипсина), метилмалоновой ацидемии (отсутствии превращения D-метилмалоновой кислоты в янтарную кислоту), нарушениях выделения мочевины.
Одиночные гиперэхогенные включения большого размера гораздо лучше, чем множественные разрозненные образования в сочетании с другими патологиями. Практически в 100% случаев гиперэхогенные включения большого размера устраняются до рождения малыша или в первый год жизни.
В некоторых случаях порок органов брюшной полости ставится ошибочно. Такое бывает, если брюшная полость малыша сдавливается стенками матки, патологиях миометрия или других факторах.
На экране монитора видна псевдоомфалоцеле — ошибочная визуализация выхода органов брюшной полости за пределы брюшной стенки. Иногда УЗИ «не видит» значительных пороков. Так, грыжа по форме и эхоструктуре напоминает петли кишечника, в этом плане большую помощь оказывает допплерометрия, позволяющая увидеть кровоток.
Наша клиника имеет прекрасный 4D аппарат, оснащённый всеми современными возможностями, исключающими ошибки диагностики.
Желудок
На 16-20 неделе визуализируется желудок плода как анэхогенное образование круглой или овальной формы в верхних отделах брюшной полости. Если желудок не наполнен амниотическими водами, то можно говорить об атрезии пищевода (полном отсутствии просвета).
При диафрагмальной грыже желудок смещён и также не может быть определён на УЗИ. Также амниотическая жидкость отсутствует при поражении ЦНС у плода.
Если плод заглатывает вместе с жидкостью кровь, в желудке визуализируются гиперэхогенные включения. Они также видны при опухолях желудка, но они обычно сопровождаются другими пороками развития. Размеры органа увеличиваются при кишечной непроходимости, многоводии, утолщении стенок, отсутствии малой кривизны.
Уменьшение размеров желудка типично для микрогастрии, которая возникает на фоне отсутствия мочевого пузыря или неправильного положения печени. В 52% случаев плод погибает до 24-й недели беременности, ребёнок рождается нежизнеспособным.
Щелевидный желудок характерен для недоразвитии на ранних стадиях беременности. Данная патология исправляется после рождения малыша: ребёнку конструируют желудок из части тонкого кишечника. Операция крайне сложная, но аномалия не является показанием для выполнения аборта.
Атрезия желудка характеризуется отсутствием эхотени и предполагает образование плёнки с отверстием или без него, расположенной поперёк стенок желудка. Если это изолированная патология, то в 90% случаев она устраняется хирургически. Но обычно атрезия желудка сочетается со сращиванием пищевода, асцитом (излишним скоплением жидкости), недоразвитостью лёгких.
Агенезия желудка предполагает полное отсутствие органа. Это типично для тяжёлых хромосомных аномалий, от которых плод погибает в пренатальный период. Большое значение в диагностике имеет УЗИ на 22 неделе. некоторые отклонения исчезают сами собой, а некоторые требуют немедленного вмешательства.
Современные подходы к изучению плодового фенотипа в эру генетического ультразвука
Медико-генетическое отделение Московского областного НИИ акушерства и гинекологии, Москва.
Курс пренатальной диагностики, ФГБОУ ДПО РМАПО Минздрава России, Москва.
УЗИ сканер WS80
Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Настоящая работа посвящена изучению плодового фенотипа при ультразвуковом исследовании в различные сроки беременности при помощи новейших технологий Samsung, оптимизирующих диагностику многих врожденных пороков развития, аномалий, нарушений строения, особенностей развития с оценкой значимости отдельных ультразвуковых патологических маркеров в качестве потенциальных признаков генетических синдромов и ассоциаций.
Одной из ведущих причин детской и младенческой смертности являются врожденные пороки развития (ВПР), среди которых в 20% случаев встречаются множественные ВПР (МВПР) с установленной частотой 1:250 новорожденных [1]. Особое значение в профилактике МВПР имеет пренатальная диагностика - современный и высокоэффективный метод диспансеризации плода, направленный на своевременное выявление патологии, впоследствии определяющий выбор адекватной акушерской тактики при данной беременности и специфических мер профилактики болезни в данной семье в дальнейшем [2]. Современные ее возможности позволяют из комплекса патологических нарушений у плода выделить достоверно значимые ультразвуковые маркеры для постановки диагноза генетических синдромов различной этиологии. Сегодня пренатальная синдромология активно развивается, как в плане расширения спектра возможных лабораторных исследований, так и описания значимых, ключевых, таргетных ультразвуковых признаков многих наследственных синдромов различного происхождения.
Группа МВПР включает сотни нозологических форм, различных по этиологии, фенотипическим проявлениям и прогнозу. В силу огромной гетерогенности МВПР представляют собой сложную проблему для постановки окончательного диагноза. Основными этиологическими факторами, приводящими к возникновению синдромов с множественными пороками развития, являются генные, хромосомные мутации и действие на плод неблагоприятных факторов внешней среды [3, 4].
Любые наследственные или врожденные генетические болезни являются результатом повреждения генетической информации на геномном, хромосомном или генном уровне. В 60% всех случаев МВПР встречаются хромосомные синдромы, достаточно широко изученные и хорошо диагностируемые. Для лабораторной диагностики этих повреждений разработаны разнообразные и хорошо известные методы: цитогенетический, молекулярно-цитогенетический и молекулярно-генетический. МВПР нехромосомного генеза встречаются в 40% случаев. Среди них выделяют синдромы, ассоциации и неклассифицированные комплексы. Применительно к нехромосомным синдромам цитогенетическое исследование позволяет лишь отвергнуть хромосомную природу данного комплекса пороков развития, но не установить диагноз.
Сегодня имеется определенное количество публикаций о выявлении некоторых синдромов и ассоциаций при пренатальной эхографии [6, 7]. Однако дородовая идентификация нозологических форм нехромосомных синдромов пока не вошла в рутинную практику врачей в области пренатальной диагностики и носит случайный характер. В литературе отсутствуют четкие рекомендации о системном подходе к диагностике наследственных синдромов различной этиологии, нет диагностических алгоритмов и определенных схем взаимодействия врачей ультразвуковой пренатальной диагностики, генетиков, акушеров-гинекологов.
Использование эхографии делает возможным пренатальное выявление не менее 80% врожденных дефектов во II, III триместрах беременности и свыше 50% значимых нарушений анатомии плода уже в I триместре начиная со сроков 11-12 нед. Весь комплекс диагностированных пороков развития и различных микроаномалий в совокупности составляет фенотипический спектр синдрома, который состоит из «ядерных» (главных, ключевых) признаков и дополнительных аномалий, наличие которых не является обязательным для диагностики клинической нозологии синдрома.
Революцией в пренатальной ультразвуковой диагностике явилось появление объемной эхографии, которая, обладая такими качествами, как неинвазивность, безопасность и возможность многократного применения у одной пациентки, имеет высокую информативность в исследовании анатомии плода и изучении его фенотипа. При применении различных режимов объемной эхографии абсолютно очевидно их преимущество по сравнению с обычным сканированием. Детально можно изучить лицо плода (рис. 1-4) в различные сроки беременности, начиная со сроков первого пренатального скрининга в 11-14 нед, конечности плода, причем не только их наличие и положение (рис. 5, 6), но и состояние и количество пальцев (рис. 7-9) как на руках, так и на ногах. Также можно изучить позвонки плода (рис. 10), состояние твердого нёба (рис. 11, 12), строение наружного уха (ушной раковины) (рис. 13), состояние основных швов черепа и родничков, исключая их преждевременное закрытие при кранисиностозах (рис. 14, 15).
Новый эхографический признак для изучения нижней челюсти плода в норме и при патологии (микрогнатии) в I триместре беременности (11-14 недель)
Московский областной НИИ акушерства и гинекологии, Москва.
Кафедра медицинской генетики, курс пренатальной диагностики РМАПО, Москва.
Clinica lаs Condes, Santiago, Chili.
Важнейшим маркером генетических синдромов как хромосомного, так и нехромосомного генеза, является микрогнатия. Микрогнатия (нижняя микрогнатия, микрогения) - аномалия развития нижней челюсти, характеризующаяся ее гипоплазией. Диагностика этого состояния при трисомии 18 и триплоидии доходит до 80% [1, 2]. При введении в поисковую систему OMIM термина "micrognatia" можно встретить 447 различных синдромов и ассоциаций, в синдромальное ядро которых входит этот важный генетический маркер. Одна из самых крупных работ в мире по изучению этого маркера принадлежит D. Paladini и соавт. [3], которые описали более 50 случаев микрогнатии в сочетании как с хромосомными [4], так и нехромосомными синдромами и ассоциациями. Степени микрогнатии рассматривались от крайней - агнатии, входящей в состав аутосомно-рецессивного синдрома агнатии, голопрозэнцефалии (отоцефалии) [5, 6]. Отоцефалия - чрезвычайно редкая аномалия, при которой встречаются грубые лицевые дизморфии: недоразвитие или тяжелая гипоплазия нижней челюсти, неправильное положение ушей (рис. 1, 2), которые могут быть объединены и чаще всего располагаются на шее плода [7]. Также крайне выраженная степень микрогнатии может встречаться при окуло-ауриколофронтоназальном синдроме. Он был выделен в самостоятельную нозологическую группу, объединяющую симптомы как фронтоназальной дисплазии, так и синдрома Гольденхара [8, 9].
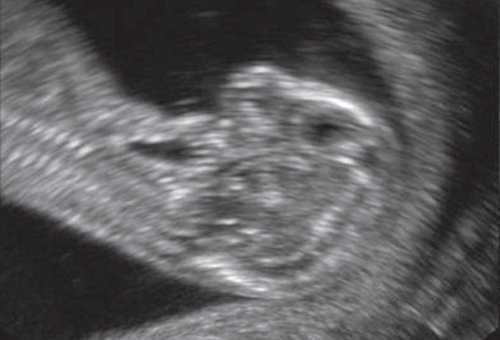
Рис. 1. Профиль плода с синдромом агнатии-голопрозэнцефалии в 12 нед беременности.
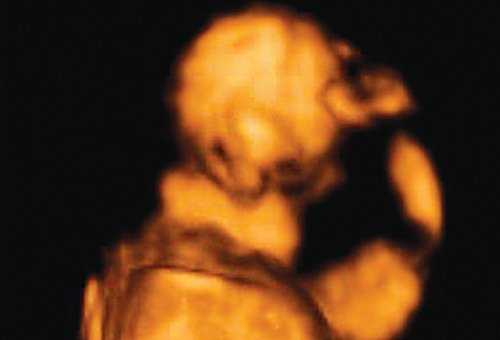
Рис. 2. Фенотип лица плода при синдроме агнатииголопрозэнцефалии в 12 нед беременности.
Гипоплазия нижней челюсти при различных нехромосомных синдромах обычно встречается в сочетании со скелетными дисплазиями и мышечно-скелетными аномалиями: синдром Пьера Робена (рис. 3), Тичера - Коллинза (Франческетти), акрофасциальный дизостоз, цереброкостомандибулярный синдром, ахондрогенез (рис. 4), ателостеогенез, кампомелическая дисплазия, диастрофическая дисплазия (рис. 5), синдром множественных птеригиумов, синдром Пены - Шокейра и др. Наличие микрогнатии характерно для синдрома Карпентера, синдрома Фринса, синдрома Меккеля - Грубера, гидролетального синдрома, синдрома Миллера - Дикера, синдрома Нунан, синдрома Секкеля, Рубинштейна - Тейби и др. Большинство из описанных синдромов имеют аутосомно-рецессивный либо аутосомно-доминантный тип наследования [10, 11].
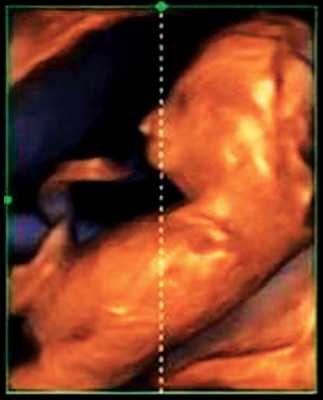
Рис. 3. Микрогнатия у плода при синдроме Пьера Робена в 13 нед беременности.
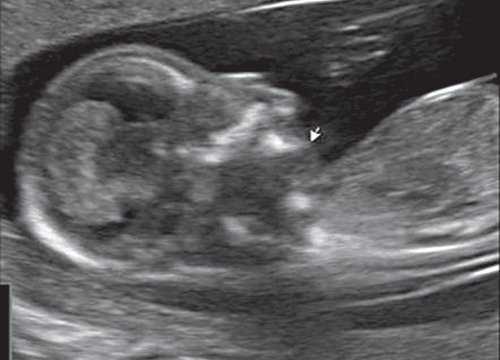
Рис. 4. Микрогнатия у плода с ахондрогенезом в 13 нед беременности.
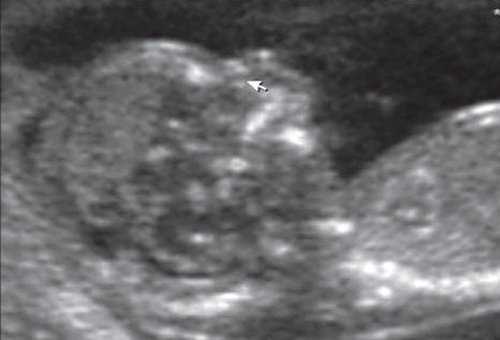
Рис. 5. Микрогнатия у плода с синромом диастрофической дисплазии в 12 нед беременности.
Пренатальная оценка положения и размера нижней челюсти может быть как субъективной, так и объективной. Так, на сегодняшний день известны оценки разных индексов измерения нижней челюсти [3, 6, 12], угла нижней челюсти [13, 14]. Эти измерения сопряжены со значительными погрешностями и в клинической практике применяются не часто, ввиду отсутствия стандартизации изучаемых срезов, трудоемкости и затратности обследования. Учитывая огромную значимость этого маркера, как для диагностики хромосомных, так и нехромосомных синдромов и ассоциаций, поиск новых объективных критериев микрогнатии продолжается 16.
Для качественной оценки особенностей строения нижней челюсти в I триместре беременности специалистами МГО МОНИИАГ совместно с профессором W. Sepulveda (Чили) был изучен и впервые описан новый ультразвуковой признак нижнечелюстной промежуток (mandibular "gap"), визуализируемый при первом скрининговом ("генетическом") ультразвуковом исследовании [18, 19].
Методика базируется на изучении коронарного скана лица плода, так называемого ретроназального треугольника, при котором визуализируется верхняя и нижняя челюсть. Техника получения этого скана чрезвычайно проста и может быть рекомендована для скринингового исследования в 11-14 нед беременности. Эта методика позволяет оценить нижнюю челюсть плода без применения трудоемких оценок, и не сопряжена с математически сложными расчетами коэффициентов, также она существенно не увеличивает время осмотра. Коронарный скан можно оценивать как в режиме 2D, так и в режиме объемной эховизуализации 3D. Методика оценки коронарного скана лица плода в I триместре беременности показана на рисунке 6.
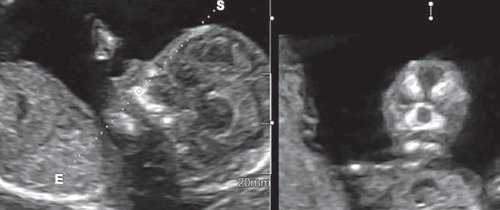
Рис. 6. Методика оценки коронарного скана лица плода в I триместре беременности.
Обе ветви нижней челюсти при сроке 11-14 нед беременности выглядят гиперэхогенными, а в месте слияния имеют характерный гипоэхогенный промежуток, ультразвуковой "разрыв". Этот признак визуализируется при нормальном развитии нижней челюсти (mandibular "gap").
Такие особенности ультразвуковой анатомии связаны с этапами эмбрионального развития костей нижней челюсти, ветви которой начинают развиваться из первой жаберной дуги с 7-й недели эмбрионального развития (рис. 7), и, постепенно приближаясь друг к другу к концу I триместра (на 14-й неделе беременности), образуют синостоз в области подбородка.
Размер этого промежутка уменьшается с увеличением срока беременности. Нижнечелюстной промежуток здорового плода представлен на рисунке 8.
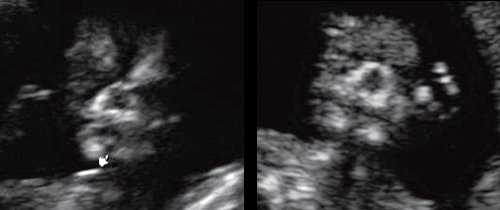
Рис. 8. Нижнечелюстной промежуток в 13 нед беременности при нормальном развитии нижней челюсти.
При патологии нижней челюсти (микрогнатии) в срок 11-14 нед беременности при изучении коронарного скана лица нижнечелюстной "промежуток" отсутствует, нижняя челюсть представлена единой, слившейся костной массой. Отсутствие нижнечелюстного "промежутка" (mandibular "gap") при эхографии в этот срок является маркером гипоплазии нижней челюсти (микрогнатии). Варианты отсутствия нижнечелюстного промежутка при микрогнатии при различных синдромах в срок 11-14 нед беременности представлены на рисунке 9.
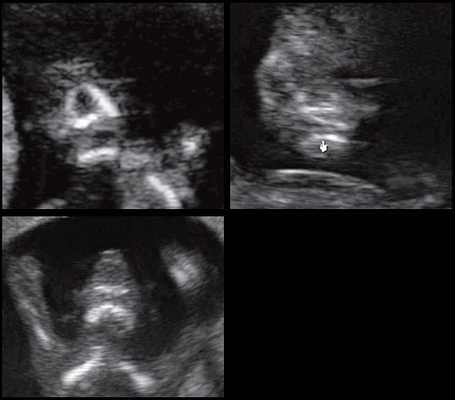
Рис. 9. Отсутствие нижнечелюстного промежутка при микрогнатии, при различных синдромах нехромосомного генеза в 11-14 нед беременности.
Оценка описанного признака при проведении пренатальной эхографии I триместра беременности не только проста в методологии и не требует больших затрат по времени исследования, но и высоко информативна, диагностически точна и специфична.
Литература
- Bianchi D.W., Crombleholme T.M., D'Alton M.E. Micrognathia. In Fetology: Diagnosis and Management of the Fetal Patient // McGraw-Hill: New York. 2000. P. 233-238.
- Nicolaides K.H., Salvesen D.R., Snijders R.J.M., Gosden C. Micrognathia fetal facial defects: Associated malformations and chromosomal abnormalities // Fetal Diagn Ther. 1993. V. 8. Р. 1-9.
- Paladini D., Morra T., Teodoro A., Lamberti A., Tremolaterra F., Martinelli P. Objective diagnosis of micrognathia in the fetus: the Jaw Index // Obstet Gynecol. 1999. V. 93. Р. 382-386.
- Dixon A.D., Hoyte D., Rоnning O. Prenatal development of the facial skeleton // In Fundamentals of Craniofacial Growth. CRC Press: Boca Raton. New York. 1997. Р. 59-97.
- Blaas H.G.K., Eriksson A.G., Salvesen K.A. et al. Brains and faces in holoprosencephaly: pre- and postnatal description of 30 cases // Ultrasound Obstet. Gynecol. 2002. V. 19. 1. P. 24-38.
- Paladini D. Fetal micrognathia: almost always anominous finding // Ultrasound Obstet. Gynecol. 2010. V. 35. P. 377-384.
- Cohen M.M.Jr. Perspectives on holoprosencephaly: Part I. Epidemiology, genetics, and syndromology // Teratology. 1989. V. 40. Р. 211-235.
- Carey J.C., Yong S.L. Frontonasal dysplasia and Goldenhar syndrome: the oculo-auriculo-frontonasal syndrome // Paper presented at the Conference on Malformations and Morphogenesis (March of Dimes). Dartmouth College, Hanover, NH, USA. 1981.
- Casey H.D., Braddock S.R., Haskins R.C., Carey J.C., Morales L. Frontonasal malformation and the oculoauriculovertebral spectrum: the oculoauriculofrontonasal syndrome // Cleft Palate Craniofac. J. 1996. V. 33. Р. 519-523.
- Ван Фехт Дж. Ультразвуковые маркеры хромосомных аномалий у плода // Ультразвуковая Диагностика. 1997. 3. С. 37-44.
- Turner G.M., Twining P. The facial profile in the diagnosis of fetal abnormalities // Clin Radiol. 1993. V. 47. Р. 389-395.
- Chitty L.S., Campbell S., Altman D.G. Measurements of the fetal mandible feasibility and construction of a centile chart // Prenat Diagn. 1993. V. 13. Р. 749-756.
- Otto C., Platt L.D. The fetal mandible measurement: an objective determination of fetal jaw size // Ultrasound Obstet Gynecol. 1991. V. 1. Р. 12-17.
- Rotten D., Levaillant J.M., Martinez H., Ducou H., Le Pointe D., Vicaut E. The fetal mandible: a 2D and 3D sonographic approach to the diagnosis of retrognathia and micrognathia // Ultrasound Obstet. Gynecol. 2002. V. 19. Р. 122-130.
- Bronshtein M., Blazer S., Zalel Y., Zimmer E.Z. Ultrasonographic diagnosis of glossoptosis in fetuses with Pierre Robin sequence in early and mid pregnancy // Am. J. Obstet. Gynecol. 2005. V. 193. Р. 1561-1564.
- Chitty L.S., Campbell S., Altman D.G. Measurements of the fetal mandible feasibility and construction of a centile chart // Prenat Diagn. 1993. V.13. Р. 749-756.
- Watson W. J., Katz V.L. Sonographic measurement of the fetal mandible: standards for normal pregnancy // Am J Perinatol. 1993. V. 10. Р. 226-228.
- Sepulveda W., Wong A., Andreeva E., Adzehova N. Absent mandibular gap at retronasal triangle view: a clue to the diagnosis of micrognathia in the first trimester // Ultrasound in obstetrics and gynecology. 2012. V. 39. P. 152-156.
- Sepulveda W., Wong A., Andreeva E. et al. A novel, simple technique for diagnosis of micrognathia in firsttrimester: identification of the receding chin on the retronasal triangle (RNT) view. Oral poster abstracts. 21 World Congress on Obstetrics and Gynecology. LosAngeles // Ultrasound in Obstetrics and Gynecology. 2011. V. 38. P. 64.

УЗИ аппарат HM70A
Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Читайте также:
