Влияние химиотерапии на плод беременной
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
Химиотерапия и беременность
Химиотерапия и беременность
Онкологические заболевания с каждым годом имеют все большую тенденцию к распространению среди молодого поколения. Поэтому химиотерапия и беременность ─ это актуальный вопрос для медицины.
При удовлетворительном самочувствии женщины во время лечения рака и в промежутках между курсами химической терапии интимные отношения с партнером вполне допустимы. Поэтому многих интересуют вопросы, нужно ли прибегать к методам контрацепции в этот период и возможно ли в принципе зачатие во время проведения химиотерапии? Чтобы ответить на эти вопросы, рассмотрим как цитостатики (основные препараты для борьбы с онкологическими заболеваниями) влияют на репродуктивную систему женщины.
Можно ли забеременеть во время химиотерапии?
В зависимости от своего состава, химические препараты наносят разной степени урон яичникам. Некоторые практически не влияют на их функционирование, другие - вызывают серьезные изменения в тканях, которые носят обратимый или необратимый характер. Самым токсичным препаратом для женского здоровья является “Циклофосфамид”.
Степень поражения от одного и того же препарата разная и зависит от:
- возраста женщины;
- класса лекарственного препарата;
- длительности применения.
Изменения в яичниках после проведения “химии” бывают функциональные и структурные:
- снижение количества фолликулов, вплоть до их исчезновения и фиброза (замещение соединительной тканью с образование рубцов);
- повреждение созревающих фолликулов;
- разрушение самой структуры яичников ─ ооцитов (незрелая яйцеклетка) и гранулезных клеток;
- возникновение преждевременной яичниковой недостаточности (ПЯН).
Одним из главных побочных эффектов химиотерапии у женщин является аменорея (отсутствие менструального цикла).
У молодых девушек менее выражены нарушения функции яичников, и наблюдаются временные дисфункциональные изменения в виде нарушения регулярности цикла. У взрослых женщин развивается менопауза. Это связано с тем, что их количество ооцитов значительно меньше.
Влияние цитостатиков на биологическую способность женщины к зачатию (фертильность) во время лечения до конца не изучено и непредсказуемо. Но одно наука знает точно:
Важно!
Беременеть во время химиотерапии категорически НЕЛЬЗЯ по двум причинам. Во-первых, химические препараты оказывают токсическое воздействие на плод, приводя к его аномальному развитию или гибели. Во-вторых, во время беременности в организме женщины происходит существенная гормональная перестройка. Всплеск гормонов может вызвать стремительный рост опухоли и спровоцировать ее метастазирование.
Поэтому у пациенток онкологического отделения в историях болезни в обязательном порядке предусмотрена графа «Методы контрацепции», способы и пути которой подбираются врачом каждой женщине индивидуально.
Возможна ли беременность после химиотерапии?
Риск возникновения бесплодия после перенесенной химиотерапии велик. Он может носить временный или постоянный характер. Сроки возобновление репродуктивной функции женщины зависят от:
- степени тяжести перенесенного заболевания и места локализации опухоли (например, при раке яичников риск бесплодия возрастает);
- вида химических препаратов ─ специфические имеют низкую дозу гонадотоксичности (токсическое воздействие на половые железы), неспецифические ─ высокую дозу;
- количества проведенных курсов химиотерапии;
- восстановительной способности организма;
- возраста.
Основываясь на наблюдениях медицинской практики, восстановительный период после химиотерапии в среднем длится от 2 до 5 лет. У молодых женщин до 30 лет есть все шансы забеременеть естественным путем, выносить и родить здорового ребенка. После 30 эти шансы стремительно падают. Тем не менее, утверждать с точностью, что репродуктивная функция полностью восстановится, нельзя.
Учитывая этот факт, перед назначением такого лечения у женщин репродуктивного возраста врач обязан выяснить планирует ли она беременность в будущем. Если да, то в таком случае, чтобы сберечь и защитить яичники на время курса терапии, назначают специальные блокирующие препараты.
Как восстановить репродуктивную функцию после химиотерапии?
Существуют новейшие методы сохранения фертильности после химиотерапии. Один из них ─ витрификация ооцитов (отсроченное материнство). Суть методики заключается в изъятии ооцитов путем пункции яичника с последующей их заморозкой. Таким образом, спустя некоторое время после химиотерапии, женщина может забеременеть путем ЭКО.
Для устранения нарушений в половой сфере после химической терапии назначают медикаментозное профилактическое лечение и фитотерапию, которая заключается в назначении антиоксидантов и агонистов.
Антиоксиданты ─ это отрицательно заряженные молекулы, которые притягивают токсины и выводят их из организма. Наибольшее их содержание в овощах, фруктах, зелени.
Агонисты ─ вещества, которые взаимодействуя с рецепторами, полностью угнетают функцию клетки. Их главная задача ─ отключить процесс деления бластных (незрелые предшественники яйцеклеток) клеток яичников. Находясь в состоянии покоя половые клетки в минимальной степени подвержены влиянию химиотерапии.
Основные группы растений для восстановления репродуктивной функции после перенесенного химиотерапевтического лечения:
- Антиоксидантные ─ шиповник, розмарин, боярышник, полынь.
- Антигонадотропные ─ воробейник краснокорневой, окопник лекарственный,
- Фитоэстрогеносодержащие ─ люцерна посевная, хмель обыкновенный, клевер красный, солодка, шалфей.
- Адаптогены ─ радиола розовая, элеутерококк, женьшень, аралия маньчжурская.
Травы усиливают в яичниках секрецию половых стероидов и восстанавливают созревание яйцеклетки.
Решение о предстоящей беременности должно быть не эмоциональным, а взвешенным и приниматься не только самой женщиной, но и онкологами, гинекологами, членами семьи. Это залог благоприятного исхода будущей беременности и здоровья малыша!
Важно знать: Бывают ли дети после химиотерапии?
Безопасна ли химиотерапия при беременности (в том числе внематочной)?
Что делать, если диагноз об онкологическом заболевании установлен во время беременности? Как правило, о наличии возможной опухоли женщины узнают от гинеколога, который наблюдает ее.
В первую очередь, оценивают размеры опухоли, структуру и характер ее динамики. Если есть основания (медленный рост опухоли), то сроки химиотерапии переносят на послеродовой период.
Если лечение в первом триместре неизбежно, в таком случае показано искусственное прерывание беременности, так как химические препараты приводят к патологии развития плода, несовместимой с жизнью. На поздних сроках, когда уже завершена закладка органов и систем плода, химиотерапию проводят. Но могут быть следующие осложнения:
- недоношенность и преждевременные роды;
- маловесные дети;
- нарушение или отсутствие лактации.
Химиотерапию также применяют для устранения внематочной беременности. Препарат “Метотрексат” ─ это эффективная альтернатива хирургическому вмешательству. Он не только устраняет плодное яйцо, но и восстанавливает проходимость маточных труб. Этот метод используют тогда, когда размеры эмбриона не превышают 3,5 см.
Химиотерапия и беременность в определенных ситуациях вполне совместимы. И, вопреки всем мифам и предрассудкам, лечение химиопрепаратами не лишает женщину счастья материнства.
Онкологические заболевания во время беременности
В статье рассматривается вопрос о влиянии онкологических заболеваний на беременность и здоровье плода. Описаны действие химиотерапии на течение беременности, плод и состояние иммунной системы беременной и плода, риски развития патологии центральной нервной системы (ЦНС), сердечно-сосудистой системы, общего состояния здоровья и физического развития новорожденных. Рассмотрен иммунный статус новорожденного у матерей, получавших химиотерапию во время беременности, вакцинопрофилактика в первые сутки жизни детям, чьи матери получали химиотерапию во время беременности. Представлены тактика ведения беременности, оптимальные сроки назначения и отмены химиотерапии, исходы беременности при раннем и отсроченном начале проведения терапии, последние результаты исследований по оптимизации сроков родоразрешения как для матери, так и для плода.
По данным мировой литературы, в настоящее время отмечается тенденция к увеличению частоты онкологических заболеваний в структуре заболеваемости у женщин репродуктивного возраста. Если в 1964 г. частота злокачественных новообразований среди беременных женщин составляла 1:2000, то к 2000-м гг. частота заболеваемости раком увеличилась до 1-2 случаев на 1000 беременных 2. Среди 805 500 женщин, которым был поставлен диагноз рака в 2013 г., около 20-30% были моложе 45 лет [6]. Рост частоты заболеваемости может быть связан с увеличением возраста наступления первой беременности у женщин. Так, возраст матери при рождении первого ребенка в некоторых европейских странах достиг 30 лет [6, 7].
Наиболее часто во время беременности встречаются рак молочной железы (РМЖ), рак шейки матки (РШМ), лейкемия, лимфома и рак легких. Ведущее место в структуре заболеваемости занимают РМЖ и лимфома, составляя 1-3 и 1-6 случаев на 10 000 беременных женщин соответственно [8].
Основные принципы химиотерапии
До недавнего времени онкологический диагноз являлся приговором для материнства и служил показанием для прерывания беременности. Достижения современной медицины, развитие высокотехнологической помощи способствуют повышению качества жизни данной группы пациенток и в большинстве случаев позволяют не только пролонгировать беременность, но и проводить терапию, которая оказывает минимальное влияние на плод. Одними из ведущих методов лечения онкологических заболеваний являются неоадъювантная и адъювантная химиотерапия. Неоадъювантная химиотерапия применяется при распространенных опухолях с целью уменьшения объема опухоли до проведения операции, она также воздействует, но в меньшей степени, и на метастазы. Адъювантная химиотерапия дополняет хирургические и лучевые методы лечения рака, ее основной целью является подавление микрометастазов после хирургического лечения. Продолжительность неоадъювантной химиотерапии занимает обычно от 2 до 3 месяцев, адъювантной химиотерапии - от 4 до 6 месяцев.
Противоопухолевая терапия включает комбинацию нескольких химиопрепаратов, которые подразделяются на 5 групп: 1-я группа - алкилирующие препараты (циклофосфамид, тиофосфамид, мелфалан, нитрозометилмочевина, кармустин, хлорамбуцил и др.), вступающие во взаимодействие с нуклеиновыми кислотами клетки, что приводит к нарушению обмена и гибели клетки; 2-я группа - антиметаболиты (метотрексат, 5-фторурацил, фторафур, 6-меркаптопурин и др.), селективно тормозящие образование ДНК в S-фазе, что приводит к остановке деления клетки и ее гибели; 3-я группа - антибиотики (адриамицин, блеомицин, актиномицин D, митомицин С, эпирубицин и др.), вызывающие нарушение синтеза ДНК и РНК; 4-я группа - препараты растительного происхождения (винкристин, винбластин, этопозид, колхамин, таксол, таксотер, доцетаксел, паклитаксел) - митотические ядовитые вещества, блокирующие фазу митоза клеток; 5-я группа - другие противоопухолевые препараты (L-аспарагиназа, дакарбазин, цисплатин, карбоплатин) - вещества из различных химических классов.
Одним из наиболее важных достижений фармакологии является создание таргетных препаратов, которые воздействуют на определенные, заранее установленные внутриклеточные молекулярные мишени опухолевой клетки.
Цели таргетных препаратов:
- - рецепторы к эпидермальным факторам роста (EGFR) и факторам роста сосудов - VEGF (рецепторы ангиогенеза - VEGFR);
- - белки, осуществляющие проведение митогенных сигналов от рецепторных молекул;
- - молекулы, контролирующие запуск и течение программированной смерти клеток;
- - гены, отвечающие за рост и деление раковых клеток;
- - «выключение» (сайленсинг, от англ. silence - молчание) генов на основе механизма РНК-интерференции (механизма ингибирования экспрессии гена на стадии трансляции с помощью малых интерферирующих РНК).
Большая часть таргетных препаратов ингибирует пролиферацию и/или стимулирует дифференцировку опухолевых клеток за счет выключения механизмов, отвечающих за формирование злокачественного фенотипа (цитостатическое воздействие), из чего следует, что главным эффектом является сдерживание роста опухолевых клеток или уменьшение опухолевой массы. Данная задача является важной частью лечения и замедления роста опухоли, но применение химиотерапии остается одним из основных методов лечения онкологических заболеваний.
Эффективность применения химиотерапии во время беременности зависит от нескольких факторов, в том числе от продолжительности и времени начала проведения химиотерапии, дозировки препаратов, механизма воздействия на клетки. От того, в каком триместре беременности начато проведение химиотерапии, какие препараты использовали, их комбинации, дозы и молекулярной массы, зависит оказываемое влияние на плод. Так, применение цитотоксических препаратов во время оплодотворения или имплантации (в течение первых 10 дней после зачатия) может привести к гибели эмбриона, однако не исключены благоприятный исход и физиолог.
Воздействие химиотерапии на систему мать-плацента-плод: современное состояние проблемы
1 ФГБУ Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России, Москва;
2 ФГБНУ Научный центр психического здоровья РАН, Москва
Проведен сравнительный анализ результатов исследований, опубликованных в научной литературе и посвященных изучению воздействия химиотерапии на здоровье матери и плода. Рассмотрены рекомендации по изменению существующих алгоритмов ведения беременности пациенток с онкологическими заболеваниями. Дальнейшие исследования позволят найти разумный обоснованный подход к решению проблемы, связанной с проведением эффективного лечения онкологического заболевания беременной пациентки при условии сохранения здоровья ее ребенка.
Наличие онкологического заболевания у беременных женщин несет серьезную угрозу здоровью пациентки и ее плоду. По многолетним наблюдениям рак осложняет одну из тысячи беременностей 2. В последние десятилетия наблюдается тенденция к росту частоты диагностики опухолевых заболеваний среди беременных пациенток.
Среди онкологических заболеваний, выявляемых во время беременности, наиболее часто встречаются: рак молочной железы, рак шейки матки, лимфомы, рак щитовидной железы, меланома и лейкозы [1, 2, 4].
Выбор программы лечения беременных женщин с онкологическими заболеваниями зависит от нозологической группы, стадии и агрессивности заболевания. Так, к основным схемам лечения при раке молочной железы относятся: AC (доксорубицин и циклофосфамид) и ЕС (эпирубицин и доксорубицин) [5]. При лимфомах лечение проводится либо в виде монохимиотерапи (винбластин), либо по схемам: CHOP (доксорубицин, циклофосфамид, винкристин и преднизолон), ABVD (доксорубицин, блеомицин, винбластин и дакарбазин), EPOCH (этопозид, преднизолон, винкристин, циклофосфамид, доксорубицин), BEACOPP-14 (блеомицин, этопозид, доксорубицин, циклофосфамид, винкристин, прокарбазин и преднизолон) [6].
Лечение и ведение беременности женщин с онкологическими заболеваниями сопровождается клинической дилеммой: с одной стороны необходимо минимизировать потенциально неблагоприятное воздействие противоопухолевого лечения на плод, с другой - сохранить здоровье матери.
При лечении беременных женщин со злокачественными заболеваниями необходимо учесть:
- Влияние физиологических изменений, происходящих в организме беременной пациентки, на фармакокинетику и фармакодинамику химиотерапевтических агентов и, следовательно, на эффективность химиотерапии и выраженность побочных эффектов терапии.
- Возможность трансплацентарной передачи цитотоксической химиотерапии плоду.
- Влияние химиотерапии на органогенез и физиологию всех систем организма плода как внутриутробно, так и впоследствии на протяжении всей жизни.
С увеличением срока беременности наблюдается повышение активности почечных транспортеров (в частности органических катионов и Р-гликопротеинов) [8], вследствие чего происходит повышение почечного клиренса лекарств (от 20 до 65%). В итоге уменьшается период полувыведения лекарственных средств [10].
Многие противоопухолевые препараты являются пролекарствами - их активное действующее вещество после трансформации в печени преобразуется в активный метаболит. Во время беременности наблюдается увеличение печеночной гемодинамики с нарастанием биодоступности лекарственных препаратов. В работе N. Isoherranen и соавт. [10] показано, что в период гестации повышается активность ферментов в системе цитохрома Р450 в печени (в частности фермента CYP3A4), которые участвуют в метаболизме ряда химиотерапевтических средств. С увеличением активности ферментов происходит более интенсивное превращение пролекарства в активный метаболит. Активность печеночного метаболизма напрямую влияет на эффективность терапии. Таким образом, биотрансформация лекарства в организме беременных пациенток происходит быстрее, чем у небеременных.
Следует отметить, что чрезмерное превышение концентрации активного метаболита в крови увеличивает риск возникновения токсических эффектов. Напротив, при снижении активности ферментов пролекарство медленно трансформируется в активный метаболит, эффективность терапии снижается, лекарство выводится в неизмененном виде, терапевтические концентрации препарата в крови не достигают целевых значений.
Ключевым вопросом при лечении беременных пациенток с онкологическими заболеваниями является вопрос оптимизации доз химиопрепаратов. В развитых странах в практике лечения различных заболеваний активно используется терапевтический лекарственный мониторинг (ТЛМ). ТЛМ позволяет определить концентрацию препаратов в биологических пробах организма и для каждого пациента индивидуально подобрать дозы лекарственных средств, позволяющие эффективно воздействовать на мишень и минимизировать побочные явления терапии [11]. ТЛМ в основном используется для наблюдения за лекарствами, имеющими узкий терапевтический диапазон, и лекарствами с выраженной нестабильностью фармакокинетики.
Противоопухолевая терапия обычно включает в себя применение сложных химиотерапевтических препаратов. Наиболее перспективным методом для проведения ТЛМ беременных с онкологическими заболеваниями является хромато-масс-спектрометрия. Хромато-масс-спектрометрия позволяет в отсутствии полной тест-системы химиопрепарата, валидировав методику измерения для каждой молекулы препарата на чистой субстанции, определить концентрацию лекарства в биологической пробе [12].
Влияние химиотерапии на плод беременной
Кафедра акушерства и гинекологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова
филиал ГБУЗ ГКБ №24 Департамента здравоохранения Москвы «Перинатальный центр», Москва, Россия
Кафедра акушерства и гинекологии лечебного факультета Российского государственного медицинского университета
Кафедра акушерства и гинекологии лечебного факультета ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
Влияние ионизирующего излучения на плод
Цель исследования — провести систематический анализ данных, имеющихся в современной литературе, относительно рисков развития патологии плода в результате воздействия ионизирующего излучения в ходе диагностических или лечебных процедур. Материал и методы. В обзор включены данные статей по выбранной теме, опубликованные в Pubmed за последние 10 лет. Результаты. Внутриутробная радиочувствительность зависит от гестационного возраста, максимальна она в период органогенеза. Анализ данных показал, что при использовании ионизирующего излучения, доза которого не превышает 100 мГр, риск негативного влияния на плод минимален. Заключение. При беременности желательно избегать воздействия ионизирующего излучения, но в случае крайней необходимости проведения диагностических или лечебных процедур доза, полученная плодом, не должна превышать 100 мГр.
Воздействие ионизирующего излучения сопровождается увеличением риска спонтанных абортов, развития микроцефалии, задержки умственного развития и, возможно, развития онкологических заболеваний в течение жизни [1]. В связи с этим абсолютно логичным кажется, что согласно Федеральному закону «О радиационной безопасности населения» № 3-ФЗ от 09.01.96: «На период беременности и грудного вскармливания ребенка женщины должны переводиться на работу, не связанную с источниками ионизирующего излучения».
До момента нидации влияние радиации, как и других факторов, происходит по принципу «все или ничего», т. е. эмбрион или погибает, или формируется нормально. Существуют убедительные доказательства увеличения риска гибели эмбриона в предымплантационный период под действием облучения, причем при дозах менее 100 мГр частота летальных эффектов ионизирующего излучения очень мала.
Результаты многих исследований свидетельствуют о том, что внутриутробная радиочувствительность зависит от гестационного возраста с максимальной чувствительностью в период органогенеза. На основе данных, полученных на лабораторных животных, сделан вывод о наличии пороговой дозы облучения для индукции мальформаций, равной 100 мГр. Чаще всего аномалии связаны с центральной нервной системой. Суммарный риск нарушений развития плода и возникновения онкологических заболеваний в детском и юношеском возрасте при экспозиции радиации в дозе 0,1 Гр составляет приблизительно 3% (что сопоставимо с популяционными значениями). Поэтому воздействие радиации в дозе менее 0,1 Гр не может быть показанием к прерыванию беременности [2].
При анализе данных по исследованию выживших после атомных бомбардировок в отношении формирования тяжелой умственной отсталости у детей, подвергшихся внутриутробному облучению в наиболее чувствительный период внутриутробного развития (10—17 нед беременности), было показано, что порог дозы для развития такого повреждения находится на уровне как минимум 300 мГр. Облучение в дозе менее 100 мГр на уровень IQ и частоту мальформаций у ребенка однозначно не влияет [3].
Лучевая диагностика
Существовало мнение, что ионизирующее излучение уже при дозах 10 мГр может вызывать нарушение органогенеза у плода, а также увеличивать риск развития онкологических заболеваний у ребенка после рождения вплоть до подросткового возраста. Однако по результатам систематического обзора, проведенного в 2008 г., не было выявлено статистически значимой связи между пренатальным воздействием рентгеновских лучей и развитием онкологических заболеваний у ребенка (отношение рисков 0,99; 95% доверительный интервал 0,78—1,13) [4]. В Швеции в 2007 г. было проведено крупное исследование, в ходе которого были обследованы 652 ребенка, рожденных у матерей, подвергавшихся во время беременности диагностической рентгенографии. Частота лейкозов у этих детей не отличалась от таковой в контрольной группе [5].
В ходе крупного долгосрочного исследования J. Ray и соавт. [6] оценивали риск развития онкологических заболеваний у детей, подвергшихся внутриутробному воздействию ионизирующего излучения при проведении матери компьютерной томографии или радионуклидной диагностики. Статистически значимой связи между лучевой экспозицией и риском онкологических заболеваний у детей (ОШ (отношение рисков) 0,69; 95% ДИ (доверительный интервал) — 0,26—1,82) выявлено не было.
По данным Международной комиссии по радиологической защите, риск развития злокачественных новообразований равняется приблизительно одному случаю на 500 плодов, подвергшихся излучению в дозе 30 мГр. При этом пожизненный риск развития рака после внутриутробного облучения будет таким же, как и после облучения в раннем детском возрасте, т. е., по крайней мере, в 3 раза выше, чем у населения в целом [7].
Таким образом, в зависимости от возможного воздействия на плод, дозы ионизирующего излучения можно разделить следующим образом:
— до 100 мГр — безопасная для плода;
— 100—300 мГр — возможно повреждающее действие на плод;
— более 300 мГр — высока вероятность пороков развития, задержки роста и гибели плода, поэтому после воздействия такой дозы радиации в I триместре беременности следует поставить вопрос об искусственном прерывании беременности.
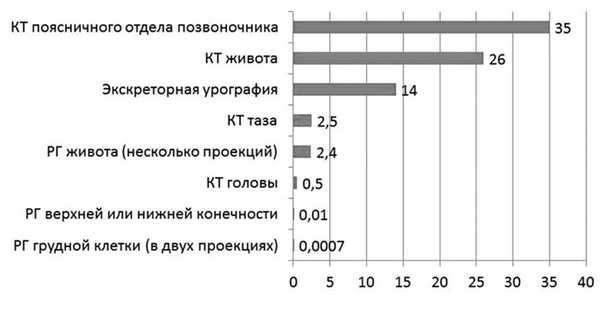
Большинство диагностических процедур, основанных на воздействии ионизирующего излучения (рентгенологическое обследование, флюорография), характеризуются дозировкой излучения менее 50 мГр (см. рисунок) Поглощаемая плодом доза ионизирующего излучения при проведении рентгенологических исследований (мГр) [8]. (например, доза для плода при рентгенографии грудной клетки составляет менее 1 мкГр, при флюорографии — 1,5 мкГр), поэтому даже при проведении нескольких рентгенологических исследований подряд вероятность неблагоприятного воздействия на плод крайне низка. Так, компьютерная томография (КТ) характеризуется довольно высокой дозой излучения (поскольку проводится серия рентгеновских снимков, излучение, сопровождающее каждый из них, суммируется). Поэтому К.Т. во время беременности должно выполняться по строгим показаниям, хотя риск для плода также невысок. Согласно современным рекомендациям, этот метод исследования имеет свою нишу при беременности. КТ рекомендуют проводить при сомнении в диагнозе острый аппендицит, подозрении на тромбоэмболию легочной артерии, при серьезных травмах, а в некоторых случаях и при необходимости уточнения строения и формы таза. При этом во всех случаях перед проведением этой процедуры с пациенткой необходимо провести беседу и информировать ее о потенциальных рисках для плода, получив с нее информированное согласие на манипуляцию [8].
Американская коллегия радиологов даже опубликовала меморандум о том, что ни одна диагностическая процедура, основанная на рентгеновском облучении, не угрожает здоровью и развитию эмбриона и плода. Несмотря на это, флюорография и рентгеновское исследование во время беременности должны проводиться только при наличии строгих показаний.
Лучевая терапия
Лучевую терапию, учитывая риск формирования пороков развития у плода, во время беременности используют редко. Дозы облучения, применяемые при лучевой терапии, составляет 30—70 Гр, что в 100—1000 раз выше, чем при диагностических процедурах. Соответственно, при невозможности отложить лучевую терапию нужно использовать методы экранирования плода. Кроме того, роль играет расстояние между зоной облучения и дном матки. Если это расстояние превышает 30 см, периферическая доза облучения для плода составит 0,04—0,2 Гр. При высоком стоянии дна матки (III триместр беременности, многоплодная беременность и т. д.) периферическая доза облучения для плода может превысить 2 Гр [11, 12].
В связи с этим риск для плода минимален при облучении опухолей, локализующихся выше диафрагмы (опухоли головы и шеи, рак молочной железы), а при раке шейки матки лучевая терапия несовместима с жизнеспособностью плода [2, 12].
В 2009 г. S. Luis и соавт. [13] провели анализ 109 случаев лучевой терапии при беременности. Средний период наблюдения за детьми составил 37 мес. Было зафиксировано 13 наблюдений неблагоприятного завершения беременности (2 самопроизвольных аборта, 6 наблюдений перинатальной гибели, 1 случай нейросенсорной тугоухости, случай затруднения в обучении и сколиоза, 1 наблюдение сочетания крипторхизма и дефекта межжелудочковой перегородки, 1 наблюдение гипоспадии, а также случай нарушения психомоторного развития).
Радиоизотопная терапия
Радиоактивные вещества даже при их однократном поступлении в организм беременной могут надолго задерживаться в нем, переходить через плацентарный барьер и быть источником облучения плода. Особенно значимо поражаются у беременной гормональная, иммунная и репродуктивная системы. Влияние на эти системы обусловлено тем, что в период гестации в организме беременной происходят значительные изменения в эндокринной системе, за счет угнетения адаптивного иммунитета смещается иммунное равновесие, а в репродуктивной системе (в матке) развивается плодное яйцо, элементы которого с различной интенсивностью и специфичностью накапливают отдельные радионуклиды.
Такие радиоактивные элементы, как 131 I, 32 P, 134 Cs излучают α-, β-, γ-лучи, обладающие различной проникающей способностью. Существуют следующие пути передачи радионуклидов: 1) гематогенный ( 131 I, 32 P, 134 Cs); 2) накопление радионуклидов в тканях плаценты с последующим воздействием на плод (трансурановые элементы); 3) параплацентарный переход через плодные оболочки и околоплодные воды (радиоактивный плутоний).
Беременность является противопоказанием к терапии радиоизотопами, за исключением случаев, когда без проведения терапии существует риск для жизни пациентки.
Некоторые радиоизотопы, включая 131 I в виде иодида и 32 Р в виде фосфата, быстро проходят через плаценту, поэтому перед проведением терапии радиоактивными препаратами следует исключить беременность. На практике, так как рак щитовидной железы обладает относительно низкой агрессивностью течения, и хирургическое, и радиоизотопное лечение можно отсрочить до родов.
На ранних сроках беременности наиболее опасным для плода является γ-излучение радиоактивного йода, скапливающегося в мочевом пузыре. Доза, которая действует на плод при радиоизотопной терапии при беременности, составляет приблизительно 50—100 мкГр на 1 МБк от введенного препарата. Дозу можно снизить, рекомендовав пациентке обильное питье и частое мочеиспускание.
В сроке более 10 нед щитовидная железа может накапливать йод, что может приводить как к аблации щитовидной железы плода, так и к индукции в дальнейшем у него рака щитовидной железы [14].
Таким образом, при беременности желательно избегать воздействия ионизирующего излучения, но в случае крайней необходимости проведения диагностических или лечебных процедур доза, полученная плодом, не должна превышать 100 мГр.
Кафедра акушерства и гинекологии Московского факультета Российского государственного медицинского университета
Кафедра акушерства и гинекологии факультета послевузовского профессионального образования врачей Московской медицинской академии им. И.М. Сеченова
Кафедра акушерства и гинекологии №2 лечебного факультета Российского национального исследовательского университета им. Н.И. Пирогова
Кафедра акушерства и гинекологии лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова Минздрава России, Москва, Россия
Химиотерапия во время беременности: возможности и риски
Журнал: Российский вестник акушера-гинеколога. 2019;19(3): 81‑85
Беременность, ассоциированная с онкопатологией, является актуальной проблемой современного акушерства. Ежегодно регистрируется от 17 до 38 новых случаев заболевания на 100 000 родов. Возможность пролонгирования беременности определяется индивидуально и зависит от срока гестации, распространенности опухолевого процесса и желания пациентки. В I триместре рекомендованы прерывание беременности и проведение стандартной комплексной терапии. Со II триместра лечебные мероприятия включают хирургическое и медикаментозное воздействие. Химиотерапия возможна и относительно безопасна после окончания периода эмбриогенеза. Схемы и дозы применяемых препаратов идентичны разработанным для небеременных пациенток. Последний курс химиотерапии должен быть завершен не позднее 3-й недели перед родоразрешением. В статье представлена информация о специфике действия химиопрепаратов и рисках, связанных с их применением на фоне беременности.
Термин «беременность, ассоциированная с онкопатологией», подразумевает обнаружение злокачественного новообразования на фоне гестации и/или в течение 1 года после родов. Впервые опухоли диагностируются в 17—38 наблюдениях на 100 000 беременных. Среди всей патологии наиболее часто встречаются рак молочной железы, рак шейки матки и лимфопролиферативные заболевания [1]. Смещение периода деторождения в сторону старшего репродуктивного возраста рассматривается в качестве ведущей причины роста частоты выявления онкологической патологии у беременных [1, 2]. Прогнозы течения болезни во многом определяются сроком беременности, при котором был поставлен диагноз. При своевременном начале терапии, как правило, прогноз не ухудшается, однако отсроченное лечение значительно снижает 5-летнюю выживаемость [1].
Согласно российским и международным рекомендациям, в I триместре показано прерывание беременности. Со II триместра возможно проведение системной химиотерапии по схемам, разработанным для небеременных пациенток [1—3].
Химиотерапия во время беременности
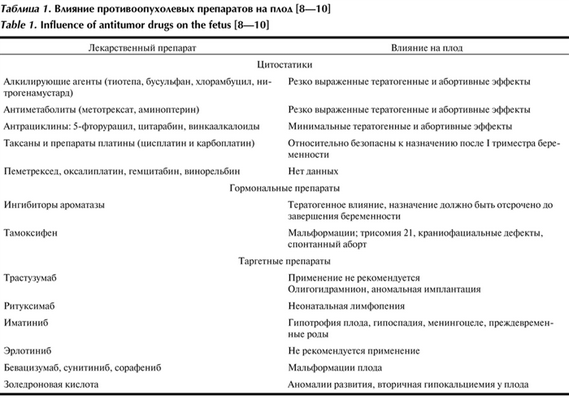
Согласно классификации FDA, все лекарственные средства, применяемые во время беременности, разделяются по категориям их безопасности. Химиотерапевтические препараты отнесены к категории X, т. е. противопоказаны в связи с эмбрио- и тератогенным воздействием. Накопленный опыт свидетельствует о том, что использование данных препаратов возможно после завершения периода эмбриогенеза. Наиболее уязвимым является интервал с 5-й по 10-ю неделю, в период эмбриогенеза, когда применение антиметаболитов и алкилирующих агентов приводит к грубым порокам развития в 16% наблюдений. Введение одного цитостатика в I триместре повышает риск развития пороков до 10%, а нескольких — до 25% [4]. После 12 нед проведения химиотерапии не повышается риск возникновения пороков развития у плода, но ассоциировано с акушерскими осложнениями (задержка роста плода, преждевременные роды, анте- и интранатальная гибель плода, подавление гемопоэтических клеток) в 27% [4—6] (табл. 1). Таблица 1. Влияние противоопухолевых препаратов на плод [8—10]
Органогенез продолжается до 10-й недели беременности, а становление функций головного мозга продолжается на протяжении всего периода гестации. Поэтому и головной, и спиной мозг остаются потенциально уязвимыми. Пока нет достаточных данных для суждения о рисках и отдаленных последствиях нейротоксичного действия внутриутробной химиотерапии [7].
Физиологические изменения, происходящие во время беременности, влияют на всасывание, распределение, метаболизм и экскрецию лекарственных средств. В связи с увеличением объема циркулирующей крови и снижением концентрации альбумина значительно изменяются процессы распределения и клиренса препаратов [6]. Повышение уровня эстрогенов и прогестерона приводит к изменению функционирования микросомальной оксидазной системы печени и скорости трансформации лекарственных средств [11, 12]. Увеличение сердечного выброса и объема крови на 50% (в основном за счет увеличения объема плазмы на 45%) приводит к росту перфузии, скорости клубочковой фильтрации в почках и скорости почечной элиминации. Появление нового третьего пространства, представленного околоплодными водами, приводит к увеличению объема распределения и снижению концентрации препаратов в системном кровотоке [6, 12]. Любое лекарственное средство, которое вводится матери, в некоторой степени может проникать через плаценту [13].
Плацента выступает в качестве биологического барьера, а также может влиять на метаболизм лекарственных средств за счет имеющихся в ее структуре ферментов. Трансплацентарный перенос любых веществ осуществляется путем пассивной диффузии, активного транспорта, облегченной диффузии, фагоцитоза или пиноцитоза [14, 15]. Трансплацентарный перенос химиотерапевтических препаратов в основном происходит путем пассивной диффузии, зависящей от градиента концентрации препарата между материнской и фетальной циркуляцией и скоростью плацентарного кровотока. Вещества с низкой молекулярной массой (500 г/моль), жирорастворимые и не связанные с белком-переносчиком, легко преодолевают плацентарный барьер [16]. На материнской поверхности плаценты экспрессируются специфические белки-транспортеры, такие как Р-гликопротеин (P-GP: MDR 1/ABCB1), белок резистентности рака молочной железы (BCRP/ABCG2), белки 1—3 и 5 множественной лекарственной резистентности (MRP 1—3 и 5/ABCC1—3 и 5), которые способствуют перемещению химиопрепаратов [14, 17].
Наиболее эффективным является еженедельное введение химиопрепарата, что позволяет снизить концентрацию лекарственного вещества в крови и риск его токсического действия. Побочные эффекты химиотерапии можно купировать за счет использования безопасных противорвотных средств, ондансетрона или метоклопрамида [18]. Противорвотные средства (прометазин, селективные блокаторы серотонина — 5-HT, антагонисты нейрокинина-1 — NK1 и дроперидол) в сочетании с дифенгидрамином или дексаметазоном используются для купирования выраженной тошноты и рвоты [1].
Проведение химиотерапии заканчивают за 3 нед до предполагаемых родов, так как препараты вызывают супрессию костного мозга у плода, повышая вероятность развития сепсиса, тяжелой анемии, кровотечения и смерти новорожденного [5].
Химиотерапия при беременности, ассоциированной с раком яичников
Схемы лечения беременных, больных раком яичников, не должны отличаться от разработанных для данной патологии. Назначается стандартная схема химиотерапии: паклитаксел с карбоплатином. Исследования, проведенные на моделях животных, показали, что таксаны не влияют на органогенез и когнитивные функции. Однако способность этих препаратов проникать через трансплацентарный барьер у человека до конца не известна [18]. Концентрация циклофосфамида в амниотической жидкости составила 25% от его уровня в материнской плазме [18]. Цисплатин накапливается в амниотической жидкости в количествах до 13%, а карбоплатин от 2,2 до 23,7% от плазменной концентрации. Доксорубицин, проникая трансплацентарно, накапливается в легких, печени и почках плода. Трансплацентарный переход паклитаксела незначителен и составляет около 5% от введенной дозы [19, 20].
Из препаратов платины при лечении рака яичников наиболее часто используют цисплатин и карбоплатин. Платиносодержащие препараты оказывают тератогенное действие и могут приводить к антенатальной гибели плода. Они легко проникают через плаценту, циркулируя в пуповинной крови плода и у новорожденного [21]. Карбоплатин является платиносодержащим препаратом второго поколения, его побочные эффекты менее выражены, в связи с чем применение препарата у беременных предпочтительно. Карбоплатин и паклитаксел во второй половине беременности могут быть использованы в терапии больных раком яичников. Стартовые дозы не отличаются от таковых вне беременности, но на фоне терапии проводится их корректировка в зависимости от показателей крови [22].
Химиотерапия при беременности, ассоциированной с раком шейки матки
Согласно рекомендациям Международного Консенсуса по «гинекологическим ракам», проведение неоадъювантной химиотерапии (НАХТ) рака шейки матки во время беременности рекомендовано [23, 24] в следующих ситуациях:
1. При IB 1-й стадии, в отсутствие метастазов в регионарных лимфатических узлах и размерах опухоли менее 2 см НАХТ возможна со II триместра.
2. При IB 1-й стадии и размерах опухоли 2—4 см НАХТ может быть назначена пациенткам, у которых отсутствуют метастазы в регионарных лимфатических узлах, либо тем больным, у которых лимфаденэктомия не была выполнена.
3. При IB2—IIB стадиях НАХТ проводится для пролонгирования беременности до периода жизнеспособности плода.
В большинстве наблюдений НАХТ включает платиносодержащие препараты: цисплатин (50—100 мг/м 2 ) в монорежиме или в комбинации с паклитакселом (175 мг/м 2 ) каждые 3 нед [25]. Эффективна также комбинация цисплатина (75 мг/м 2 ) с ифосфамидом 2 г/м 2 каждые 2 нед [26, 27]. Терапия должна быть завершена за 3 нед до предполагаемого родоразрешения.
В случае инвазивного рака шейки матки методом родоразрешения является кесарево сечение корпоральным разрезом.
Ведение беременности
В большинстве случаев на фоне химиотерапии проводится рутинное наблюдение, аналогичное таковому при физиологическом течении беременности. Дополнительными являются мониторинг за состоянием плода (кардиотокография после 33 нед беременности) и допплерометрия маточно-плацентарного кровотока (до начала курса химиотерапии и через 2 дня после него) [1, 7]. Проведение химиотерапии сочетается с угнетением красного ростка кроветворения, что сопровождается развитием анемического синдрома. Для оценки степени его выраженности и эффективности лечения проводится дополнительное исследование клинического анализа крови с оценкой уровня ферритина. На фоне и после окончания курса химиотерапии проводится биохимическое исследование крови для оценки функции печеночных ферментов.
В ряде случаев (особенно при терапии больных с лимфопролиферативными заболеваниями) целесообразно использование низкомолекулярных гепаринов под контролем показателей свертывающей системы крови.
В идеале родоразрешение должно проводиться после 37 нед. Метод определяется акушерскими показаниями и опухолевым процессом. При раке молочных желез, мочевого пузыря, лимфопролиферативных процессах возможны влагалищные роды. При инвазивном раке шейки матки проводится оперативное родоразрешение. Оно предпочтительно при наличии метастазов в трубчатых костях (риск переломов), в ЦНС (противопоказаны потуги), при раке шейки матки и вульвы [18].

После родов химиотерапия может быть начата через 7 дней. В табл. 2 суммированы Таблица 2. Акушерская тактика при ведении беременных с онкопатологией базовые положения по наблюдению беременных с онкозаболеваниями [1, 5, 7, 12, 17, 22].
Заключение
Одной из сложных и противоречивых проблем в онкологии является ведение беременных со злокачественными новообразованиями. В структуре смертности женщин репродуктивного возраста онкологические заболевания занимают второе место, а частота сочетания опухолей и беременности достигает 1:1000 [10]. Беременность теоретически может оказывать влияние на течение опухолевого процесса за счет гормональных, иммунологических и микроциркуляторных изменений. Физиологические изменения, связанные с увеличением объема циркулирующей крови, снижением уровня белков, появлением третьего пространства (околоплодные воды), могут оказывать влияние на терапевтические эффекты проводимого лечения.
Согласно Российскому законодательству, постановка диагноза злокачественного новообразования в I триместре беременности является показанием к ее прерыванию. После 14 нед, когда процессы органогенеза завершены, возможно проведение химиотерапии без риска эмбриотоксического и тератогенного действия. Выбор препаратов зависит от гистологического типа опухоли и проводится согласно разработанным нормативам для небеременных пациенток. Последний курс химиотерапии должен быть завершен не позднее чем за 3 нед перед родами для предотвращения развития у ребенка миелосупрессии и вторичных инфекционных осложнений. В случае первичного выявления заболевания после 32 нед проведение химиотерапии нецелесообразно, так как один курс лечения не окажет существенного влияния на прогноз. Сроки родоразрешения должны быть максимально приближены к доношенным (более 37 нед); раннее (34—37 нед) и очень раннее (до 34 нед) преждевременное родоразрешение проводится только по абсолютным показаниям у матери и плода.
Читайте также:
- Причины и возбудитель дизентерии. Механизмы развития дизентерийной инфекции
- Пример гипотиреоза при пороке сердца. Синдром Шершевского-Тернера при пороке сердца
- Доступ, техника реконструкции медиальной бедренно-надколенниковой связки
- Жевание. Акт жевания. Регуляция жевания. Центр жевания.
- Ультразвуковые исследования. Компоненты ультразвукового сканера
