Влияние лучевой терапии на кости, мышцы, сухожилия
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Сергеев Пётр Сергеевич
к.м.н ведущий хирург-онколог, химиотерапевт, зав.отделения онкологии
«Рак кости» - не совсем правильный термин. Строго говоря, раком называют злокачественные опухоли, которые происходят из эпителиальной ткани. Костная ткань относится к соединительной ткани, поэтому здесь злокачественные опухоли называются саркомами .
Методы лечения различаются в зависимости от типа злокачественной опухоли. Здесь мы поговорим об общих принципах и расскажем о том, где можно получить современную помощь в России.
Не знаете, в какую клинику лучше обратиться? Рассматриваете лечение в частной онкологической клинике? Ищете хорошего врача, который специализируется на лечении рака костей? Обратитесь к специалистам Центра Комплексной Медицины. Мы знаем, где вам помогут: 8 (495) 215-50-60
Хирургическое лечение злокачественных опухолей костей
Хирургия - основной метод лечения злокачественных опухолей костей. Врач выбирает объем операции, опираясь на результаты МРТ и биопсии.
Ранее стандартным методом хирургического лечения при раке костей конечностей была ампутация. В настоящее время часто практикуются органосохраняющие операции. К ампутации прибегают, лишь когда не удается сохранить конечность, если в любом случае пришлось бы удалять важные сосуды, нервы и мышцы, что сделало бы пораженную конечность бесполезной.
Во время ампутации хирург удаляет опухоль, участок здоровых тканей, который находится выше, а также всё, что ниже. Во время органосохраняющей операции удаляют только опухоль и небольшое количество нормальных тканей вокруг. Удаленное новообразование обязательно отправляют в лабораторию для гистологического исследования. Важно получить негативный («чистый») край резекции - чтобы на линии разреза не осталось опухолевых клеток.
После любого типа хирургического вмешательства требуется реабилитация. Это даже более сложный этап лечения, чем сама операция. Утраченную конечность замещают протезом, удаленный участок кости - эндопротезом. Обычно восстановительное лечение после органосохраняющих операций занимает больше времени, чем после ампутации. Например, после ампутации ноги многие пациенты могут ходить самостоятельно спустя 3-6 месяцев, а после органосохраняющего вмешательства - в среднем через год.
При раке тазовых костей и нижней челюсти опухоль удаляют, захватывая участок окружающей здоровой ткани, утраченная часть кости может быть замещена трансплантатом.
Злокачественную опухоль позвоночника и костей черепа зачастую сложно удалить, потому что рядом находятся жизненно важные структуры. В таких случаях прибегают к специальным хирургическим методам:
- Выскабливание пораженного участка кости.
- Криохирургия - уничтожение опухолевых клеток низкой температурой с помощью жидкого азота.
- Костный цемент на основе полиметилметакрилата помогает закрыть отверстие, которое осталось после выскабливания и криохирургии, кроме того, при застывании он выделяет тепло, которое уничтожает опухолевые клетки.
Лучевая терапия
Злокачественные опухоли костей непросто уничтожить с помощью облучения. Для этого приходится применять высокие дозы, которые могут повредить соседние органы, сосуды и нервы, поэтому лучевую терапию применяют редко, в основном при саркомах Юинга, которые, как правило, встречаются у людей младше 30 лет.
Лучевая терапия при опухолях костей может преследовать одну из трех целей:
- Борьба с новообразованиями, которые не могут быть удалены хирургически.
- В качестве адъювантного лечения, если по результатам биопсии после хирургического вмешательства получен позитивный край резекции.
- При рецидиве, для того чтобы уменьшить боль и отек.
Как правило, при злокачественных опухолях костей применяют интенсивно-модулированную лучевую терапию. Эта методика позволяет добиться максимального соответствия формы излучения форме злокачественной опухоли и избежать повреждения окружающих здоровых тканей. Иногда применяют протонную терапию, но она доступна только в специализированных центрах, так как требует сложного, дорогостоящего и очень массивного оборудования.
Химиотерапия
Химиопрепараты применяют при остеосаркомах, саркомах Юинга и определенных типах хондросаркомы. Другие злокачественные опухоли костей не очень чувствительны к химиотерапии. Этот вид лечения главным образом применяют в случаях, когда имеются отдаленные метастазы.
Обычно врачи назначают комбинацию 2-3 химиопрепаратов, таких как: цисплатин, доксорубицин, ифосфамид, этопозид, метотрексат, циклофосфамид, винкристин.
Таргетная терапия
Таргетные препараты работают отличным образом от классических химиопрепаратов. Они блокируют определенные «молекулы-мишени», которые способствуют размножению и поддержанию жизнедеятельности опухолевых клеток. Таргетная терапия имеет особое значение при опухолях костей, которые не реагируют на химиотерапию.
В настоящее время при злокачественных опухолях костей в мировой практике есть опыт применения двух таргетных препаратов:
- Иматиниб применяют для лечения запущенных и рецидивировавших хордом. Препарат блокирует сигнальные молекулы, которые активируют размножение опухолевых клеток, на фоне его применения опухоль перестает расти или даже сокращается в размерах. Иматиниб принимают в виде таблеток один раз в сутки.
- Деносумаб используют для лечения неоперабельных и рецидивировавших гигантоклеточных опухолей. Препарат представляет собоймоноклональное антитело, которое ингибируетRANK-лиганд - белок, активирующий разрушение кости остеокластами. Деносумаб вводят подкожно. В течение нескольких месяцев он помогает уменьшить размеры опухоли.
Иммунотерапия
Иногда при гигантоклеточных опухолях применяют интерферон. Препарат можно вводить подкожно, внутримышечно или внутривенно.
Прогноз выживаемости
Средняя пятилетняя выживаемость для всех типов злокачественных опухолей костей у детей и взрослых составляет 70%. Это достаточно неплохой показатель. Можно сказать, что зачастую опухоли костей успешно лечатся. Конечно, большую роль играют такие факторы, как тип опухоли, стадия, степень злокачественности.
Центр Комплексной Медицины сотрудничает с лучшими онкологическими клиниками Москвы, мы знаем, где можно получить наилучшее лечение:
Изменения костных структур малого таза после лучевой терапии
Гинекологический рак является распространенной неоплазией и составляет 10-15% от всех злокачественных новообразований у женщин (1). Задача визуализации до лечения является стадирование злокачественного процесса для дальнейшего планирования терапии и манипуляций. Задача визуализации после лечения (хирургических манипуляций, химиотерапии, лучевой терапии) являются оценка ответа на терапию. Компьютерная томография (КТ) является методом выбора для оценки рецидива рака яичника (2). Магнитно-резонансная томография (МРТ)—в частности, с динамической контрастированием имеет высокую чувствительность (91%) при выявлении рецидивов гинекологического рака (3).
Существуют различные онкологические варианты в гинекологии, в зависимости от локализации, гистологического типа, а также степени и стадии заболевания, поэтому важно, чтобы диагност был готов правильно оценить изображения пациентов после химиотерапии, лучевой терапии или их комбинации, интерпретируя исследование и избегая ошибок в дифференциации нормальной анатомии после лечения и рецидива заболевания.
Химиотерапия и лучевая терапия.
Химиотерапия чаще используется в качестве неоадъювантного лечения при высокодифференцируемом раке яичников, реже высокодифференцируемом раке шейки матки. Адъювантная химиотерапия используется после операции по поводу рака яичников и рака эндометрия. Первичные химиотерапия и лучевая терапия применяется для лечения распространенного рака шейки матки (2-4 стадии) (4). При эндометриальной карциноме лучевая терапия применяется после хирургического вмешательства у пациентов, у которых патологический процесс распространяется на миометрий или выходит за пределы матки. При раке яичников лучевая терапия рекомендуется только в качестве паллиативного лечения при IV стадии заболевания (4,5).
Влияние лучевой терапии на кости, мышцы, сухожилия
Кафедра радиобиологии и биофизики ФГБОУ ВПО "Московская государственная академия ветеринарной медицины и биотехнологии им. К.И. Скрябина"
Механизмы развития метастатического поражения скелета и роль N-бисфосфонатов в терапии
Журнал: Онкология. Журнал им. П.А. Герцена. 2013;2(1): 73‑77
Волознев Л.В. Механизмы развития метастатического поражения скелета и роль N-бисфосфонатов в терапии. Онкология. Журнал им. П.А. Герцена. 2013;2(1):73‑77.
Voloznev LV. The mechanisms for the development of metastatic skeletal lesion and the role of N-bisphosphonates in its therapy. P.A. Herzen Journal of Oncology. 2013;2(1):73‑77. (In Russ.).
Метастатические поражения костей относятся к вторичным новообразованиям, занимая третье место по частоте после метастазов в легких и печени. Механизмы, лежащие в основе поражения костной ткани, сложные и являются результатом взаимодействия как опухоли, так и костной системы. Приведен механизм действия N-бисфосфонатов и патогенетические механизмы возникновения резорбтивных процессов в костной ткани вследствие влияния метастатических клеток. Понимание процесса метастатического поражения позволяет утверждать немаловажную роль применения N-бисфосфонатов и внедрять их в клиническую практику с целью улучшения результатов лечения и качества жизни пациентов.

Метастатические поражения костей относятся к вторичным новообразованиям и в структуре костной патологии встречаются в 35—40 раз чаще, чем первичные опухоли, занимая третье место по частоте после метастазов в легких и печени. При этом частота развития опухолевого процесса варьирует в широких пределах в зависимости от нозологической формы основного заболевания. В 85% случаев источником метастазов в костях являются злокачественные новообразования молочной железы, легкого и простаты. Так, частота метастазирования рака молочной железы в кости составляет 65—75%, рака предстательной железы — 65—75%, легкого — 30—40% (табл. 1) [1—4].

Примерно у 80% больных костные метастазы локализуются в позвоночнике, костях таза, ребрах, грудине и черепе [5—7]. American Joint Committee on Cancer за 2009 г. приводит данные частоты метастатического поражения костей с учетом локализации (табл. 2).
Различие в частоте метастатического поражения костей в зависимости от локализации может быть обусловлено особенностями распределения красного костного мозга в скелете, в котором могут присутствовать специфические рецепторы, способствующие «прицельной» инвазии опухолевых клеток. В работе R. Coleman [8] было показано, что у взрослого человека до 65% красного костного мозга локализуется в плоских костях, что, по его мнению, и обусловливает высокий процент преимущественного распространения метастазов по оси скелета.
Патогенез костных метастазов
Механизмы, лежащие в основе поражения костной ткани, сложные и являются результатом взаимодействия как опухоли, так и костной системы. В настоящее время понимание этих взаимодействий существенно улучшилось, однако окончательных специфических путей развития метастатического поражения не выявлено.
Опухолевые клетки метастазируют в костную систему преимущественно гематогенным путем в связи с отсутствием в ней лимфатического дренажа. Главным коллектором транспорта опухолевых клеток в кости является венозная система [1,9].
С. Batson в 1940 г. впервые описал комплексную сеть позвоночных, эпидуральных и околопозвоночных вен. Это соединение параллелей и коммуникантных путей создает «особую» венозную систему как один из путей транспорта опухолевых клеток в кости. Отсутствие клапанного аппарата позволяет крови перетекать в различных направлениях, что связано с внешним давлением, создаваемым физической активностью. Эти факты частично могут объяснить высокую частоту распределения метастазов вдоль позвоночного столба, костей таза и грудной клетки [4, 6].
Проявление способности опухоли к метастазированию обнаруживается на определенном этапе развития первичной опухоли и свидетельствует о прогрессировании заболевания. Время от возникновения опухоли до появления способности к метастазированию подчиняется законам прогрессии и является индивидуальным [10].
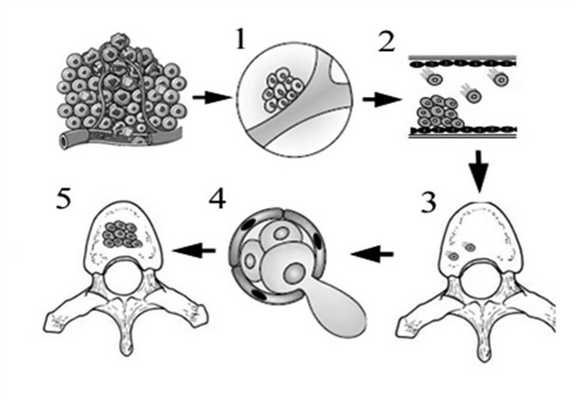
Формирование костных метастазов при опухолевом процессе осуществляется в основном прямой или опосредованной резорбцией костной ткани. Если процесс прямого разрушения кости включает в себя этапы инвазии опухолевой клетки в сосудистую сеть, миграцию в кровеносном русле, имплантацию в отдаленных сосудах кости, экстравазацию и пролиферацию в костной ткани, то при опосредованном пути костной резорбции дополнительно включаются медиаторные механизмы активации остеокластов и остеобластов (рис. 1) [1, 3, 11]. Рисунок 1. Этапы поражения кости при метастазировании опухолевых клеток из первичной опухоли в скелет. 1 — инвазия опухолевой клетки в сосудистую сеть опухоли; 2 — миграция в кровеносном русле; 3 — имплантация в отдаленных сосудах кости; 4 — экстравазация; 5 — пролиферация в костной ткани.
В результате активного ангиогенеза опухоли и особенности строения этих сосудов площадь их поверхности значительно выше, чем в интактных тканях, следовательно, клетки имеют повышенную возможность выхода в кровеносное русло [12]. Тем не менее во многих случаях наличие циркулирующих опухолевых клеток в периферической крови не предполагает наличия метастазов и имплантации клеток в отдаленных регионах и, как правило, зависит от органоспецифических факторов, которые обеспечивают благоприятные условия для активации процессов резорбции костной ткани. Это теория впервые была предложена S. Paget и в настоящее время поддерживается во многих доклинических моделях [13].
В 1889 г. S. Paget (1855—1926) опубликовал статью в журнале Lancet, в которой описал склонность различных типов рака к образованию метастазов в конкретных органах, и так как рост метастазов, по существу, подобен росту «зерна» («seed») в определенной микросреде («soil»), то и клинически определимый метастаз развивается только в том случае, если зерно и микроокружение совместимы: «When a plant goes to seed, its seeds are carried in all directions; but they can only live and grow if they fall on congenial soil» [9].
В 1928 г. J. Ewing (1866—1943) опроверг гипотезу S. Paget, высказав предположение, что образование метастазов контролируется особенностями кровообращения и механическими факторами (анатомические структуры сосудистой системы) [14]. Позже было высказано предположение, что регионарное метастатическое поражение связано с анатомическими и механическими условиями, такими как эфферентная венозная циркуляция в регионарные лимфатические узлы, но отдаленное метастазирование является продуктом взаимодействия опухоли и организма, что подтверждает гениальную гипотезу, выдвинутую S. Paget в конце XIX века [5].
Экспериментальные данные метастатического поражения на лабораторных мышах подтвердили обе концепции, т.е. кровообращение и «seed-soil» совместимость способствуют определенным типам опухолей распространяться на различные органы-мишени [15].
По мнению ряда авторов [1, 5, 8, 15], одним из важнейших условий развития метастатического поражения костей, известных в настоящее время, является повышенная экспрессия системных факторов, которые способны активировать ремоделирование костной ткани.
Процесс ремоделирования костной ткани основан на совместном функционировании остеолитических и формирующих костную ткань клеточных популяций — остеокластов и остеобластов. Соотношение между процессами резорбции и формирования костной ткани находится под постоянным контролем как местных, так и системных регулирующих факторов, что позволяет в норме поддерживать постоянную плотность кости [10, 16, 17]. Ремоделирование костной ткани осуществляет так называемая базовая многоклеточная единица (БМЕ), представляющая собой функционально объединенную совокупность остеокластов, остеобластов и остеоцитов в полости ремоделирования кости [10, 18].
Цикл ремоделирования состоит из пяти фаз. В первой фазе (активации) происходит распознавание стимулирующих сигналов (нагрузка на кость, гормональные и цитокиновые стимулы) остеоцитами, находящимися в толще костного матрикса, и передача сигнала клеткам остеобластического ряда, покрывающим поверхность костной ткани. В ответ на этот стимул выделяются факторы, привлекающие к поверхности кости клетки — предшественники остеокластов (клетки моноцитарно-макрофагального ряда) и стимулирующие их пролиферацию, дифференцировку в многоядерные остеокласты и прикрепление к поверхности костной ткани. Кроме того, покровные клетки подготавливают поверхность кости для прикрепления остеокластов, секретируя металлопротеиназы, разрушающие поверхностный белковый слой. Во второй фазе (резорбции) остеокласты выделяют ферменты, разрушающие костный матрикс, а кальций и фосфаты попадают в кровеносное русло. В третьей фазе (реверсии) остеокласты подвергаются апоптозу, а их место занимают преостеобласты (клетки, происходящие из мезенхимального ростка). Четвертая фаза характеризуется образованием на дне лакуны покрова из созревших остеобластов, которые выделяют молекулы, составляющие органическую основу костного матрикса и регуляторы минерализации — коллаген I типа, остеокальцин, остеонектин, остеопонтин. Далее происходит минерализация матрикса за счет преципитации кальция и фосфата, поступающих из кровеносного русла. В пятой фазе остеобласты превращаются в покоящиеся остеоциты и покровные клетки на поверхности кости. Формирование костной ткани занимает около 150 дней и в норме заканчивается полным заполнением резорбтивной лакуны новым матриксом [19, 20].
Процесс регуляции ремоделирования осуществляется OPG/RANKL/RANK каскадом, включающий рецептор активатора фактора транскрипции каппа В (RANK), его лиганд (RANKL) и остеопротегерин (OPG), а также рядом местных и системных факторов.
RANKL экспрессируется стромальными клетками и остеобластами, являясь медиатором активности остеокластов. Выработка RANKL регулируется посредством Т-клеток, а также такими факторами, как паратгормон, 1,25-дигидроксивитамина D3, интерлейкины, простагландины и др. RANKL активирует RANK на поверхности остеокластов и их предшественников, что приводит к увеличению пула этих клеток и усилению резорбции кости. ОPG является секретируемым рецептором, связывающим RANKL и блокирующим его функцию, и, таким образом, оказывающим негативное воздействие на резорбцию. Баланс между RANKL и OPG находится под контролем множества гормонов и цитокинов. Помимо OPG/RANKL/RANK каскада прямое стимулирующее действие на пролиферацию и активацию остеокластов оказывают паратгормонподобный пептид (PTHrP), макрофагальный колониестимулирующий фактор, интерлейкины 1 и 6 (ИЛ-1, ИЛ-6), фактор некроза опухоли альфа (TGF-α) и др. [3, 20—23].
Процесс метастазирования опухолевой клетки в кость приводит к активному образованию системных и местных факторов, активирующих сложный каскад биохимических и клеточных реакций. Как только опухолевые клетки поражают костный матрикс, они производят факторы роста, которые прямо или косвенно стимулируют процесс ремоделирования кости [2, 5, 22, 24]. В основе лежит активизация резорбтивных процессов в костной ткани вследствие влияния метастатических клеток. При этом развитие ремоделирования кости под воздействием метастатического поражения сопровождается патологическими изменениями (сдвигом) в процессе костного обмена. А преобладание одной из фаз в этом процессе позволяет клинически выделить три основные формы костных метастазов: остеолитическую, остеобластную и смешанную.
Литические изменения характерны для большинства злокачественных опухолей, метастазирующих в кости. При этом разрушение костной ткани происходит за счет активации остеокластов, индуцированных метастазами. Ключевой причиной резорбции кости при метастатическом поражении является PTHrP и ИЛ-6. Опухолевые клетки выделяют PTHrP и ИЛ-6, которые являются мощными медиаторами активации остеокластов [25].
В экспериментальных исследованиях на мышах с прививаемой опухолью молочной железы было доказано преимущественное развитие остеолитических метастазов скелета, сопровождающееся высокой экспрессией PTHrP [26]. PTHrP, паратиреоидный гормон (ПТГ), ИЛ-1, ИЛ-6 и ИЛ-11 участвуют в остеолизе, стимулируя выработку остеобластами и стромальными клетками активатора фактора транскрипции каппа В (RANK) соответственно, баланс экспрессии OPG и RANKL смещается в сторону последнего [10]. RANKL связывается со своим рецептором RANK на поверхности предшественников остеокластов, что приводит к дифференциации в зрелые остеокласты и началу резорбции кости. Резорбция костного матрикса высвобождает цитокины, стимулирующие опухолевый рост и продукцию PTHrP, который в свою очередь воздействует на остеобласты, снижая экспрессию OPG и повышая экспрессию RANKL. Последний стимулирует пролиферацию и дифференцировку остеокластов, усиливая резорбцию костного матрикса и высвобождение цитокинов [10, 25, 26].
Таким образом, во взаимодействии опухоли и костной ткани в пределах метастатического очага образуется так называемый «порочный круг», в результате которого формируются литические метастатические очаги в костях.
Остеобластические метастазы характеризуются избыточным образованием структурно неполноценной костной ткани и весьма характерны для метастазов рака предстательной железы. При этом морфологическом варианте первичной опухоли более чем у 90% больных диагностируются остеобластные костные метастазы [1,27]. Повышенная активность формирования костного матрикса определяется активацией остеобластов паракринными факторами: TGF-β, трансформирующий фактор роста-β и эндотелина-1. Ключевая роль в развитии остеобластических метастазов на сегодняшний день отводится эндотелину-1 (ЕТ-1), который является мощным стимулятором остеобластов и формирования костной ткани. Этот фактор секретируется клетками рака предстательной железы и рака молочной железы и способен стимулировать развитие остеобластических метастазов на моделях опухолей у мышей [28]. Однако, несмотря на характер остеобластического поражения кости, процесс формирования костной ткани сопровождается резорбцией костной ткани, что приводит к уменьшению прочности вновь образованной кости [29].
При смешанных метастазах наблюдается активация как остеокластов, так и остеобластов.
Таким образом, очевидно, что метастазирование солидных опухолей обусловлено целым рядом сложноорганизованных процессов и взаимодействий между опухолевыми клетками и костной тканью, образующих порочный круг взаимной стимуляции опухолевого роста и патологической перестройки кости [7, 10].
С учетом механизмов метастатического поражения большое внимание уделяется поиску современных подходов к предупреждению развития патологического процесса. Наряду с современными методами специальной терапии злокачественных новообразований и их метастазов (химио-, гормонотерапия, лучевое лечение и т.д.) появляются эффективные средства дополнительного лечения — бисфосфонаты. Так, препараты группы N-бисфосфонатов (азотсодержащих, таких как золедроновая, ризедроновая, аледроновая кислоты) оказывают наибольшее антирезорбтивное действие при метастазах в скелете [10, 30]. Последние данные о механизме действия N-бисфосфонатов позволяют утверждать их немаловажную роль в механизме антирезорбтивного эффекта.
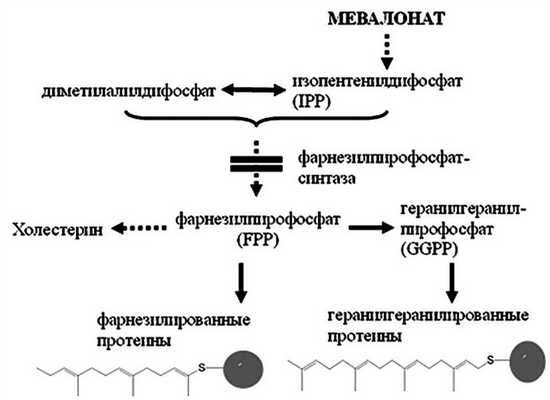
Ключевое значение для понимания механизма работы N-бисфосфонатов имела демонстрация того, что биохимический участок действия находится в пределах механизма мевалоната, известного благодаря его роли в биосинтезе холестерина и других стеринов. Основной целью N-бисфосфонатов является пероксисомальный фермент фарнезилпирофосфат-синтаза, играющий фундаментальную роль в функционировании и выживании остеокластов (рис. 2). Рисунок 2. N-бисфосфонаты ингибируют фермент фарнезилпирофосфат-синтазу, предотвращая, таким образом, пренилирование протеинов небольших ГТФаз, играющих существенную роль в функционировании и выживании остеокластов.
Ингибирование фермента фарнезилпирофосфат-синтазы блокирует синтез фарнезилпирофосфата (FPP), необходимой для модификации липидов (пренилирование). Пренилирование необходимо для правильной локализации субклеточной мембраны и функционирования сигнальных протеинов [31]. Ингибируя фарнезилпирофосфат-синтазу, N-бисфосфонаты предотвращают пренилирование вновь синтезированных небольших ГТФаз таким образом, что протеины аккумулируются в непренилированной форме. Небольшие ГТФазы представляют собой семейство сигнальных протеинов в функционировании остеокластов. В последнее время были проведены исследования, которые позволяют предположить, что антирезорбтивный эффект N-бисфосфонатов может быть следствием аккумуляции непренилированных небольших ГТФаз в активном состоянии (т.е. вызывая нехарактерную активацию сигнальных механизмов), а не результатом потери пренилированных белков [31, 32]. Начальный эффект N-бисфосфонатов, по-видимому, заключается в нарушении функции остеокластов и уменьшении резорбции остеокластами, а в итоге N-бисфосфонаты могут вызывать апоптоз, но апоптоз, по-видимому, не является обязательным для ингибирования, осуществляемого бисфосфонатами [33].
Обзор литературы показал, что в настоящее время продолжаются исследования механизмов развития метастатического поражения. При этом одной из наиболее важных задач является выбор оптимальной тактики комбинированного лечения больных для профилактики патологических изменений, происходящих в процессе костного обмена на фоне костных метастазов. Полученные результаты исследований патофизиологии разрушения костной ткани позволяют разрабатывать новые и усовершенствовать существующие методы специальной и дополнительной терапии, внедрять их в клиническую практику с целью улучшения результатов лечения и качества жизни пациентов.
Метастазы в костях
Метастазы в костях среди всех прочих локализаций вторичных злокачественных новообразований имеют самый благоприятный прогноз в отношении продолжительности жизни заболевшего. Процесс лечения иногда растягивается на годы, а при раке молочной и предстательной желёз - на десятилетие. Влияние костных поражений на качество жизни не столь позитивно, именно они обуславливают тот тяжелый и плохо поддающийся коррекции болевой синдром, который так пугает пациентов и их близких. Однако, наш опыт показывает, что метастазы в костях хорошо поддаются лечению. Хирург-онколог, Сергеев Петр Сергеевич
Какие злокачественные заболевания осложняются
метастазами в костях
Практически все злокачественные новообразования могут дать метастазы в костную систему, но более всего присущи раку молочной и предстательной железы, реже - раку легких и органов желудочно-кишечного тракта, очень нечасто развиваются при опухолях яичников и головного мозга. Замечено, что при метастазировании только в кости скелета, даже многоочаговом, но без поражения других органов и систем, у пациента гораздо выше вероятность прожить несколько лет, чем при метастазах в легкие, а тем более печень и головной мозг. Костные поражения трудно лечатся, эффект зачастую ограничивается стабилизацией опухолевой деструкции - разрушения кости, тем не менее, при умелом лечении это «замирание» рака может продолжаться несколько лет.
Какие кости поражаются при раке
Принципиально возможно развитие метастаза в любой кости скелета, но чаще всего опухолевые клетки задерживаются в костях с лучшим кровоснабжением, где всегда есть достаточное питание для продолжения неуправляемого деления. Очень редко метастазы образуются в мелких косточках кисти и стопы, но часты в обильно пронизанных сосудистой сетью костях таза, позвонках и ребрах, нередко поражают кости черепа, за исключением лицевого скелета. Наибольшую опасность для пациента несёт опухолевое поражение позвонков и трубчатых костей конечностей, когда в месте деструкции при обычной нагрузке случается перелом, лишающий возможности двигаться, а при патологическом переломе шейного позвонка высока вероятность паралича из-за сдавления спинного мозга отломками разрушенной опухолью кости.
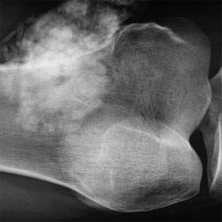
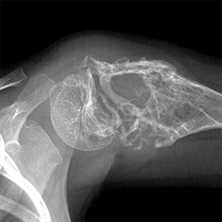
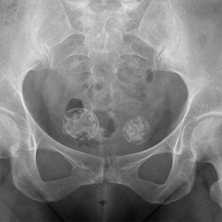
Какими бывают метастазы в костях
Раковые клетки разрушают ткань кости, вызывая её деструкцию, которая может проявляться как разрежением костной ткани с образованием бескостных участков, так и увеличением патологической, гораздо менее прочной и чётко структурированной костной массы.
- Деструкция с «разъеданием» костной структуры на рентгенограммах выглядит как дефект - «дырка», такой вариант метастазирования называют остеолитическим, что буквально означает «съеденная кость».
- При утолщении кости за счёт опухоли рентгенограмма выявляет «плюс ткань», тогда говорят об остеопластическом метастазировании.
- Как правило, у больного встречаются оба вида метастазов с превалированием одного из вариантов, в большинстве случаев остеолитического.
По распространённости выделяют:
- множественные - более десятка вовлечённых в процесс костей, но также обозначается и обширное метастатическое поражение только одной кости;
- единичные - до десяти очагов или не более десятка патологически изменённых костей;
- солитарный - единственный очаг.
Диагностика метастазов в костях
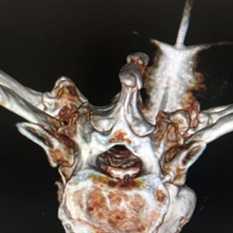
До «эры визуализации» деструктивные изменения скелета выявляли при рентгенологическом обследовании и остеосцинтиграфии - изотопном исследовании. Остеосцинтиграфия очень чувствительна, она обнаруживает крохотные опухолевые образования, не видимые на рентгенограммах, поэтому и сегодня она актуальна и обязательна для каждого онкологического пациента.
Рентгенография способна обнаружить очаг более сантиметра, КТ высокочувствительна, но уступает МРТ при необходимости параллельной визуализации прилежащих к кости мягких тканей и суставов. Наилучшая диагностика - ПЭТ и МРТ или КТ. Остеосцинтиграфия признана стандартным методом скрининга - диагностика для 100% больных раком, по местам накопления изотопа в виде «горячих точек» выполняется прицельное рентгенологическое или визуализирующее исследование - МРТ или КТ.
Динамическое наблюдение за течением метастазирования и оценка результатов лечения должны осуществляться одним способом, на одном аппарате и, желательно, одним и тем же специалистом. Если до начала терапии не удалось выполнить МРТ, а было сделано только КТ, то и оценивать итоги терапии надо по КТ
Клинические проявления метастазов в кости
В начальной стадии костное метастазирование проявляется болевым синдромом только у каждого шестого онкологического больного, у абсолютного большинства вначале процесса нет никаких признаков. Боль появляется при проникновении раковых клеток в обильно иннервированную покровную костную ткань - надкостницу, внутри кости нервных окончаний почти нет, поэтому и боли не бывает.
Считается, что остеолитические очаги чаще вызывают боли, а остеопластические протекают без симптомов, но могут проявляться выбуханием - «наростом» в месте поражения.
Неблагоприятное осложнение опухолевого поражение кости - патологический перелом в месте деструкции:
- Часто переломы позвонков без существенного смещения происходят незаметно для больного и выявляются при рентгенологическом обследовании.
- Шейные позвонки при переломе могут защемить спинной мозг, вызывая разнообразные нарушения двигательной активности.
- Не остаются незамеченными для пациента переломы конечностей, особенно бедра или плеча, сопровождающиеся усилением боли в месте деструкции и нарушением движений.
- Переломы ребер могут проявиться клиникой межреберной невралгии.
- Кости таза преимущественно ломаются в области лона или вертлужной впадины, как правило, боли невысокой интенсивности, но существенно изменяется походка.
Химиотерапия при метастазах в костях
Преимущественно при костных поражениях используют лекарственный метод - химиотерапию или гормонотерапию, для минимизации возможных осложнений в виде переломов и повышения концентрации кальция в крови дополнительно вводят бисфосфонаты. Бисфосфонаты помогают уменьшить болевой синдром.
Химиотерапия проводится длительно, частые контрольные обследования нецелесообразны, поскольку костная ткань на месте уничтоженной опухоли растет очень медленно. Практически всегда при химиотерапии достигается хороший обезболивающий эффект. При интенсивном болевом синдроме зону деструкции можно облучить, в обязательном порядке лучевой терапии подлежит метастазирование в шейные позвонки, что снижает вероятность перелома.
Операция при метастазах в костях
Хирургическое лечение при метастазировании в скелет преследует одну из двух целей:
- Радикальная операция - полное удаление раковых очагов;
- Паллиативная операция -восстановление функции кости после перелома.
Радикальное лечение возможно при отсутствии первичного рака и одиночном метастатическом поражении скелета. После стабилизации роста солитарного - единственного костного метастаза, с помощью курсов химиотерапии, ставится вопрос об оперативном лечении. Как правило, таким способом лечат поражения конечностей.
Сегодня есть возможность заменить протезом пораженные кости верхних и нижних конечностей, но чаще к операции прибегают при патологическом переломе, когда из-за обширной опухолевой деструкции маловероятно восстановление костной целостности. Операция сложная, требующая плановой подготовки, в том числе и нескольких предварительных курсов химиотерапии и долгого лекарственного лечения после операции.
Такие вмешательства выполняются специальной бригадой, владеющей навыками онкологов и травматологов-ортопедов, в специальной операционной, оснащенной рентгеновским оборудованием, но лучше - КТ-установкой. Опухоль разрушает не только кость, но и прорастает в окружающие мягкие ткани - мышцы, сухожилия и суставы, очень важно для будущего восстановления удалить всё поражённое раком, поэтому во время оперативного вмешательства возникает необходимость уточнения объективной реальности с помощью высокоточной КТ.
Современная онкологическая помощь требует высокоточного оборудования для диагностики, дорогостоящих лекарств и, обязательно, опытных специалистов, владеющих инновационными хирургическими методиками. Правильное лечение должен подбирать консилиум из нескольких специалистов, владеющих разными методами терапии. Мы подскажем, где это уже делается на высоком уровне и с хорошими результатами.
Метастазы в кости
Метастазы в костях могут развиться абсолютно при любом злокачественном процессе, для некоторых раков это практически обязательная локализация, при других заболеваниях — редкость. В метастатическом рейтинге первое место по частоте встречаемости достанется метастазам в лёгкие, второе — печеночным очагам и третье — скелетным метастазам.
Метастазы в костях трудно лечатся и обещают боли, тем не менее, скелетные очаги менее прочих локализаций опухоли сокращают жизнь, но способны испортить её переломом или сдавлением спинного мозга.
Какими могут быть метастазы в костях?
По клинико-рентгенологическим признакам все костные очаги подразделяют на три группы:
- остеобластические — с преобладанием уплотнения сверх физиологической меры, но дополнительно наросшая опухолевая ткань не придаёт кости прочности и может сдавливать проходящие по соседству нервы;
- остеолитические — превалирует разрушение структуры и вероятность перелома увеличивается по мере разрастания рака;
- смешанные — сочетание двух видов и это ситуация встречается чаще всего.
Практически не случает такого, чтобы у пациента были исключительно остеолитические или только остебластические очаги, как правило, диагностируется сочетание с превалированием либо разреженной литической, либо избыточной бластической структуры.
При каких раках развиваются?
Лидер среди всех злокачественных процессов, протекающих с метастатическим поражением скелета, миеломная болезнь — разрушение кости начинается в самом начале заболевания и в 100% клинических случаев отмечается множественная деструкция костной ткани.
При раке молочной и предстательной желёз у двух третей больных диагностируются скелетные метастазы, а патологоанатомические наблюдения выявляют вовлечение костей в злокачественный процесс практически у 90% пациентов. При раке молочной железы (РМЖ) превалируют смешанные и остеолитические варианты, при раке простаты — остеобластические.
Высокая частота метастазирования в кости отмечается при раке легкого, но при мелкоклеточном варианте — вдвое чаще и множественные костные дефекты, тогда как при немелкоклеточном — у 40% больных с тяготением к очагам единичным или солитарным, то есть единственному.
Каждый четвёртый, страдающий раком почки, имеет скелетные метастазы, при карциноме мочевого пузыря костные новообразования встречаются много реже.
При раке толстой кишки костное метастазирование выявляется у каждого восьмого больного, при раке желудка — не часто, поскольку раньше и обильнее рак поражает печень и брюшную полость. Рак кишечника тяготеет к мелкоочаговым и множественным вторичным образованиям.
Когда появляются скелетные метастазы?
При злокачественных процессах время появления метастазов в кости различается, тогда как скорость роста очага зависит исключительно от индивидуальных биологических характеристик опухолевой ткани, меняющихся под воздействием лечения и по мере раковой диссеминации.
При первичном обращении костные очаги при отсутствии других проявлений ракового процесса имеются едва ли у 20% пациентов, в подавляющем большинстве случаев опухолевое поражение костей признак диссеминации рака — распространения по системам или генерализации. При РМЖ, немелкоклеточной карциноме легких и раке толстой кишки именно так и происходит.
При раке предстательной железы нередко скелетная патология обнаруживается одновременно с опухолью простаты или в ближайшие сроки после диагностики неблагополучия в половой железе.
При карциноме почки часто сначала находят метастазы в костях и легочной ткани, а после обнаруживается первичная опухоль.
Какие отделы скелета поражаются чаще всего?
Локализация метастаза в кости определяется не нозологической принадлежностью первичной злокачественной опухоли, а функциональной нагрузкой и связанной с нею развитостью кровоснабжения. Множественные очаги в скелете более характерны для высоко агрессивного рака, единичные и тем более один метастаз свидетельствует в пользу благоприятного прогноза заболевания.
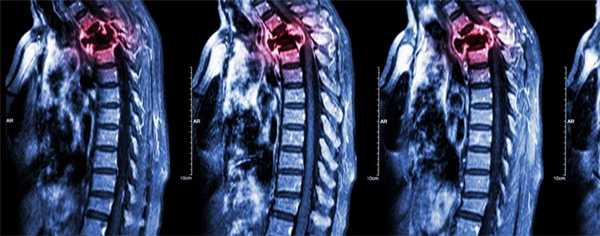
- Чаще всего вторичные отсевы рака возникают в обильно питаемых кровью губчатых костях — позвонках, причём преимущественно в испытывающих высокую нагрузку поясничных и грудных отделах позвоночника.
- Далее по частоте следуют метастазы в костях таза — почти половина всех случаев, типичные локализации — подвздошная и лонные кости.
- Вполовину реже отмечается метастазирование в костях черепа и нижней конечности, где превалирует поражение бедренной кости.
- Грудная клетка, преимущественно ребра и грудина, вовлекаются в злокачественный процесс практически в 30% случаев.
Клинические проявления костного метастазирования
Вопреки сложившимся мифам, скелетное метастазирование часто протекает без выраженной боли и даже вовсе без симптомов. Остеобластические очаги реже сопровождаются болевыми ощущениями, нежели остеолитические.
Опасные проявления метастатического костного поражения:
- гиперкальциемия — значительное повышение концентрации кальция из-за разрушения костного матрикса приводит к тяжелейшему состоянию, требующему коррекции метаболизма фактически реанимационными мерами;
- перелом — для возникновения достаточно разрушения половины поперечника кости или позвонка, каждому одиннадцатому пациенту с патологическим переломом необходима срочная хирургическая помощь;
- синдром сдавления или компрессии спинного мозга осколками сломанного грудного или поясничного позвонка осложняется тяжелыми неврологическими нарушениями ниже зоны повреждения;
- нарушение двигательной активности вплоть до паралича возможно при сдавлении спинного мозга в шейном отделе остеобластическим очагом или повреждении отломками при литическом разрушении.
Осложнения метастазирования в кости фатально отражаются на состоянии пациента и активно мешают проведению адекватного лечения, что может сократить срок жизни при безусловном отсутствии качества.
Почему возникает боль?
Боль обусловлена тремя причинами:
- разрушением раковым конгломератом обильно иннервированной надкостницы;
- раздражением в надкостнице болевых рецепторов биологически активными продуктами жизнедеятельности раковых клеток;
- вовлечением в метастатический узел нервных окончаний мышц.
Невыносимая боль далеко не всегда связана со скелетным метастазированием, как правило, это следствие высокой агрессивности опухолевых клеток в терминальной стадии процесса, когда в крови огромна концентрация биологически активных веществ — цитокинов, которые буквально «жгут» нервные окончания даже не поражённых опухолью тканей.
При высокой степени злокачественности первичной опухоли болевой синдром отмечается чаще и более интенсивный. Наиболее наглядный пример, распространенные и постоянные боли в абсолютно целых костях при аденокарциноме легкого, операция с удалением пораженного легкого полностью излечивает боль.
Как обнаруживают метастазы в кости?
Диагностика скелетных повреждений не сложная, но высокотехнологичная, начинают с изотопного обследования — остеосцинтиграфии, выявляющей минимальные раковые новообразования. Затем засвеченные изотопом «горячие очаги» подвергают рентгенографии или, что лучше, компьютерной томографии (КТ). ПЭТ — «королева» доказательств, к сожалению, дорогое исследование, поэтому для контроля эффективности терапии не очень подходит.

Для выявления очагов в скелете маркеры костной резорбции не подходят, в практической онкологии активного применения не нашли.
Анализы крови позволяют заподозрить опухолевое поражение костного мозга, что часто сопровождает метастазирование в грудину.
Лечение скелетных поражений
Можно ли вылечить метастазы в костях? Однозначно лечением можно продлить жизнь при хорошем самочувствии. С одной стороны, скелетные поражения — манифестация распространения рака по организму, с другой — признак относительно благоприятного прогноза заболевания при отсутствии опухоли в других тканях и висцеральных (внутренних) органах, что даёт годы жизни при стабилизации процесса.
На этапе костного метастазирования вопрос о радикальном лечении уже не стоит, но операция не исключается при благоприятной гистологической структуре и солитарном — единственном костном поражении. Так при раке легкого или почки с метастазом в плечевую кость или бедро можно выполнить одномоментное вмешательство с удалением больного органа и резекцией кости с протезированием, но после нескольких месяцев химиотерапии.
Химиотерапия — главный метод лечения костных поражений, лекарственная схема определяется первичной опухолью. При раке молочной и предстательной железы хорошие результаты демонстрирует гормональная терапия.
Дополнение химиотерапии локальным облучением позволяет повысить общий результат терапии, снять боль и уменьшить вероятность перелома. Так при поражении шейных позвонков лучевая терапия обязательна уже на первом этапе.
Операция необходима при угрозе сдавления (компрессии) спинного мозга поломанным позвонком, как правило, удаляется поражённая часть позвонка — ламинэктомия. При длительной — более полугода стабилизации в результате химиотерапии можно поставить вопрос об удалении поражённой кости конечности с заменой на протез, если больше нет других проявлений рака.
Зачем нужны бисфосфонаты?
Использование бисфосфонатов при метастатическом поражении скелета стало стандартом адекватной терапии.
Человеческие кости постоянно обновляются: остекласты разрушают, а остеобласты наращивают ткани, в норме процессы уравновешены, в присутствии злокачественной опухоли остеокласты приобретают избыточную активность. Бисфосфонаты по своему строению схожи с костным матриксом, поэтому после введения в организм направляются в кости, где губительно действуют на активизированные раковыми продуктами остеокласты, параллельно снимая боль и оберегая от переломов.
Бисфосфонатами можно лечиться около двух лет, при утрате чувствительности к ним аналогичную роль выполняет моноклональное тело деносумаб. Демосумаб и бисфосфонаты относят к остеомодифицирующим агентам (ОМА).
Для назначения ОМА недостаточно выявления «горячих» очагов при остеосцинтиграфии, их применяют при доказанном рентгенологическими методами опухолевом поражении.
Химиотерапия и ОМА — основные методы лечения скелетных поражений, но не единственные. Лечение костных метастазов должно быть комплексным, только комбинацией облучения и лекарств, с коррекцией метаболизма и присоединением паллиативной хирургии можно избавить от боли и вернуть пациенту активную жизнь.
Когда и что нужно и возможно в каждом конкретном клиническом случае онкологического заболевания знают специалисты нашей клиники. Узнайте больше, звоните:
Читайте также:
