Влияние соматостатина на секрецию поджелудочной железы. Регуляция уровня глюкозы
Добавил пользователь Владимир З. Обновлено: 01.02.2026
Поджелудочная железа - орган пищеварительной системы. Она выполняет внешнесекреторную (экзокринную) и внутрисекреторную (эндокринную) функции. Внешнесекреторная функция поджелудочной железы реализуется выделением панкреатического сока, который содержит ферменты, участвующие в пищеварении. Внутрисекреторная функция поджелудочной железы состоит в выработке гормонов, участвующих в регуляции углеводного, жирового и белкового обмена.
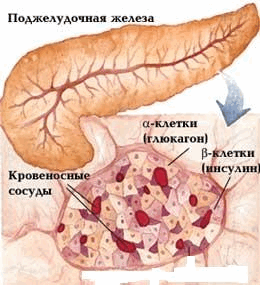
Эндокринная часть поджелудочной железы представлена панкреатическими островками, или островками Лангерганса. Островки состоят из клеток, в которых синтезируются гормоны.
- b-клетки продуцируют инсулин
- a-клетки продуцируют глюкагон
- D-клетки продуцируют соматостатин и гастрин
- РР-клетки продуцируют панкреатический полипептид.
Проинсулин - белок, который синтезируется в b-клетках островков поджелудочной железы. Он практически полностью превращается в инсулин после отщепления от него молекулы С-пептида. Небольшая его доля, которая не превратилась в инсулин, поступает в кровоток в неизмененном виде. Биологическая активность проинсулина гораздо ниже, чем инсулина. Чаще всего определение уровня проинсулина применяется в диагностике инсулино́м. Инсулино́ма - это опухоль b-клеток островков Лангерганса, бесконтрольно секретирующая инсулин.
С-пептид образуется из проинсулина. Он является показателем секреции инсулина. Период полувыведения С-пептида из кровотока 30-40 минут, что на порядок дольше, чем у инсулина, а его концентрация примерно в 5 раз больше концентрации инсулина. С-пептид полезно определять у пациентов, которые наблюдаются после удаления поджелудочной железы, для диагностики гипогликемических состояний, при подозрении на инсулино́му. Также С-пептид позволяет оценить уровень эндогенного инсулина, при приеме препаратов инсулина, или при наличии в крови антител к инсулину.
Глюкагон синтезируется a-клетками поджелудочной железы и является антагонистом инсулина. Его повышение служит сигналом для организма о необходимости повысить в крови уровень глюкозы. Это достигается путем распада гликогена до молекул глюкозы, или образование глюкозы альтернативным путём (глюконеогенез).
Гастрин стимулирует желудочную секрецию. Его концентрация изменяется в течение суток. После приема пищи концентрация гастрина увеличивается в 1,5-2 раза. Синтез гастрина стимулируется при снижении уровня соляной кислоты в желудке. Определение уровня гастрина применяется в диагностике и контроле лечения синдрома Золлингера-Эллисона, или гастриномы, при котором у 2/3 больных отмечается 10-кратное увеличение уровня гастрина в сыворотке натощак (>1000 пг/мл).
Действие соматостатина в рамках пищеварительной системы заключается в подавлении секреции гастрина, инсулина, глюкагона, пищеварительных ферментов. Он также подавляет секреторную активность других органов желудочно-кишечного тракта.
5. Гормоны поджелудочной железы. Нарушение функции поджелудочной железы
Поджелудочная железа - железа со смешанной функцией. Морфологической единицей железы служат островки Лангерганса, преимущественно они расположены в хвосте железы. Бета-клетки островков вырабатывают инсулин, альфа-клетки - глюкагон, дельта-клетки - соматостатин. В экстрактах ткани поджелудочной железы обнаружены гормоны ваготонин и центропнеин.
Инсулин регулирует углеводный обмен, снижает концентрацию сахара в крови, способствует превращению глюкозы в гликоген в печени и мышцах. Он повышает проницаемость клеточных мембран для глюкозы: попадая внутрь клетки, глюкоза усваивается. Инсулин задерживает распад белков и превращение их в глюкозу, стимулирует синтез белка из аминокислот и их активный транспорт в клетку, регулирует жировой обмен путем образования высших жирных кислот из продуктов углеводного обмена, тормозит мобилизацию жира из жировой ткани.
В бета-клетках инсулин образуется из своего предшественника проинсулина. Он переносится в клеточные аппарат Гольджи, где происходят начальные стадии превращения проинсулина в инсулин.
В основе регуляции инсулина лежит нормальное содержание глюкозы в крови: гипергликемия приводит к увеличению поступления инсулина в кровь, и наоборот.
Паравентрикулярные ядра гипоталамуса повышают активность при гипергликемии, возбуждение идет в продолговатый мозг, оттуда в ганглии поджелудочной железы и к бета-клеткам, что усиливает образование инсулина и его секрецию. При гипогликемии ядра гипоталамуса снижают свою активность, и секреция инсулина уменьшается.
Гипергликемия непосредственно приводит в возбуждение рецепторный аппарат островков Лангерганса, что увеличивает секрецию инсулина. Глюкоза также непосредственно действует на бета-клетки, что ведет к высвобождению инсулина.
Глюкагон повышает количество глюкозы, что также ведет к усилению продукции инсулина. Аналогично действует гормоны надпочечников.
Вегетативная нервная система регулирует выработку инсулина посредством блуждающего и симпатического нервов. Блуждающий нерв стимулирует выделение инсулина, а симпатический тормозит.
Количество инсулина в крови определяется активностью фермента инсулиназы, который разрушает гормон. Наибольшее количество фермента находится в печени и мышцах. При однократном протекании крови через печень разрушается до 50 % находящегося в крови инсулина.
Важную роль в регуляции секреции инсулина выполняет гормон соматостатин, который образуется в ядрах гипоталамуса и дельта-клетках поджелудочной железы. Соматостатин тормозит секрецию инсулина.
Активность инсулина выражается в лабораторных и клинических единицах.
Глюкагон принимает участие в регуляции углеводного обмена, по действию на обмен углеводов он является антагонистом инсулина. Глюкагон расщепляет гликоген в печени до глюкозы, концентрация глюкозы в крови повышается. Глюкагон стимулирует расщепление жиров в жировой ткани.
Механизм действия глюкагона обусловлен его взаимодействием с особыми специфическими рецепторами, которые находятся на клеточной мембране. При связи глюкагона с ними увеличивается активность фермента аденилатциклазы и концентрации цАМФ, цАМФ способствует процессу гликогенолиза.
Регуляция секреции глюкагона. На образование глюкагона в альфа-клетках оказывает влияние уровень глюкозы в крови. При повышении глюкозы в крови происходит торможение секреции глюкагона, при понижении - увеличение. На образование глюкагона оказывает влияние и передняя доля гипофиза.
Гормон роста соматотропин повышает активность альфа-клеток. В противоположность этому гормон дельта-клетки - соматостатин тормозит образование и секрецию глюкагона, так как он блокирует вхождение в альфа-клетки ионов Ca, которые необходимы для образования и секреции глюкагона.
Физиологическое значение липокаина. Он способствует утилизации жиров за счет стимуляции образования липидов и окисления жирных кислот в печени, он предотвращает жировое перерождение печени.
Функции ваготонина - повышение тонуса блуждающих нервов, усиление их активности.
Функции центропнеина - возбуждение дыхательного центра, содействие расслаблению гладкой мускулатуры бронхов, повышение способности гемоглобина связывать кислород, улучшение транспорта кислорода.
Нарушение функции поджелудочной железы.
Уменьшение секреции инсулина приводит к развитию сахарного диабета, основными симптомами которого являются гипергликемия, глюкозурия, полиурия (до 10 л в сутки), полифагия (усиленный аппетит), полидиспепсия (повышенная жажда).
Увеличение сахара в крови у больных сахарным диабетом является результатом потери способности печени синтезировать гликоген из глюкозы, а клеток - утилизировать глюкозу. В мышцах также замедляется процесс образования и отложения гликогена.
5. Поджелудочная железа
Поджелудочная железа выполняет две функции: экзокринную (синтез и секреция пищеварительных ферментов) и эндокринную (синтез и секре ция гормонов). Эндокринную функцию выполняют особые участки поджелудочной железы - островки Л ангерганса, занимающие около 1% ее объема. Эндокринные клетки островков Лангерганса секретируют в кровь:
- инсулин ( б ет а -клет ки );
- глюкагон ( а ль ф а -к лет ки );
- сомат ост ат ин (делы п а -к лет ки ).
По химической структуре эти гормоны относятся к белково-пептидным, а их основная физиологическая роль - регуляция углеводного обмена.
5.1. Гормоны поджелудочной железы
I. Инсулин — основной по количеству и значению гормон остров ков Лангерганса.
Эффекты дейст вия инсулина:
1) гипогликем ическое дейст вие: инсулин - единственный гормон, снижающий концентрацию глюкозы в крови . В частности, инсулин:
• повышает проницаемость клеточных мембран для глюкозы; инсулин регулирует поступление глюкозы во все ткани, исключая ЦНС, нейро ны которой являются инсулиннезависимыми - могут потреблять глюкозу в отсутствие инсулина;
• усиливает утилизацию глюкозы в клетках - ее превращение в гликоген и жиры;
2) анаболическое действие : инсулин стимулирует синтез и тормозит
распад гликогена, жиров и белков, РНК, ДНК (анаболический эффект).
2. Глюкагон — антагонист инсулина - повышает концентрацию глюкозы в крови, усиливая глюконеогенез и расщепление гликогена в печени. Г люкагон также стимулирует распад белков и жиров.
Регуляция секреции инсулина и глюкагона
В основном, осуществляется глюкозой по принципу отрицательной обратной связи. Увеличение концентрации глюкозы в крови приводит к увеличению секреции инсулина и снижению секреции глюкагона; наоборот, снижение концентрации глюкозы тормозит секрецию инсулина и усиливает секрецию глюкагона. Таким образом концентрация глюкозы поддерживается на постоянном уровне (рис. 11).
Рис. 11. Регуляция секреции инсулина и глюкагона.
Дополнительную петлю отрицательной обратной связи в этой cистеме образуют инсулин и глюкагон: глюкагон стимулирует секрецию инсулина, а инсулин тормозит секрецию глюкагона. Кроме того, секрецию обоих гормонов подавляет соматостатин дельта-клеток островков Лангерганса.
Следует добавить, что секрецию инсулина усиливают некоторые гормоны желудочно-кишечного тракта (гастрин, секретин и др.); 2) парасимпатические волокна блуждающего нерва (через Механорецепторы). Наоборот, секрецию инсулина угнетают 2) симпатические волокна (через арадренорецепторы).
5.2. Регуляция концентрации глюкозы в крови
Нормальная концентрация глюкозы в плазме крови (натощак) составляет 3,5-5,5 ммоль/л. В регуляции концентрации глюкозы в крови участвуют несколько гормонов.
Повышают концентрацию глюкозы несколько гормонов (их называют «контринсулярными»): глюкагон, глю кокортикоиды, адреналин, т ироидны е горм оны , соматотропный гормон. Секреция этих гормонов усиливается при гипогликемии или при стрессе. В результате, концентрация глюкозы в крови повышается за счет гликогенолиза (распада гликогена) и глюконеогенеза - синтеза глюкозы из неуглеводных соединений: жирных кислот (их концентрация увеличивается вследствие липолиза) и, в крайнем случае, аминокислот (образуются при распаде белков). Выходящая в кровь глюкоза потребляется, в первую очередь, нейронами ЦНС, которые с одной стороны, практически не имеют собственных запасов гликогена и поэтому очень чувствительны к гипогликемии, а с другой стороны, способны потреблять глюкозу в отсутствии инсулина, секреция которого при стрессе снижена.
Патология. Нарушение регуляции уровня глюкозы в крови может приводить к развитию сахарного диабета, основным признаком которого является стойкая гипергликемия (концентрация глюкозы в крови натощак превышает 7 ммоль/л). Повышается также концентрация глюкозы в первичной моче, вследствие чего замедляется реабсорбция воды в почках, и увеличивается диурез - количество вторичной мочи может превышать 5 л/сут.
Механизмы развития сахарного диабета разнообразны и могут быть объединены в две группы:
1 ) абсолютная недостаточность инсулина - снижение секреции инсулина вследствие генетических дефектов, иммунных поражений (3-клеток островков Лангерганса, заболеваний и повреждений поджелудочной железы, недостаточности питания (прежде всего белкового) и других причин;
2) относительная недостаточность инсулина - секреция инсулина в этом случае не снижается, или даже повышается; гипергликемия при этом связана со снижением чувствительности тканей к инсулину вследствие изменения рецепторов инсулина, ожирения, гиперсекреции контринсулярных г ормонов и других причин. Например, сахарный диабет может развиваться при акромегалии (гиперсекреция СТГ), синдроме Иценко-Кушинга (избыток глюкокортикоидов), гипертирозе (гиперсекреция Т3, Т4), феохромоцигоме (опухоль, продуцирующая катехоламины), глюкагономе (опухоль, продуцирующая глюкагон).
3.3. Соматостатин: химическая природа, регуляция секреции, механизм действия, роль в обмене.
Соматостатин - пептид из 12 аминокислот, он образуется также в островках поджелудочной железы и контролирует высвобождение глюкагона и инсулина, а также гормонов желудочно-кишечного тракта. Существует в двух биологически активных формах, происходящих от одного предшественника и различающихся длиной N-конца: SST-14 (14 аминокислот: AGCKNFFWKTFTSC, между остатками цистеина дисульфидная связь) и SST-28 (28 аминокислот). Помимо соматостатинов, близкородственные пептиды кортистатин (PCKNFFWKTFSSCK), триттен (13 N-конечных аминокислот SST-28) и уротензин II (ETPDCFWKYCV) также принимают участие в регуляции соматостатинэргической системы
Наибольшее количество соматостатина содержится в срединном возвышении, но значительные концентрации присутствуют и в других областях гипоталамуса, равно как и в таламусе, коре мозга, преоптической области, среднем и спинном мозге. Полная деафферентация медиобазального гипоталамуса приводит к ускорению роста и повышению уровня СТГ в плазме, но концентрация соматостатина в деафферентированной области не регистрировалась. Не ясно, осуществляется ли предполагаемая нейро-трансмиттерыая регуляция секреции СТГ путем изменения концентрации соматостатина или пока еще гипотетического рилизинг-фактора СТГ. Кроме того, введение СТГ тормозит его собственную секрецию. Этот эффект мог бы опосредоваться изменением концентрации соматостатина или рилизинг-фактора СТГ, влияющих на гипофиз, но мог бы определяться и теми изменениями концентрации соматостатина, которые действуют на нервные факторы, регулирующие секрецию СТГ. Относительно парагипофизарного влияния соматостатина на мозг существует мало данных. Подобно ТРГ и ГнРГ, соматостатин при непосредственной аппликации на определенную популяцию одиночных нейронов как в гипоталамусе, так и в других областях (такие, как кора мозга и мозжечка и спинной мозг) может приводить к значительному снижению частоты нейрональных разрядов.
Соматостатинсодержащие клетки обнаружены в спинальных ганглиях, а нервные волокна, содержащие соматостатин, выявляются в дорсальных рогах спинного мозга, периферических симпатических нейронах, превертебральных ганглиях, нижнем и верхнем мезентериальных узлах. В этой связи интерес представляют работы последних лет, в которых показано, что соматостатин вовлечен в такие важные функции мозга, как сознание, память, двигательная активность, вегетативная и эндокринная регуляция. M-F. Chesselet и соавт. (1995) показали, что соматостатин и его мРНК экспрессируются в полосатом теле мозга, которое вовлечено в двигательную активность и поведенческие реакции организма. Ишемия этих участков мозга увеличивает экспрессию гена соматостатина. И, наоборот, уровень соматостатиновой мРНК снижается после применения галоперидола, антипсихотических препаратов, которые способствуют развитию экстрапирамидных симптомов. Авторы справедливо считают, что выявляемая повышенная экспрессия гена соматостатина при патологических состояниях имеет прямое отношение к появлению при этом различных клиничесих симптомов. Кроме того, перерыв дофаминергической иннервации также приводит к повышению экспрессии гена соматостатина в этой области, что является дополнительным подтверждением участия соматостатина в нарушении двигательных реакций, столь характерных для болезни Паркинсона.
Из 52 н. п. синтетического гена 42 пары составляли структурный ген гормона, а остальные служили для присоединения синтетического гена к плазмиде pBR322, а также к сегменту лактозного оперона (lac) из генома Е. coliили к β-галактозидазному гену. Такую синтетическую чужеродную ДНК встраивали непосредственно за бактериальным геномом (или внутри его) после расщепления ДНК рестрикционными эндонуклеазами с образованием в результате трансляции гибридного белка.
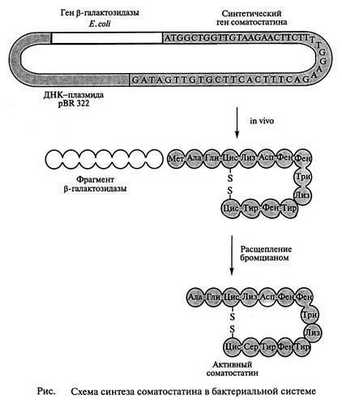
Основные этапы генно-инженерного синтеза соматостатина показаны на Синтетический ген соматостатина был встроен в плазмиду pBR322 E. Coli вблизи конца гена, кодирующего фермент β-галактозидазу. Между двумя генами был помещен кодон метионина. После выделения рекомбинантной плазмиды в бактериальную клетку кишечная палочка стала синтезировать гибридный белок. Часть его (соматостатин) затем отщепляли от β-галактозидазы BrCN. Такой сложный способ получения гормона был необходим, так как соматостатин, синтезированный в виде свободных молекул, быстро деградирует под действием бактериальных протеаз. Первый синтез соматостатина генно-инженерным способом был осуществлен в 1977 ᴦ. Бойером. Выход гормона составил 10 000 молекул на одну клетку. Из 100 г биомассы Е. coli, выращенной в ферментере объёмом 8 л, удалось вьщепить 5 мг соматостатина, ᴛ.ᴇ. столько, сколько можно его вьщепить из 100 г овечьих мозгов.
Выделение соматостатина происходит при участии автономной нервной системы в ответ на поступление жиров и аминокислот с пищей.
Соматостатин оказывает свое биологическое влияние через комплексирование с рецепторами, расположенными на мембранах клеток. В настоящее время различают 5 типов рецепторов к соматостатину, которые неодинаково экспрессируются как в тканях различных областей ЦНС, так и в периферических тканях. Все типы рецепторов экспрессируются в передней доле гипофиза и в гипоталамусе, что указывает на участие этих областей в модуляции секреции гормона роста. M. Berelovitz и соавт. (1995) показали, что сахарный диабет и депривация пищи приводят к уменьшению мРНК рецепторов к соматостатину 1, 2 и 3-го типа в гипофизе примерно на 80% по сравнению с контрольными животными, получающими нормальное питание. При этом количество мРНК рецепторов 4 и 5 типа остается без изменений. Также не изменяется количество мРНК всех видов рецепторов в гипоталамусе. В гипофизе диабетических крыс сниженное количество мРНК рецепторов 1, 2 и 3 типа на 50-80% по сравнению с контрольными животными восстанавливается при проведении инсулинотерапии, но только в отношении мРНК рецепторов 1 типа. Экспрессия мРНК рецепторов 4 типа в гипофизе и всех четырех типов в гипоталамусе при этом остается без изменений. Экспрессия же рецепторов 5 типа в гипофизе, сниженная при диабете на 70% и на 30%, в гмпоталамусе восстанавливается при введении инсулина. Эти исследования четко показывают взаимосвязь количества рецепторов к соматостатину с состоянием обмена веществ. Исходя из структуры и фармакологических свойств рецепторы к соматостатину разделяют на две группы (два семейства): к первой группе относятся рецепторы 2, 3 и 5-го типа, которые раньше по фармакологическим характеристикам относили к соматостатиновым рецепторам 1-го типа; ко второй группе относятся рецепторы 1-го и 4-го типа, ранее называемые соматостатиновыми рецепторами 2-го типа. Таким образом, исследования показали, что соматостатиновые рецепторы относятся к группе с 7 трансмембранными фрагментами и кодируются генами, расположенными на различных хромосомах. Ген рецептора 1-го типа локализуется на 14-й; 2-го типа-на 17-й; 3-го типа-на 22-й; 4-го типа-на 20-й и 5-го типа - на 16-й хромосоме. Рецепторы 1-4-го типа практически эквивалентно комплексируются с соматостатином -14 и 28, тогда как рецепторы 5-го типа почти селективно комплексируются с соматостатином, имеющим структуру, включающую 28 аминокислот. Установлена различная аффинность рецепторов к соматостатину и его аналогам. Так, аналог соматостатина октреотид (SMS 201-995) взаимодействует с рецепторами 2 и 3 типа, очень незначительно с рецепторами 5-го типа. Другой аналог соматостатина - соматулин (BIM 23014) комплексируется с рецепторами 2-го и 5-го типа и лишь незначительно с рецепторами 3-го типа.
Соматостатин оказывает влияние на моторную и секреторную функции пищеварительной системы, ее кровообращение и кишечную абсорбцию. Он задерживает эвакуацию желудочного содержимого, угнетая высвобождение мотилина - гормона, стимулирующего моторику желудочно-кишечного тракта, снижает сократитильную активность желчного пузыря путем торможения действия холецистокинина. У накормленных животных соматостатин тормозит высвобождение гастрина и холецистокинина, наблюдаемое после приема пищи.
Соматостатин угнетает секрецию поджелудочной железой инсулина и глюкагона. Это действие распространяется на обе фазы высвобождения инсулина, вызванного глюкозой, толбутамидом, глюкагоном или секретином. Из-за короткого периода полураспада соматостатина (около 4 мин) его тормозящее влияние заканчивается вскоре после прекращения инфузии. Угнетая секрецию глюкагона, соматостатин понижает концентрацию глюкозы в периферической крови путем уменьшения выхода ее из печени в воротную вену. Однако после внутривенной нагрузки глюкозой или длительного введения соматостатина вместо ожидаемого снижения уровня глюкозы в крови наблюдается гипергликемия, что объясняется одновременным значительным угнетением секреции инсулина.
В настоящее время доказаны следующие влияния соматостатина: 1) ингибирование секреции гастрина, секретина, ТТГ, СТГ, инсулина, глюкагона, мотилина, глицентина, ВИП, ренина; 2) угнетение секреции соляной кислоты и пепсина желудком, уменьшение моторики желудка, ингибирование секреции бикарбонатов и ферментов поджелудочной железой, снижение абсорбции в кишечнике, уменьшение кровотока на всем протяжении желудочно-кишечного тракта, снижение секреции и транспорта желчи.
В связи с тормозящим влиянием соматостатина на секрецию СТГ, глюкагона и инсулина высказывались предположения о возможности его использования в лечении сахарного диабета. Оказалось, однако, что соматостатин, угнетая секрецию инсулина, приводит к развитию еще более выраженной инсулиновой недостаточности. Большие надежды возлагались на получение аналогов соматостатина, обладающих исключительным влиянием на ингибирование секреции СТГ и глюкагона и интактным в отношении влияния на секреции инсулина. Полученный аналог соматостатина октреотид обладает рядом преимуществ по сравнению с соматостатином: имеет длительный период полураспада, что позволяет применять его 2-3 раза в сутки; ингибирует патологическую секрецию многих гормонов и может применяться при различных патологических состояниях, включая випому, карциноидный синдром, низидиобластоз, гастриному, соматотропиному (акромегалия). Кроме того, опубликованы данные о применении октреотида при тиротропиноме, желудочном кровотечении, перфорирующей язве желудка, глюкагономе, диарее как у детей, так и у взрослых.
Физиология человека и животных
9. Эндокринная функция поджелудочной железы и ее гормоны (инсулин, глюкагон, соматостатин)
Поджелудочная железа относится к железам смешанной секреции. Эндокринная ее часть представлена так называемыми островками Лангерганса (около 2 млн), в которых различают альфа-, бета- и дельта-клетки, вырабатывающие гормоны, которые регулируют углеводный обмен. Для нормального функционирования островков Лангерганса необходимо наличие тиреоидных гормонов и кортикостероидов.
В a-клетках (25% клеток островков) синтезируется гормон глюкагон (29 аминокислот) при активации центра голода в переднем гипоталамусе (в ответ на уменьшение уровня глюкозы в крови). Симпатическая стимуляция также увеличивает синтез глюкагона. Глюкагон действует через цАМФ-аденилатциклазу и усиливает гидролиз гликогена в печени с образованием глюкозы (гликогенолиз), что приводит к увеличению уровня глюкозы в крови.
В b-клетках (60 % клеток островков) вырабатывается инсулин (две пептидные цепи по 21 и 30 аминокислот, соединенные двумя дисульфидными мостиками) в ответ на подъем уровня глюкозы. Присутствие глюкозы в желудочно-кишечном тракте стимулирует образование в нем регуляторных пептидов типа энтероглюкагона (глюкагоноподобный пептид-1), который с кровью поступает в поджелудочную железу и стимулирует в ней секрецию инсулина.
Эффекты инсулина разделяют на быстрые (секунды), медленные (минуты) и отсроченные (часы).
Быстрые эффекты: способствует транспорту глюкозы через клеточные мембраны внутрь клетки (способствуя перемещению молекул переносчика глюкозы на поверхность плазматической мембраны), а также усиливает превращение глюкозы внутри клетки в резервные жиры и гликоген. Инсулин одновременно влияет на многие биохимические процессы, облегчающие липогенез и тормозящие глюконеогенез.
Медленные эффекты: улучшает проникновение аминокислот в клетки, усиливает синтез клеточных белков и тормозит их распад, обеспечивая положительный азотистый баланс.
Отсроченные эффекты: усиливает транскрипцию генов и трансляцию мРНК, активирует процессы клеточного деления.
В дельта-клетках островков Лангерганса вырабатывается соматостатин, который ингибирует секрецию и инсулина, и глюкагона, уменьшает всасывание глюкозы в желудочно-кишечном тракте, ограничивая таким образом эффекты и инсулина, и глюкагона, а также панкреогастрин, который стимулирует секрецию соляной кислоты в желудке.
Читайте также:
- Эккринная акроспирома века глаза: признаки, гистология, лечение, прогноз
- Диагностика метастазов во внутригрудные лимфатические узлы на рентгене, КТ, МРТ
- Хроническое головокружение: причины, тактика ведения пациента
- Киста общего желчного протока и недостаток антитрипсина. Геморрагические заболевания
- Блестящий лишай у ребенка
