Врожденная вирилизирующая гиперплазия коры надпочечников: причины и механизмы развития
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Гиперплазия надпочечников - очень опасная патология. Это обусловлено особенностями функции парных желез. Они продуцируют особые гормоны - глюкокортикоиды, андрогены, альдостерон, адреналин, норадреналин, - которые, в свою очередь, регулируют жизнедеятельность организма человека.
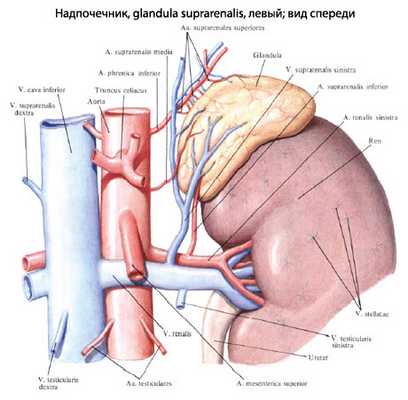
Гиперплазия - это чрезмерное и быстрое увеличение тканей клеток. Если подобное происходит с органом, он сохраняет свою форму, но приобретает значительно больший объем. Надпочечники состоят из коры и мозгового вещества. Патологический процесс при гиперплазии чаще всего происходит в коре надпочечников. В мозговом веществе чаще всего диагностируют различного рода опухоли.
В большинстве случаев болезнь врожденная, носит наследственный характер или может возникнуть как следствие разного рода неблагоприятных факторов, как внутренних, так и внешних. Также гиперплазия надпочечников может быть сопутствующей патологией некоторых заболеваний. Ее выявляют у 40% больных с синдромом Кушинга, который диагностируется в старческом или даже в пожилом возрасте. Если наличествует узловая форма гиперплазии, то выявляют одно или несколько новообразований, величина которых может достигать нескольких сантиметров.
Причины гиперплазии надпочечников
Причины возникновения заболевания обусловлены типом патологии. Если во время беременности у будущей матери наблюдались тяжелые формы функциональных расстройств организма, то у ребенка могут выявить врожденные патологии.
Гиперплазия надпочечников может быть нескольких видов:
- Гипертоническая.
- Вирильная.
- Сольтеряющая.
Вирильный тип обусловлен активностью секрета андрогена, что приводит к заметному увеличению размеров наружных половых органов. Кроме того, гораздо раньше и в большем количестве появляются оволосение, акне, очень активно развивается мускулатура. Гипертонический подтип диагностируется, если слишком активно вырабатываются андрогены и минералокортикоиды. Этот процесс отрицательно влияет на сосуды глазного дна и почек и приводит к развитию гипертензионного синдрома.
Сольтеряющий тип гиперплазии вызывается увеличенной выработкой андрогенов при недостатке прочих гормонов, которые продуцирует кора надпочечников. Такой тип изменений приводит к гипогликемии и гиперкалиемии. Они, в свою очередь, опасны тем, что вызывают обезвоживание организма, потерю веса и рвоту.
Гиперплазию надпочечников могут спровоцировать и следующие факторы:
- стресс,
- нервные и психологические перегрузки,
- нестабильное эмоциональное состояние.
Они могут привести к переизбытку кортизола - важнейшему гормону среди глюкокортикоидов.
Симптомы
При болезни отмечаются сбои в процессах обмена веществ в организме и обнаруживаются симптомы, обусловленные недостатком или, наоборот, увеличением того или иного глюкокортикоида.
При неклассических типах гиперплазии выявляют такие симптомы:
- Рано вырастают волосы на лобке и в подмышечной зоне.
- Слишком высокий для своего возраста рост.
- Чрезвычайно большое количество андрогенов. - терминальное оволосение тела.
- Слишком рано закрываются ростковые зоны.
- Отсутствуют месячные.
- Бесплодие.
- Акне.
- Залысины на висках.
Проявления гиперплазии надпочечников очень разные и зависят от того, какой патологией вызваны. Чаще всего врачи выявляют такие:
- Перепады артериального давления.
- Атрофия и онемение мышц.
- Диагностика диабета.
- Увеличение веса, «луноподобное» лицо.
- Появление растяжек на животе и бедрах.
- Обнаружение остеопороза.
- Психические изменения (ухудшается память, психоз и др.).
- Болезни ЖКТ.
- Снижение иммунитета.
Если человек часто испытывает жажду и позывы к мочеиспусканию ночью, это должно быть причиной скорейшего обращения к врачам.
Узелковая гиперплазия надпочечника
При синдроме Кушинга 40 пациентов из ста получают диагноз «двухсторонняя гиперплазия надпочечников». Узелки становятся 2-4 см в размере. Иногда это единичные образования, иногда — множественные. Во многих случаев строение характеризуется как дольчатое. Болезнь обнаруживают в основном у людей в возрасте. Узелковая гиперплазия надпочечника становится причиной роста автономной аденомы.
Этот вид гиперплазии является наследственным, передается по аутосомно-доминантному типу. Нет характерной симптоматики. Предположительно, патогенез имеет аутоиммунную основу. Чем старше пациент, тем более выражена клиническая картина. Возможные симптомы:
- симптоматика слизистого нейрофиброматоза
- синдром Карнея (на коже пятнистые пигменты)
- дисфункции проведения и возбуждения нейронов мышечных структур, что выражается слабостью в теле и судорогами
- головокружения
- головные боли
- мельтешение «мушек» перед глазами
- дисфункция почек
Диффузная гиперплазия надпочечников
Гиперплазия диффузного вида характеризуется сохранением формы надпочечников и образованием 1 или большего количества узелков. УЗИ почти не применяется для диагностики, поскольку не дает достоверных точных результатов. А методы КТ и МРТ актуальны на сегодняшний день для обнаружения патологии. Обнаруживают гипоэхогенные структуры треугольной формы и окружением из жировой клетчатки.
Гиперплазия надпочечников может быть смешанной формы: диффузно-узелковой. У человека проявляются такие симптомы:
- панические атаки
- слабость в теле, даже после хорошего отдыха , периодически проявляющаяся
- лишний вес
- излишнее количество волос на теле и проч.
Нодулярная гиперплазия надпочечников
Нодулярная гиперплазия надпочечников также известна как узловая. Большинство больных находятся в детском или подростковом возрасте. Болезнь имеет связь с синдромом Иценко-Кушинга и гиперкортицизмом. Причины: разлад деятельности надпочечников или прием излишнего количества ГКС.
- мышечная атрофия (на нижних конечностях преимущественно)
- неравномерное ожирение (лицо, грудная клетка, абдоминальный жир, шея)
- остеопороз груди и поясницы
- компрессионные переломы с сильной болью
- тонкая и очень сухая кожа
- сосудистый рисунок на кожных покровах
- формирование стриев фиолетового или багрового оттенка
- зоны с гиперпигментацией
- депрессия и заторможенность, но может быть и противоположное состояние: очень сильной радости и эмоциональности
- нарушения биения сердца
- отсутствие менструального цикла
- большое количество волос на теле у женщины
Если очень рано обнаружить болезнь и правильно лечить, прогноз будет благоприятным.
Гиперплазия коры надпочечников
Вместе с гиперплазией коры данного органы может быть также расстройство выработки гормонов, которые влияют на половую сферу человека. Врожденная патология возникает из-за ненормальных изменений в генах, что ведет к нарушению выработки такого гормона как кортизол. Снижается его уровень в организме, а в крови увеличивается АКГТ, фиксируют двухстороннюю гиперплазию.
- пигментация зоны внешних половых органов выше нормы
- превалируют мужские черты
- появляются угри
- в раннем возрасте начинают расти волосы под мышками и на лобке больного
- критические дни первый раз начинаются в позднем возрасте
Заболевание напоминает опухоль надпочечников. Потому важно проверить уровень гормонов в организме, для чего исследуют кровь и мочу пациента.
Врожденная гиперплазия надпочечников
Течение врожденной гиперплазии может быть классическим или неклассическим. К первому типу относят липоидную форму, диффузную, с выраженной потерей соли и с недостатком 21-гидроксилазы. Случаи липоидной гиперплазии надпочечников фиксируют очень редко, в организме не хватает стероидных гормонов и 20.22 десмолазы, что часто кончается летально. Если же больной малыш не умер, у него значительно тормозится половое развитие, а также фиксируют тяжелую недостаточность органа. При врожденной патологии с солевой потерей, когда в организме есть дефицит 3β-гидроксистероиддегидрогеназы, у младенцев женского пола могут появиться мужские внешние половые органы. А мальчики при такой патологии очень похожи на детей противоположного пола.
Диффузная врожденная гиперплазия надпочечников развивается с дефицитом 17α-гидроксилазы, такие случаи весьма редки. У детей развивается гипотония, а также нехватка калия в организме. У больных женского пола задерживается половое развитие, а для больных мужского пола характерны проявления так называемого псевдогермафродитизма.
Врожденная гиперплазия надпочечников в большинстве случаев выявляется после рождения или же на протяжении 12-24 месяцев после рождения. В основном патология характерна для девочек. Страдает не только половая сфера, но и другие системы в организме. Предотвратить печальные последствия может только ранняя диагностика и профессиональная терапия.
Диагностика
Врач должен произвести клинический осмотр, назначить лабораторные исследования, в том числе на гормоны, а также биохимию. Определяют функциональные показатели надпочечников по специальным методикам, возможно функциональное тестирование. Среди лабораторных методов выделяют РИА и ИФА. При проведении радиоиммунологического анализа определяют свободный кортизол в моче больного и его крови. При проведении ИФА исследуют сыворотку крови на количество присутствующих гормонов.
Для диагностики гиперплазии надпочечников применяют рентгенографию, включая аортографию, ангиографию и томографию. На сегодня форму и размер надпочечника можно определить при помощи радионуклидного сканирования, а также МРТ. В части случаев врачи говорят о необходимости аспирационной пункции, которая проводится под контролем УЗИ.
Лечение
Лечение проводится почти всегда гормональными средствами. До сих пор не определена ведущая тактика лечения, которая дает результат в большинстве случаев. Применяют глюкокортикоиды:
Также актуальны комбинации данных препаратов. При нехватке соли в организме (выше описан такой тип гиперплазии надпочечников) терапия проводится минералокортикоидами, а суточное потребление соли увеличивают до 1-3 грамм. Чтобы у больных подросткового возраста нормально формировались вторичные половые признаки, мальчикам назначают терапия андрогенами, а девочкам лечение эстрогенами.
В тяжелых случаях патологии прибегают к хирургическим методам. Они необходимы, если обнаружены наружные половые органы, которые нельзя дифференцировать как мужские или женские. Половые признаки следует привести в норму, пока малышу нет и одного года. Если же его состояние тяжелое, коррекцию проводят в более позднем возрасте.
Профилактика
Если у вас в семье были случаи врожденной гиперплазии, нужно обратиться к квалифицированному генетику. Для профилактики важно пренатальное диагностирование (диагностика, когда ребенок находится еще в утробе матери). Проводят биопсию хориона в первые 3 месяца беременности. Во второй половине делают анализ амниотической жидкости, определяя уровень гормонов.
Важное значение для профилактики рассматриваемой патологии имеет и скрининговое тестирование новорожденных детей. Для этого из пятки ребенка берут кровь из капилляра. Когда мать еще беременна, нужно исключить действие на ее организм ядов в различной форме и радиации.
Врожденная гиперплазия надпочечников - увеличение объема надпочечников вследствие дефекта ферментов стероидогенеза в корковой зоне, приводящего к компенсаторному росту органа для устранения гормональной недостаточности. Проявляется признаками гиперандрогении у детей обоих полов, вследствие чего наружные половые органы развиваются неправильно. Также характерно нарушение водно-солевого обмена и регуляции артериального давления со склонностью к его снижению. Врожденная гиперплазия надпочечников диагностируется на основании данных лабораторного обследования. Проводится заместительная гормональная терапия и хирургическая коррекция наружных половых органов.
Общие сведения
Врожденная гиперплазия надпочечников представляет собой целую группу заболеваний со схожей клиникой, однако лежащие в основе генетические мутации могут быть разными. Раньше нозология носила название адреногенитальный синдром. Частота встречаемости клинически выраженных форм составляет примерно 1 случай на 12 тысяч новорожденных. Около 0,01% в структуре заболеваемости приходится на стертые формы, проявляющиеся в подростковом возрасте, часто клинически незначимые. Врожденная гиперплазия надпочечников является актуальной проблемой в педиатрии, поскольку продуцируемые надпочечниками гормоны имеют множество органов-мишеней, а значит, последствия их недостатка в организме проявляются масштабно. Дефицит гормонов оказывает влияние на рост и развитие ребенка, приводя к серьезным последствиям.
Причины врожденной гиперплазии надпочечников
Заболевание развивается вследствие генетического дефекта в каком-либо звене стероидогенеза в надпочечниках. Повреждение может коснуться одного или нескольких ферментов, которые участвуют в синтезе гормонов, продуцируемых в коре надпочечников. Мозговой слой, как правило, не затрагивается. Причины мутаций в генах, отвечающих за синтез участников стероидогенеза и их правильную работу, остаются неизвестными. В настоящее время доказан аутосомно-рецессивный механизм наследования, то есть для манифестации врожденной гиперплазии надпочечников необходимо, чтобы оба родителя имели дефектный ген.
Патогенез заболевания сводится к нарушению синтеза глюкокортикоидов, минералкортикоидов и других гормонов, продуцируемых надпочечниками. Как следствие, возрастает концентрация адренокортикотропного гормона (АКТГ), поскольку именно он является предшественником вышеперечисленных гормонов и стимулирует их усиленное образование. Результатом влияния АКТГ на орган-мишень становится увеличение корковой зоны надпочечников, то есть гиперплазия. Несмотря на увеличение размеров, концентрация продуцируемых надпочечниками гормонов не возрастает, поскольку имеет место нарушение цепочки их синтеза. Таким образом, врожденная гиперплазия надпочечников в клинике проявляется симптомами дефицита гормонов на фоне избытка их гормона-предшественника - АКТГ.
Классификация врожденной гиперплазии надпочечников
Клиническая классификация имеет менее сложную структуру. Выделяют три формы врожденной гиперплазии надпочечников: простую (вирильную), сольтеряющую, неклассическую (стертую, позднюю). Простая форма заболевания сопровождается нарушением развития первичных половых признаков у детей обоих полов - гиперандрогенией у девочек, и макрогенитосомией у мальчиков. Для сольтеряющей формы характерны те же симптомы, уже в период новорожденности возможны приступы острой надпочечниковой недостаточности (адреналовые кризы). Неклассическая врожденная гиперплазия надпочечников проявляется отсрочено, чаще всего - в период полового созревания. Ввиду позднего начала раньше эта форма считалась приобретенной, однако в настоящее время доказано, что в ее основе лежит генетический дефект.
Симптомы врожденной гиперплазии надпочечников
Заболевание (за исключением поздней формы) проявляется с рождения, хотя первые признаки можно заметить еще антенатально, во время проведения УЗИ-скрининга. После родов педиатр сразу может диагностировать неправильное развитие наружных половых органов у девочек. Как правило, речь идет об увеличенном клиторе, но иногда может встречаться и полностью сформированный половой член, а также недоразвитие или полное отсутствие влагалища и матки. Что касается мальчиков, то у них отмечается усиленное развитие наружных половых органов и увеличенные их размеры. Иногда при врожденной гиперплазии надпочечников у детей обоих полов наблюдается гиперпигментация кожи. Это связано с избыточным синтезом меланина, предшественником которого также является АКТГ.
Помимо нарушения полового развития, отмечаются симптомы недостаточности глюкокортикоидов или минералкортикоидов либо обеих групп гормонов (в зависимости от уровня генетического дефекта). Характерно пониженное давление при учащенном сердцебиении, бледность или мраморный оттенок кожи. В то же время, такие дети кажутся физически более развитыми в сравнении со здоровыми новорожденными, отличаются крупными размерами, усиленным развитием мышц и скелета, небольшим размером родничков. Врожденная гиперплазия надпочечников впоследствии может проявляться преждевременным половым созреванием с ранним оволосением, которое у пациентов всегда предшествует развитию вторичных половых признаков.
Острая надпочечниковая недостаточность может возникать при любой форме заболевания, однако при сольтеряющей форме она отмечается достаточно рано, примерно на второй неделе жизни. Осложнение сопровождается критическим падением артериального давления, тахикардией, срыгиваниями или рвотой. Наблюдается диарея и прогрессирующая потеря массы тела. Адреналовый криз требует немедленного лечения в отделении интенсивной терапии, поскольку данное осложнение врожденной гиперплазии надпочечников часто приводит к летальному исходу. Симптомы заболевания также могут усиливаться после стрессовых ситуаций, например, в подростковом возрасте.
Диагностика врожденной гиперплазии надпочечников
Первичная диагностика проводится во время УЗИ-обследования беременных. Иногда во время первого или (чаще) второго акушерского УЗИ можно заметить неправильное развитие половых органов. При подозрении на врожденную гиперплазию надпочечников возможно проведение дополнительных лабораторных исследований, позволяющих определить уровень гормонов и концентрацию различных ферментов адреналового стероидогенеза. Ранняя диагностика позволяет специалистам определиться с дальнейшей тактикой ведения беременности, а также начать терапевтические мероприятия еще до родов.
В настоящее время осуществляется массовое обследование новорожденных на некоторые наследственные патологии, в число которых входит врожденная гиперплазия надпочечников. После рождения ребенка заболевание диагностируется на основании неправильного развития наружных половых органов, но подтвердить диагноз и установить конкретную форму этого состояния можно только на основании результатов лабораторной диагностики. Золотым стандартом является проба с АКТГ, позволяющая достоверно определить его высокую концентрацию. Кроме того, данная проба необходима для того, чтобы исключить вторичный дефицит гормонов надпочечников.
Дополнительные анализы выявляют гиперкалиемию и гипонатриемию, метаболический ацидоз и снижение концентрации глюкозы в крови. Уровень продуктов метаболизма надпочечников определяется также в моче. Проводится определение костного возраста, который у пациентов значительно ускорен. Установить его позволяет серия рентгенограмм области запястья. Кроме того, возможна генетическая диагностика заболевания, однако данный метод является дорогостоящим, и его использование обосновано только в случае установленного семейного анамнеза, то есть случаев врожденной гиперплазии надпочечников в семьях родителей больного.
Лечение и прогноз
Проводится заместительная гормональная терапия. Корректируется уровень глюкокортикоидов, минералкортикоидов. Назначение гормонов возможно также при установлении врожденной гиперплазии надпочечников до родов. В этом случае устраняется гиперандрогения у девочек, поэтому наружные половые органы формируются правильно. Однако антенатальная гормональная терапия в настоящее время является предметом дискуссии. Основные ее осложнения для матери - отеки, артериальная гипертензия и значительная прибавка массы. Отдаленное влияние на плод в настоящее время изучается. Кроме гормональной терапии, осуществляется хирургическая коррекция половых органов. Операцию лучше провести как можно раньше, однако ее срок обязательно оговаривается с родителями.
Прогноз заболевания сомнительный. Своевременная диагностика и терапия позволяют в значительной мере скорректировать гормональные нарушения и предотвратить их дальнейшее развитие. Однако необходим постоянный контроль концентрации гормонов, поскольку любой внешний или внутренний стрессовый фактор становится причиной изменения усвояемости препаратов. Результатом может быть развитие острой надпочечниковой недостаточности, часто приводящей к летальному исходу ввиду стремительного течения осложнения. В целом можно сказать, что врожденная гиперплазия надпочечников поддается контролю, но заболевание представляет серьезную опасность на протяжении всей жизни. Профилактика заключается в медико-генетическом консультировании родителей, имеющих данную патологию в анамнезе.
Адреногенитальный синдром ( ВДКН , Врожденная дисфункция коры надпочечников )
Адреногенитальный синдром — наследственное заболевание надпочечников, при котором вследствие функциональной несостоятельности ферментов нарушается стероидогенез. Проявляется вирилизацией гениталий, маскулиноподобным телосложением, недоразвитием груди, гирсутизмом, акне, аменореей или олигоменореей, бесплодием. В ходе диагностики определяют уровни 17-гидроксипрогестерона, 17-кетостероидов, андростендиона, АКТГ, проводят УЗИ яичников. Пациенткам назначают заместительную гормонотерапию глюкокортикоидами и минералокортикоидами, эстрогены в комбинации с андрогенами или прогестинами нового поколения. При необходимости выполняют пластику половых органов.
МКБ-10
Адреногенитальный синдром, или врожденная дисфункция (гиперплазия) коры надпочечников, — наиболее частое из наследуемых заболеваний. Распространенность патологии отличается у представителей разных национальностей. Классические варианты АГС у лиц европеоидной расы встречаются с частотой 1:14 000 младенцев, в то время как у эскимосов Аляски этот показатель составляет 1:282.
Существенно выше заболеваемость у евреев. Так, неклассическую форму адреногенитального расстройства выявляют у 19% лиц еврейской национальности группы ашкенази. Патология передается по аутосомно-рецессивному типу. Вероятность рождения ребенка с таким синдромом при носительстве патологического гена у обоих родителей достигает 25%, в браке носителя и больного — 75%. Если один из родителей имеет полноценные ДНК, клинические проявления синдрома у детей не развиваются. При наличии АДС у отца и матери ребенок также будет болен.
Причины
У больных с наследуемой гиперплазией надпочечников генетический дефект проявляется несостоятельностью ферментных систем, участвующих в секреции стероидных гормонов. В 90-95% случаев патология возникает при повреждении гена, который отвечает за синтез 21-гидроксилазы — фермента, влияющего на образование кортизола. В остальных клинических случаях вследствие дефекта ДНК нарушается производство других ферментов, обеспечивающих стероидогенез, — StAR/20,22-десмолазы, 3-β-гидрокси-стероиддегидрогеназы, 17-α-гидроксилазы/17,20-лиазы, 11-β-гидроксилазы, P450-оксидоредуктазы и синтетазы альдостерона.
У пациентов с признаками вирилизирующего синдрома вместо активного гена CYP21-B в коротком плече 6-й аутосомы расположен функционально несостоятельный псевдоген CYP21-A. Структура этих участков ДНК-цепи во многом гомологична, что повышает вероятность конверсии генов в мейозе с перемещением участка нормального гена на псевдоген или делецию CYP21-B.
По-видимому, именно этими механизмами объясняется существование скрытых форм болезни, дебютирующих в пубертате или постпубертатном периоде. В таких случаях клинические признаки патологии становятся заметными после нагрузок, истощающих кору надпочечников: тяжелых болезней, травм, отравлений, радиационных воздействий, длительного периода интенсивной работы, психологически напряженных ситуаций и т. д.
Патогенез
В основе механизма развития наиболее распространенного варианта адреногенитального синдрома с дефектом CYP21-B-гена лежит принцип обратной связи. Ее начальным звеном становится дефицит стероидов — кортизола и альдостерона. Несостоятельность процессов гидроксилирования сопровождается неполным переходом 17-гидроксипрогестерона и прогестерона в 11-дезоксикортизол и дезоксикортикостерон. В результате снижается секреция кортизола, а для компенсации этого процесса в гипофизе усиливается синтез АКТГ — гормона, вызывающего компенсаторную гиперплазию коры надпочечников для стимуляции выработки кортикостероидов.
Параллельно возрастает синтез андрогенов и появляются видимые признаки их влияния на чувствительные ткани и органы. При умеренном снижении активности фермента минералокортикоидная недостаточность не развивается, поскольку потребность организма в альдостероне почти в 200 раз ниже по сравнению с кортизолом. Только глубокий дефект гена вызывает тяжелую клиническую симптоматику, которая проявляется с раннего возраста. Патогенез развития заболевания при нарушении структуры других участков ДНК аналогичен, однако пусковым моментом являются нарушения в других звеньях стероидогенеза.
Классификация
Систематизация различных форм вирилизирующей гиперплазии надпочечников основана на особенностях клинической картины заболевания, выраженности генетического дефекта и времени проявления первых патологических признаков. Тяжесть расстройства напрямую связана со степенью повреждения ДНК. Специалисты в сфере эндокринологии различают следующие виды адреногенитального синдрома:
- Сольтеряющий. Самый тяжелый вариант патологии, проявляющийся в первый год жизни ребенка грубыми нарушениями строения наружных половых органов у девочек и их увеличением у мальчиков. Активность 21-гидроксилазы составляет не более 1%. Значительное нарушение стероидогенеза приводит к выраженным соматическим нарушениям — рвоте, поносу, судорогам, чрезмерной пигментации кожи. Без лечения такие дети умирают в раннем возрасте.
- Простой вирильный. Течение заболевания менее тяжелое, чем при сольтеряющем варианте. Преобладают проявления неправильного развития гениталий у младенцев женского пола, увеличение их размеров у мальчиков. Признаки надпочечниковой недостаточности отсутствуют. Уровень активности 21-гидроксилазы снижен до 1-5%. С возрастом у пациентов нарастают признаки вирилизации вследствие стимулирующего действия андрогенов.
- Неклассический (постпубертатный). Наиболее благоприятная форма АГС, явные признаки которой возникают в период полового созревания и в репродуктивном возрасте. Наружные половые органы имеют нормальное строение, может быть увеличен клитор у женщин и половой член у мужчин. Функциональность 21-гидроксилазы снижена до 20-30%. Заболевание выявляется случайно при обследовании в связи с бесплодием или нарушениями менструальной функции.
Сольтеряющий и простой вирильный виды адреногенитальных расстройств относят к категории антенатальной патологии, формирующейся внутриутробно и проявляющейся с момента рождения. При дефекте строения других генов наблюдаются более редкие варианты заболевания: гипертензивные — классический (врожденный) и неклассический (поздний), гипертермический, липидный, с ведущими проявлениями гирсутизма.
Сольтеряющий и простой вирильный
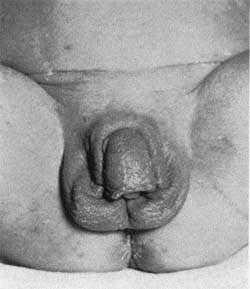
При антенатальных формах заболевания основным клиническим симптомом является видимая вирилизация гениталий. У новорожденных девочек обнаруживаются признаки женского псевдогермафродитизма. Клитор большой по размерам или имеет пенисообразную форму, преддверие влагалища углублено, сформирован урогенитальный синус, большие и малые половые губы увеличены, промежность высокая. Внутренние половые органы развиты нормально.
У младенцев-мальчиков увеличен половой член и гиперпигментирована мошонка. Кроме того, при сольтеряющем адреногенитальном расстройстве выражена симптоматика надпочечниковой недостаточности с тяжелыми, зачастую несовместимыми с жизнью соматическими нарушениями (понос, рвота, судороги, обезвоживание и др.), которые проявляются с 2-3-недельного возраста. У девочек с простым вирильным АГС по мере взросления признаки вирилизации усиливаются, формируется диспластическое телосложение.
Из-за ускорения процессов окостенения пациентки отличаются невысоким ростом, широкими плечами, узким тазом, короткими конечностями. Трубчатые кости массивные. Половое созревание начинается рано (до 7 лет) и протекает с развитием вторичных мужских половых признаков. Отмечается увеличение клитора, снижение тембра голоса, нарастание мышечной силы, формирование типичной для мужчин формы перстневидного хряща щитовидной железы. Грудь не растет, менархе отсутствует.
Неклассический
Менее специфичны клинические симптомы при неклассических формах вирилизирующего синдрома, возникшие в пубертате и после стрессовых нагрузок (выкидыша на ранних сроках беременности, медицинского аборта, операции и др.). Обычно пациентки вспоминают, что у них еще в младшем школьном возрасте появилось небольшое оволосение в подмышечных впадинах и на лобке. В последующем развились признаки гирсутизма с ростом стержневых волос над верхней губой, по белой линии живота, в области грудины, в сосково-ареолярной зоне.
Женщины с АГС предъявляют жалобы на стойкую угревую сыпь, пористость и повышенную жирность кожи. Менархе наступает поздно — к 15-16 годам. Менструальный цикл неустойчив, интервалы между менструациями достигают 35-45 дней и более. Кровянистые выделения во время месячных скудные. Молочные железы небольшие. Клитор несколько увеличен. Такие девушки и женщины могут иметь высокий рост, узкий таз, широкие плечи.
По наблюдениям специалистов в сфере акушерства и гинекологии, чем позже развиваются адреногенитальные расстройства, тем менее заметны внешние признаки, характерные для мужчин, и тем чаще ведущим симптомом становится нарушение месячного цикла. При более редких генетических дефектах пациентки могут жаловаться на повышение артериального давления или, наоборот, гипотонию с низкой работоспособностью и частыми головными болями, гиперпигментацию кожи с минимальными симптомами вирилизации.
Осложнения
Основным осложнением адреногенитального синдрома, по поводу которого пациентки обращаются к акушерам-гинекологам, является стойкое бесплодие. Чем раньше проявилось заболевание, тем меньше вероятность забеременеть. При значительной ферментной недостаточности и клинических проявлениях простого вирилизирующего синдрома беременность вообще не наступает.
У забеременевших пациенток с пубертатными и постпубертатными формами заболевания возникают самопроизвольные выкидыши на раннем сроке. В родах возможна функциональная истмико-цервикальная недостаточность. Такие женщины более склонны к возникновению психоэмоциональных расстройств — склонности к депрессии, суицидальному поведению, проявлениям агрессии.
Постановка диагноза при антенатальных типах АГС с характерными изменениями половых органов не представляет сложности и проводится сразу после родов. В сомнительных случаях применяют кариотипирование для подтверждения женского кариотипа (46ХХ), молекулярно-генетические тесты. Большее значение диагностический поиск приобретает при позднем клиническом дебюте или скрытом течении с минимальными внешними проявлениями вирилизации. В подобных ситуациях для выявления адреногенитального синдрома используют следующие лабораторные и инструментальные методы:
- Уровень 17-ОН-прогестерона. Высокая концентрация 17-гидроксипрогестерона, который является предшественником кортизола — ключевой признак недостаточности 21-гидроксилазы. Его содержание увеличено в 3-9 раз (от 15 нмоль/л и выше).
- Стероидный профиль (17-КС). Повышение уровня 17-кетостероидов в моче у женщин в 6-8 раз свидетельствует о высоком содержании андрогенов, производимых корой надпочечников. При выполнении преднизолоновой пробы концентрация 17-КС уменьшается на 50-75%.
- Содержание андростендиона в сыворотке крови. Повышенные показатели этого высокоспецифичного метода лабораторной диагностики подтверждают усиленную секрецию предшественников мужских половых гормонов.
- Уровень АКТГ в крови. Для классических форм заболевания характерна компенсаторная гиперсекреция адренокортикотропного гормона передней долей гипофиза. Поэтому при синдроме вирилизирующей дисфункции показатель повышен.
- УЗИ яичников. В корковом веществе определяются фолликулы на разных стадиях созревания, не достигающие преовуляторных размеров. Яичники могут быть несколько увеличены, однако разрастания стромы не наблюдается.
- Измерение базальной температуры. Температурная кривая типична для ановуляторного цикла: первая фаза растянута, вторая укорочена, что обусловлено недостаточностью желтого тела, которое не образуется из-за отсутствия овуляции.
Для сольтеряющего варианта АГС также характерна повышенная концентрация ренина в плазме крови. Дифференциальная диагностика адреногенитальных расстройств, возникших в пубертатном и детородном возрасте, проводится с синдромом поликистозных яичников, овариальными андробластомами, андростеромами надпочечников, вирильным синдромом гипоталамического происхождения и конституциональным гирсутизмом. В сложных случаях к диагностике привлекают эндокринологов, урологов, врачей-генетиков.
Лечение адреногенитального синдрома
Основным способом коррекции вирильной дисфункции надпочечников является заместительная гормональная терапия, восполняющая дефицит глюкокортикоидов. Если у женщины со скрытым АГС нет репродуктивных планов, кожные проявления гиперандрогении незначительны и месячные ритмичны, гормоны не применяют. В остальных случаях выбор схемы лечения зависит от формы эндокринной патологии, ведущей симптоматики и степени ее выраженности. Зачастую назначение глюкокортикоидных препаратов дополняют другими медикаментозными и хирургическими методами, подобранными в соответствии с конкретной терапевтической целью:
- Лечение бесплодия. При наличии планов по деторождению женщина под контролем андрогенов крови принимает глюкокортикоиды до полного восстановления овуляторного месячного цикла и наступления беременности. В резистентных случаях дополнительно назначают стимуляторы овуляции. Во избежание выкидыша гормонотерапию продолжают до 13-й недели гестационного срока. В I триместре также рекомендованы эстрогены, во II-III — аналоги прогестерона, не обладающие андрогенным эффектом.
- Коррекция нерегулярных месячных и вирилизации. Если пациентка не планирует беременность, но жалуется на расстройство менструального цикла, гирсутизм, угри, предпочтительны средства с эстрогенным и антиандрогенным эффектом, оральные контрацептивы, содержащие гестагены последнего поколения. Терапевтический эффект достигается за 3-6 месяцев, однако по окончании лечения при отсутствии заместительной гормонотерапии признаки гиперандрогении восстанавливаются.
- Лечение врожденных форм АГС. Девочкам с признаками ложного гермафродитизма проводят адекватную гормонотерапию и выполняют хирургическую коррекцию формы половых органов — клитеротомию, интроитопластику (вскрытие урогенитального синуса). При сольтеряющих адреногенитальных расстройствах кроме глюкокортикоидов под контролем рениновой активности назначают минералокортикоиды с увеличением терапевтических доз при возникновении интеркуррентных заболеваний.
Определенные сложности в ведении пациентки возникают в тех случаях, когда заболевание не диагностировано в акушерском стационаре, и девочка с выраженной вирилизацией гениталий регистрируется и воспитывается как мальчик. При решении о восстановлении женской половой идентичности хирургическую пластику и гормонотерапию дополняют психотерапевтической поддержкой. Решение о сохранении гражданского мужского пола и удалении матки с придатками принимается в исключительных случаях по настоянию больных, однако такой подход считается ошибочным.
Прогноз и профилактика
Прогноз при своевременном обнаружении адреногенитального синдрома и адекватно подобранной терапии благоприятный. Даже у пациенток со значительной вирилизацией гениталий после пластической операции возможна нормальная половая жизнь и естественные роды. Заместительная гормонотерапия при любой форме АГС способствует быстрой феминизации — развитию грудных желез, появлению месячных, нормализации овариального цикла, восстановлению генеративной функции. Профилактика заболевания осуществляется на этапе планирования беременности.
Если в роду наблюдались случаи подобной патологии, показана консультация генетика. Проведение пробы с АКТГ обоим супругам позволяет диагностировать гетерозиготное носительство или скрытые формы адреногенитального расстройства. При беременности синдром может быть обнаружен по результатам генетического анализа клеток хорионических ворсин или содержимого околоплодных вод, полученных методом амниоцентеза. Неонатальный скрининг, проводимый на 5-е сутки после родов, направлен на выявление повышенной концентрации 17-гидропрогестерона для быстрого выбора терапевтической тактики.
Врожденная дисфункция коры надпочечников
Адреногенитальный синдром Hадпочечники секретируют кортикостероиды, которые по биологическим свойствам можно разделить на 4 группы: глюкокортикоиды, минералокортикоиды, андрогены и эстрогены. Синтез кортизола в надпочечниках плода под вли
 |
| Адреногенитальный синдром |
Hадпочечники секретируют кортикостероиды, которые по биологическим свойствам можно разделить на 4 группы: глюкокортикоиды, минералокортикоиды, андрогены и эстрогены.
Синтез кортизола в надпочечниках плода под влиянием адренокортикотропного гормона (АКТГ) начинается рано, в связи с этим дефект ферментных систем приводит к вирилизации до рождения ребенка. Так как к этому сроку формирование внутренних половых органов заканчивается, вирилизация затрагивает наружные половые органы.
Из различных ферментных дефектов недостаточность 21-гидроксилазы встречается наиболее часто и протекает в виде двух клинических форм: вирильного и сольтеряющего синдромов.
Вирильная форма связана с частичной недостаточностью 21-гидроксилазы. Как правило, при этом наблюдается компенсация функции коры надпочечников в результате повышенной секреции АКТГ, то есть уровень кортизола определяется на нижней границе нормы. Компенсаторное выделение АКТГ приводит к образованию значительного количества андрогенов, прогестерона, 17-гидроксипрогестерона, которые угнетают сользадерживающую активность на уровне канальцев почек, что ведет к значительному увеличению продукции альдостерона. У девочек с вирильной формой с рождения имеются признаки ложного гермафродитизма. Клитор гипертрофирован, напоминает по строению половой член, имеющий единое мочеполовое отверстие — урогенитальный синус, открывающийся у корня клитора, мошонкообразные большие половые губы.
| Врожденная дисфункция коры надпочечников является наследственным заболеванием, характеризующимся нарушением синтеза кортикостероидов, в основном кортизола, в результате дефицита ферментных систем коры надпочечников с одновременной избыточной продукцией андрогенов в надпочечниках |
У мальчиков с рождения отмечается увеличение полового члена, кожа мошонки морщинистая, выражена пигментация шва полового члена, кожи мошонки, передней линии живота, ареолы сосков.
В постнатальном периоде продолжается избыточная секреция андрогенов, усиливаются явления вирилизации. Дети быстрее растут, имеют развитую мускулатуру. Вначале больные обгоняют в росте сверстников, в дальнейшем же, после 9-10 лет, в связи с закрытием зон роста остаются низкорослыми. В возрасте 2-4 лет появляется преждевременное оволосение на лобке, подмышках, туловище, лице. У некоторых мальчиков значительно увеличивается половой член и появляются эрекции. Телосложение девочек мускулинного типа. В пубертатный период менструации не наступают, молочные железы не развиваются, так как повышенная секреция андрогенов надпочечниками по принципу обратной связи тормозит образование и выделение гонадотропинов. У мальчиков по этой причине угнетается развитие яичек — они остаются маленькими.
При сольтеряющей форме дефицит 21-гидроксилазы более глубокий, поэтому наряду с дефицитом образования кортизола происходит резкое снижение биосинтеза альдостерона. Если при вирильной форме потеря натрия, обусловленная избыточной продукцией прогестерона, 17-гидроксипрогестерона, компенсируется избыточной секрецией альдостерона, то при сольтеряющей форме снижено образование альдостерона. Результатом такого комбинированного действия является развитие клинической картины по типу острой надпочечниковой недостаточности.
| Заболевание наследуется по аутосомно-рецессивному типу и проявляется в гомозиготном состоянии. Распространенность составляет в среднем 1:4000-5000, а гетерозиготное носительство — 1:35-40 человек |
У новорожденных при этом синдроме резко выражены симптомы вирилизации, особенно у детей женского пола — полное заращение половой щели и появление мошоночноподобного образования. На 5-10-й день наступает быстрое ухудшение состояния, связанное с частой рвотой, жидким стулом. Развивается дегидратация, ребенок становится вялым, снижается масса тела. В сыворотке крови нарастает уровень кальция и снижается содержание натрия и хлора.
Гипертоническая форма дисфункции коры надпочечников, связанная с дефицитом 11b-гидроксилазы, встречается реже. В клинической картине, помимо признаков андрогенизации в раннем возрасте, характерно повышение артериального давления. При этой патологии отсутствует гиперплазия юкстагломерулярного аппарата почки и уровень ренина в плазме не повышен.
Дифференциальный диагноз врожденной дисфункции коры надпочечников у девочек первых лет жизни следует проводить с дисгенезией гонад, анорхизмом, истинным гермафродитизмом; у мальчиков — с преждевременным половым развитием различного генеза, в том числе с опухолью яичка, с андрогенпродуцирующей опухолью надпочечника (андростерома). Сольтеряющую форму у новорожденных дифференцируют с пилороспазмом и пилоростенозом.
У девочек старшего возраста при подозрении на врожденную дисфункцию коры надпочечников требуется исключить такие заболевания, как андрогенпродуцирующая опухоль яичника, стромальный текоматоз, поликистоз яичников.
Наиболее приемлемым средством заместительной терапии является преднизолон, который в течение длительного срока сохраняет достаточную концентрацию и обладает некоторым минералокортикоидным действием. Суточная доза его подбирается индивидуально и колеблется в зависимости от возраста: от 1,5-3 мг (для детей младше 3 лет) до 5 мг для детей старшего возраста. Реже применяют преднизолон, кортизон, дексаметазон. Соответственно суточному физиологическому ритму 17-гидроксипрогестерона принимать преднизолон рекомендуется рано утром, в 6-7 часов (причем в это время следует принять 2/3-1/2 дозы) и поздно вечером (23-24 часа). Глюкокортикоиды больные должны получать постоянно, так как отмена препарата ведет к декомпенсации заболевания.
При лечении больных с сольтеряющей формой врожденной дисфункции коры надпочечников к кортикостероидам добавляют минералкортикоиды. Это либо масляный раствор дезоксикортикостерона ацетата (ДОКА), либо таблетированный препарат кортинеф (0,1 мг), который в 5-10 раз активнее первого. Препараты назначаются в течение 1-2 недель ежедневно (ДОКА по 1-2 мл, кортинеф по 1 таб.) с последующим постепенным снижением дозы до оптимальной. Возможно поддерживающую терапию проводить через каждые 1-2 дня. У некоторых больных дефицит минералкортикоидов можно компенсировать добавлением в пищу поваренной соли. Обязательный контроль за весом, артериальным давлением, калием, натрием, ЭКГ.
Начальные дозы кортикостероидов должны быть в два раза выше физиологических.
При адекватном лечении у детей уменьшается мышечная гипертрофия, перераспределяется подкожножировая клетчатка, половое оволосение не прогрессирует. Если лечение начинают до закрытия ядер окостенения, то увеличивается темп роста. В случаях же поздней терапии эти дети так и остаются низкорослыми.
Гипертоническая форма заболевания лечится аналогично вирильной.
При присоединении интеркуррентных заболеваний дозу глюкокортикоидов увеличивают в 1,5-2 раза.
В случае развития острого криза недостаточности коры надпочечников показано внутривенное капельное введение жидкости (физиологический раствор и 5%-ный раствор глюкозы 100-200 мл/кг массы тела в сутки) в 4 приема, ДОКА 2-3 мг/кг массы тела в сутки. В последующие дни доза глюкокортикоидов быстро снижается и больной переводится на пероральный прием преднизолона.
Важное место в лечении врожденной дисфункции коры надпочечников занимает психотерапия, особенно в случае необходимости перемены пола ребенка.
Большинство девочек с этим заболеванием нуждается в проведении феминизирующей пластики наружных гениталий, удалении клитора и формировании малых половых губ после вскрытия урогенитального синуса. Коррекцию наружных гениталий рекомендуется проводить через год после назначения кортикостероидной терапии.
Гирсутизм, вирилизм
У взрослых есть два типа волос: пушковые и терминальные. Третий тип волос — лануго — имеет место только у плода и новорожденного. Пушковые волосы являются непигментированными, мягкими и покрывают все тело. Терминальный волос является пигментированным, толстым и покрывает скальп, подмышечные зоны и лобковую зону.
Волосы имеет 3 стадии роста:
- анаген (фаза роста);
- катаген (фаза инволюции, волосы перестают расти и выходят из волосяных фолликулов;
- телоген (фаза отдыха, предшествует потере волос).
Андрогены отвечают за конверсию пушковых волос в терминальные в пубертатном периоде, следствием чего является появление лобкового и аксилярного оволосения. Аномальное увеличение терминальных волос может происходить вследствие гиперпродукции андрогенов или роста активности фермента 5а-редуктазы, которая конвертирует тестостерон в более активный андроген дигидротестостерон (ДГТ), который является основным стимулятором развития терминальных волос.
Гирсутизм
Гирсутизм — это рост терминальных волос в андрогенчувствительных зонах женщины — на лице, груди, спине, нижней части живота и внутренней поверхности бедер. Часто рост лобковых волос происходит по мужскому типу и имеет ромбовидную форму, в отличие от треугольной формы чисто женского лобкового оволосения.
Основными причинами гирсутизма являются:
- рост действия экзогенных андрогенов;
- увеличение яичниковой или надпочечниковой продукции андрогенов;
- повышение чувствительности органов-мишеней к действию андрогенов вследствие повышения активности 5а-редуктазы.
Модуляторами действия андрогенов в организме могут быть ферменты и белки:
1) глобулин, связывающий половые гормоны (ГСПГ). Этот модулятор связывает циркулирующие андрогены, уменьшает уровень циркулирующих, свободных андрогенов; только свободные андрогены достигают клеток-мишеней;
2) 5а-редуктаза — энзим, конвертирует андрогены в дигидротестостерон.
Вирилизация — развитие мужских черт: снижение тембра голоса, фронтальное облысение, рост мышечной массы, клиторомегалия, атрофия молочных желез и приобретения мужских контуров тела.
Исследование причин гирсутизма и вирилизма у женщин является сложным процессом и требует понимания процессов пубертатного развития, функции надпочечников, яичников, особого внимания к изменению синтеза глюкокортикоидов, минералокортикоидов, андрогенов и эстрогенов.
Дифференциальная диагностика причин гирсутизма
- Синдром поликистозных яичников
- Гиперплазия надпочечников с началом во взрослом возрасте
- Андрогенпродуцирующие опухоли яичников и надпочечников
- Гиперпролактинемия
- Влияние экзогенных андрогенов
- Идиопатические
Нормальный синтез андрогенов
Надпочечники состоят из двух компонентов: коры, которая отвечает за синтез глюкокортикоидов, минералокортикоидов и андрогенов, и мозгового вещества, участвующего в синтезе катехоламинов. Кора надпочечников имеет три слоя. Внешний слой, гранулезно продуцирует альдостерон и регулируется ренин-ангиотензиновую систему. Эта зона не имеет фермента 17а-гидроксилазы и, следовательно, кортизол и андрогены в ней не синтезируются. Между внутренними слоями, продуцирующими кортизол и андрогены, не образуются альдостерон вследствие отсутствия фермента альдостерон-синтазы. Эти два внутренних слоя коры надпочечников регулируются адренокортикотропным гормоном (АКТГ).
Указанный гормон регулирует конверсию холестерола в прегненолон путем гидроксилирования и расщепления косвенного цепи. Прегненолон конвертируется в прогестерон и, наконец, — в альдостерон или кортизол или шунтируется для продукции половых стероидов.
В надпочечниках андрогены синтезируются с их предшественником — 17а-гидроксипрегненолоном, который конвертируется в дегидроэпиандростерон (ДГЭА) и его сульфат (ДГЭАС), андростендион и, наконец — в тестостерон. ДГЭА и ДГЭАС является крупнейшей группой надпочечников андрогенов; другие андрогены в них синтезируются в незначительном количестве.
В яичниках клетки внутренней тека-оболочки фолликулов (тека-клетки) стимулируются лютеинизирующим гормоном к продукции андростендиона и тестостерона. Андростендион и тестостерон в дальнейшем ароматизируются в гранулезных клетках в эстрон и эстрадиол, соответственно, в ответ на действие ФСГ. Итак, повышение соотношения ЛГ / ФСГ может привести к увеличению синтеза андрогенов.
Патологическая продукция андрогенов
Повышение продукции андрогенов может быть следствием как надпочечниковых, так и яичниковых расстройств. Учитывая, что синтез стероидных гормонов корой надпочечников стимулируется АКТГ недифференцированным путем, повышение уровня АКТГ приводит к росту продукции стероидных гормонов, в том числе андрогенов. При наличии энзимного дефекта, ближайший к дефекту предшественник аккумулируется и шунтирует на другой путь развития. Так, энзимный блок синтезируя как кортизол, так и альдостерон, приводит к росту продукции андрогенов.
В яичниках роста ЛГ или соотношение ЛГ / ФСГ также приводит к чрезмерной продукции андрогенов. Независимо от причины, повышение продукции андрогенов приводит к гирсутизму и может способствовать развитию вирилизма.
Заболевания надпочечников
Заболевания надпочечников, которые могут повлечь вирилизации у женщин, разделяют на 2 группы: ненеопластические и неопластические заболевания. Андрогенпродуцирующие опухоли надпочечников могут быть представлены аденомами или карциномами (раком). Аденомы надпочечников обычно вызывают чрезмерную продукцию глюкокортикоидов, вирилизирующие последствия редки. Карциномы могут более быстро прогрессировать и вызывать значительное повышение уровня глюкокортикоидов, минералокортикоидов и андрогенных стероидов.
Синдром Кушинга
Синдром Кушинга характеризуется избыточной продукцией кортизола. Учитывая, что промежуточными продуктами синтеза кортизола являются андрогены, синдром Кушинга может сопровождаться сопутствующим гиперандрогенным состоянием. Причинами развития синдрома Кушинга могут быть аденомы гипофиза, эктопическая продукция АКТГ, опухоли надпочечников.
При синдроме Кушинга, вызванном развитием аденомы гипофиза, имеет место гиперсекреция АКТГ. Паранеопластический синдром, например негипофизарные АКТГ-продуцирующие опухоли, также приводит к росту уровня АКТГ. Опухоли надпочечников обычно сопровождаются снижением уровня АКТГ вследствие отрицательной обратной связи с повышением уровня надпочечников стероидных гормонов. Все три причины приводят к чрезмерной продукции глюкокортикоидов — глюкокортикоидного эксцесса, что и вызывает развитие синдрома Кушинга, а также гирсутизм, акне, нерегулярные менструальные кровотечения вследствие гиперпродукции андрогенов надпочечниками.
При подозрении на синдром Кушинга диагноз подтверждают с помощью ночного дексаметазонового супрессорного теста. Если имеет место нормальная отрицательная обратная связь от экзогенного стероидного гормона, надпочечники должны уменьшить гормональную продукцию в ответ на дексаметазон. Уровень кортизола в плазме крови измеряют следующее утро. Если уровень кортизола 10 мг / дл считается диагностическим, тогда как значение в пределах 5-10 мг / дл — неопределенными. Для подтверждения диагноза оценивают уровень свободного кортизола в 24-часовой количества мочи.
Врожденная гиперплазия коры надпочечников
Врожденная гиперплазия коры надпочечников — это комплекс дефицитов энзимов, включенных в стероидогенез. Наиболее частым нарушением является дефицит 21а-гидроксилазы. Энзимный блок на этом уровне приводит к накоплению 17а-гидроксипрогестерона (17-ОГП), который шунтирует в круг синтеза андрогенов.
Пациентки с врожденной гиперплазией коры надпочечников не синтезируют кортизол или минералокортикоиды, что проявляется адреналовой недостаточностью и потерей натрия при рождении. Новорожденные женского пола имеют неопределенные гениталии вследствие избытка продукции андрогенов. При более мягкой форме гиперплазии коры надпочечников с началом во взрослом возрасте степень дефицита может варьировать и часто имеют место лишь признаки мягкой вирилизации или нерегулярность ритма менструаций.
Другие типы врожденной гиперплазии коры надпочечников, которые ассоциируются с вирилизацией, включают дефицит 11р-гидроксилазы и 3р-гидроксистероид-дегидрогеназы (3р- ГСД). Пациентки с дефицитом 11р-гидроксилазы имеют сходные симптомы избыточной продукции андрогенов — предшественники аккумулируются и шунтируются на синтез андростендиона и тестостерона.
Пациентки с дефицитом 3Р-ГСД аккумулируют ДГЭА вследствие невозможного преобразования прегненолона в прогестерон, или ДГЭА уменьшает синтез андрогенов. ДГЭА и ДГЭАС имеют мягкое андрогенное действие. В случае присутствия этого дефекта у гонадного стероидогенеза у мужчин имеет место феминизация, а у женщин — гирсутизм и вирилизация. Все пациентки имеют нарушенный синтез кортизола и различные степени избытка или дефицита минералокортикоидов, в зависимости от локализации энзимного блока.
При подозрении на врожденную гиперплазию коры надпочечников, определяют уровень 17-ОГП, так как дефицит 21а-гидроксилазы является наиболее частым. Если 17-ОГП повышен (> 200 нг / дл), диагноз подтверждают тестом со стимуляцией АКТГ. Препарат АКТГ (кортрозин) вводят в / в и через 1 ч измеряют уровень 17-ОГП. Значительный рост уровня 17-ОГП свидетельствует о врожденной гиперплазии коры надпочечников, несколько ниже значения могут свидетельствовать о врожденной гиперплазией коры надпочечников с более поздним началом во взрослом возрасте или гетерозиготности по дефициту 21а-гидроксилазы.
Функциональные расстройства яичников
Заболевания яичников, которые могут повлечь вирилизацию, разделяют на ненеопластические и неопластические. Ненеопластические поражения включают поликистозные яичники, тека-лютеиновые кисты, стромальную гиперплазию и стромальный гипертекоз. Неопластические заболевания варьируют и часто приводят к быстрому началу вирилизации.
Ненеопластические заболевания яичников
Синдром поликистозных яичников
Синдром поликистозных яичников (СПКЯ, синдром Штейна-Левенталя) — является довольно частым заболеванием, которое поражает около 4-5% женщин репродуктивного возраста и передается, возможно, по аутосомно-доминантному типу. Синдром сопровождается комплексом патологических симптомов, включающих гирсутизм, вирилизации, ановуляцию, аменорею и ожирения. У таких пациенток также растет частота гиперинсулинемии, инсулинорезистентности и сахарного диабета типа II (инсулиннезависимого сахарного диабета).
Причина гиперандрогенного состояния при СПКЯ связана с избыточной ЛГ-стимуляцией, а также гиперинсулинемией, что приводит к кистозных изменений в яичниках и рост яичниковой секреции андрогенов.
Основными клиническими критериями диагностики СПКЯ считают
1) гиперандрогенные (клиническую или биохимическую);
2) нарушение менструального цикла вследствие олигоовуляции и ановуляции.
Для подтверждения диагноза СПКЯ используют следующие показатели:
Тека-лютеиновые кисты
Тека-клетки яичника стимулируются ЛГ и продуцируют андростендион и тестостерон. В норме эти андрогены шунтируются к гранулезным клеткам для ароматизации в эстрон и эстрадиол. Тека-лютеиновые кисты возникают при длительной и массивной стимуляции яичника гонадотропинами и продуцируют избыточное количество андрогенов. Такие кисты в большинстве случаев являются двусторонними и могут наблюдаться при нормальной беременности и трофобластической болезни. Яичники являются увеличенными у пациенток, у которых имеют место гирсутизм и, редко, вирилизация. Тека-лютеиновые кисты нередко регрессируют спонтанно.
Стромальная гиперплазия и гипертекоз
Стромальная гиперплазия (гиперплазия стромы яичника) является частой между 50 и 70 годами жизни и может вызывать развитие гирсутизма. Яичники являются униформно увеличенными. Стромальный гипертекоз характеризуется накоплением «гнезд» тека-клеток среди гиперплазированной стромы и более часто приводит к вирилизации, чем простая стромальная гиперплазия, потому что накопленные тека-клетки сохраняют способность к синтезу андрогенов. Яичники выглядят увеличенными и мясистыми, не соответствующими возрасту больных.
Сертоли-Лейдига-клеточные опухоли обычно возникают у молодых женщин и составляют около 1% всех опухолей яичников. Гилюсноклеточные клетки являются более редкими, чем Сертоли-Лейдига-клеточные, и наблюдаются преимущественно у женщин в постменопаузе. Эти опухоли могут секретировать андрогены, что приводит к развитию гирсутизма и вирилизма.
Во время беременности может развиваться лютеома — доброкачественная опухоль, которая растет в ответ на стимуляцию ХГЧ. Эта опухоль может вызывать значительное повышение уровня тестостерона и андростендиона и, соответственно, вирилизации у 65% плодов женского пола. Эти изменения исчезают после родов.
Другие опухоли яичников
Избыточный синтез андрогенов может иметь место и при других опухолях яичников — цистаденоме, опухоли Крукенберга. Эти опухоли не секретируют андрогены, но стимулируют пролиферацию прилегающей стромы яичников, что, в свою очередь, может привести к избыточной секреции андрогенов.
Медикаментозные препараты и экзогенные гормоны
Значительное количество медикаментозных препаратов может влиять на уровень циркулирующего ГСПГ, циркулирующий тестостерон, оставляя небольшое количество «свободного» тестостерона для взаимодействий на клеточном уровне. Андрогены и кортикостероиды уменьшают уровень ГСПГ, освобождая большее количество «свободного» тестостерона в циркуляции. Пациентки, которые получают анаболические стероиды, даназол или тестостерон, часто имеют гирсутизм и вирилизации. Такие препараты, как миноксидил, фенитоин, диазоксид, циклоспорин могут вызывать гирсутизм, не влияя на синтез андрогенов.
Идиопатический гирсутизм
Существуют национальные, семейные и расовые различия степени оволосения тела. Гирсутизм считается идиопатическим при отсутствии патологии яичников и надпочечников, при экзогенном воздействии андрогенов или употреблении определенных медикаментозных препаратов.
Пациентки могут иметь увеличенную продукцию андрогенов, хотя многие из них имеют нормальный уровень циркулирующих андрогенов. В этих случаях может иметь место рост периферической продукции андрогенов вследствие повышения активности 5а-редуктазы на уровне кожи и волосяных фолликулов.
Клиническая манифестация. Пациенток опрашивают относительно начала, прогрессирования и симптомов гирсутизма и вирилизации, выясняют пубертатный, менструальный и репродуктивный, а также семейный (генетические нарушения, включая гиперплазию надпочечников) анамнез, наличие приема медикаментов, которые влияют на уровень ГСПГ или изменяют внутреннюю андрогенную активностью.
Объективное обследование включает оценку типа роста волос (лицо, грудь, спина, живот, внутренние поверхности бедер), а также оценку наличия фронтального облысения, контуров тела. Оценку выраженности гирсутизма проводят по шкале Ферримана-Голуэе.
Обследование молочной железы может выявить атрофические изменения. При гинекологическом исследовании оценивают линию роста лобковых волос, величину клитора, размеры яичников. Проявляют кушингоидные черты, наличие акантоза (утолщенной, бархатной гиперпигментации в аксиллярной зоне и на шее), что может быть проявлением СПКЯ.
Диагностика. Лабораторные исследования включают определение уровня свободного тестостерона, 17-ОГП, ДГЭАС и пролактина. Повышение уровня 17-ОГП (измеряют утром) позволяет заподозрить врожденную гиперплазию надпочечников. Повышение уровня свободного тестостерона подтверждает чрезмерную продукцию андрогенов, сопроводительное повышения ДГЭАС свидетельствует о поражении надпочечников.
Увеличение уровня ДГЭАС> 700 мкг / дл подозрительно относительно возможной опухоли надпочечников. Наличие опухоли надпочечников определяют с помощью компьютерной или магнитно-резонансной томографии. Выполняют тест с АКТГ и оценивают содержание кортизола в 24-часовом анализе мочи для диагностики синдрома Кушинга.
Если уровень ДГЭАС является нормальным или несколько повышенным, подозревают поражения яичников и с целью исключения опухоли яичников выполняют ультрасонографию или компьютерную томографию. Повышение соотношения ЛГ / ФСГ> 3: 1 свидетельствует о СПКЯ. Быстрое начало вирилизации и уровень тестостерона> 200 нг / дл может свидетельствовать о наличии андрогенсекретирующей опухоли яичника.
Для подтверждения генеза чрезмерной продукции андрогенов используют магнитно-резонансную томографию и селективный анализ венозной крови для выявления локализации поражения. У женщин с гирсутизмом и нормальным уровнем свободного тестостерона определяют активность 5а-редуктазы для выявления роли увеличенной периферической энзимной активности в развитии гирсутизма.
Лечение. Существуют различные варианты лечения гирсутизма в зависимости от причины и выраженности клинических проявлений. Супрессия действия надпочечниковых андрогенов при отсутствии опухоли надпочечников может быть достигнута назначением глюкокортикоидов (преднизон, преднизолон). Финастерид ингибирует энзим 5а-редуктазу, что уменьшает периферическую конверсию тестостерона в дигидротестостерон. Антиандрогены (ципротерон-ацетат (андрокур), спиронолактон) могут быть эффективными. В случае опухолей яичников выполняют хирургическое лечение.
Яичниковые ненеопластические заболевания, сопровождающиеся увеличением продукции андрогенов, подлежат супрессии путем применения комбинированных оральных контрацептивов, что приводит к супрессии выделения ЛГ и ФСГ, а также росту ГСПГ.
Наиболее эффективным является Диане-35, который как гестагенный компонент содержит ципротерон-ацетат с антиандрогенными свойствами. Гестагены также могут быть применены у пациенток с противопоказаниями к эстрогенной терапии. Прогестины уменьшают уровень ЛГ и, следовательно, продукцию андрогенов (андрокур и др.). Кроме того, растет катаболизм тестостерона, что ведет к уменьшению его уровня.
С целью супрессии ЛГ и ФСГ могут быть применены агонисты ГнРГ (золадекс, декапептил, диферелин т.п.). Длительное применение агонистов ГнРГ может привести к гипоэстрогенному состоянию и потребовать заместительной эстрогенной терапии.
Пациенткам с медикаментознозависимым гирсутизмом рекомендуют прекратить прием андрогенстимулирующих препаратов. Симптоматическая терапия включает депиляцию, электролизис, сбривание волос и другие косметические процедуры. Сбривание волос не увеличивает его рост и сопровождается меньшим риском фолликулита и образования рубцов.
Читайте также:
