Заместительная почечная терапия в реаниматологии. Доступ для экстракорпорального контура
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Хроническая почечная недостаточность (ХПН) - неспецифический синдром, развивающийся вследствие постепенной потери основных почечных функций, обусловленных развитием склероза почечной ткани на фоне различных прогрессирующих заболеваний почек.
Большинство первичных и вторичных заболеваний почек может привести к развитию диффузного нефроангиосклероза, проявляющегося синдромом хронической почечной недостаточности (ХПН), терминальная стадия которой неизбежно ведет к смерти, если не применяются методы заместительной почечной терапии (ЗПТ) - гемодиализ, перитонеальный диализ и трансплантация почек.
Методы заместительной терапии (МЗПТ) разделяются на экстракорпоральные - гемодиализ (ГД), гемофильтрацию (ГФ), гемодиафильтрацию (ГДФ), перитонеальный диализ (ПД) и трансплантация почки. ГДФ он-лайн - является разновидностью эктракорпоральной детоксикации, применяется для удаления средних молекул (В-2 -микроглобулин). Все методы имеют свои преимущества и недостатки, поэтому выбор использования МЗПТ определяется в каждом конкретном случае в зависимости от возраста больного, заболевания, тяжести состояния, опыта персонала.
Категория пациентов: пациенты с первичными и/или вторичными болезнями почек (гломерулярными, тубулоинтерстициальными поражениями почек при системных заболеваниях), а также с ВАРМС, осложненными хронической почечной недостаточностью (ХБП 4-5 стадии), пациенты с острой почечной недостаточностью.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Хроническая болезнь почек выставляется при наличии повреждения почек и/или снижения СКФ < 60 мл/мин/1,73м2 в течение 3 месяцев и более. Повреждение почек - это структурные и функциональные аномалии почек, выявленные в анализах крови, мочи или при визуальных обследованиях. Расчет СКФ у пациентов на стадии 4-5 ХБП проводится по формуле MDRD и CKD-EPI или определяется по суточному клиренсу эндогенного креатинина.
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Основные:
1. Общий анализ крови (6 параметров)
2. Определение креатинина, мочевины в крови до и после диализа
3. Электролиты крови (калий, натрий, кальций, фосфор)
4. Сывороточное железо
Лечение
1. Стандартная доза диализа - 3 раза в неделю по 4 часа, даже если стандартная адекватная доза выраженная Kt/V достигнута.
2. Продолжительность и кратность процедур гемодиализа могут быть увеличены у пациентов с гемодинамической нестабильностью и сердечно-сосудистыми проблемами.
3. Независимо от применяемых программ общий Kt/V должен соответствовать или быть больше недельного стандартного значения, т.е Kt/V=l,2 для 4 часового 3 кратного в неделю диализа, или Kt/V^O,4-0,3 для ежедневного диализа.
Для сеанса программного гемодиализа требуется подключить больного с терминальной стадией ХПН к аппарату “искусственная почка”. Предварительно у пациента готовится один из видов сосудистого доступа - устанавливается наружный катетер или формируется подкожная артериовенозная фистула. Сеанс гемодиализа проводится при нахождении больного в кровати либо в полусидячем кресле с подлокотниками для фиксации конечности с артерио-венозной фистулой. Аппарат “искусственная почка” располагается непосредственно у больного рядом с кроватью или креслом. Диализное место обеспечивается подводкой электричества, магистрали с химически чистой водой от системы водоподготовки и канализационной системой для слива отработанного диализирующего раствора.
Непосредственно перед сеансом готовится концентрат диализирующего раствора и в соответствующих промаркированных канистрах доставляется к аппарату “искусственная почка”. Перед началом гемодиализа аппарат должен пройти обязательное автоматическое тестирование по заданной программе, обеспечивающей проверку годности всех блоков аппаратуры.
После каждой процедуры необходимо провести гигиеническую обработку поверхности аппарата “искусственная почка”, дезинфекцию (декальцификацию) гидравлики.
Подключение сосудов больного к магистралям аппарата “искусственная почка” производится в асептических условиях.
1. С этой целью под обработанную антисептиками конечность с фистулой помещается стерильная пеленка, которой после пункции фистулы иглами и соединения их с магистралями аппарата “искусственная почка” закрывается участок сосудистого доступа.
2. При отсутствии особых указаний в инструкции к диализатору и заглушек на коннекторах диализирующего контура подсоединение магистралей диализирующего раствора аппарата “искусственная почка” происходит до подготовки кровопроводящего контура.
3. Диализатор располагается в держателе вертикально так, чтобы надписи на этикетке были доступны для прочтения и диализирующий раствор после подсоединения магистралей аппарата “искусственная почка” двигался снизу вверх.
4. После вытеснения воздуха из контура диализирующего раствора диализатор переворачивается на 180° и подсоединяются кровопроводящие магистрали так, чтобы кровь и диализирующий раствор двигались в противотоке.
5. Предварительная подготовка контура кровообращения заключается в заполнении и промывании диализатора и магистралей 0,9% раствором хлорида натрия в строгом соответствии с инструкцией по применению диализатора. Для этого артериальная магистраль подсоединяется к флакону или мешку с 1 л стерильного 0,9% раствора хлорида натрия, в который добавляется выбранный для данного пациента антикоагулянт в дозе, равной болюсной (таблица 6). Включается перфузионный насос и со скоростью 150-180 мл/мин раствор начинает поступать по артериальной линии в кровопроводящий контур диализатора, вытесняя из него воздух. Для облегчения вытеснения воздуха следует осуществлять краткие пережатия артериальной магистрали. Для удаления возможных остатков стерилизующих веществ и пластификаторов первые 300-500 мл необходимо слить. Этим обеспечивается профилактика возможных анафилактоидных реакций.
6. После заполнения магистралей раствором и слива первой порции производится остановка перфузионного насоса и подсоединение конца венозной магистрали к флакону или мешку с 0,9% раствором хлорида натрия.
7. Обороты насоса увеличиваются до 300 м/мин. и обеспечивается рециркуляция раствора в системе в течение 10-15 минут с многократным кратковременным пережатием артериальной магистрали.
8. Последующее заполнение магистралей и диализатора кровью пациента осуществляется только после тщательной промывки и вытеснения воздуха из кровопроводящего контура стерильным физиологическим раствором.
9. Антикоагуляция (гепаринизация) производится с учетом состояния свертывающей системы пациента, массы тела, наличия скрытых очагов кровотечения. Предпочтение отдается дозированной гепаринизации, при которой болюсно вводится часть дозы (5000 ЕД), остальное вводится дозировано в течение всего диализа при помощи гепаринового насоса
При индивидуальной непереносимости гепарина применяются препараты низкомолекулярного ряда - надропарин, дальтепарин, эноксапарин (таблица 7).
| Длительность гемодиализа | Надропарин | Дельтаперин | Эноксапарин | |||
| болюсно | дозировано | болюсно | дозировано | болюсно | дозировано | |
| 4 часа | 0,3 мл | 0,6 мл | 2500 ЕД | 5000 ЕД | 0,2 мл | 0,4 мл |
| 5 часов | 0,6 мл | 0,6 мл | 5000 ЕД | 5000 ЕД | 0,4 мл | 0,4 мл |
10) При подключении больного к аппарату “ИП” врач, проводящий гемодиализ, контролирует либо выставляет параметры скорости кровотока (150-350 мл/мин), потока диализирующего раствора (500 мл/мин), проводимости и температуры диализирующего раствора (36-38°), времени и объема ультрафильтрации. Объем ультрафильтрации устанавливается исходя из разницы между текущим и сухим весом, которая определяется путем взвешивания пациента до и после процедуры.
11. После того, как аппарат “искусственная почка” полностью готов к работе (пройден первоначальный тест, кровопроводящий контур заполнен и промыт 0,9% раствором хлорида натрия, вытеснен воздух из контура крови и контура диализирующего раствора) в асептических условиях производится подключение пациента, которое должно происходить в соответствии с требованиями, регламентирующими порядок работы
12. Пункция артерио-венозной фистулы. Пункция осуществляется фистульной иглой срезом вниз под углом приблизительно 300 к поверхности кожи. При пункции срезом вверх под углом 450 после попадания в просвет фистулы иглу необходимо повернусь по оси на 1800 для предотвращения повреждения задней стенки сосуда. Следует избегать повторных пункций в одну и ту же точку, что ведет к образованию аневризм, а также прямого прокола кожи и сосуда (после прокола кожи игла должна пройти через подкожную клетчатку, затем попасть в сосуд). Артериальная игла (забор крови) должна располагаться по возможности навстречу току крови, венозная (возврат крови) - наоборот, по току крови. Расстояние между иглами должно составлять не менее 5 см, что предотвращает рециркуляцию и ухудшение качества очищения крови. При использовании двухпросветного диализного катетера забор и возврат крови должен осуществляться в соответствии с маркировкой коннектеров на катетере: красный - артериальный, синий - венозный.
13. Болюсное введение антикоагулянта производится в венозную иглу сразу после пункции (либо в венозный отвод катетера), дозированное введение начинается параллельно заполнению магистралей кровью.
14. После соединения артериальной магистрали с артериальной иглой включается насос крови и начинается вытеснение 0,9% раствора хлорида натрия из системы магистралей и диализатора кровью пациента при скорости не более 150-180 мл/мин. Раствор хлорида натрия вытесняется до тех пор, пока не появляется окрашивание кровью дистального отдела венозной магистрали (современные аппараты имеют специальный детектор ниже венозной ловушки воздуха), после чего насос крови останавливается, венозная магистраль пережимается и соединяется с венозной иглой.
15. Проверяется надежность и правильность всех соединений, после чего включается насос крови и устанавливается необходимая скорость кровотока в зависимости от возможностей сосудистого доступа и состояния сердечно-сосудистой системы. Типичной является скорость кровотока в пределах 200-300 мл/мин.
16. Возврат крови после окончания процедуры осуществляется путем вытеснения ее стерильным 0,9% раствором хлорида натрия, объем которого должен учитываться при программировании ультрафильтрации. При этом после остановки перфузионного насоса артериальная игла извлекается, а конец артериальной магистрали подсоединяется к емкости с раствором. Перфузионный насос включается вновь и нагнетает в систему стерильный раствор хлорида натрия, вытесняющий кровь. После попадания промывающего раствора хлорида натрия в диализатор следует многократно кратко временно пережать артериальную магистраль до полной очистки диализатора от крови. Полностью возвращается пациенту кровь, затем останавливается перфузионный насос и пережимается венозная магистраль.
17. После извлечения игл места пункций прижимаются свернутыми стерильными салфетками (при отсутствии специальных пластырей) до полной остановки кровотечения, после чего накладывается сухая повязка.
18. Контроль биохимических показателей уремии'’ производится в зависимости от состояния пациента и стабильности параметров процедуры (эффективный кровоток в диализаторе, эффективное время диализа), но не реже одного раза в месяц. Оцениваются, главным образом, преддиализные показатели, позволяющие вносить коррекцию в режимы очищения крови.
1. Артериальная гипотензия во время сеанса гемодиализа часто является следствием снижения ОЦК при быстром удалении жидкости из крови больного, которое ведет к снижению сердечного выброса и падению АД. В этой связи требуется снижать ультрафильтрацию или проводить ее в небольших пределах.
При падении АД во время гемодиализа пациента необходимо поместить в позицию Тренделенбурга (если нет дыхательной недостаточности) и назначить вдыхание увлажненного 30% кислорода. Затем в вену (венозную магистраль) болюсно вводится 100-150 мл 0,9% раствора хлорида натрия, а ультрафильтрация убирается до минимума. Кроме изотонического 0,9% раствора хлорида натрия можно вводить гипертонический 10% раствор хлорида натрия, 40% раствор декстрозы, коллоидные растворы.
2. Артериальная гипертензия. Лечение высокого артериального давления у диализных больных должно начинаться с достижения “сухого веса”. Для купирования гипертонического криза используются лекарственные средства нескольких групп: блокаторы кальциевых каналов (нифедипин), ингибиторы АПФ (каптоприл), препараты центрального типа действия (урапидил), нитраты (изокет).
3. Мышечные судороги. Рекомендуется введение 0,9% раствора хлорида натрия в объеме до 500 мл, однако предпочтительней вводить гипертонический раствор (10-20%) хлорида натрия или декстрозы (40%) по 20-40 мл, что быстро снимает судорожный синдром.
4. Тошнота и рвота встречаются в 10% планового диализа. Для лечения этого осложнения необходимо устранить причины гипотензии, у части больных требуется снижение скорости кровотока в диализаторе в первый час диализа на 20-30%.
5. Головная боль - частый симптом на диализе и связана, чаще всего, с подъемом или падением АД. Она может быть первым симптомом начинающегося отека головного мозга при синдроме нарушенного осмотического равновесия, реже - опухолей головного мозга. Лечение заключается в нормализации артериального давления, снижении скорости кровотока (при этом следует увеличить время диализа), введении анальгетиков внутрь или парентерально.
6. Боль за грудиной и нарушения ритма сердца. Лечение заключается в нормализации АД, снижении скорости кровотока и ультрафильтрации, вдыхании увлажненного кислорода, изокет 1 -2 дозы сублингвально, назначается после подъема АД. В случае возникновения тахиаритмии - амиодарон.
7. Кожный зуд. Для снижения кожного зуда рекомендовано применение седативных лекарственных средств во время сеанса, в сочетании с антигистаминными средствами. При диффузной гиперплазии паращитовидных желез, периферической кальцификации, патологических переломах костей, сочетающихся с кожным зудом, показана субтотальная паратиреоидэктомия или склерозирование. Для коррекции фосфорнокальциевого обмена в междиализный период неходимо назначение фосфатбиндеров (севеламера карбонат), препаратов кальция (карбонат кальция), активные метаболиты витамина Д (альфакальцидол).
8. Нефрогенная анемия. Показанием к назначению эритропоэтинов является стойкое снижение уровня гемоглобина менее 100 г/л, а гематокрита - ниже 30%. При более выраженной анемии у диализных больных (Нв менее 70 г/л, Ht - ниже 25%) требуется экстренное лечение - гемотрансфузии эритроцитарной массы или отмытых эритроцитов, параллельно начинается парентеральное введение эритропоэтинов. Целевым уровнем гемоглобина у больных на хроническом диализе является 110 г/л. В этой связи индивидуально подбирается такая доза конкретного лекарственного препарата этой группы, которая позволяла бы достичь целевого уровня в течение 1-1,5 месяцев после начала лечения и постоянно поддерживать его в течение всей оставшейся жизни. Начальной дозой любого эритропоэтина является 50-60 ЕД .на кг массы тела 2 раза в неделю подкожно или 3 раза внутривенно. При отсутствии эффекта и устранении причин замедленного действия эритропоэтина его доза удваивается и лечение продолжается. При достижении целевого уровня гемоглобина и стабилизации в течение месяца общая недельная доза снижается на 30-50% (переход на две инъекции вместо трех или снижение дозы при каждом введении). Основной причиной неадекватного ответа на терапию эритропоэтином является дефицит железа вследствие низки запасов в организме или быстрой утилизации для образования гема. В это связи у больных с ХПН, получающих программный гемодиализ, требуется исключить кровопотери, связанные с работой аппаратуры, а также назначить препараты железа, причем, учитывая плохую всасываемость железа при ХПН в кишечнике, требуется назначение Железосодержащих лекарственных средств парентерально (лучше внутривенно). Усилить лечение препаратами железа целесообразно при уровне сывороточного ферритина менее 100 нг/мл.
При гемодилизе: средний показатель 6 месячных измерений Kt/V должен быть не ниже 1.2 (>1.2) для больных на ГД, при этом количество больных с уровнем Kt/V ниже 1.2 (<1.2) не должно превышать 30%. В этот критерий не входят пациенты, вновь начавшие лечение с ГД (менее 3 месяцев). Kt/V рассчитывается по формуле Daugirdas-2. Данный фракционный клиренс рассчитывается как произведение клиренса диализатора (К мл/мин) на время (t - длительность диализа), к объему распределения мочевины (V).
Средний показатель 6-месячных измерений гемоглобина должен быть в пределах 110 - 120 г/л, при этом количество больных с уровнем гемоглобина ниже 100 г/л не должно превышать 25% и уровнем гемоглобина ниже 110 г/л - 40%. В этот критерий не входят пациенты, вновь начавшие диализное лечение (менее 3 месяцев).
Средний показатель 6-месячных измерений фосфора должен быть в пределах 1.13 - 1.78 ммоль/л, при этом количество больных с уровнем фосфора выше 1.78 ммоль/л не должно превышать 40% и уровнем фосфора выше 2.1 ммоль/л - 20%. В этот критерий не входят пациенты, вновь начавшие диализное лечение (менее 3 месяцев).
Заместительная почечная терапия в реаниматологии. Доступ для экстракорпорального контура
Летальность пациентов с ОПП, нуждавшихся в проведении ЗПТ, n (%)
Примечание. n — количество пациентов; ОПП — острое почечное повреждение; ОРИТ — отделение реанимации и интенсивной терапии; ЗПТ — заместительная почечная терапия.
ОПП развивается в 5,1—25% случаев у пациентов с новой коронавирусной инфекцией (COVID-19), особенно на фоне тяжелого острого респираторного синдрома SARS-CoV-2 [15—17].
Критерии острого почечного повреждения
В течение последних 20 лет к проблемам ОПП приковано внимание международного медицинского сообщества. Начиная с 2000 г. ежегодно проходят международные согласительные конференции «Инициатива качества заместительной почечной терапии у больных ОПП» (Acute Dialysis Quality Initiative, ADQI) [18], и в 2018 г. состоялась уже 21-я конференция ADQI, посвященная дисфункции легких и почек [19]. В 2012 г. опубликованы рекомендации Международного комитета по улучшению глобальных результатов лечения заболеваний почек (Kidney Disease: Improving Global Outcomes, KDIGO) [20], действующие по настоящее время. Исходя из них, ОПП — это остро возникшее нарушение функции почек, определяемое при наличии как минимум одного из следующих критериев:
— абсолютное повышение концентрации креатинина в крови на 0,3 мг/дл (≥26,4 мкмоль/л) в течение 48 ч;
— относительное повышение сывороточного креатинина в 1,5 раза и более по сравнению с исходным уровнем (если это известно или предполагается, что это произошло в течение предшествующих 7 дней);
— мочеотделение менее 0,5 мл на 1 кг массы тела в час за 6 часов наблюдения.
Классификация ОПП по стадиям базируется на определении уровня креатинина в плазме пациента и критериях мочеотделения (табл. 2).
Таблица 2. Стадии острого почечного повреждения по шкале KDIGO
Table 2. KDIGO grading system of acute renal injury
Стадии почечного повреждения
Критерии мочеотделения (темп диуреза)
В 1,5—1,9 раза выше исходного или увеличение на 0,3 мг/дл (≥26 мкмоль/л)
В 2—2,9 раза выше исходного
В 3 раза выше исходного, или повышение ≥4,0 мг/дл (353,6 мкмоль/л), или начало ЗПТ, или у пациентов
Примечание. ЗПТ — заместительная почечная терапия; СКФ — скорость клубочковой фильтрации.
Одной из основных проблем ранней диагностики ОПП является отсутствие высокочувствительного и специфичного биомаркера почечного повреждения. Дело в том, что уровень креатинина плазмы (SCr), используемый как суррогатный показатель СКФ, оценивает только изменение функции почек и зависит от возраста, пола, расы, величины мышечной массы, катаболизма, уровня гидратации. Тем не менее даже незначительное повышение SCr сопровождается увеличением летальности. Так, при использовании многофакторного регрессионного анализа выяснено, что увеличение SCr на 0,3 мг/дл (26 мкмоль/л) от нормального значения сопровождалось повышением риска смерти в 4,1 раза, на 2,0 мг/дл (176,8 мкмоль/л) — в 16,4 раза [21]. Несмотря на то что темп диуреза не всегда адекватно отражает функцию почек, олигурия, как правило, отражает снижение СКФ. Если СКФ в норме (около 125 мл/мин, что у взрослого человека с массой тела 70 кг соответствует примерно 107 мл на 1 кг массы тела в час), то уменьшение объема выделяемой мочи менее 0,5 мл на 1 кг массы тела в час должно отражать реабсорбцию более 99,5% гломерулярного фильтрата [20].
Наиболее часто в научной и клинической практике применяются следующие биомаркеры ОПП. Липокалин, ассоциированный с желатиназой нейтрофилов (NGAL), — острофазный белок с молекулярной массой 25 кДа. При развитии ОПП NGAL фильтруется, но не реабсорбируется в проксимальных канальцах и собирательных трубочках, показал высокую чувствительность в моделях ишемического и нефротоксического повреждения. В то же время при сепсисе уровень NGAL не является эффективным маркером ОПП, хотя может потенциально использоваться как критерий начала ЗПТ и предиктор летальности [22]; уровень NGAL в плазме имеет высокую чувствительность — 0,88, но низкую специфичность — 0,22 [23].
Цистатин C — белок с молекулярной массой 13 кДа. Свободно фильтруется через клубочковую мембрану, реабсорбируется в проксимальных почечных канальцах. Концентрация цистатина C, в отличие от SCr, зависит только от СКФ, на нее не оказывают влияния такие факторы, как возраст, пол, мышечная масса пациента [24].
Молекула повреждения почки 1-го типа (KIM-1) — трансмембранный белок из суперсемейства иммуноглобулинов. Не содержится в почках здоровых людей и животных, но активно продуцируется проксимальными канальцами после ишемического или нефротоксического повреждения почек. KIM-1 наиболее эффективна при ранней диагностике ОПП в кардиохирургии [25].
Интерлейкин IL-18. Относится к провоспалительным цитокинам, вырабатывается проксимальным трубчатым эпителием. В ряде исследований IL-18 определен как ранний биомаркер ОПП после искусственного кровообращения, острого легочного повреждения, трансплантации почки, в педиатрической практике [26]. Для тканевого ингибитора металлопротеиназы 2-го типа (TIMP-2) и инсулиноподобного фактора роста, связывающего белок-7 (IGFBP7), чувствительность и специфичность в моче для диагностики ОПП составили 0,83 и 0,72 соответственно. В метаанализе J. Ho и соавт. отметили низкую специфичность этого биомаркера в плазме и моче для диагностики ОПП у кардиохирургических больных, особенно через 24 ч после оперативных вмешательств [27].
Таким образом, несмотря на то что использование биомаркеров является целесообразным для выявления группы риска развития ОПП, прогнозирования тяжести и потребности в ЗПТ, использование их в практическом здравоохранении вызывает ряд проблем. На сегодняшний день не существует единого биомаркера, который доказал бы свою эффективность в клинической практике [28].
Заместительная почечная терапия
Предметом научных дискуссий до сих пор остаются вопросы оптимизации тактики применения ЗПТ у пациентов с ОПП. Это прежде всего использование четких критериев для начала и завершения процедур ЗПТ, применение различных методик, режимов ЗПТ, выбор оптимальных протоколов антикоагуляции. Принимая решение о начале ЗПТ, клиницисту необходимо взвесить пользу и оценить возможные риски методов. Во-первых, необходимо оценить тяжесть ОПП и динамику состояния почечной функции, выявить олигоанурию, наличие осложнений, в первую очередь симптомы перегрузки жидкостью, нарушений электролитного баланса и кислотно-основного состояния, оценить вероятность восстановления почечной функции, особенно у пациентов без олигоанурии. Если есть возможность, следует оценить наличие и стадию ХБП, постренального ОПП, при котором требуется первоочередное выполнение урологических вмешательств.
Во-вторых, принимая решение о начале ЗПТ, необходимо оценить динамику заболевания, приведшего к ОПП, тяжесть органной (внепочечной) дисфункции, наличие дыхательной недостаточности, использование искусственной вентиляции легких, динамику респираторного индекса, выраженность нарушений сердечно-сосудистой системы и коагуляционного статуса, возможность элиминации токсических веществ, коррекции гиперкатаболизма, системного воспаления и тяжелых нарушений терморегуляции. Необходимо четко представлять цели терапии и, исходя из них, формировать программу лечения, выбирая метод и режимы ЗПТ.
В-третьих, нельзя забывать о возможных рисках и осложнениях при проведении ЗПТ, связанных с сосудистым доступом, нарушениями гемодинамики во время процедуры (гипотония, нарушения ритма сердца), катетер-ассоциированной инфекцией, потерей в связи с процедурой аминокислот, микроэлементов, витаминов, лекарственных препаратов, длительной иммобилизацией, особенно при продолжительных манипуляциях.
В-четвертых, ЗПТ можно проводить, только когда есть специальная аппаратура, обученный персонал и расходные материалы. Все это требует нормативной базы, адекватного финансирования и организации обучения как врачебного, так и сестринского персонала. Необходимо также учитывать национальные клинические рекомендации и локальные алгоритмы применения ЗПТ [29].
Критерии начала заместительной почечной терапии
Международным комитетом KDIGO предложены следующие рекомендации по применению ЗПТ [20]: ЗПТ должна быть начата немедленно, как только выявляются опасные для жизни нарушения водного и/или электролитного балансов и кислотно-основного равновесия. Решение о начале ЗПТ должно приниматься не только на основании показателей мочевины и креатинина плазмы крови, но в большей мере на основании оценки динамики лабораторных данных и всестороннего анализа клинической ситуации в целом с учетом тяжести органной дисфункции, основного и сопутствующих заболеваний. Существуют общепринятые показания к началу ЗПТ у больных с ОПП (табл. 3).
Таблица 3. Показания к началу заместительной почечной терапии
Table 3. Indications for renal replacement therapy
Заместительная почечная терапия (ЗПТ) — это комплекс разнородных по своей структуре и основополагающим принципам мероприятий, проводимых для поддержания жизни пациента с необратимо утраченными функциями собственных почек. В сегодняшней медицинской практике состояния, связанные с необратимой утратой функции собственных почек, называют терминальными заболеваниями почек (ТЗП) или терминальной стадией хронической почечной недостаточности (ТХПН). В свою очередь, под хронической почечной недостаточностью (ХПН) понимают симптомокомплекс, развивающийся при двусторонних хронических заболеваниях почек вследствие постепенной необратимой гибели нефронов и характеризующийся нарушением гомеостатической функции почек. Критерием ХПН в узком смысле этого слова принято считать скорость клубочковой фильтрации (СКФ) менее 60мл/мин/1,73 м 2 , продолжительностью 3 месяца и более, а критерием ТХПН — скорость клубочковой фильтрации менее 15 мл/мин/1,73 м 2 .
В связи с вышесказанным, важным критерием для диагностики ХПН, терминальных заболеваний почек и определения показаний к началу ЗПТ является определение СКФ. До сегодняшнего дня «золотым» стандартом для измерения СКФ является определение клиренса инулина. Классический метод определения клиренса инулина требует внутривенной инфузии и сбора мочи за определенное время (несколько часов), что делает этот метод дорогим и обременительным. В то же время очень популярная и активно применяемая в настоящее время в терапевтической практике проба Реберга-Тареева определяющая клиренс креатинина, имеет существенные недостатки, связанные, во-первых, с тем что должна проводится в условиях труднодостижимого при ХПН минутного диуреза равного 1,5 до 2,5 мл/ мин, а, во-вторых, с тем что креатинин не только фильтруется в почечных клубочках, но и секретируется канальцами. Эти факторы существенно ограничивают точность данного метода. Таким образом, клиренс креатинина систематически завышает СКФ. Показано, что у здоровых лиц клиренс креатинина может превышать истинную величину СКФ от 10 до 40%, а при поражениях почек и при ХПН это завышение еще значительнее и менее предсказуемо.
Альтернативой клиренс-методам оценки СКФ является расчет СКФ по легко измеряемым параметрам. Одна из методологически наиболее корректных формул, была предложена в 1976 г. Кокрофтом и Голтом. Согласно этой формуле СКФ может быть рассчитана как:
СКФ = [(140 — возраст) х вес тела (кг) х 0,85 (для женщин)]/ [814 х креатинин сыворотки (ммоль/л)].
При дальнейшем изучении надежности формулы Кокрафта и Голта оказалось, что расчетные показатели отклоняются от измеренной СКФ, как правило, на (-14%) — (+25%) и в 75% случаев — не более чем 30%. Эти данные позволили рекомендовать формулу Кокрофта-Голта как достаточно надежный метод оценки СКФ в клинической практике.
В последние годы все большее признание получает формула MDRD (Modification of Diet in Renal Disease Study), согласно которой:
СКФ = 6,09 x (креатинин сыворотки в ммоль/л) -0,999 х (возраст) -0,176 х (0,762 для женщин) х (1,18 для афроамериканцев) х (мочевина сыворотки в ммоль/л) -0,17 х (альбумин сыворотки в г/л) 0,318
или ее сокращенный вариант:
СКФ (мл/мин/1,73м2) = 186x(Scr) -1,154 x (возраст) -0,203 х (0,742 для женщин) х (1,210 для афроамерианцев)
Более чем в 90% случаев отклонения результатов расчета по формуле MDRD не превышали 30% от показателей измеренной СКФ. Только в 2% случаев ошибка превышала 50%. В связи с этим считается, что эта формула MDRD надежнее оценивает СКФ, чем формула Кокрофта-Голта (рис №1).
Рис №1. Сравнение результатов расчетной скорости клубочковой фильтрации к измеренной по клиренсу инулина
В повседневной врачебной практике более удобной для проведения расчетов является формула Кокрафта и Голта, однако наличие специализированного калькулятора или программы на персональном компьютере делает формулу MDRD, такой же доступной и при этом более точной к оценке СКФ.
Таким образом, СКФ, определенная любым из рекомендуемых в настоящее время методом, равная 15 мл/мин/1,73 м 2 или менее может служить надежным критерием в определении показаний к срочной консультации нефролога (хотя она должна быть плановой и обязательной уже при СКФ ниже 60 мл/мин/1,73м 2 ) и решения вопроса о необходимости начала ЗПТ.
К методам ЗПТ относятся программный гемодиализ (ПГ), перитонеальный диализ (ПД) и трансплантация почки (ТП). Для того чтобы понять эффективность каждого из этих методов необходимо рассмотреть функции здоровой почки и возможность замены каждым из имеющихся методов заместительной почечной терапии. Так, здоровая почка регулирует содержание воды в организме, удаляет шлаки, регулирует баланс электролитов и регулирует pH крови, каждая их этих функций может быть частично заменена применением диализных методов. Кроме этого, почка выделяет гормоны, стимулирующие кроветворение, активизирует витамин D и регулирует кровяное давление, эти функции могут быть заменены частично или полностью применением дополнительной медикаментозной терапии, а такая функция как инактивация излишних гормонов может быть обеспечена только нормально функционирующей почкой.
В связи с этим, для спасения человека с ТЗП необходимо систематически проводить очищение крови от токсических соединений и обеспечивать выведение излишней жидкости из организма. В арсенале современной медицины для этой цели существуют действенные средства и среди них — аппарат искусственной почки, при этом сама процедура называется программным гемодиализом, которая проводится в специализированном диализном центре, как правило, по четыре часа три раза в неделю. Кроме того, в последнее время все большее распространение приобретает применение другого вида ЗПТ — перитонеального диализа, который не предполагает использование дорогостоящей аппаратуры и позволяет больному производить его в домашних условиях при соответствующей подготовке. Для проведения процедуры перитонеального диализа в брюшную полость должен быть установлен так называемый перитонеальный катетер, через который вводятся специальные растворы. Эта процедура проводится ежедневно, обычно четыре раза в день. Существенным положительным аспектом ПГ и ПД является практическое отсутствие противопоказаний для проведения этих видов ЗПТ.
В отличие от ПГ или ПД трансплантация почки имеет свои противопоказания, количество которых в последние годы существенно сократилось. Так, абсолютными противопоказаниями для ТП являются злокачественные новообразования, активный инфекционный процесс, тяжелые внепочечные осложнения (цереброваскулярные или коронарная болезни), несоблюдение медицинских рекомендаций и тяжелые психические заболевания.
Однако, как гемодиализ, так и перитонеальный диализ занимают значительное количество времени в связи с тем, что речь идет о кратковременной искусственной замене функции естественного органа, работающего непрерывно в течение всей жизни. Однако, несмотря на постоянно совершенствующуюся медицинскую технику и технологию исполнения процедуры гемодиализа, существует достаточно много отрицательных побочных эффектов и обстоятельств, снижающих качество жизни больного. В частности, ПГ со временем приводит к уменьшению содержания в крови гемоглобина, разрушению костей. К недостаткам ПГ можно отнести также необходимость введения гепарина во время процедуры, необходимость в сосудистом доступе, гипотензия при удалении излишней жидкости, накопленной в перерывах между диализами, плохая коррекция гипертензии и необходимость следовать диете и режиму процедур. Недостатками ПД являются перитониты, ожирение, гипертриглицеридемия, образование грыж и боли в спине.
Именно поэтому ПГ или ПД могут рассматриваться лишь как промежуточное звено лечения пациентов с ТХПН (рис №2).
Рис №2. Интегрированный подход к лечению пациентов с хронической почечной недостаточностью
Наилучшей конечной целью для таких людей, дающей шанс на полноценную и активную жизнь, можно считать только трансплантацию почки. Благодаря появлению новых иммуносупрессивных препаратов и совершенствованию техники операции, процент выживаемости трансплантата в течение первого года после пересадки поднялся за последние двадцать лет на 40-50%, достигнув 95 процентов, а качество жизни больных после пересадки улучшилось в несколько раз.
В настоящее время выполнение операций ТП возможно в двух вариантах — пересадка почки от умершего донора и пересадка почки от живого донора. По анатомическим соображениям правая почка донора пересаживается слева, а левая справа. Донорская почка помещается в подвздошную ямку, мочеточник должен быть направлен к мочевому пузырю. Почечная вена присоединяется к подвздошной вене непрерывным швом. Почечная артерия соединяется к внутренней или наружной подвздошной артерии. Мочеточник донорской почки пересаживается в верхне-боковую стенку мочевого пузыря. Здоровая донорская почка уже через несколько минут после восстановления в ней кровообращения начинает производить мочу.
Немаловажным является и тот факт, что в группах, сопоставимых по полу и возрасту, прогнозируемая продолжительность жизни у пациентов, перенесших операцию трансплантации почки, оказывается в 2-3 раза выше, по сравнению с пациентами, ожидающими трансплантацию. Кроме того, риск кардиоваскулярной летальности у пациентов после трансплантации почки оказывается практически в 100 раз ниже, чем у пациентов получающих диализную терапию, а в возрасте старше 65 лет становится сопоставимым с общепопуляционной.
Существенной представляется и финансовая сторона этого вопроса. До сих пор среди большинства населения страны, врачей, организаторов здравоохранения и политиков бытует мнение о крайней дороговизне и экономической нецелесообразности выполнения этих операций. Это в корне ошибочное мнение, так как расчеты компетентных экономистов еще в 1980 году показали, что консервативное лечение пациента с хроническим необратимым заболеванием обходится государству, а также страховым компаниям значительно дороже, чем затраты на трансплантацию и последующее поддерживающее лечение после этого вмешательства. Так, стоимость поддержания жизни одного человека на гемодиализе в год составляет около 500 тысяч рублей. В тоже время трансплантация почки не только реально улучшает качество жизни пациента, но и, начиная со следующего года после трансплантации, позволяет снизить расходы на поддерживающую терапию в 5 раз. Все операции по трансплантации почки финансируются из бюджета и бесплатны для граждан Российской Федерации.
Таким образом, трансплантация почки является наиболее рациональным методом ЗПТ, призванным обеспечить наиболее полную реабилитацию людей, страдающих почечной недостаточностью, максимально продлить срок жизни пациентов с ТХПН и снизить экономические расходы на лечение этой категории пациентов.
В.М. БЕЛОПУХОВ 1 , В.И. КРАСИЛЬНИКОВ 2 , Т.С. ГАНЕЕВ 3 , А.Э. ВАЛИУЛЛИН 3 , А.В. ПАШЕЕВ 3
1 Казанская государственная медицинская академия, 420012, г. Казань, ул. Бутлерова, д. 36
2 Республиканская клиническая больница МЗ РТ, 420064, г. Казань, Оренбургский тракт, д. 138
3 Межрегиональный клинико-диагностический центр, 420101, г. Казань, ул. Карбышева, д. 12а
Цель работы — оптимизация применения методов заместительной почечной терапии (ЗПТ) в лечении ОПН у кардиохирургических больных. Под наблюдением было 128 пациентов после кардиохирургических операций, которым потребовались методы заместительной почечной терапии для лечения острой почечной недостаточности. Из них 80 пациентам проведены продленные методики (группа А), 48 пациентам проведены прерывистые методики (группа В). Выявлено, что проведение продленных методик сопровождалось большей гемодинамической стабильностью, менее резкими изменениями электролитного состава, однако большим оказалось количество гипокоагуляционных расстройств. Проведение продленных методик наиболее оправдано у пациентов с тяжелыми формами сердечной недостаточности. Внедрение в клиническую практику продленных методик с цитратной антикоагуляцией способствует стабилизации гемостаза.
Ключевые слова: острая почечная недостаточность, заместительная почечная терапия, кардиохирургия.
V.M. BELOPUKHOV 1 , V.I. KRASILNIKOV 2 , T.S. GANEEV 3 , A.E. VALIULLIN 3 , A.V. PASHEEV 3
1 Kazan State Medical Academy, 36 Butlerov St., Kazan, Russian Federation, 420012
2 Republican Clinical Hospital of the MH of RT, 138 Orenburgskiy Tract, Kazan, Russian Federation, 420064
3 Interregional Clinical Diagnostic Center, 12a Karbyshev St., Kazan, Russian Federation, 420101
Comparison of intermittent and prolonged methods of renal replacement therapy in the treatment of renal failure following cardiac surgery
The purpose of our study is optimization of the applying renal replacement methods in the treatment of acute renal failure, following cardiac surgery. Matherial and methods. Under our observation were 128 cardiosurgical patients, who required renal replacement therapy for the treatment acute renal failure. The 80 patients received prolonged methods (A group) and the 48 patients received intermittent methods (B group) of the renal replacement therapy. Results. It was revealed, that prolonged methods have more hemodynamic and water-saline stability, but they had more events of hypocoagulation. Conclusion. Applying of prolonged renal replacement methods is justified for the treatment patients with severe heart failure. Introduction of the prolonged methods with citrate anticoagulation supports the coagulation stability.
Key words: acute renal failure, renal replacement therapy, cardiosurgery.
Тяжелая острая почечная недостаточность (ОПН) после операций на открытом сердце (уровень креатинина более 2,5 мг/л) развивается у 5-7% пациентов и более характерна для группы пожилых больных. Синдром низкого сердечного выброса, как правило, является основной причиной ОПН. Медикаментозное лечение, направленное на поддержание адекватного минутного объема кровообращения, одновременно улучшает и функцию почек. Однако необходимо учитывать, что вазопрессорные катехоламины в дозах, превышающих для адреналина 1,5 мкг/кг/мин. и допамина более 12 мкг/кг/мин., могут привести к вазоконстрикции и снизить корковый почечный кровоток. Минутный объем кровообращения менее 2,4 л/мин и диурез менее 0,5 мл/кг/час во время операции являются прогностически неблагоприятными показателями функции почек [1].
Методы заместительной почечной терапии (ЗПТ) при ОПН, имеющиеся сегодня в арсенале врача, можно разделить на прерывистые (дискретные) и непрерывные продолжительные. К прерывистым относятся гемодиализ, гемофильтрация, гемодиафильтрация, их длительность, как правило, не превышает 3-4 часов. Непрерывные продолжительные представлены продолжительной вено-венозной (артерио-венозной) гемофильтрацией, продолжительным вено-венозным (артерио-венозным) гемодиализом, продолжительной вено-венозной (артерио-венозной) гемодиафильтрацией и проводятся от 8 до 48 часов.
Особенностью прерывистых методов является высокая скорость выведения токсических веществ и жидкости. Непрерывные продолжительные методы, уступая в скорости, обеспечивают медленное, но постоянное поддержание гомеостаза.
Цель исследования — оптимизация применения методов ЗПТ в лечении ОПН у кардиохирургических больных.
Для достижения поставленной цели были сформулированы следующие задачи исследования:
- Оценить этиологию и распространенность развития ОПН в послеоперационном периоде у кардиохирургических пациентов.
- Сравнить частоту развития побочных эффектов во время проведения прерывистых и продленных процедур.
- Осветить перспективы развития методов ЗПТ у кардиохирургических пациентов.
Материал и методы
С 2008 по 2013 гг. в ГАУЗ МКДЦ было выполнено 6284 кардиохирургических операций, из которых 128 осложнились ОПН, потребовавшей проведение ЗПТ, что составило 2,0% от числа проведенных операций. Показаниями для начала ЗПТ являлись: развитие олигурии (диурез менее 0,5 мл/кг/ч за 12 часов, на фоне двукратного повышения концентрации креатинина плазмы), гиперкалиемия (К + >6,5 ммоль/л), выраженная диснатриемия (115160ммоль/л), выраженная ацидемия (рН<7,1), азотемия (мочевина >30ммоль/л). Сеансы ЗПТ, а именно гемодиализ проводили на ап. Fresenius 4008 H с использование гемофильтров HF 6, HF 7 (Fresenius); продленная гемофильтрация и гемодиафильтрация — на аппарате Fresenius Multifiltrate с использованием гемофильтров AV600S, AV 1000S (Fresenius). Средняя длительность сеансов при прерывистых методиках составила 4±0.7 ч. и 1±22.5 ч. при проведении продленных методов. Средняя скорость кровотока при проведении прерывистых методов составила 280±20.5 мл/мин и 250±10 мл/мин при проведении продленных методик. Объем замещающего раствора при проведении продленных методик рассчитывался на 35-45 мл/кг/ч. Вне зависимости от длительности процедур антикоагуляция достигалась применением нефракционированных гепаринов в начальной дозе 10-20 ед/кг с дальнейшей продленной гепаринизацией 3-20 ед/кг/ч [2].
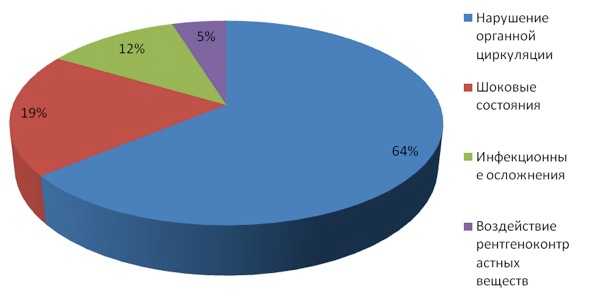
Частой причиной ОПН (64,0%) было нарушение системной и органной циркуляции после операций с длительным искусственным кровообращением, в 19,5% случаев ОПН развивалась после шоковых состояниях произошедших в послеоперационном периоде, таких как сердечно-сосудистая недостаточность, резкая гиповолемия, требующая введения значительных доз вазоактивных препаратов; в 11,7% случаев ОПН проявилась вследствие инфекционно-токсических осложнений послеоперационного периода и в 4,8% случаев вследствие введения ретнгенконтрастных препаратов. Необходимо отметить, что в 82% случаев ОПН была связана с нарушением системной гемодинамики, сопровождалась нарушением макро- и микроциркуляции во всех органах и системах, сочеталась с недостаточностью других органов и систем (системы крови — в 95%, дыхательной системы — в 61%, ЦНС — 59%, ЖКТ — 43%) и являлась компонентом полиорганной недостаточности, и лишь в 18% случаев имела изолированный характер (рис. 1).
Не смог убрать надпись на рисунке - надо убрать.
Рисунок 1. Этиология ОПН после кардиохирургических операций
Пациентам, которым потребовались сеансы ЗПТ, были проведены 384 процедуры. Из них 48 пациентам — 202 дискретные процедуры и 80 пациентам — 182 продленные процедуры. Соответственно в группе А (дискретные методики) было проведено в среднем 3,5±1,4 процедуры, а в группе В (продленные методики) 2±1,2 процедуры.
Сравнивая методики можно отметить, что течение их было различно. Это обусловлено более быстрым обменом электролитов, перемещением водных секторов и биологически активных веществ при дискретных методах ЗПТ. Так, при проведении дискретных методов ЗПТ гораздо чаще (40%) возникали эпизоды гипотензии по сравнению с продленными (20%). Аритмия вследствие быстрого перемещения электролитов возникла в 13,6% при использовании дискретных методов, а при продленных методах — в 2%. Дизэквилибриум-синдром не наблюдался в наших наблюдениях ни при использовании дискретных ни при продленных методах. Нарушения системы гемостаза в виде гиперкоагуляции, проявлявшейся в виде частичных, либо полных тромбозов контуров и диализаторов, в ряде случаев потребовавших их замены. Гепаринизация, требующаяся для антикоагуляции контуров редко провоцировала гипокоагуляцию, проявлявшейся кровоточивостью из области послеоперационных ран и желудочно-кишечные кровотечения. В группе А гиперкоагуляционные расстройства наблюдались в 10% процедур, гипокоагуляционные в 5%. В группе В гиперкоагуляционные расстройства наблюдались в 10% процедур, гипокоагуляционные в 12% (табл. 1).
Таблица 1.
Сравнительная характеристика течения сеансов ЗПТ
Полученные нами данные свидетельствуют о том, что и дискретные, и продленные методы ЗПТ являются абсолютно необходимыми методами лечения при развитии ОПН у кардиохирургических пациентов. В то же время они, как и всякие иные инвазивные процедуры, имеют ряд неблагоприятных эффектов, связанных с методологией самих процедур. Нами отмечена значимо большая гемодинамическая стабильность и меньшее число аритмий при проведении продленных процедур, что свидетельствует о меньшей скорости перемещения водных секторов и электролитов при проведении этих методик [3]. Это позволило применять их у пациентов с выраженной сердечной недостаточностью, находящихся на инотропной поддержке вазопрессорами, внутриаортальной баллонной контрпульсации. Гиперкоагуляционные нарушения возникали в обеих группах и не имели значимой разницы, однако несколько большей оказалась частота возникновения гипокоагуляционных расстройств в группе продленных методов ЗПТ, что, по нашему мнению, связано с длительной гепаринизацией, сложностью подбора оптимальных доз гепарина для антикоагуляции.
Говоря о перспективах развития методов ЗПТ у вышеуказанной категории больных, наибольший интерес представляют продленные методы ЗПТ с цитратной антикоагуляцией, которые позволяют минимально воздействовать на систему гемостаза и минимизировать связанные с ней неблагоприятные эффекты. Несмотря на кажущуюся сложность применения цитрата и большое число потенциальных нарушений метаболизма, цитрат все чаще используется при продленных методах ЗПТ, поскольку он является очень эффективным региональным антикоагулянтом, особенно у больных с риском развития кровотечений. Альбуминовый диализ является наиболее эффективной методикой лечения печеночной недостаточности, но, к сожалению, высокая стоимость процедур не позволяет этой методике широко внедриться в рутинную практику лечения этого грозного осложнения. Недостаточный опыт не позволяет оценивать эффективность проведения альбуминового диализа при лечении печеночно-почечной недостаточности, возникающей в ряде случаев, после кардиохирургических операций.
Таким образом, продленные методы ЗПТ позволяют проводить их у пациентов с сердечной недостаточностью, тогда как дискретные методы можно рекомендовать лишь у гемодинамически стабильных пациентов, без выраженных нарушений остальных органов и систем [4].
Читайте также:
